油樟[Cinnamomum longepaniculatum (Gamble) N.Chao]属樟科常绿乔木,是中国特有经济树种,主产于四川省宜宾市[1]。油樟植株根、茎、叶、果实均可用于提炼精油,其叶为主要产油器官,含油量高达3.8%~4.5%[2-3]。油樟油富含几十种不同沸点的物质成分,其中α-松油醇为其主成分之一,相对含量在10%以上。α-松油醇作为食品添加剂,除具有类似紫丁香的宜人香气,还具有各种生物和药物特性,如抗氧化、抗癌、抗惊厥、抗溃疡、抗腹泻等,被认为是最常用的香料化合物之一[4-6]。α-松油醇存在于多种植物精油中,但物质含量较低,从植物源获取α-松油醇需克服植物生长周期问题,考虑植被破坏、废渣污染等影响,所得α-松油醇也难以满足日益增长的市场需求,因此,实际使用的α-松油醇主要通过化学合成松油醇后再精制而得。目前,工业合成松油醇分为一步法与二步法,通过无机液体酸(H2SO4、H3PO4等)为催化剂,催化工业蒎烯或松节油水合合成松油醇[7-9]。其中,二步法所得松油醇纯度较高、香气较正但工艺繁琐,成本高昂,一步法虽较为简单,但所得松油醇香气较差。工业合成松油醇虽能满足市场需求但其香味不及天然松油醇纯正,且生产工艺以无机酸为催化剂,加重环境污染,设备腐蚀严重,增加生产成本[7,10]。近年食品安全问题关注度逐年增长,被誉为“食品工业灵魂”的食品添加剂成为众矢之的,合成的香精香料与人们对天然风味物的追求已不相适应[11]。
植物内生菌指生活史的一定阶段或全部阶段生活于健康植物各种组织和器官内部的微生物,可通过组织学方法从表面严格消毒的植物组织中分离出来。经报道,许多内生菌由于与宿主的长期共处,与后者形成了互利共生关系[12-13];部分内生菌可以产生与宿主细胞相同或相近的活性物质[14],分离培养植物内生菌可为获取其宿主植物活性物质提供新思路。王涛等[15-16]从油樟植株分离内生细菌和芽孢内生细菌,根茎叶共分离203株内生细菌和40株芽孢内生细菌,其中叶的分离量均不超过20株,未能充分挖掘油樟叶内生细菌多样性。本研究拟采用3种(组织块、研磨、中和剂)处理方法分离油樟叶内生细菌,旨在获取更丰富的内生细菌资源;并对α-松油醇高产内生细菌进行筛选及诱变育种,为进一步开发利用高产菌株生产α-松油醇奠定基础。
1 材料与方法
1.1 材料
1.1.1 材料来源
根据前期研究结果,以宜宾市高县月江森林经营所红岩山油樟母本园中油樟产油率和成分相对含量存在差异的5株油樟株系叶片为材料(表1)。
表1 1~5号油樟株系叶片产油率及主成分含量差异 单位:%
Table 1 Oil production rate and main component content of five C.longepaniculatum

油樟植株12345得油率4.7255.4506.7005.7256.0251,8-桉叶油素含量51.18047.22048.64052.85056.510
1.1.2 培养基
LB营养琼脂、胰酪大豆胨琼脂培养基(tryptose soya agar,TSA)、卵磷脂吐温-80营养琼脂均为成品培养基,杭州百思生物科技有限公司。
1.1.3 主要试剂
细菌基因组DNA快速抽提试剂盒、PCR通用引物(27F:5’-AGAGTTTGATCATGGCTCAG -3’;1492R:5’ -ACGGT TACCTTGTTACGACTT -3’),上海生工生物工程公司提供和合成;中和剂:质量分数0.5%甘氨酸,体积分数3%吐温-80,磷酸缓冲液(0.1 mol/L pH 7.2);乙醇、NaClO、MgSO4为分析纯、二氯甲烷为色谱纯,成都科隆化学品有限公司;
1.2 方法
1.2.1 油樟叶表面消毒处理
1~5号油樟叶于流水冲洗10 min后,在无菌条件下按无菌水2次(30 s/次)→体积分数75%乙醇2 min→无菌水2次(30 s/次)→体积分数2% NaClO(按有效氯含量计算)5 min→无菌水4~5次(30 s/次)程序进行表面消毒,备用。实验设置漂洗对照、印记对照和环境对照。
1.2.2 中和剂浓度的筛选
无菌条件下,称取1 g经消毒的油樟叶于无菌研钵中,剪碎,依次添加体积分数为0,10%,30%,50%,70%,90%经121 ℃灭菌15 min的中和剂9 mL,充分研磨,各取200 μL接种LB培养基,重复3次,36 ℃恒温培养1~2 d,观察出菌情况,筛选最适中和剂浓度。
1.2.3 内生细菌的分离
无菌条件下,取表面彻底消毒的1~5号油樟叶片,吸干表面水分,(1)用无菌镊子和剪刀裁去油樟叶叶柄及组织边缘,沿着叶脉将其剪成0.5~1 cm的组织块,备用;(2)称取1g油樟叶于无菌研钵中,剪碎后加入9 mL无菌蒸馏水,充分研磨,备用;(3)称取1g油樟叶于无菌研钵中,剪碎后加入9 mL最适浓度中和剂,充分研磨,备用。将上述组织块及研磨液分别接种LB、TSA和卵磷脂吐温-80营养琼脂培养基,组织块每皿接种5片,研磨液每皿接种200 μL,设置5个重复,36 ℃恒温培养,每24 h观察出菌情况并计数。
1.2.4 内生细菌分子鉴定
按同方法同样本同培养基原则挑取特征菌落于液体培养基,36 ℃、140 r/min培养12 h。按细菌基因组DNA快速抽提试剂盒提取DNA并进行PCR扩增。25 μL PCR反应体系为:12.5 μL Taq PCR Master Mix (2x),1 μL DNA模板,1 μL 10 μmol/L 引物27F,1 μL 10 μmol/L 引物1492R,用Sterilized ddH2O 补足至25 μL。扩增程序:94 ℃ 4 min;30个循环94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s;72 ℃ 10 min,4 ℃保存。PCR扩增产物送上海生工生物工程公司进行16S rDNA序列测定,测定序列提交GenBank进行Blast同源性匹配。
1.2.5 α-松油醇高产菌株的筛选
样品制备:油樟叶内生细菌接种至40 mL LB液体培养基,36 ℃,140 r/min摇床培养12 h。将二氯甲烷与菌液按1∶1(mL∶mL)混合,超声破碎20 min后充分混匀,静置。取有机相,添加适量无水MgSO4,静置过夜。吸取1 mL二氯甲烷萃取液,0.22 μm 微孔滤膜过滤,进行GC-MS(安捷伦7890A-5975C)分析检测。
GC条件:HP-5MS毛细管色谱柱(30 m×250 μm×0.25 μm);载气(He);流速1 mL/min,不分流进样,进样口温度220 ℃;柱温60 ℃用于0 min,然后10 ℃/min 到190 ℃,保持 2 min,5 ℃/min 到 210 ℃保持2 min,然后 10 ℃/min 到 220 ℃保持 8 min。运行30 min。
MS条件:接口温度280 ℃;离子源温度230 ℃;电子电离源;电子能量70 eV;质量扫描范围45~300 u。
1.2.6 α-松油醇高产菌株的诱变选育
将α-松油醇高产菌株按10倍梯度用PBS缓冲液稀释到适当菌种浓度后,取100 μL涂布LB培养基,放置带菌平板于30 W、30 cm紫外灯处,进行紫外诱变。诱变以30 s为时间间隔,随后36 ℃避光倒置培养12 h,计算致死率。挑取诱变菌株接种LB液体培养基,36 ℃,140 r/min摇床培养12 h后,制样,进行GC-MS分析检测。致死率计算如公式(1)所示,
致死率![]()
(1)
1.2.7 α-松油醇诱变菌株遗传稳定性检测
对筛选到的诱变菌株进行连续传代培养,采用平板划线传至第5代,测定子代产α-松油醇的稳定性。
1.2.8 数据分析
数据采用DPS 7.05进行统计分析,origin 8.0软件作图。α-松油醇含量采用外标法进行定量分析检测。
2 结果与分析
2.1 中和剂浓度的选择
如表2所示,随着中和剂浓度的增大,油樟叶内生细菌分离量呈先上升后下降的趋势。在中和剂体积分数为50%时,油樟叶内生细菌数量最高达到4.9×103 CFU/g 叶重。继续增大中和剂浓度,油樟叶内生细菌数量开始递减,说明高浓度下的中和剂对油樟叶内生细菌的分离存在抑制作用。
表2 中和剂浓度对油樟叶内生细菌分离的影响
Table 2 Effect of neutralizer concentration on separation of lead endophytic bacteria from C.longepaniculatum

中和剂体积分数/%01030507090内生细菌数量×10-3/(CFU·g-1)0.9301.5002.6504.9000.9750.675
2.2 不同处理方法分离油樟叶内生细菌的结果
3种培养基中,组织块法接种75皿375片油樟叶组织块,5 d内仅有3.2%组织块长出13株内生细菌;研磨法接种75皿,5 d内48皿长出内生细菌181株;在中和剂作用下,接种75皿培养基,5 d内51皿长出内生细菌458株,见表3。3种处理方法分离效果依次为中和剂辅助法>研磨法>组织块法。研磨法分离内生细菌数量远大于组织块植入,可能因为研磨处理使内生细菌从组织分散到匀浆液,更多内生细菌直接或更快吸收培养基营养,从而生长更快。王涛等[15]采用研磨法分离到油樟叶内生细菌13株,少于本实验研磨法所得数量,这可能受油樟叶采集季节、叶龄、树龄等[17]因素影响,也可能与所用的营养琼脂(nutrient agar,NA)培养基有关。其次,中和剂辅助分离油樟叶内生细菌数量远远大于传统研磨法与组织块法,这可能是中和剂抑制了油樟油抑菌活性。研究表明[18-19],3.13~12.50 μL/mL浓度油樟油即可显著抑制多种革兰氏阳性菌和革兰氏阴性菌的生长,而中和剂的加入可能使得油樟油抑菌活性被抑制。也可能是因为中和油樟叶因充分研磨而释放的黏液,促进内生细菌释放。
表3 不同处理方法和培养基下油樟叶内生细菌的生长数量
Table 3 Numbers of leaf endophytic bacteria from C.longepaniculatum with different treatment methods and medium
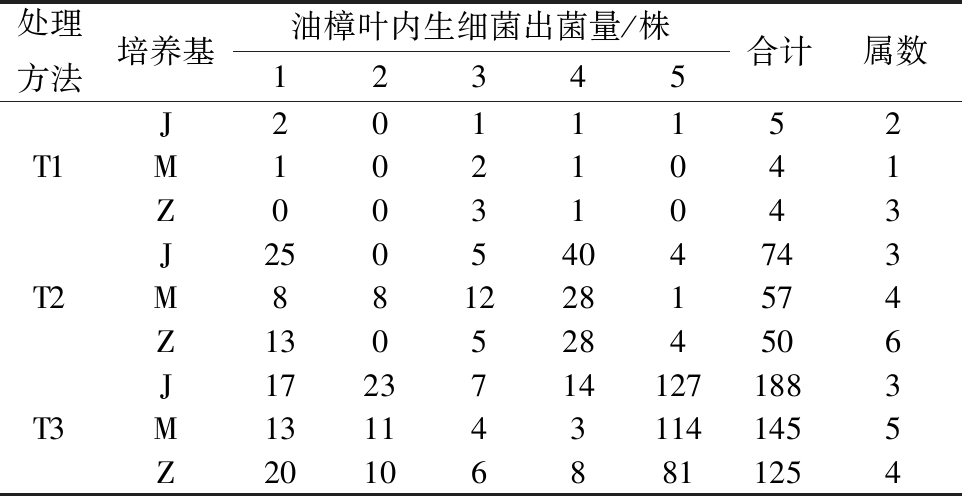
处理方法培养基油樟叶内生细菌出菌量/株12345合计属数J2011152T1M1021041Z0031043J2505404743T2M8812281574Z1305284506J17237141271883T3M1311431141455Z201068811254
注:T1、T2、T3依次代表组织块法、研磨法、中和剂辅助法;J、M、Z依次为LB、TSA、卵磷脂吐温-80营养琼脂。
2.3 油樟叶内生细菌的16S rDNA鉴定
如表4、表5所示,5株油樟植株共保存176株内生细菌,经鉴定分属于4个门13个属的34个种。13个属包括Bacillus、Lysinibacillus、Staphylococcus、Microbacterium、Micrococcus、Rothia、Aerococcus、Pseudomonas、Kocuria、Virgibacillus、Sphingomonas、Acinetobacter、Chryseobacterium。其中,组织块法保存10株,分属于1个门4个属;研磨法保存59株,分属于3个门7个属;中和剂辅助法保存107株,分属于3个门7个属。Bacillus和Staphylococcus分别为油樟叶内生细菌第一优势属和第二优势属,占总量的71.02%和11.36%。
表4 不同处理方法和培养基对油樟叶内生细菌种类的影响
Table 4 Species of different treatment methods and medium on endophytic bacteria in C.longepaniculatum leaves
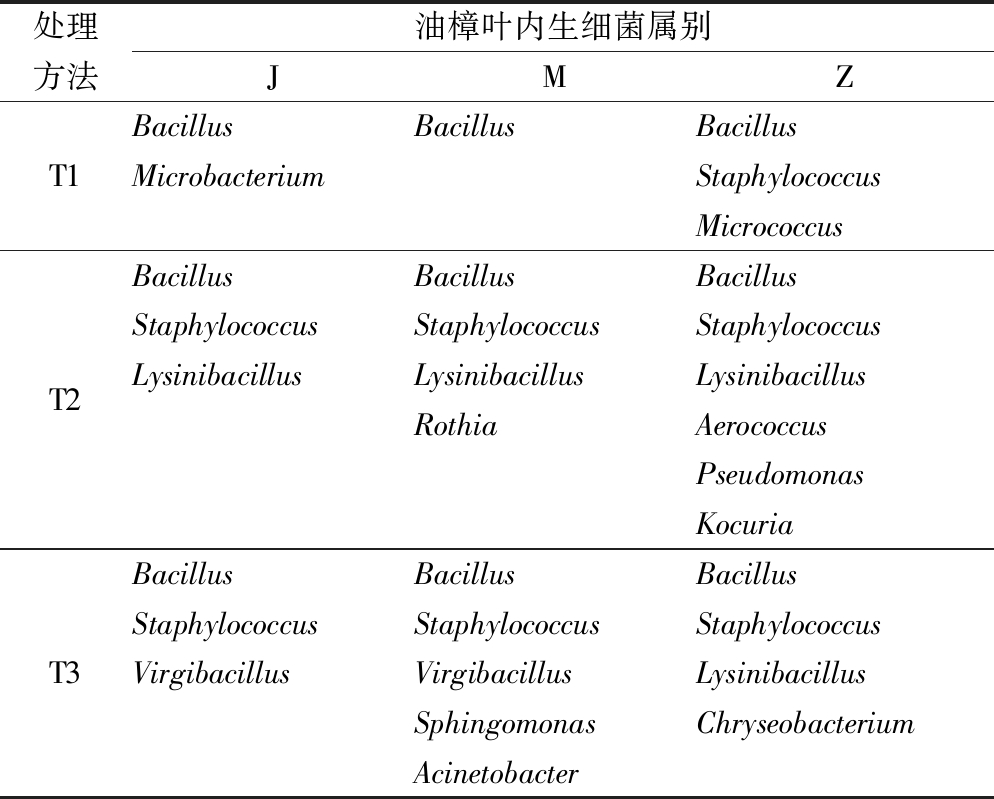
处理方法油樟叶内生细菌属别JMZT1BacillusBacillusBacillusMicrobacteriumStaphylococcusMicrococcusT2BacillusBacillusBacillusStaphylococcusStaphylococcusStaphylococcusLysinibacillusLysinibacillusLysinibacillusRothiaAerococcusPseudomonasKocuriaT3BacillusBacillusBacillusStaphylococcusStaphylococcusStaphylococcusVirgibacillusVirgibacillusLysinibacillusSphingomonasChryseobacteriumAcinetobacter
表5 油樟叶内生细菌部分序列相似性分析
Table 5 Similarity analysis of partial sequences of leaf endophytic bacteria from C.longepaniculatum

类群属代表菌株登录号相似菌种相似度/%油樟植株FirmicutesBacillusT2-J-68MK910180Bacillussp.(in:Bacteria)strainDW024(MK713577.1)100%1、3T3-Z-60MK910178BacillusamyloliquefaciensstrainYC16(MK713569.1)100%1、2、3、4、5T3-J-16MK910162BacillussiamensisstrainTSS18(MF620076.1)99.7%1、4、5T3-Z-14MK910161BacilluscereusstrainX-7(MF988730.1)100%1、2、3、4、5T3-J-32MK910166BacillussubtilisstrainHZ-72(MF136610.1)99.62%1、2、3、4、5T3-M-45MK910168BacilluskochiistrainYou8(KY021739.1)99.62%1、2、3、5T3-M-39MK910176BacillusaeriusstrainUB02(MK696417.1)100%3、4T1-J-15MK910203Bacillussp.(in:Bacteria)strainH2(MK704289.1)100%1、4T3-M-36MK910172BacillussimplexstrainE133(MK100910.1)100%1、4T3-Z-61MK910179BacilluscirculansstrainPK3-56(MG988220.1)100%3、5T3-J-4MK910160BacillusflexusstrainBl39(KX058514.1)100%4T3-Z-29MK910165BacillussolanistrainDSS-STR-5(MF076550.1)99.34%3T3-J-23MK910163Bacillussp.210_52(GQ199754.1)99.18%5AerococcusT2-Z-130MK910189Aerococcussp.strainInS-169(KY964258.1)100%5LysinibacillusT2-M-108MK910185Lysinibacillussp.strainJX-5(KX960107.1)100%4T2-M-107MK910184LysinibacillusalariessstrainIAE195(MK414895.1)100%4T3-Z-55MK910177Lysinibacillussp.strainNT1(MH559628.1)100%1、3、4VirgibacillusT3-J-28MK910164VirgibacillusalariesstrainSM-N-19-12(MK622386.1)99.70%5StaphylococcusT3-M-137MK910193Staphylococcussp.strain201709CJKOP-113(MG867563.1)100%3T2-Z-133MK910191StaphylococcusepidermidisstrainBMC2N11_1(MH050411.1)100%3、4、5T2-Z-119MK910187Staphylococcussp.Felineoraltaxon334strain7011(KM461949.1)100%3、5T2-J-75MK910181StaphylococcuspasteuristrainBMLN9(MG996798.1)100%2、3T3-Z-46MK910175Staphylococcussp.strainCE01(MK618637.1)100%1T2-Z-134MK910192StaphylococcusxylosusstrainIAE165(MK414862.1)100%2、5T1-Z-8MK910201StaphylococcusnepalensisstrainRCB145(KT260357.1)100%3MicrococcusT1-Z-6MK910200Micrococcussp.strainCLC-F35(MH518217.1)99.89%1MicrobacteriumT1-J-10MK910202MicrobacteriumresistensstrainPL-24(MK517595.1)100%4
续表5

类群属代表菌株登录号相似菌种相似度/%油樟植株ActinobacteriaKocuriaT2-Z-113MK910186KocuriaassamensisstrainSCSIO_43735(MH283819.1)100%1RothiaT2-M-102MK910183Rothiasp.3_1/4V(EF540463.1)100%3ProteobacteriaPseudomonasT2-Z-129MK910188Pseudomonassp.XBGRA4(KJ184870.1)100%5SphingomonasT3-M-41MK910174Sphingomonassp.MEB2(JX026010.1)99.61%4AcinetobacterT3-M-24MK910171Acinetobacterlwoffiistrain263ZG5(KF831406.1)99.71%2T3-M-57MK910170AcinetobacterradioresistensstrainKA5(MK127547.1)100%3BacteroidetesChryseobacteriumT3-Z-55MK910169CandidatusChryseobacteriummassiliaestrainCRh10(KR780447.1)100%1
34种油樟叶内生细菌中,Micrococcus、Kocuria和Chryseobacterium仅出现在1号油樟株系;Rothia仅出现在3号油樟株系;Microbacterium和Sphingomonas仅出现在4号油樟株系;Aerococcus、Virgibacillus和Pseudomonas仅出现在5号油樟株系,这可能与1~5号油樟植株产油率和1,8-桉叶油素含量差异有关(表1),有待进一步研究。并且,Microbacterium仅用LB培养基分离获得;Rothia、Sphingomonas和Acinetobacter仅用TSA培养基分离获得;Micrococcus、Aerococcus、Pseudomonas、Kocuria和Chryseobacterium仅用卵磷脂吐温-80营养琼脂分离获得,这可能与该属油樟叶内生细菌对培养基营养物质的专一性有关。王涛等[15-16]采用NA培养基分离到Paenibacillus油樟叶内生细菌,本实验所用培养基均未分离到该属内生细菌,除与培养基有关,也可能是油樟植株种属、株号、季节等不同造成的。
2.4 α-松油醇高产菌株的筛选结果
天然的香气物质除来源植物精油或挥发油外,微生物是其获取的另一生物途径。由图1可知,34种油樟叶内生细菌通过液体培养后,均可在培养液中检测到不同物质含量的α-松油醇,其中α-松油醇产量最高的为芽孢杆菌属(Bacillus)的1株内生细菌,菌株编号为T3-M-39(图2),其α-松油醇产量为1.075 mg/L。将T3-M-39菌株作为出发菌株进行紫外诱变试验。
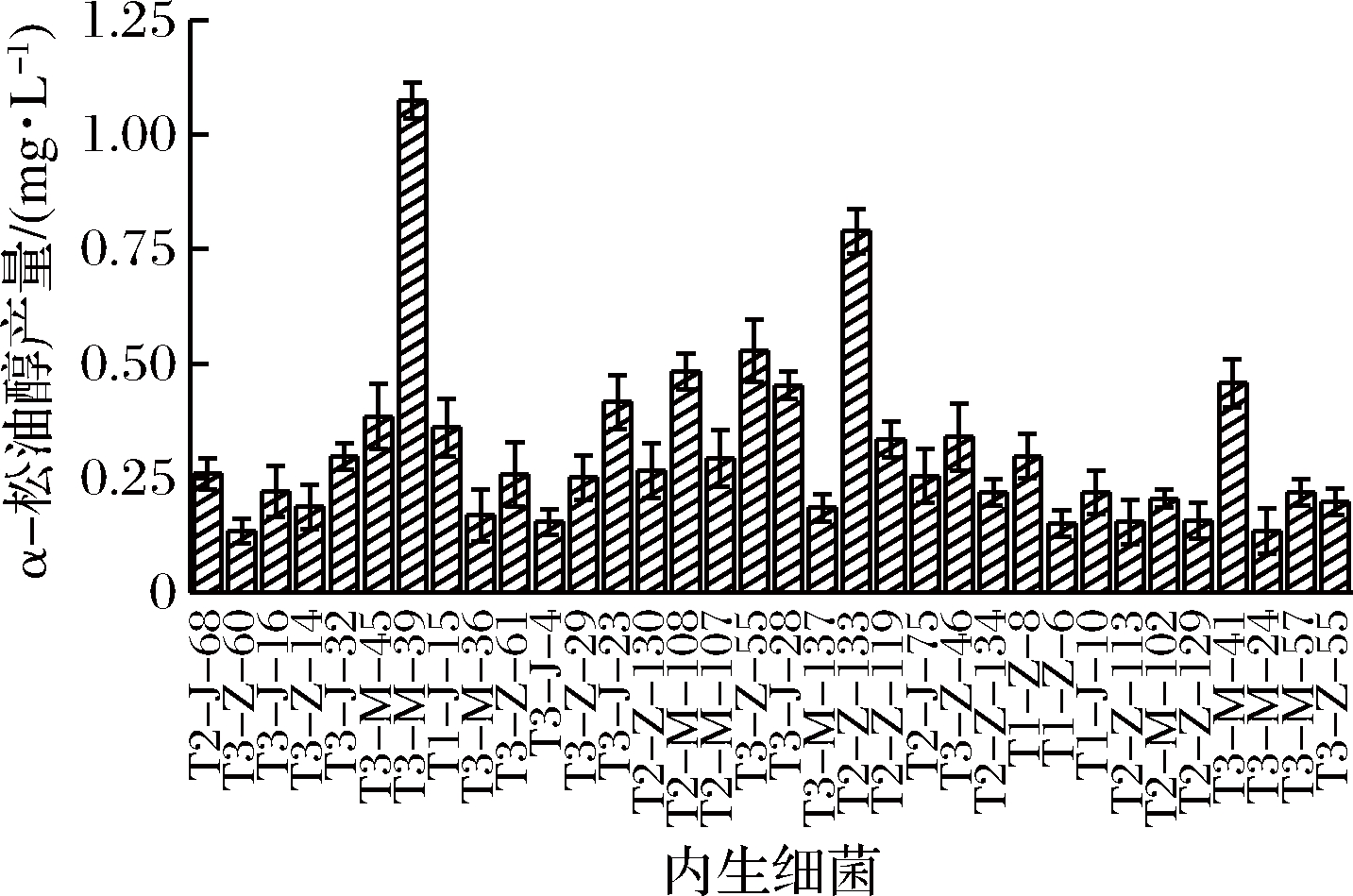
图1 α-松油醇高产菌株的筛选
Fig.1 Screening of endophytic bacteria with high yield of α-terpineol
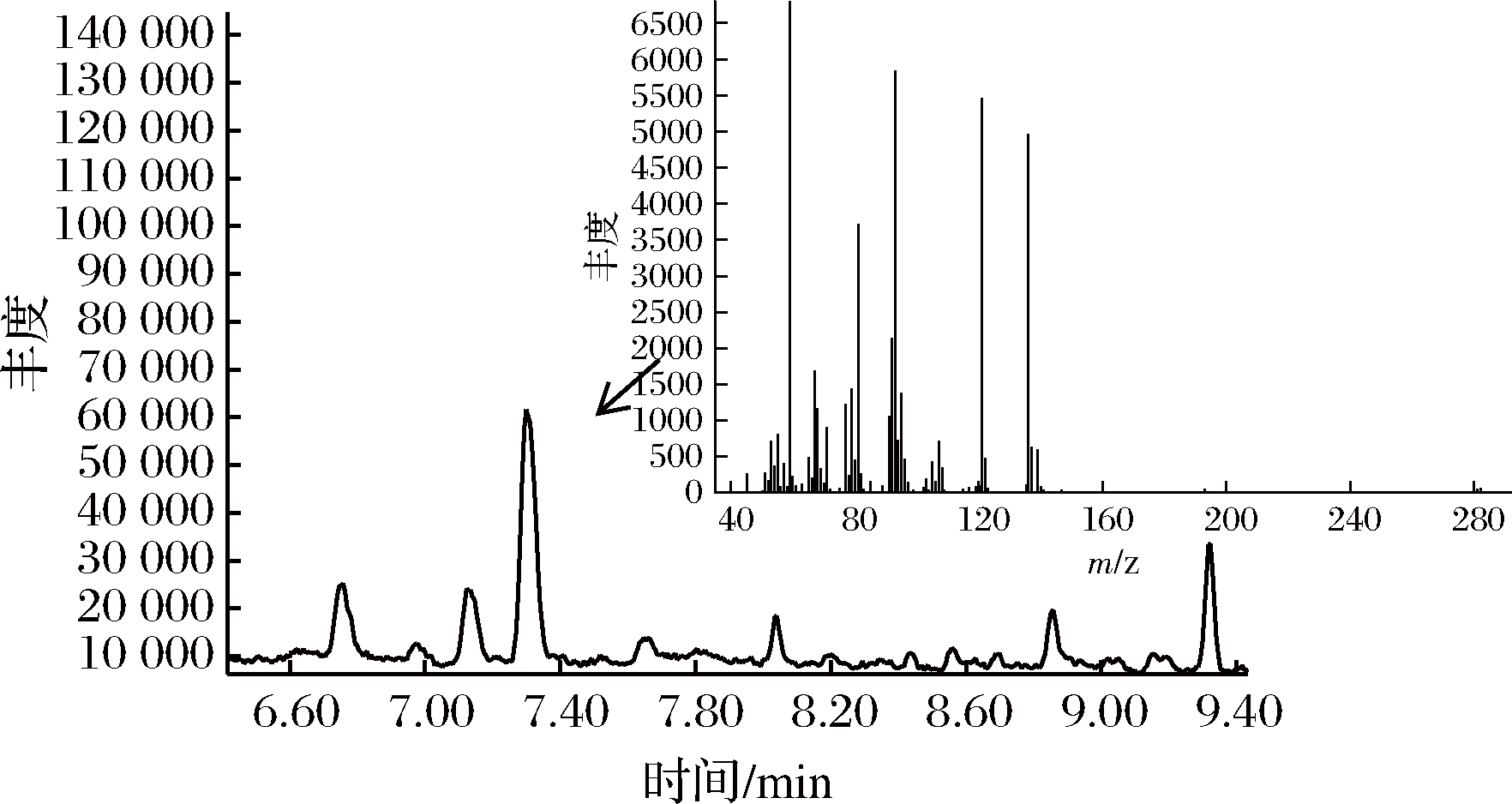
图2 T3-M-39菌株GC-MS色谱图及α-松油醇质谱图
Fig.2 GC-MS chromatogram of T3-M-39 and α-terpineol mass spectrum
2.5 紫外诱变时间的选择
紫外线具有较高的杀菌能力和诱变能力,随着照射时间延长,培养皿中活菌数逐渐减少(图3)。一般认为,高剂量诱变(致死率90%以上)引发的突变范围更广,变异菌株更多,但高剂量诱变下回复突变菌株出现率增大[20],不利于筛选,且一般认为低剂量可以提高正突变率。目前普遍认为致死率控制在70%~80%时的诱变剂量较为合适[21-22]。如图4所示,从2.5 min开始,T3-M-39菌株紫外诱变致死率超过80%,2 min时,致死率为74.07%,符合正向突变菌株的理想致死率,故选择诱变时间2 min作为最佳诱变时间。
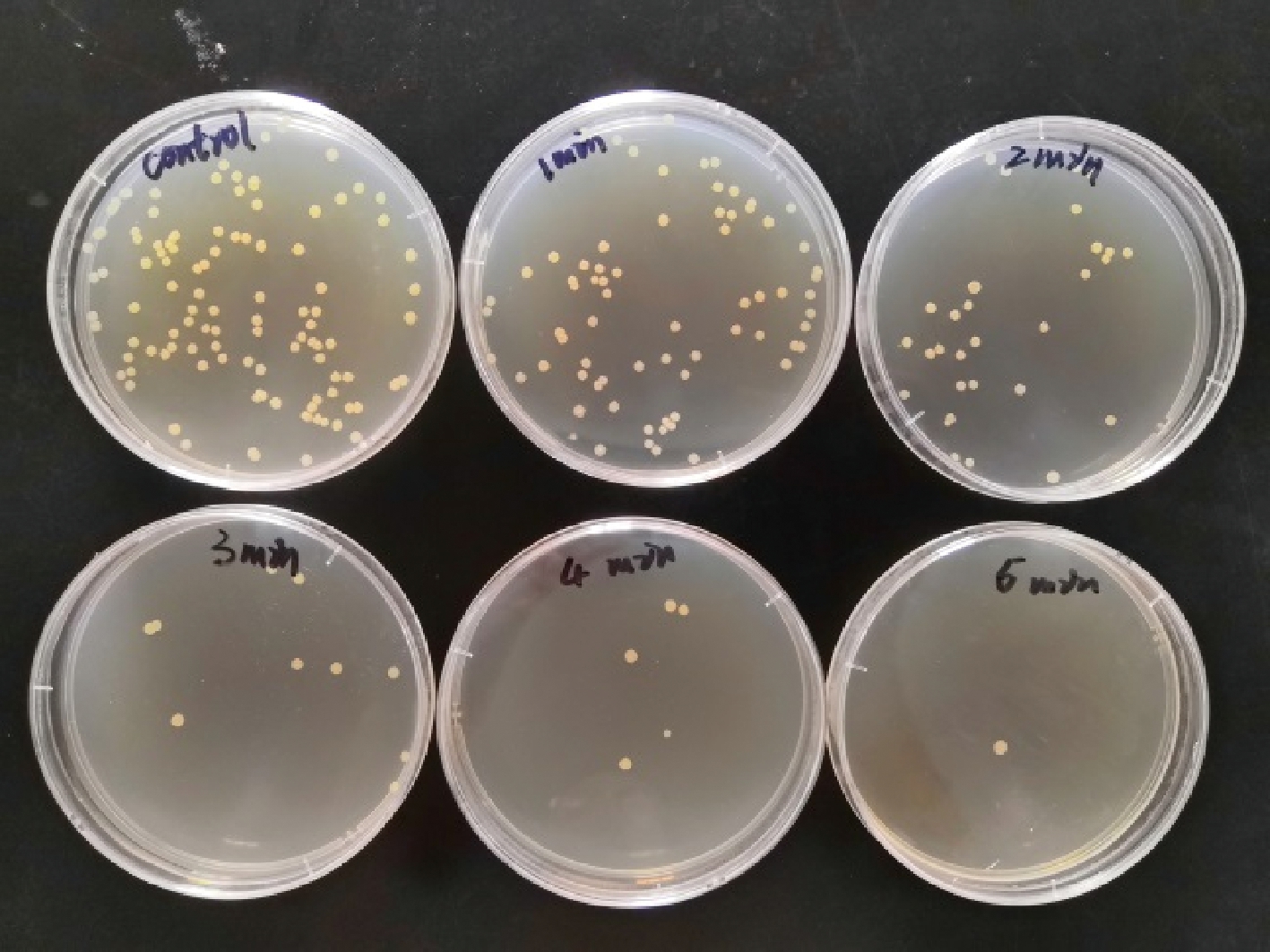
图3 紫外诱变处理结果
Fig.3 UV mutagenesis results
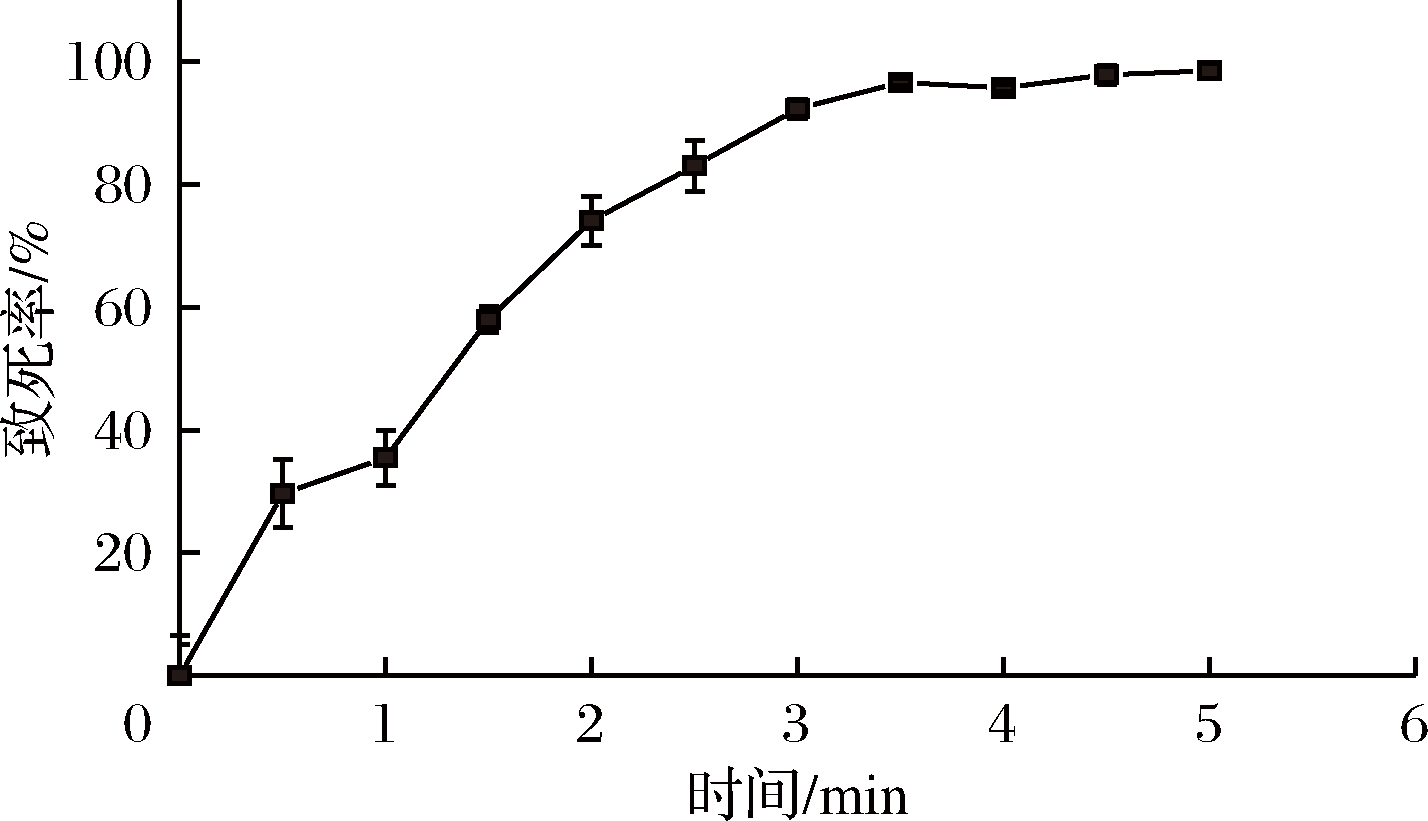
图4 T3-M-39紫外诱变致死曲线
Fig.4 Lethality curve of T3-M-39 under UV mutagenesis
2.6 突变菌株产α-松油醇能力及遗传稳定性分析
如图5、图6所示,出发菌株T3-M-39经紫外诱变处理2 min时,其正突变率和负突变率分别为26.04%和14.34%。将出发菌株T3-M-39作为对照,经紫外诱变后,T3-M-39最优正向突变菌株产α-松油醇能力比出发菌株提高了34.85%,显著高于出发菌株(P<0.05)。对该菌株连续传代培养5代,测定α-松油醇含量,发现该菌株产α-松油醇能力稳定,未出现回复突变菌株。并且,T3-M-39最优突变菌株子代产α-松油醇含量保持在1.450 mg/L左右,无差异显著性变化(P>0.05),说明该菌株具有良好的遗传稳定性。
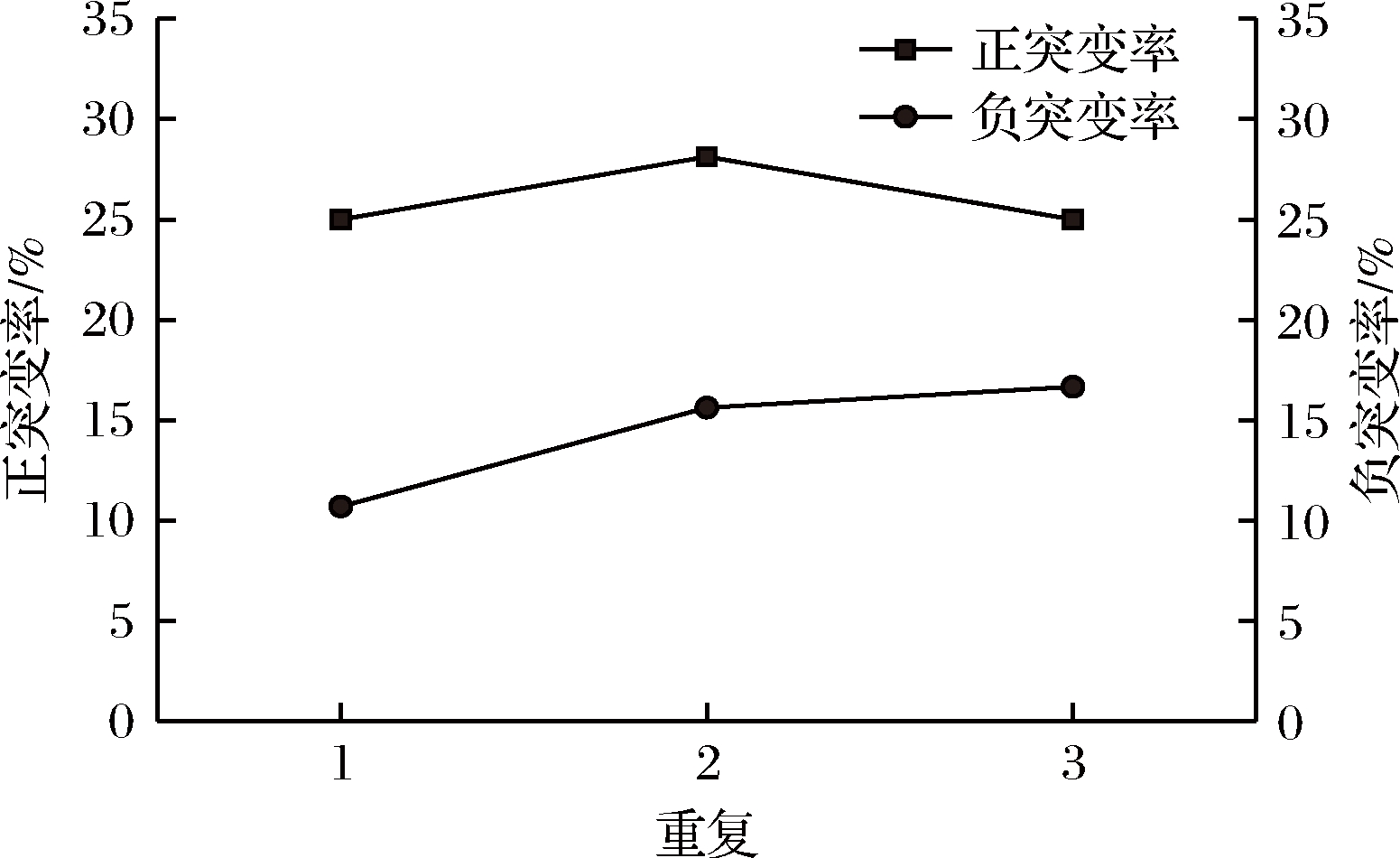
图5 T3-M-39菌株的诱变效应
Fig.5 Mutagenic effect of T3-M-39
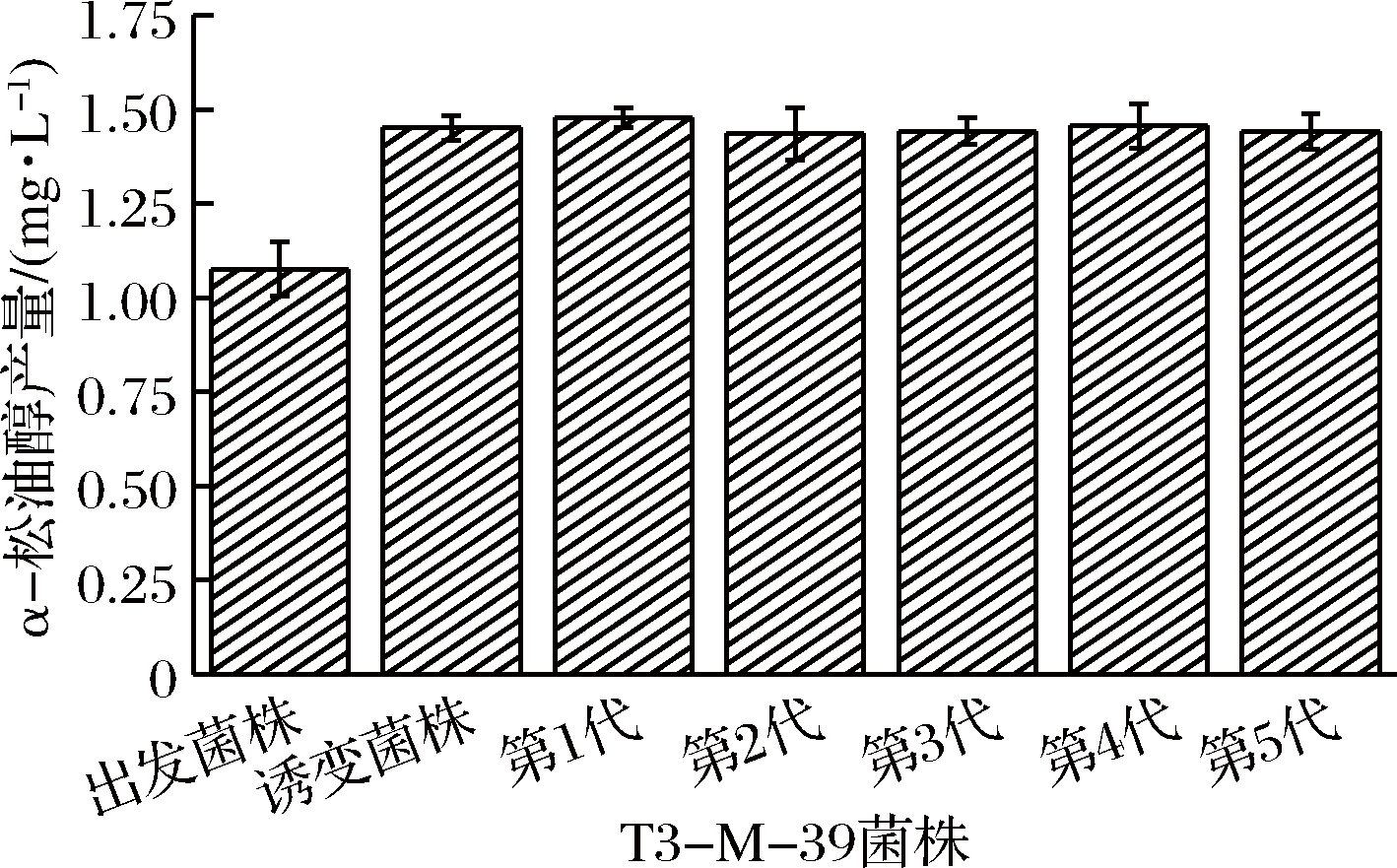
图6 正突变菌株α-松油醇产能及遗传稳定性
Fig.6 α-terpineol production of positive mutant strain and genetic stability
3 结论
α-松油醇作为一种允许使用的食品合成香精香料,广泛用于食品工业。然而,通过化工合成的α-松油醇已难以满足人们对 “绿色”香精香料的需求。生物法生产香精香料是一种模拟天然动植物代谢过程的方法,其产物已被欧洲和美国食品法规界定为“天然的”[23]。利用微生物采用生物技术是生产天然香精香料的途径之一。鉴于内生菌的生境特殊性,从植物微生态系统中筛选与宿主植株存在共代谢作用的功能菌株是获取菌株材料的有效途径。本实验采用组织块法、研磨法、中和剂辅助法共保存176株内生细菌,鉴定分属于Bacillus、Lysinibacillus、Staphylococcus、Microbacterium、Micrococcus、Rothia、Aerococcus、Pseudomonas、Kocuria、Virgibacillus、Sphingomonas、Acinetobacter、Chryseobacterium的34个种。其中,Bacillus为绝对优势菌属,这与大多数其他植物内生菌优势属研究结果相似[24]。内生芽孢杆菌属可能较其他内生细菌更易产生宿主植物主要活性物质或前体物质[25-26]。通过对34种油樟叶内生细菌培养液中α-松油醇含量进行GC-MS分析,筛选到1株芽孢杆菌属高产α-松油醇的内生细菌T3-M-39,说明Bacillus内生细菌在与油樟的相互作用中可能发挥着重要作用。
野生菌株生产能力较低,一般用于生产的菌株需经过菌种改良提高生产能力。基因工程技术在菌种选育方面取得了瞩目成就,但利用物理或化学诱变仍然是国内外提高菌种生产能力的重要手段[27]。张建新等[28]采用紫外诱变产β-甘露聚糖酶的黄豆内生菌,使其产酶能力较出发菌株提高了37%。徐婉如[29]对1株分离自秦艽根部的内生真菌QJ18进行80 s紫外照射,发现其产龙胆苦苷的能力比出发菌株提高25.2%。本实验将T3-M-39菌株作为出发菌株进行紫外诱变,诱变条件为30 W紫外灯30 cm处照射2 min,其最优正向突变菌株α-松油醇产量增至1.451 mg/L,较出发菌株提高了34.85%,且遗传稳定性良好。说明通过紫外诱变方式提高T3-M-39菌株生产α-松油醇是可行的,结果可为提高α-松油醇产量提供菌株材料,为利用生物法生产α-松油醇奠定基础。然而本实验仅采用单一诱变对菌株进行改良,为防止平顶效应[30],还有待于通过多轮复合诱变或基因工程技术对菌种进行改造,优化发酵工艺条件以提高α-松油醇产量。
[1] 罗中杰,李维一,魏琴,等.宜宾油樟的现状及未来[J].四川师范大学学报(自然科学版),2001,24(3):317-319.
[2] 尹礼国,凌跃,杜永华,等.宜宾油樟营养器官精油主成分分析[J].江苏农业科学,2014,42(11):348-350;355.
[3] 胡文杰,许樟润,李冠喜.基于响应面法对油樟籽油超声波提取工艺的优化[J].中国粮油学报,2017,32(2):109-115.
[4] CHRISTINA K,NURHAYAT T,GERHARD B.α-Terpineol,a natural monoterpene:A review of its biological properties[J].Open Chemistry,2018,16(1):349-361.
[5] DANIELE N G,JANARA S C,MARLANGE A O,et al.α-Terpineol reduces cancer pain via modulation of oxidative stress and inhibition of iNOS[J].Biomedicine &Pharmacotherapy,2018,105:652-661.
[6] POLYANNA D S N,DOUGLAS S D C,VALDEANIA G D S,et al.Antidiarrheal activity of α-terpineol in mice[J].Biomedicine &Pharmacotherapy,2019,110:631-640.
[7] 陈绮琪,黄贵玲,刘文森,等.碳硅复合固体酸催化剂的制备及其催化性能研究[J].肇庆学院学报,2019,40(2):45-50;55.
[8] 牟大庆.二步法生产药用松油醇工艺技术改进及效果分析[J].生物质化学工程,2010,44(1):27-30.
[9] 曹松,安兰芝,卢祥,等.D型大孔磺酸树脂催化松节油水合一步合成松油醇[J].离子交换与吸附,2015,31(5):455-463.
[10] 梁鸣,陈敏,蔡春平,等.松油醇的分析及其生产工艺改进的研究[J].色谱,2002,20(6):577-581.
[11] 田红玉,陈海涛,孙宝国.食品香料香精发展趋势[J].食品科学技术学报,2018,36(2):1-11.
[12] CUI J L,WANG C L,GUO S X,et al.Stimulation of dragon′s blood accumulation in Dracaena cambodiana via fungal inoculation [J].Fitoterapia,2013,87(1):31-36.
[13] 严宽,陈放,魏琴,等.内生真菌对油樟挥发油积累及生理生化特性的影响[J].生物技术通报,2017,33(3):138-143.
[14] 周婧,杨琦,李钢,等.红树属植物内生真菌多样性及其代谢产物研究进展[J].林业科学,2019,55(1):92-102.
[15] 王涛,游玲,魏琴,等.油樟内生细菌的多样性及抑制植物病原菌初步研究[J].西北林学院学报,2009,24(2):97-100.
[16] 王涛,游玲,崔晓龙,等.油樟内生芽孢细菌的系统发育多样性[J].微生物学报,2009,49(5):574-580.
[17] 方珍娟,张晓霞,马立安.植物内生菌研究进展[J].长江大学学报(自科版),2018,15(10):41-45.
[18] LI L,LI Z W,YIN Z Q,et al.Antibacterial activity of leaf essential oil and its constituents from Cinnamomum longepaniculatum [J].International Journal of Clinical &Experimental Medicine,2014,7(7):1 721-1 727.
[19] 魏琴,周宇科,周黎军,等.油樟油抑制细菌生长的活性试验[J].热带农业科学,2009,29(1):5-7.
[20] 刘晓丹,王俊玲,王霞.树舌灵芝复合诱变选育漆酶高产菌株[J].北方园艺,2019(14):124-129.
[21] 田蕊,萨如拉,段晓霞,等.产γ-氨基丁酸乳酸菌的筛选鉴定及其紫外诱变研究[J].食品工业科技,2018,39(17):128-132.
[22] 孙会忠,宋鹏,杜君,等.一株硅酸盐细菌的鉴定及其紫外线诱变育种[J].基因组学与应用生物学,2018,37(3):1 225-1 230.
[23] 辛羚,俞苓,齐凤兰,等.天然香精香料与生物技术[J].食品科技,2004,25(11):49-51;54.
[24] 陈泽斌,夏振远,雷丽萍,等.烟草可培养内生细菌的分离及多样性分析[J].微生物学通报,2011,38(9):1 347-1 354.
[25] 王玉美.汽爆辅助提取喜树碱及产喜树碱内生菌的筛选[D].北京:中国科学院大学,2011.
[26] 张庭静,蒋瑾,徐淑霞,等.一株产梓醇的地黄内生细菌的鉴定[J].浙江农业科学,2011(2):395-399.
[27] 陈奕涵,钱悦,侯永泰,等.复合诱变选育大分子量透明质酸高产菌株[J].中国酿造,2012,31(9):98-101.
[28] 张建新,张吨,王海磊,等.产β-mannanase内生菌的诱变育种和酶学特性研究[J].现代食品科技,2012,28(10):1 331-1 335;1 410.
[29] 徐婉如.秦艽内生真菌的诱变育种及其发酵条件优化[D].西安:西北大学,2008.
[30] 张建新,赵杰,陈泽田,等.产β-甘露聚糖酶内生菌的诱变育种及产酶条件优化[J].基因组学与应用生物学,2014,33(4):815-821.