近年来,随着消费者对食品健康与安全关注日益增加,天然色素的市场需求日益增长,其开发和利用具有较大的商业价值。根据色素的色调,红曲色素分为红曲红、红曲黄和红曲橙3类;其中公认的黄色素2种组分为红曲素和安卡红曲黄素[1]。目前红曲红色素已大规模工业化生产,它具有一系列有利于健康的生理活性[2-7,8-10]。在固态红曲米色素中,3类色素共存,含有一定含量的黄色素,种类较多、成分复杂,直接以溶剂提取法从红曲色素产品中分离提取利用并不经济,因而相关的研究主要集中在高色价的红曲菌筛选和固态或液态发酵条件的优化上。
毛鹏[11]筛选出黄色素产量高的红曲菌Monascus sp.sjs-6,并优化发酵条件,最终发酵罐中发酵液的黄色素色价达到397.2 U/mL。薄层析色谱对色素进行展开,出现一个深黄色和一个浅黄色色带,特征吸收波长分别为421和409 nm,且色素不含有橙色素和红色素。但研究并未对这2种色素条带进行进一步的纯化鉴定,其所含色素的分子结构式尚未明确。根据文献报道目前已发现35种红曲黄色素组分[12],因而需要分离纯化出高纯度红曲黄色素组分并鉴定其分子结构。
MARIE等[13]采用连续薄层析色谱法分离红曲黄色素,先用氯仿-丙酮(9∶1,体积比)作为展开剂,然后用石油醚-二乙基醚(5∶5,体积比)再次展开,从Monascusruber ATCC 96218的发酵产物中得到黄色斑点,进一步使用制备型高效液相色谱进行纯化,得到高纯度组分,经核磁共振分析确定为Monarubrin和Rubropunctin。杨强等[14]采用硅胶柱层析法,分离纯化了红曲菌丝体内醇溶性红曲黄色素,经鉴定表征,确定3种色素组分为红斑胺素、红曲素、红斑素,其中红曲素为主要成分。夏明等[15]采用高速逆流色谱法,从红曲米中提取的色素中分离出一种黄色素和一种紫红色素,但并未对2种组分进行进一步分析。郑允权等[16]建立两步逆流萃取,通过高速逆流色谱法从红曲粉中分离得到红、橙、黄6种色素组分,纯度均大于98.5%。崔莉等[17]从红曲米中索氏抽提出红曲黄色素粗提取物,并用制备液相分离纯化得到高纯度的红曲素和安卡红曲黄素,建立了高效液相色谱同时检测红曲混合色素中红曲黄色素含量的检测方法,具有较高的重复性和精密度。
本研究以通过液态发酵技术生产的高色价红曲黄色素为研究对象,采用高效液相色谱作为分离手段,分离纯化并制备少量高纯度的红曲黄色素组分,使用液质联用和核磁共振分析对色素组分的分子结构进行表征,以鉴定液态发酵的天然红曲黄色素的主要色素成分,为红曲黄色素在食品工业中应用提供基础理论指导。
1 实验材料与设备
1.1 实验材料
液态发酵红曲黄色素粗提物,由江南大学生物工程学院毛鹏所在实验室提供;无水乙醇、液相色谱级甲醇、液相色谱级甲酸、氘代氯仿,国药集团化学试剂有限公司;超纯水,市售。
1.2 实验设备
A560分光光度计,翱艺仪器(上海)有限公司;E2695高效液相色谱仪、1525半制备型液相色谱仪、MALDI SYNAPT MS液相色谱四极杆飞行时间串联质谱联用仪,美国Waters公司;R-205旋转蒸发仪,上海申顺生物科技有限公司;DZG-6050SAD真空干燥箱,上海森信实验仪器有限公司;Aduance Ⅲ 400 MHz全数字化核磁共振波谱仪,德国布鲁克AXS有限公司。
1.3 实验方法
1.3.1 红曲黄色素的萃取
将体积分数为85%的乙醇溶液与含色素的脂溶性提取物按体积比4∶1混匀,静置分层,取上层乙醇溶液,经真空旋转蒸发后,除去乙醇和水,获得天然红曲黄色素油树脂(色素和油脂类物质的互溶物)。
1.3.2 红曲黄色素色价的测定
精确称取一定量红曲黄色素油树脂,用无水乙醇溶解,定容至100 mL,摇匀。取样品溶液置于1 cm比色皿中,以无水乙醇为空白对照,用分光光度计在350~600 nm范围内进行全波段扫描,于波长(410±10)nm的最大吸收波长处测定其吸光度。色价(U/g)按公式(1)计算:
色价=吸光度(A)×稀释倍数
(1)
1.3.3 分析型高效液相色谱分离红曲黄色素组分
称取0.15 g红曲黄色素油树脂,用无水乙醇溶解并定容至250 mL。将溶液以0.22 μm有机膜过滤后进样。流动相A:100%甲醇,流动相B:100%水;流速:0.5 mL/min;进样体积:20 μL,样品室温度:20 ℃;柱温:30 ℃;波长扫描范围:220~600 nm;色谱柱:Symmetry C18反相硅胶柱(4.6 mm×250 mm,5 μm)。分离度R按公式(2)计算:
(2)
式中,tR2,相邻两峰后一峰的保留时间;tR1,相邻两峰前一峰的保留时间;W1、W2,相邻两峰的峰宽。
1.3.4 制备型液相色谱分离红曲黄色素组分
称取一定量的红曲黄色素油状树脂,用甲醇溶解,制得0.1 g/mL的色素甲醇溶液,以0.22 μm有机膜过滤。将分析型液相色谱的分离条件乘以放大系数4.73后作为制备液相的初始条件,再根据实际的分离情况对分离条件进行优化。对收集到的目标组分在分析型液相色谱上进行分析,以峰面积归一化法计算纯度。色谱柱为X bridge C18反相硅胶柱(10 mm×250 mm,5 μm)。流出液在40 ℃进行真空旋转蒸发,收集液至称量瓶中;吹N2除去甲醇后置于真空干燥箱,30 ℃下真空干燥72 h,获得高纯度色素组分。
1.3.5 液相色谱-质谱联用分析
红曲黄色素组分用色谱级甲醇溶解,经0.22 μm有机膜过滤后进样。色谱柱:Waters BEH C18柱(2.1 mm×50 mm,1.7 μm);流动相A:100%甲醇;流动相B:水(含体积分数为0.1%的甲酸);流速:0.3 mL/min:分析时间:15 min。洗脱程序:0~0.1 min,5%甲醇等度洗脱;0.1~8 min,5%甲醇线性变化至80%甲醇;8~10 min,80%甲醇线性变化至100%甲醇;10~12 min 100%甲醇等度洗脱;12~12.1 min 100%甲醇线性变化至5%甲醇。超高效液相色谱串联四极杆飞行时间质谱联用仪条件:ESI源,ESI+毛细管电压:3.5 kV;离子源温度:100 ℃;脱溶剂气温度:400 ℃;脱溶剂气流:700 L/h;锥孔气流:50 L/h;碰撞能量:6 eV;扫描质量(m/z)范围:50~1 000;检测器电压:1 800 V。
1.3.6 核磁共振分析
以氘代氯仿为溶剂,样品质量浓度:30 mg/mL,测试温度:25 ℃,氢谱(1H NMR)的观测频率:400.140 MHz,碳谱(13CNMR)的观测频率:100.625 MHz。
1.3.7 数据分析
核磁共振分析软件为TopSpin 4.0.1,质谱分析软件为MassLynx V4.1。所得数据采用OriginPro 9.0软件制图,其中二维核磁共振数据采用MestReNova制图。
2 结果与分析
2.1 红曲黄色素的萃取
红曲发酵液的黄色素粗提物油相的色价为(701±42.7) U/g,所得油树脂的色价为(9 100±93.1)U/g,萃取率为63.50%,与李明起[18]采用溶剂抽提法提取红曲色素的得率66%较为接近。
2.2 分析型液相色谱分离条件的优化
以甲醇-水为流动相,流速为0.5 mL/min,并通过改变流动相的极性,探究红曲黄色素中不同组分的保留时间、出峰形状和相邻峰干扰状况,优化分离条件使红曲黄色素组分之间完全分离,即分离度R大于1.5[19-20]。
由表1可知,在90%甲醇等度洗脱的情况下,红曲黄色素在330~440 nm波长范围内出现2个相邻的大峰,峰A和峰B。330~440 nm为黄色素的特征吸收峰[21],峰A和峰B的对应物质为红曲黄色素的主要组分。其中,峰A的最大吸收波长为235和394 nm,峰B的最大吸收波长为235和389 nm。此条件下2个相邻峰的分离度为0.95,表明2个峰没有完全分开。将流动相调整为85%甲醇时,两峰之间的分离度为1.63,表明二者完全分离,但存在杂质峰与两峰部分重叠。进一步将流动相调整为80%甲醇时,2个峰的分离度进一步增加至2.51,且无杂质峰干扰(图1)。但当流动相进一步调整至75%甲醇时,两峰的保留时间变长,分别达到19.8 min和22.1 min,分离度因峰变宽而减小,为2.21。综合考虑分离效果和分离时间,确定最佳洗脱条件为80%的甲醇等度洗脱。
表1 色素以不同流动相条件洗脱的分离结果
Table 1 Results of pigment eluted by different mobile phase
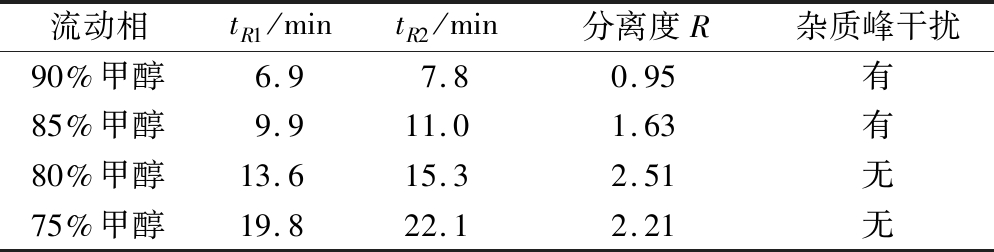
流动相tR1/mintR2/min分离度R杂质峰干扰90%甲醇6.97.80.95有85%甲醇9.911.01.63有80%甲醇13.615.32.51无75%甲醇19.822.12.21无
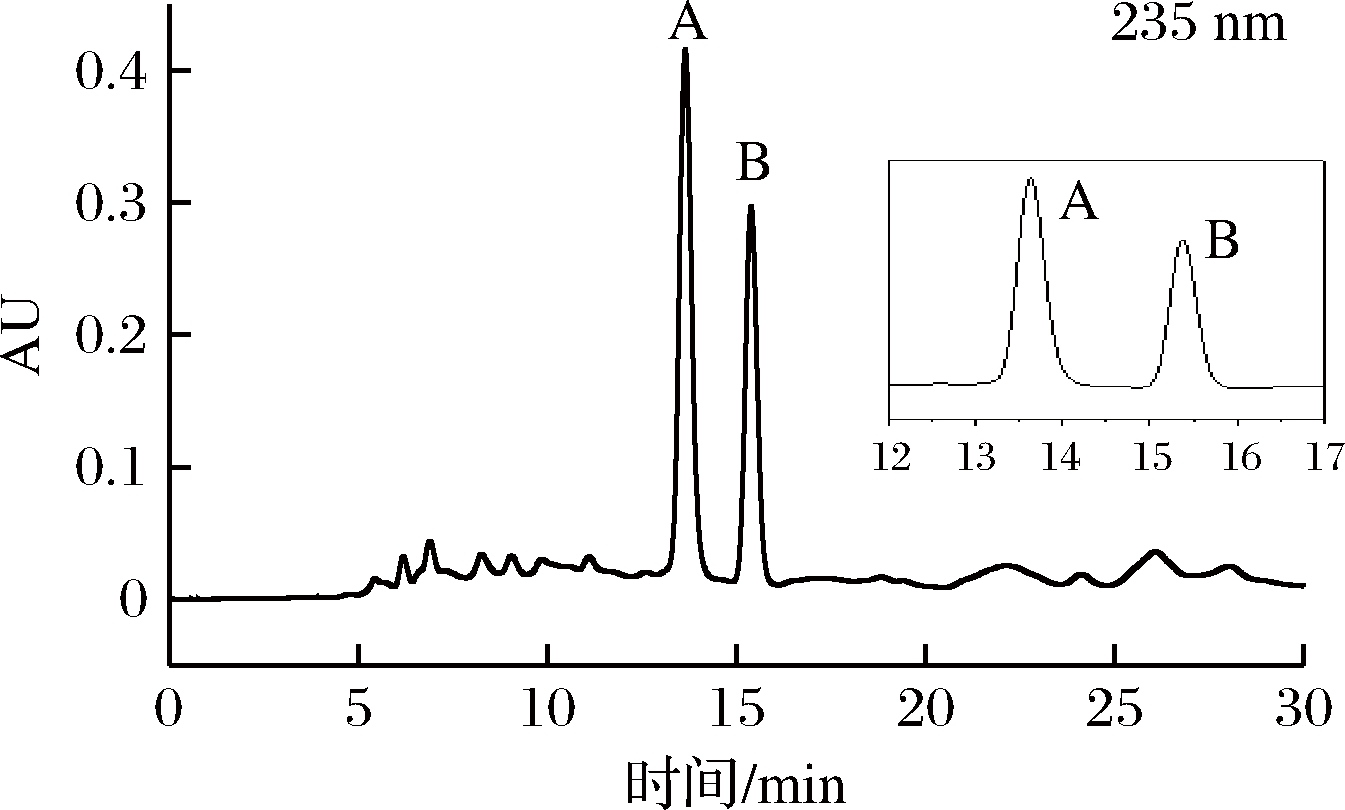
图1 色素以80%甲醇等度洗脱时的液相色谱图
Fig.1 HPLC spectrum of pigment:isocratic elution by methanol
2.3 制备型液相色谱分离纯化制备高纯度红曲黄色素组分
根据色素组分分离状况和分离时间调整流动相的极性和流速,确定洗脱条件为:流速4 mL/min,70%甲醇等度洗脱。组分A和组分B的保留时间分别为18.7和20.5 min,分离度为2.12,满足分离要求(图2)。收集半峰高以上的流出液以确保色素组分较高的纯度。
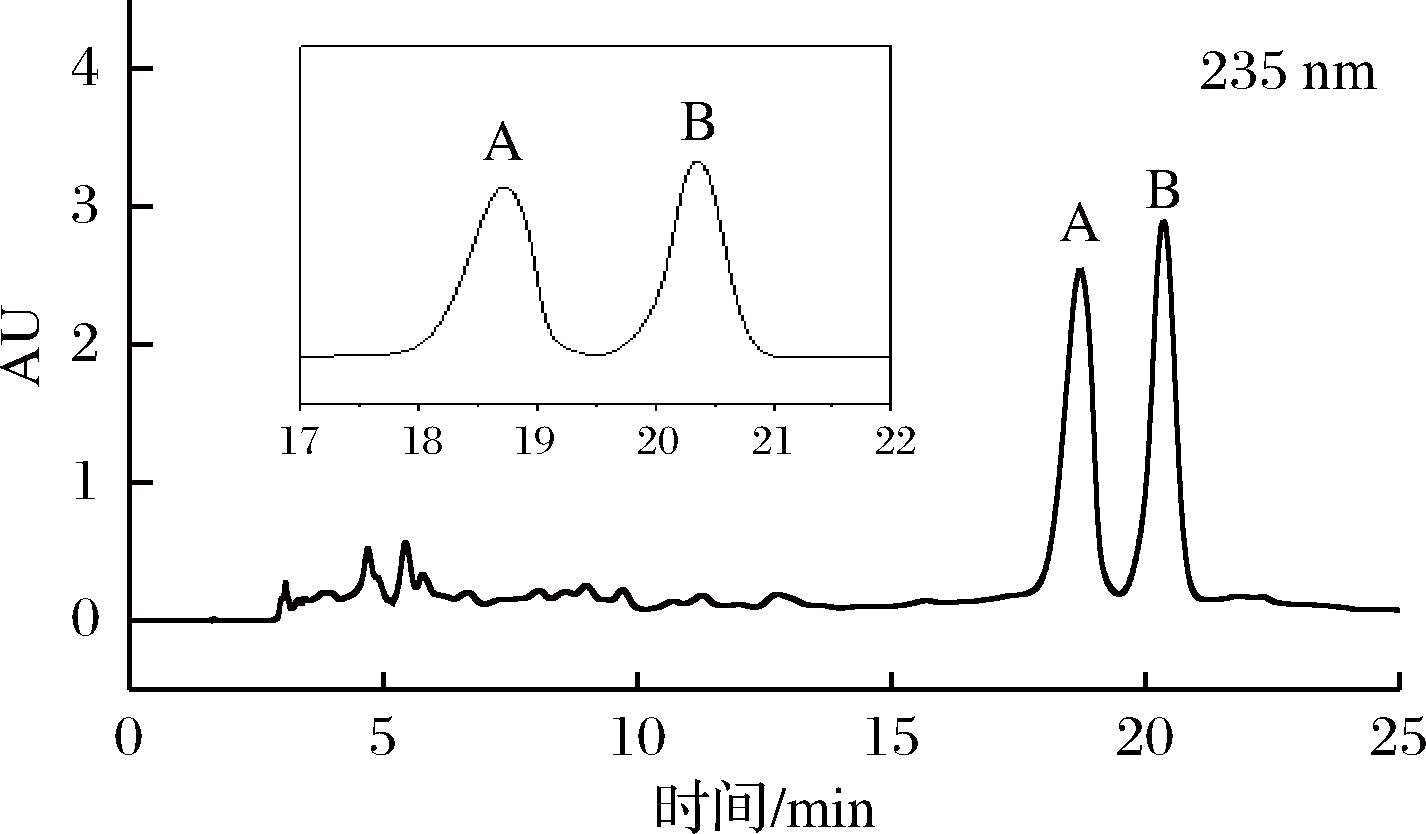
图2 红曲黄色素制备液相分离色谱图
Fig.2 Separation spectrum of pigment on prep HPLC
收集得到的组分A和组分B的流出液在分析型液相上进行纯度检测。经检测,制备液相纯化得到的组分A和组分B的纯度分别为98.95%和99.02%,已达到标准品纯度(纯度大于97%)。
2.4 质谱分析
对制备型液相色谱分离得到的高纯度色素组分A和组分B进行质谱分析(见图3)。

图3 组分A和组分B的质谱图
Fig.3 MS spectrograph of component A and B
由图3可知,组分A在质谱上的离子峰为359,故组分A的相对分子质量为358。此相对分子质量与BUSABA等[22-23]报道的红曲素和Monankins A、Monankins B和Monakins F的相对分子质量一致,组分B在质谱上的离子峰为333,故其相对分子质量为332,目前的文献报道[24]Monaphilone B的相对分子质量为332,最大吸收波长为229和384 nm。组分的B的最大吸收波长分别为235和389 nm,与文献报道的最大吸收波长存在差异。
经质谱分析确定了组分A与组分B的相对分子质量,目前已知的与组分A同分异构的红曲色素有4种,而组分B的相对分子质量仅与1种已知组分吻合,但最大吸收波长存在差异。因此,进一步通过核磁共振分析对组分A和组分B的分子结构进行表征,以确定其具体化学结构。
2.5 核磁共振分析
核磁共振分析中,可通过一维核磁,即氢谱(1HNMR)和碳谱(13CNMR)给出未知物质分子中氢原子和碳原子的化学位移信息,通过二维核磁,即COSY谱、HSQC谱和HMBC谱分别给出的相邻氢、相邻碳氢和远程碳氢的耦合关系,来鉴定未知物质的分子结构。
2.5.1 一维核磁分析
如图4所示,组分A的氢谱数据为δ 0.89(3H,J=7.2,t),δ1.30(4H,m),δ1.45(3H,s),δ1.62(2H,m),δ1.87(3H,J=7.2,d),δ2.44(1H,J=18.0,11.8,dd),δ2.60(1H,J=18.0,7.2,dt),δ2.67(1H,J=17,4,dd),δ3.01(1H,J=18,7.2,dt),δ3.23(1H,m),δ3.67(1H,J=13.2,d),δ4.72(1H,J=12.6,d),δ5.06(1H,J=12.6,d),δ5.27(1H,s),δ5.90(1H,J=15.4,d),δ6.50(1H,J=22.4,7.2,dt)。组分A的碳谱数据为δ13.9,δ17.7,δ18.5,δ22.4,δ22.8,δ29.4,δ31.2,δ42.9,δ54.9,δ63.8,δ83.2,δ103.3,δ114.0,δ124.4,δ135.4,δ150.8,δ160.5,δ169.5,δ189.8,δ202.5。结合氢谱和碳谱的数据,可知组分A有21个碳原子,26个氢原子,其相对分子质量为358,所以可知组分A的分子式为C21H26O5。
组分B的氢谱数据为δ0.89(3H,J=7.2,t),δ1.16(3H,s),δ1.28(4H,m),δ1.58(2H,m),δ1.86(3H,J=7.2,d),δ2.10(1H,J=20,12.2,dd),δ2.40(3H,m),δ2.60(2H,m),δ2.97(1H,J=17,d),δ4.76(1H,J=12.4,d),δ5.01(1H,J=12.4,d),δ5.22(1H,s),δ5.89(1H,J=15.4,d),δ6.47(1H,J=22.4,7.2,dt)。组分B的碳谱数据为δ13.9,δ18.4,δ19.9,δ22.4,δ23.5,δ31.4,δ32.6,δ39.4,δ42.0,δ43.2,δ64.0,δ74.1,δ103.4,δ113.0,δ124.7,δ134.7,δ152.5,δ160.4,δ197.9,δ210.1。组分B有20个碳原子,28个氢原子,其相对分子质量为332,所以可知组分B的分子式为C20H28O4。组分A和组分B可能为红曲素和Monaphilone B,但部分氢谱数据与文献[24]存在差异,且最大吸收波长不一致,推测组分A和组分B有可能分别为红曲素和Monaphilone B的同分异构体,将进一步采用二维核磁分析以确定组分A与组分B的分子结构。
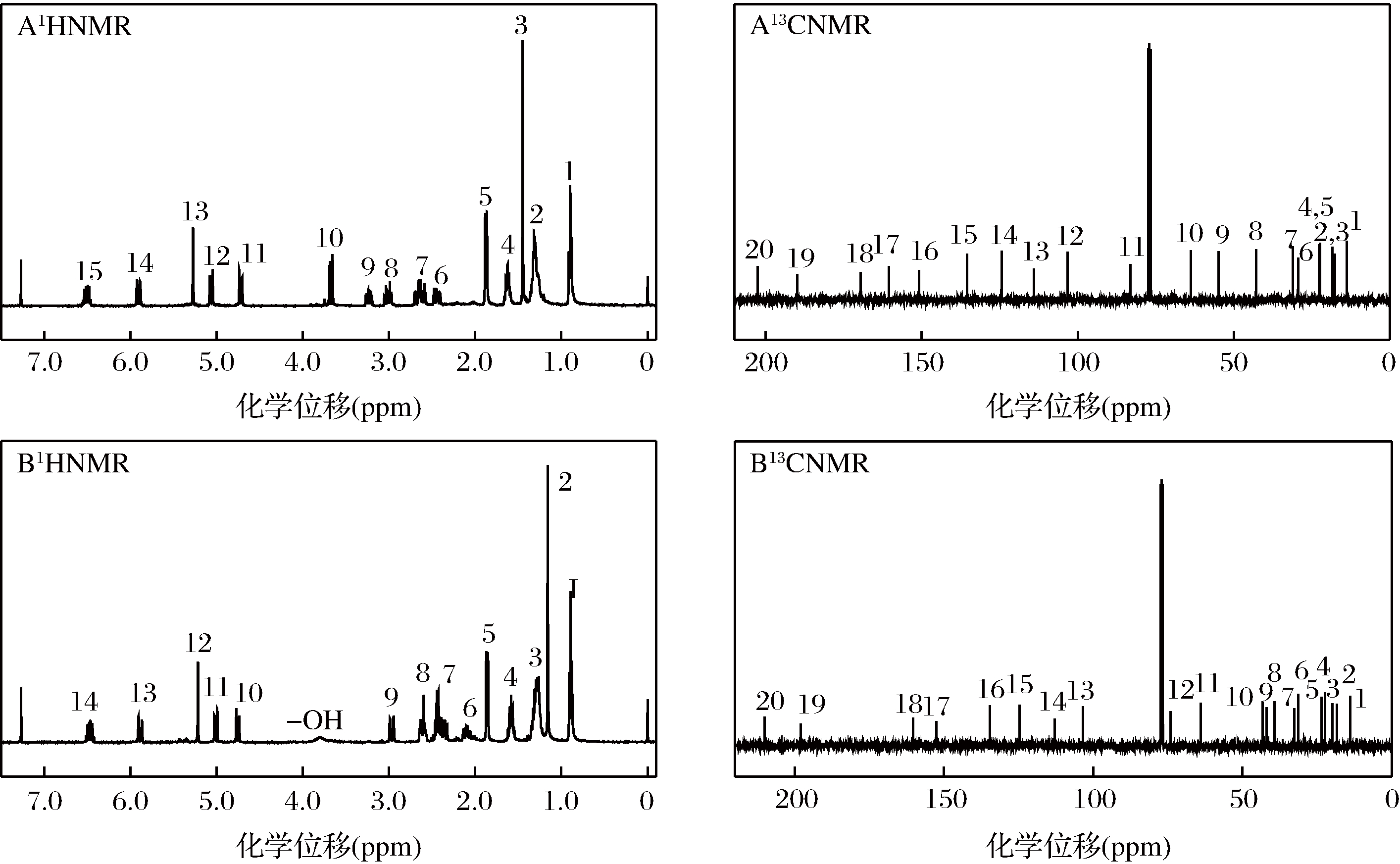
图4 组分A和组分B的氢谱和碳谱
Fig.4 1HNMR and 13C NMR spectrum of A and B
2.5.2 二维核磁分析
组分A有15个氢核,按1~15分别编号。H1、H3和H5均为甲基上的氢,但H1为三重峰,表明H1所在的甲基与亚甲基相连(—CH2—CH3);H3的相邻碳上没有氢原子;而H5的甲基与1个不饱和双键(—C![]() C—)相连。烯烃的质子化学位移为4.0~6.5,化学位移δ值为5.27、5.9和6.0的H13、H14和H15则为不饱和双键的氢,其中H15(m)所在的碳原子与甲基(—CH3)相连,H14(d)在该双键的另1个碳上,而H13(s)所在的碳碳双键可能在环上。δ值为4.72和5.06的H11和H12为不对称的二重峰,J=12.6 Hz,表明H11和H12可能为六元环上手性碳的2个氢原子。手性碳的相邻碳上没有氢原子,表明可能与羰基连接或氧原子相连,因此化学位移较大。H10的δ值为3.67,且为双峰,可能有相邻碳为羰基,只有1个邻位氢。
C—)相连。烯烃的质子化学位移为4.0~6.5,化学位移δ值为5.27、5.9和6.0的H13、H14和H15则为不饱和双键的氢,其中H15(m)所在的碳原子与甲基(—CH3)相连,H14(d)在该双键的另1个碳上,而H13(s)所在的碳碳双键可能在环上。δ值为4.72和5.06的H11和H12为不对称的二重峰,J=12.6 Hz,表明H11和H12可能为六元环上手性碳的2个氢原子。手性碳的相邻碳上没有氢原子,表明可能与羰基连接或氧原子相连,因此化学位移较大。H10的δ值为3.67,且为双峰,可能有相邻碳为羰基,只有1个邻位氢。
根据碳谱数据,组分A有20个碳核,分别以1~20编号,但C8有裂峰,实际有2种碳,分别编号为C8a和C8b。根据化学位移可知,C12、C13、C14、C15、C16和C17为双键上的碳,C18、C19和C20为羰基碳。结合HSQC图谱(图5),H1与C1相连,H2与C4,C7相连,H3与C2相连,H4与C5相连,H5与C3相连,H6与C6相连,H7a与C8a相连,H7b与C6相连,H8与C8a相连,H9与C8b相连,H10与C9相连,H11、H12与C10相连,H13与C12相连,H14与C14相连,H15与C15相连,C11、C13、C16、C17、C18、C19、C20没有氢原子与之相连。H11和H12为C10上的2个氢,H6和H7b为C6上的2个氢,H7a和H8为C8a上的2个氢。
从COSY图谱可以看出,H1与H2相互耦合,H2和H4相互耦合,H4和H7a相互耦合,表明C1、C4、C7、C5和C8a连接,是1个戊烷基。H6与H9相互耦合,H9和H10相互耦合,则C6、C8b和C9这3个碳相连。H5与H15相互耦合,H15和H14相互耦合,则C3、C15和C14相连,是1个丙烯基(—CH![]() CH—CH3)。H11和H12,H6和H7b,H7a和H8均为1个手性碳上的2个氢,互相耦合,与HSQC图谱数据一致。
CH—CH3)。H11和H12,H6和H7b,H7a和H8均为1个手性碳上的2个氢,互相耦合,与HSQC图谱数据一致。
分析A的HMBC图谱,可知H3与C8b、C11和C19耦合,表明C8b、C11和C19为C2的邻位碳和间位碳;H7a、H8与C5、C7和C20耦合,所以戊烷基与羰基(C20)相连;H9与C6、C9、C11、C19和C20耦合;H10与C6、C8b、C18和C20耦合,C6、C8b、C18和C20为C9的邻位碳和间位碳。H11、H12与C13、C16、C17和C19耦合,H13与C6、C10、C13、C14、C16、C17和C9耦合。

图5 组分A和组分B的二维核磁数据(COSY、HSQC和HMBC谱)
Fig.5 2D NMR data of A and B(COSY,HSQC,HMBC)
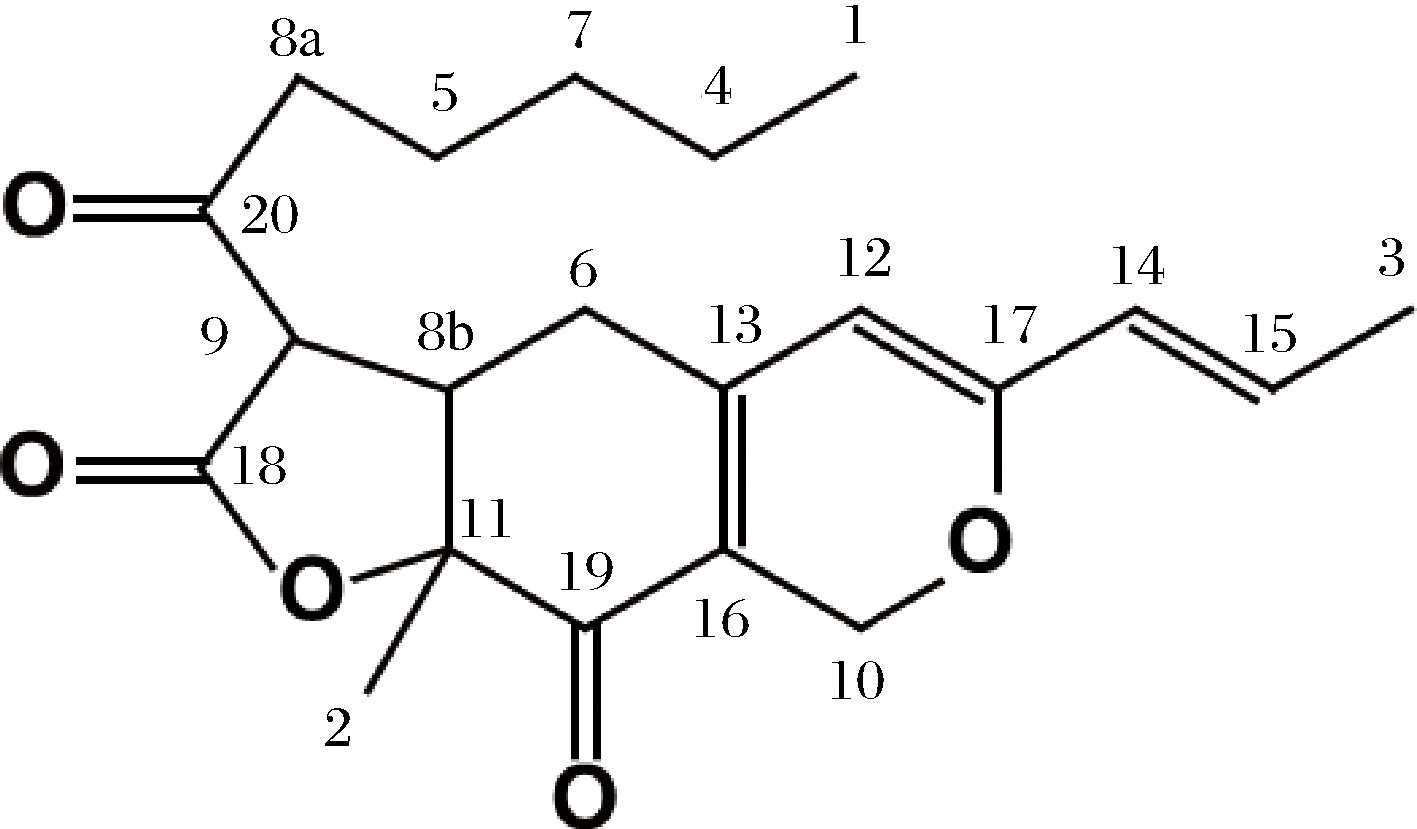
图6 红曲素Monascin的分子结构式
Fig.6 Molecular structure of monascin
结合组分A的氢谱、碳谱、COSY谱、HSQC谱和HMBC谱,以及二维核磁数据(表2),最终确定组分A为红曲素,分子结构图如图6所示。
与组分A二维核磁的分析方法相同,对组分B的COSY谱、HSQC谱和HMBC谱数据进行分析。
根据组分B的二维核磁数据(表3),最终确定该组分为Monaphilone B,分子结构图如图7所示。
表2 红曲素的核磁共振数据
Table 2 Specific NMR data of monascin

碳δCδH碳δCδH113.90.89t1063.84.72d217.71.45s5.06d318.51.87d1183.2422.41.30m12103.35.27s522.81.62m13114629.42.44dd14124.45.90d2.67dd15135.46.5dt731.21.30m16150.88a42.92.60m17160.53.01m18169.58b42.93.23m19189.8954.93.67m20202.5
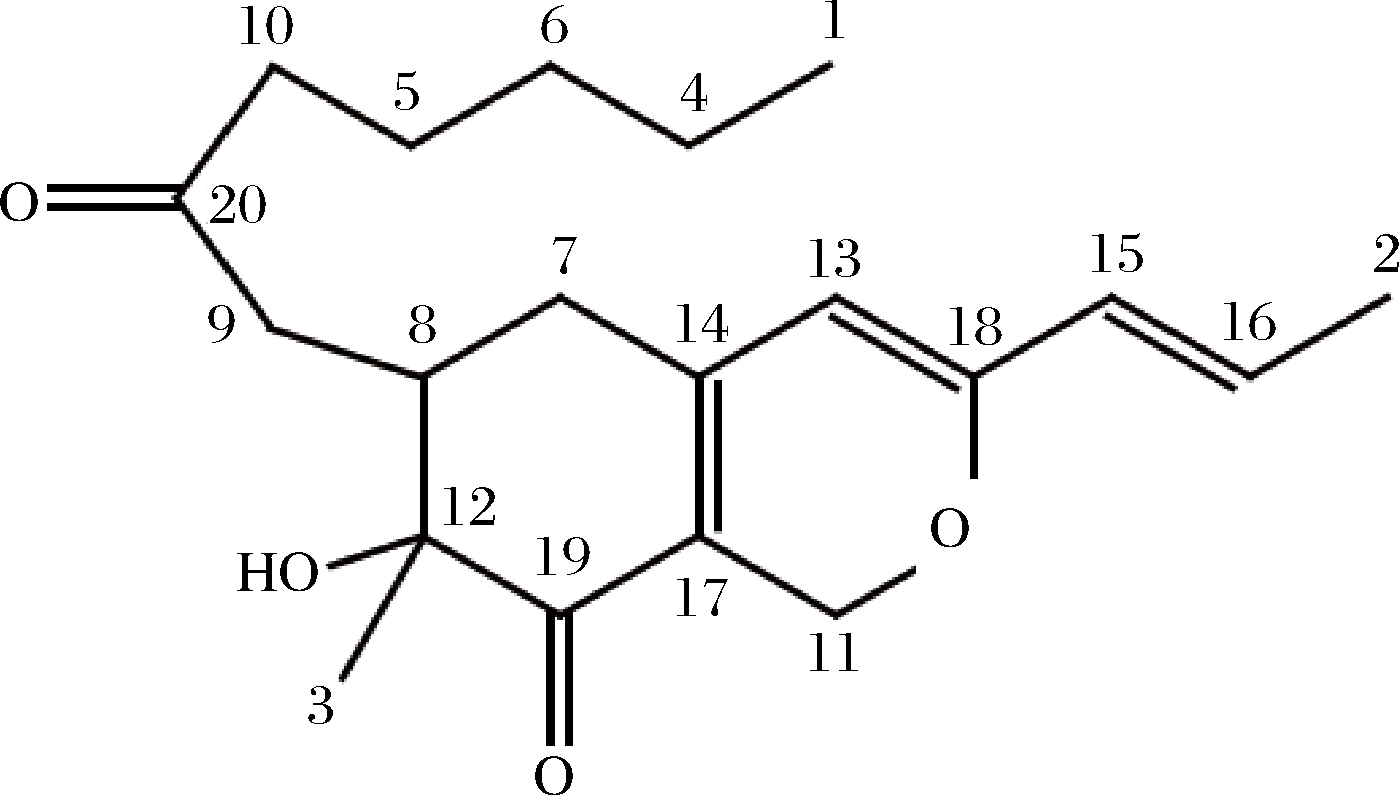
图7 Monaphilone B的分子结构式
Fig.7 Molecular structure of Monaphilone B
表3 Monaphilone B的核磁共振数据
Table 3 Specific NMR data of Monaphilone B

碳δCδH碳δCδH113.90.89t11644.76d218.41.86d5.01d319.91.16s1274.1422.41.28m13103.45.22s523.51.58m14113631.41.28m15124.75.89d732.62.10dd16134.76.47dt2.63m17152.5839.42.60m18160.49422.36m19190.72.97d20210.11043.22.44m
2.6 红曲黄色素分子结构对其吸收波长的影响
分离得到的红曲素与Monaphilone B经紫外-可见光分光光度计在200~600 nm波长范围进行全波长扫描,红曲素的最大吸收波长为235和394 nm,Monaphilone B的最大吸收波长为235和389 nm(图8),与HPLC检测结果一致。
根据分子结构式可知,红曲素与Monaphilone B的主体结构基本一致,是1个具有延伸共轭双键的α,β-不饱和酮结构(图9)。
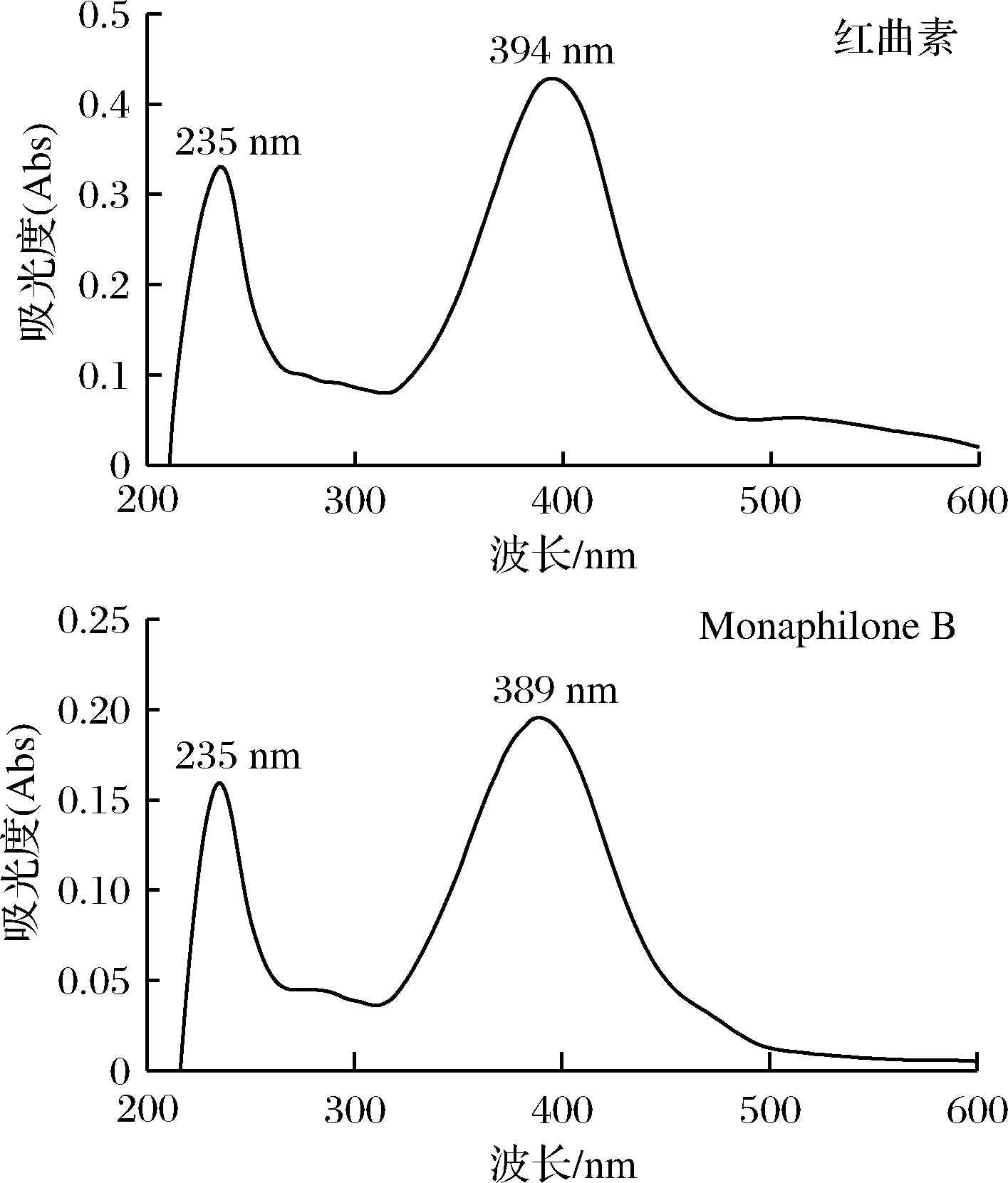
图8 红曲素和Monaphilone B在200~600 nm波长范围内的吸收
Fig.8 Absorption of Monascin and Monaphilone B in range of 200~600 nm
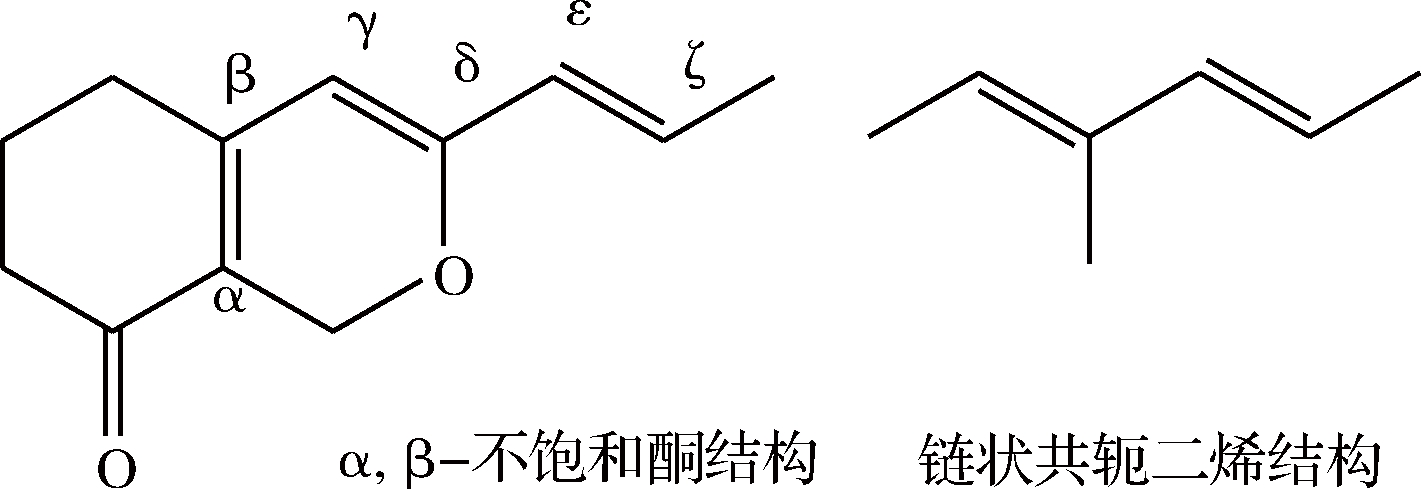
图9 红曲素和Monaphilone B 中具有紫外-可见光吸收的官能团
Fig.9 Functional groups with ultra-violet absorption in Monascin and Monaphilone B
根据α,β-不饱和酮的吸收规则[25]可以推算红曲黄色素组分的最大吸收波长λmax:推理过程如下,α,β-不饱和酮的基本吸收波长为215 nm,该结构上增加了2个共轭双键,增量为30×2 nm;且延伸的2个共轭双键在同1个环内,故吸收波长增加39 nm;由于α位点、β位点和ζ位点均有烷基取代,所以吸收波长分别增加10、12 nm和18 nm;δ位点上存在1个烷氧基取代,所以吸收波长增加31 nm;红曲素分子中存在1个内酯五元环与α,β-不饱和酮六元环连接,故吸收波长增加6 nm,因此红曲素理论最大吸收波长为391 nm,与实测吸收波长394 nm基本吻合,而Monaphilone B分子结构中没有内酯结构,所以其理论最大吸收波长为385 nm,与实测吸收波长389 nm基本吻合。红曲素和Monaphilone B同时在235 nm处有强吸收,根据红曲素在235 nm处存在1个强吸收,根据共轭多烯类化合物的吸收规则[25],红曲素和Monaphilone B中链状共轭二烯基本吸收值为217 nm,由于存在2个烷基取代和1个烷氧基取代,分别增加5×2 nm和6 nm,所以理论最大吸收波长为233 nm,与实测波长235 nm基本一致。
3 结论
本研究从发酵液的粗提物中萃取得到高色价的红曲黄色素油树脂,以高效液相色谱为分离纯化,其色价高达9 100 U/g,萃取率为63.50%,具有较高的应用价值。分析型高效液相色谱最佳分离条件为80%甲醇等度洗脱,流速为0.5 mL/min下,在液态发酵红曲黄色素中检测出2种主要色素组分,色素组分之间分离度为2.51,且不受杂质峰影响,分离效果较好。制备型高效液相色谱最佳的分离条件为70%甲醇等度洗脱,流速为4 mL/min,2种组分纯度分别为98.95%和99.02%,达到了标准品的要求(>97%)。通过液质联用和核磁共振分析,最终确定分离得到的2种色素组分为红曲素(C21H26O5)和Monaphilone B(C20H28O4),发酵液的粗提物中的红曲黄色素主要色素组分为红曲素,红曲黄色素的显色性能来自于分子结构中具有延伸双键的α,β-不饱和酮结构。
[1] JUZLOVAP,MARTINKOVA L,KREN V.Secondary metabolites of the fungus Monascus:A review[J].Journal of Industrial Microbiology,1996,16(3):163-170.
[2] HSU L C,HSU Y W,LIANG Y H,et al.Anti-tumor and anti-inflammatory properties of ankaflavin and monaphilone A from Monascus purpureus NTU 568[J].Journal of Agricultural and Food Chemistry,2011,59(4):1 124-1 130.
[3] LEE C L,KUNG Y H,WU C L,et al.Monascin and ankaflavin act as novel hypolipidemic and high-density lipoprotein cholesterol-raising agents in red mold dioscorea[J].Journal of Agricultural and Food Chemistry,2010,58(16):9 013-9 019.
[4] LEE C L,HUNG Y P,HSU Y W,et al.Monascin and ankaflavin have more anti-atherosclerosis effect and less side effect involving increasing creatinine phosphokinase activity than Monacolin K under the same dosages[J].Journal of Agricultural and Food Chemistry,2013,61(1):143-150.
[5] LEE C L,WEN J Y,HSU Y W,et al.Monascus-fermented yellow pigments monascin and ankaflavin showed antiobesity effect via the suppression of differentiation and lipogenesis in obese rats fed a high-fat diet[J].Journal of Agricultural and Food Chemistry,2013,61(7):1 493-1 500.
[6] HSU W H,LEE B H,Lu I J,et al.Ankaflavin and monascin regulate endothelial adhesion molecules and endothelial NO synthase (eNOS) expression induced by tumor necrosis factor-alpha (TNF-alpha) in human umbilical vein endothelial cells (HUVECs)[J].Journal of Agricultural and Food Chemistry,2012,60(7):1 666-1 672.
[7] HSU W H,PAN T M.A novel PPARgamma agonist Monascin′s potential application in diabetes prevention[J].Food &Function,2014,5(7):1 334-1 340.
[8] CHANG Y Y,HSU W H,PAN T M.Monascus secondary metabolites monascin and ankaflavin inhibit activation of RBL-2H3 cells[J].Journal of Agricultural and Food Chemistry,2015,63(1):192-199.
[9] HSU W H,PAN T M.Treatment of metabolic syndrome with ankaflavin,a secondary metabolite isolated from the edible fungus Monascus spp.[J].Applied Microbiology and Biotechnology,2014,98(11):4 853-4 863.
[10] HSU L C,LIANG Y H,HSU Y W,et al.Anti-inflammatory properties of yellow and orange pigments from Monascus purpureus NTU 568[J].Journal of Agricultural and Food Chemistry,2013,61(11):2 796-2 802.
[11] 毛鹏.红曲黄色素液态发酵技术研究[D].无锡:江南大学,2015.
[12] PATRA P.Monascus secondary metabolites:production and biological activity[J].Journal of Industrial Microbiology &Biotechnology,2013,40(2):169-181.
[13] MARIE O L,SANDRINE M.Isolation and structural characterization of two new metabolites from Monascus[J].Journal of Agricultural and Food Chemistry,2010,58(3):1 800-1 803.
[14] 杨强,郎天丹,岳建明,等.红曲黄色素的分离纯化与表征[J].食品工业科技,2015,36(16):308-312.
[15] 夏明,杜琪珍.高速逆流色谱提取分离红曲色素的研究[J].广州食品工业科技,2002(4):5-6.
[16] 郑允权,李泳宁,王阿万,等.高速逆流色谱法分离纯化红曲色素组分[J].食品科学,2010,31(20):192-195.
[17] 崔莉,胡晓丹,张德权.HPLC法同时测定红曲色素中的红曲素和安卡红曲黄素[J].食品科学,2009,30(8):163-166.
[18] 李明起.红曲色素的制备、分离及黄色素结构表征[D].武汉:武汉工业学院,2011.
[19] 王丽峰.高效液相色谱在中草药质量控制中的应用[D].重庆:西南大学,2009.
[20] 冼燕萍,郭新东,罗海英,等.固相萃取-超高效液相色谱分离测定洗涤用品中4种荧光增白剂[J].色谱,2013,31(2):162-169.
[21] 黄艳,王璐,毛鹏,等.红曲液态发酵生产橙、黄色素及其色调研究[J].食品工业科技,2014,35(19):142-145.
[22] BUSABA Y,SOMCHAI K,RAPEEPOL B.Production of yellow pigments in submerged culture of a mutant of Monascus spp.[J].Journal of Fermentation and Bioengineering,1994,78(3):223-228.
[23] BUSABA Y,PANIDA T,WORAWAN K,et al.Fermentation and quality of yellow pigments from golden brown rice solid culture by a selected Monascus mutant[J].Applied Microbiology and Biotechnology,2013,97(20):8 895-8 902.
[24] HSU Y W,HSU L C,LIANG Y H,et al.Monaphilones A-C,three new antiproliferative azaphilone derivatives from Monascuspurpureus NTU 568[J].Journal of Agricultural and Food Chemistry,2010,58(14):8 211-8 216.
[25] 刘约权.现代仪器分析第3版[M].北京:高等教育出版社,2015.