生物氢气因其高燃烧热值、无污染等优点,是未来极具发展前景的能源载体[1]。与其他生物制氢方法(如光发酵、微生物电解池(microbial electrolysis cells,MEC等)相比,生物暗发酵具备低成本和高氢气产率等优势,该方法是通过微生物将生物质大分子物质分解成挥发性脂肪酸进而转化为氢气。利用生物质废弃物产氢,一方面能够解决生物质废弃物引起的环境污染问题,另一方面,能够回收生物质能,缓解能源紧张局面[2]。因此,生物暗发酵制氢备受多国政府和能源公司关注。
酒糟是白酒生产中最主要的副产物,据统计,中国酒糟年产量约为4×107 t,且呈增加趋势[3]。目前,酒糟主要用于焚烧和饲料化,但焚烧易污染环境,饲料化难以被广泛使用,因此酒糟处理是许多酿酒企业的难题[4]。酒糟的化学成分为纤维素类物质、少量淀粉和蛋白质等[5],若要实现其生物氢气转化,需首先通过预处理将纤维素物质转化为微生物可直接利用的糖,常用的预处理方法有物理法、化学法和生物法等[6],目前报道尚无有效的高粱酒糟糖化方法,且缺乏对糖化液生物氢气转化性能研究。本研究探究了酸法、碱法和酶法、酸-酶耦合、碱-酶耦合法5种预处理方法对酒糟糖化的影响并考察了糖化液暗发酵制氢性能,以期充分回收高粱酒糟的生物质能。
1 材料与方法
1.1 试验材料
酒糟由湖北武汉某酒厂提供。产氢菌Clostridium beijerinckii购自中国工业微生物菌种保藏中心。
富集培养基(g/L):酵母浸粉1,蛋白胨 3,葡萄糖 2,沸水浴充入N2除氧20 min,自然pH,灭菌121 ℃,20 min。
发酵培养基1 L,其中含:酵母浸粉 1 g,葡萄糖 2 g,KH2PO4 5 g,K2HPO4 4 g,NH4Cl 1.6 g;微量元素1 mL(MgSO4 20 g/L,MnSO4 1 g/L,NaCl 1 g/L,FeSO4 1 g/L);维生素1 mL(对氨基苯甲酸 1 g/L,生物素 0.1 g/L,维生素B1 1 g/L)。
1.2 仪器与设备
SOP电子天平,赛多利斯科学仪器(北京)有限公司;HYL-C组合式摇床,太仓市强乐实验设备有限公司;GC-2010 plus气相色谱仪,上海精密科学有限公司;Agilent 7890B气相色谱仪,美国惠普公司;SU8010场发射扫描电子显微镜,日本日立科技有限公司。
1.3 试验方法
1.3.1 酒糟预处理
(1)酸法:固(以挥发性固形物(volatility solids,VS)为基准)液比为1∶10(g∶ mL),加入0.1 mol/L HCl调节pH为1,常温搅拌24 h。
(2)碱法:固液比为1∶10(g∶mL),加入15%(质量浓度)NaOH溶液调节pH为12,常温搅拌6 h。
(3)酸-酶耦合法:将酸处理后的酒糟pH调至4.8~5.0,加入纤维素酶4 000 U/g,50 ℃酶解72 h。
(4)碱-酶耦合法:将碱处理后的酒糟pH调至4.8~5.0,加入纤维素酶4 000 U/g,50 ℃酶解72 h。
(5)单酶法:固液比(g∶mL)分别为1∶15和1∶4时,pH调至4.8~5.0,纤维素酶添加量为4 000 U/g,50 ℃酶解72 h。
(6)双酶耦合法:固液比分别为1∶15和1∶4时,pH调至4.8~5.0,纤维素酶添加量为4 000 U/g酶解8 h后,沸水浴加热20 min,纤维素酶灭活,调pH至6.0,再加入淀粉酶100 U/g,50 ℃酶解4 h。
1.3.2 不同预处理方式酒糟暗发酵产氢试验
将1.2.1(5)和(6)酶处理糖化液用于暗发酵产氢,各取50 mL糖化液于100 mL西林瓶中,加入缓冲液、微量元素等,沸水浴充入N2除氧20 min,121 ℃灭菌20 min。冷却后用无菌滤膜加入维生素。接种10%(体积分数)的Clostridium beijerinckii,置于37 ℃、180 r/min转速下发酵3 d。
1.4 分析方法
(1)氢气测定
采用气相色谱仪对氢气进行测定,色谱配有TCD检测器、填充柱TDX-01,进样口、柱温和检测器温度分别为200、180 和200 ℃。载气为Ar,流速为30 mL/min。
(2)挥发性脂肪酸(volatile fatty acids,VFAs)测定
采用气相色谱仪检测,配置氢火焰检测器和毛细管柱(30 m×0.25 mm),进样口和检测器温度分别为 240和260 ℃,柱箱温度采用升温程序:初温60 ℃保持3 min,以30 ℃/min的速率升温至90 ℃保持1 min,30 ℃/min速率升温至165 ℃保持2 min,15 ℃/min速率升至180保持1 min,15 ℃/min速率升至230 ℃保持2 min。载气氮气、氢气和空气的流速分别为30、40和300 mL/min。
(3)酒糟表面结构分析
采用场发射扫描电子显微镜检测,将处理好的样品用双面胶固定于扫描电镜样品台上,并对样品喷金60 s,观察表面结构。
(4)化学分析方法
采用3,5-二硝基水杨酸比色法测定还原糖含量。采用酸水解法测定淀粉含量,参考GB 5009.9—2016。纤维素类物质测定参考GB/T 20805—2006、GB/T 20806—2006和NY/T 1459—2007。采用凯氏定氮法测定酒糟蛋白质含量。
(5)计算方法
还原糖产率Y还原糖和转化率α以及氢气产率Y氢气分别按公式(1)~(3)计算。
(1)
式中:ρ,糖化液中还原糖质量浓度,g/L;V,糖化液体积,mL;m,酒糟质量,g。
(2)
式中:m1,发酵前还原糖质量,g;m2,发酵后还原糖质量,g。
(3)
式中:V,氢气的体积,mL;m,酒糟质量,g。
2 结果与分析
2.1 处理方式对酒糟糖化的影响
表1显示了不同预处理方式对酒糟糖化的影响。酶处理、酸处理、酸-酶处理、碱处理、碱-酶处理的还原糖产率分别为17.21%、13.41%、13.89%、4.66%、4.82%,均高于未处理酒糟(3.9%)。还原糖产率的次序为:酶法>酸-酶耦合法>酸法>碱-酶耦合法>碱法。固液比为1∶15(g∶mL)经酶处理的酒糟糖化效果最佳,还原糖产率为17.21%,相比未处理酒糟(3.9%)提高了341.28%。相同酶解条件下马文鹏等[7]酒糟酶解后还原糖产率为16.87%,与本文最佳还原糖产率相近。刘浩[8]研究表明酸处理不仅能将纤维素和半纤维素组分降解为葡萄糖和木糖,而且过度酸化会产生糠醛、甲酸和乙酰丙酸等副产物,不利于还原糖产量的提高,且酸处理液以及糖醛等副产物对纤维素酶活性有一定抑制作用[9]。碱液能将木质素降解为小片段或酚类等物质,但不能提高还原糖产率。徐栋梁等[10]研究表明碱预处理后,底物的酶解效率会降低。这可能是碱法和碱-酶耦合法糖化率较低的原因。酒糟酶法处理时,高固液比1∶4(g∶mL)虽提高了酒糟预处理液的还原糖浓度(44.52 g/L),但还原糖产率(14.12%)低于低固液比1∶15(g∶mL)的产率(17.21%)。高固液比下得到的酒糟糖化液黏度较高,添加的纤维酶难以充分与纤维素结合,不利于糖化。相反,低固液比更有利于酒糟纤维素糖化,同时有利于糖分向溶液中扩散。这可能是低固液比下还原糖产率较高的原因。
表1 不同处理方式对酒糟糖化的影响
Table 1 Effects of different treatments on saccharification of distiller′s grain
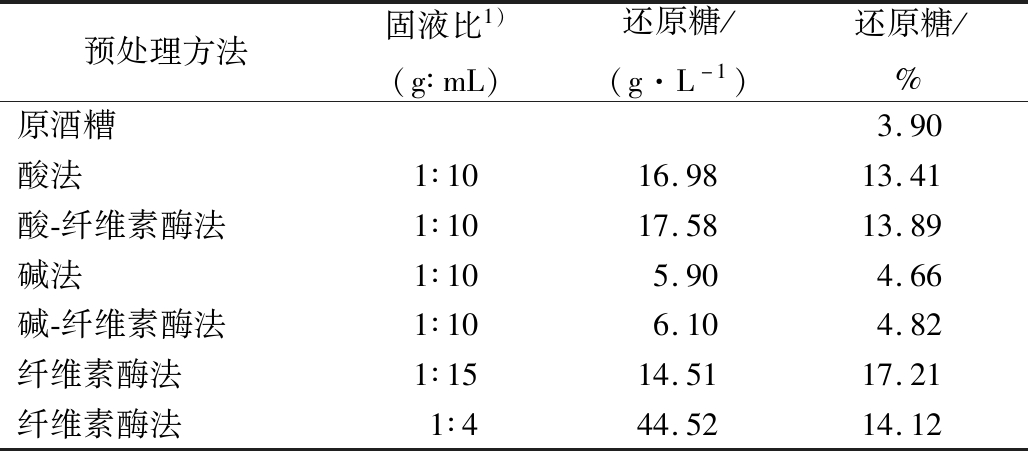
预处理方法固液比1)(g∶mL)还原糖/(g·L-1)还原糖/%原酒糟3.90酸法1∶1016.9813.41酸-纤维素酶法1∶1017.5813.89碱法1∶105.904.66碱-纤维素酶法1∶106.104.82纤维素酶法1∶1514.5117.21纤维素酶法1∶444.5214.12
注:1)固体指干酒糟所含物质的含量。
2.2 纤维素酶法处理前后酒糟组分和结构分析
表2显示了低固液比下酒糟酶解前后的组分变化。酶解前后淀粉和蛋白质含量无明显变化,纤维素、半纤维素、木质素和还原糖成分变化明显。原始酒糟中纤维素、半纤维素和木质素的含量分别为9.37%、7.11%和11.27%,酶解后含量分别为5.00%、5.20%和7.20%,其转化率(根据1.4(5)中公式(2)计算)分别为46.63%、26.86%和36.11%,同时原始酒糟中还原糖含量仅为3.90%,酶解后含量为17.21%,提高了341.28%。任海伟等[11]研究表明,酶解后纤维素转化率为44.45%,与本文纤维素转化率相近。说明纤维素酶破坏酒糟的木质纤维网络结构,水解纤维素和半纤维素中的葡萄糖苷键,促使其转化为葡萄糖。图1表明,酒糟原料的木质纤维结构紧密,纤维素聚集态结构清晰。酶解后,表面结构发生变化,原先紧密的表面结构被破坏,纤维素骨架发生断裂,表面呈现无规则或形状各异的膨松状态,沟壑明显,比表面积增大[12]。因此,预处理对酒糟木质纤维包覆结构有一定破坏。
表2 酒糟各组分含量 单位:%
Table 2 Composition of distiller's grain
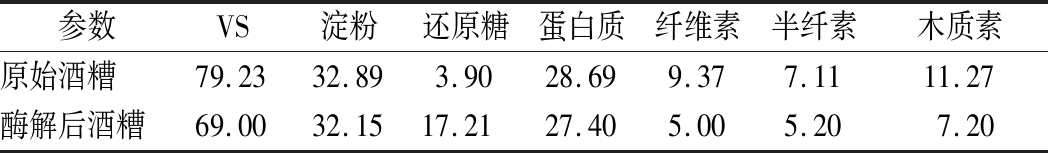
参数VS淀粉还原糖蛋白质纤维素半纤素木质素原始酒糟79.2332.893.9028.699.377.1111.27酶解后酒糟69.0032.1517.2127.405.005.207.20

a-酒糟对照组;b-酒糟酶解组
图1 酶解前(a)与酶解后(b)酒糟颗粒形态结构
Fig.1 Surface structure of distiller′s grain before (a) and after (b) enzymatic hydrolysis
2.3 糖化液暗发酵产氢性能
由表3可知,双酶法处理酒糟产糖效果比单酶法处理效果好。双酶法处理后还原糖产率分别16.49%[固液比1∶4(g∶mL)]、23.49%[固液比1∶15(g∶mL)],单酶法处理后还原糖产率分别为14.17%[固液比1∶4(g∶mL)]和17.33%[固液比1∶15(g∶mL)],数据表明双酶法比单酶法处理后还原糖产率提高了16.37%[固液比1∶4(g∶mL)]和33.24%[固液比1∶15(g∶mL)]。另外,低固液比产糖率优于高固液比,分别提高了22.30%(单酶)和40.02%(双酶)。暗发酵过程中,产氢菌对糖的利用程度不同,菌种对单酶处理的酒糟糖化液中糖的利用率为24.40%[固液比1∶15(g∶mL)]和28.17%[固液比1∶4(g∶mL)],氢气产率分别为39.21、14.89 mL/g。菌种对双酶处理液中糖的利用率为12.51%[固液比1∶15(g∶mL)]和15.66%[固液比1∶4(g∶mL)],氢气产率分别为51.56、19.66 mL/g。因此单酶、高固液比的酒糟糖化液中的还原糖更容易被产氢菌利用。张全国等[13]将玉米秸秆进行酶解,得到的酶解液发酵产氢率为54.94 mL/g,与本试验最佳产氢率相近。另外,发酵结束后,发酵液中VFAs主要成分是乙酸,说明酒糟糖化液产氢发酵属于乙酸型发酵[14]。
酒糟通过酶解将纤维素和淀粉等转化为还原糖,产氢菌通过糖酵解途径将还原糖乙酸化,进一步将乙酸转化为氢气[15]。表3双酶酶解结果表明,不同固液比对发酵液初始糖浓度有直接影响,固液比(g∶mL)为1∶4和1∶15下的发酵液初始糖质量浓度分别为51.78和19.34 g/L,对应的氢气产率和乙酸质量浓度分别为19.66、51.56 mL/g和6.34、3.37 g/L,说明高糖含量导致了体系乙酸的大量累积,抑制了氢气的生成,而低糖浓度有利于氢气的生成。乙酸作为氢气发酵的重要中间代谢产物,其生成速率与糖浓度有直接关系,糖浓度较高时,产氢菌能够快速利用葡萄糖产乙酸,易导致乙酸浓度迅速升高和pH快速下降,过低pH将影响产氢菌代谢进而抑制氢气的生成。另外表3表明,高固液比获得的糖浓度较高,而较高糖浓度不利于氢气产率的提高,同时高固液比获得的糖化液黏度较大,不利于发酵液传质。因此,酒糟糖化处理时不易采用较高的固液比1∶15(g∶mL)为本文推荐值。
表3 酒糟暗发酵产氢结果
Table 3 Hydrogen production results of distiller's grain
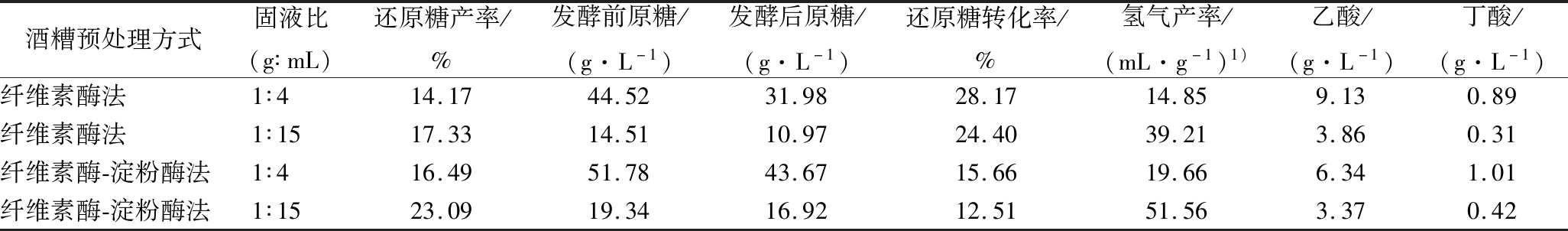
酒糟预处理方式固液比(g∶mL)还原糖产率/%发酵前原糖/(g·L-1)发酵后原糖/(g·L-1)还原糖转化率/%氢气产率/(mL·g-1)1)乙酸/(g·L-1)丁酸/(g·L-1)纤维素酶法1∶414.1744.5231.9828.1714.859.130.89纤维素酶法1∶1517.3314.5110.9724.4039.213.860.31纤维素酶-淀粉酶法1∶416.4951.7843.6715.6619.666.341.01纤维素酶-淀粉酶法1∶1523.0919.3416.9212.5151.563.370.42
注:1)每克消耗的还原糖氢气的产率。
3 结论
酶法对高粱酒糟的降解效果明显优于化学法(酸法和碱法),纤维素酶酶解时,最佳固液比和纤维素酶添加量分别为1∶15(g∶mL)和4 000 U/g,对应还原糖产率为17.21%。由于高粱酒糟中的淀粉含量较高,在纤维素酶酶解的同时,向酶解体系添加淀粉酶,有助于进一步提高还原糖产率,固液比为1∶15(g∶mL)时的还原糖产率可达23.09%,此糖化液用于氢气发酵的氢气产率为51.56 mL/g。SEM观察结果表明,高粱酒糟经过酶解后,其纤维结构明显遭到破坏,这表明酶法是高粱酒糟糖化的有效方法。
[1] LI D,YUAN Z H,SUN Y,et al.Hydrogen production characteristics of the organic fraction of municipal solid wastes by anaerobic mixed culture fermentation [J].International Journal of Hydrogen Energy,2009,34(2):812-820.
[2] SHOW K Y,LEE D J,CHANG J S.Bioreactor and process design for biohydrogen production[J].Bioresource Technology,2011,102(18):8 524-8 533.
[3] 裴芳霞.超声波辅助黄孢原毛平革菌对酒糟酶解糖化的影响[D].兰州:兰州理工大学,2016.
[4] 马文鹏,裴芳霞,任海伟,等.白酒糟糖化降解的预处理技术研究进展[J].酿酒科技,2015(12):90-95.
[5] 王聪.酒糟与甜高粱秸秆混合固态发酵品质及微生物多样性研究[D].兰州:兰州理工大学,2018.
[6] 刘姗,杨柳,何述栋,等.酶解黄酒糟对料酒发酵的影响[J].食品与发酵工业,2019,45(3):148-152;160.
[7] 马文鹏,裴芳霞,任海伟,等.双酶复合水解酒糟制备可发酵糖的工艺研究[J].酿酒科技,2016(4):89-92.
[8] 刘浩.亚硫酸氢盐预处理提高阔叶木纤维素的可水解性[D].广州:华南理工大学,2011.
[9] 亓伟,张素平,任铮伟,等.酸浓度对水解液中葡萄糖分解反应的影响研究[J].太阳能学报,2008,29(11):1 395-1 398.
[10] 徐栋梁,任浩.木质素对纤维素酶水解抑制作用的研究进展与展望[J].中华纸业,2017,38(20):19-24.
[11] 任海伟,裴芳霞,李金平,等.混合酸催化水解白酒丢糟的研究[J].太阳能学报,2014,35(11):2 230-2 235.
[12] 任海伟,徐娜,李金平,等.化学预处理提高酒糟生物质酶解糖化效果[J].农业工程学报,2014,30(16):239-246.
[13] 张全国,孙堂磊,荆艳艳,等.玉米秸秆酶解上清液厌氧发酵产氢工艺优化[J].农业工程学报,2016,32(5):233-238.
[14] 聂艳秋.废水产氢产酸/同型产乙酸耦合系统厌氧发酵产酸工艺及条件优化[D].无锡:江南大学,2007.
[15] 宋梓梅.鸡粪与果蔬废弃物混合厌氧制氢特性研究[D].咸阳:西北农林科技大学,2018.