表1 正交试验因素与水平
Table 1 Factors and levels of orthogonal test
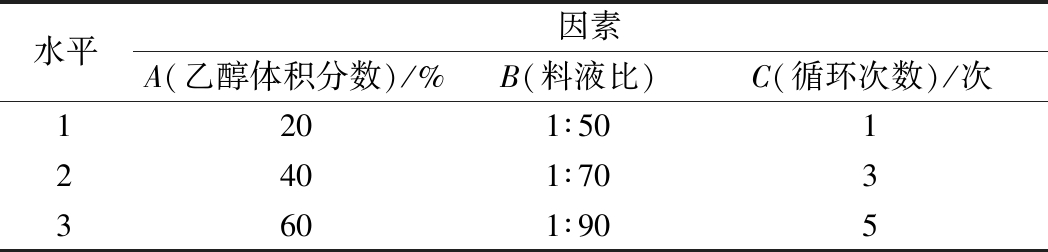
水平因素A(乙醇体积分数)/%B(料液比)C(循环次数)/次1201∶5012401∶7033601∶905
云南省地处我国西南边陲,海拔76.4~6 740 m,属于低纬高原。全省地形地貌复杂,气候多样,植被丰富,适宜野生菌的分化生长,被称为“野生食用菌王国”[1]。云南诸多的野生食用菌中,红菇(Russula)是最常见的一类野生食用菌,据统计,云南已知的红菇属种类有88种,生长期较长,采获量很大,价格相对较便宜,深受当地消费者的喜爱,也是云南省出口东南亚等国的大宗贸易品种之一[2]。大红菇(Russula vinosa)是红菇属中可食性较高的一个品种,常见于云南各地野生食用菌市场。大红菇营养丰富,味道鲜美,民间常以红菇加肉类炖服治疗贫血、水肿、营养不良、产后出血过多等症状,常食可增强机体免疫力[3]。大红菇菌体色泽红艳,又被称为葡酒红菇。日常食用发现,炒、煮、炖等烹饪过程中,菌体红色素可溶于汤汁,且色泽保持鲜艳,推断其可能具有较好的热、添加剂等稳定性,表明大红菇菌体红色素可能具有很好的开发利用价值。本文拟对云南产野生食用大红菇子实体红色素进行制取,对其稳定性影响因素进行分析,测定了其抗氧化活性并对其物质基础进行了探讨。本研究不仅为云南野生食用菌多元化开发提供新的途径,还可为天然红色素的微生物资源利用提供科学依据。
干红菇(R. vinosa),购于云南省木水花野生食用菌交易市场,产自云南省普洱墨江片区,干制工艺为鼓风热干。经昆明硕擎生物科技有限公司进行内转录间隔区(internal transcribed spacer,ITS)鉴定,确认为大红菇种。
DPPH、ABTS、三吡啶基三嗪(tripyridyltriazine,TPTZ)(色谱纯),美国Sigma公司,过硫酸钾、硫代巴比妥酸(分析纯),上海源叶公司;甲醇、无水乙醇、浓HCl、NaOH、三氯乙酸、H2O2溶液、水杨酸溶液等(分析纯或化学纯),上海阿拉丁生化科技公司;乙腈、甲酸(质谱级),德国Merck公司。
SB5200D超声波清洗机,宁波新芝生物科技股份有限公司;LGJ-12真空冷冻干燥机,北京松源华兴科技发展有限公司;T9系列双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;超高效液相色谱-四级杆-静电场轨道阱高分辨质谱(ultra performance liquid chromatography-quadrupole-orbitrip-mass spectrometry,UPLC-Q-Orbitrap-MS)系统,Thermo Fisher Scientific公司。
1.3.1 样品制备
将购置的干红菇研磨粉碎,过40目筛,收集筛下物于棕色真空干燥器中储存备用。
1.3.2 红菇红色素提取剂的筛选
分别以水、体积分数为20%乙醇、60%乙醇、无水乙醇、乙酸乙酯、丙酮、石油醚作为提取剂,超声辅助浸提红菇色素。提取方法为:30 mL提取剂与1 g红菇粉混合后超声5 min,静置5 min,涡旋振荡30 s,2次循环后5 000 r/min离心10 min,收集上清液,2次提取,合并上清液定容至100 mL[4]。观察提取液颜色,并利用双光束紫外-可见分光光度计对提取液进行全波长扫描,确定红菇色素的最大吸收波长为546 nm,以色泽和A546nm表征不同提取剂对红菇色素的溶出能力。
1.3.3 红菇红色素最佳提取条件的确定
根据单因素实验结果,以乙醇体积分数20%、40%、60%、料液比1∶50、1∶70、1∶90(g∶mL)、“超声5 min、静置5 min、涡旋振荡30 s”循环1、3、5次作为实验因素,采用3因素3水平设计正交表(表1),以相同单位浓度(10 mg菇粉/mL溶剂)下A546nm表征红菇红色素的提取效果,分析红菇色素最佳提取条件。
表1 正交试验因素与水平
Table 1 Factors and levels of orthogonal test

水平因素A(乙醇体积分数)/%B(料液比)C(循环次数)/次1201∶5012401∶7033601∶905
1.3.4 红菇红色素粗提物的制取
以正交实验的最优提取条件制取红菇红色素提取液,将提取液旋蒸浓缩、冷冻干燥后制得红菇红色素粗提物,置于干燥器内保存供测试。
1.3.5 红色素的色价测定
准确称取红色素粗提物0.1 g,溶于100 mL体积分数为40%的乙醇溶液,并用体积分数为40%的乙醇溶液稀释一定倍数,在最大吸收波长λmax处测定色素溶液吸光值,使吸光值在0.3~0.8,计算色价,如公式(1)所示:
(1)
式中:![]() 质量色素色价,即样品质量浓度为1 g/L,透过1 cm比色皿,在最大吸收波长λmax处的吸光度值;A,稀释后式样溶液的吸光度; m,试验质量,g; f,稀释倍数。
质量色素色价,即样品质量浓度为1 g/L,透过1 cm比色皿,在最大吸收波长λmax处的吸光度值;A,稀释后式样溶液的吸光度; m,试验质量,g; f,稀释倍数。
1.3.6 红菇红色素稳定性的研究
1.3.6.1 温度对色素稳定性的影响
准确称取色素粗提物配制成质量浓度10 g/L的色素溶液,分别于20、40、60、80、100 ℃下水浴加热20 min,取出冷却至室温后,测定其A546nm。
1.3.6.2 pH对色素稳定性的影响
分别以NaH2PO4-Na2HPO4(0.1 mol/L)、柠檬酸-柠檬酸钠(0.05 mol/L)、NaHCO3-Na2CO3(0.1 mol/L)的缓冲溶液调制为pH 3、4、5、6、7、8、9、10的溶液,溶解色素粗提物,配制质量浓度为10 g/L的色素溶液,充分摇匀,静置1 h后离心,测定其A546nm。
1.3.6.3 光照对色素稳定性的影响
准确称取色素粗提物配制成10 mg/mL的色素溶液,分别用UVB中波紫外线灯管(280~320 nm)照射100 min,每20 min取出1次测定其A546nm;照射30 min,每5 min取出1次测定其A546nm。
1.3.6.4 金属离子对色素稳定性的影响
准确称取色素粗提物配制成20 mg/mL的色素溶液,分别向其中添加等体积质量分数为0.2%的Na+、Fe3+、Ca2+、K+、Al3+溶液,即作用体系中色素浓度为10 mg/mL,金属离子浓度为0.1%。反应1 h后离心、测其A546 nm。
1.3.6.5 食品添加剂对色素稳定性的影响
准确称取色素粗提物配制成20 mg/mL的色素溶液,分别向其中添加等体积质量浓度为3 g/L的蔗糖、柠檬酸钠、抗坏血酸溶液,即作用体系中色素溶液质量浓度为10 g/L,食品添加剂质量浓度为1.5 g/L。反应1 h后离心、测其A546nm。
1.3.7 红菇红色素粗提物抗氧化活性研究
1.3.7.1 DPPH·清除能力的测定
参考文献[5]的方法,准确称取色素粗提物配制成浓度梯度的样品液,用甲醇配制0.1 mmol/L DPPH·工作液。准确吸取0.4 mL样品液和2 mL DPPH·工作液于试管中,漩涡振荡,室温暗处反应30 min,于517 nm下测定吸光值。0.4 mL蒸馏水+2 mL甲醇为空白调零,0.4 mL蒸馏水+2 mL DPPH工作液作为对照,清除率计算如公式(2)所示,IC50值表示清除率为50%时样品的浓度。
清除率![]()
(2)
1.3.7.2 ABTS+·清除能力的测定
参考文献[5]的方法,准确称取色素粗提物配制成浓度梯度的样品液,取88 μL过硫酸钾溶液(140 mmol/L)与5 mL ABTS溶液(7 mmol/L)混合避光反应16 h,制得ABTS+·储备液,使用前稀释成A734nm为0.70±0.02的工作液。准确吸取0.5 mL样品液和4 mL ABTS+·工作液于试管中,漩涡振荡,30 ℃水浴6 min,于734 nm处测定吸光值。0.5 mL蒸馏水+4 mL乙醇为空白凋零,0.5 mL蒸馏水+4 mL ABTS+·工作液作为对照。清除率计算如公式(3)所示,IC50值表示清除率为50%时样品的浓度。
清除率![]()
(3)
1.3.7.3 ·OH清除能力的测定
参考文献[6]的方法,准确称取色素粗提物配制成浓度梯度的样品液,准确吸取1 mL样品液于试管中,依次加入0.3 mL FeSO4溶液(8 mmol/L),0.25 mL H2O2溶液(20 mmol/L)和1 mL水杨酸溶液(3 mmol/L),混匀,37 ℃水浴30 min,取出,冷却,加入0.45 mL蒸馏水,混匀后3 000 r/min离心10 min,取上清液于510 nm处测吸光值。1 mL蒸馏水+0.3 mL FeSO4+1 mL无水乙醇+0.25 mL H2O2混合液的吸光值作为空白调零,1 mL蒸馏水+0.3 mL FeSO4+0.25 mL H2O2+1 mL水杨酸作为对照。清除率计算如公式(4)所示,IC50值表示清除率为50%时样品的浓度。
清除率![]()
(4)
1.3.7.4 Fe3+还原能力(FRAP法)的测定
参考文献[5]的方法,准确称取色素粗提物配制成浓度梯度的样品液,将醋酸缓冲液(300 mmol/L, pH 3.6),TPTZ溶液(10 mmol/L)和FeCl3溶液(20 mmol/L)按体积比10∶1∶1混匀,制得FRAP试剂,37 ℃水浴备用。准确吸取0.15 mL样品液和4.5 mL FRAP试剂于试管中,混匀, 37 ℃水浴反应10 min,于593 nm处测定吸光值。EC50值表示还原产生0.5 mmol/L Fe2+时样品的浓度。
1.3.7.5 抑制脂质体过氧化能力的测定
参考文献[1]的方法,准确称取色素粗提物配制成浓度梯度的样品液。准确吸取1 mL样品液于试管中,依次加入1 mL脂质体磷酸盐缓冲分散系,1 mL FeCl3溶液(40 μmol/L)和1 mL抗坏血酸溶液(400 μmol/L),混匀,37 ℃避光水浴60 min,再加入2 mL三氯乙酸-硫代巴比妥酸-盐酸混合液,混匀,沸水浴15 min,立即冷却,5 000 r/min离心10 min,取上清液于532 nm处测定吸光值。1 mL 蒸馏水代替样品+1 mL磷酸盐缓冲液代替脂质体分散体系为空白调零,1 mL蒸馏水代替样品作为对照。脂质体过氧化抑制率计算如公式(5)所示,IC50值表示抑制率为50%时样品的浓度。
抑制率![]()
(5)
1.3.8 红菇红色素粗提物基本组成成分分析
1.3.8.1 总酚含量测定
采用Folin-Ciocalteu法测定红菇色素粗提物中总酚含量,结果表达为红菇色素粗提物中所含没食子酸当量(mg GAE/g DW)。
1.3.8.2 水溶性总糖含量测定
采用硫酸-苯酚法测定红菇色素粗提物中水溶性总糖含量,结果表达为%红菇色素粗提物。
1.3.8.3 水溶性蛋白质含量测定
采用考马斯亮蓝法测定红菇色素粗提物中水溶性蛋白质含量,结果表达为%红菇色素粗提物。
1.3.8.4 UPLC-Q-Orbitrap-MS分析
样品处理:准确称取色素粗提物配制成4 mg/mL的溶液,过0.45 μm滤膜于棕色液相小瓶中。
色谱条件:色谱柱,InfinityLab Poroshell 120 EC-C18(2.1×100 mm,1.9 μm,Agilent Technologies),柱温40 ℃;流动相A,水(0.1%甲酸),流动相B,乙腈;梯度洗脱:0~1 min,5%B,1~5 min,5%~15%B,5~10 min,15%~38%B,10~12 min,38%~72%B,12~18 min,72%~80%B,18~20 min,80%~100%B,20~28 min,100%B,28~29 min,100%~5%B;流速0.2 mL/min,进样量3 μL[7]。
质谱条件:在正离子(ESI+)和负离子(ESI-)监测模式扫描,扫描范围m/z 100~1 000;喷雾电压3.5 kV,毛细管传输温度320 ℃,干燥器温度350 ℃;一级和二级质谱的分辨率分别为70 000和35 000。
每个实验至少3次重复,使用Microsoft Office Excel 2016进行数据处理,采用SPSS 22.0软件对数据进行方差分析;正交试验采用正交设计助手Ⅱ V3.1进行数据处理;紫外-可见光谱扫描作图使用Origin 9.0 软件,UPLC-Q-Orbitrap-MS采用Thermo Xcalibur Qual Browser软件对数据进行分析。
如表2所示,水和体积分数为20%、60%的乙醇作为提取剂制得提取溶液呈红色,而丙酮等制取的提取液为淡黄色。浓缩后经紫外-可见光谱分析(图1),水和乙醇提取液在546 nm有特征吸收峰,被认为是花青素的特征吸收峰之一[8]。表明红菇红色素极易溶于水、乙醇混合体系等强极性溶剂中,在丙酮等弱极性有机试剂的溶出能力低,可能是红菇红色素或其前体中含有羟基或羰基等极性基团,属于水溶性花色苷类物质[9]。后续研究中选用一定浓度的水-乙醇体系作为提取剂。
表2 不同提取剂对红菇红色素的溶出效果
Table 2 Solubility of red pigments from R.vinosa in different solvents

提取剂超纯水体积分数20%乙醇体积分数60%乙醇无水乙醇丙酮石油醚乙酸乙酯提取液颜色红红红无色黄黄黄A546nm0.1840.2250.2150.0040.0340.0300.023
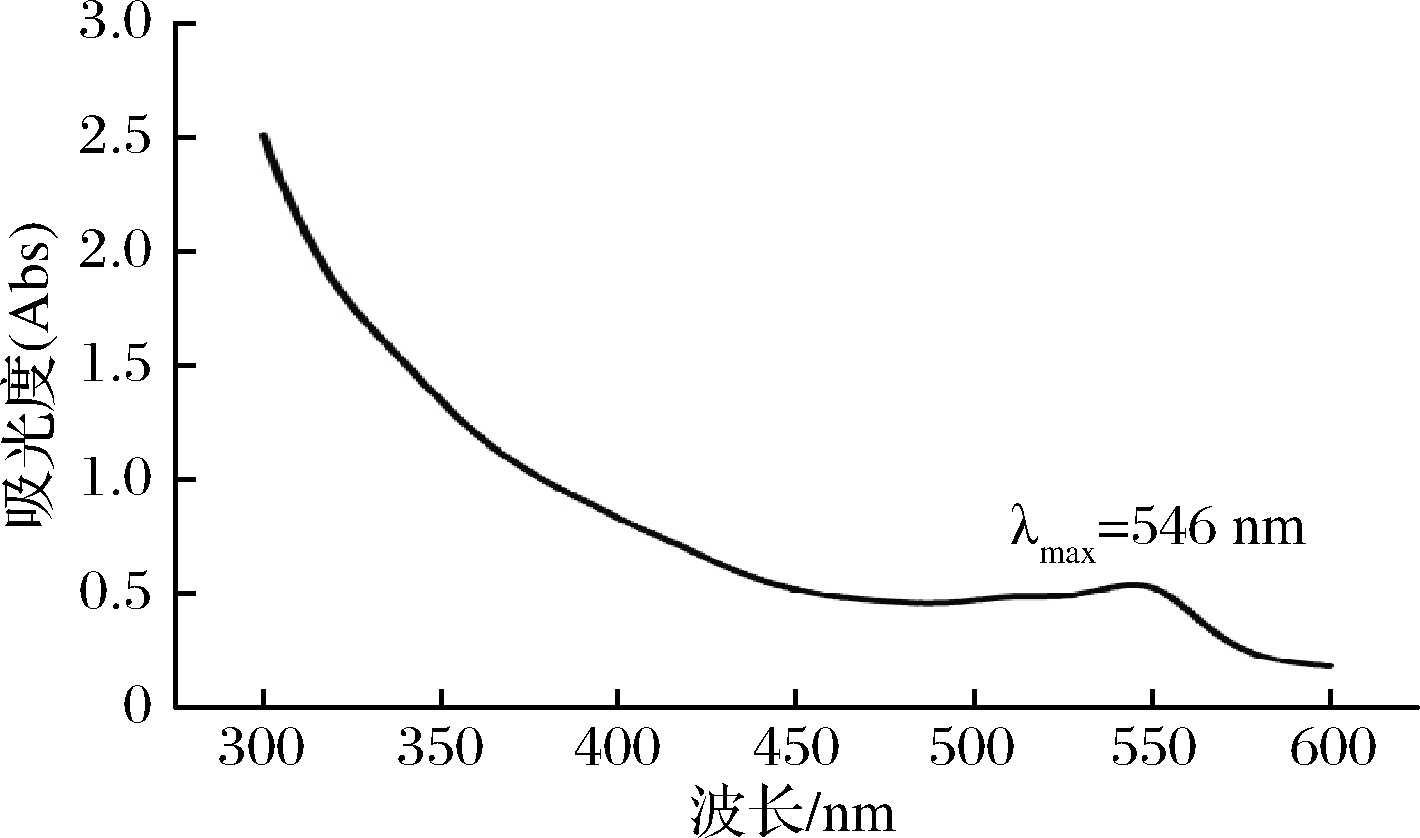
图1 红菇色素水提取液的紫外-可见光谱
Fig.1 UV-vis spectrum of red pigments from R. vinosa in water
由表3可知,各因素对红菇红色素提取效果的影响主次顺序为乙醇浓度(A)>料液比(B)>循环次数(C),即乙醇浓度对红菇红色素提取效果影响最大。最佳工艺参数为A2B3C3,即乙醇体积分数为40%,料液比1∶90,循环提取5次。在此条件下10 mg菇粉/mL溶剂质量浓度下提取液的A546nm为0.286。
表3 正交试验设计及结果
Table 3 Design and results of orthogonal experiments
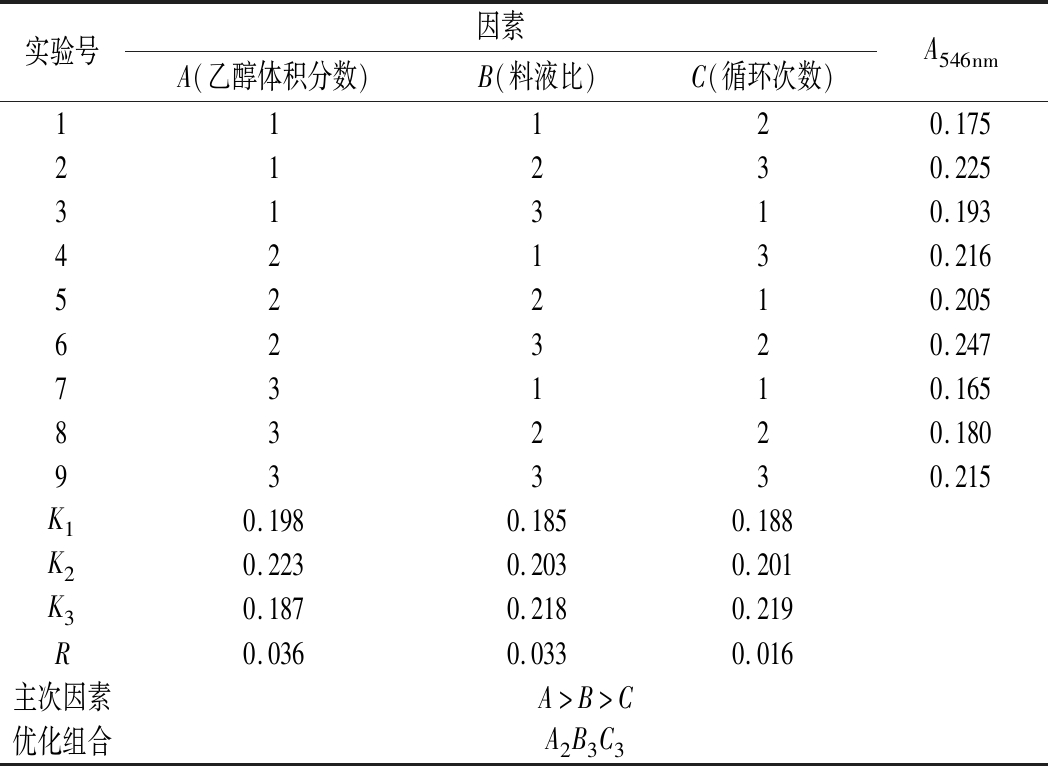
实验号因素A(乙醇体积分数)B(料液比)C(循环次数)A546nm11120.17521230.22531310.19342130.21652210.20562320.24773110.16583220.18093330.215K10.1980.1850.188K20.2230.2030.201K30.1870.2180.219R0.0360.0330.016主次因素A>B>C优化组合A2B3C3
色价能从一定程度上反映色素含量的高低和产品着色能力的强弱。红菇红色素粗提物的色价为57.46。与辣椒红色素色价51.60~75.60相近[10]。
2.4.1 温度对色素稳定性的影响
由图2可知,红菇色素在20~60 ℃时稳定性较好,能耐受一定的热处理。当温度高于80 ℃时,色素溶液A546 nm呈下降趋势,表明高温对色素有一定的破坏作用。
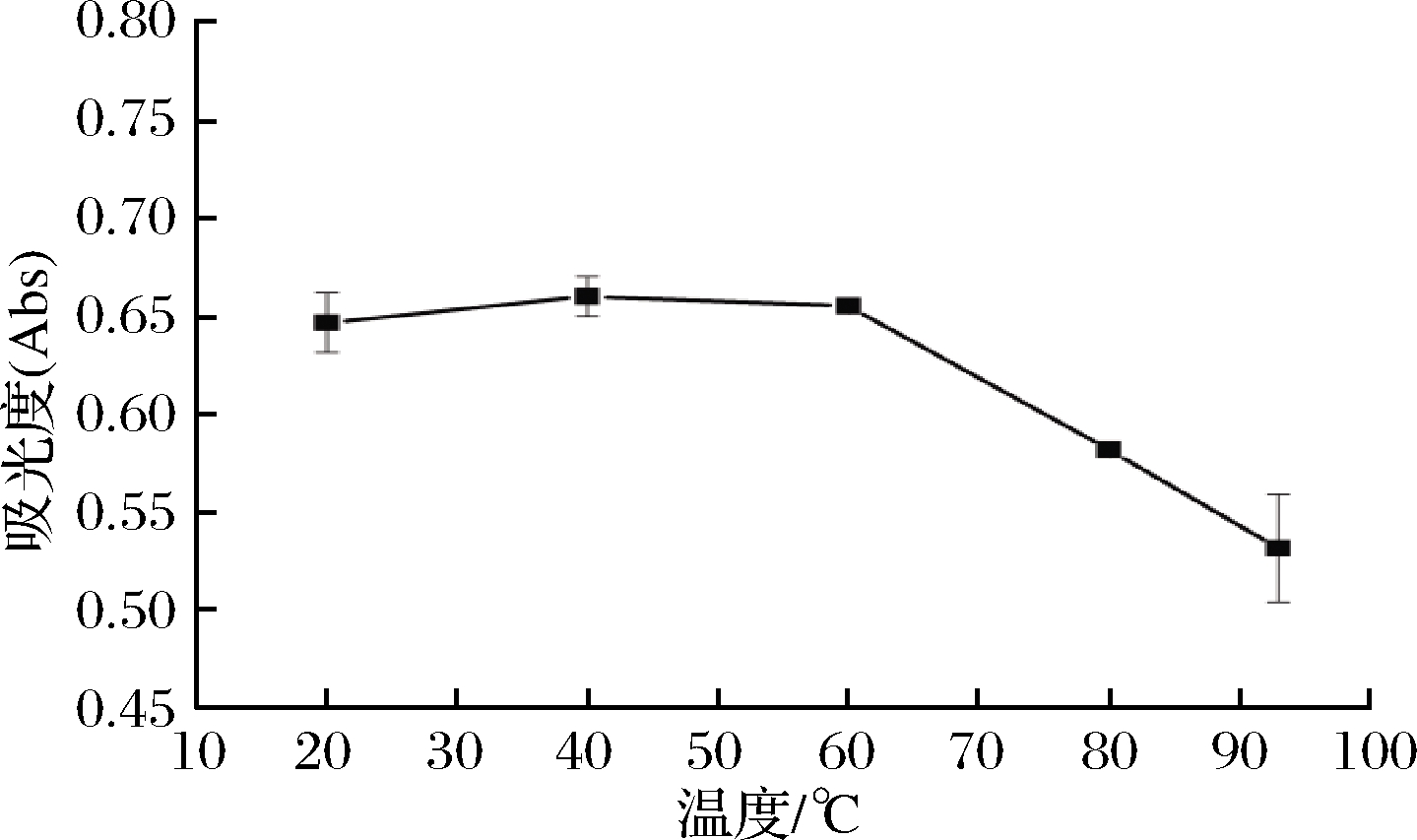
图2 温度对色素稳定性的影响
Fig.2 Effect of temperature on stability of the pigments
2.4.2 pH对色素稳定性的影响
以未调pH的色素水溶液作为参比,调节色素水溶液在pH 6~9时,溶液颜色为红色,且在pH 8时,颜色最深,A546 nm最大,如图3所示。在pH>9或pH<6时,颜色变淡,为橙黄色。因此,红菇色素在中性及弱碱性条件下色度较好,在酸性、碱性中显色较差。在pH>9时,色素溶液更澄清透明,而pH<4时,产生沉淀,这也可能说明红菇红色素物质结构中含有羧基,在弱碱性环境中溶解性更好。
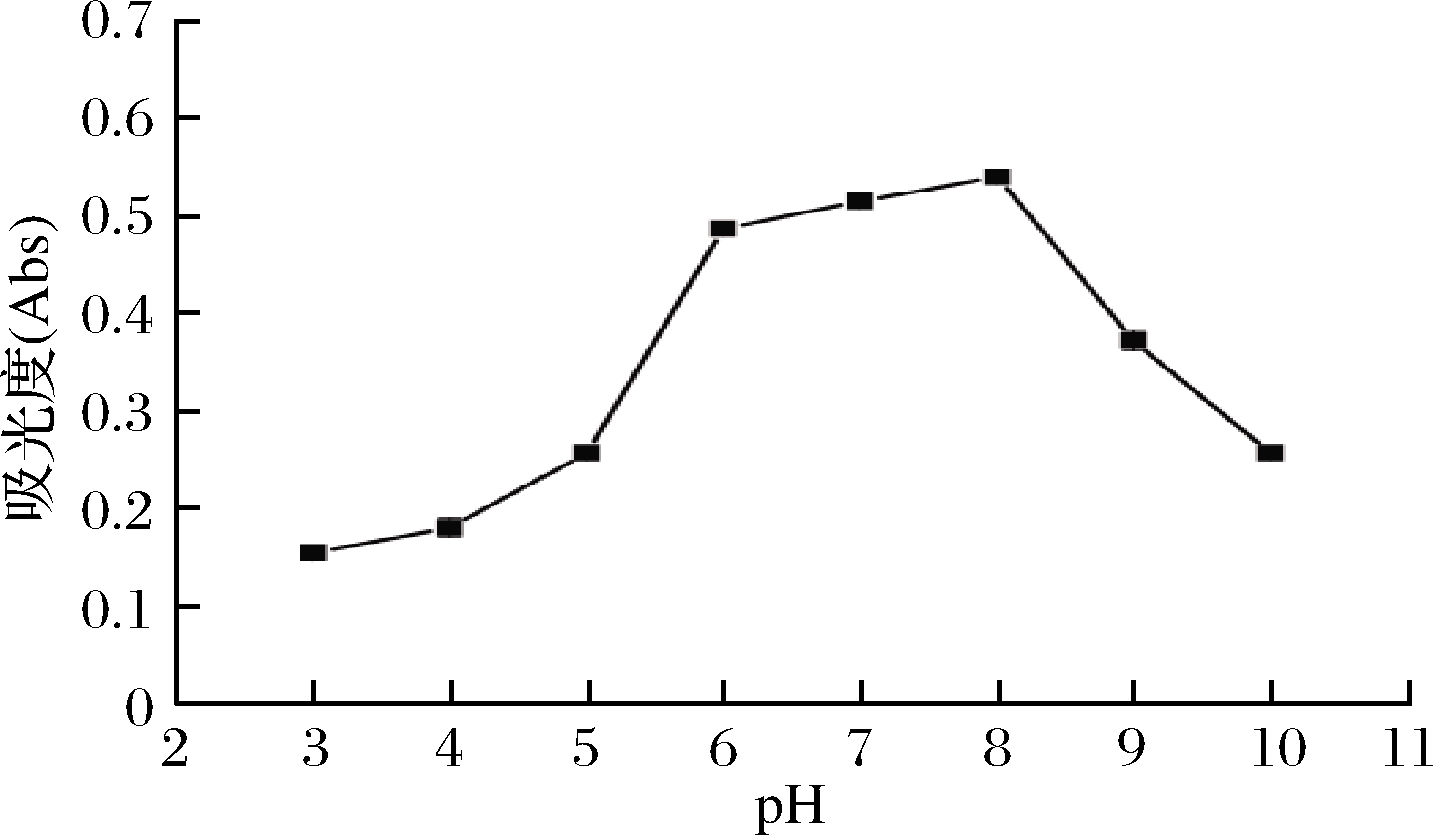
图3 pH对色素稳定性的影响
Fig.3 Effects of pH on the stability of the pigments
2.4.3 光照对色素稳定性的影响
由图4可知,紫外照射100 min时,随照射时间增加,红菇色素溶液A546nm逐渐减小,且溶液褪色明显,由粉红、橙红变为黄色、橙色。但紫外照射30 min时色素溶液吸光值变化较慢,随时间的增加逐渐呈现平稳趋势,长时间光照对红菇色素影响较大,短时间照射对其影响较小。

A-照射时间100 min,每20 min检测1次;B-照射时间30 min,每5 min检测1次
图4 光照对色素稳定性的影响
Fig.4 Effect of UV irradiation on the stability of the pigments
2.4.4 金属离子对色素稳定性的影响
由图5可知,以未加入金属离子的色素溶液作参比,色素溶液加入Fe3+、Al3+后溶液变棕黄,且Fe3+加入1 h后的色素溶液产生絮状沉淀。添加其他金属离子的溶液无明显变化。说明Fe3+、Al3+对红菇色素的稳定性影响较大,K+、Na+、Ca2+对红菇色素的稳定性影响较小,因此红菇色素生产和使用过程中要尽量避免和含铁、铝等容器的接触。
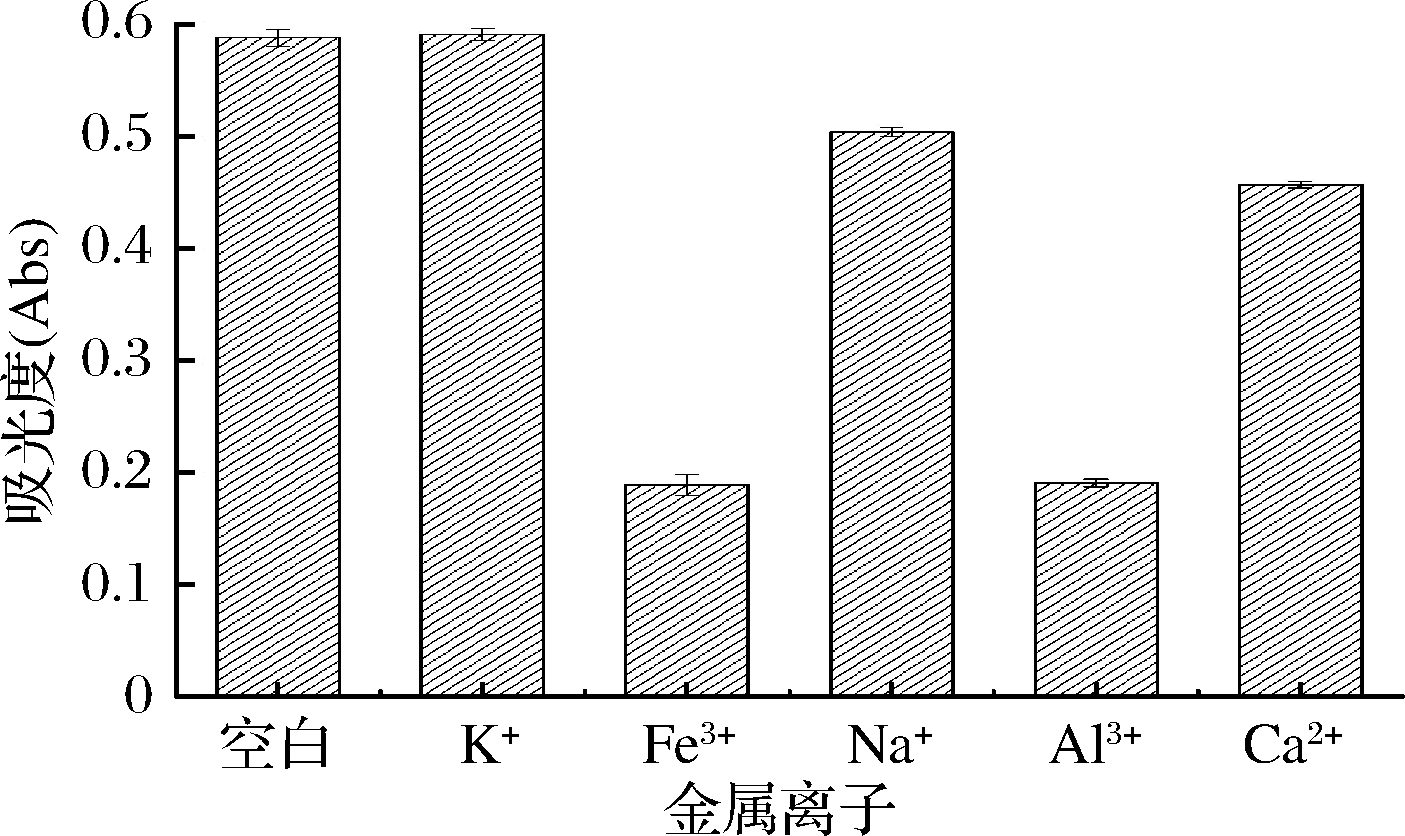
图5 金属离子对色素稳定性的影响
Fig.5 Effect of metal ions on the stability of the pigments
2.4.5 食品添加剂对色素稳定性的影响
由图6可知,以未加食品添加剂的色素溶液作为空白,添加了抗坏血酸的色素溶液吸光度减小,添加了蔗糖的色素溶液吸光度增大,添加了柠檬酸钠的色素溶液吸光度变化较小。标明抗坏血酸对红菇色素有一定的影响,蔗糖对其有一定的增色作用,柠檬酸钠对其影响较小。
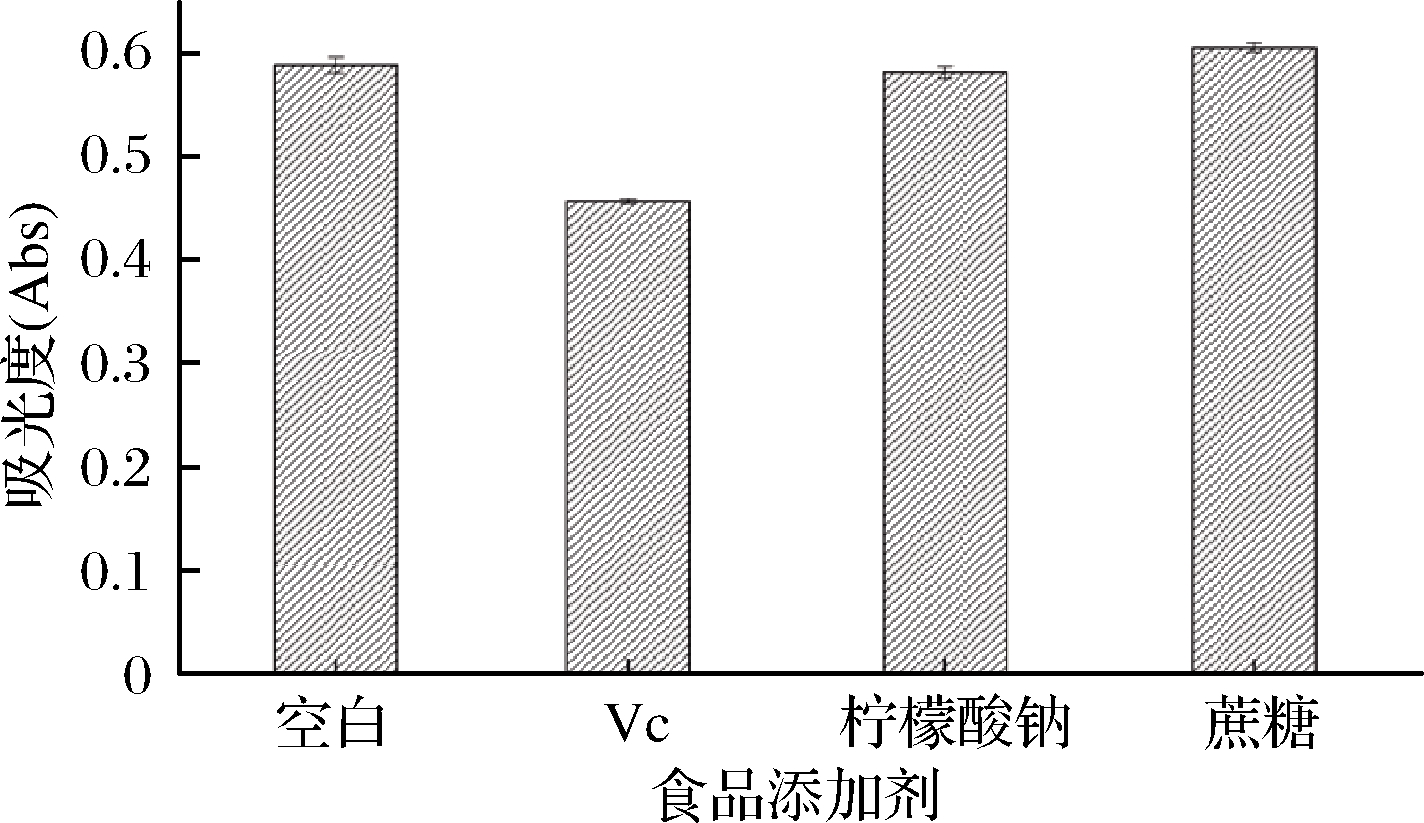
图6 食品添加剂对色素稳定性的影响
Fig.6 Effect of food additives on the stability of the pigments
2.5.1 DPPH·清除活性
DPPH·溶于有机溶剂后显紫色,加入自由基清除剂时,其孤电子被配对,导致溶液颜色变浅,在 517 nm 处的吸光度变小,其变化程度与自由基清除程度呈线形关系[11]。红菇色素提取物对DPPH·具有一定的清除能力(图7),且随着色素浓度的增加,DPPH·清除活性也不断增大,其IC50值为4.252 mg/mL,相同评价体系中VC清除DPPH·的IC50值为14.250 μg/mL。
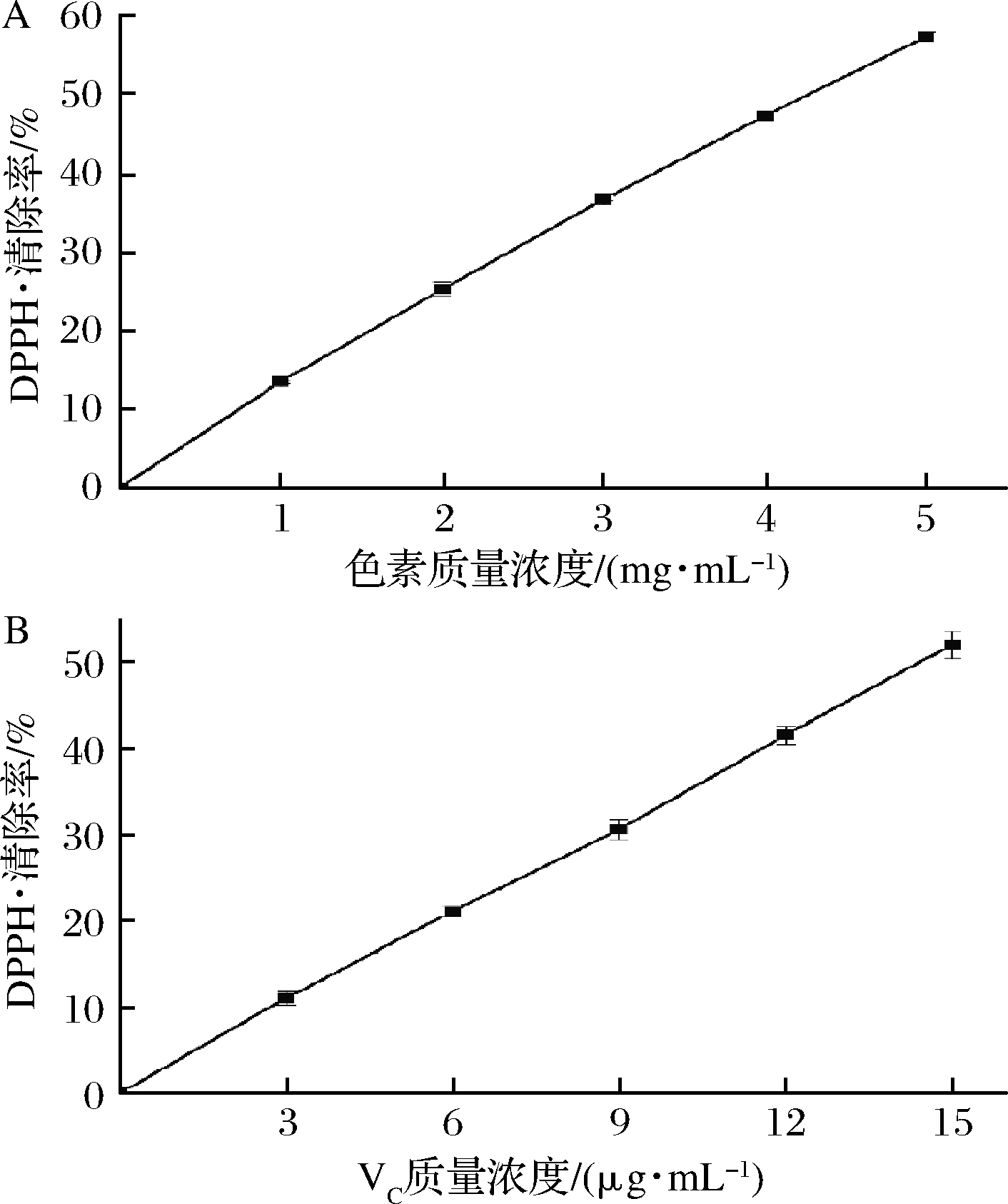
A-红菇色素;B-VC
图7 DPPH·清除能力
Fig.7 DPPH·-scavenging capacity
2.5.2 ABTS+·清除活性
ABTS+·是一种以氮为中心的自由基,溶于有机溶剂、水以及水性缓冲液后显墨绿色,加入自由基清除剂时电子转移导致溶液颜色变浅,在 734 nm 处的吸光度变小,其变化程度与自由基清除程度呈线形关系[12]。如图8所示,红菇色素具有较强的ABTS+·清除能力,随着色素浓度的增加,ABTS+·清除活性也不断增大,其IC50值为0.690 mg/mL,相同评价体系中VC清除ABTS+·的IC50值为15.134 μg/mL。

A-红菇色素;B-VC
图8 ABTS+·清除能力
Fig.8 ABTS+·-scavenging capacity
2.5.3 ·OH清除活性
Fenton反应生成的·OH与水杨酸反应,生成紫色的2,3-二羟基苯甲酸,在510 nm处的吸光值与·OH的量成正比,向反应体系中加入自由基清除剂时被氧化的水杨酸减少,体系颜色变浅[13]。本试验通过对·OH的清除能力来评价红菇红色素的抗氧化活性,如图9所示,红菇色素对·OH清除能力随着色素浓度的增加而增大,其IC50值为3.605 mg/mL,相同评价体系中VC的IC50值为0.360 mg/mL。
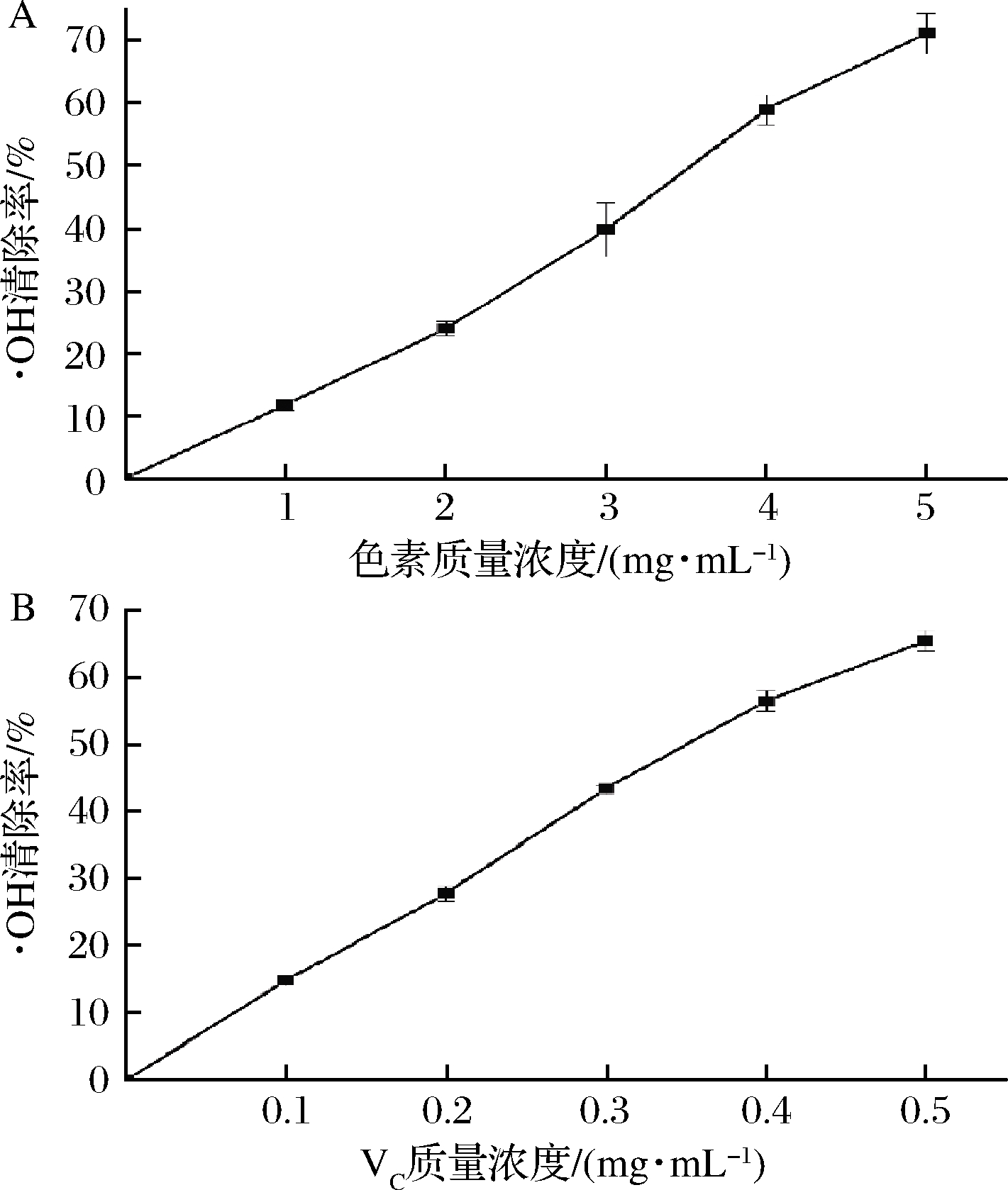
A-红菇色素;B-VC
图9 ·OH清除能力
Fig.9 ·OH scavenging capacity
2.5.4 铁离子还原能力
在酸性条件下抗氧化剂可以提供电子将Fe3+还原成Fe2+,Fe2+与TPTZ结合生成蓝色络合物,在593 nm处有最大吸收峰[14]。抗氧化剂的还原能力被认为是提供电子的能力。如图10所示,红菇红色素粗提物还原Fe3+生成Fe2+的能力随浓度的而增强,其EC50值分别为8.430 mg/mL。相同评价体系中VC的EC50值为0.030 mg/mL。

A-红菇色素;B-VC
图10 铁离子还原能力
Fig.10 Fe3+ reducing ability
2.5.5 抑制脂质体过氧化能力的测定
在Fe2+引发的卵磷脂脂质体体系中,红菇红色素对脂质体有明显的抑制作用,抑制率随浓度的增加而增大,其IC50值为17.301 mg/mL,二丁基羟基甲苯(butylated hydroxytoluene,BHT)的IC50值为14.534 μg/mL(图11)。
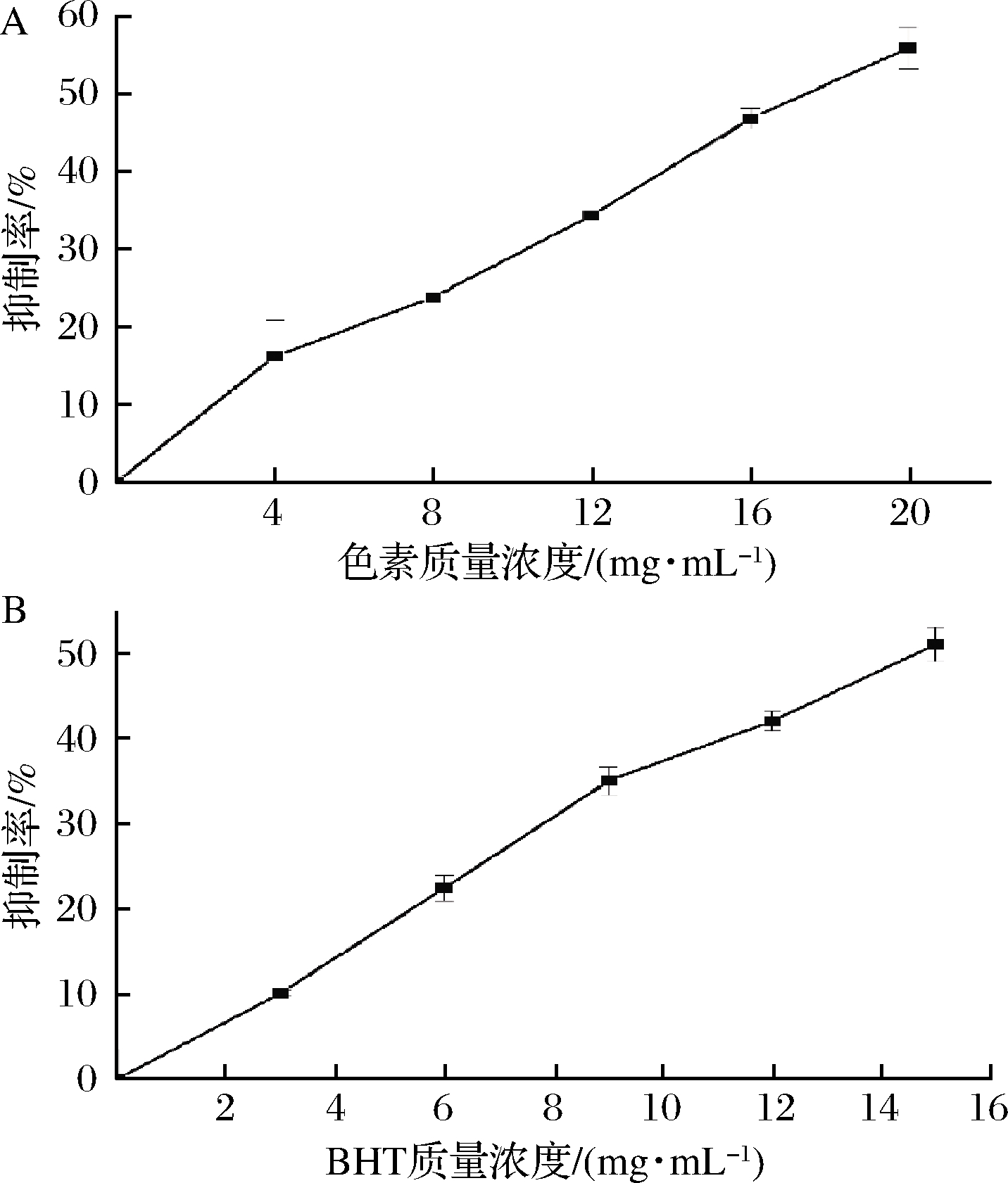
A-红菇色素;B-BHT
图11 抑制脂质体过氧化能力
Fig.11 Lipid peroxidation inhibition capacity
2.6.1 基本组成成分
红菇色素提取物中总酚含量为26.84 mg GAE/g DW,水溶性总糖质量分数为5.88%,可溶性蛋白质质量分数为2.69%。多酚质量分数与周倩[15]测得的新疆黑桑红色素的23.18~64.53 mg GAE/g DW相近。多糖质量分数低于新疆黑桑红色素的28.72%~51.59%。
2.6.2 UPLC-Q-Orbitrap-MS分析
应用UPLC-Q-Orbitrap-MS系统对红菇红色素溶液进行进一步分析,总离子流图如图12所示。根据文献进行化合物定性分析[16-28],结果如表4所示,主要鉴定到31个化合物,其中有机酸类成分9个,多元醇类成分1个,多糖类成分1个,维生素类成分1个,花青素类成分9个,确定了红菇红色素为花色苷类色素。
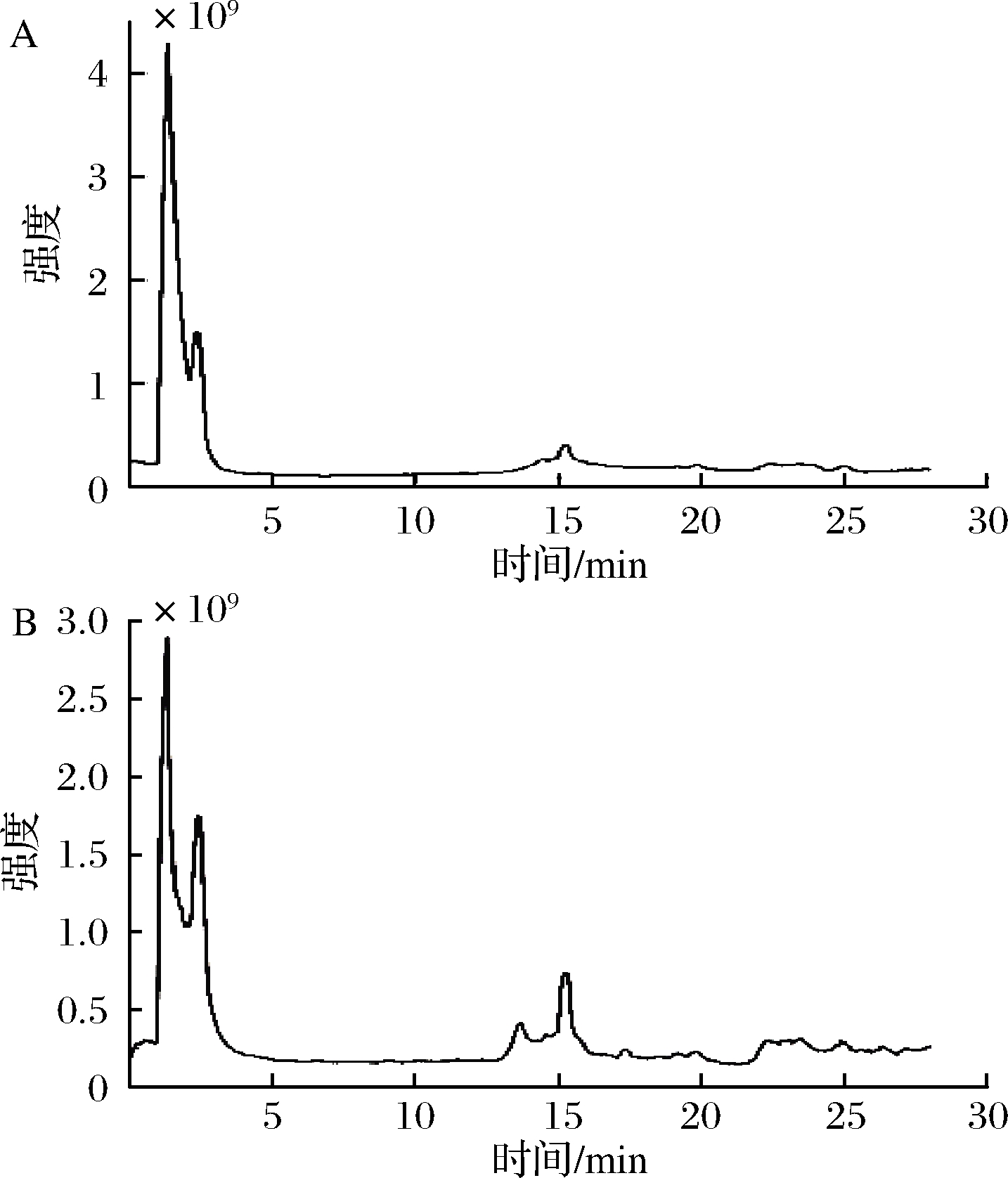
A-负离子模式;B-正离子模式
图12 红菇色素在UPLC-Q-Orbitrap-MS系统分析中的总离子流图
Fig.12 UPLC-Q-Orbitrap-MS spectums of the pigments
本文制取了云南产野生大红菇子实体水溶性花色苷类色素粗提物。该色素提取物具有一定的温度、pH、金属离子和食品添加剂等因素影响下的稳定性。红菇红色素提取物在不同的抗氧化评价体系中均表现出一定的自由基清除能力和供电子能力,抗氧化活性较好。经UPLC-Q-Orbitrap-MS系统分析,主要鉴定到红菇色素提取物中的31个化合物,其中有机酸类成分9个,多元醇类成分1个,多糖类成分1个,维生素类成分1个,花青素类成分9个,确定了红菇红色素为水溶性花色苷类色素。后续可进一步对红菇色素提取物进行分离纯化,研究红菇花青素的生理活性,进而探讨其“补血”的物质基础及作用机制,为红菇的综合开发和高值化利用提供理论支撑。
表4 红菇红色素主要化学成分信息
Table 4 Information on main chemical constituents of red pigment from Russula vinosa
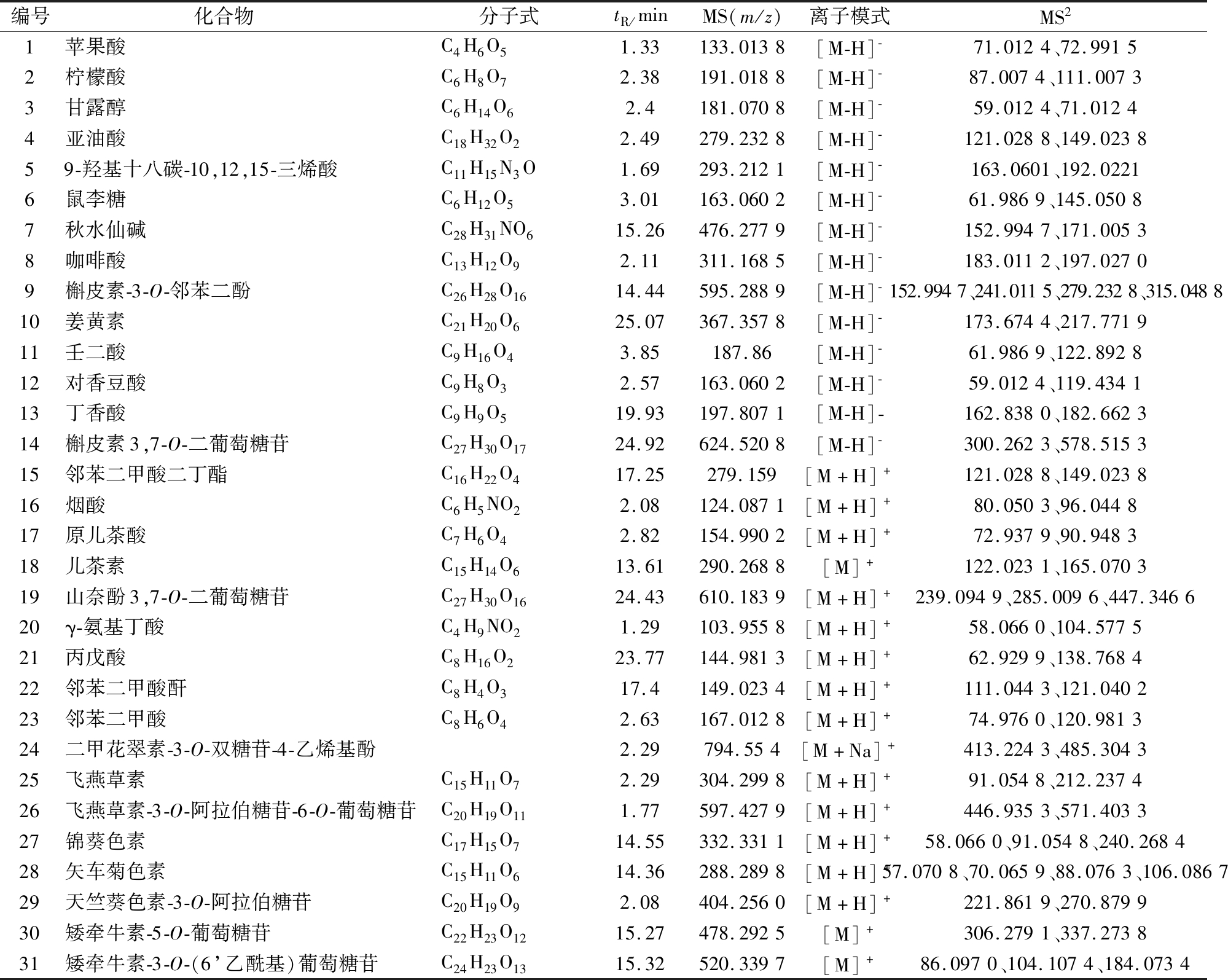
编号化合物 分子式tR/minMS(m/z)离子模式MS21苹果酸C4H6O51.33133.0138[M-H]-71.0124、72.99152柠檬酸C6H8O72.38191.0188[M-H]-87.0074、111.00733甘露醇C6H14O62.4181.0708[M-H]-59.0124、71.01244亚油酸C18H32O22.49279.2328[M-H]-121.0288、149.023859-羟基十八碳-10,12,15-三烯酸C11H15N3O1.69293.2121[M-H]-163.0601、192.02216鼠李糖C6H12O53.01163.0602[M-H]-61.9869、145.05087秋水仙碱C28H31NO615.26476.2779[M-H]-152.9947、171.00538咖啡酸C13H12O92.11311.1685[M-H]-183.0112、197.02709槲皮素-3-O-邻苯二酚C26H28O1614.44595.2889[M-H]-152.9947、241.0115、279.2328、315.048810姜黄素C21H20O625.07367.3578[M-H]-173.6744、217.771911壬二酸C9H16O43.85187.86[M-H]-61.9869、122.892812对香豆酸C9H8O32.57163.0602[M-H]-59.0124、119.434113丁香酸C9H9O519.93197.8071[M-H]-162.8380、182.662314槲皮素3,7-O-二葡萄糖苷C27H30O1724.92624.5208[M-H]-300.2623、578.515315邻苯二甲酸二丁酯C16H22O417.25279.159[M+H]+121.0288、149.023816烟酸C6H5NO22.08124.0871[M+H]+80.0503、96.044817原儿茶酸C7H6O42.82154.9902[M+H]+72.9379、90.948318儿茶素C15H14O613.61290.2688[M]+122.0231、165.070319山奈酚3,7-O-二葡萄糖苷C27H30O1624.43610.1839[M+H]+239.0949、285.0096、447.346620γ-氨基丁酸C4H9NO21.29103.9558[M+H]+58.0660、104.577521丙戊酸C8H16O223.77144.9813[M+H]+62.9299、138.768422邻苯二甲酸酐C8H4O317.4149.0234[M+H]+111.0443、121.040223邻苯二甲酸C8H6O42.63167.0128[M+H]+74.9760、120.981324二甲花翠素-3-O-双糖苷-4-乙烯基酚2.29794.554[M+Na]+413.2243、485.304325飞燕草素C15H11O72.29304.2998[M+H]+91.0548、212.237426飞燕草素-3-O-阿拉伯糖苷-6-O-葡萄糖苷C20H19O111.77597.4279[M+H]+446.9353、571.403327锦葵色素C17H15O714.55332.3311[M+H]+58.0660、91.0548、240.268428矢车菊色素C15H11O614.36288.2898[M+H]+57.0708、70.0659、88.0763、106.086729天竺葵色素-3-O-阿拉伯糖苷C20H19O92.08404.2560[M+H]+221.8619、270.879930矮牵牛素-5-O-葡萄糖苷C22H23O1215.27478.2925[M]+306.2791、337.273831矮牵牛素-3-O-(6’乙酰基)葡萄糖苷C24H23O1315.32520.3397[M]+86.0970、104.1074、184.0734
[1] 孙丽平, 常惟丹, 鲍长俊, 等. 云南产6种野生食用牛肝菌的营养成分及抗氧化特性研究[J].现代食品科技,2016,32(12):285-292.
[2] 殷建忠, 周玲仙. 云南4种红菇类野生食用菌营养成分分析及评价[J]. 食品研究与开发, 2008, 29(7):133-136.
[3] 李惠珍, 李淑冰, 许旭萍, 等. 正红菇培养菌丝体与野生子实体有效成分的比较分析[C]//全国第六届食用菌学术研讨会论文集. 福州:中国农学会中国菌物学会, 2001:154.
[4] 庞庭才, 胡上英, 甘红. 红菇色素超声波提取及其稳定性和抗氧化性研究[J]. 食品与发酵工业, 2015, 41(11):222-227.
[5] 杨成涛, 孙丽平, 孙云, 等. 云南省4个主产区无核白鸡心葡萄果皮组成成分及抗氧化能力分析[J]. 食品科学, 2015, 36(22):85-89.
[6] 孙丽平, 鲍长俊, 刘建华, 等. 乌鳢分泌多糖和黏多糖的提取及其抗氧化活性研究[J]. 食品与发酵工业, 2015, 41(7):81-85.
[7] LI X, GUO Y, ZHUANG Y, et al. Nonvolatile taste components, nutritional values, bioactive compounds and antioxidant activities of three wild Chanterelle mushrooms[J]. International Journal of Food Science and Technology, 2018, 53(8):1 855-1 864.
[8] 谭亮, 董琦, 曹静亚, 等. 黑果枸杞中花色苷的提取与结构鉴定[J]. 天然产物研究与开发, 2014, 26(11):1 797-1 802;1 760.
[9] 王晓梅, 徐为民, 曹士锋, 等. 红心萝卜花色苷稳定性的研究[J]. 食品科学, 2008, 29(7):98-100.
[10] 谭佩毅, 吴君艳. 响应面法优化辣椒红色素的提取工艺[J]. 贵州农业科学, 2013, 41(12):154-156;159.
[11] 何慧娟, 黄娜, 曹瑞军, 等. 植物中主要抗氧化剂的结构、抗氧化机理和抗氧化性能检测[J]. 生物物理学, 2015, 3(1): 25-47.
[12] 朱洁, 王红宝, 孔佳君, 等. 梨幼果多酚的纯化及其抗氧化性[J]. 食品科学, 2017,38(5):14-20.
[13] SUN L, BAO C, CHANG W, et al. Preparation, characterisation, antioxidant and antiglycation activities of the novel polysaccharides from the pileus of Dictyophora rubrovolvata[J]. International Journal of Food Science & Technology, 2016, 52(1):161-170.
[14] YANG J, ZHANG W, DU L, et al. Comparative antioxidant properties of some Gingerols and Shogaols, and the relationship of their contents with the antioxidant potencies of fresh and dried ginger (Zingiberofficinale Roscoe)[J]. Journal of Agricultural Science & Technology, 2018, 16(5):1 063-1 072.
[15] 周倩. 新疆黑桑红色素提取工艺、化学总成分与初步应用的研究[D]. 乌鲁木齐:新疆医科大学, 2015.
[16] 郭晓倩, 房子舒, 刘凤娇, 等. 东北野生蓝莓花色苷组分分析及其抗氧化性比较[J]. 现代食品科技, 2016,32(3):313-320.
[17] RAMIREZ J E, ZAMBRANO R, ![]() et al. Anthocyanins and antioxidant capacities of six chilean berries by HPLC-HR-ESI-ToF-MS[J]. Food Chemistry, 2015, 176:106-114.
et al. Anthocyanins and antioxidant capacities of six chilean berries by HPLC-HR-ESI-ToF-MS[J]. Food Chemistry, 2015, 176:106-114.
[18] ABU-REIDAH I M, ALI-SHTAYEH M S, JAMOUS R M, et al. HPLC-DAD-ESI-MS/MS screening of bioactive components from Rhus coriaria L. (Sumac) fruits[J]. Food Chemistry, 2015, 166:179-191.
[19] 成果, 黄羽, 杨莹, 等. ‘桂葡6号’葡萄酒花色苷组分HPLC-MS分析[J]. 食品科学, 2018, 39(1):269-275.
[20] 成梦琳, 张艳艳, 赵大球, 等. 芍药黄色花瓣中黄酮醇及其糖苷类化合物组成分析[J]. 天然产物研究与开发, 2018, 30(8):1 340-1 345.
[21] XIANG J, ZHANG M, FRANKLIN B A, et al. Hydroxycinnamic acid amide (HCAA) derivatives, flavonoid C-glycosides, phenolic acids and antioxidant properties of foxtail millet[J]. Food Chemistry, 2019, 295:214-223.
[22] 袁帅, 姚胜军, 耿昱, 等. HPLC-ESI-MS/MS 识别蓝莓提取物中的花青素和黄酮醇[J]. 分析化学, 2009, 67(4):318-322.
[23] 高玥, 李新生, 韩豪, 等. UPLC-MS/MS定性测定紫薯花青苷方法研究[J]. 食品工业科技, 2013, 34(3):317-320.
[24] SCORRANO S, LAZZOI M R, MERGOLA L, et al. Anthocyanins profile by Q-TOF LC/MS in Myrtus Communis berries from Salento Area[J]. Food Analytical Methods, 2017, 10(7):2 404-2 411.
[25] YANG H J, KIM H W, KWON Y S, et al. Fast and simple discriminative analysis of anthocyanins-containing berries using LC/MS spectral data[J]. Phytochemical Analysis, 2017, 28(5): 416-423.
[26] XU Y, SIMON J E, FERRUZZI M G, et al. Quantification of anthocyanidins in the grapes and grape juice products with acid assisted hydrolysis using LC/MS[J]. Journal of Functional Foods, 2012, 4(4):710-717.
[27] 施文祥, 陈新华. 稳定同位素iTRAQ标记/高效液相色谱-串联质谱法测定3种红菇中游离氨基酸[J]. 食品与发酵工业, 2015, 41(2):179-183.
[28] SAMOTICHA J, WOJDY O A, GOLIS T. Phenolic composition, physicochemical properties and antioxidant activity of interspecific hybrids of grapes growing in Poland[J]. Food Chemistry, 2017, 215:263-273.
O A, GOLIS T. Phenolic composition, physicochemical properties and antioxidant activity of interspecific hybrids of grapes growing in Poland[J]. Food Chemistry, 2017, 215:263-273.