
宁夏枸杞(Lycium barbarum)是西北半干旱地区重要的经济林种,其叶、果实均可食用和药用,尤其是其干燥果实——枸杞子,是一种享誉国内外的药食同源滋补佳品[1]。在生产中,枸杞鲜果保质期仅2~3 d[2],必须在短期内通过晾晒或烘干制成干品。但是,宁夏枸杞果实表皮蜡质极发达[3],厚度可超过0.1 mm,保水性强,成为枸杞果实干制加工中的主要障碍。
宁夏枸杞果实表皮蜡质主要成分为C29烷烃,占蜡质总量的42.9%[3]。目前,对参与植物表皮蜡质烷烃合成代谢中的酶基因及其功能没有完全鉴定,仅在拟南芥中取得少量的实验证据表明,醛脱羰基酶(ECERIFERUM1,CER1)催化长链偶数碳脂肪醛脱羰基,转化为长链奇数碳烷烃,影响C29烷烃及其他长链奇数碳烷烃、醇和酮的合成,是长链烷烃合成过程中的关键酶,与提高表皮保水性密切相关[4-5]。
RNA干扰(RNA interference,RNAi)技术是指利用基因工程技术使体内合成一些针对特定基因的短片段单链RNA与该基因的mRNA结合,形成部分双链RNA,促使mRNA降解,从而特异地阻断该基因在体内表达,获得该基因缺陷株系的技术[6-7]。因该技术具有特异性强[8-9]、效率高[10]、能沉默基因家族和多基因[11]、基因沉默效果可传代[12]等优点,成为近20年来最重要的鉴定基因功能[13]和选育经济植物新品种[14-15]的方法之一。
扁果枸杞(Lycium barbarum ssp. Bianguo)是宁夏枸杞的一个品种,不仅其果实营养价值优于其他品种[16],也是一种表皮蜡质极为发达的抗旱耐盐植物[17]。本文以扁果枸杞LbCER1基因为目标,构建LbCER1-RNAi植物表达载体,并通过冻融法转入根癌农杆菌(Agrobacterium tumefaciens) GV3101中,为进一步获得LbCER1-RNAi沉默株系,鉴定LbCER1基因功能及选育适宜于干制加工的宁夏枸杞品种奠定基础。
含有LbCER1基因开放阅读框的pMD-19质粒、pKANNIBAL质粒,由本实验室保存,pART27质粒和根癌农杆菌GV3101菌株,由兰州大学草地农业科技学院王锁民教授实验室赠送。
PCR扩增试剂盒、T-载体PCR产物克隆试剂盒、DNA胶回收试剂盒,TAKARA公司;DNA marker,Novoprotein公司;限制性内切酶、T4 DNA 连接酶,Thermo Scientific公司;质粒提取试剂盒,OMEGE公司;琼脂糖和引物合成,上海生物工程股份有限公司。
DYY-6C型电泳仪,北京市六一仪器厂;Genesy 96T型PCR扩增仪,西安天隆科技有限公司;5424R型高速冷冻离心机: 德国Eppendorf 公司;Nichipet ExⅡ型移液枪,日本立洋公司;HH-S6型电热恒温水浴锅,北京科伟永兴仪器有限公司。
1.3.1 以LbCER1为靶标的RNAi 中间载体的构建
根据LbCER1基因开放阅读框序列选定1 469~1 840 bp区段作为RNAi 最佳靶位区段,该片段长372 bp,包含3个最佳RNAi作用位点。根据该片段序列设计引物,上游P1为5′-GGAGAGGACACGCTCGAG-AGCTTACCCCTGAGGCTGCAG(XhoI),下游P2为5′-TTTCCTTACCAATTGGGGTACCAAAATCCATGATCGA-GACTAGCTTTCC(KpnI),划线部分为限制性内切酶酶切位点。以本实验室已构建好含LbCER1开放阅读框的pMD-19质粒为模板,用引物P1、P2通过PCR法扩增选定的靶位区段,PCR条件为95 ℃预变性5 min;94 ℃变性30 s;58 ℃退火30 s;72 ℃延伸1 min;循环33次,72 ℃终延伸10 min。
将PCR产物连接到T载体测序,正确的克隆提取质粒后用XhoI/KpnI双酶切,回收小片段,同 T4连接酶与经同种限制性内切酶双酶切并回收大片段的载体pKANNIBAL连接,得到重组克隆pKANNIBAL-LbCER1(+),转化至大肠杆菌DH5α 感受态细胞。以P3、P4为引物,进行菌落 PCR扩增检测阳性菌落。P3序列为5′-AGAAGACGTTCCAACCACG,P4序列为5′-AAAATCCATGATCGAGACTAGCTTTCC。挑取阳性菌落测序验证pKANNIBAL-LbCER1(+)质粒构建的正确性。
以含LbCER1开放阅读框的pMD-19质粒为模板,以P5、P6为引物,进行PCR扩增,得到插入片段的负向产物。P5序列为5′-TTCGAAATCGATAAGCTTAAAATCCATGATCGAGACTAGCTTTCC-3′(HindⅢ),P6序列为5′- TTAAAGCAGGACTCTAGAAGCTTACCCCTGAGGCTGCA-G-3′(XbaI)。测序验证序列正确后,提取质粒,用HindⅢ/XbaI双酶切,回收小片段,再次与经HindⅡ/XbaI双酶切并回收大片段的pKANNIBAL-LbCER1(+)质粒连接,得到重组的中间载体pKANNIBAL-LbCER1(+)-PDK intron-LbCER1(-),转化至 DH5α 感受态细胞。以P7、P8为引物,进行菌落 PCR扩增检测阳性菌落。P7为5′-CGGTAAGGATCTGAGCTACAC-3′, P8为5′-AAAATCCATGATCGAGACTAGCTT-TCC-3′。挑取阳性菌落提取质粒,用XhoI/XbaI双酶切质粒后电泳检测pKANNIBAL-LbCER1(+)-PDK intron-LbCER1(-)质粒构建的正确性。
1.3.2 植物表达载体的构建及根癌农杆菌的转化
将测序正确的pKANNIBAL-LbCER1(+)-PDK intron-LbCER1(-)质粒用NotI酶切,与经同样酶切回收的pART27 载体用T4连接酶相连,构建植物RNAi 表达载体pART27-LbCER1(+)-PDK intron-LbCER1(-)转化大肠杆菌,提质粒进行酶切验证。
用冻融法将pART27-LbCER1(+)-PDK intron-LbCER1(-)导入根癌农杆菌GV3101,阳性菌落用引物P3、P4做正向片段菌落 PCR验证。
根据扁果枸杞LbCER1基因开放阅读框序列设计RNAi最佳靶位区段长372 bp,加上设计引物时所带的酶切位点和T载体连接区域共计40 bp,PCR产物预期长度应为412 bp。电泳结果表明,在250~500 bp有明显条带(图1),符合预期结果。测序分析也证明该PCR产物序列与LbCER1基因相应序列相似度为100%。

图1 LbCER1基因RNAi靶位区段PCR扩增产物
Fig.1 PCR production of LbCER1 gene’s targeted segments for RNA interference
注:M-DNA marker(下同); 1~4泳道为PCR扩增产物
RNAi载体靶基因序列长度、位置的选择都将影响基因沉默的效率和效果。一般认为,用于RNAi的基因片段长度在200~1 000 bp 都能发挥作用。在植物中,通常构建发卡状RNA(hairpin RNA,hpRNA)所选靶序列长98~853 bp可达到较高的沉默效率,其转化植株沉默效率可达66%~100%,平均90%[10]。RNAi载体靶基因序列通常以mRNA开放阅读框区域作为设计RNAi的作用靶点,一般在基因转录起始位点下游100 bp以后[8]。本文选取的RNAi作用靶基因长372 bp,位于扁果枸杞LbCER1基因开放阅读框序列1 469~1 840 bp区段,在GenBank中经BLAST全基因组扫描及序列同源性分析表明,所选靶序列与其他基因序列没有同源性,不会引起多基因沉默。因此, RNAi载体构建设计合理,预期能对靶基因产生满意的沉默效果。
以P3、P4为引物,进行菌落 PCR检测pKANNIBAL-LbCER1(+)质粒构建结果,在500~750 bp接近500 bp处有明显条带(图2-a)。由于上游引物P3起始于CaMV 35S启动子的一部分,距离XhoI酶切位点长141 bp,因此,预期正向片段PCR扩增产物长513 bp。电泳结果符合预期,测序结果与LbCER1基因序列也一致,表明LbCER1正向片段插入正确。
以P7、P8为引物,扩增pKANNIBAL-LbCER1(+)-PDK intron-LbCER1(-)质粒中LbCER1的负向片段,由于下游引物P8终止于载体OCS terminator的一段序列,从XbaI酶切位点到引物P8长115 bp,因此预期负向片段的PCR扩增产物长487 bp。电泳结果显示,在接近500 bp处有明显条带(图2-b),符合预期结果,表明LbCER1负向片段插入正确。
XhoI/XbaI双酶切质粒pKANNIBAL-LbCER1(+)-PDK intron-LbCER1(-)质粒,电泳后,在5 000~6 000 bp、1 000~2 000 bp分别有明显的条带(图2-c)。由于pKANNIBAL空载质粒为6 063 bp,其中包含767 bp的间隔序列——丙酮酸脱氢酶激酶内含子序列(PDK intron),双酶切后的质粒片段去掉PDK intron序列,又保留了两端各4 bp的酶切位点,因此应为5 234 bp,与双酶切后电泳图中位于6 000~8 000 bp的条带相符。根据pKANNIBAL质粒序列分析,正向片段距离PDK intron为8 bp,PDK intron与反向片段之间为21 bp,因此双酶切后LbCER1(+)-PDK intron-LbCER1(-)片段预测长度为1 540 bp,也与双酶切电泳图中位于1 000~2 000 bp的条带位置相符,表明pKANNIBAL-LbCER1(+)-PDK intron-LbCER1(-)质粒构建成功。
研究表明,RNAi载体若仅含1段正向序列或其反向序列,则沉默效率仅为10%左右,但是如果载体构建成正向序列-间隔序列-列反向序列,形成hpRNA,其沉默效率可达到50%[18-19],而具有“正向序列-内含子-反向序列”的ihpRNA载体沉默效率可达到90%~100%[20]。
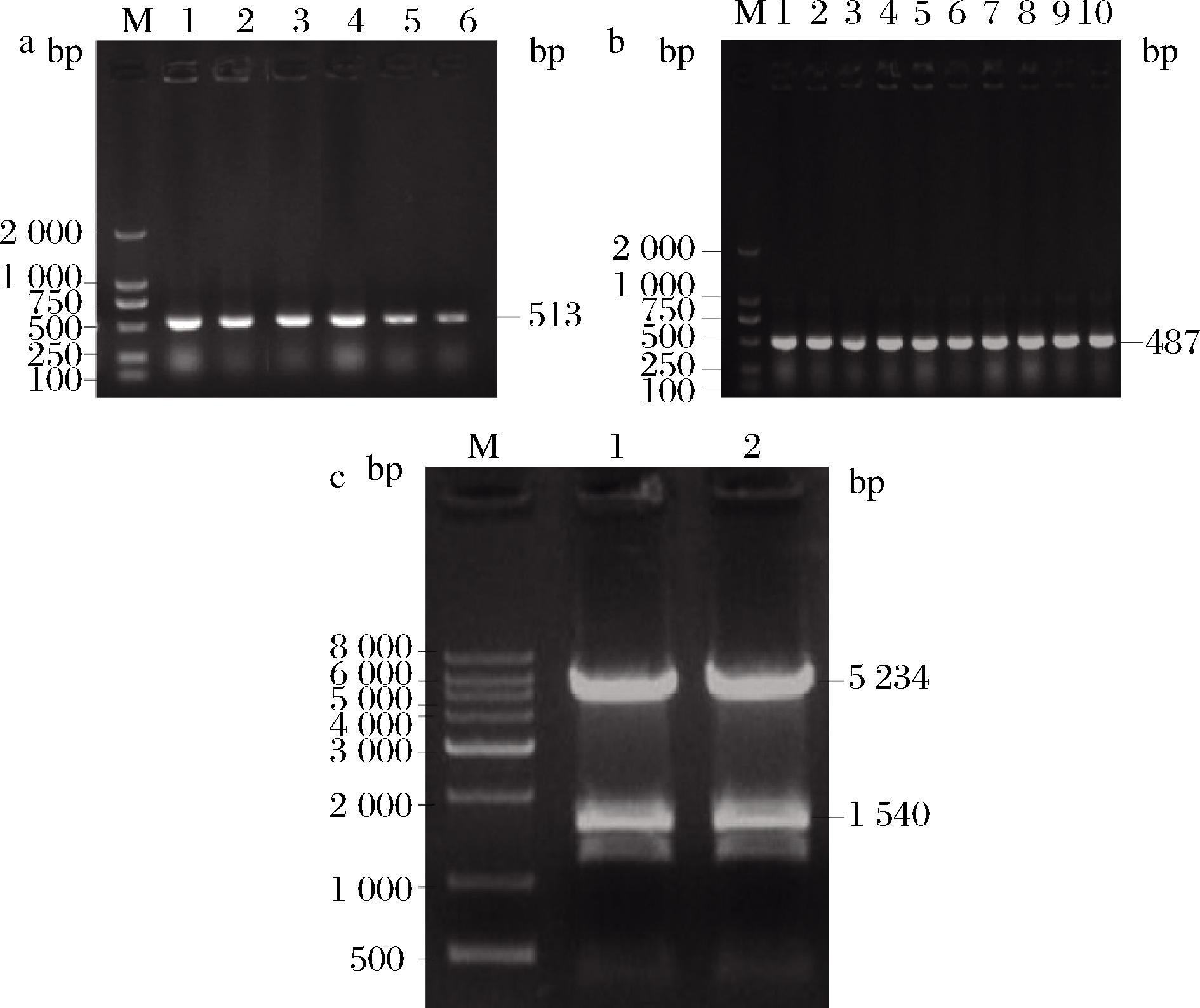
a-PCR法检测LbCER1正向片段插入pKANNIBAL载体;b-PCR法检测LbCER1反向片段插入pKANNIBAL载体;c-XhoI/XbaI双酶切法检测载体中的LbCER1(+)-PDK intron-LbCER1(-)片段
图2 RNAi中间载体的构建
Fig.2 Construction of RNAi intermediate vector
注:图a、b中1~6、1~10泳道为PCR扩增产物;图c中1、2泳道为双酶切产物
以P3、P4为引物,用菌落 PCR法检测RNAi表达载体pART27中的LbCER1正向片段,预期片段长度应为513 bp。电泳结果表明,在500~750 bp靠近500 bp的位置有明显条带(图3-a),与预测相符,表明pART27中含有LbCER1(+)-PDK intron-LbCER1(-)序列。进一步用XhoI、XbaI双酶切RNAi表达载体pART27-LbCER1(+)-PDK intron-LbCER1(-),预测大片段应为pART27质粒的线性产物,大小为11 660 bp;小片段应为LbCER1(+)-PDK intron- LbCER1(-),长度为1 540 bp。电泳检测结果表明,在8 000 bp之上、1 000~2 000 bp分别有2条明显的条带(图3-b),与预期结果符合。上述结果均表明RNAi表达载体pART27-LbCER1(+)-PDK intron-LbCER1(-)的构建正确。
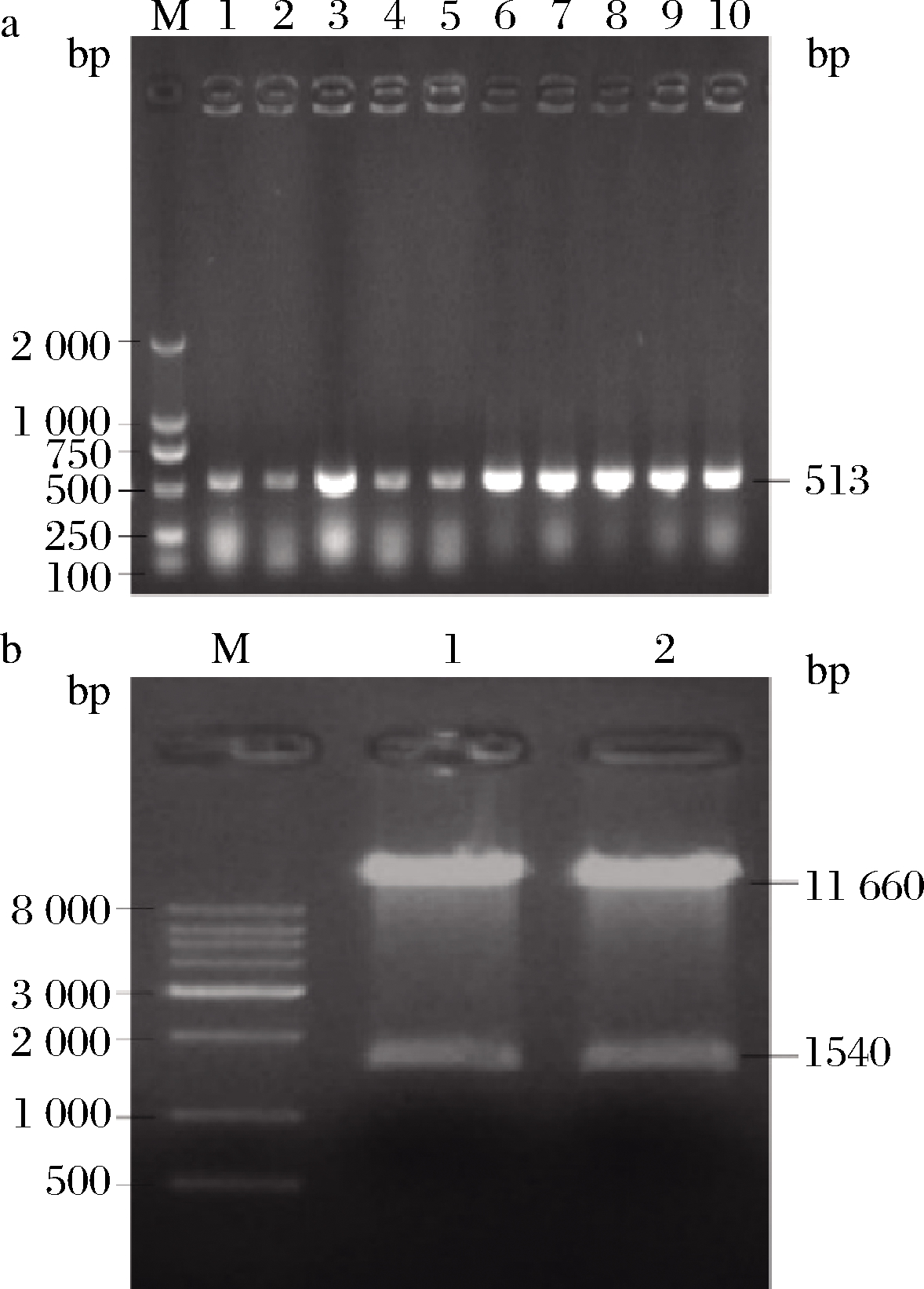
a-PCR法检测载体pART27中的LbCER1正向片段,b-XhoI、XbaI双酶切法检测pART27载体中的LbCER1(+)-PDK intron-LbCER1(-)片段
图3 PCR法和限制性内切酶酶切分析RNAi表达载体构建结果
Fig.3 PCR analysis and restriction enzyme digestion analysis of RNAi expression vector
注:图a中1~10泳道为PCR扩增产物;图b中1、2泳道为双酶切产物
以P3、P4为引物,用菌落 PCR法扩增含RNAi表达载体的根癌农杆菌GV3101菌株中的正向片段,在500~750 bp靠近500 bp的位置有明显条带(图4),与预测的513 bp相符,表明转基因根癌农杆菌GV3101菌株构建成功。
RNA干扰技术也存在不足,例如在快速繁殖的细胞中,RNAi可能不起作用[21];RNAi可能引起同源基因的沉默;siRNA和反义RNA都有可能引发基因沉默[19],因此当表型出现时,需要进一步验证;沉默效率与dsRNA的长度之间的关系不确定,一般是双链RNA的臂越短,沉默效率越低[22-24]。因此,本文构建的LbCER1-RNAi转基因根癌农杆菌株最终的沉默效果需要通过检测扁果枸杞遗传转化苗中LbCER1的表达量和表型等多方面证据证明。
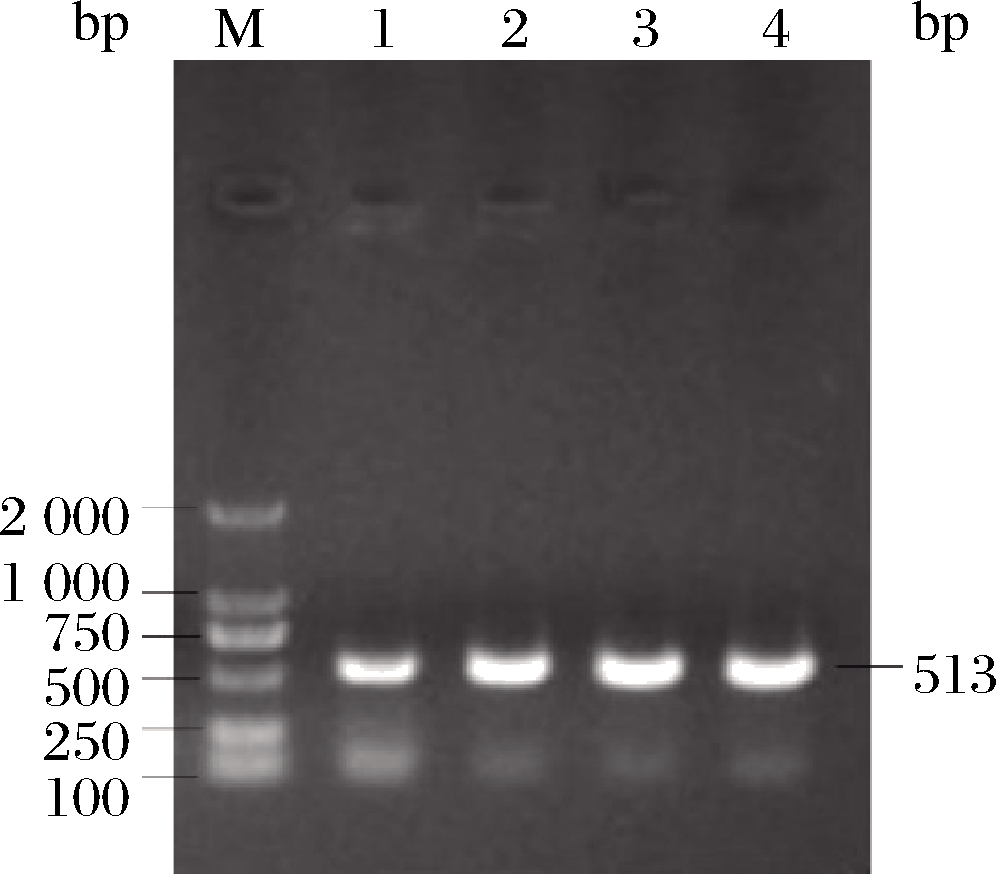
图4 PCR法鉴定含RNAi表达载体的根癌农杆菌GV3101
Fig.4 Identify Agrobacterium tumefaciens GV3101 containing RNAi expression vector by PCR
注:1~4泳道为PCR扩增产物
本文克隆了扁果枸杞LbCER1基因开放阅读框中1 469~1 840 bp区段,将其通过不同的限制性内切酶双酶切组合按正向和反向分别插入pKANNIBAL载体中PDK intron的两侧,构建了具有LbCER1(+)-PDK intron-LbCER1(-)发卡状反向重复序列的pKANNIBAL载体,并将该反向重复序列通过酶切、连接转入RNAi表达载体pART27,再用冻融法将pART27-LbCER1(+)-PDK intron-LbCER1(-)载体转化根癌农杆菌GV3101,得到含有LbCER1-RNAi质粒的根癌农杆菌GV3101菌株,为进一步鉴定CER1基因在旱生植物表皮蜡质烷烃合成过程中的功能,揭示表皮蜡质与植物保水性的关系,培育适宜干制加工的果蔬新品种奠定基础。
[1] 肖佳,高昊,周正群,等.枸杞属中枸杞红素类成分研究进展[J].科学通报, 2017,62(16):1 691-1 698.
[2] 章中.枸杞保藏加工技术现状[J].中国食物与营养,2008(5):31-33.
[3] 杨爱梅,吴古飞,杜静,等.枸杞表皮蜡质层成分及显微结构研究[J].食品工业科技,2011,32(12):112-114.
[4] BOURDENX B,BEMARD A,DOMERGUE F,et al.Overexpression of Arabidopsis ECERIFERUM1 promotes wax very-long-chain alkane biosynthesis and influences plant response to biotic and abiotic stresses[J].Plant Physiology,2011,156(1):29-45.
[5] 袁惠君,马倩国,高泽,等.扁果枸杞角质层蜡质合成相关基因LbCER1的克隆及其表达特征分析[J].华北农学报,2019,34 (5):15-22.
[6] FIRE A,XU S,MONTGOMERY M,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6 669):806-811.
[7] 马建,刘艺苓,王丕武.植物RNA干扰的研究进展[J].中国油料作物学报,2008,30(2):252-259.
[8] ELBASHIR S M,LENDECKEL W T,TUSCHL T.RNA interference is mediated by 21- and 22- nueleotide RNAs[J].Genes & Development,2001,15:188-200.
[9] KERSCHEN A,NAPOLI C A, RICHAD A,et al.Effectiveness of RNA interference in transgenic plants[J].FEBS Letters,2004,566(1-3): 223-228.
[10] WESLEY S V,HELLIWELL C A,SMITH N A,et al.Construct design for efficient effective and high-throughput gene silencing in plants[J].The Plant Journal,2001,27(6):581-590.
[11] BRUMMELKAMP T R,BERNARDS R,AGAMI R.A system for stable express ion of short interfering RNAs in marnrnalian[J].Science.2002,296(5 567):550-553.
[12] DALMAY T,HAMILTON A J,RUDD S.An RNA-dependent RNA polymerase gene in Arabidopsis is required for posttranscriptional gene silencing mediated by a transgene but not by a virus[J].Cell,2000,101(5):543-553.
[13] 陈悦,陈宁美,松布尔巴图,等.盐芥WBC11克隆与RNAi载体的构建[J].中央民族大学学报(自然科学版),2018,27 (1):89-94.
[14] 刘颖,刘国选,黄川腾,等.麻疯树JcFATA基因干涉表达载体构建和功能初步分析[J].农业生物技术学报,2018,26(5):175-186.
[15] 尹国,路正营,李世云,等.利用RNAi研究棉花SSH文库上调表达EST的功能[J].华北农学报,2018,33(1):71-79.
[16] 王益民,张珂,许飞华,等.不同品种枸杞子营养成分分析及评价[J].食品科学,2014,35(1):34-38.
[17] 袁惠君,刘轲,王春梅,等.两个宁夏枸杞品种的耐渗透胁迫和耐盐特征比较[J].草业科学,2016,33(4):681-690.
[18] LIN J H,LEVIN H L.Reverse transcription of a self-primed retro-transposon requires an RNA structure similar to the U5-IR stem-loop of retroviruses[J].Molecular and Cellular Biology,1998,18(11):6 859-6 869.
[19] HAMILTON A J,BAULCOMBE D C.A species of small antisense RNA in posttranscriptional gene silencing in plants[J].Science,1999,286(5 441):950-952.
[20] SMITH N A,SINGH S P,WANG M B.Gene expression: Total silencing by intron-spliced hairpin RNAs[J].Nature,2000,407(6 802):319-320.
[21] MITSUHARA I,SHIRASAWA-SEO N,IWAI T,et al.Release from post-transcriptional gene silencing by cell proliferation in transgenic tobacco plants: Possible mechanism for noninheritance of the silencing[J].Genetics,2002,160(1):343-352.
[22] KLAHRE U,CRETE P, LEUENBERGER S A,et al.High molecular weight RNAs and small interfering RNAs induces systemic posttranscriptional gene sileneing in plants[J].Proceedings of the National Academy of Sciences of the United States of America,2002, 99(18):11 981-11 986.
[23] HAMMOND S M,BERSTEIN E,BEACH D,et al.An RNA-directed nuclease mediates posttranscriptional gene silencing in Drosophila cells[J].Nature,2000,404:293-296.
[24] BERNSTEIN E,CAUDY A,HAMMOND S M,et al.Role for a bidentate ribonucleasein the initiation step of RNA interference[J].Nature.2001,409(6 818):363-366.