表1 包装材料参数
Table 1 Packaging material parameters

参数包装材料PA/PEPLA/PBAT厚度/μm86±2.062±2.0氧气透过率/[mL·(m2·d)-1]21.3±0.0426.6±0.07氧气透过系数/[mL·m·(m2·d·Pa)-1]0.23×10-70.17×10-7水蒸气透过率/[mL·(m2·d)-1]143.09±1.90192.26±1.90水蒸气透过系数/[g·m·(m2·d·Pa)-1]6.84×10-66.31×10-6
肉色是消费者用以判断鲜肉货架期和可接受性非常重要的指标[1],因此在冷鲜肉有氧贮藏过程中维持肉色稳定尤为重要[2]。近年来有学者研究验证了通过注射增强技术在肉中加入乳酸盐,可稳定肉的色泽[3]。目前,市场上冷却肉的主要包装形式有真空包装、托盘透氧包装和高氧气调包装[4],其中阻气性非常重要,因此塑料薄膜是肉类产品在零售期间的首选材料[5]。大多数肉品包装材料都是用聚乙烯(polyethylene,PE)、聚丙烯(polyropylene,PP)、聚对苯二甲酸乙二醇酯(polyethylene terephthalate, PET)和聚氯乙烯(polyvinyl chloride, PVC)制得,其中聚酰胺/聚乙烯(polymide polythyene,PA/PE)薄膜应用最为广泛。这些聚合物的优点包括容易实现机械化生产,生产成本低,同时这些聚合物还具有优良的阻隔性和热封性等特点。由于考虑到石油化学塑料包装材料的不可再生性与不可降解性,对环境的不利因素已成为影响这些聚合物材料发展的重要障碍,人们开始关注塑料包装材料的替代品[6],开发生物可降解材料来替代塑料包装材料,从而实现真正的绿色经济、绿色生产,解决环境可持续问题有为重要[7]。目前,可生物降解塑料聚乳酸(polylactic acid,PLA)是大众认为最具潜力的生物降解材料,因为具有的良好热塑性、可生物降解性、生物相容、高模量和良好的加工性[8]。PLA是线性脂肪族热塑性聚酯,通过乳酸的缩聚或通过乳液的缩聚产生丙交酯开环聚合,它可通过玉米、纤维素和其他多糖等再生农业来源的物质发酵合成[9]。而限制PLA材料大规模应用的重要因素是其阻气性相对较差[10],通常需添加增塑剂以增加其柔韧性和阻气性[11]。近年来一些学者对PLA进行了改性处理,将PLA与其他柔性聚合物如聚己内酯(polycaprolactone, PCL)、聚己二酸对苯二甲酸丁二酯(plybuyladpate terepthalate,PBAT)进行改性研究。其中PBAT是一种脂肪族芳香共聚酯,可完全生物降解,具有优良的延展性、断裂伸长率、热量阻力和抗冲击性,因此PBAT被认为是一种良好的韧性材料候选者[12]。李月明等[13]研究表明了PBAT和碳酸钙混合可以实现材料的快速降解,这大大节省了成本。刘燕等[14]对PLA、聚甲基乙撑碳酸酯(polymethylethylene carbonate, PPC)、PBAT三种材料共混制得的生物可降解复合膜的阻隔性和延伸性进行研究,发现其阻隔性能优于PA/PE薄膜。ALITRY等[15]研究了PLA和PBAT两种材料共混制得的生物可降解复合膜的机械特性和形态特性,发现其韧性和封口性优于PLA薄膜。
藏羊属于绵羊三大品种之一,分布区域集中分布于我国的青藏高原地区[16],由于生长在高海拔低氧环境下,藏羊肉色因其较高的肌红蛋白含量而呈深红色。肉色作为最直观的品质指标,是消费者判断肉品质的重要标准[17]。伴随着肉的货架期延长和后续加工处理,肉色稳定性变差、商业价格降低等现象是导致藏羊肉及其产品在市场上不易被消费者接受的重要原因。因此本实验以藏羊肉后腿肉为原料,结合乳酸盐注射增强技术,通过综合对比分析PLA/PBAT可降解薄膜、PA/PE薄膜2种不同包装材料对藏羊肉色稳定性的影响,探讨其对肉色稳定性的作用及对高铁肌红蛋白还原酶(methemglobin reductase,MMbR)活力的影响,以期为延缓宰后生鲜藏羊肉肉色劣变提供理论依据,为不同包装材料在肉及肉制品的实际应用提供理论参考。
新鲜藏羊后腿肉,采自甘肃临夏安多有限公司,离体后采取严格避光、隔绝空气和低温运输条件下送入实验室。除去表皮脂肪和筋膜,切成50 g左右薄厚相同的肉块,注射0.3%(质量分数)的乳酸钙,添加量为肉质量的5%。包装处理后贮藏在(4±1) ℃条件下,分别在成熟的1、3、5、7 d测定相应指标。
聚酰胺/聚乙烯(PA/PE)包装袋,郑州博利达包装有限公司;聚乳酸复合包装材料(PLA/PBAT),江苏天仁生物材料有限公司(表1)。
表1 包装材料参数
Table 1 Packaging material parameters

参数包装材料PA/PEPLA/PBAT厚度/μm86±2.062±2.0氧气透过率/[mL·(m2·d)-1]21.3±0.0426.6±0.07氧气透过系数/[mL·m·(m2·d·Pa)-1]0.23×10-70.17×10-7水蒸气透过率/[mL·(m2·d)-1]143.09±1.90192.26±1.90水蒸气透过系数/[g·m·(m2·d·Pa)-1]6.84×10-66.31×10-6
食品级乳酸钙,郑州凯之裕食品添加剂有限公司;亚铁氰化钾(分析纯)、Tris,天津市光复科技发展有限公司;NADH(分析纯),邦泰生物工程有限公司。
Konica CR-10色差计,珠海天创仪器有限公司;JY96-N高速分散器,广州格丹纳仪器有限公司;TGL-16M高速台式冷冻离心机,上海沛欧分析仪器公司;SP-756P紫外可见光分光光度计,贝克曼有限公司;PHS-3C电子天平,沃特世有限公司;CN10-JY92-2DA超声波细胞破碎机,托摩根生物技术有限公司。
1.4.1 色度值的测定
肉色采用CR-410色差计测定,CIE Lab均匀颜色空间分为L*值(亮度)、a*值(红色度)和b*值(黄色度)。将色差计测量孔对准确定待测肉表面并压紧,按下“测量”按钮,读取L*、a*、b*值。分别测定在1、3、5、7 d的L*、a*、b*值,每块肉取3个点进行测量,取平均值。
1.4.2 总色素的测定
参考KRZYWICKI的方法并略有改进[18]。准确称取5.0 g肉样,加入pH 6.8、0.04 mol/L 20 mL的缓冲液,匀浆后静置1 h,以3 300 r/min离心30 min,过滤,后用同样的缓冲液定容,在572、565、545、525 nm处测定其吸光度值。氧合肌红蛋白(oxymyoglobin,OMb)和高铁肌红蛋白(methemoglobin,MMb)含量的计算公式如公式(1)和公式(2)所示:
OMb含量/%=(0.882R1-1.267R2+0.809R3-0.361)×100
(1)
MMb含量/%=(-2.514R1+0.777R2+0.800R3+1.098)×100
(2)
式中:R1、R2、R3分别是吸光率比值A572/A525、A565/A525、A545/A525。
1.4.3 烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)浓度的测定
采用来自科铭生物有限公司的试剂盒,操作流程如下:准确称取0.1 g的肉样,离心力为600×g的条件下离心5 min,过滤上清液,在1 100×g的条件下离心10 min,取沉淀,按照说明加入相应试剂,超声波进行破碎,功率为20%,超声时间为3 s,间隔10 s,重复25次,所有的操作都在4 ℃下完成。在600 nm处以蒸馏水调零,按照操作说明加入相应试剂,最后测定其在20 s和80 s处的吸光度值,并计算。
1.4.4 高铁肌红蛋白还原酶(methemoglobin reductase,,MMbR)活力的测定
(1)粗酶液的制备
参照REDDY等的方法并略有改进[19]。取肉样10.0 g,加入2.0 mmol/L,pH 7.0的磷酸缓冲液20 mL,冰浴匀浆2 min,均质2 min,在10 000 r/min的条件下离心20 min,用中性定性滤纸过滤得到上清液,上清液用铁氰化钾氧化后,用缓冲液进行透析,时间为24 h,期间要换液5次,透析后在12 000 r/min的条件下离心20 min,并用相同缓冲液定容20 mL,贮存在-80 ℃条件下备用。
(2)高铁肌红蛋白标准液的制备
用2.0 mmol/L pH 7.0的磷酸缓冲溶液溶解肌红蛋白标品,并加入铁氰化钾进行氧化,在4 ℃下先用蒸馏水透析,后用相同缓冲液透析使其高铁肌红蛋白的浓度缩至0.75 mmol/L。将制备好的高铁肌红蛋白溶液在50 ℃下水浴加热5 min,过程中要防止高铁肌红蛋白酶失去活性。
(3)MMbR活力的测定
配制MMbR反应体系,成分如表2所示。
表2 高铁肌红蛋白还原酶活性测定的反应组分
Table 2 Reaction substances of yak meat metmyoglobin reductase activity

反应物浓度/(mmol·L-1)体积/mLEDTA5.000.10磷酸缓冲液(pH7.0)50.000.10K4Fe(CN)63.000.10去离子蒸馏水/0.10aMetMb标准液0.750.20MetMbR酶液/0.60NADH2.00.20总计/1.4
注:a为50 ℃水浴,保温10 min,重复样本(平行样)∶n=3
1.4.5 乳酸脱氢酶(lactate dehydrogense,LDH)活性的测定
采用来自科铭生物有限公司的试剂盒,操作步骤如下:准确称取0.5 g肉样,加入5 mL的提取液,冰浴匀浆,后在离心力为8 000×g的条件下离心10 min,按照操作说明顺序加入相应试剂,在室温下静置3 min,在450 nm处测定其吸光度值并计算。
1.4.6 线粒体膜电位的测定
线粒体膜电位的测定使用试剂盒,其操作步骤如下:
(1)工作液的配制:每50~100万个细胞悬浮需要0.5 mL JC-1染色溶液,JC-1染色溶液的配制参考操作说明进行。
(2)线粒体膜电位的测定:用荧光光谱仪直接混合扫描,按照说明书进行参数设定进行测定。
1.4.7 线粒体膜通透性的测定
参考LANARI等方法并略有改进[20]。首先称取剔除脂肪和筋膜的肌肉组织10.0 g,用250 mmol/L蔗糖洗涤组织2次并悬浮于60 mL线粒体分离缓冲液中(250 mmol/L 蔗糖、10 mmol/L Tris-HCl、1mmol/L EDTA,pH 7.4),匀浆,使其pH保持在7.0~7.2。后用线粒体分离缓冲液将悬浮液稀释至300 mL,以900×g的离心力离心20 min,得到的上清液再次在14 000×g条件下离心15 min,最后将线粒体沉淀洗涤2次悬浮于线粒体悬浮缓冲液(250 mmol/L蔗糖、10 mmol/L Tris-HCl,pH 7.4)中,所有步骤均在0~4 ℃下进行。
参照HALSTRAP等方法并略有改进[21]。在520 nm(A520)处测量其吸光度值,并且根据A520改变表示线粒体膜通透性的变化。如果溶液的吸光度值A520降低,说明线粒体膜的渗透性增加;若吸光度值A520增加,则线粒体膜通透性降低。
本试验除特殊说明外,所有指标测定均重复3次,结果以平均值±标准差形式表示。所有试验数据使用Excel进行处理,采用SPSS 19.0软件对测定指标进行统计分析。
由表3可知,2个处理组的L*值随冷藏时间的延长呈先上升后下降的趋势,其中在冷藏的3~7 d,PLA/PBAT包装组与对照组的差异显著(P<0.05),而PA/PE包装组与对照组的差异不显著(P>0.05)。A*值在冷藏期内呈逐渐下降的趋势,这主要是由于宰后肌肉随着氧分压的增大,氧合肌红蛋白被进一步氧化成高铁肌红蛋白所致。其中在3~7 d时,PLA/PBAT包装组与对照组差异显著(P<0.05)。3种处理组的b*都随时间的延长逐渐上升,PLA/PBAT包装组、PA/PE包装组和对照组分别增加了28%、29%和35%。
表3 乳酸钙注射增强结合不同包装材料对冷却藏羊肉色度值的影响
Table 3 Effect of calcium lactate injection combined with different packaging materials on the color value of chilled Tibetan mutton
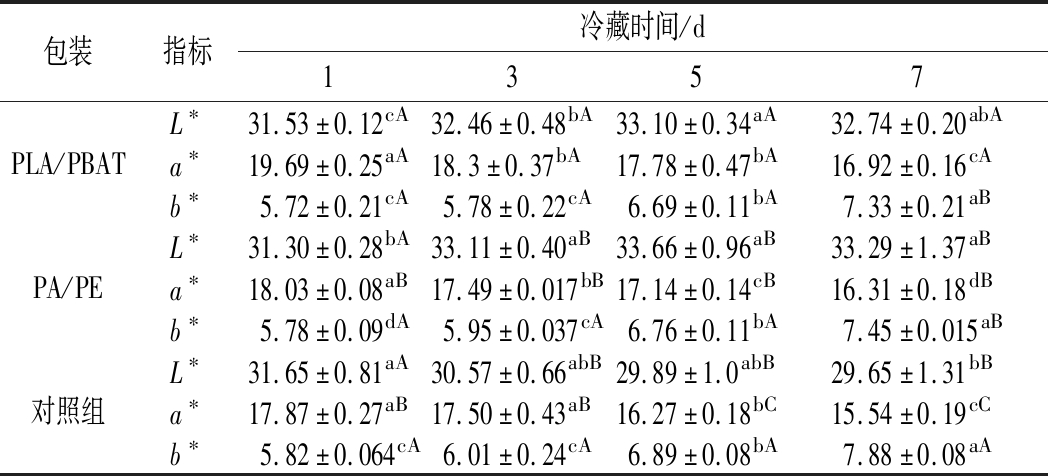
包装指标冷藏时间/d1357L∗31.53±0.12cA32.46±0.48bA33.10±0.34aA32.74±0.20abAPLA/PBATa∗19.69±0.25aA18.3±0.37bA17.78±0.47bA16.92±0.16cAb∗5.72±0.21cA5.78±0.22cA6.69±0.11bA7.33±0.21aBL∗31.30±0.28bA33.11±0.40aB33.66±0.96aB33.29±1.37aBPA/PEa∗18.03±0.08aB17.49±0.017bB17.14±0.14cB16.31±0.18dBb∗5.78±0.09dA5.95±0.037cA6.76±0.11bA7.45±0.015aBL∗31.65±0.81aA30.57±0.66abB29.89±1.0abB29.65±1.31bB对照组a∗17.87±0.27aB17.50±0.43aB16.27±0.18bC15.54±0.19cCb∗5.82±0.064cA6.01±0.24cA6.89±0.08bA7.88±0.08aA
注:不同字母(a~d)表示冷藏期内差异显著 (P<0.05),不同字母(A~C)表示不同处理组之间的差异显著(P<0.05)
冷却肉色泽显著影响消费者的购买决定[22]。而氧合肌红蛋白含量决定这消费者所需的鲜肉的健康颜色。如图1所示,3个包装组OMb的相对含量均随冷藏时间的延长而降低,这是由于随着冷藏时间的延长,氧分子的渗透量增多,血红素辅基内的还原态铁离子被逐渐氧化成氧化态铁离子,从而引起冷却肉的色泽劣变。其中PLA/PBAT包装组的OMb相对含量在1~5 d下降缓慢,在5~7 d下降变快,而无包装处理组的氧合肌红蛋白在1~3 d呈现大幅下降。且由图1可知,PLA/PBAT包装处理组合PA/PE包装处理组的氧合肌红蛋白相对含量显著高于未包装组(P<0.05),在第7天时2个包装处理组的差异显著(P>0.05)。
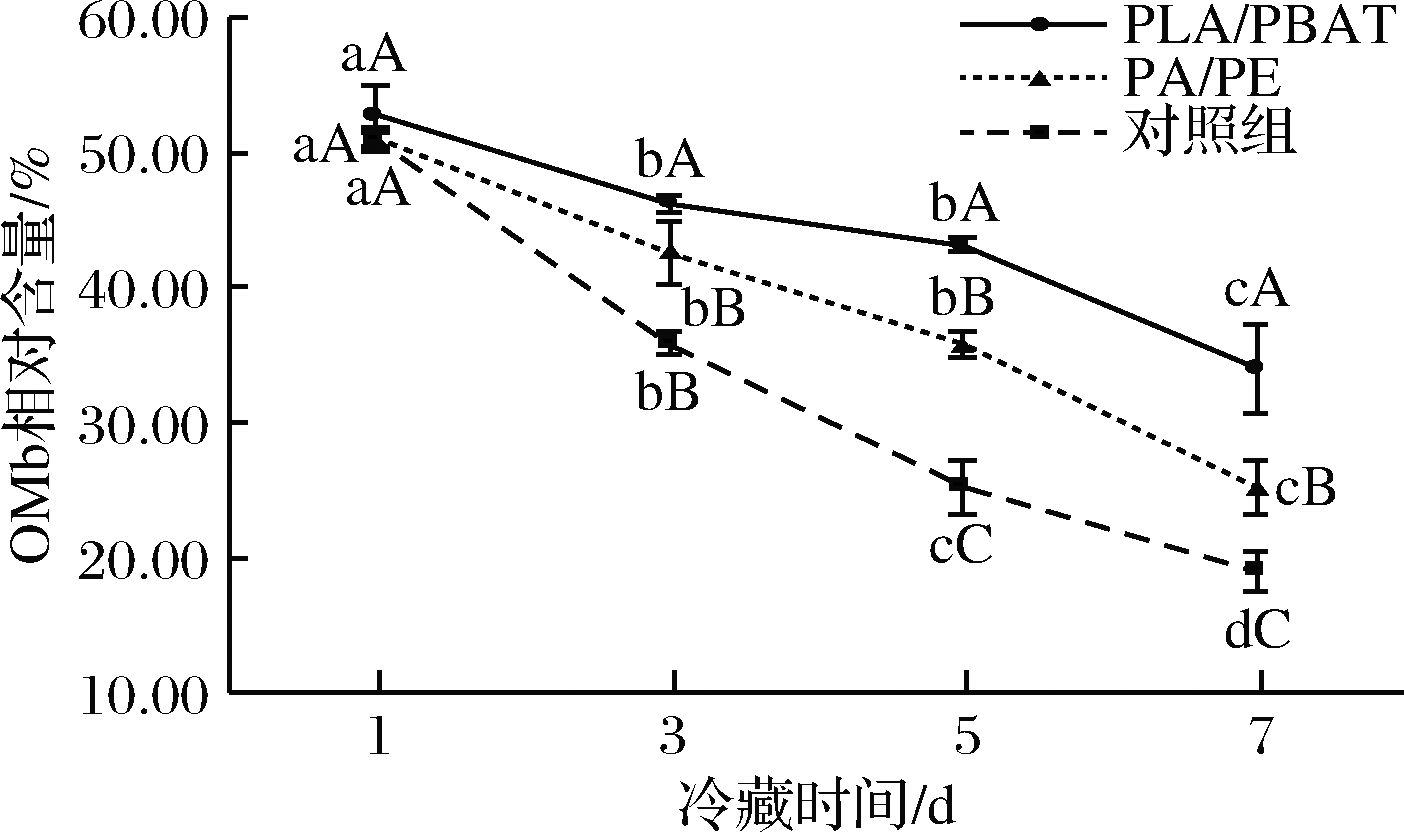
图1 乳酸钙注射增强结合不同包装材料对氧合肌红蛋白相对含量的影响
Fig.1 Effect of calcium lactate injection combined with different packaging materials on the relative contents of oxygen and myoglobin
注:不同字母(a~d)表示冷藏期内差异显著(P<0.05),不同字母(A~C)表示不同处理组之间的差异显著(P<0.05)(下同)
MMb相对含量的逐渐增加,是引起鲜肉色泽劣变的主要原因。如图2所示,3个处理组肉样的MMb相对含量都是随冷藏时间的延长而逐渐增加的。其中PLA/PBAT包装组的MMb相对含量在1~5 d上升缓慢,在5~7 d上升加快,而对照组的MMb在3~5 d呈现大幅上升。RIORDAN报道称[23], MMb含量和消费者的选择可能性之间存在显著的负相关,当MMb的相对含量高于60%时,鲜肉色泽已不能被消费者接受。由图2可知,对照组的MMb的相对含量在冷藏第7天时高达67.15%,由此可见,此时的冷却肉已不能被大众所接受。此外,PLA/PBAT包装的MMb相对含量在冷藏期间显著低于PA/PE包装组(P<0.05)。本试验研究结果表明,随着冷藏时间的延长,OMb的相对含量逐渐降低,而MMb的相对含量逐渐增加,这主要是由于随着氧气的渗透量增加,肌肉中的OMb被氧化为MMb,亚铁离子被氧化成高铁离子,肌肉的颜色发生劣变,冷却肉品质逐渐劣化。由此说明相对于PA/PE包装组,PLA/PBAT包装组的阻隔性更好,其很好地阻隔氧气的渗透,从而延缓MMb生成速率。
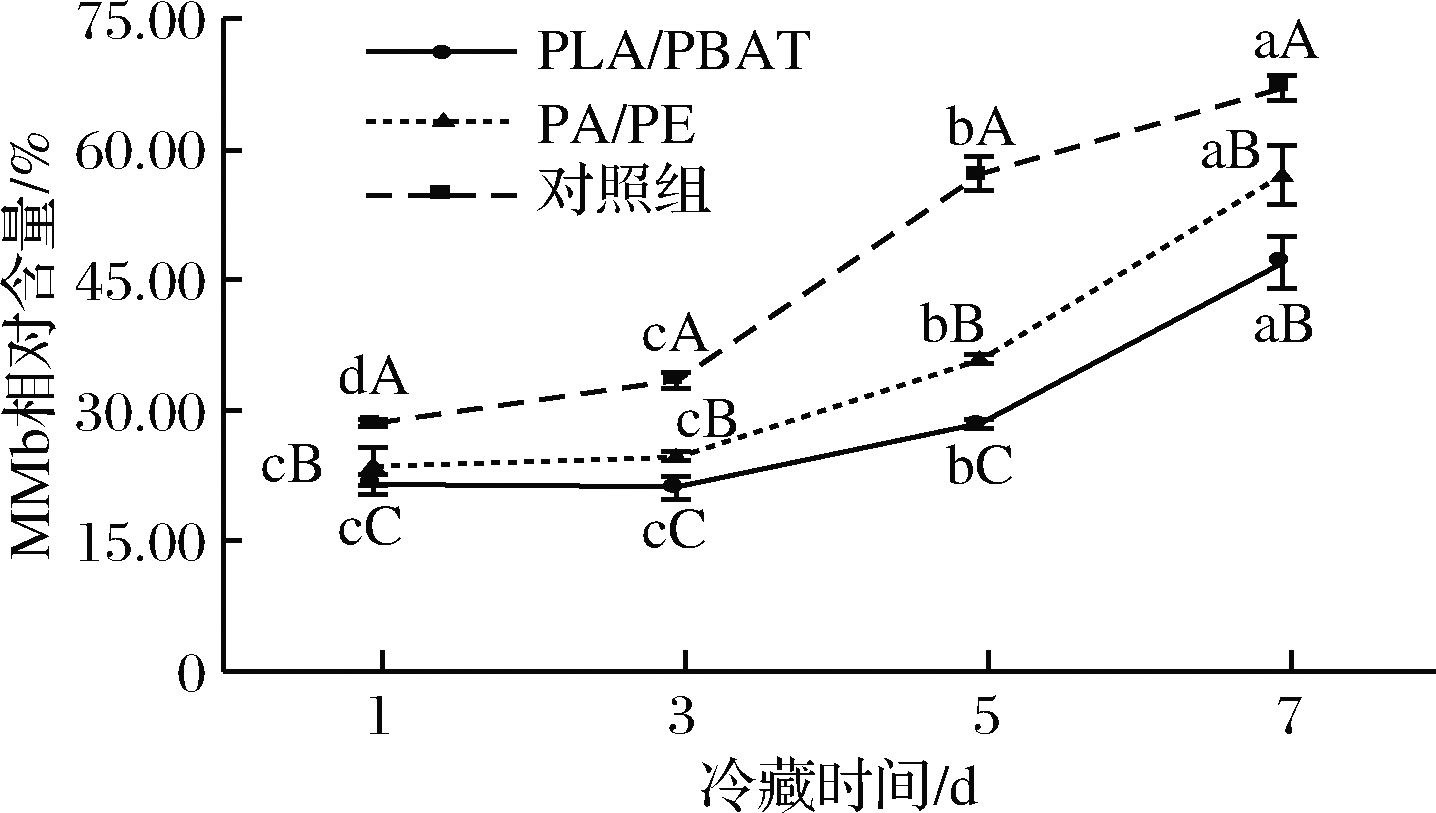
图2 乳酸钙注射增强结合不同包装材料对高铁肌红蛋白相对含量的影响
Fig.2 Effect of calcium lactate injection combined with different packaging materials on the relative content of metmyoglobin
肉中的MMb还原主要是由于发生以NADH为辅酶的酶促和非酶促反应,也就是说NADH是限制MMb还原的关键[24]。宰后肌肉代谢的限制因素可能是缺乏足够的底物而不是酶,而乳酸盐可以充当这个补充剂[25]。WATTS等[26]研究发现为肌肉提供充足的乳酸和LDH,其中氢离子可能通过LDH从乳酸转移到NAD+,将NAD+还原为NADH,从而加快MMb的还原速率。由图3可知,3种处理的NADH浓度随冷藏时间的延长逐渐降低,其中2种不同包装处理组的NADH浓度都在1~5 d下降较快,在5~7 d下降速度降低,在第7天时2种包装处理组的差异不显著(P>0.05)。冷藏结束与开始相比较PLA/PBAT、PA/PE和对照组分别下降了58%、60%、76%。其中PLA/PBAT包装组的NADH浓度显著高于对照组(P<0.05)。因此PLA/PBAT包装膜相对于PA/PE包装膜和对照组可以很好地延缓NADH浓度的降低,达到稳定肉色的目的。
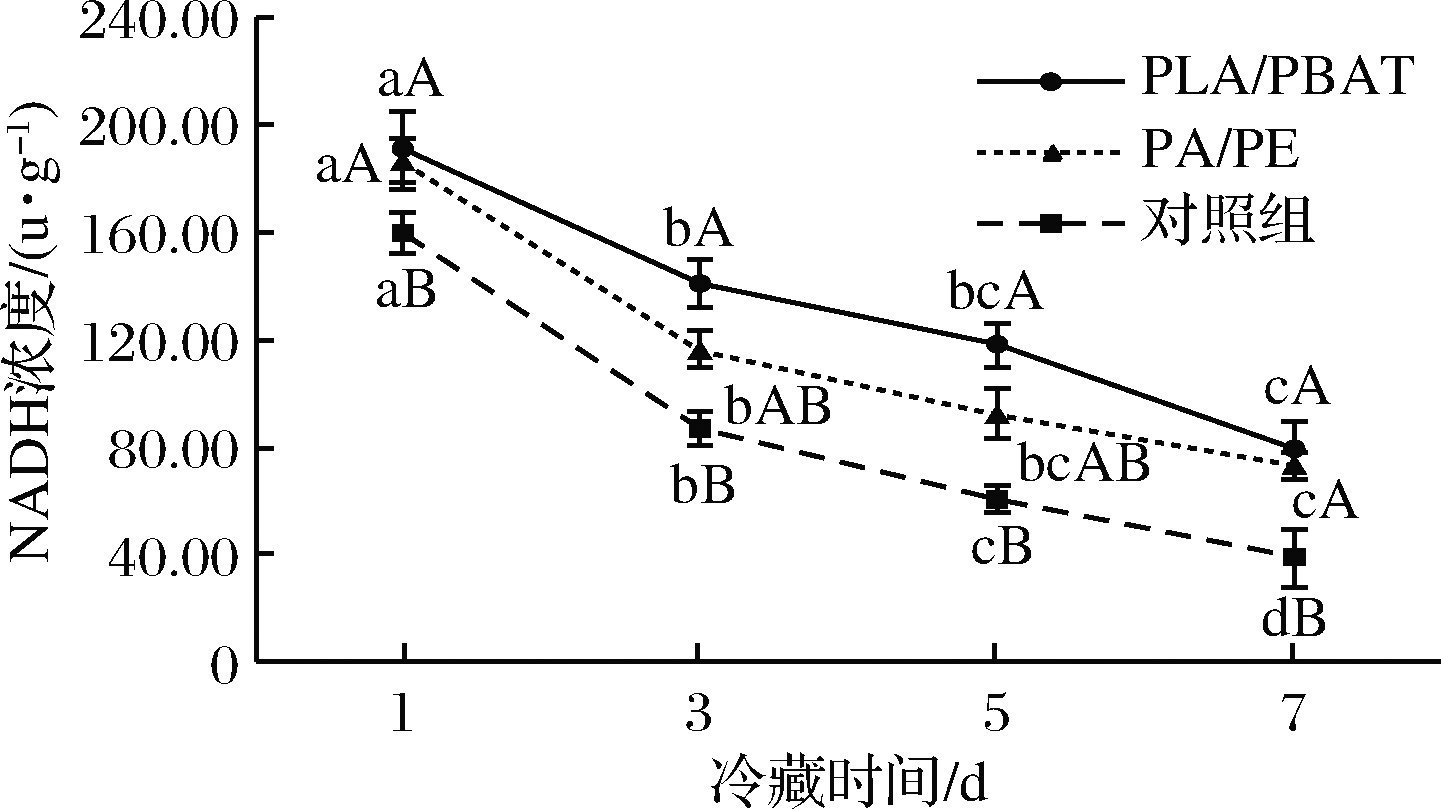
图3 乳酸钙注射增强结合不同包装材料对NADH浓度的影响
Fig.3 Effect of calcium lactate injection combined with different packaging materials on NADH concentration
MMbR系统是影响MMb还原的因素之一,这些酶系统主要是MMbR。MMbR不是单独的一种酶类,而是一类与肉色有关酶类的统称。LEDWARD等[27]认为MMbR是影响牛肉表面形成MMb速度的主要因素,是控制牛肉中MMb积累速率最重要的内在因素,同时他也发现不同肌肉的MMbR活性与肌肉颜色的差异具有高度的相关性。由图4可知,2种包装处理组的MMbR活力随冷藏时间的延长呈下降趋势,MMbR活力在1~5 d下降迅速,在第5天后下降缓慢,且对照组与PLA/PBAT包装组和PA/PE包装组具有显著的差异性(P<0.05)。这同MANCINI等[28]学者的研究结果基本一致。而本文中MMbR活性略高一方面可能是由于本试验注射了乳酸盐,其作为补充剂提高了还原氢的浓度,进而提高了冷却肉的MMb还原能力,另一方面MMbR主要位于线粒体内膜上,而肌肉中线粒体结构会随着冷藏时间的延长受到一定的破坏,其在一定程度上影响着MMbR活力。
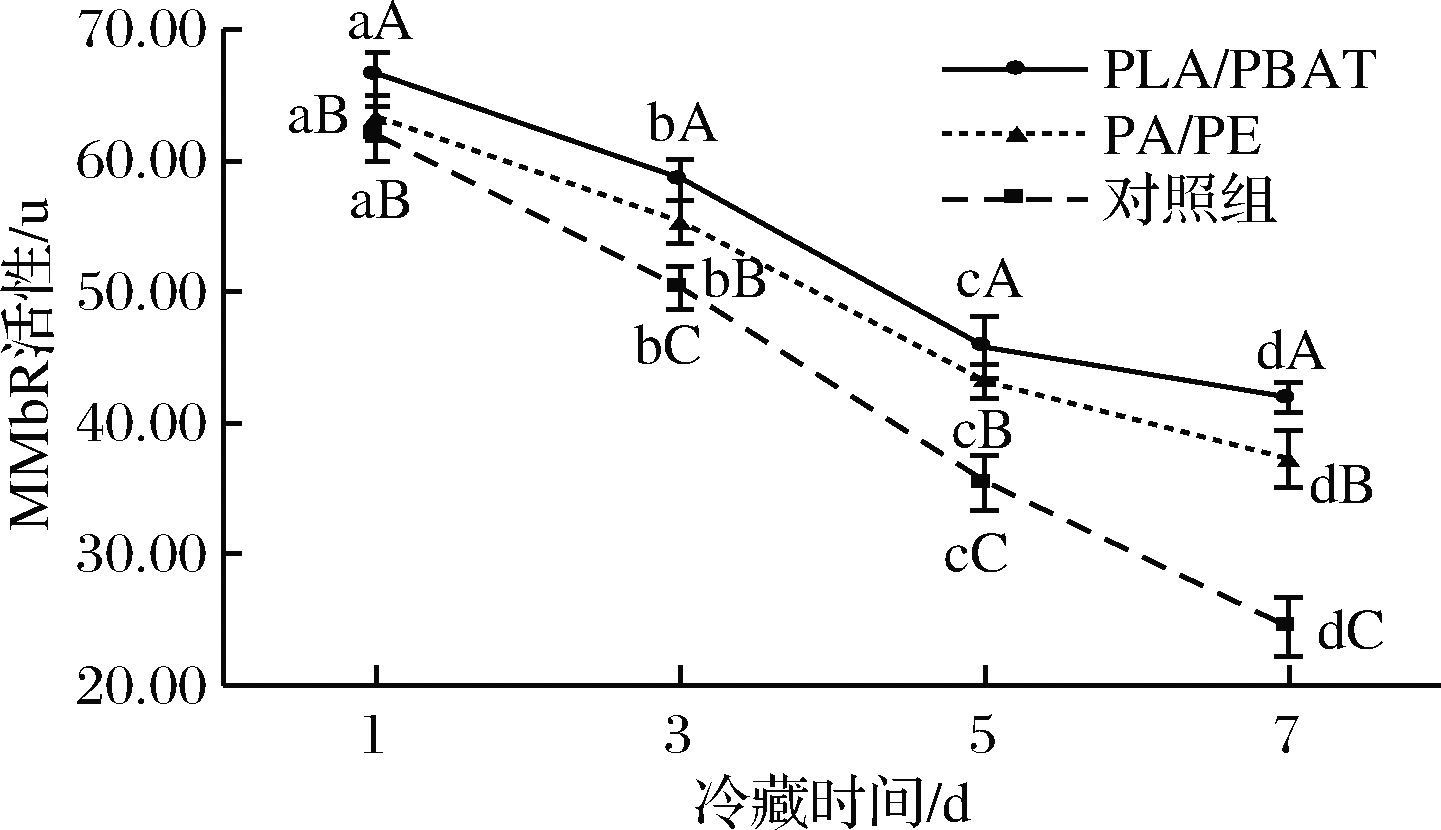
图4 乳酸钙注射增强结合不同包装材料对高铁肌红蛋白还原酶活力的影响
Fig.4 Effect of calcium lactate injection combined with different packaging materials on high iron myoglobin reductase
LDH又称NAD+氧化酶,是脱氢酶中研究较多的酶类,因为糖酵解过程的丙酮酸要在此酶的作用下生成乳酸,所以其在糖代谢过程中发挥着重要的作用。不同肌肉可以通过不同的NADH补充率来调节LDH活性[29],也可通过LDH影响高铁肌红蛋白的还原速率来补充NADH[28],从而有助于肉色稳定性的维持。如图5所示,3个包装处理组肉样的LDH活力随贮藏时间的延长而呈逐渐下降的趋势,此变化趋势与NADH的变化趋势一致。其中PLA/PBAT包装组在1~3 d下降缓慢,3~7 d下降变快,而对照组在1~3 d呈现大幅下降,在第7天时对照组的LDH活力最低,为5.82 mol/(min·g)。在冷藏的7 d内PLA/PBAT包装组的LDH活性与对照组具有显著的差异性(P<0.05)。通过3种处理的比较,发现PLA/PBAT包装膜能很好地延缓LDH活力的下降速度,保持鲜肉的色泽,这与刘金鑫的研究结果基本一致[30]。
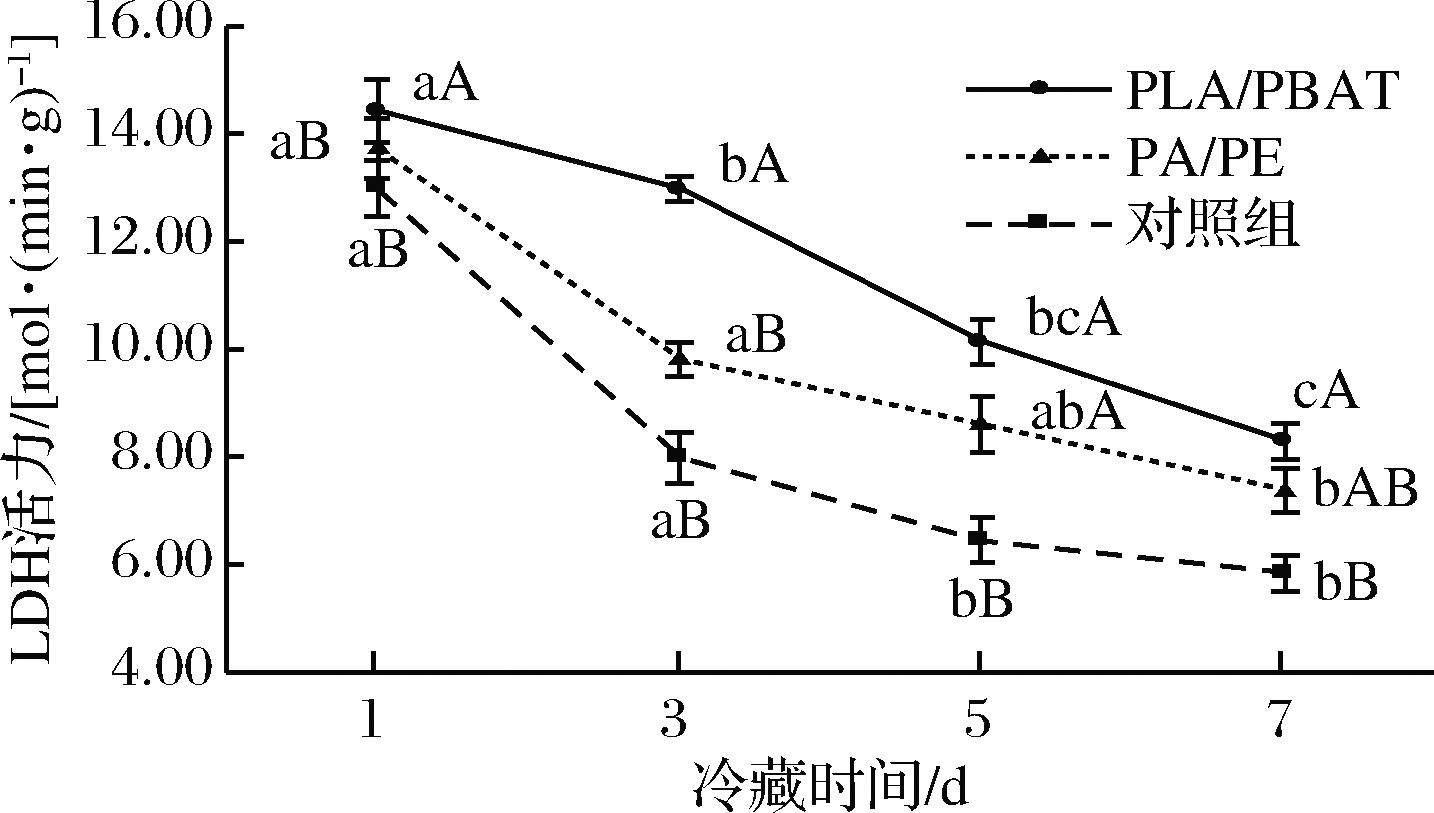
图5 乳酸钙注射增强结合不同包装材料对乳酸脱氢酶活力的影响
Fig.5 Effect of calcium lactate injection combined with different packaging materials on the activity of lactate dehydrogenase
线粒体渗透转换孔的大量开启,造成线粒体内分子质量低于1.5 kDa的溶质通透性突然暴增,内膜上的质子泵可以将基质内质子通过通道运输到外室,此时内膜内外的离子就会分布不均匀,形成了线粒体的膜电位。线粒体膜电位是线粒体具有正常生理功能的典型特征,当线粒体受到严重损伤时,线粒体膜电位会消失,线粒体内部的正常代谢会被干扰,其上所存在的还原酶系也会受到影响,当然与此同时线粒体的氧消耗也会降低[31]。随冷藏时间的延长,线粒体膜电位易发生崩解。如图6所示,随冷藏时间的延长,线粒体膜电位会发生崩解而逐渐降低,其中3种处理的线粒体膜电位都在1~3 d大幅下降,其中PLA/PBAT包装处理和对照组的线粒体膜电位在第7天时分别为0.43和0.35,与第1天相比下降了61.7%和68%。
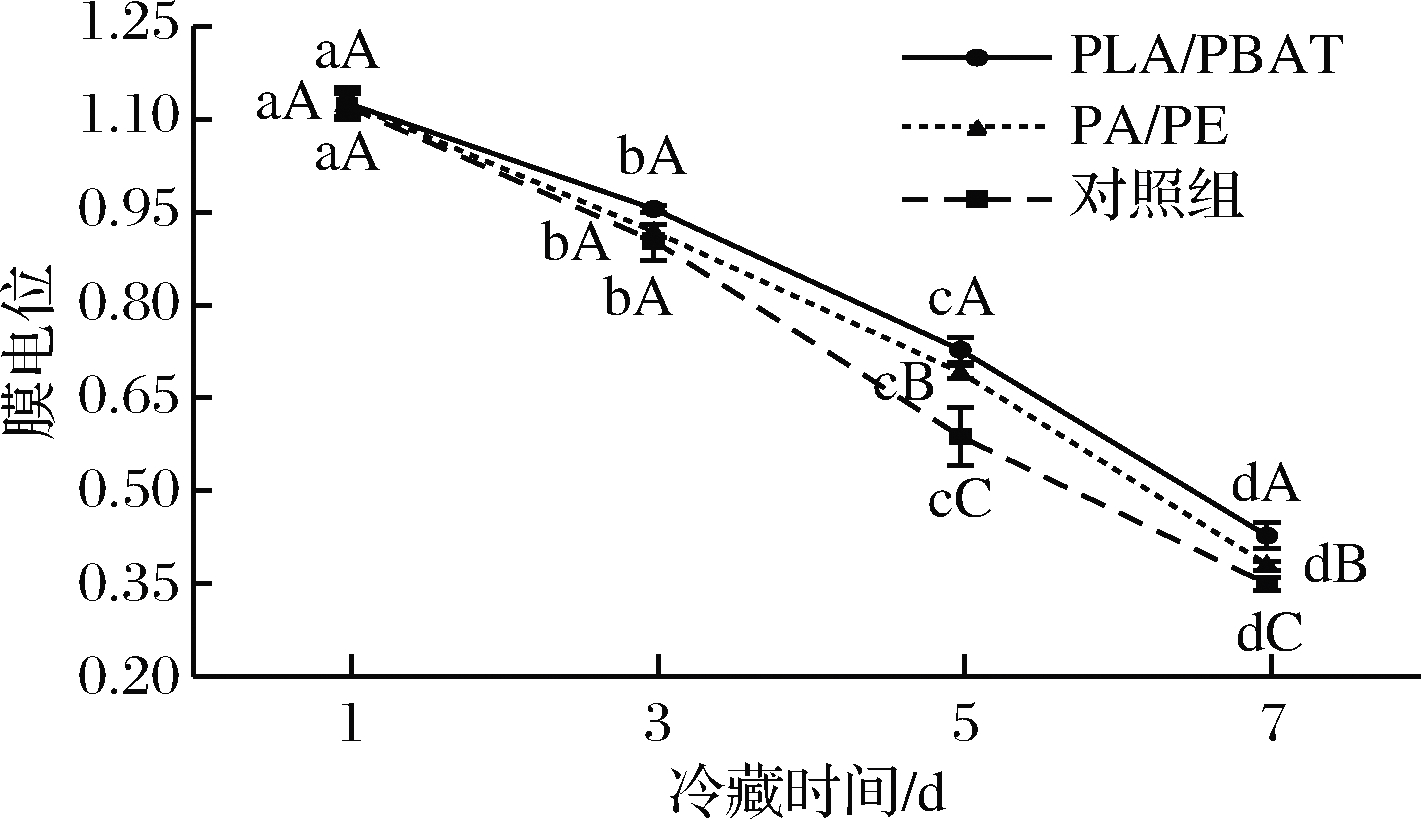
图6 乳酸钙注射增强结合不同包装材料对线粒体膜电位的影响
Fig.6 Effect of calcium lactate injection combined with different packaging materials on mitochondrial membrane potential
肌肉宰后由于线粒体通透性转换孔的打开,线粒体内膜的通透性会随着通透性转换孔的开放而不断地上升,内膜中的氢离子梯度也会因线粒体膜通透性的开放出现失常的现象。线粒体膜通透性随着冷藏时间的延长逐渐降低,这主要由于宰后肌肉中产生较多自由基,产生的自由基会造成线粒体膜电位逐渐消失,线粒体膜通透性和完整性也会发生不可逆的损伤。由图7可知,3种处理的线粒体膜通透性在冷藏期间呈下降趋势。线粒体膜通透性在1~3 d下降缓慢,5 d后线粒体膜通透性下降速度加快,且PLA/PBAT包装组的线粒体膜通透性显著高于PA/PE包装组(P<0.05),通过本实验测定发现,3种处理的线粒体膜电位和膜通透性在冷藏期间均呈现下降趋势,其中PLA/PBAT的下降速度低于PA/PE包装组低于对照组,说明PLA/PBAT包装组中的线粒体结构保持的相对较为完整,其所上存在的酶系和电子传递链相对完整,可以较好地稳定冷却肉的色泽,增加颜色稳定性。
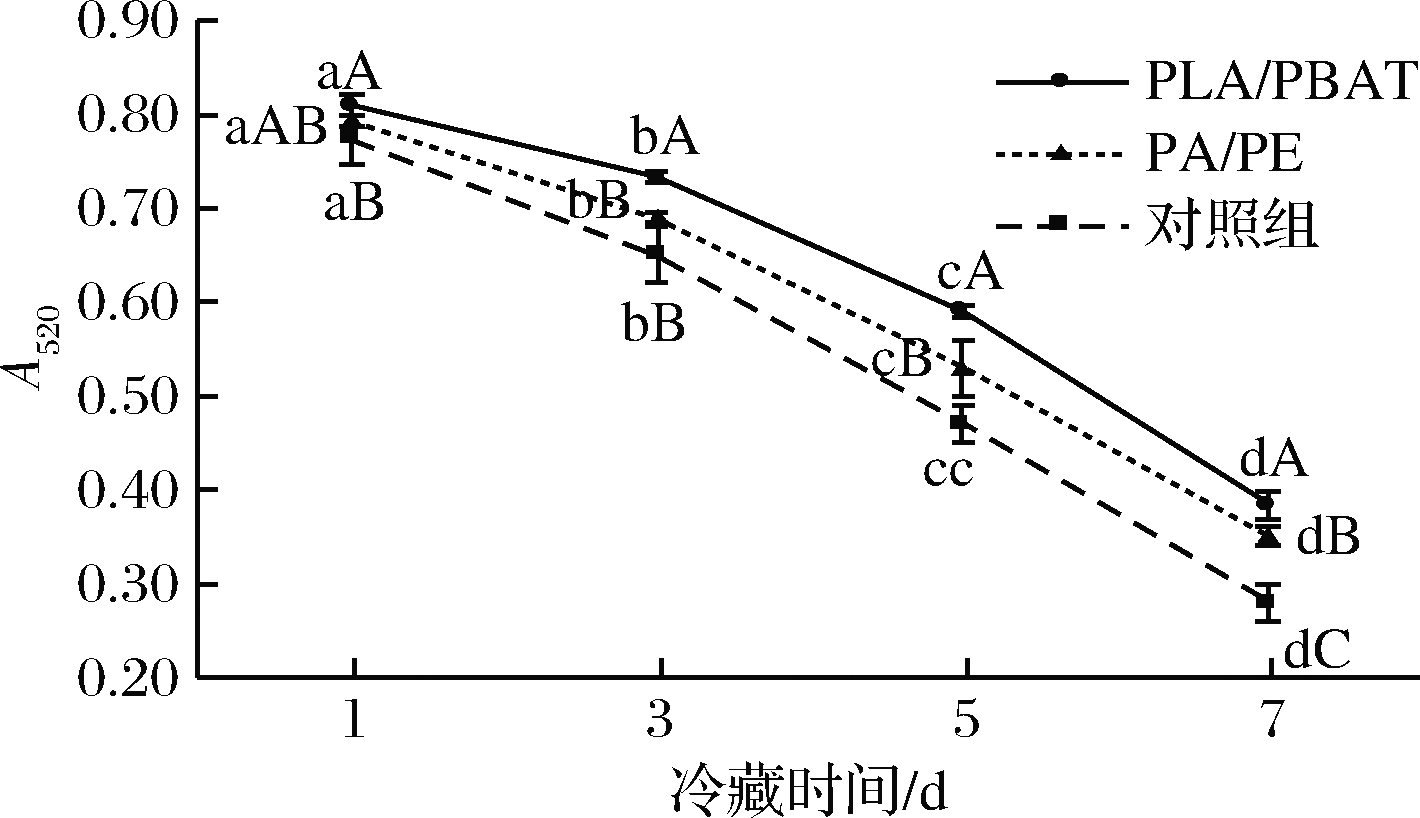
图7 乳酸钙注射增强结合不同包装材料对线粒体膜通透性的影响
Fig.7 Effect of calcium lactate injection combined with different packaging materials on mitochondrial membrane permeability
在乳酸钙注射增强的条件下,通过用不同包装材料包装藏羊后腿肉,经过1~7 d的贮藏,发现冷藏期间PLA/PBAT包装组的L*值随冷藏时间的延长呈先上升后下降的趋势且与对照组差异显著(P<0.05),3种处理组的a*值在冷藏期内呈逐渐下降的趋势,b*值都随时间的延长逐渐上升。MMbR活力降低速度明显低于其他2组,而PLA/PBAT包装膜的OMb相对含量、NADH含量和LDH活力高于PA/PE组,而MMb相对含量低于PA/PE组。随着贮藏时间的延长,PLA/PBAT包装组的线粒体膜电位和膜通透性下降速度均显著小于PA/PE组(P<0.05)。从整个实验结果来看,PLA/PBAT包装膜较于PA/PE具有高阻隔性,更有效地减少MMb的积累量,且减缓线粒体生理结构的损失速度,对保持冷却肉色稳定的作用最明显,使藏羊肉具有较好的色泽,易于被消费者接受,适合藏羊肉的贮藏。
[1] FAUSTMAN C, CASSENS R G. The biochemical basis for discolouration in fresh meat: A review[J]. Journal of Muscle Foods, 1990,1: 217-243.
[2] RENERRE M, LABAS R. Biochemical factors influencing metmyoglobin formation in beef muscles[J]. Meat Science, 1987, 19(2): 151-165.
[3] RENERRE M. Review: Factors involved in the discoloration of beef meat[J]. International Journal of Food Science and Technology, 1990, 25(6): 613-630.
[4] 扶庆权, 刘瑞. 不同包装方式下蛋白质氧化对鲜肉品质的影响研究进展[J]. 肉类研究, 2019, 33(4): 49-54.
[5] 李焕荣, 逄焕明, 朱正兰,等.软包装材料对鲜羊肉品质的影响[J]. 食品与机械, 2010, 26(4), 91-94.
[6] 房越.希悦尔公司冷鲜肉包装市场分析及营销策略研究[D].上海:华东理工大学, 2014.
[7] LEE K T, YOON C S. Storage and quality characteristics of vacuum-packaged fresh meat with oxygen barrier second-heat-seal film or shrink film[J]. Korean Journal for Food Science of Animal Resources, 2001,21(24): 235-245.
[8] CILL C O.Extending the storage life of raw chilled meats[J].Meat Science, 2016,43(43): 99-109.
[9] GARLOTTA D. A literature review of poly(lactic acid)[J].Journal of Polymers & the Environment, 2001, 9(2): 63-84.
[10] SHIVE M S, ANDERSON J M. Biodegradation and biocompatibility of PLA and PLGA microspheres[J]. Advanced Drug Delivery Reviews, 2012,64(3): 72-82.
[11] KULINSKI Z, PIORKOWSKA E, GADZINOWSKA K, et al. Plasticization of polywith poly(propylene glycol)[J]. Biomacromolecules, 2006, 7(7):2 128-2 135.
[12] LEDWARD D A.Recent advances in the chemistry of meat[J].Food Chemistry,1984,15(4):315-316.
[13] 李月明,刘飞,姜雪晶,等. 生物可降解膜在肉品保鲜中的应用研究进展[J].肉类研究, 2017,31(6):51-54.
[14] 刘燕, 姜文慧, 吴姝宓,等.可降解包装材料对冷鲜驼肉品质的影响[J]. 食品科技, 2017(1):146-151.
[15] ALITRY R, LAMNAWAR K, MAAZOUZ A. Rheological, morphological, and interfacial properties of compatibilized PLA/PBAT blends[J]. Rheologica Acta, 2014, 53(7):501-517.
[16] 张楠, 朱子雄. 永昌蘑菇羊与甘南藏羊肉品质比较[J].食品工业科技, 2018, 39(6):82-85;101.
[17] 段虎, 王祎娟, 马汉军. 超高压处理对肉及肉制品食用品质的影响[J]. 食品与机械, 2012, 27(1): 151-154.
[18] KRZYWICKI K. The determination of haem pigments in meat[J]. Meat Science, 1982,7(1): 29-36.
[19] REDDY I M, CARPENTER C E. Determination of metmyoglobin reductase activity in bovine skeletal muscles[J].Journal of Food Science, 1991, 56(5): 1 161-1 164.
[20] LANARI M C, CASSENS R G, SCHAEFER D M, et al. Dietary Vitamin E enhances color and display life of frozen beef from holstein steers[J]. Journal of Food Science, 1993, 58(4):4.
[21] HALESTRAP A P, CLARKE S J, JAVADOV S A. Mitochondrial permeability transition pore opening during myocardial reperfusion—a target for cardioprotection[J]. Cardiovascular Research, 2004, 61(3): 372-385.
[22] LIVINGSTON S, EWEN M, DECAPRIO J A, et al. The transcription factor E2F interacts with the retinoblastoma product and a p107-cyclin A complex in a cell cycle-regulated manner[J]. Cell, 1992, 68(1):157-166.
[23] RIORDAN D C, DUFFY G, SHERIDAN J J, et al.Effects of acid adaptation, product pH, and heating on survival of Escherichia coli O157:H7 in pepperoni[J].Applied and Environmental Microbiology, 2011,66(4): 1 726-1 729.
[24] RAMANATHAN R. Role of mitochondria in postmortem color stability[J]. Dissertations & Theses - Gradworks, 2010, 78(5): 7-35.
[25] 陈景宜, 牛力, 黄明,等.影响牛肉肉色稳定性的主要生化因子[J]. 中国农业科学, 2012,45(16):3 363-3 372.
[26] WATTS B M, KENDRICK J, ZIPSER M W, et al. Enzymatic reducing pathways in meat[J]. Journal of Food Science, 1966, 31(6):8.
[27] LEDWARD D A, CHIZZOLINI R, LAWRIE R A. The effect of extraction, animal age and post mortem storage on tendon collagen. A differential scanning calorimetric study[J]. International Journal of Food Science & Technology, 2010,10(3): 349-357.
[28] MANCINI R A, KERRY J P, LEDWARD D. Improving the sensory and nutritional quality of fresh meat[J]. Nutritional Quality, 2010, 53 (7): 647-664.
[29] KIM Y H, KEETON J T, SMITH S B, et al. Evaluation of antioxidant capacity and colour stability of calciumlactate enhancement on fresh beef under highly oxidising condition[J].Food Chemistry, 2009, 115(1): 272-278.
[30] 刘金鑫. 不同包装体系中乳酸钙对冷却牛肉肉色稳定性的影响[D].兰州:甘肃农业大学, 2018.
[31] 陈伟, 何振华, 欧阳劭,等.肺纤维化大鼠上皮细胞凋亡及Bcl-xl和Bid动态变化[J]. 国际呼吸杂志, 2012, 32(14):1 058-1 061.