鹅肉是一种典型的绿色禽类食品,是一种低脂肪、低胆固醇的健康食品,肉中的必需氨基酸含量与成人必需氨基酸平均需要量非常接近,所以鹅肉蛋白质是一种优质完全蛋白质,且其蛋白含量高达22.3%,是畜禽肉中蛋白含量较高的一种[1]。肌原纤维蛋白(myofibrillar protein,MP)作为鹅肉蛋白中的主要成分对肉蛋白的凝胶特性起主要作用,同时与肉制品的质构、保水性及感官品质等性质密切相关[2]。畜禽经屠宰后,其肌肉组织的载体蛋白中过渡金属的释放和抗氧化系统的减弱都会导致活性氧的形成[3],这些活性氧会造成蛋白质氧化[4]。蛋白氧化的程度不同对于肉类的影响不同,适度的蛋白氧化有利于促进和改善蛋白的凝胶性和乳化性,过度的蛋白氧化则会降低凝胶强度,影响肉类的品质。
NaCl通常用于在肉类加工中溶解MP。通常,需要2%~3%(0.47~0.68 mol/L)的NaCl来溶解MP并充分发挥其功能。然而,高盐食品的摄入会导致钠摄入过量,进而增加易感盐个体的血压[5],从而提高了心血管疾病及肾脏疾病的风险[6-7],因此低钠食品已经引起了学者及企业的广泛关注,但是 NaCl含量的降低将导致蛋白质的不完全溶解,这可能导致肉制品品质的恶化。而近年来氨基酸作为一类盐替代的成分,已逐步进入人们的研究范畴。ZHANG等得出L-赖氨酸(L-lys),L-组氨酸(L-His)和L-精氨酸(L-Arg)能够通过组分之间的相互作用促成NaCl的咸味[8]。GUO等的研究发现L-Lys和L-His能够引起二级结构的转化并增加肌球蛋白的溶解度[9]。HAYAKAWA等的研究进一步证实L-组氨酸对肌球蛋白凝胶特性有显著影响[10]。在郭秀云的研究中,通过仿生学原理,采用配方均匀设计实验,开发出了一种新型的HL-低钠盐,其配方(质量分数)为:NaCl 42.8%,KCl 45.2%, 葡萄糖酸钠 3.5%, L-组氨酸 1.5%,L-赖氨酸7.0%[11],经过研究发现HL-低钠盐比单独使用L-赖氨酸或L-组氨酸更有利于肌球蛋白功能特性及凝胶特性的提升。目前这一配方已用于金华火腿及肉制品中,研究发现这一配方在降低钠含量的同时,能够较好地保持甚至改善产品的品质[12-13]。但目前对于HL-低钠盐的用量用于MP的影响还没有报道。因此,本研究以鹅肉MP为原料,分别以不同的NaCL添加比例(高盐、生理盐、低盐)为对照,探究不同添加比例的HL-低钠盐对经Fenton氧化体系加速氧化后24、48及72 h后MP凝胶特性的影响,进而初步探索HL-低钠盐对氧化MP凝胶的影响及机理,为HL-低钠盐用于MP凝胶的研究提供参考依据。
原料:新鲜白条鹅(120 d日龄),购于浙江省绍兴市天天肉食品有限公司,将活鹅宰杀后进行清洗冷冻,并在运输过程中将鹅肉置于装有冰袋的保温箱中,以减少外界温度对原料肉品质的影响。鹅肉解冻后,将其鹅肉剔出来,封口包装,放于-20 ℃的冰箱内,用之前将鹅肉置于4 ℃的冰箱中解冻。
试剂:NaCl(99.5%)、KCl(99.19%)、葡萄糖酸钠(99.4%),美国Two Poles Metallic Compound Co.,Ltd公司;L-赖氨酸(99.2%)、L-组氨酸(99%),美国Double Speed Amino Acid Corporation公司;
HL-低钠盐的配制(质量分数):NaCl 42.8%,KCl 45.2%, 葡萄糖酸钠 3.5%, L-组氨酸 1.5%,L-赖氨酸7.0%。Feton 氧化体系的配制:10 μmol/L FeCl3,100 μmol/L 抗坏血酸,1 mmol/L H2O2。
5810型台式高速离心机,德国Eppendorf公司;TA. XT Plus质构仪,英国Stable Micro System公司;MCR302模块化旋转与界面流变仪,德国Anton公司;SYNERGYH1MG全波长酶标仪,美国基因公司;冰箱,BCD-649WE,青岛海尔股份有限公司;TGL-16医用冷冻离心机,四川蜀科仪器有限公司;FSH-Ⅱ高速电动匀浆器,江苏金坛市环宇科学仪器厂。HH-S数显恒温水浴锅,常州普天仪器制造有限公司。
1.3.1 肌原纤维蛋白的提取
参考PARK等[14]和XIONG[15]的方法略作修改,鹅肉于0~4 ℃解冻后,去除脂肪、淤血及结缔组织并搅碎,加入4倍体积的缓冲液A(0.15 mol/L NaCl,2 mmol/L MgCl2·6H2O,1 mmol/L DTT,1 mmol/L EDTA,50 mmol/L磷酸盐缓冲液,pH 7.0)进行提取,以灭菌、晾干后的纱布过滤以除去多余的筋腱结缔组织,冰水浴匀浆60 s(10 000 r/min),再离心30 min(4 ℃,8 000×g),重复离心操作3次,收集沉淀物,即MP粗体物。之后将沉淀物分散在4倍体积的冰浴混合液B(0.15 mol/L NaCl溶液,1 mmol/L NaN3,pH 7.0)中,冰水浴匀浆60 s(10 000 r/min),离心20 min(4 ℃,8 000×g),重复操作2次,收集沉淀物,之后加入8倍体积的缓冲液B(pH 6.25),匀浆后用4层纱布过滤,之后再进行离心(4 ℃,9 000×g,20 min),所得沉淀即为纯的MP。所得沉淀再次分散在4倍体积的去离子水中进行洗脱2次,离心10 min(4 ℃,9 000×g),取沉淀,即为不含食盐的MP。以牛血清蛋白作标准曲线,双缩脉法测定蛋白质浓度,并将MP放置于4 ℃冰箱保存,48 h内用完。
1.3.2 不同浓度的NaCl和HL-低钠盐处理MP
参照TAKAI等[16]方法,稍作改动。取上述MP分散于氧化体系中(pH6.0,含有0.5 mol/L KCl,10 μmol/L FeCl3,100 μmol/L 抗坏血酸,1 mmol/L H2O2溶液中),匀浆30 s(4 500 r/min),配制成40 mg/mL的蛋白溶液,分成8组,分别向其中加入质量分数0.1%、1%、3.5%的NaCl和质量分数0.1%、1%、1.5%、2.5%、3.5%的HL-低钠盐,缓慢搅拌(尽量避免产生泡沫),在4 ℃冰箱中静置反应,分别于反应结束后的24、48、72 h用1 mmol/L 乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)终止反应,之后进行指标的测定。
1.3.3 凝胶的制备
参考付渊[17]的方法,将上述处理组的MP溶液分别装入小烧杯(θ 27 mm×35 mm),置于25 ℃水浴锅中,以2 ℃/min的升温速率加热至40 ℃,恒温处理30 min,再以2 ℃/min的升温速率加热至80 ℃,恒温处理30 min,取出小烧杯放入冰水浴中冷却20 min,放入4 ℃冰箱中过夜(约12 h),待用。
1.4.1 凝胶强度的测定
参照徐幸莲[18]等的方法,稍作改动。将蛋白凝胶从冰箱中取出,室温下放置30 min,采用型号为TA-XT Plus的质构仪,程序设定采用TPA,触发类型为Stain,探头采用P/0.5。探头下压过程中,测前速度定为2 mm/s,测中速度定为1.0 mm/s,测后速度定为1.0 mm/s,触发力定为5 g,下压距离为4 mm(变性率为40%),数据提取率为200 pps,停留时间为5 s,凝胶强度单位为g,试验重复3次。
1.4.2 凝胶蒸煮损失率的测定
称量加热前离心管的质量W(g)、离心管和鹅肉MP的总质量W1(g),加热后除去水分称总质量W2(g),鹅肉MP的加热损失按公式(1)计算:
凝胶蒸煮损失率![]()
(1)
1.4.3 凝胶保水性的测定
参照MA[19]的方法,并作适当修改。将已称重的MP凝胶置于规格为40ml的离心管中(θ=25mm)于4 ℃环境下,以3 000 r/min的转速离心10 min。离心后,取出离心管,用滤纸吸去多余可见的水分,称重。试验重复3次。保水性(WHC)的计算如公式(2)所示:
(2)
式中:M0,空离心管的质量,g;M1,离心前离心管和MP凝胶的总质量,g;M2,离心后离心管和MP凝胶的总质量,g。
1.4.4 凝胶相互作用力的测定
参照 G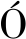 MEZ-GUILLÉN等[20]的方法,并略作修改。称取 1 g 凝胶样品,分别加入 9 mL 的 SA(0.05 mol/L NaCl)、SB(0.6 mol/L NaCl)、SC(0.6 mol/LNaCl+1.5 mol/L 尿素)、SD(0.6 mol/L NaCl+8 mol/L 尿素)、SE(0.6 mol/L NaCl+8 mol/L 尿素+1.5 mol/L β-ME),振荡均匀后,于 4 ℃条件下静置2 h,然后10 000×g离心10 min,取上清液。采用考马斯亮蓝法测定上清液中蛋白质的含量。离子键的含量以溶解于 SB 与 SA 的蛋白质含量之差表示;氢键的含量以溶解于 SC 与SB 的蛋白质含量之差表示;疏水相互作用的含量以溶解于 SD 与 SC 的蛋白质含量之差表示;二硫键的含量以溶解于 SE 与 SD 的蛋白质含量之差表示。
MEZ-GUILLÉN等[20]的方法,并略作修改。称取 1 g 凝胶样品,分别加入 9 mL 的 SA(0.05 mol/L NaCl)、SB(0.6 mol/L NaCl)、SC(0.6 mol/LNaCl+1.5 mol/L 尿素)、SD(0.6 mol/L NaCl+8 mol/L 尿素)、SE(0.6 mol/L NaCl+8 mol/L 尿素+1.5 mol/L β-ME),振荡均匀后,于 4 ℃条件下静置2 h,然后10 000×g离心10 min,取上清液。采用考马斯亮蓝法测定上清液中蛋白质的含量。离子键的含量以溶解于 SB 与 SA 的蛋白质含量之差表示;氢键的含量以溶解于 SC 与SB 的蛋白质含量之差表示;疏水相互作用的含量以溶解于 SD 与 SC 的蛋白质含量之差表示;二硫键的含量以溶解于 SE 与 SD 的蛋白质含量之差表示。
1.4.5 凝胶流变性质的测定
动力流变学试验通过测定储能模量(G′),可以阐明蛋白质凝胶和蛋白质网状结构形成的机理。将提取的MP溶解在含0.5 mol/L KCl的氧化体系中,配制成 40 mg/mL的溶液,在反应结束后的24、48、72 h进行处理。在动态流变仪中使用直径为60 mm的平行板,平行板间的空隙选1 mm,在25~80 ℃进行温度扫描,并在80℃下保温10 min,加热速率为1 ℃/min,振荡频率为1 Hz,应力振幅为0.01。记录温度扫描过程中弹性模量的变化。
凝胶强度的高低反映MP与水结合的程度,同时与肉制品的质构特性密切相关。凝胶强度的高低与凝胶的网络结构和氢键键能的强弱有关[21]。由图1可知,随着氧化周期的延长,MP的凝胶强度显著降低(P<0.05),这是由于氧化破坏蛋白结构,使得疏水基团暴露,导致蛋白无法与水形成稳定致密的结构,进而降低了蛋白质的凝胶强度[22]。同时氧化使得凝胶形成疏松多孔的网络结构,且随着氧化时间的延长,凝胶网络结构减少,而大小不一的蛋白聚集胶束增加,好似变性蛋白颗粒的聚集体,而这在宏观上表现为凝胶强度的降低[23]。DECKER等在研究经自由基氧化体系处理后的火鸡肉MP的凝胶强度时,也得出一致的结论[24]。在同一个氧化周期内,MP的凝胶强度随着NaCl添加比例的升高而显著增强(P<0.05),这是由于Cl-的电负性较强,易和氨基酸侧链的—NH2结合,且N—H—Cl的键能强于N—H—H的氢键键能。而随着HL-低钠盐添加比例的升高,MP的凝胶强度显著升高(P<0.05),当HL-低钠盐的添加比例达到2.5%时,其MP凝胶强度和3.5%的NaCl处理组的凝胶强度差异不显著(P>0.05),这可能与HL-低钠盐对蛋白氧化的抑制程度有关[23]。
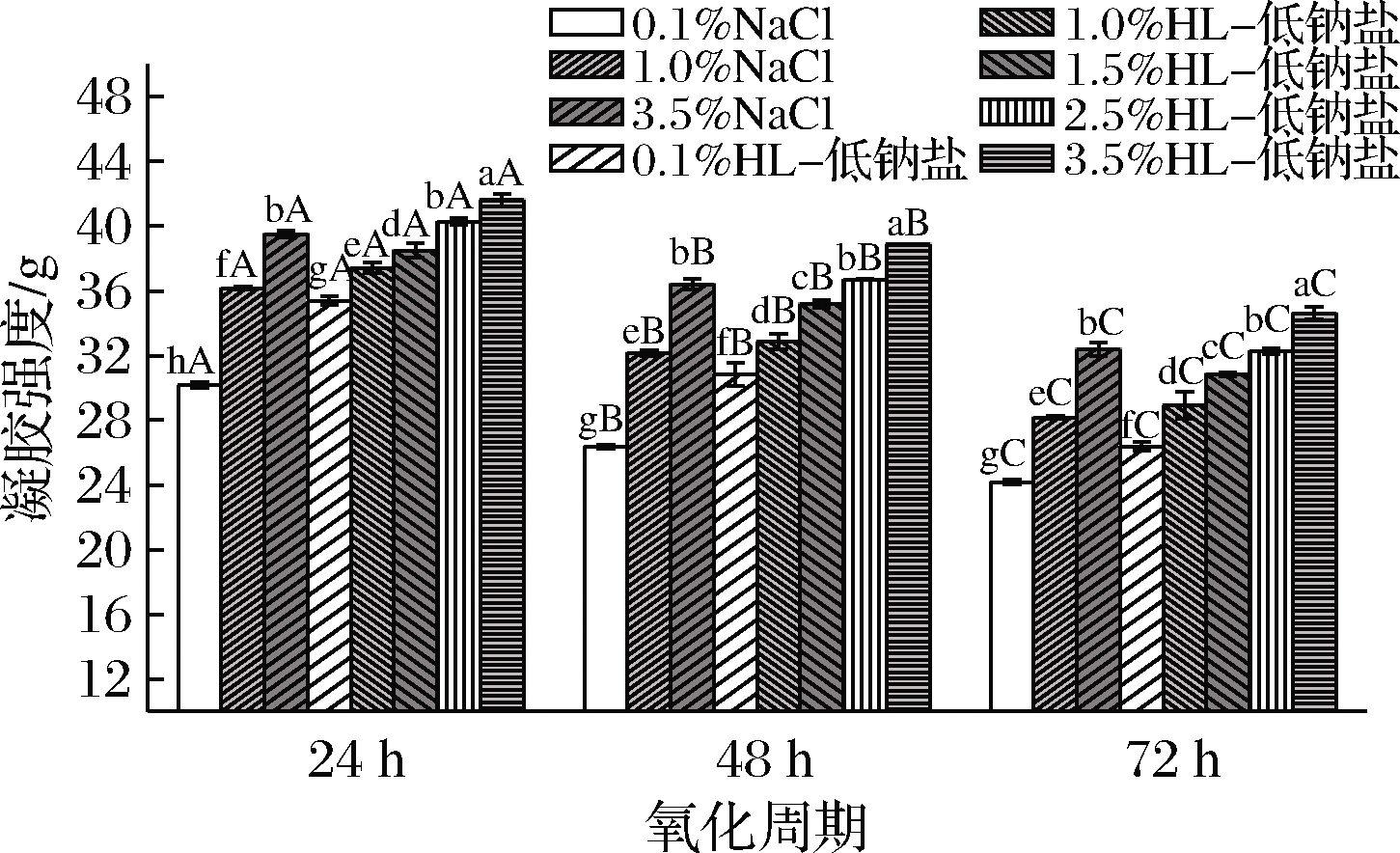
图1 不同盐替代对鹅肉MP凝胶强度的影响
Fig.1 Effect of different salt substitutions on gel strength of goose muscle fibrillin
注:A~C表示不同氧化周期之间差异显著,a~g表示在同一周期内不同处理组之间差异显著,且由A→C、由a→g依次减小(下同)
凝胶的蒸煮损失率可以用来评估凝胶的持水能力。由图2可知,随着氧化周期的延长,MP凝胶的蒸煮损失率显著升高(P<0.05),这是由于氧化导致蛋白结构破坏,进而使得MP在空间结构上对水分子的保留能力减弱[25]。同时氧化使得凝胶网络结构疏松甚至被破坏,加大水分等的流出,因此蒸煮损失率增大[26]。在同一个氧化周期内,随着NaCl添加比例的升高,MP凝胶的蒸煮损失率显著降低(P<0.05),这是由于NaCl 对盐溶性蛋白的溶出作用,进而利于形成结构均匀细致的凝胶网络结构,增强了对水分的束缚作用,减少蒸煮损失[27]。而随着HL-低钠盐添加比例的升高,MP凝胶的蒸煮损失率显著降低(P<0.05),氧化24 h后,2.5%HL-低钠盐处理组的MP凝胶的蒸煮损失率和3.5% NaCl处理组的MP凝胶的蒸煮损失率差异不显著(P>0.05),而氧化48 h和72 h后,2.5%HL-低钠盐处理组的MP凝胶的蒸煮损失率显著低于3.5% NaCl处理组的MP凝胶的蒸煮损失率(P<0.05),说明HL-低钠盐处对于MP凝胶蒸煮损失的抑制作用随着氧化周期的延长而逐渐显著。

图2 不同盐替代对鹅肉MP凝胶蒸煮损失率的影响
Fig.2 Effect of different salt substitutions on the cooking loss rate of goose muscle fibrillin gel
凝胶保水性是凝胶最重要的品质之一,其与凝胶强度及凝胶结构等密切相关[28]。由图3可知,随着氧化周期的延长,MP凝胶的保水性显著降低(P<0.05),LI等[26]指出羟基自由基引起的氧化将导致结合水部分转移为游离水,从而降低了MP凝胶的保水性,增大MP凝胶的蒸煮损失率,这与2.2的结论一致。在同一个氧化周期内,MP凝胶的保水性随着NaCl添加比例的升高而显著升高(P<0.05),这与NaCl有利于形成结构均匀细致的凝胶网络结构有关[29]。随着HL-低钠盐添加比例的升高,MP凝胶的保水性显著升高(P<0.05),氧化24 h后,3.5% HL-低钠盐处理组的MP凝胶的保水性和3.5% NaCl处理组的MP凝胶的保水性差异不显著(P>0.05),而氧化48和72 h后,2.5%HL-低钠盐处理组的MP凝胶的保水性显著高于3.5% NaCl处理组的MP凝胶的保水性(P<0.05),说明HL-低钠盐对于MP凝胶保水性的保护作用随着氧化周期的延长而显著增强。而LI等[25]指出凝胶中的含水量越高,凝胶的强度越高,这与2.1的结论一致。
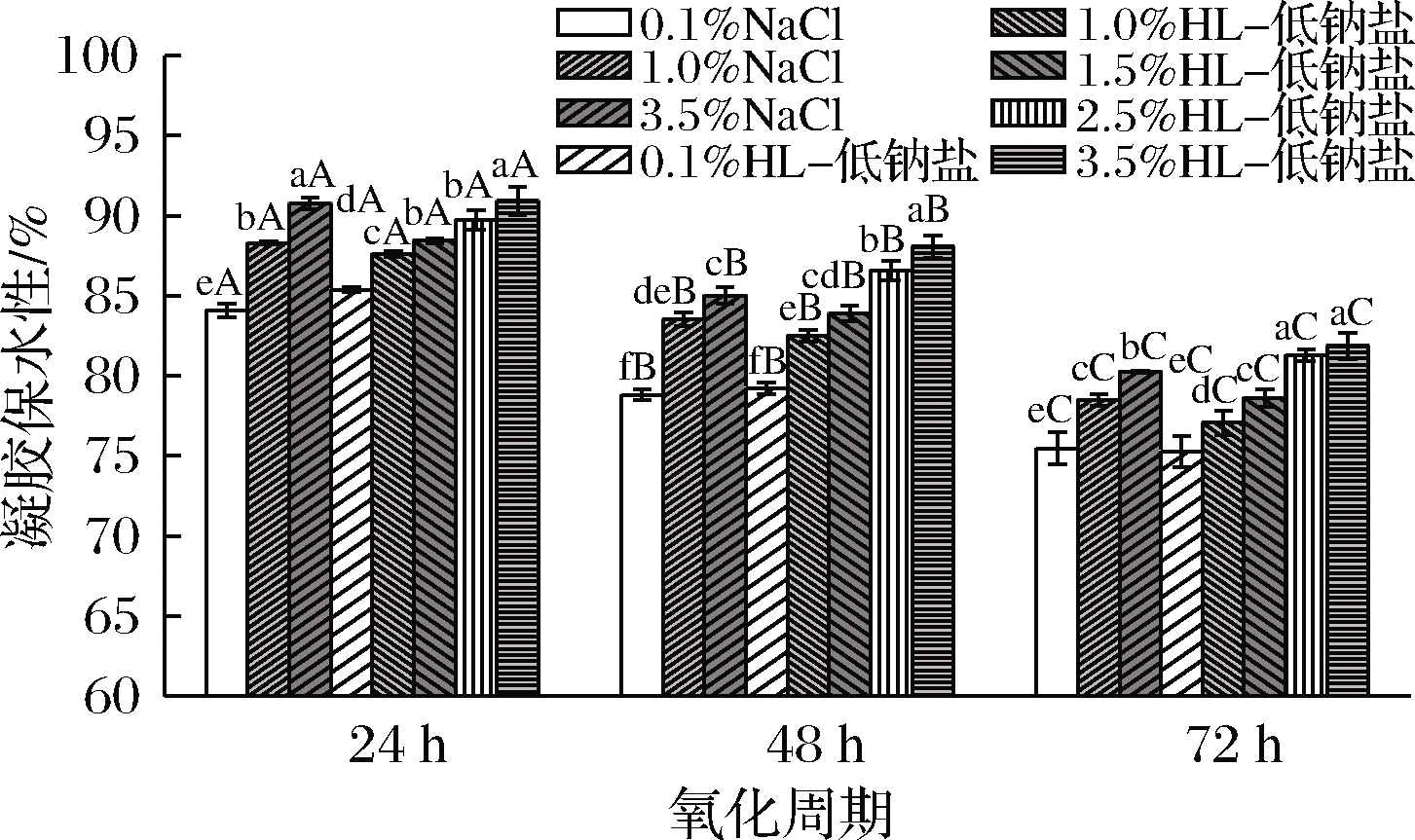
图3 不同盐替代对鹅肉MP凝胶保水性的影响
Fig.3 Effect of different salt substitutions on water retention of goose muscle fibrillin gel
化学作用力是维持MP构象稳定性的重要指标。
凝胶的化学作用力与凝胶的强度、保水性、蒸煮损失率及MP的羰基含量、巯基含量、表面疏水性等性质密切相关。由图4可知,在MP凝胶中化学作用力由强到弱依次为:疏水相互作用>二硫键>氢键>离子键,且疏水相互作用和二硫键的贡献远大于离子键和氢键,说明在MP凝胶中维持构象稳定性的主要作用力是疏水相互作用和二硫键。随着氧化周期的延长,MP凝胶中的离子键、氢键和二硫键含量显著降低(P<0.05),而疏水相互作用的含量显著升高(P<0.05),这是由于氧化降低蛋白表面的净电荷数,进而降低离子键的含量[30],同时由于自由基对于氨基酸侧链的攻击,进而降低了氢键的含量[21],而二硫键含量的降低可能是由于蛋白巯基被氧化成为不可逆氧化状态,形成了非二硫键的含硫化合物[31],同时氧化能够增强蛋白的表面疏水性,进而引起疏水相互作用的增强[32]。在同一个氧化周期内,随着NaCl和HL-低钠盐添加比例的升高,MP凝胶的氢键、疏水相互作用和二硫键含量呈上升趋势,而离子键呈下降趋势。而研究表明疏水相互作用、二硫键和氢键含量的升高都有利于维持凝胶的三维结构,进而有利于凝胶的品质形成[33-35],这与本文中2.1、2.2及2.3的结论一致。

a-离子键;b-氢键;c-疏水相互作用;d-二硫键
图4 不同盐替代对鹅肉MP凝胶化学作用力的影响
Fig.4 Effect of different salt substitutions on chemical force of goose muscle fibrillin gel
弹性模量(G′)是描述蛋白形成凝胶的重要指标,目前已广泛用于研究MP的热诱导凝胶化,其与凝胶强度和保水性等性质密切相关[36]。由图5可知,随加热温度的升高,MP凝胶的流变特性符合一般蛋白流变特性的规律,即处理组的MP在45~50 ℃时出现第1个峰值,随后下降,当温度超过55 ℃后又开始逐步上升达至第2个峰值[37]。随着氧化周期的延长,MP凝胶的弹性模量显著降低,氧化24、48、72 h后,MP凝胶的弹性模量范围依次在132~202 Pa、107~184 Pa、61~112 Pa。这是由于蛋白氧化导致蛋白变性,且随着氧化时间的延长,蛋白变性程度增强,进而导致更大的破坏作用,引起蛋白结构及蛋白分子间和分子内作用力的变化[38],这也同本实验中凝胶强度、凝胶保水性及凝胶二硫键含量的变化是一致的。且随着氧化周期的延长,MP形成凝胶温度降低,氧化24、48、72 h后,MP形成凝胶的温度依次为75.11~77.12、71.12~73.12、69.13~71.13 ℃。这与崔旭海的研究结果一致[38]。在同一个氧化周期内,随着NaCl添加比例的升高,MP凝胶最终的弹性模量值逐渐升高,这是由于NaCl能够增强MP溶解度,进而增强蛋白分子间的相互吸引作用,从而形成了稳定的凝胶结构[39],而随着HL-低钠盐添加比例的升高,MP凝胶最终的弹性模量值逐渐升高,说明HL-低钠盐促进了MP凝胶的形成并提高了其凝胶性能,这与本文中2.1、2.2、2.3的结论一致。
a-氧化24 h;b-氧化48 h;c-氧化72 h
图6 不同盐替代对鹅肉MP升温间断弹性模量的影响
Fig.6 Effect of different salt substitutions on the intermittent elastic modulus of goose myofibrillar protein
本实验以经Fenton氧化体系加速氧化后的鹅肉MP为基础,以质量分数0.1%、1%和3.5%的NaCl添加组对照,探究了不同添加比例的HL-低钠盐处理组对MP凝胶特性的影响。研究发现由于蛋白氧化对蛋白结构的破坏,引起蛋白分子间和分子内的化学键断裂,以及疏水基团的暴露,进而导致MP凝胶特性发生变化。随着氧化周期的延长,MP凝胶中的离子键、氢键和二硫键的含量显著降低(P<0.05),而疏水相互作用显著升高(P<0.05),同时MP凝胶的弹性模量显著降低(P<0.05),且形成凝胶的温度降低,而这些变化导致了凝胶强度和凝胶保水性的显著降低(P<0.05),凝胶蒸煮损失率显著升高(P<0.05)。在同一个氧化周期内,随着NaCl添加比例和HL-低钠盐添加比例的升高,MP凝胶中的氢键、疏水相互作用和二硫键的含量呈上升趋势,而离子键的含量呈下降趋势,同时MP凝胶的弹性模量显著升高,进而导致MP凝胶的强度和保水性显著升高(P<0.05),而凝胶的蒸煮损失率显著降低(P<0.05),且当HL-低钠盐的添加比例达到2.5%时,MP的凝胶特性和3.5%的NaCl处理组的凝胶特性差异不显著或部分性质显著优于3.5%NaCl处理组的凝胶特性。由于本实验只研究了Fenton氧化体系中HL-低钠盐对MP凝胶特性的影响,所以对在其他氧化体系中或是自然氧化状态下HL-低钠盐对MP的特性影响有待进一步深入。
[1] 王莉莉, 潘道东. 鹅肉盐溶蛋白提取条件对其凝胶特性的影响[J]. 中国食品学报. 2010, 10(6):113-121.
[2] LIU G, XIONG Y L, BUTTERFIELD D A. Chemical, physical, and gel-forming properties of oxidized myofibrils and whey- and soy-protein isolates[J].Journal of Food Science, 2000, 65(5):811-818.
[3] LAPIDOT T, GRANIT R, KANNER J. Lipid peroxidation by "free" iron ions and myoglobin as affected by dietary antioxidants in simulated gastric fluids[J]. Journal of Agricultural and Food Chemistry, 2005, 53(9):3 383-3 390.
[4] PARK D, XIONG Y L. Oxidative modification of amino acids in porcine myofibrillar protein isolates exposed to three oxidizing systems[J]. Food Chemistry, 2007, 103(2):607-616.
[5] ZHANG Y W, ZHANG L, HUI T, et al. Influence of partial replacement of NaCl by KCl, l -histidine and l -lysine on the lipase activity and lipid oxidation in dry-cured loin process[J]. LWT - Food Science and Technology, 2015, 64(2):966-973.
[6] COOK N R, CUTLER J A, OBARZANEK E, et al. Long term effects of dietary sodium reduction on cardiovascular disease outcomes: Observational follow-up of the trials of hypertension prevention (TOHp)[J]. Bmj British Medical Journal, 2007, 334(7 599):17-19.
[7] BORST M H D, NAVIS G. Sodium intake, RAAS-blockade and progressive renal disease[J]. pharmacological Research, 2016, 107(5):344-351.
[8] ZHANG Y W, ZHANG L, HUI T, et al. Influence of partial replacement of NaCl by KCl, l-histidine and l-lysine on the lipase activity and lipid oxidation in dry-cured loin process[J]. LWT - Food Science and Technology, 2015, 64(2):966-973.
[9] GUO X Y, PENG Z Q, ZHANG Y W, et al. The solubility and conformational characteristics of porcine myosin as affected by the presence of L-lysine and L-histidine[J]. Food Chemistry, 2015, 170(5):212-217.
[10] HAYAKAWA T, ITO T, WAKAMATSU J, et al. Myosin filament depolymerizes in a low ionic strength solution containing L-histidine[J]. Meat Science, 2010, 84(4):742-746.
[11] 郭秀云. HL-低钠盐及其组分组氨酸和赖氨酸对猪肉肌球蛋白理化特性与热诱导凝胶特性的影响[D]. 南京:南京农业大学, 2016.
[12] 张露, 张雅玮, 惠腾,等. 低钠盐对干腌肉制品加工过程中理化特性的影响[J]. 食品科学, 2014, 35(17):77-82.
[13] 马志方. 低钠传统金华火腿加工过程中脂质和蛋白质水解及氧化的研究[D]. 南京:南京农业大学, 2016.
[14] PARK D, XIONG Y L, ALDERTON A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine musclemyofibrillar protein[J]. Food Chemistry, 2006, 101(7):1 239-1 246.
[15] XIONG Y L. Role of myofibrillar proteins in water-binding in brine-enhanced meats[J]. Food Research International, 2005, 38(3):280-287.
[16] TAKAI E, YOSHIZAWA S, EJIMA D, et al. Synergistic solubilization of porcine myosin in physiological salt solution by arginine[J]. International Journal of Biological Macromolecules, 2013, 62(11):647-651.
[17] 付渊. L-精氨酸、L-赖氨酸对鸡胸肉中肌球蛋白凝胶特性的影响[D]. 合肥:合肥工业大学, 2016.
[18] 徐幸莲. 兔骨骼肌肌球蛋白热诱导凝胶特性及成胶机制研究[D]. 南京:南京农业大学, 2003.
[19] MA F. Effect of high pressure processing on the gel properties of salt-soluble meat protein containing CaCl2 and κ-carrageenan.[J]. Meat Science, 2013, 95(1):22-26.
[20] G MEZ-GUILL
MEZ-GUILL N M C, BORDER
N M C, BORDER AS A J , MONTERO P. Chemical interactions of nonmuscle proteins in the network of sardine(Sardina pilchardus) muscle gels[J]. LWT- Food Science and Technology, 1997, 30(6):602-608.
AS A J , MONTERO P. Chemical interactions of nonmuscle proteins in the network of sardine(Sardina pilchardus) muscle gels[J]. LWT- Food Science and Technology, 1997, 30(6):602-608.
[21] PAL A, ABRAHAM S, ROGERS M A, et al. Comparison of dipolar, h-bonding, and dispersive interactions on gelation efficiency of positional isomers of keto and hydroxy substituted octadecanoic acids[J]. Langmuir, 2013, 29(21):6 467-6 475.
[22] 赵冰, 李素, 张顺亮, 等. 蛋白氧化对肌原纤维蛋白凝胶构效关系的影响[J]. 食品科学, 2018,39(3):55-61.
[23] 李艳青, 孔保华, 夏秀芳, 等. 羟自由基氧化对鲤鱼肌原纤维蛋白乳化性及凝胶性的影响[J]. 食品科学, 2012, 33(9):31-35.
[24] DECKER E A, XIONG Y L, CALVERT J T, et al. Chemical, physical, and functional properties of oxidized turkey white muscle myofibrillar proteins[J]. Journal of Agricultural and Food Chemistry, 1993, 41(2):186-189.
[25] LI Y, LI X, ZHANG C, et al. Oxidation and decrease of gelling properties for meat myofibrillar protein induced by hydroxyl radical[J]. Nongye Gongcheng Xuebao/Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(12):286-292.
[26] LI Y, LI X, WANG J Z, et al. Effects of oxidation on water distribution and physicochemical properties of porcine myofibrillar protein gel[J]. Food Biophysics, 2014, 9(2):169-178.
[27] 张立彦, 胡嘉颖, 王仕钰. 食盐添加量对微波加热鸡胸肉糜凝胶品质的影响[J]. 现代食品科技, 2016, 32(3):190-195.
[28] PUOLANNE E, HALONEN M. Theoretical aspects of water-holding in meat[J]. Meat Science, 2010, 86(1):151-165.
[29] HE J S.Effects of sugars on the cross-linking formation and phase separation of high-pressure induced gelof whey protein from bovine milk[J].Bioscience Biotechnology and Biochemistry,2006,70(3):615-625.
[30] 王策, 李侠, 邓少颖, 等. 羟基自由基氧化对牛血清白蛋白结构及水合特性的影响[J]. 中国农业科学, 2017,50(15):3 013-3 023.
[31] THOMAS J A, MALLIS R J. Aging and oxidation of reactive protein sulphydryls[J]. Experimental Gerontology, 2001, 36(9): 1 519-1 526.
[32] RAVI C R K, LILIE H, RUDOLPH R, et al. L-Arginine increases the solubility of unfolded species of hen egg white lysozyme[J]. Protein Science, 2005, 14(4):929-935.
[33] 刘书成, 郭明慧, 刘媛, 等. 高密度CO2处理过程中虾肌球蛋白分子间作用力的变化[J]. 食品科学, 2018,39(7):153-159.
[34] SHIGERU H, SHURYO N. Contribution of hydrophobicity, net charge and sulfhydryl groups to thermal properties of ovalbumin[J]. Canadian Institute of Food Science and Technology Journal, 1985, 18(4):290-295.
[35] 朱潘红, 齐慧红, 李婷, 等. 不同盐浓度下罗非鱼肌球蛋白热诱导凝胶的形成及机理[J]. 食品与发酵工业, 2018(8):93-98.
[36] VISESSANGUAN W, OGAWA M, NAKAI S, et al. Physicochemical changes and mechanism of heat-induced gelation of arrowtooth flounder myosin[J]. Journal of Agricultural and Food Chemistry, 2000, 48(4):1 016-1 023.
[37] 陈雪珂. 肌球蛋白凝胶化过程中与迷迭香酸的互作机制及其对蛋白理化特性的影响[D].重庆:西南大学,2019.
[38] 崔旭海. 羟基自由基氧化对乳清蛋白凝胶流变性质的影响[J]. 食品与发酵工业, 2010,36(3):40-45.
[39] 李德阳, 侯雅文, 黄颖, 等. NaCl对大菱鲆MP特性的影响[J]. 食品科学, 2018,39(1):61-67.