中国是食醋酿造大国,有几千年的酿醋历史。传统的食醋发酵工艺为固态发酵[1],但随着现代生物技术的发展,液态深层发酵法因生产周期短、产品稳定、产量高、成本低等优点[2-3]受到众多食醋企业的青睐[4]。醋酸菌菌种是影响液态深层发酵醋品质的主要因素[5],目前中国酿醋工业常用的醋酸菌为巴氏醋酸杆菌(Acetobacter pasteurianus),如 AS1.41和沪酿1.01[6],但是它们的产酸能力不高且条件耐受性不强,影响了液态深层发酵醋的品质[7]。因此,筛选产酸能力强且条件耐受性好的醋酸菌,对促进我国食醋产业的发展具有重要意义[8]。
从中国民间或工业醋醅中筛选优良醋酸菌,是当前研究热点之一[9],近年来,关于这方面的研究报道较多。刘阳[10]等从保宁醋曲筛选出1株产酸量为54.28 g/L、乙醇和乙酸耐受性较好的醋酸杆菌。CHEN等[11]从工业醋醅中筛选出1株产酸量高达61.2 g/L的巴氏醋酸杆菌,并且可以耐受体积分数为12%的乙醇和42 ℃的高温,具有潜在应用价值。
中国陕西民间有酿醋的习俗,因此民间醋醅资源丰富,是筛选醋酸菌的良好来源,但这方面鲜有研究报道。本研究采集到一种评价良好的陕西民间醋醅,通过初筛和复筛从中筛选高产酸醋酸菌,并与应用广泛的醋酸菌菌种AS1.41进行深层发酵特性比较,然后将比较得到的最优菌株进行16S rDNA同源序列分析鉴定。本研究旨在获得高产醋酸且具有较好耐受性的醋酸菌菌株,为推进醋酸行业的发展提供参考。
醋醅样品,取自陕西民间。菌株为巴氏醋酸杆菌(Acetobacter pasteurianus)AS1.41,湖北工业大学实验室保藏菌种。
CaCO3(轻质,99%),上海麦克林;酵母提取物(YEAST EXTRACT),Oxid; 葡萄糖、无水乙醇、NaOH、酚酞、FeCl3等(均为分析纯)、琼脂条(BR),国药集团化学试剂有限公司。
LDZX-50FB立式压力蒸汽灭菌器,上海申安医疗器械厂;SW-CJ-1FD洁净工作台,苏州安泰空气技术有限公司; HNY恒温培养振荡器,天津市欧诺仪器仪表有限公司;303电热培养箱,上海浦东荣丰科学仪器有限公司;TGL-18M台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司;T6紫外可见分光光度计,北京普析通用仪器有限责任公司。
富集培养基(GYa):10 g/L葡萄糖、10 g/L酵母提取物、体积分数为2%的无水乙醇。
分离培养基(GYb):10 g/L葡萄糖、110 g/L酵母提取物、20 g/L CaCO3、20 g/L琼脂、体积分数为3%的无水乙醇。
种子培养基(GYc):10 g/L葡萄糖、10 g/L酵母提取物、体积分数为3.6%的无水乙醇。
发酵培养基(GYd):10 g/L葡萄糖、10 g/L酵母提取物。使用前,根据实验设计添加不同体积分数的无水乙醇。
以上培养基使用前,均在0.1 MPa、121 ℃条件下蒸汽灭菌20 min。
1.3.1 醋醅中醋酸菌的富集培养
采集新鲜的陕西民间醋醅,于4 ℃下保存。首先富集醋醅中醋酸菌。在250 mL摇瓶中,醋醅与GYa培养基按1∶20的质量比稀释至100 mL, 30 ℃、 180 r/min富集培养48 h,使醋酸菌快速增殖。
1.3.2 醋酸菌的初筛
在灭菌后热的GYb培养基添加体积分数为3%的无水乙醇,倒平板。用无菌生理盐水将富集的醋醅醋酸菌培养液进行梯度稀释,分别取 10-5、10-6和10-7 稀释度培养液200 μL涂布于筛选平板上,30 ℃培养72 h。挑取透明圈直径比大的单菌落进行划线分离,4 ℃下斜面保存。
1.3.3 醋酸菌的复筛
斜面保藏的分离菌株进行革兰氏染色试验[12]和产酸定性试验[13]。产酸定性试验操作为将分离菌株接种于GYc培养基中,30 ℃、180 r/min摇瓶培养72 h。然后取10 mL培养液5 000 r/min离心10 min,取5 mL 上清液用0.1 mol/L NaOH溶液调节pH至7.0,然后煮沸,加入5滴0.1 mol/L FeCl3溶液,产生红褐色沉淀者初步确认为醋酸菌。
1.3.4 醋酸菌种子活化
斜面保藏的分离菌株接种至GYc中,30 ℃、180 r/min 摇瓶活化24 h。
1.3.5 高产酸醋酸菌的复筛
以AS1.41菌株作为对照。将各活化菌株培养液按10%接种量接种于含体积分数5%乙醇的GYd培养基中,30 ℃、180 r/min摇瓶培养5 d,测定产酸量。
1.3.6 醋酸菌耐受性试验
1.3.6.1 乙醇耐受性
在乙醇体积分数为1.8%、3.6%、5.4%、7.2%、9%、10%、11%的GYd培养基中分别接入体积分数10%的活化菌液,培养基装液量均为100 mL/250 mL三角瓶,30 ℃、180 r/min摇瓶培养,每隔24 h测定OD600和产酸量,直至稳定。
1.3.6.2 温度耐受性
在乙醇体积分数为3.6%的GYd培养基中接入体积分数10%的活化菌液,装液量同上,180 r/min摇瓶培养,温度分别设定为26、30、34、37、40、42 ℃,取样测定同上。
1.3.6.3 乙酸耐受性
在乙醇体积分数为3.6%,乙酸体积分数分别为0、1%、2%、3%、4%、5%的GYd培养基中接入体积分数10%的活化菌液,装液量、培养条件和取样测定同1.3.6.1。
1.3.6.4 盐耐受性
在乙醇体积分数为3.6%,盐质量浓度分别为0、3.0、6.0、9.0、12.0、14.0、16.0、18.0 g/L的GYd培养基中接入体积分数10%的活化菌液,装液量、培养条件和取样测定同1.3.6.3。
1.3.7 菌种鉴定
选择产酸量和条件耐受性最优的分离菌株进行菌种鉴定。基因组DNA提取按参考文献操作[14-15]。利用16S rDNA两端引物和聚合酶链反应扩增目的菌株16S rRNA基因[16],引物序列分别为:5′-AGAGTTTGATCCTGGCTCAG-3′和5′-TACGGCTACCTTGTTACG-ACTT-3′。DNA电泳检测扩增结果,然后对扩增的16S rRNA基因进行测序。最后将测序结果与GenBank中的已知序列进行同源比对,判定细菌种类,将细菌划分到属或种[17]。利用MEGA 5.0软件采用相邻法构建系统发育树[18]。
1.3.8 指标测定方法
菌体生物量用分光光度计测定波长600 nm处的光密度,用OD600值来表示菌体的生物量;产酸量测定参照GB/T 12456—2008食品中总酸的测定指示剂法。
2.1.1 醋酸菌的初筛
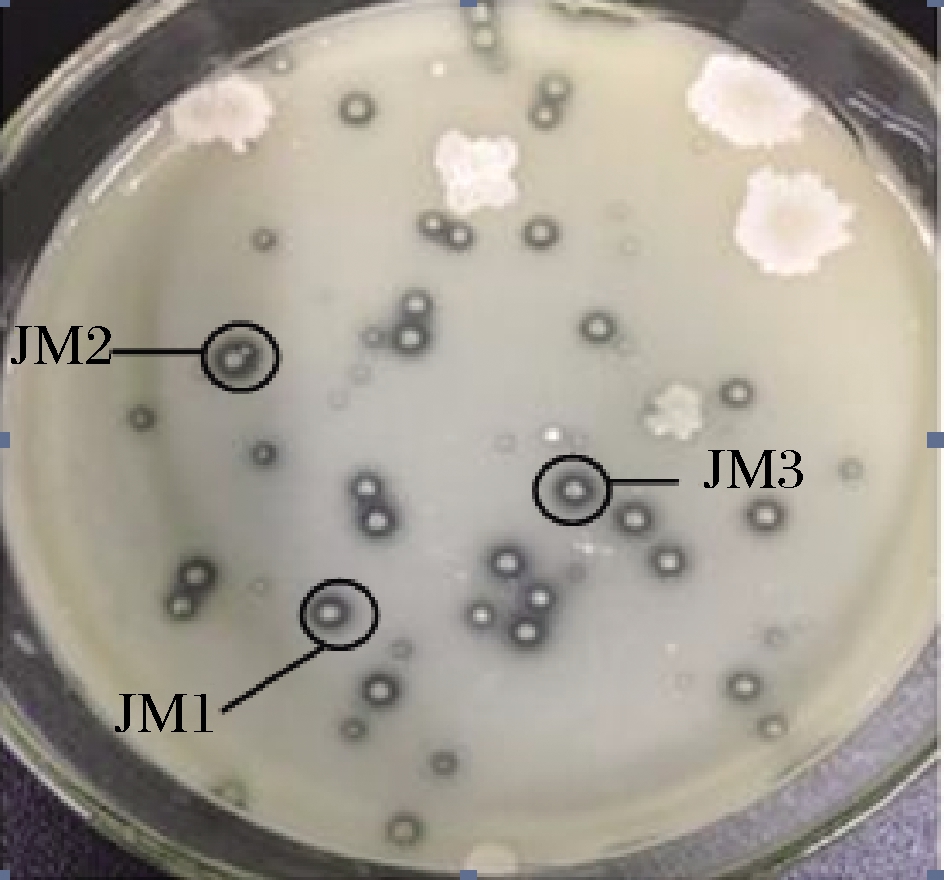
由图1可知,在富集培养液稀释度为10-5筛选平板上,有32个单菌落产生了透明圈。从中挑取3个透明圈直径比明显较大的单菌落,进行划线分离,最后从筛选分离平板上挑取单菌落进行斜面保藏,编号分别为JM1、JM2、JM3。

图1 菌株筛选平板
Fig.1 Screening plate of strains
2.1.2 醋酸菌定性
由于固态醋醅中菌相较为复杂,仅从筛选特征和菌落形态难以确认为符合要求的醋酸菌,因此对初筛菌株JM1、JM2、JM3进行革兰氏染色和产酸定性实验,结果如表1所示。由表1可知,3个初筛菌株均为G-,均为醋酸产生菌。
表1 醋酸菌初步鉴定结果
Table 1 Preliminary identification of acetic acid bacteria

菌株 革兰氏染色试验产酸定性试验JM1 -+JM2 -+JM3 -+中科1.41-+
注:-为阴性;+为阳性
2.1.3 高产酸醋酸菌的复筛
将所有试验菌株分别接种于乙醇体积分数为5%的GYd培养基中培养5 d,产酸结果如图2所示。JM1、JM2、JM3、AS1.41产酸量分别为37.0、42.0、38.5、26.0 g/L。筛选菌株的产酸量均显著高于AS1.41(P<0.05)。
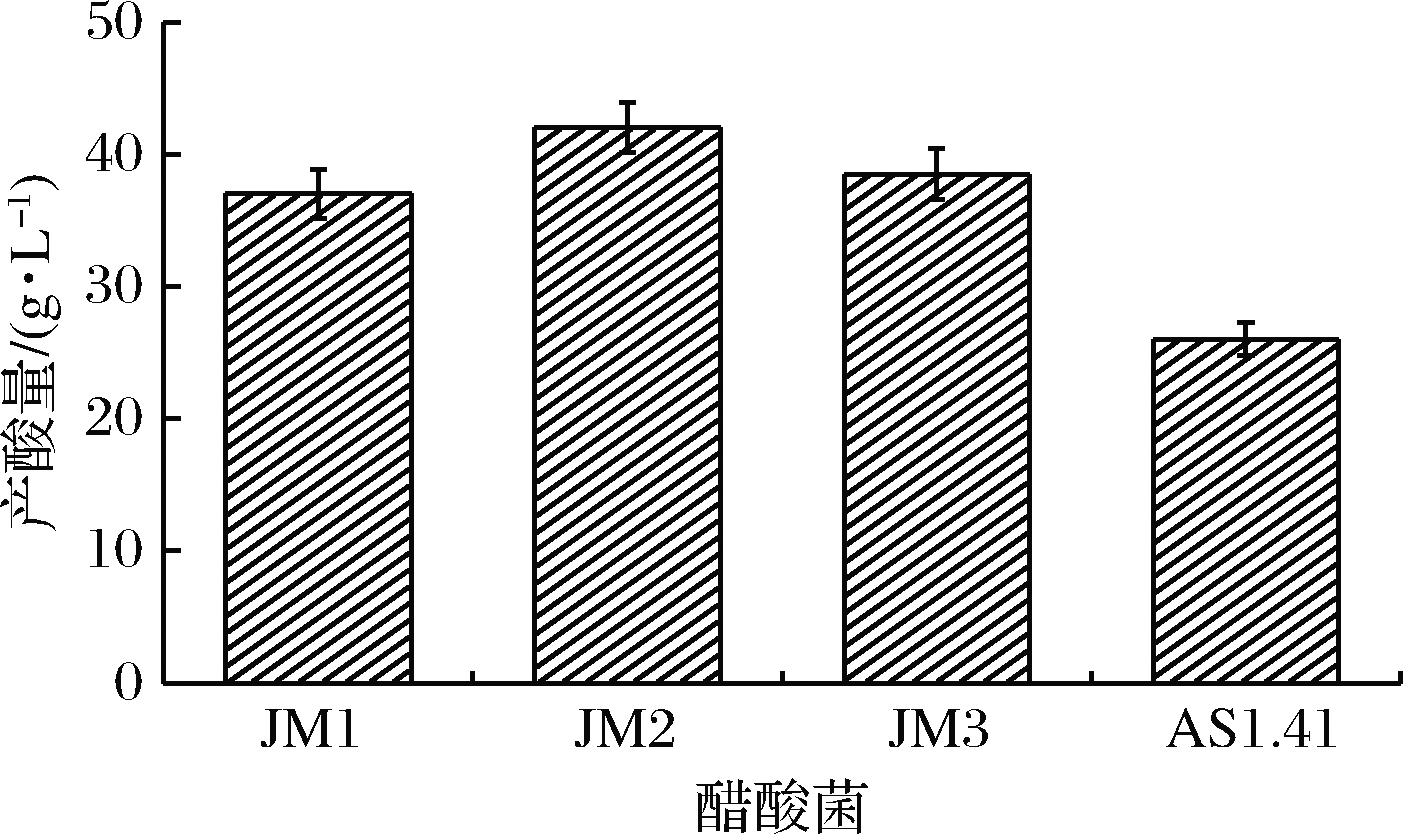
图2 各菌株发酵5 d的产酸量
Fig.2 Acid-producing yield of the strains after fermented for 5 days
2.2.1 乙醇耐受性
试验菌株在乙醇体积分数不同的发酵液中生长和产酸情况如图3所示。所示由图3可知,乙醇体积分数从1.8%增加至11%的过程中,各醋酸菌生物量均呈现下降趋势,而产酸量均呈现先增加后降低的趋势,表明试验体积分数的乙醇对各醋酸菌的生长均有一定程度的抑制作用,而一定体积分数的乙醇对产醋酸有利。乙醇体积分数为3.6%时,AS1.41产酸量最大,达到30.6 g/L;而JM1、JM2、JM3在乙醇体体积分数为5.4%时产酸量均最大,其中JM2产酸量最高,可达49.8 g/L。在乙醇体积分数为3.6%~7.2%,JM1、JM2、JM3的产酸较强且稳定。当乙醇体积分数增至10%以上时,所有试验菌株生长和产酸均明显受抑制,AS1.41甚至停止产酸,这与乙醇抑制细菌生长和代谢的作用有关[19-20]。比较可知,JM2具有相对较好的乙醇耐受性,产酸能力也明显高于AS1.41。

A-菌体生物量;B-产酸量
图3 乙醇体积分数对菌体生物量和产酸量的影响
Fig.3 Effect of ethanol volume fraction on bacterial biomass and acid production
2.2.2 温度耐受性
温度耐受性试验结果如图4所示。在26~37℃,所有试验菌株生长和产酸均较稳定,37~40 ℃时,生长和产酸均趋于停滞状态。JM1、JM2、JM3最适培养和产酸温度为30 ℃左右,且在26~37 ℃产酸能力均较强,其中JM2的产酸量最高,达38.9 g/L。AS1.41适宜的培养温度为30~34 ℃,适宜的产酸温度30~37 ℃,产酸达到32 g/L。在一定的培养温度范围内,温度上升会有利于醋酸菌的生长和代谢,而温度过高会导致醋酸菌产酶能力降低,因此产酸下降[21]。综合分析可知,JM2具有更好的温度耐受性。
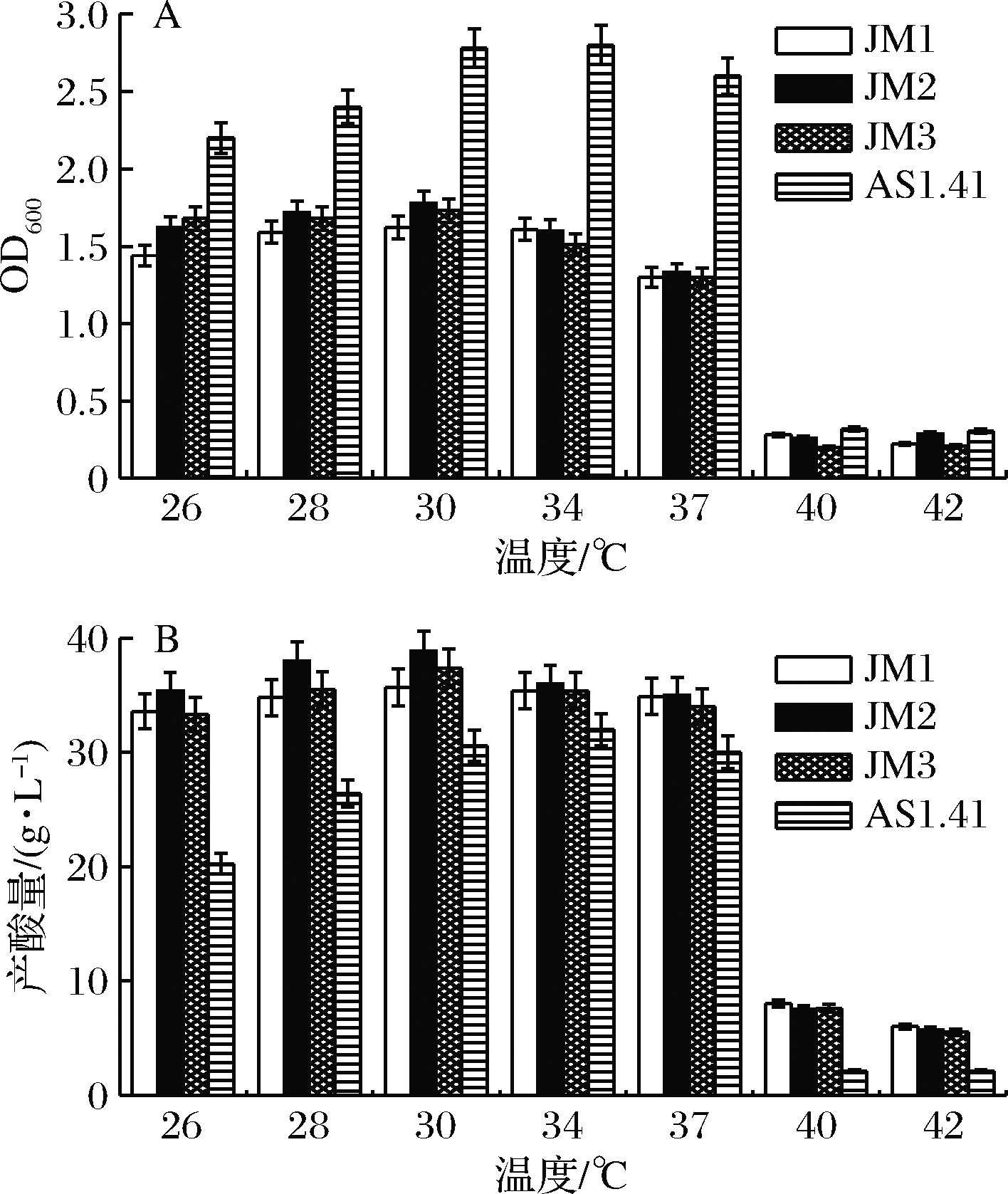
A-菌体生物量;B-产酸量
图4 温度对菌体生物量和产酸量的影响
Fig.4 Effect of temperature on bacterial biomass and acid production
2.2.3 乙酸耐受性
试验菌株的乙酸耐受性结果如图5所示。乙酸对4株醋酸菌的生长均具有一定抑制作用,而体积分数1%的乙酸似乎可以促进醋酸菌的产酸,使JM1、JM2和AS 1.41的产酸量均达到最高,此时JM2的产酸量最高为40.5 g/L,而AS1.41产酸量为32.7 g/L;当乙酸体积分数增加至4%以上时,醋酸菌的生长和产酸均受到明显抑制,因为过酸的环境会影响醋酸菌的生长[22]。过酸和碱性的环境都会导致相关酶活性的下降,从而影响醋酸菌的生长和产酸能力[23]。综合分析,在相同乙酸浓度下,AS1.41的生长情况好于3株分离醋酸菌菌株,而JM2在乙酸为体积分数为0%~2%的条件下,乙酸耐受性最强。
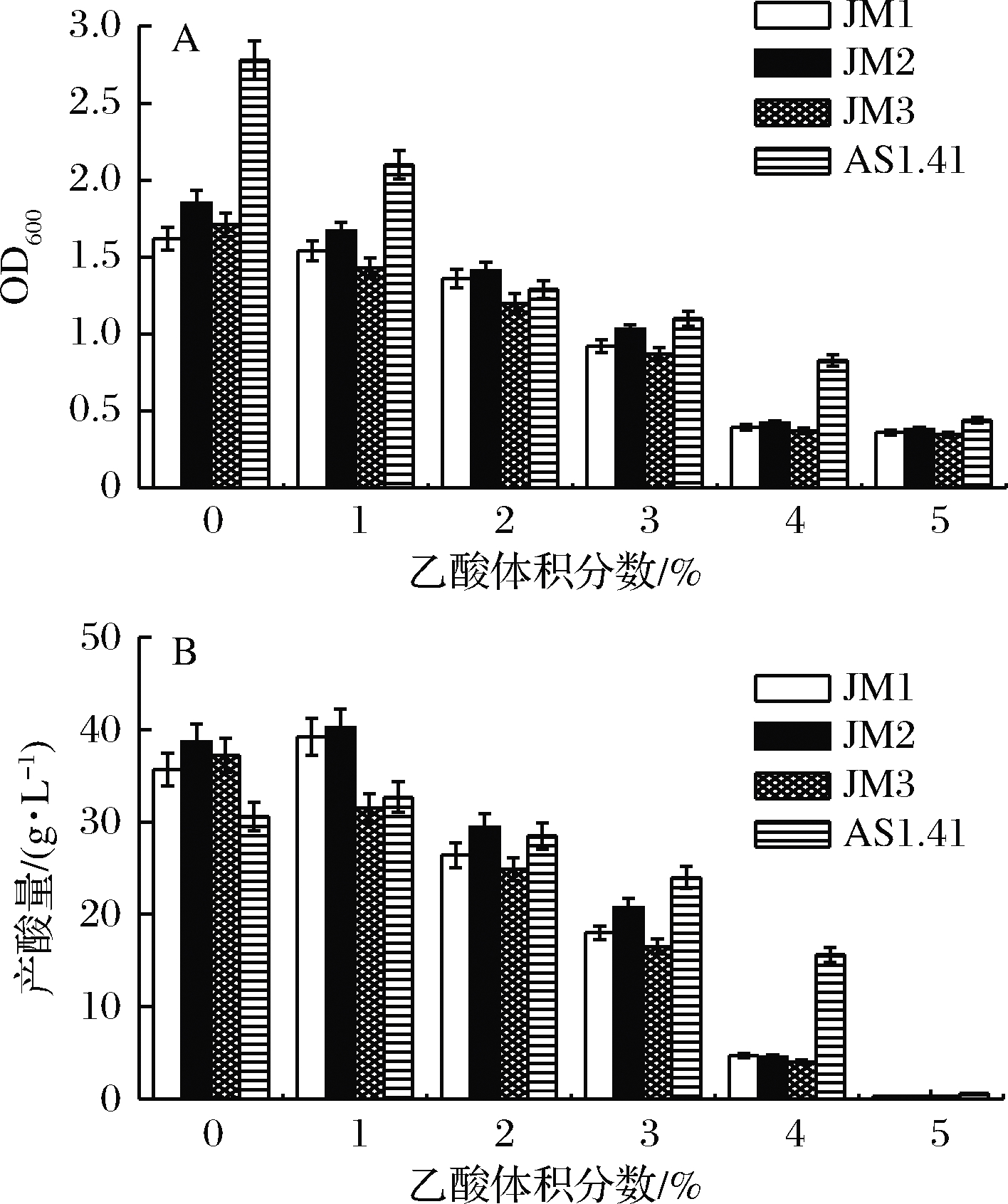
A-菌体生物量;B-产酸量
图5 乙酸体积分数对菌体生物量和产酸量的影响
Fig.5 Effect of acetic acid volume fraction on bacterial biomass and acid production
2.2.4 盐耐受性
由图6可知,在盐质量浓度为0~16.0 g/L时,3个筛选菌株表现出较好的耐盐性,其中JM2耐盐能力最强。在低于质量浓度为3.0 g/L的盐溶液中,盐对JM1、JM2、JM3的生长和产酸均没有显著影响,而AS1.41的产酸有明显降低;当盐质量浓度从3.0 g/L增至14.0 g/L,AS1.41的生长及产酸量呈现明显下降的趋势,并且在质量浓度为14.0 g/L时,几乎停止产酸;而当盐质量浓度从3.0 g/L增至12.0 g/L,JM1、JM2、 JM3的生长及产酸量所受影响较小,当盐质量浓度从12.0 g/L增至18.0 g/L,JM1、JM2、JM3生长和产酸量呈现明显的下降趋势,其中JM2产酸量一直高于JM1和JM3。低盐质量浓度对醋酸菌生长影响较小,但随着盐质量浓度的增加,醋酸菌的生长受到严重抑制,并且影响其产酸能力[24]。综合分析,JM2的盐耐受性最好。

A-菌体生物量;B-产酸量
图6 盐浓度对菌体生物量和产酸量的影响
Fig.6 Effect of salt concentration on bacterial biomass and acid production
对耐受性试验结果进行综合分析可知,在各试验条件下,AS1.41的生长适应能力较强,而JM1、JM2、JM3的产酸能力却明显高于AS1.41。以沪酿1.01为对照菌株时,文献报道也有类似规律发生[25]。最终试验确定JM2产酸能力最强、条件耐受性最好,需要进一步对JM2进行菌种鉴定。
2.3.1 DNA的提取及其PCR扩增
以JM2菌株的DNA为模板,采用特定的引物进行PCR扩增,对PCR扩增产物进行琼脂糖凝胶电泳检测,结果如图7所示,基因扩增的产物大小约为1 500 bp,结合参考文献[26]可知,实验结果符合预期。
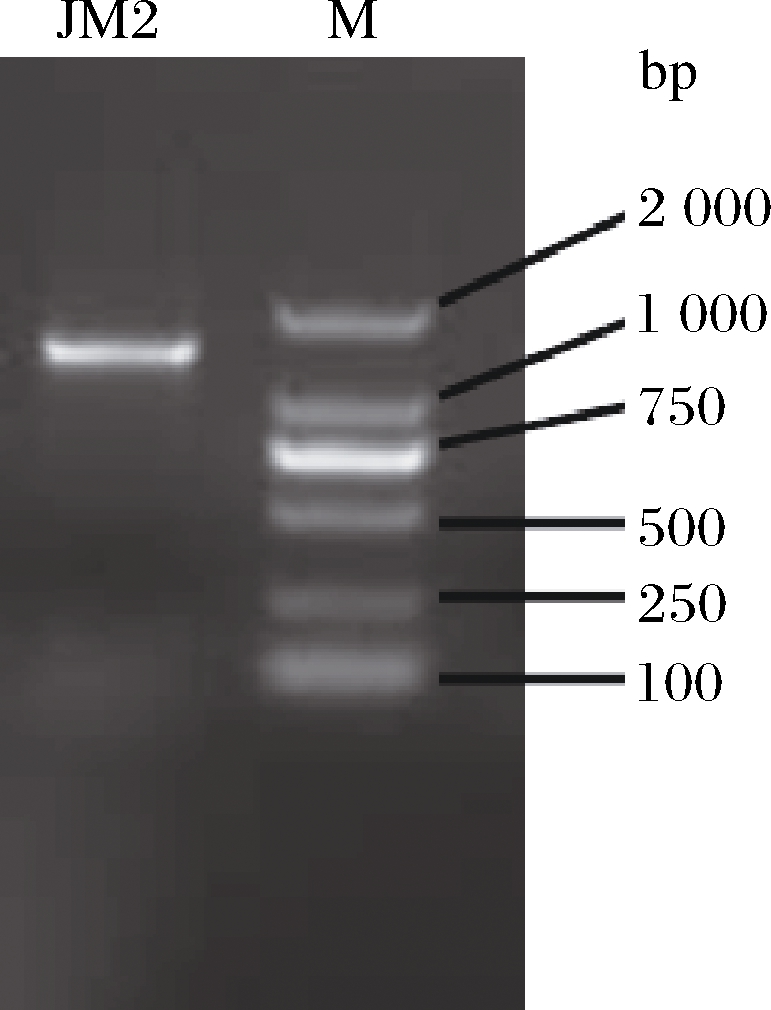
图7 JM2醋酸菌的16S rDNA扩增电泳图
Fig.7 Electrophoresis pattern of 16S rDNA amplification of acetic acid bacteria JM2
2.3.2 同源序列分析及系统发育树构建
将JM2菌株的16S rDNA序列放入NCBI数据库进行比对,结果表明菌株JM2与热带醋酸杆菌(Acetobacter tropicalis)的16S rDNA序列相似度达到100%,结合文献[27]可以确认JM2为热带醋酸菌。然后采用NJ法构建系统发育树,结果如图8所示。
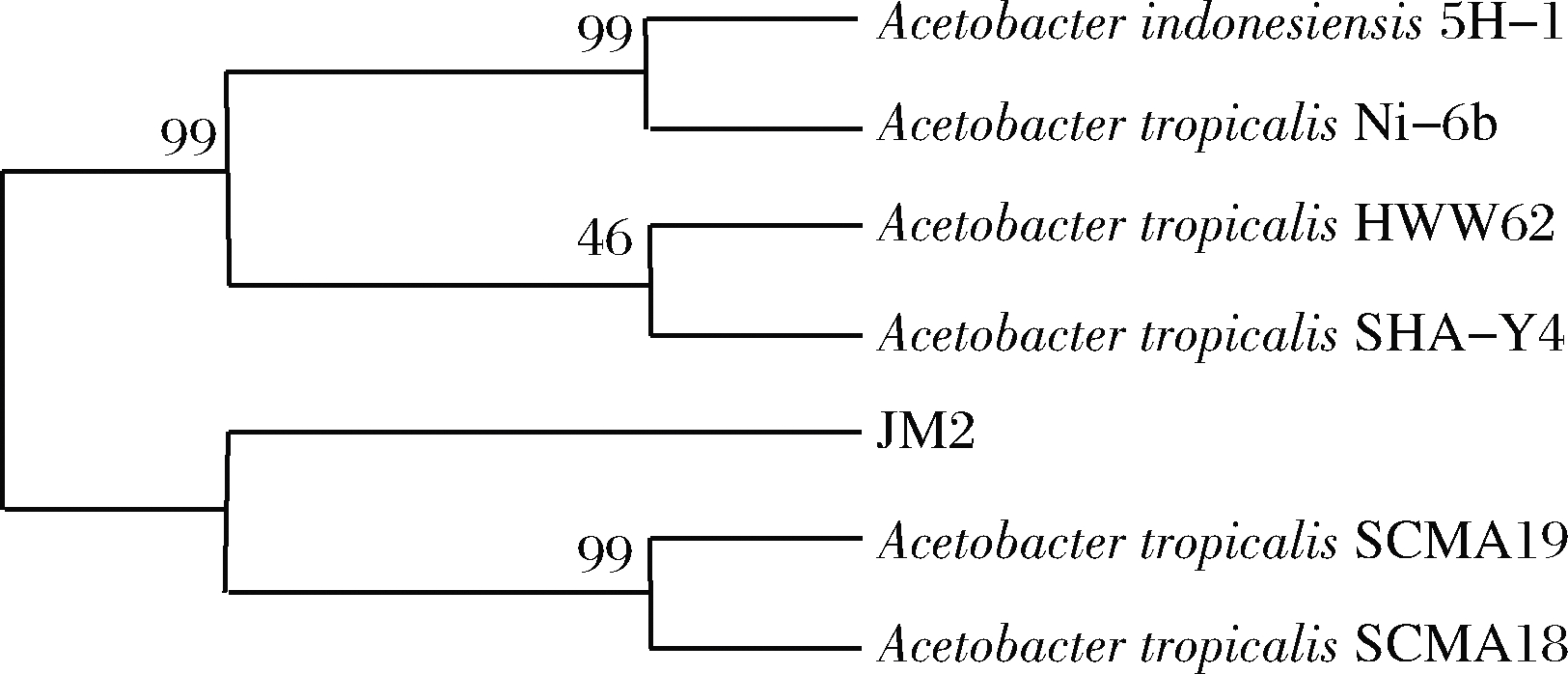
图8 采用NJ法构建的系统发育进化树
Fig.8 Phylogenetic tree constructed by neighbor-joining method
由图8可知,菌种JM2显示与热带醋酸杆菌(Acetobacter tropicalis SCMA19)具有最亲近的关系。结合16S rDNA序列同源性和系统发育树分析结果,确定JM2菌株为热带醋酸杆菌(Acetobacter tropicalis)。
陕西民间有酿醋的传统,有丰富的醋醅资源,因此陕西民间醋醅是优良醋酸菌菌种的宝库。本研究从新鲜的陕西民间醋醅中筛选到3株醋酸菌JM1、JM2、JM3,与AS1.41进行产酸和条件耐受性比较,发现JM2的条件耐受性和产酸能力相对较强,在其他条件适宜的情况下,可耐受的乙醇体积分数、乙酸体积分数、盐质量浓度分别为9%、3%和16.0 g/L,在26~37 ℃具有较强而稳定的产酸能力。经16S rDNA基因测序和分析,确定JM2为热带醋酸杆菌(Acetobacter tropicalis)。JM2是1株高产酸且耐受性较好的醋酸菌,具有很好的工业应用前景。
[1] 秦伟军. 浅谈我国食醋生产技术及质量安全[J]. 中国调味品, 2019(7): 195-197.
[2] 江海, 张长虹, 王立奇, 等. 液态发酵食醋品质改良初探[J]. 农产品加工(学刊), 2013(5): 31-34.
[3] 龚国利, 张甜. 醋酸菌及其酒醋质量的影响因素[J]. 中国调味品, 2015, 40(3): 28-32.
[4] 张晓辉, 余兴文, 顾乡, 等. 液态发酵食醋品质提升方法概述[J]. 安徽农学通报, 2017, 23(11):144-145.
[5] 胡杨, 任梦, 王心强,等. 全液态发酵红曲米醋工艺的研究[J].中国调味品, 2018, 43(2):124-128.
[6] 李大为, 朱运平, 张雪, 等. 自然发酵的苹果醋中醋酸菌的分离鉴定[J].中国食品添加剂, 2015(8): 165-173.
[7] 张霁红, 李明泽, 曾朝珍, 等. 优势醋酸菌株的筛选鉴定及乙醇脱氢酶活性研究[J]. 中国酿造, 2017,36(5):100-104.
[8] 张月阳, 李海峰, 曹健, 等. 高耐受性醋酸菌的研究和应用进展[J]. 中国酿造, 2017, 36(11):11-14.
[9] 张志燕, 钱静亚, 马真, 等. 镇江香醋醋醅中优势高产酸醋酸菌菌株的筛选[J]. 食品工业科技, 2016, 37(11): 174-178.
[10] 刘阳, 邓静, 吴华昌. 保宁醋醋曲中醋酸菌筛选及其代谢产物分析[J]. 食品研究与开发, 2018, 39(17):145-152.
[11] CHEN Y, YE B, LI D, et al. Screening and characterization of ethanol-tolerant and thermotolerant acetic acid bacteria from Chinese vinegar Pei[J]. World Journal of Microbiology & Biotechnology, 2016, 32(1): 1-9.
[12] 陈洋, 汪超, 高冰, 等. 高耐受性醋酸菌的筛选及发酵特性研究[J]. 中国酿造, 2015, 34(12): 28-33.
[13] 林祥群, 刘文玉, 颜雪琴, 等. 红枣果醋醋酸菌株的分离鉴定[J]. 食品安全导刊, 2017(27):136-137.
[14] GAMBA C, HANGH J K, GAUNITZ C, et al. Comparing the performance of three ancient DNA extraction methods for high-throughput sequencing[J]. Molecular Ecology Resources, 2016, 16(2):459-469.
[15] UNNO H, INADA M, NAKAMURA A, et al. Improved rapid and efficient method for Staphylococcus aureus DNA extraction from milk for identification of mastitis pathogens[J]. Journal of Veterinary Medical Science, 2015, 77(8): 1 007-1 009.
[16] BROSIUS J, DULL T J, NOLLER H F. Complete nucleotide sequence of a 23S ribosomal RNA gene from Escherichia coli[J]. Proceedings of the National Academy of Sciences, 1980, 77(1): 201-204.
[17] GAMBA C, HANGHJ K, GAUNITZ C, et al. Comparing the performance of three ancient DNA extraction methods for high-throughput sequencing[J]. Molecular Ecology Resources, 2016, 16(2): 459-469.
[18] ALTSCHUL S F, MADDEN T L. Gapped BLAST and PSI-BLAST: A new generation of protein detabase search programs[J]. Nucleic Acids Research, 1997, 25(17): 3 389-3 402.
[19] NITTAYA P, PATTARAPORN Y, WILAWAN S, et al. Identification of acetic acid bacteria isolated in Thailand and assigned to the genus gene sequence analysis[J]. Annals of Microbiology, 2015, 65(3): 1 557-1 564.
[20] 陈洋. 耐乙醇醋酸菌特性研究及应用[D].武汉:湖北工业大学, 2016.
[21] ORY I D, ROMERO L E, CANTERO D. Modelling the kinetics of growth of Acetobacter acetiin discontinuous culture: Influence of the temperature of operation[J]. Applied Microbiology and Biotechnology, 1998, 49(2): 189-193.
[22] 亓正良. 酸激复合紫外诱变提高醋杆菌产酸能力及耐酸机理的研究[D]. 无锡: 江南大学, 2013.
[23] 姚洪礼, 李兴江, 郑志, 等. 基于16S rDNA的醋酸菌筛选及其发酵特性[J]. 食品科学, 2017, 38(4): 6-12.
[24] 徐清萍, 李会帅, 刘瑞峰, 等. 巴氏醋杆菌Ap2012的生长及耐受性研究[J]. 食品与发酵工业, 2012, 38(10): 40-43.
[25] 李欢, 毛健, 刘双平, 等. 醋酸高产菌株的筛选及高酸度苹果醋的酿造[J]. 食品与生物技术学报, 2019, 38(5),7-14.
[26] GONZALEZ A, MAS A. Differentiation of acetic acid bacteria based on sequence analysis of 16S-23S rRNA gene internal transcribed spacer sequences[J]. International Journal of Food Microbiology, 2011, 147(3): 217-222.
[27] WEISBURG W G, BARNS S M, PELLETIER D A, et al. 16S ribosomal DNA amplification for phylogenetic study[J]. J Bacteriol,1991, 173(2): 697-703.