目前因食品在生产、运输以及销售过程中受污染造成的食物中毒及传染病造成了严重的公共卫生问题[1-2]。据世界卫生组织估计,世界上每年有6亿人因食用受污染的食物患病,其中42万人因此而丧命[3]。其中细菌总数是反映食品安全的指标之一,实现一类食品微生物的快速检测对食品安全有重要意义。目前,平板计数法是细菌检测的金标准,但该方法劳动密集且依赖于操作者的经验[4]。基于聚合酶链式反应的细菌DNA检测同样因假阳性以及检测广谱性问题而受到限制[5-6]。近年来,通过适配体[7-10]、抗生素[11-13]以及抗体[14-16]等对细菌或细菌代谢产物的特异性结合实现了细菌的快速灵敏检测,其中部分方法对操作者经验依赖性较小且能避免假阳性。
溶菌酶(lysozyme, LZM)是一种含有129个氨基酸残基的碱性蛋白质[17-18],其在食品保藏中有一定的应用[19-21]。通过对细胞壁中N-乙酰基胞壁酸与N-乙酰基葡糖胺之间的β-1,4糖苷键水解[22-23],LZM可以使不溶性肽聚糖转化为可溶性糖肽,从而起到杀菌作用[24]。LZM蛋白质一级结构中大量的游离氨基使其带有大量的正电荷,LZM与带柠檬酸配体金纳米粒子(gold nanoparticles, GNPs)之间的静电作用可以使GNPs聚集从而发生比色变化。另一方面,革兰氏阳性菌细胞壁与LZM的特异性结合可以屏蔽这一静电作用。LZM对GNPs与目标微生物之间的竞争结合可以实现细菌的定量检测。
比色法通过GNPs粒径变化产生的颜色变化实现目标物质的定量[25],但是目标物质与识别分子之间的结合常数过小将可能会导致GNPs的尺寸变化不够明显,检测的灵敏度也将受到限制。激光光散射仪可通过粒子布朗运动引起的光强波动检测粒子尺寸信息,目标物质浓度可通过与GNPs的流体力学半径(Rh)之间的线性关系实现定量。本研究通过激光光散射仪以及紫外光谱建立了革兰氏阳性菌的广谱检测方法,并且激光光散射仪法的检测灵敏度相比紫外光谱法实现了一个数量级的提高。
1.1.1 实验试剂
四氯金酸水合物、无水柠檬酸钠、溶菌酶(来源于鸡蛋白)、牛血清蛋白,上海阿拉丁生化科技股份有限公司;营养肉汤,北京索莱宝科技有限公司,实验用水,实验室自制一级水;塑料托盘,当地超市。
1.1.2 实验菌种及培养基
大肠杆菌(ATCC8739)、金黄葡萄球菌(ATCC 6538)、单增李斯特菌(ATCC 19115)、枯草芽孢杆菌(ATCC 6633)试管斜面菌种,上海鲁微技术有限公司;所用培养基为营养肉汤。
1.1.3 仪器与设备
UV-1800 紫外光谱,日本岛津公司;BI-200SM 激光光散射仪,美国布鲁克海文仪器公司;TEM 1400透射电子显微镜,日本JOEL公司。
1.2.1 GNPs合成
GNPs根据BASTUS等报道的方法合成[26]。将100 mL 5.94 mmol/L柠檬酸钠水溶液加入烧瓶中,加热并强力搅拌至溶液沸腾后,向溶液中加入 38 μL 2.94 mol/L四氯金酸水溶液,溶液颜色由无色变为蓝色继而变为紫红色最终呈现红色。继续加热反应15分钟后停止加热,待溶液冷却后储存于4 ℃冰箱。
制得的GNPs通过紫外-可见光(ultraviolet-visible,UV-Vis)光谱、激光光散射仪(dynamic light scattering,DLS)以及透射电子显微镜(transmission electron microscope,TEM)进行表征。
1.2.2 检测条件优化
1.2.2.1 孵育时间
将500 μL制得的GNPs与50 μL 0.14 mg/mL的LZM水溶液混合,并用纯水补充溶液体积至2 mL,并用UV-Vis光谱记录523、600 nm处吸光值的变化。
1.2.2.2 孵育pH
基于1.2中所优化的检测条件,将500 μL制得的GNPs与50 μL 0.14 mg/mL的LZM水溶液混合,分别用pH为5.0、6.0、7.0、8.0的10 mmol/L磷酸盐缓冲液(phosphate buffer solution, PBS)补充体积至2 mL,孵育15 min后测试样品400~800 nm的UV-Vis光谱。
1.2.2.3 孵育温度
基于1.2中所优化的检测条件,将500 μL制得的GNPs与50 μL 0.14 mg/mL的LZM水溶液混合,用pH为8.0的10 mmol/L PBS补充体积至2 mL。将溶液分别放置于30、35、40、45、50 ℃条件下孵育15 min后,测试样品400~800 nm的UV-Vis光谱,信号强度计算如公式(1)所示:
信号强度![]()
(1)
式中:A600,A523分别代表样品在600、523 nm处的吸光值。
1.2.2.4 LZM添加量
基于1.2中所优化的检测条件,将500 μL制得的GNPs分别与0~70 μL 0.14 mg/mL的LZM水溶液混合,并用pH为8.0的10 mmol/L PBS补充体积至2 mL。溶液常温下孵育15 min后分别通过UV-Vis光谱以及DLS测试各样品400~800 nm的UV-Vis光谱和Rh。
1.2.3 检测体系选择性
大肠杆菌(Escherichia coli, E. coli),金黄色葡萄球菌(Staphylococcus aureus, S. aureus)、枯草芽孢杆菌(Bacillus subtilis, B. subtilis)以及单增李斯特菌(Listeria monocytogenes, L. monocytogene)在37 ℃下用营养肉汤孵育17 h。所得菌液在3 000×g离心15 min后,除去上清液并重悬于pH为8.0的10 mmol/L PBS中,重复3次并最终控制菌液在波长为600 nm处的吸光值为1 (109 CFU/mL)。后续实验进一步稀释以达到所需浓度。
基于文中所优化的检测条件,取1 mL浓度为108 CFU/mL E. coli、S. aureus、B. subtilis、L. monocytogene、0.05 mg/mL的牛血清蛋白(bovine serum albumin, BSA),并以1 mL pH为8.0的PBS作为空白对照,依次加入40 μL 0.14 mg/mL的LZM溶液以及500 μL GNPs,并用pH为8.0的10 mmol/L PBS补充体积至2 mL。样品常温下孵育15 min后测试各样品400~800 nm的UV-Vis光谱,测试结果通过公式(1)转化为信号强度。对于通过DLS检测的样品Rh(信号强度),除了LZM溶液添加量为20 μL以及样品在测试前以0.22 μL醋酸纤维素滤膜过滤外,其余操作相同。所得信号强度通过公式(2)归一化:
(2)
式中:In为归一化后的信号强度;IB为测试样品的信号强度;ICK为空白对照组的信号强度;IH为上述5组中信号强度的最大值。
1.2.4 线性关系建立
分别取1 mL细菌浓度在105 ~ 108 CFU/mL的S. aureus,根据1.2.3所述的2种方法进行检测。各细菌浓度重复3个平行样。
1.2.5 真实体系检测
为确定该体系在真实样品检测中的可行性及灵敏度,进行加标回收实验。分别取1 mL浓度为107 CFU/mL及108 CFU/mL的S.aureus涂抹于塑料托盘表面5 cm×5 cm的矩形内,待菌液在常温下干燥后,通过棉拭子取样。用浸泡在pH为8.0的无菌10 mmol/L PBS中的棉拭子在接种有细菌的矩形范围内来回涂抹10次,去除棉拭子木柄后将棉拭子放入含有10 mL pH为8.0的无菌PBS中。将液体摇匀后通过1.2.3所述的2种方法进行检测,各细菌浓度重复3个平行样并计算平均浓度、回收率及相对标准偏差(relative standard deviation, RSD)。
如图1所示,通过柠檬酸钠还原法制得了直径约为12 nm且单分散的GNPs。由于表面等离子体效应,GNPs的UV-Vis光谱在523 nm处有一吸收峰,这为后续生物传感器的构建提供了良好的基础。
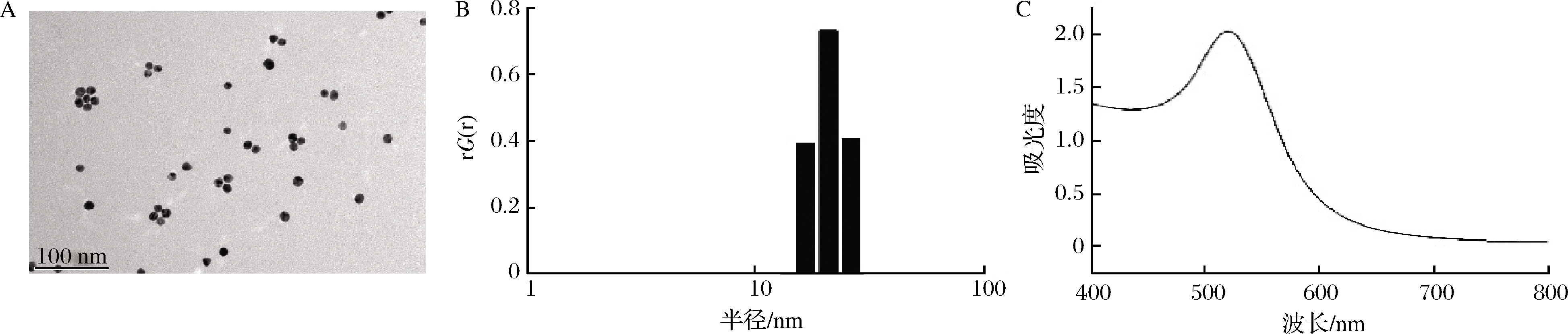
A-GNPs TEM图;B-GNPs粒径分布;C-GNPs UV-Vis光谱
图1 GNPs表征
Fig.1 Characterization of GNPs
LZM是一种碱性蛋白质,通过静电作用可以使得带有负电的GNPs发生聚集。由图2可知,随着LZM的添加,GNPs半径逐渐增大,吸收峰由523 nm红移到570 nm处;而单独添加S. aureus并不能引起紫外吸收峰的红移。当体系同时存在LZM和S. aureus时,由于细菌对LZM的电荷的屏蔽,GNPs的吸收峰无明显红移。这一结果证明该竞争结合体系可用于革兰氏阳性细菌检测。
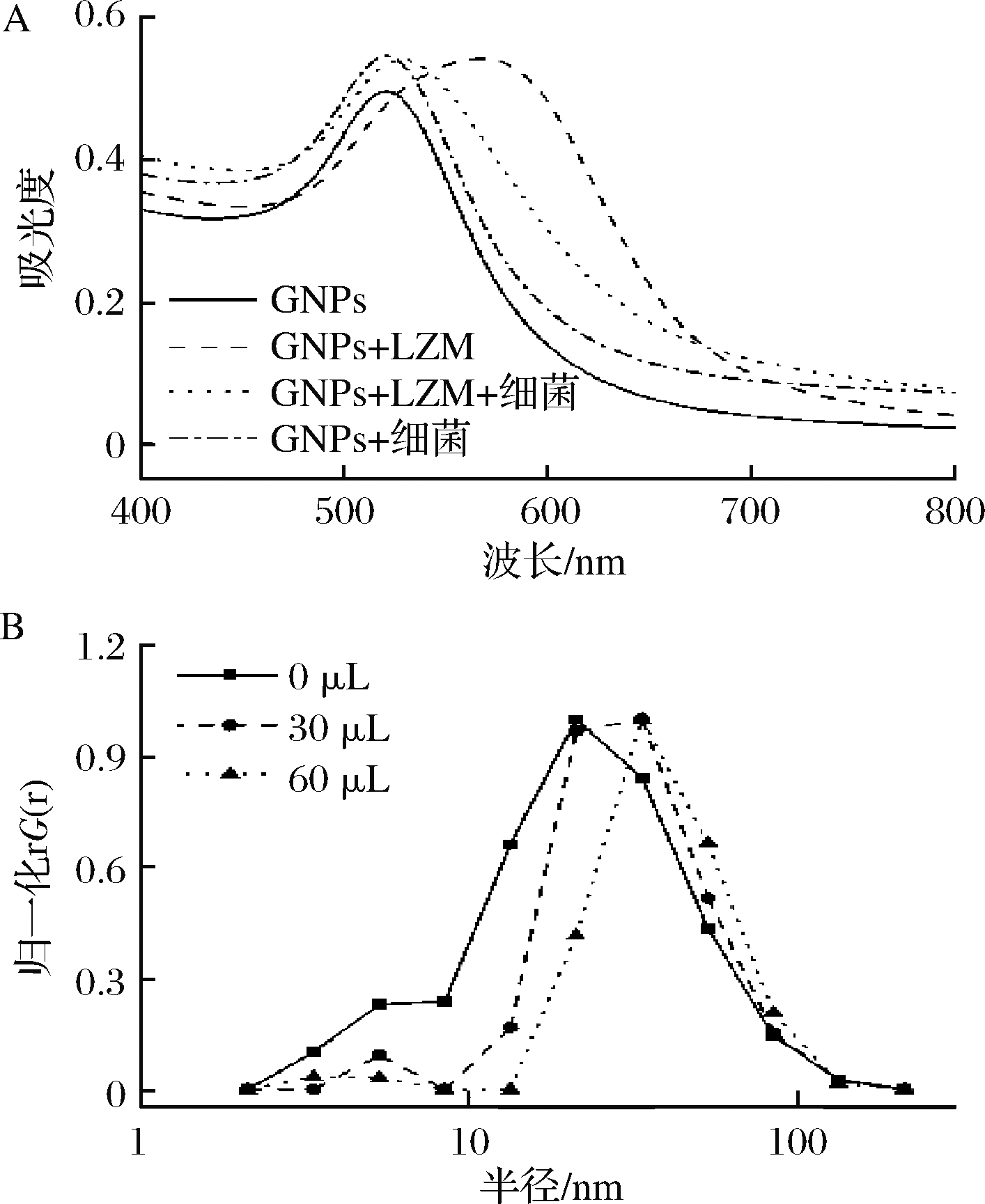
A-GNPs UV-Vis吸收光谱;B-不同LZM添加量下GNPs粒径
图2 检测体系可行性
Fig.2 Feasibility of detection system
对孵育时间、孵育pH、孵育温度以及LZM添加量4个条件进行优化,实验结果如图3所示。吸光度在前3 min内快速变化并逐渐趋于平缓(图3-A),紫外吸收峰变化在pH为8.0的条件下最显著(图3-B),孵育温度对信号强度无明显影响(图3-C)。因此后续检测条件设定为孵育时间15 min,体系pH=8.0,孵育温度为常温。
由于细菌所能结合的LZM数量有限,过多的LZM会导致体系检测限过高。由图3-D可知,LZM添加量为40 μL时吸收峰变化明显且LZM添加量适中,因此后续UV-Vis光谱检测中LZM的添加量设定为40 μL。DLS对GNPs的Rh变化表现出了更高的灵敏度,这一特点可以在产生足够信号强度的同时减少LZM的添加量,因此DLS检测中LZM的添加量设定为20 μL。
在真实环境中,革兰氏阴性与阳性细菌可能同时存在,因此检测体系需要在对目标细菌有明显响应的同时实现对非目标细菌尽可能小的响应以实现选择性检测。2种检测方式对革兰氏阴性以及阳性细菌检测的归一化信号强度如图4所示。相比于革兰氏阴性菌,2种检测方式均体现出对革兰氏阳性菌良好的选择性响应,并且能抵抗体系中存在的蛋白质干扰,实现革兰氏阳性菌的广谱检测。
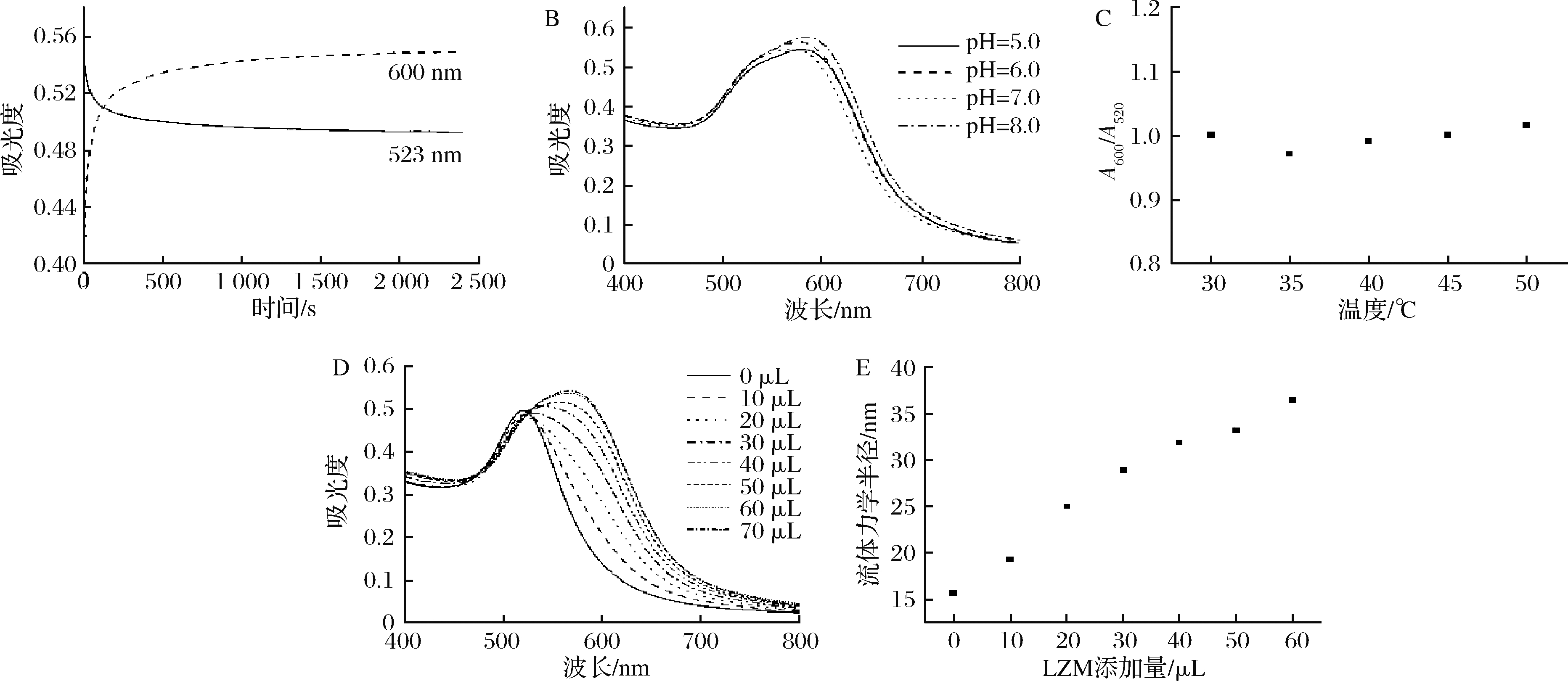
A-孵育时间;B-孵育pH;C-孵育温度;D-不同LZM添加量下GNPs UV-Vis光谱;E-不同LZM添加量下GNPs Rh
图3 检测条件优化
Fig.3 Optimization of detect condition
选取S.aureus用于建立标准曲线,通过UV-Vis光谱进行检测的回归方程为Y=0.69X-3.70,相关系数R2=0.993,定量限为1.26×107 CFU/mL。通过DLS进行检测的回归方程为Y=-2.28X+30.08,相关系数R2=0.954,定量限为6.87×105 CFU/mL。
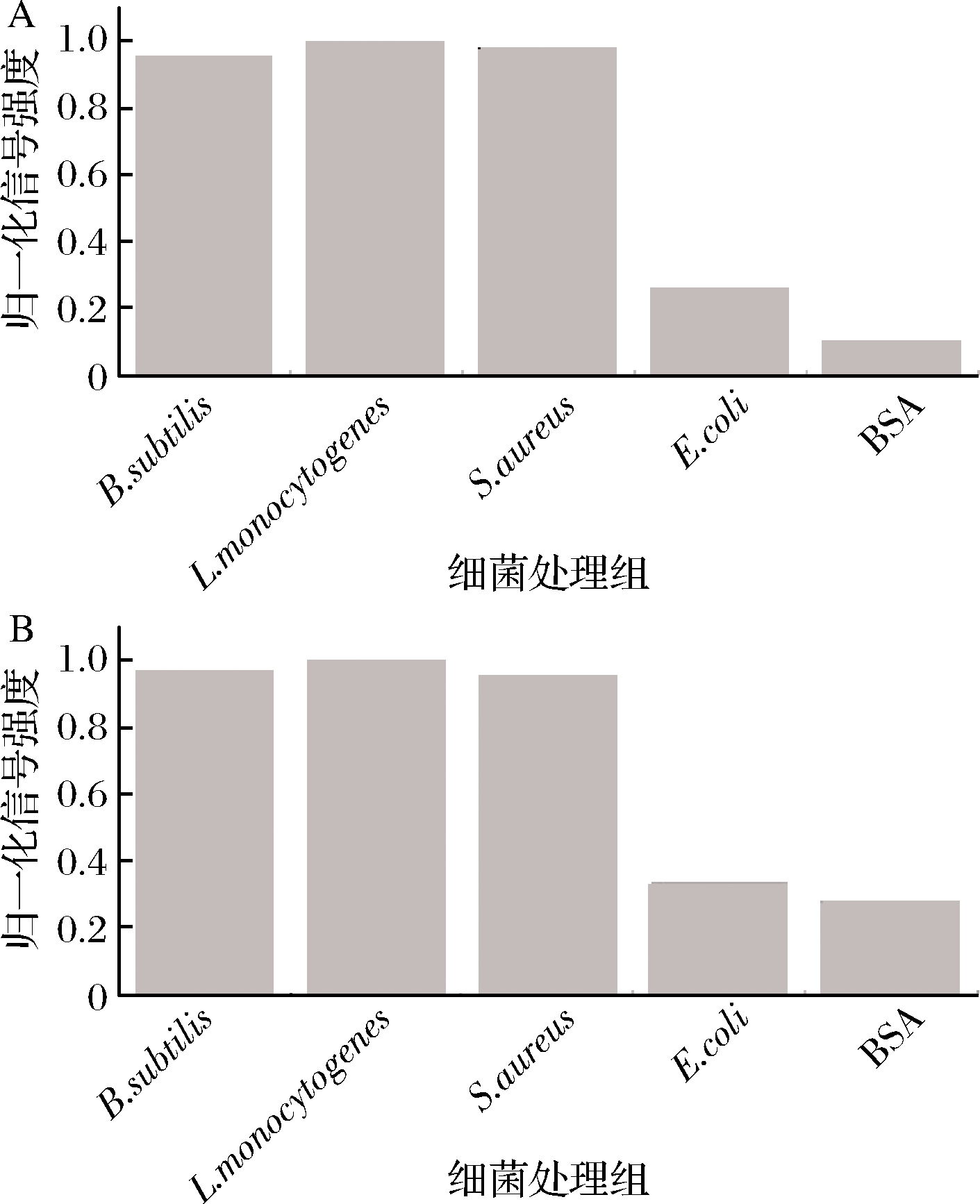
A-UV-Vis光谱检测法选择性,B-DLS检测法选择性
图4 两种检测方法的选择性
Fig.4 Selectivity of the two detections system
为评估该体系检测真实样品的可行性及灵敏度,选取S. aureus作为代表,通过1.2.3所述的检测条件进行检测,即进行加标回收实验。其中1、3样品的加标细菌浓度为108 CFU/mL,2、4样品的加标细菌浓度为107 CFU/mL,1、2样品通过DLS进行检测,3、4通过UV-Vis光谱检测,检测结果如表1所示。从实验结果可以看出,2种检测方法均能实现真实样品中细菌的检测,且DLS法体现出了更高的灵敏度。这一结果也证明了通过DLS进行定量对实现更灵敏的检测存在价值。相比于平板计数法24 h及以上的培养时间,该方法仅需15 min孵育时间,且单个样品检测可在30 min内完成,能够实现革兰氏阳性菌总数的快速检测。
表1 GNPs-LZM竞争结合检测体系在真实样品中对S. aureus的检测
Table 1 S. aureus detection in real sample
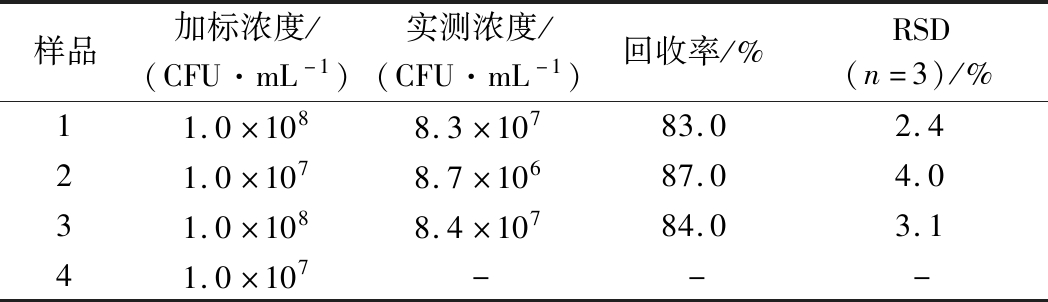
样品加标浓度/(CFU·mL-1)实测浓度/(CFU·mL-1)回收率/%RSD(n=3)/%11.0×1088.3×10783.02.421.0×1078.7×10687.04.031.0×1088.4×10784.03.141.0×107---
注:-表示通过该方法未检出
本研究通过LZM对革兰氏阳性菌和GNPs的竞争结合建立了革兰氏阳性菌的广谱检测方法。通过UV-Vis光谱优化了孵育时间、孵育pH以及孵育温度,并分别通过UV-Vis光谱以及DLS两种方法实现革兰氏阳性菌的定量检测。相比紫外光谱检测的定量限(1.26×107 CFU/mL),DLS体现出对GNPs尺寸变化更高的敏感性,并实现定量限一个数量级的降低(6.87×105 CFU/mL)。与革兰氏阴性菌相比,2种检测方式对革兰氏阳性菌均体现出良好的选择性响应,并能用于真实体系的检测。相比于紫外光谱,DLS对粒子尺寸变化体现出了更高的敏感性,这一策略有助于提高比色法检测的灵敏度。此外,细菌总数是反映食品新鲜程度的指标之一,该方法可实现革兰氏阳性菌的定量检测,对食品安全有一定意义。
[1] SCHELIN J, WALLIN-CARLQUIST N, COHN M T, et al. The formation of Staphylococcus aureus enterotoxin in food environments and advances in risk assessment[J]. Virulence, 2011, 2(6): 580-592.
[2] FU L L, LI J R. Microbial source tracking: A tool for identifying sources of microbial contamination in the food chain[J]. Critical Reviews in Food Science and Nutrition, 2014, 54(6): 699-707.
[3] WHO. Food safety[EB/OL]. WHO, 2017, https://www.who.int/news-room/fact-sheets/detail/food-safety.
[4] WANG H, ZHOU Y, JIANG X, et al. Simultaneous capture, detection, and inactivation of bacteria as enabled by a surface-enhanced raman scattering multifunctional chip[J]. Angewandte Chemie-International Edition, 2015, 54(17): 5 132-5 136.
[5] BOTARO B G, CORTINHAS C S, MARCO L V, et al. Detection and enumeration of Staphylococcus aureus from bovine milk samples by real-time polymerase chain reaction[J]. Journal of Dairy Science, 2013, 96(11): 6 955-6 964.
[6] KWON S J, LEE K B, SOLAKYILDIRIM K, et al. Signal amplification by Glyco-qPCR for ultrasensitive detection of carbohydrates: Applications in glycobiology[J]. Angewandte Chemie-International Edition, 2012, 51(47): 11 800-11 804.
[7] WU W, ZHAO S, MAO Y, et al. A sensitive lateral flow biosensor for Escherichia coli O157:H7 detection based on aptamer mediated strand displacement amplification[J]. Analytica Chimica Acta, 2015, 861: 62-68.
[8] BROSEL-OLIU S, FERREIRA R, URIA N, et al. Novel impedimetric aptasensor for label-free detection of Escherichia coli O157:H7[J]. Sensors and Actuators B: Chemical, 2018, 255: 2 988-2 995.
[9] JIANG Y, ZOU S, CAO X. A simple dendrimer-aptamer based microfluidic platform for E.coli O157:H7 detection and signal intensification by rolling circle amplification[J]. Sensors and Actuators B: Chemical, 2017, 251: 976-984.
[10] ZHU L, LI S, SHAO X, et al. Colorimetric detection and typing of E.coli lipopolysaccharides based on adual aptamer-functionalized gold nanoparticle probe[J]. Microchimica Acta, 2019, 186(2): 111.
[11] YU M, WANG H, FU F, et al. Dual-recognition forster resonance energy transfer based platform for one-step sensitive detection of pathogenic bacteria using fluorescent vancomycin-gold nanoclusters and aptamer-gold nanoparticles[J]. Analytical Chemistry, 2017, 89(7): 4 085-4 090.
[12] SINGH P, GUPTA R, CHOUDHARY M, et al. Drug and nanoparticle mediated rapid naked eye water test for pathogens detection[J]. Sensors and Actuator B-Chemical, 2018, 262: 603-610.
[13] YOU Q, ZHANG X, WU F G, et al. Colorimetric and test stripe-based assay of bacteria by using vancomycin-modified gold nanoparticles[J]. Sensors and Actuators B-Chemical, 2019, 281: 408-414.
[14] ZHANG L, SHI Y, CHEN C, et al. Rapid, visual detection of Klebsiella pneumoniae using magnetic nanoparticles and an horseradish peroxidase-probe based immunosensor[J]. Journal of Biomedical Nanotechnology, 2019, 15(5): 1 061-1 071.
[15] WANG M, YANG H, WU Y, et al. Fluorescent analysis of Staphylococcus aureus by using daptomycin and immunoglobulin G for dual sites affinity[J]. Spectrochimica acta(Part A), Molecular and Biomolecular Spectroscopy, 2019, 215: 340-344.
[16] CHATTOPADHYAY S, SABHARWAL P K, JAIN S, et al. Functionalized polymeric magnetic nanoparticle assisted SERS immunosensor for the sensitive detection of S. typhimurium[J]. Analytica Chimica Acta, 2019, 1067: 98-106.
[17] BLAKE C C F, KOENIG D F, MAIR G A, et al. Structure of hen egg-white lysozyme: A three-dimensional fourier synthesis at 2 Å resolution[J]. Nature, 1965, 206(4 986): 757-761.
[18] 杨曼利, 曹栋, 史苏佳. 化学法改性溶菌酶抑菌性及其结构研究[J]. 食品与发酵工业, 2014, 40(6): 22-26.
[19] LOPES N A, BARRETO PINILLA C M, BRANDELLI A. Antimicrobial activity of lysozyme-nisin co-encapsulated in liposomes coated with polysaccharides[J]. Food Hydrocolloids, 2019, 93: 1-9.
[20] XU F, LIU S, LIU Y, et al. Effectiveness of lysozyme coatings and 1-MCP treatments on storage and preservation of kiwifruit[J]. Food Chemistry, 2019, 288: 201-207.
[21] 范林林, 林楠, 冯叙桥, 等. 溶菌酶及其在食品工业中的应用[J]. 食品与发酵工业, 2015, 41(3): 248-253.
[22] MASSCHALCK B, MICHIELS C W. Antimicrobial properties of lysozyme in relation to foodborne vegetative bacteria[J]. Critical Reviews in Microbiology, 2003, 29(3): 191-214.
[23] PROCTOR V A, CUNNINGHAM F E. The chemistry of lysozyme and its use as a food preservative and a pharmaceutical[J]. Critical Reviews in Food Science and Nutrition, 1988, 26(4): 359-395.
[24] VOCADLO D J, DAVIES G J, LAINE R, et al. Catalysis by hen egg-white lysozyme proceeds via a covalent intermediate[J]. Nature, 2001, 412(6 849): 835-838.
[25] 袁爱梦, 蔡珺珂, 李彤, 等. 金纳米基比色传感器法测定动物源食品中卡那霉素残留[J]. 食品与发酵工业, 2016, 42(12): 179-182.
![]() N G, COMENGE J, PUNTES V. Kinetically controlled seeded growth synthesis of citrate-stabilized gold nanoparticles of up to 200 nm: Size focusing versus ostwald ripening[J]. Langmuir, 2011, 27(17): 11 098-11 105.
N G, COMENGE J, PUNTES V. Kinetically controlled seeded growth synthesis of citrate-stabilized gold nanoparticles of up to 200 nm: Size focusing versus ostwald ripening[J]. Langmuir, 2011, 27(17): 11 098-11 105.