基于固相微萃取-气相色谱-质谱与电子鼻技术分析发酵乳中的挥发性风味物质
李婷1,2,田佳乐1,2,刘洋1,2,李嘉雯1,2,乔少婷1,2,丹彤1,2,孙天松1,2*
1(乳品生物技术与工程教育部重点实验室(内蒙古农业大学),内蒙古 呼和浩特,010018) 2(农业农村部奶制品加工重点实验室(内蒙古农业大学),内蒙古 呼和浩特,010018)
摘 要 为筛选风味优良的发酵剂菌株。该实验在前期研究的基础上,以具有良好风味的德氏乳杆菌保加利亚亚种和嗜热链球菌为实验菌株,进行复配发酵,采用固相微萃取-气相色谱-质谱(solid phase microextraction and gas chromatography-mass spectrometry,SPME-GC-MS)等方法对复配发酵乳香气成分进行检测分析。SPME-GC-MS分析结果表明,对照菌株JD和6组复配发酵乳中共检测出116种挥发性风味物质,其中有酸类化合物(17种)、醛类化合物(11种)、酮类化合物(17种)、醇类化合物(15种)、酯类化合物(11种)、烷烃类(30种)、含氮化合物(15种)。气味活度值(odor activity values,OAV)结果表明发酵乳中关键性风味物质(OAV≥1)有6种,包括3-甲基丁醛、苯甲醛、正壬醛、双乙酰、乙偶姻和2-壬酮。而其他化合物,如辛酸、乙醛、3-羟基丁醛、庚醛、癸醛和2-庚酮等对发酵乳的整体风味起修饰作用(0.1≤OAV<1)。其中,这些关键性风味物质在样品中浓度较高,赋予发酵乳优良风味。主成分分析及线性判别分析结果表明,A6复配组有良好产香特性,在发酵过程中产生的风味和酸类化合物、酮类化合物、醇类化合物、含氮类化合物、烷烃类化合物等呈正相关。
关键词 挥发性风味物质;固相微萃取-气相色谱-质谱;气味活度值;主成分分析
DOI:10.13995/j.cnki.11-1802/ts.023457
引用格式:李婷,田佳乐,刘洋,等.基于固相微萃取-气相色谱-质谱与电子鼻技术分析发酵乳中的挥发性风味物质[J].食品与发酵工业,2020,46(10):233-241.LI Ting, TIAN Jiale, LIU Yang, et al. Analysis of volatile flavor compounds in fermented milk by SPME-GC-MS and electronic nose technology[J].Food and Fermentation Industries,2020,46(10):233-241.
第一作者:硕士研究生(孙天松教授为通讯作者,E-mail:sts9940@sina.com)
基金项目:国家自然科学基金项目(31771954);国家现代农业产业技术体系建设项目(CARS-36);国家自然科学基金项目(31460446)
收稿日期:2020-01-28,改回日期:2020-03-01
Analysis of volatile flavor compounds in fermented milk by SPME-GC-MS and electronic nose technology
LI Ting1,2,TIAN Jiale1,2,LIU Yang1,2,LI Jiawen1,2,QIAO Shaoting1,2,DAN Tong1,2,SUN Tiansong1,2*
1(Key Laboratory of Dairy Biotechnology and Engineering,Ministry of Education (Inner Mongolia Agricultural University),Hohhot 010018, China)2(Key Laboratory of Dairy Products Processing,Ministry of Agriculture and Rural Affairs (Inner Mongolia Agricultural University), Hohhot 010018, China)
ABSTRACT To evaluate the potential of superior flavor production by starter strains in fermented milk, Lactobacillus delbrueckii subsp. bulgaricus and Streptococcus thermophilus were used in combination as experimental strains for fermentation. Solid phase microextraction and gas chromatography-mass spectrometry (SPME-GC-MS) were used to analyze the aroma profile in the commercial starter JD and the consortium fermented milk. The SPME-GC-MS results showed that a total of 116 volatile flavor compounds were identified in the fermented milk. The identified compounds were constituted of 17 acids, 11 aldehyde, 17 ketones, 15 alcohols, 11 esters, 30 alkanes, and 15 nitrogen compounds. The results of odor activity values (OAV) indicated that 6 kinds of key flavor compounds (OAV≥1) were found in the fermented milk, including 3-methylbutyraldehyde, benzaldehyde, n-nonanal, diacetyl, acetoin, and 2-nonanone. Moreover, other compounds such as caprylic acid, acetaldehyde, 3-hydroxybutyraldehyde, heptaldehyde, decanal, and 2-heptanone played a modificatory role in the overall flavor of the fermented milk (0.1≤OAV<1). These compounds had significant higher concentration, which conferred a superior flavor to the fermented milk. Principal component analysis and linear discriminant analysis revealed that A6 compound group had good aroma-producing characteristics. During fermentation, flavor was positively related to acid compounds, ketone compounds, alcohol compounds, nitrogen compounds and alkanes.
Key words volatile flavor compounds; solid phase microextraction and gas chromatography-mass spectrometry; odor activity value; principal component analysis
发酵乳指牛乳或复原乳经杀菌、冷却、接菌发酵而制成的乳制品。德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp. bulgaricus)和嗜热链球菌(Streptococcus thermophilus)是常用发酵剂菌种,发酵过程中产生乙醛、双乙酰等风味化合物,赋予产品良好风味。
产香特性是筛选发酵剂菌株的重要指标。挥发性化合物的种类、含量及感觉阈值之间的相互作用决定着风味[1]。一般采用气味活度值(odor activity value,OAV)评价挥发性物质对风味的贡献程度,OAV越大对总体气味贡献越大。OAV≥1的关键性风味物质,对发酵乳风味有重要贡献作用; 0.1≤OAV<1的物质对总体风味有重要修饰作用[2-3]。
固相微萃取-气相色谱-质谱(solid phase microextraction and gas chromatography-mass spectrometry,SPME-GC-MS)联用技术与电子鼻技术2种手段的配合有利于从宏观和微观上全面研究食品风味,是检测食品风味物质的主要手段[4]。目前,该方法被广泛用于各种食品风味的检测。例如荣建华等[5]采用SPME-GC-MS与电子鼻技术对脆肉鲩鱼肉挥发性风味成分进行检测,发现脆肉鲩鱼肉主体风味成分是壬醛、己醛、1-辛烯-3-醇等化合物。范霞等[6]利用这种技术测定茶叶中香气成分,发现主要成分肉豆蔻酸异丙酯、β-紫罗兰酮、(E,E)-3,5辛二烯-2-酮的相对含量高,香气成分含量的差异造成了不同茶叶品种的风味特征。
风味是决定发酵乳品质的重要因素,然而采用SPME-GC-MS和电子鼻等技术联合分析发酵乳中风味物质的报道较少。本研究采用SPME-GC-MS结合电子鼻技术检测分析复配发酵乳中的挥发性风味物质,通过主成分分析、线性判别分析等不同统计学方法,揭示不同复配发酵剂在发酵过程中产生的风味间存在的差异,筛选出风味优良的菌株,以期为发酵剂的筛选及应用提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 供试菌株来源
实验所用菌株信息如表1和表2所示,由乳品生物技术与工程教育部重点实验室乳酸菌菌种资源库提供;商业对照菌株JD,科汉森(中国)有限公司。
表1 试验菌株来源信息
Table 1 The information of experimental strains
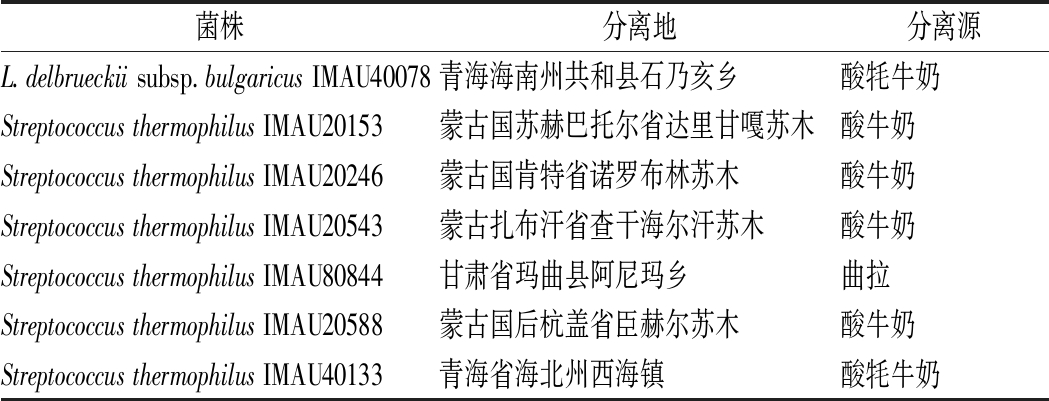
菌株分离地分离源L.delbrueckiisubsp.bulgaricusIMAU40078青海海南州共和县石乃亥乡酸牦牛奶StreptococcusthermophilusIMAU20153蒙古国苏赫巴托尔省达里甘嘎苏木酸牛奶StreptococcusthermophilusIMAU20246蒙古国肯特省诺罗布林苏木酸牛奶StreptococcusthermophilusIMAU20543蒙古扎布汗省查干海尔汗苏木酸牛奶StreptococcusthermophilusIMAU80844甘肃省玛曲县阿尼玛乡曲拉StreptococcusthermophilusIMAU20588蒙古国后杭盖省臣赫尔苏木酸牛奶StreptococcusthermophilusIMAU40133青海省海北州西海镇酸牦牛奶
表2 复配菌株编号
Table 2 The numbers of compound strains

复配菌株编号复配菌株JD商业发酵剂A1IMAU40078&IMAU20153A2IMAU40078&IMAU20246A3IMAU40078&IMAU20543A4IMAU40078&IMAU80844A5IMAU40078&IMAU20588A6IMAU40078&IMAU40133
1.1.2 主要试剂
C3-C9正构烷烃混标(AccuStandard,USA),C10-C25正构烷烃混标(AccuStandard,USA)、1,2-二氯苯(色谱纯),Sigma-Aldrich公司;脱脂奶粉,新西兰恒天然公司;M17液体培养基,青岛高科技工业园海博生物技术有限公司;MRS液体培养基,赛默飞世尔科技(北京)有限公司;实验气体为高纯氦(纯度>99.999%)。
1.1.3 仪器与设备
ZHJH-C1214C型超净工作台,上海智诚分析仪器制造有限公司;CP2202C型电子天平,奥豪斯仪器有限公司;DHP-9272型生化培养箱,上海一恒科技有限公司;SRH 60-70型高压均质机,上海申鹿均质机有限公司;7890B GC-5977A MSD型气相色谱-质谱联用仪,美国Agilent公司;PEN3型电子鼻,德国AIRSENSE公司,电子鼻各传感器的名称及性能描述如表3所示。
表3 PEN3电子鼻传感器名称及性能描述
Table 3 Description of the sensors and their performance of electronic nose

序号传感器名称性能描述1W1C芳香成分2W5S灵敏度大,对氮氧化合物很灵敏3W3C氨类,对芳香成分灵敏4W6S主要对氢气有选择性5W5C烷烃芳香成分6W1S对甲基类灵敏7W1W对硫化物灵敏8W2S对醇类、醛酮类灵敏9W2W芳香成分,对有机硫化物灵敏10W3S对烷烃灵敏
1.2 试验方法
1.2.1 菌株活化及菌悬液制备
真空冷冻干燥保藏的德氏乳杆菌保加利亚亚种和嗜热链球菌分别接种于MRS和M17液体培养基,37 ℃培养24 h,连续传3代,使菌株活力达最大。在50 mL和500 mL MRS液体培养基中扩大培养(37 ℃,24 h),离心(4 000 r/min,10 min)收菌体,重悬于PBS保护剂制备菌悬液,4 ℃备用。
1.2.2 发酵乳制备
适量蒸馏水加热至50 ℃,加11.5%(质量分数)脱脂乳粉搅拌溶解,水温升至60 ℃加6.5%(质量分数)蔗糖,水合30 min且温度保持在60 ℃,连续均质2次(65 ℃,15 MPa和35 MPa),巴氏杀菌(95 ℃,5 min),急冷,4 ℃备用。以嗜热链球菌添加量5×107 CFU/mL为基准,德氏乳杆菌保加利亚亚种和嗜热链球菌以1∶1 000复配,接种于脱脂乳中,分装至15 mL样品瓶在42 ℃发酵。待pH达发酵终点4.5左右且酸度(total acidity,TA)达70~90 °T,冷却样品,-20 ℃保存。测定挥发性风味化合物。
1.2.3 挥发性风味物质的测定
7890B气相色谱仪和5977A质谱仪测定发酵乳的挥发性风味化合物。萃取头(50/30 μm二乙基苯/碳分子筛/聚二甲基硅氧烷)在气相色谱仪进样口(250 ℃)老化5 min,插入气相瓶萃取样品的风味化合物。萃取条件为温度50 ℃,磁力搅拌器转速300 r/min,萃取时间60 min。柱温采用程序升温,初始温度35 ℃,保持5 min;以5 ℃/min升至140 ℃,保持2 min以10 ℃/min速率升至250 ℃。实验使用载气高纯氦气,载气流速1.0 mL/min,不分流进样。汽化室温度250 ℃。电离方式EI离子源,电子能量70 eV,离子源温度230 ℃,质量扫描范围m/z 35~500,发射电流100 μA,检测电压1.4 kV,无溶剂延迟。
1.2.4 定性与定量分析
利用随机携带Masshunter工作站NIST 11标准库自动检索各组分质谱结果,根据保留时间计算保留指数(retention index,RI),参考相关文献报道的RI值鉴定发酵乳样品中的挥发性风味物质。保留指数计算如公式(1)所示:
(1)
式中:RT,保留时间,min;正构烷烃碳原子数保留时间遵循RTz<RTx<RTz+1顺序原则。
内标1,2-二氯苯溶液加入发酵样品。采用峰面积归一化法计算所有组分的相对峰面积比。样品中各组分风味物质浓度计算如公式(2)所示:
(2)
式中:ci,样品中各挥发性风味化合物浓度,μg/L;cs,1,2-二氯苯浓度,μg/L;Ai,样品中待测物质对应色谱峰面积;As,内标色谱峰面积。
1.2.5 电子鼻对发酵乳挥发性物质的分析
称10 g发酵乳于50 mL顶空瓶密封,42 ℃水浴30 min,插入电子鼻探头,用10个金属传感器进行测定。电子鼻测定条件为传感器清洗时间60 s;样品准备时间5 s;测定时间90 s,内部流量300 mL/min,进样流量200 mL/min。
1.3 数据统计分析
使用Microsoft Excel、电子鼻设备自带Win Muster和Origin 7.5处理与分析数据,绘制主成分分析(principal component analysis,PCA)图、线性判别分析(Linear discriminant analysis,LDA)图、雷达图。
2 结果与分析
2.1 复配发酵乳中挥发性风味物质SPME-GC-MS检测结果
采用SPME-GC-MS技术检测分析对照菌株JD和6组复配发酵乳中的风味物质,共检测到116种挥发性风味物质(表4),主要包括酸类、醛类、酮类、醇类、酯类、烷烃及含氮等化合物。
酸类化合物来源脂肪分解和微生物发酵等代谢途径[7]。由表4可知,对照菌株JD和6组复配发酵乳共检测到17种酸类化合物,主要有3-甲基丁酸、乙酸、己酸和辛酸。其中,A3、A4、A5和A6发酵乳酸类化合物的种类和含量明显高于对照菌株JD,特别是A6发酵乳总含量最高,质量浓度为280.11 μg/L。辛酸具有水果和焦糖香味[8],对照菌株JD和6组复配发酵乳均检测到辛酸,其中,A6发酵乳辛酸质量浓度最高,为89.01 μg/L。3-甲基丁酸具有辛辣气味和酸味[9],在所有样品中,仅A1发酵乳检测到3-甲基丁酸,质量浓度为13.48 μg/L。高浓度乙酸具有尖酸、辛辣、刺激性气味[10],对发酵乳口感影响较大。A3、A4、A5和A6发酵乳均检测到乙酸,质量浓度分别为20.57、2.44、3.65和8.73 μg/L。己酸是发酵乳重要的酸类化合物,具有香甜的干酪香气[11-12]。A4、A5和A6发酵乳中检测到己酸含量相对较高,质量浓度分别为66.84、51.36和107.50 μg/L。类似结果在牛婕等[13]的研究中也有发现。
醛类化合物阈值低,对发酵乳风味贡献较大[14]。对照菌株JD和6组复配发酵乳共检测到11种醛类化合物。其中,3-甲基丁醛、苯甲醛和正壬醛OAV>1。3-甲基丁醛具有麦芽香味[15]。A1、A3和A5发酵乳中检测到3-甲基丁醛,质量浓度分别为1.14、0.68和4.19 μg/L。苯甲醛是发酵乳常检测到的重要化合物。低浓度苯甲醛赋予发酵乳杏仁香味,高浓度则具有水果香气[16]。除对照菌株JD和A4外,其余菌株发酵乳中均检测到苯甲醛,特别是A2和A5发酵乳苯甲醛显著高于其他菌株,质量浓度分别为3.20和3.39 μg/L。正壬醛阈值较低,赋予发酵乳柑橘香与脂肪香[17]。A2、A5和A6发酵乳中检测到正壬醛质量浓度相对较高,分别为2.27、1.42和1.13 μg/L。OAV>0.1的醛类物质有4种,分别为乙醛、3-羟基丁醛、庚醛和癸醛。乙醛是重要的风味化合物,对发酵乳风味影响较大[18]。所有发酵乳样品中,仅A1发酵乳检测到乙醛。庚醛主要来源于脂肪酸的自动氧化与乳酸菌代谢,赋予发酵乳脂肪香味[19]。A3和A5发酵乳检测到庚醛,质量浓度分别为1.25和0.72 μg/L。3-羟基丁醛化学性质不稳定,易被还原成酸类和醇类化合物[20]。在对照菌株JD、A1和A4发酵乳中均检测到3-羟基丁醛,质量浓度分别为4.88、0.48和0.98 μg/L。所有样品中,仅A2发酵乳检测到癸醛,其质量浓度为0.90 μg/L。
酮类化合物指不饱和脂肪酸经过氧化、热降解及氨基酸降解等一系列化学反应形成的化合物[21-22]。由表4可知,酮类化合物共17种。其中,关键性酮类化合物(OAV>1)有3种,分别为双乙酰,乙偶姻和2-壬酮。双乙酰被认为是发酵乳风味形成的关键性风味物质,赋予发酵乳奶油与坚果仁风味[23]。除A3发酵乳外,其他菌株发酵乳中均检测到双乙酰,其中,A6发酵乳双乙酰质量浓度最高,达110.03 μg/L。乙偶姻主要由2,3-丁二酮降解和α-乙酰乳酸经脱羧生成[24]。所有菌株发酵乳中均检测到乙偶姻,其中,A4和A6发酵乳中乙偶姻质量浓度明显高于对照菌株JD,分别为179.37和134.55 μg/L。2-庚酮和2-壬酮均是发酵乳风味中的重要风味物质,赋予发酵乳奶油香味和果香。对照菌株JD和6组复配发酵乳中均检测到2-庚酮和2-壬酮,其中,A6发酵乳中2-庚酮和2-壬酮质量浓度最高,分别为18.24和17.53 μg/L。
醇类化合物生成可能与乳糖代谢、甲基酮还原、氨基酸代谢、亚油酸和亚麻酸降解有关[25]。在对照菌株JD和所有发酵乳中共检测到15种醇类物质。本实验检测到一些含量较高的醇类物质,如1-己醇、1-庚醇、2-乙基-1-己醇和1-辛醇等,但风味阈值高,对发酵乳风味贡献较低。
酯类物质由脂肪酸和醇酯化产生。本实验中共检测到11种化合物,其中,A6发酵乳中检测到的乙酸壬酯质量浓度最高为12.41 μg/L。
烷烃类化合物和含氮类化合物风味阈值高,对发酵乳风味的形成影响不明显,但一定浓度的这些物质可使发酵乳口感更加饱满[26]。
一些主要风味化合物OAV值如表5所示。发酵乳风味由挥发性物质的含量和阈值共同决定。OAV指香气浓度与其阈值的比值。通常认为OAV≥1的化合物对发酵乳风味贡献较大,0.1≤OAV<1的化合物对发酵乳风味起重要修饰作用。
表4 发酵终点时发酵乳中挥发性风味化合物SPME-GC-MS鉴定结果
Table 4 Volatile compounds of the fermented milk at the end of fermentation identified by SPME-GC-MS

序号中文名称分子式保留时间/min计算RIa参考RIb鉴定方法c质量浓度/(μg·L-1)JDA1A2A3A4A5A6 酸类化合物 1乙酸C2H4O22.71630.71638MS,RI---20.572.443.658.7322-吡啶羧酸C6H5NO25.49764.62nfMS--1.04----32-氧丙酸C3H4O37.28820.15nfMS-----0.874.144丁酸C4H8O27.53826.57831MS,RI3.124.389.8112.434.45-1.15丙二酸C6H10O47.63829.33nfMS--11.16----6戊酸C5H10O27.69830.91875MS,RI27.02-7.8-8.89--73-甲基丁酸C5H10O28.22845845MS,RI-13.48-----8二乙基乙酸C6H12O29.46877.53nfMS------3.2692-甲基己酸C7H14O29.93889.9nfMS------4.1510己酸C6H12O215.061031.21037MS,RI37.7613.2428.2918.3866.8451.36107.511庚酸C7H14O217.71111.451109MS,RI---0.77-1.563.3412辛酸C8H16O220.211193.851191MS,RI34.0114.730.4241.0263.8355.8589.0113苯甲酸C7H6O220.561205.581197MS,RI-1.4-----14壬酸C9H18O223.451308.131307MS,RI-0.280.640.860.361.892.0115正癸酸C10H20O226.341415.341402MS,RI12.218.2513.0721.5225.5830.0451.8316十二烷酸C12H24O231.231607.981580MS,RI1.930.672.12.011.043.55.04173-羟基十二碳烷酸C12H24O331.951650.59nfMS----11.45-- 醛类化合物 1乙醛C2H4O1.72--MS-2.86-----23-甲基丁醛C5H10O3.68702.27697MS,RI-1.14-0.68-4.19-33-羟基丁醛C4H8O23.91710.21nfMS4.880.48--0.98--42,2-二甲基-4-戊烯醛C7H12O5.53766.1nfMS---0.61---5庚醛C7H14O10.84914.14910MS,RI---1.25-0.72-6苯甲醛C7H6O13.72991.87986MS,RI-0.363.20.92-3.391.597正壬醛C9H18O18.631142.051142MS,RI0.640.362.270.650.341.421.138癸醛C10H20O21.681245.011243MS,RI--0.9----93,4-二甲基苯甲醛C9H10O21.971255.24nfMS----0.390.75-102,4-二甲基苯甲醛C9H10O22.031257.59nfMS-0.56-0.81---11十二醛C12H24O27.61458.411421MS,RI0.47--0.61--- 酮类化合物 12,3-丁二酮(双乙酰)C4H6O22.51615.74nfMS44.251.625.88-33.9814.18110.0323,3-二甲基-2己酮C8H16O2.81638.31nfMS--10.49-9-19.9431-环氧乙烷基丙酮C4H6O22.86642.55nfMS17.93-2.94-16.519.8930.7443-甲基-2-丁酮C5H10O2.91645.99666MS,RI0.384.43-1.622.48.89-52-戊酮C5H10O3.93710.8703MS,RI---0.96-1.05-6乙偶姻C4H8O24.08716.09712MS,RI78.646.2711.2810.3179.3766.4134.5572,3-乙酰基丙酮C5H8O24.09716.48701MS,RI9.62-17.99-4.8118.6240.0782-甲基-3-戊酮C6H14O4.98747.09752MS,RI--8.77----92-羟基-3-戊酮C5H10O27.98838.39821(CP-Sil8CB-MS)MS,RI4.37-5.05-1.3213.0316.72102-庚酮C7H14O10.42902.83902MS,RI6.826.13.1910.878.289.4118.24112,5-二甲基二苯甲酮C15H14O13.78993.36nfMS-----2.86-122-壬酮C9H18O17.541106.351102MS,RI5.645.222.0211.427.488.1817.53132-十一酮C11H22O23.571312.621305MS,RI2.790.452.011.293.813.944.8214(1R-顺式)-1-(1,2,2,3-四甲基环戊基)-乙酮C11H20O24.071331.49nfMS-1.13-2.7--4.08152-十三烷酮C13H26O28.541488.091491MS,RI0.590.87-2.31.831.324.07165,9-二甲基-2-癸酮C12H24O33.521753.39nfMS------1.44172-十五烷酮C15H30O33.541754.511699MS,RI------2.3 醇类化合物 12-(甲氨基)-乙醇C3H9NO2.36604.58nfMS-4.58-----23-甲基-3-丁烯-1-醇C5H10O5.12751.76742MS,RI-0.32-0.53---33-甲基-2-丁烯-1-醇C5H10O6.78807.02789MS,RI-0.580.880.81-1.17-42-乙基-二环[2.1.1]己烷-2-醇C8H12O9.94890880MS,RI-----1.05-51-己醇C6H14O9.65882.43880MS,RI1.54-0.57-1.790.942.4262,3-环氧己醇C6H12O211.41929.43nfMS------2.76
续表4
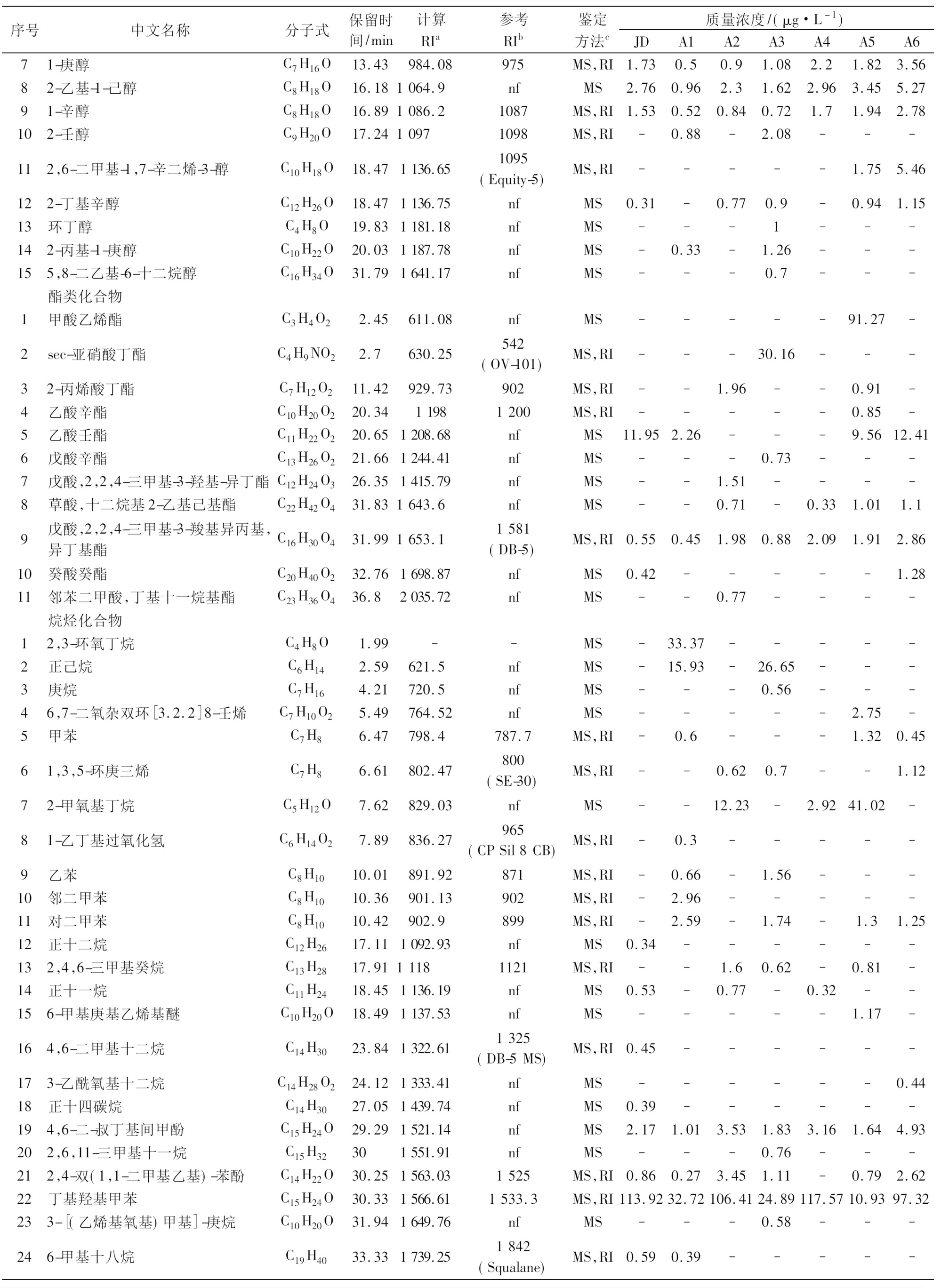
序号中文名称分子式保留时间/min计算RIa参考RIb鉴定方法c质量浓度/(μg·L-1)JDA1A2A3A4A5A671-庚醇C7H16O13.43984.08975MS,RI1.730.50.91.082.21.823.5682-乙基-1-己醇C8H18O16.181064.9nfMS2.760.962.31.622.963.455.2791-辛醇C8H18O16.891086.21087MS,RI1.530.520.840.721.71.942.78102-壬醇C9H20O17.2410971098MS,RI-0.88-2.08---112,6-二甲基-1,7-辛二烯-3-醇C10H18O18.471136.651095(Equity-5)MS,RI-----1.755.46122-丁基辛醇C12H26O18.471136.75nfMS0.31-0.770.9-0.941.1513环丁醇C4H8O19.831181.18nfMS---1---142-丙基-1-庚醇C10H22O20.031187.78nfMS-0.33-1.26---155,8-二乙基-6-十二烷醇C16H34O31.791641.17nfMS---0.7--- 酯类化合物 1甲酸乙烯酯C3H4O22.45611.08nfMS-----91.27-2sec-亚硝酸丁酯C4H9NO22.7630.25542(OV-101)MS,RI---30.16---32-丙烯酸丁酯C7H12O211.42929.73902MS,RI--1.96--0.91-4乙酸辛酯C10H20O220.3411981200MS,RI-----0.85-5乙酸壬酯C11H22O220.651208.68nfMS11.952.26---9.5612.416戊酸辛酯C13H26O221.661244.41nfMS---0.73---7戊酸,2,2,4-三甲基-3-羟基-异丁酯C12H24O326.351415.79nfMS--1.51----8草酸,十二烷基2-乙基己基酯C22H42O431.831643.6nfMS--0.71-0.331.011.19戊酸,2,2,4-三甲基-3-羧基异丙基,异丁基酯C16H30O431.991653.11581(DB-5)MS,RI0.550.451.980.882.091.912.8610癸酸癸酯C20H40O232.761698.87nfMS0.42-----1.2811邻苯二甲酸,丁基十一烷基酯C23H36O436.82035.72nfMS--0.77---- 烷烃化合物 12,3-环氧丁烷C4H8O1.99--MS-33.37-----2正己烷C6H142.59621.5nfMS-15.93-26.65---3庚烷C7H164.21720.5nfMS---0.56---46,7-二氧杂双环[3.2.2]8-壬烯C7H10O25.49764.52nfMS-----2.75-5甲苯C7H86.47798.4787.7MS,RI-0.6---1.320.4561,3,5-环庚三烯C7H86.61802.47800(SE-30)MS,RI--0.620.7--1.1272-甲氧基丁烷C5H12O7.62829.03nfMS--12.23-2.9241.02-81-乙丁基过氧化氢C6H14O27.89836.27965(CPSil8CB)MS,RI-0.3-----9乙苯C8H1010.01891.92871MS,RI-0.66-1.56---10邻二甲苯C8H1010.36901.13902MS,RI-2.96-----11对二甲苯C8H1010.42902.9899MS,RI-2.59-1.74-1.31.2512正十二烷C12H2617.111092.93nfMS0.34------132,4,6-三甲基癸烷C13H2817.9111181121MS,RI--1.60.62-0.81-14正十一烷C11H2418.451136.19nfMS0.53-0.77-0.32--156-甲基庚基乙烯基醚C10H20O18.491137.53nfMS-----1.17-164,6-二甲基十二烷C14H3023.841322.611325(DB-5MS)MS,RI0.45------173-乙酰氧基十二烷C14H28O224.121333.41nfMS------0.4418正十四碳烷C14H3027.051439.74nfMS0.39------194,6-二-叔丁基间甲酚C15H24O29.291521.14nfMS2.171.013.531.833.161.644.93202,6,11-三甲基十一烷C15H32301551.91nfMS---0.76---212,4-双(1,1-二甲基乙基)-苯酚C14H22O30.251563.031525MS,RI0.860.273.451.11-0.792.6222丁基羟基甲苯C15H24O30.331566.611533.3MS,RI113.9232.72106.4124.89117.5710.9397.32233-[(乙烯基氧基)甲基]-庚烷C10H20O31.941649.76nfMS---0.58---246-甲基十八烷C19H4033.331739.251842(Squalane)MS,RI0.590.39-----
续表4
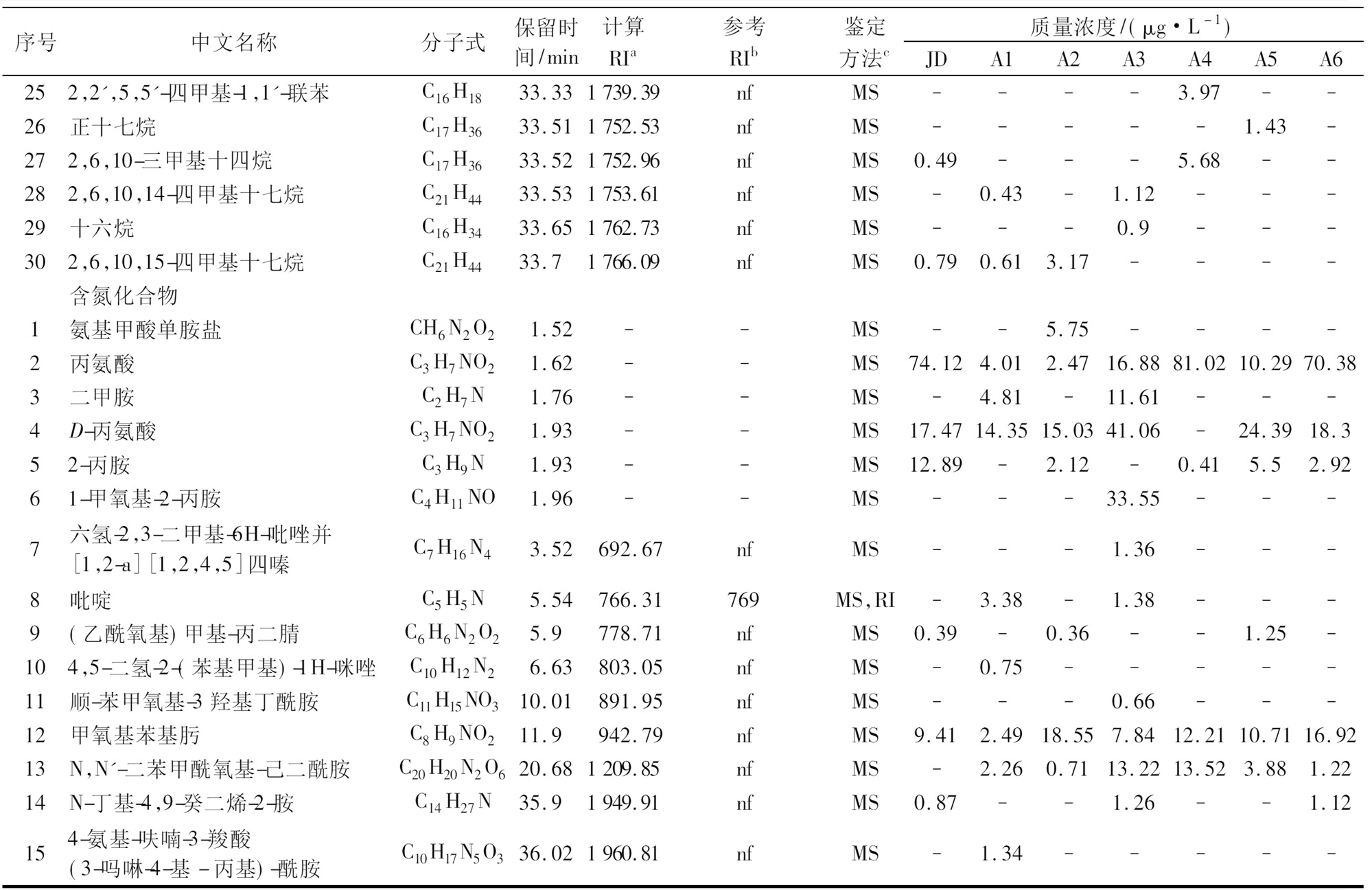
序号中文名称分子式保留时间/min计算RIa参考RIb鉴定方法c质量浓度/(μg·L-1)JDA1A2A3A4A5A6252,2′,5,5′-四甲基-1,1′-联苯C16H1833.331739.39nfMS----3.97--26正十七烷C17H3633.511752.53nfMS-----1.43-272,6,10-三甲基十四烷C17H3633.521752.96nfMS0.49---5.68--282,6,10,14-四甲基十七烷C21H4433.531753.61nfMS-0.43-1.12---29十六烷C16H3433.651762.73nfMS---0.9---302,6,10,15-四甲基十七烷C21H4433.71766.09nfMS0.790.613.17---- 含氮化合物 1氨基甲酸单胺盐CH6N2O21.52--MS--5.75----2丙氨酸C3H7NO21.62--MS74.124.012.4716.8881.0210.2970.383二甲胺C2H7N1.76--MS-4.81-11.61---4D-丙氨酸C3H7NO21.93--MS17.4714.3515.0341.06-24.3918.352-丙胺C3H9N1.93--MS12.89-2.12-0.415.52.9261-甲氧基-2-丙胺C4H11NO1.96--MS---33.55---7六氢-2,3-二甲基-6H-吡唑并[1,2-a][1,2,4,5]四嗪C7H16N43.52692.67nfMS---1.36---8吡啶C5H5N5.54766.31769MS,RI-3.38-1.38---9(乙酰氧基)甲基-丙二腈C6H6N2O25.9778.71nfMS0.39-0.36--1.25-104,5-二氢-2-(苯基甲基)-1H-咪唑C10H12N26.63803.05nfMS-0.75-----11顺-苯甲氧基-3羟基丁酰胺C11H15NO310.01891.95nfMS---0.66---12甲氧基苯基肟C8H9NO211.9942.79nfMS9.412.4918.557.8412.2110.7116.9213N,N′-二苯甲酰氧基-己二酰胺C20H20N2O620.681209.85nfMS-2.260.7113.2213.523.881.2214N-丁基-4,9-癸二烯-2-胺C14H27N35.91949.91nfMS0.87--1.26--1.12154-氨基-呋喃-3-羧酸(3-吗啉-4-基-丙基)-酰胺C10H17N5O336.021960.81nfMS-1.34-----
注:a,C6~C25一系列正构烷烃计算所得保留指数;b,保留指数数据库(http://webbook.nist.gov/chemistry)查找到的参考保留指数;nf,未在数据库查到参考保留指数;c,MS指通过NIST 11谱库定性该物质,RI指通过比对参考保留指数定性该物质;-,未检测出物质
表5 发酵乳中关键性风味物质及对应OAV
Table 5 OAV of key volatile compounds in fermented milk
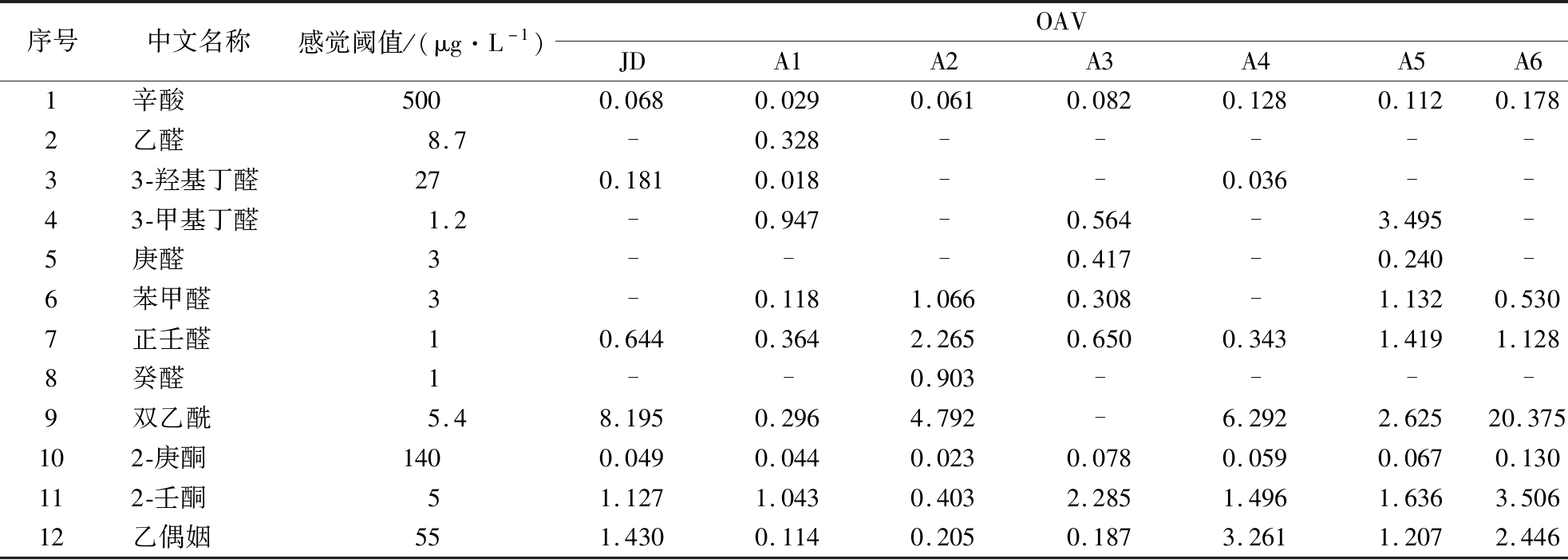
序号中文名称感觉阈值/(μg·L-1)OAVJDA1A2A3A4A5A61辛酸5000.0680.0290.0610.0820.1280.1120.1782乙醛8.7-0.328-----33-羟基丁醛270.1810.018--0.036--43-甲基丁醛1.2-0.947-0.564-3.495-5庚醛3---0.417-0.240-6苯甲醛3-0.1181.0660.308-1.1320.5307正壬醛10.6440.3642.2650.6500.3431.4191.1288癸醛1--0.903----9双乙酰5.48.1950.2964.792-6.2922.62520.375102-庚酮1400.0490.0440.0230.0780.0590.0670.130112-壬酮51.1271.0430.4032.2851.4961.6363.50612乙偶姻551.4300.1140.2050.1873.2611.2072.446
2.2 复配发酵乳中挥发性风味物质的主成分分析
主成分分析指通过少数几个主分量来解释多变量间的内部关系,使样品中物质的种类及含量有较客观的反映。本实验将对照菌株JD和6组复配发酵乳的挥发性风味物质归为七类进行主成分分析,菌株与挥发性风味物质越接近,表明两者相关性越高。由图1可知,根据菌株在发酵乳中产生风味物质的丰富度,对照菌株和6组复配发酵乳被分成左右2个区域,右半区菌株(对照菌株JD、A4、A6)与酸类化合物、酮类化合物、醇类化合物、含氮类化合物和烷烃类化合物之间有较强的正相关性。左半区菌株(A1、A2、A3、A5)与醛类化合物和酯类化合物之间有较强的正相关性。说明对照菌株JD、A4、A6菌株在发酵过程中产生的主要风味物质较丰富,和酸类化合物、酮类化合物、醇类化合物、含氮类化合物、烷烃类化合物呈正相关。其中,A6产生的双乙酰,乙偶姻、2-庚酮和2-壬酮等关键性风味物质在样品中的浓度较高(表5),对样品的风味贡献较大,赋予发酵乳良好风味。
通过综合分析对照菌株JD和6组复配发酵乳中挥发性风味物质的种类及含量。认为A6复配发酵菌株产生良好的挥发性风味物质,有良好产香特性。
2.3 复配发酵乳电子鼻检测结果
2.3.1 电子鼻传感器响应值结果分析
利用PEN3型电子鼻系统,检测分析复配发酵乳样品的气味成分。对照菌株和6组复配发酵乳响应值的雷达图,发酵乳电子鼻10个传感器的气味检测结果如图2所示。
其中,W5S、W2W、W1W、W2S、W1S、W6S六种传感器发生变化,分别对氮氧类、芳香类、硫化物、醇类及醛酮类等化合物敏感。说明这6种传感器在发酵乳香气检测过程中贡献较大。
2.3.2 电子鼻主成分分析
对照菌株JD和6组复配发酵乳电子鼻PCA结果如图3所示,PC1和PC2方差贡献率分别为94.35%和2.86%,2个主成分累积总贡献率达97.21%,有效反映原始数据绝大部分信息。由图3可知,对照菌株和6组复配发酵乳样品区分明显,均分布于各自独立的区域,说明发酵终点不同发酵乳样品之间风味特征不同[27],电子鼻可以较好地区分不同发酵乳样品中的挥发性风味物质。发酵乳样品LDA分析结果如图4所示,LD1和LD2贡献率分别为81.80%和9.74%,两判别式总贡献率91.54%。由图4可知,椭圆区域内各样品分布趋势各不相同,不同样品区分明显,互不重叠。说明LDA法能很好地区分对照菌株和6组发酵乳中的风味物质。因此,通过PCA结合LDA分析发现,与对照菌株JD进行比较,相比于其他菌株,A6菌株与对照菌株距离较近,风味较相似,说明A6发酵风味良好。
3 结论
本实验采用SPME-GC-MS结合电子鼻技术检测分析复配发酵乳中挥发性风味物质。结果表明,复配发酵乳均以酸类、醛类、酮类、醇类、酯类、烷烃类及氮类等化合物组成。对照菌株JD和6组复配发酵乳挥发性风味物质比较分析、OAV、PCA及LDA分析,结果显示不同复配发酵乳产生的风味不同。其中,A6产生的双乙酰,乙偶姻、2-庚酮和2-壬酮等特征风味物质在样品中的浓度较高,对样品的风味贡献较大,赋予发酵乳良好风味。相比于其他菌株,A6菌株与对照菌株JD距离较近,风味较相似。说明A6发酵风味良好,优于其他菌株。因此,本研究筛选得到的A6复配组产生的特征风味物质使发酵乳风味优良,具有良好产香特性,为发酵剂的开发与利用提供数据支持。
参考文献
[1] 王琴,朱小红,任远庆,等.不同乳酸菌及其组合发酵乳的产香特性分析[J].食品工业科技,2008,29(6):73-76.
[2] FERREIRA V, ORT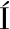 N N, ESCUDERO A,et al.Chemical characterization of the aroma of grenache rose wines: Aroma extract dilution analysis, quantitative determination, and sensory reconstitution studies[J]. Journal of Agricultural and Food Chemistry,2002,50(14):4 048-4 054.
N N, ESCUDERO A,et al.Chemical characterization of the aroma of grenache rose wines: Aroma extract dilution analysis, quantitative determination, and sensory reconstitution studies[J]. Journal of Agricultural and Food Chemistry,2002,50(14):4 048-4 054.
[3] FENG Y,CAI Y,SU G,et al.Evaluation of aroma differences between high-salt liquid-state fermentation and low-salt solid-state fermentation soy sauces from China[J].Food Chemistry,2014,145(15):126-134.
[4] CHENG H,QIN Z H,GUO X F,et al.Geographical origin identification of propolis using GC-MS and electronic nose combined with principal component analysis[J].Food Research International,2013,51(2):813-822.
[5] 荣建华,熊诗,张亮子,等.基于电子鼻和SPME-GC-MS联用分析脆肉鲩鱼肉的挥发性风味成分[J].食品科学,2015,36(10):148-152.
[6] 范霞,陈荣顺.SPME/GC-MS法结合电子鼻技术测定茶叶中的香气成分[J].检验检疫学刊,2019,29(2):13-24.
[7] CHENG H F.Volatile flavor compounds in yogurt: A review[J].Critical Reviews in Food Science and Nutrition,2010,50(10):938-950.
[8] NOBLE A C.Evaluation of chardonnay wines obtained from sites with different soil compositions[J].American Journal of Enology and Viticulture,1979,30(3):214-217.
[9] 宋昊,郑玉芝.黄豆豆渣发酵产物中挥发性风味化合物成分分析[J].食品科学,2016,37(10):176-182.
[10] SPANIER A M,SHAHIDI F,PARLIMENT T H,et al.Effect of milk composition and heating on flavor and aroma of yogurt[J].Special Publicatio-Royal Society of Chemistry, 2001, 274(1):160-170.
[11] SINGH T K,DRAKE M A,CADWALLADER K R.Flavor of cheddar cheese: A chemical and sensory perspective[J].Comprehensive Reviews in Food Science and Food Safety,2010,2(4):166-189.
[12] PATTON S.Flavor thresholds of volatile fatty acids[J].Journal of Food Science,1964,29(5):679-680.
[13] 牛婕,甘伯中,乔海军,等.牦牛乳软质干酪成熟期挥发性风味成分分析[J].食品科学,2010,31(18):285-289.
[14] 丹彤,包秋华,孟和毕力格,等.发酵乳风味物质乙醛、双乙酰的合成途径及其调控机制[J].食品科技, 2012, 37(7):75-79.
[15] DE BOK F A M,JANSSEN P W M,BAYJANOV J R,et al.Volatile compound fingerprinting of mixed-culture fermentations[J].Applied & Environmental Microbiology,2011,77(17):6 233-6 239.
[16] CHU F L,YAYLAYAN V A.Model studies on the oxygen-induced formation of benzaldehyde from phenylacetaldehyde using pyrolysis GC-MS and FTIR[J].Journal of Agricultural and Food Chemistry,2008,56(22):10 697-10 704.
[17] PIOMBINO P,PESSINA R,GENOVESE A,et al.Sensory profiling,volatiles and odour-active compounds of canestratopugliese PDO cheese made from raw and pasteurized ewes′ milk[J].Italian Journal of Food Science,2008,20(2):225-237.
[18] 赵建新,陈洁,田丰伟,等.中温发酵酸乳的挥发性风味成分与感官特性的研究[J].食品工业科技,2008,29(12):63-67.
[19] GARDINI F, LANCIOTTI R, GUERZONI M E,et al. Evaluation of aroma production and survival of Streptococcus thermophilus, Lactobacillus delbrueckii subsp. Bulgaricus and Lactobacillus acidophilus in fermented milks[J].International Dairy Journal,1999,9(2):125-134.
[20] 刘景,孙克杰,郭本恒.成品发酵乳主要风味物质与风味指标的相关性研究[J].中国乳品工业,2011,39(12):17-21.
[21] CHIOFALO B,ZUMBO A,COSTA R,et al.Characterization of maltese goat milk cheese flavour using SPME-GC/MS[J].South African Journal of Animal Science,2004,34(1):176-180.
[22] 张颖,布冠好,郑喆,等.脱脂乳发酵过程中β-乳球蛋白和α-乳白蛋白抗原性变化规律[J].食品与发酵工业, 2010, 36(6):7-11.
[23] GEORGALA A K,TSAKALIDOU E,KANDARAKIS I,et al.Flavour production in ewe′s milk and ewe′s milk yoghurt,by single strains and combinations of Streptococcus thermophilus and Lactobacillus delbrueckii subsp bulgaricus,isolated from traditional Greek yoghurt[J].Dairy Science & Technology,1995,3(3):259-263.
[24] OTT A,GERMOND J E,BAUMGARTNER M,et al.Aroma comparisons of traditional and mild yogurts: Headspace gas chromatography quantification of volatiles and origin of α-diketones[J].Journal of Agricultural and Food Chemistry,1999,47(6):2 379-2 385.
[25] MOLIMARD P,SPINNLER H E.Review: Compounds involved in the flavor of surface mold-ripened cheeses: origins and properties[J].Journal of Dairy Science,1996,79(2):169-184.
[26] SUDUN, WULIJIDELIGEN, ARAKAWA K,et al. Interaction between lactic acid bacteria and yeasts in airag, an alcoholic fermented milk[J].Animal Science Journal,2013,84(1):66-74.
[27] 叶蔺霜.电子鼻技术在花生品质中的初步应用研究[D].杭州:浙江大学,2012.










 N N, ESCUDERO A,et al.Chemical characterization of the aroma of grenache rose wines: Aroma extract dilution analysis, quantitative determination, and sensory reconstitution studies[J]. Journal of Agricultural and Food Chemistry,2002,50(14):4 048-4 054.
N N, ESCUDERO A,et al.Chemical characterization of the aroma of grenache rose wines: Aroma extract dilution analysis, quantitative determination, and sensory reconstitution studies[J]. Journal of Agricultural and Food Chemistry,2002,50(14):4 048-4 054.