鼠李糖乳杆菌FZJTZ46L6通过影响肠道内短链脂肪酸的水平缓解小鼠由葡聚糖硫酸钠导致的结肠炎
郑雨星,朱慧越,焦婷,杨树荣,刘倩,王刚*,赵建新,张灏,陈卫
(江南大学 食品学院,江苏 无锡,214122)
摘 要 该文通过葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的结肠炎小鼠模型,评价2株鼠李糖乳杆菌对小鼠结肠炎的缓解效果并探究其作用机制。结果显示,鼠李糖乳杆菌FZJTZ46L6对DSS引起的小鼠结肠炎具有显著的缓解作用,且效果优于FNMGEL5-1。FZJTZ46L6能够显著缓解DSS引起的小鼠体重下降,改善粪便性状和便血情况,且显著改善结肠黏膜损伤和炎症产生。而FNMGEL5-1虽然在一定程度上缓解了DSS引起的疾病症状,但是对于结肠炎症浸润和病理损伤没有改善作用。与模型组相比,鼠李糖乳杆菌FZJTZ46L6干预后显著提高结肠紧密连接相关蛋白基因转录水平,降低促炎因子TNF-α、IL-1β、IL-6和IFN-γ含量,显著增加小鼠粪便中短链脂肪酸含量,显著提高丙酸和丁酸产生菌属Coprococcus丰度并增加肠道菌群多样性。
关键词 鼠李糖乳杆菌;结肠炎;短链脂肪酸;肠道菌群
DOI:10.13995/j.cnki.11-1802/ts.023285
引用格式:郑雨星,朱慧越,焦婷,等.鼠李糖乳杆菌FZJTZ46L6通过影响肠道内短链脂肪酸的水平缓解小鼠由葡聚糖硫酸钠导致的结肠炎[J].食品与发酵工业,2020,46(10):44-52.ZHENG Yuxing, ZHU Huiyue, JIAO Ting, et al. Lactobacillus rhamnosus FZJTZ46L6 alleviates colitis induced by dextran sulfate sodium in mice through short-chain fatty acids regulation[J].Food and Fermentation Industries,2020,46(10):44-52.
第一作者:硕士研究生(王刚副教授为通讯作者,E-mail:wanggang@jiangnan.edu.cn)
基金项目:国家自然科学基金项目(31671839)
收稿日期:2020-01-07,改回日期:2020-03-02
Lactobacillus rhamnosus FZJTZ46L6 alleviates colitis induced by dextran sulfate sodium in mice through short-chain fatty acids regulation
ZHENG Yuxing,ZHU Huiyue,JIAO Ting,YANG Shurong,LIU Qian,WANG Gang*,ZHAO Jianxing,ZHANG Hao,CHEN Wei
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
ABSTRACT In this study, DSS-induced colitis mice were used to investigate the effects of two Lactobacillus rhamnosus strains on disease and their potential mechanisms. C57BL/6J mice with colitis induced by 25 g/L DSS were administered with L. rhamnosus strains for 28 d. The results showed that L. rhamnosus FZJTZ46L6 alleviated DSS-induced colitis significantly and more effectively than that by FNMGEL5-1. L. rhamnosus FZJTZ46L6 alleviated the body weight loss caused by DSS, improved stool consistency and relieved bloody stool, and significantly improved the colonic mucosal damage in mice. Although FNMGEL5-1 alleviated the symptoms of diseases caused by DSS, it showed no effect on colonic inflammation and pathological damage. In addition, compared with the model group, L. rhamnosus FZJTZ46L6 significantly increased the transcription level of tight junction proteins in colon and reduced pro-inflammatory cytokines such as TNF-α、IL-1β、IL-6 and IFN-γ in colon. Besides, the content of short-chain fatty acids in the feces of mice was also increased significantly. The abundance of genera Coprococcus, the propionate and butyrate-producing bacteria, were elevated together with the diversity of gut microbiota.
Key words Lactobacillus rhamnosus; colitis; short-chain fatty acids; gut microbiota
炎症性肠病(inflammatory bowel disease,IBD)是一种易复发的胃肠道炎症性疾病,目前其发病机制尚不清楚,研究显示主要与遗传因素,肠道屏障,免疫紊乱,肠道菌群以及环境因素有关[1]。IBD患者的肠道屏障受到破坏,主要表现为肠道黏液层变薄甚至消失;肠道紧密连接结构损伤,肠道上皮组织(包括肠上皮细胞,杯状细胞,神经内分泌细胞,潘氏细胞和M细胞)破坏;肠道固有层免疫细胞异常应答并产生大量促炎症细胞因子,导致肠黏膜炎症反应[1-3]。IBD患者的临床表现主要是腹痛、腹泻、便血和体重下降。目前常用的IBD治疗药物作用比较局限,且副作用较多[2]。
肠道菌群与宿主共同进化形成复杂的互利共生关系,参与宿主许多的生理功能[3]。肠道稳态的破坏与多种疾病的发生发展密切相关,包括炎症性肠病,抑郁症,糖尿病等[3-5]。研究显示,与健康人相比,IBD 患者肠道菌群的稳定性降低,表现为肠道菌群多样性和丰富度降低以及肠道菌群组成和结构改变[3]。GOPHNA等[6]发现克罗恩病患者肠道中变形菌门和拟杆菌门数量显著增加,梭状芽孢杆菌丰度降低。研究显示,IBD患者的粪便样品中丁酸产生菌的数量显著减少,炎症反应相关的菌群数量增加[7-8]。此外,肠道菌群对于IBD的影响还体现在参与宿主的代谢,ZELANTE等[9]发现肠道菌群参与宿主色氨酸代谢生成芳香烃受体激活配体并影响DSS诱导结肠炎小鼠的恢复。
短链脂肪酸(short chain fatty acids, SCFAs)是肠道菌群发酵膳食纤维产生的代谢产物,主要包括乙酸、丙酸、异丁酸、丁酸、异戊酸和戊酸。研究显示乙酸,丙酸和丁酸具有增强肠道屏障功能,改善肠黏膜损伤的作用,主要途径包括通过识别肠上皮细胞膜受体GPR41、GPR43等激活下游的信号通路,增加Treg细胞增殖,抑制Th1细胞和Th17细胞分化,降低炎症因子水平[10];激活核受体PPARγ, 抑制NF-κB信号通路, 减少促炎因子表达;通过激活转录因子(包括STAT3和SP1等)[11]诱导编码紧密连接相关组件的基因促进紧密连接蛋白表达, 保持肠上皮完整;丁酸作为组蛋白去乙酰化酶抑制剂, 能够抑制炎症基因表达, 增加抗菌肽分泌从而减少黏膜炎症[12]。
鼠李糖乳杆菌作为益生菌的一种,安全性高且具有多种健康功能而被广泛应用于食品生产。已有大量的研究报道鼠李糖乳杆菌在缓解结肠炎上的益处[13-14]。本文选取了来自于2个不同地区(浙江台州,内蒙古二连浩特),全基因组比对分析后处于进化树不同分支上亲缘关系较远的2株鼠李糖乳杆菌,探究其对于DSS诱导的小鼠结肠炎的缓解效果及作用机制,以期为进一步探究鼠李糖乳杆菌缓解结肠炎的研究打下基础,为有益于健康的益生菌产品开发利用提供参考依据。
1 材料与方法
1.1 试验菌株
鼠李糖乳杆菌FZJTZ46L6、FNMGEL5-1,均来源于江南大学食品生物技术中心菌种保藏库。其中,菌株FZJTZ46L6,分离自浙江台州人群粪便样本,菌株FNMGEL5-1,分离自内蒙古二连浩特人群粪便样本。
1.2 试剂与仪器
葡聚糖硫酸钠,美国MP Biomedicals;美沙拉嗪缓释颗粒,上海爱的发制药有限公司;粪便隐血试剂盒,珠海贝索生物技术有限公司;髓过氧化物酶检测试剂盒,南京建成生物工程研究所;TNF-α,IL-1β,IL-6,IFN-γ酶联免疫试剂盒,美国R&D Systems公司; HiFiScript gDNA Removal cDNA Synthesis Kit,康为世纪生物科技有限公司;PCR 扩增引物以及合成序列,上海生工生物工程有限公司; 粪便DNA快速提取试剂盒,美国MP biomedicals有限公司;胶回收试剂盒,倍沃医学科技有限公司。
HWS-80隔水式恒温培养箱,上海森信实验仪器有限公司;GCMS-QP2010单四级杆气相色谱质谱联用仪,岛津公司;CFX ConnectTM Real-time System实时荧光定量基因扩增仪,伯乐公司;Pannoramic MIDI 数字切片扫描仪,匈牙利3DHistech;Illumina miseq pe300高通量测序仪,Illumina公司。
1.3 菌株活化和培养
用接种环蘸取少量鼠李糖乳杆菌冻存菌液,在MRS固体平板上划线并置于37 ℃培养箱内培养48 h。挑取单菌落接种于MRS液体培养基中,37 ℃培养箱内培养15 h,接着以2%体积分数接种量扩增培养18 h后,以5 000 r/min转速在4 ℃下离心 5 min收集菌体,用无菌的 PBS 洗 3 次后用300 g/L蔗糖溶液重悬菌体冻存于-80 ℃。
1.4 动物试验设计
实验动物为4周龄SPF级健康雄性C57BL/6J 小鼠,购于上海斯莱克实验动物有限公司,动物伦理审查编号为JN.No20190430c0900605[101],饲养于(23±2)℃,相对湿度(50±10)%,12 h光照12 h黑夜交替的屏障环境内。30只小鼠随机分为空白组、模型组、药物组、鼠李糖乳杆菌FZJTZ46L6,鼠李糖乳杆菌FNMGEL5-1共5组,每组6只。适应饲养1周,适应期内所有组均给予正常饮水与饲料。从第2周开始,空白组、模型组每日灌胃30 g/L蔗糖溶液0.2 mL,药物组每日灌胃含美沙拉嗪(给药剂量300 mg/kg)的30g/L蔗糖溶液0.2 mL,实验组每日灌胃1×109 CFU鼠李糖乳杆菌的3%蔗糖溶液0.2 mL,持续27 d。第29天,在小鼠饮水中添加 25 g/L DSS,连续饲喂7 d诱导小鼠急性结肠炎。动物试验设计如表1所示。
表1 动物实验设计方案
Table 1 Animal experimental design
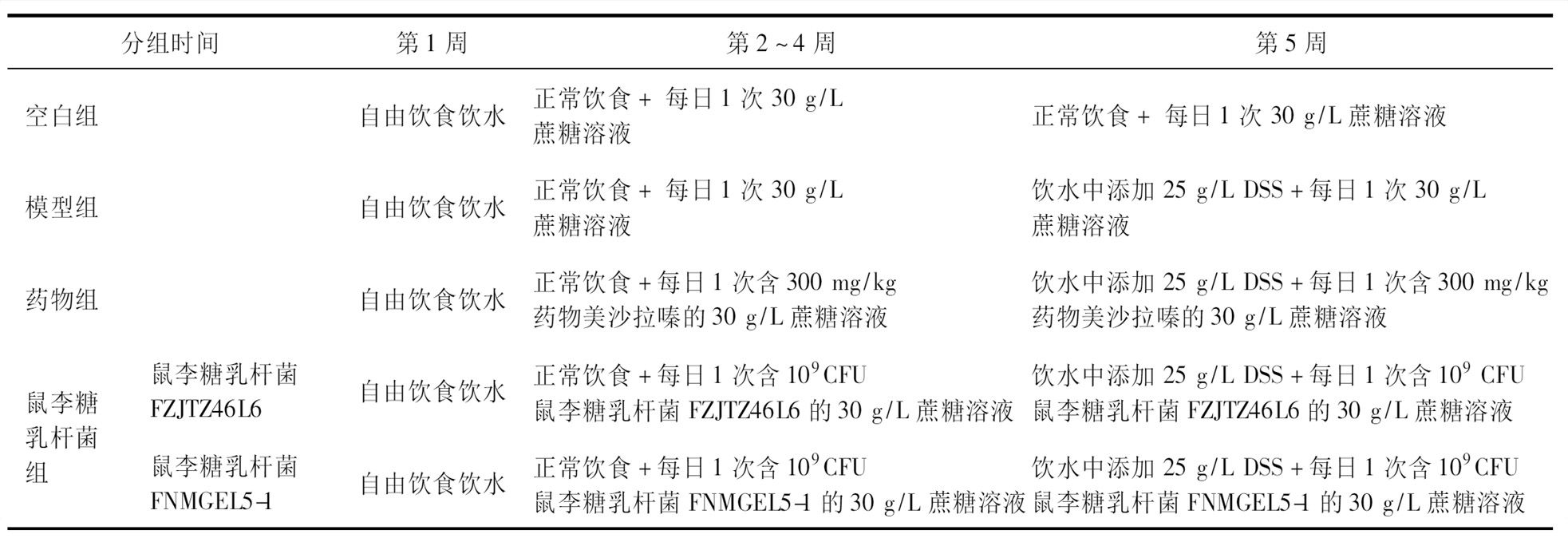
分组时间第1周第2~4周第5周空白组自由饮食饮水正常饮食+每日1次30g/L蔗糖溶液正常饮食+每日1次30g/L蔗糖溶液模型组自由饮食饮水正常饮食+每日1次30g/L蔗糖溶液饮水中添加25g/LDSS+每日1次30g/L蔗糖溶液药物组自由饮食饮水正常饮食+每日1次含300mg/kg药物美沙拉嗪的30g/L蔗糖溶液饮水中添加25g/LDSS+每日1次含300mg/kg药物美沙拉嗪的30g/L蔗糖溶液鼠李糖乳杆菌组鼠李糖乳杆菌FZJTZ46L6自由饮食饮水正常饮食+每日1次含109CFU鼠李糖乳杆菌FZJTZ46L6的30g/L蔗糖溶液饮水中添加25g/LDSS+每日1次含109CFU鼠李糖乳杆菌FZJTZ46L6的30g/L蔗糖溶液鼠李糖乳杆菌FNMGEL5-1自由饮食饮水正常饮食+每日1次含109CFU鼠李糖乳杆菌FNMGEL5-1的30g/L蔗糖溶液饮水中添加25g/LDSS+每日1次含109CFU鼠李糖乳杆菌FNMGEL5-1的30g/L蔗糖溶液
1.5 试验指标测定
1.5.1 体重变化和疾病活动指数计算
造模期间,每天定时称量小鼠体重并计算其变化的百分比。此外,每日观察小鼠的粪便性状,根据BERBERAT等[15]的方将其分为3个等级: 第一, 正常小鼠的粪便成型, 且为颗粒状; 第二,粪便黏度增加且易散,但不黏附于肛门则为“松散”;第三,粪便呈稀水样或不成形且黏附于肛门,即为“稀便”。同时,使用匹拉米洞法测定小鼠粪便隐血情况,若小鼠粪便含有肉眼可见的红褐色或鲜红色血液,则判定为肉眼便血。最后,根据 BERBERAT等[15]的评分标准,计算得出小鼠的疾病活动指数(disease activity index,DAI),具体评分项目得分如表2所示。
表2 动物疾病活动指数评分系统
Table 2 Scoring standard of the disease activity index
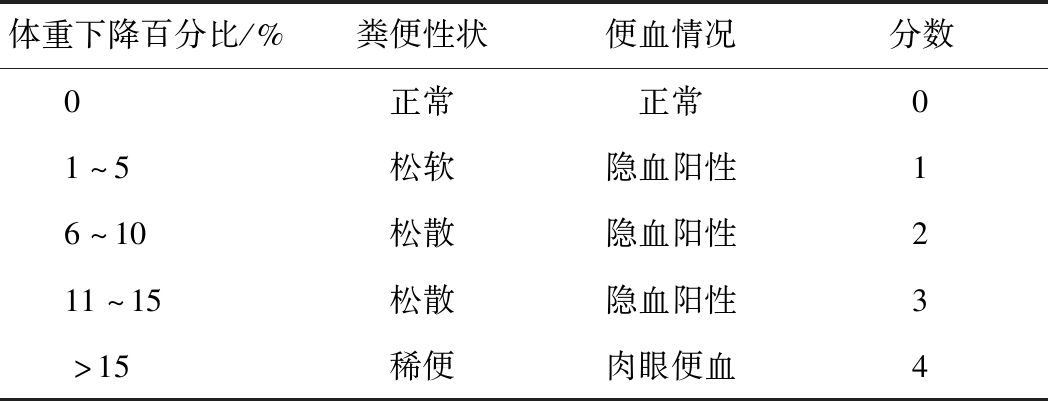
体重下降百分比/%粪便性状便血情况分数0正常正常01~5松软隐血阳性16~10松散隐血阳性211~15松散隐血阳性3>15稀便肉眼便血4
1.5.2 结肠HE染色及组织损伤评分
小鼠结肠石蜡切片和HE染色参考王俊通[7]的方法。使用Pannoramic MIDI 数字切片扫描仪对HE染色切片进行扫描拍照,所得照片从肠黏膜上皮病变、肠隐窝损害、炎症浸润和纤维组织增生4个方面进行组织损伤评分。
1.5.3 结肠组织髓过氧化物酶活性测定
按照MPO试剂盒说明书测定小鼠结肠中的髓过氧化物酶活性。
1.5.4 小鼠结肠中细胞因子含量测定
根据ELISA试剂盒说明书测定小鼠结肠组织中的细胞因子TNF-α、IL-1β、IL-6和IFN-γ的含量。
1.5.5 RT-QPCR测定结肠紧密连接相关蛋白基因表达水平
在PrimerBank上查找得到小鼠4种紧密连接相关蛋白Claudin-3、ZO-1、ZO-2和Occludin和GAPDH基因的引物序列,由上海生工有限公司合成引物,序列如表3所示。
根据王俊通[7]的方法提取小鼠结肠RNA,按照反转录试剂盒说明书合成cDNA并进行荧光定量PCR实验。QPCR的反应体系为5 μL SYBR Green Supermix,3 μL去离子水,0.5 μL上游引物(10 μmol/L),0.5 μL下游引物(10 μmol/L)和1 μL的cDNA模板(100 ng/μL)。QPCR运行程序设定为94 ℃,2 min,(94 ℃,30 s;61 ℃,30 s;72 ℃,20 s)39个循环。确保扩增产物溶解曲线为单峰,且CT值均在可信范围之内,阴性对照NTC无扩增。
表3 引物序列
Table 3 Primer sequence

基因序列GAPDH5′-TCAAGAAGGTGGTGAAGCAG-3′5′-AAGGTGGAAGAGTGGGAGTTG-3′Claudin-35′-AACTGCGTACAAGACGAGACG-3′5′-ATCCCTGATGATGGTGTTGG-3′ZO-15′-CTTCTCTTGCTGGCCCTAAAC-3′5′-TGGCTTCACTTGAGGTTTCTG-3′ZO-25′-ATGGGAGCAGTACACCGTGA-3′5′-TGACCACCCTGTCATTTTCTTG-3′Occludin5′-CACACTTGCTTGGGACAGAG-3′5′-TAGCCATAGCCTCCATAGCC-3′
1.5.6 小鼠粪便中短链脂肪酸含量测定
根据毛丙永[16]的方法利用岛津单四级杆气质联用仪测定小鼠冻干粪便中的短链脂肪酸含量。
1.5.7 小鼠肠道16S rDNA宏基因组测序
收集小鼠解剖前1天的粪便,用DNA快速提取试剂盒按说明书方法步骤提取粪便中的DNA,参照文献[17]的研究方法对样本16S rDNA的V3~V4区进行PCR扩增,用胶回收试剂盒对扩增片段进行纯化回收,在Illumina miseq pe300平台进行高通量测序,采用 QIIME2分析平台对扩增子进行分析。
1.6 数据统计方法
数据表示为“平均值±标准差”(Means±S.D.),使用 GraphPad Prism 5绘图。应用 SPSS 软件对试验数据进行统计分析,采用单因素方差分析(one-way ANOVA)或者 t 检验(student’s t-tests)分析进行差异显著性检验,采用pearson方法进行相关性分析,PCA分析在网站https://www.metaboanalyst.ca/MetaboAnalyst/home.xhtml完成。LEfSe分析在网站http://huttenhower.sph.harvard.edu/galaxy/完成。
2 结果与分析
2.1 鼠李糖乳杆菌改善结肠炎小鼠肠道黏膜损伤
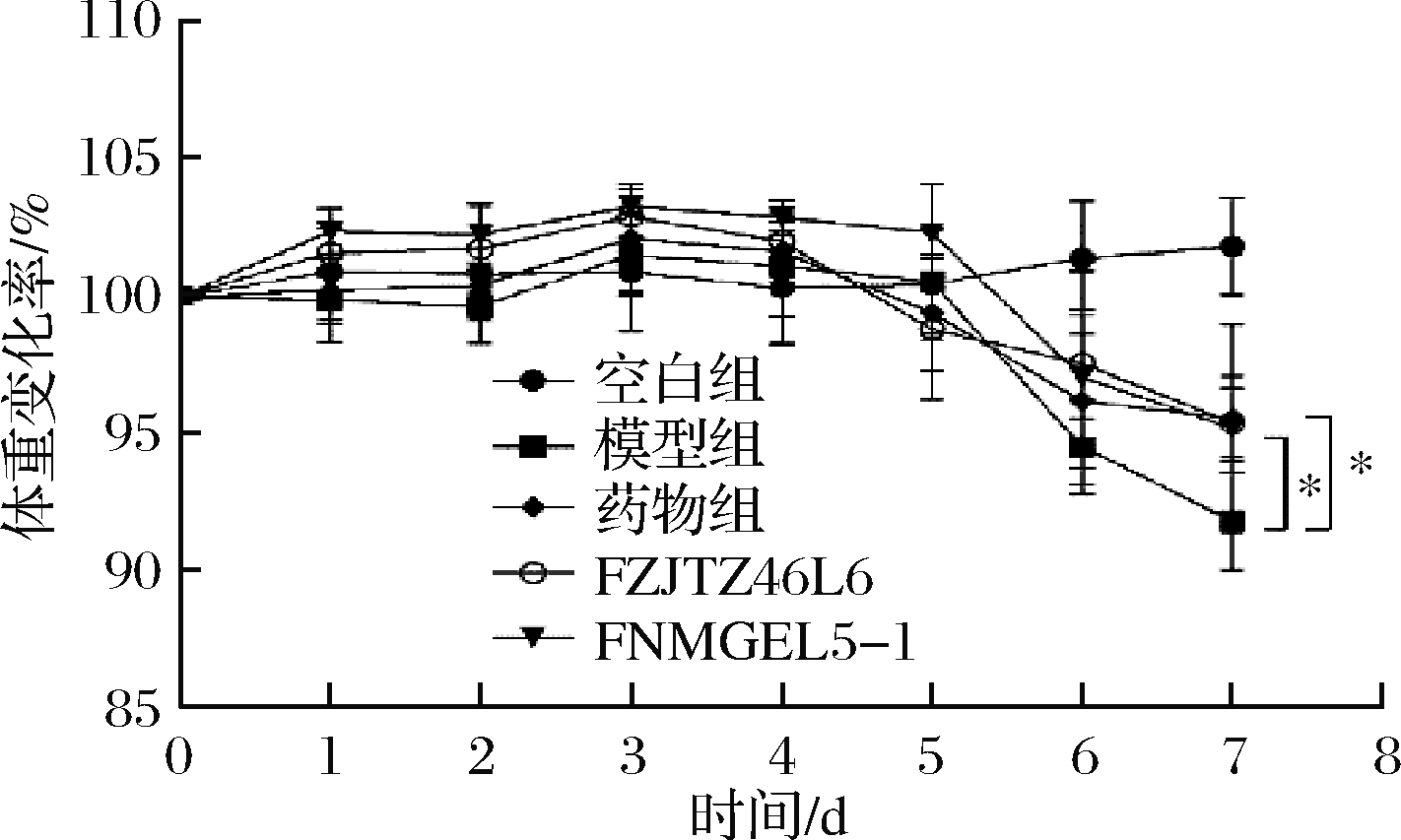
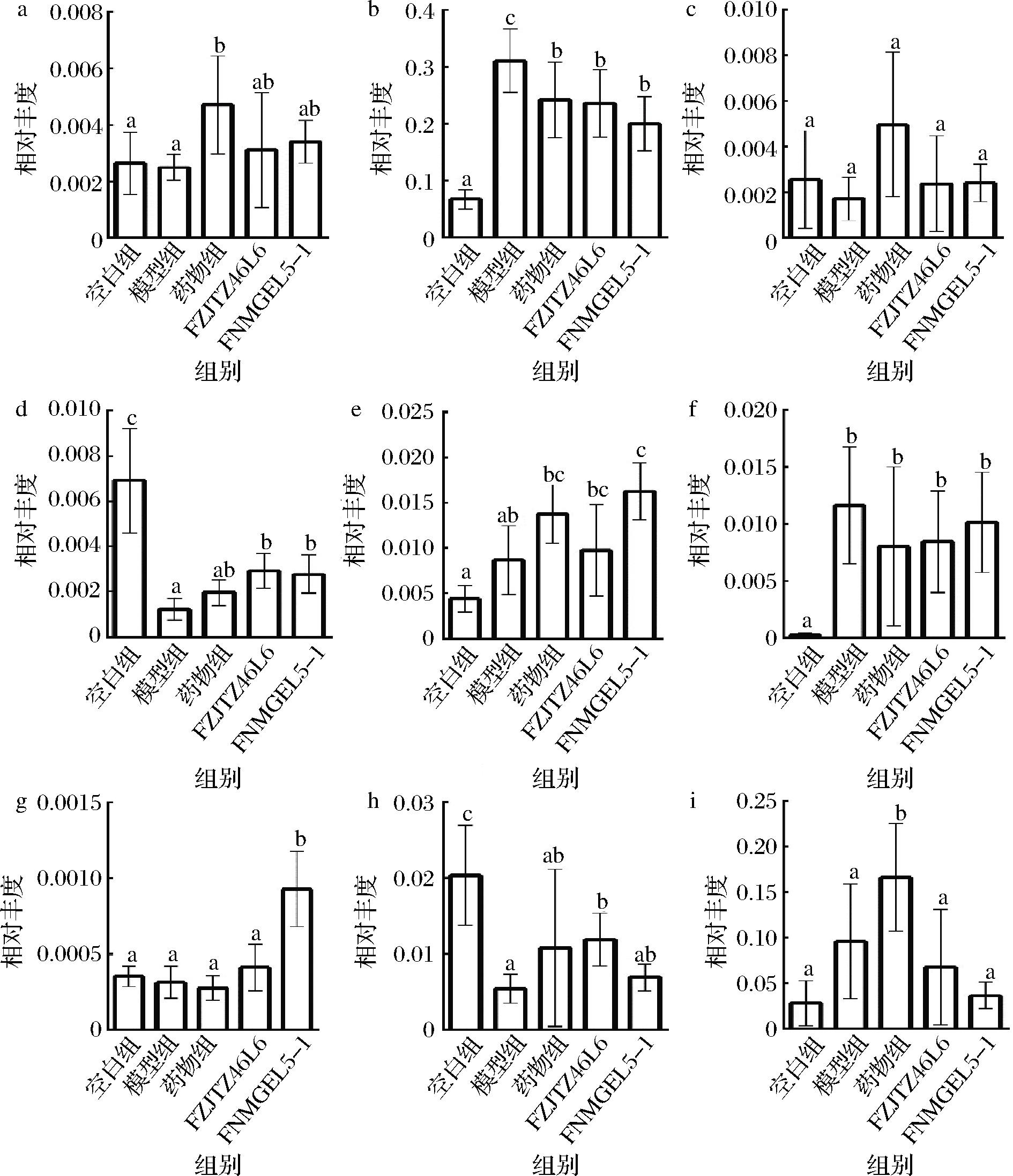
本文采用DSS诱导小鼠结肠炎并通过测定造模期间小鼠的体重变化,疾病活动指数,小鼠结肠病理评分以及小鼠结肠髓过氧化物酶活性来评估2株鼠李糖乳杆菌对于小鼠肠道损伤的改善作用。造模期间,模型组小鼠出现明显的便血,粪便松散并从第5天开始体重显著下降(图1)。与模型组相比,鼠李糖乳杆菌FZJTZ46L6和FNMGEL5-1均能显著减少DSS引起的体重下降并改善粪便性状,降低DAI值,且效果优于300 mg/kg的药物美沙拉嗪(图1,表4)。
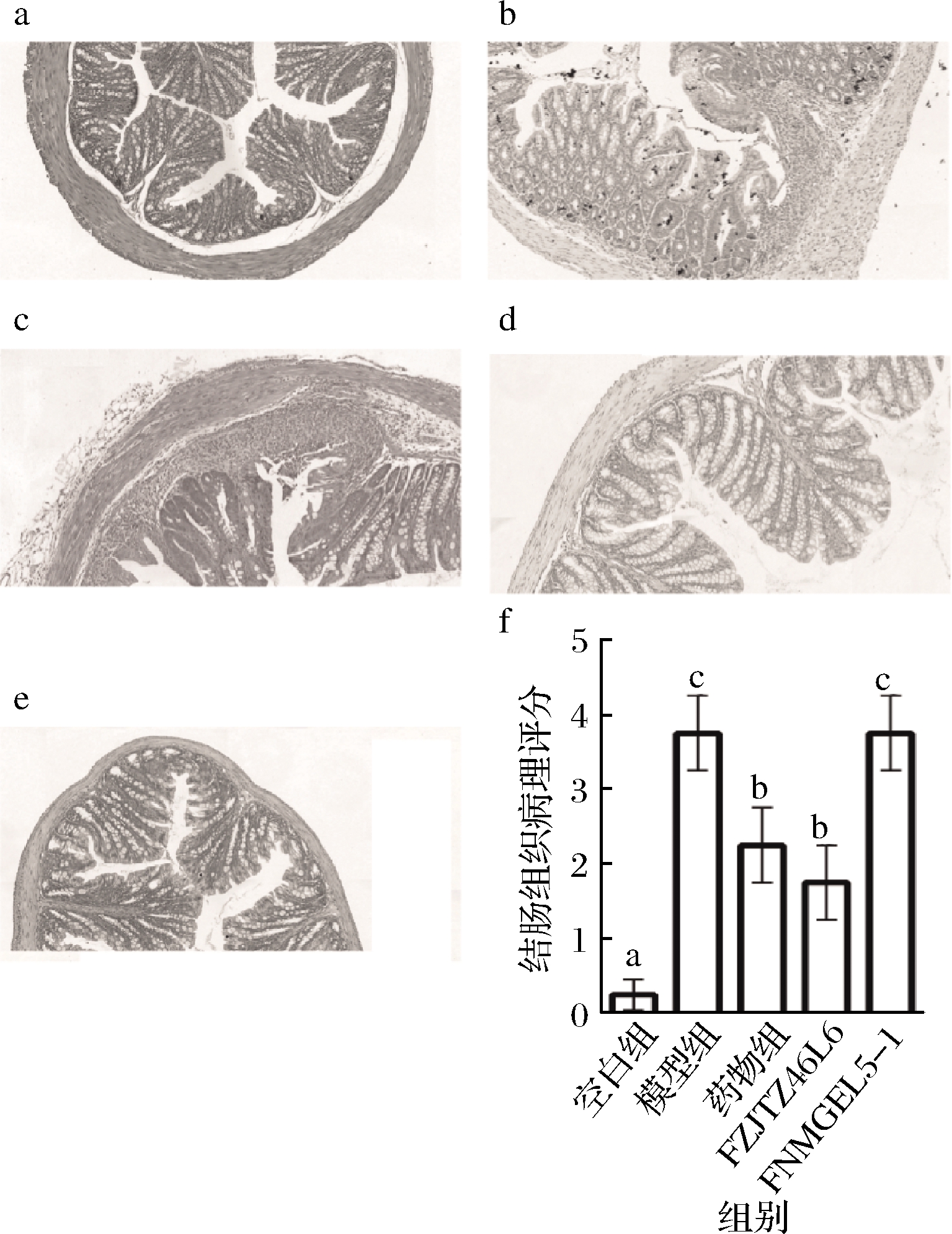
通过HE染色对小鼠结肠病理进行观察并评分,由图2可知空白组小鼠结肠形态良好,肠上皮完整,隐窝结构完整,排列有序且含有大量的杯状细胞,没有发现炎症细胞浸润;模型组小鼠结肠可见大量黏膜上皮细胞变性、坏死,杯状细胞数量明显减少和肠隐窝损伤,炎细胞浸润及纤维组织增生等病理变化,其结肠组织损伤评分显著高于空白对照组;鼠李糖乳杆菌FZJTZ46L6能够显著减少上述组织病变,除极个别隐窝结构损坏,其结肠结构与正常组相似,组织损伤评分显著低于模型组;阳性对照药物美沙拉嗪也较好地保护了结肠组织结构,但仍可见部分上皮结构和隐窝结构损坏以及炎症浸润。而鼠李糖乳杆菌FNMGEL5-1对结肠黏膜病理损伤没有显著改善效果,可见与模型组类似程度的隐窝结构破坏和炎症侵润。
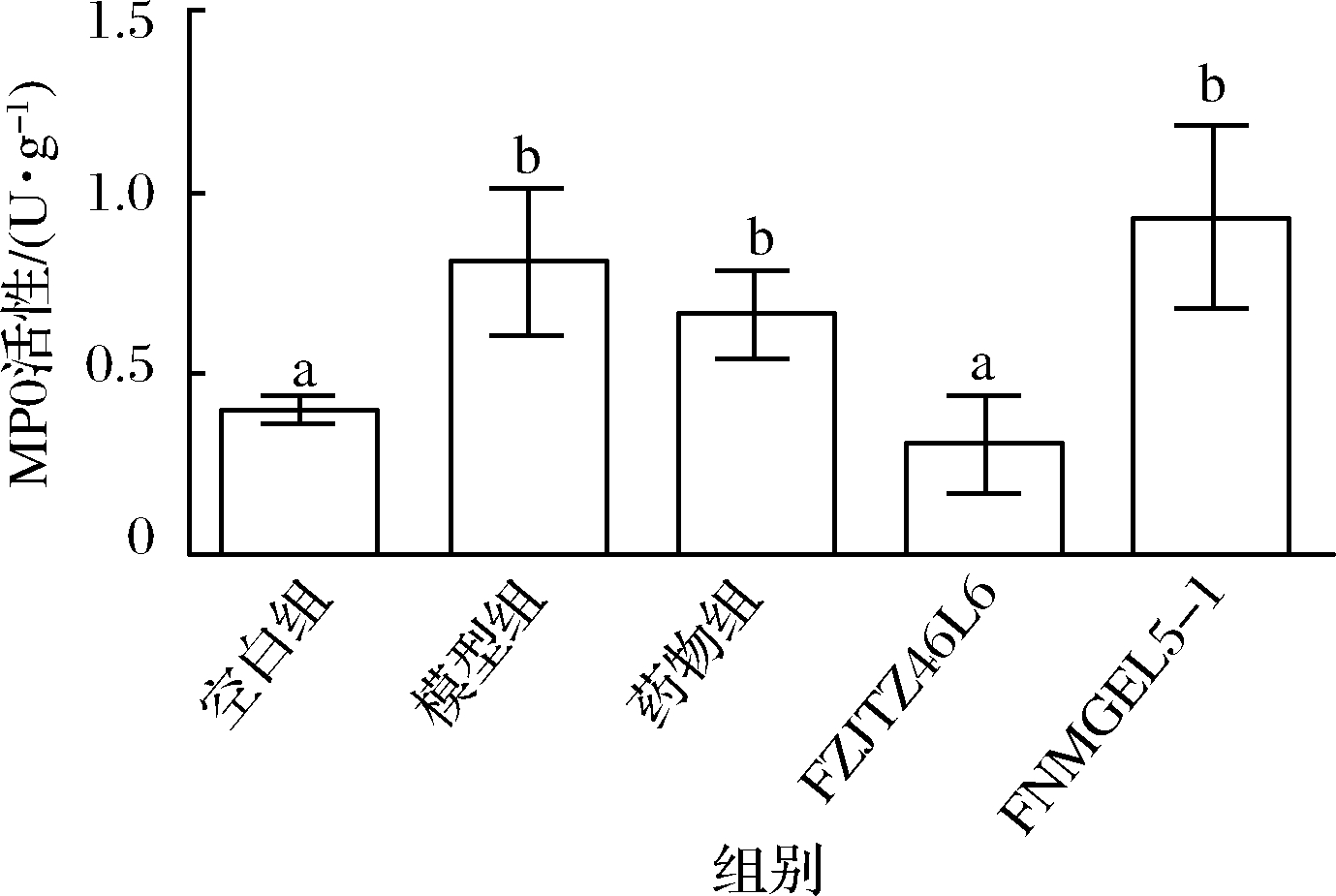
髓过氧化物酶(myeloperoxidase,MPO)富含于中性粒细胞和单核细胞中,在受到外界刺激时,中性粒细胞嗜天青颗粒释放MPO并造成炎症损伤[18]。肠道炎症反应是结肠炎的病理基础,而中性粒细胞和单核细胞的吞噬作用是炎症反应的中心环节[19]。故MPO活性可作为以中性粒细胞为主的炎症浸润指标并作为评价结肠炎炎症严重程度的指标[19-20]。由图3可知,造模组的MPO值显著高于空白组,而鼠李糖乳杆菌FZJTZ46L6组的MPO值几乎回到了正常水平,表明菌株FZJTZ46L6能够显著减轻结肠炎症浸润。而药物干预和菌株FNMGEL5-1均不能抑制DSS引起的MPO升高,可见美沙拉嗪和FNMGEL5-1不能减轻结肠炎症细胞浸润。该结果与病理结果相一致,表明鼠李糖乳杆菌FZJTZ46L6可以通过减少中性粒细胞的数量,减轻炎症反应,实现对小鼠结肠炎的缓解作用。
表4 小鼠造模期间疾病活动指数
Table 4 Disease activity index during DSS treatment
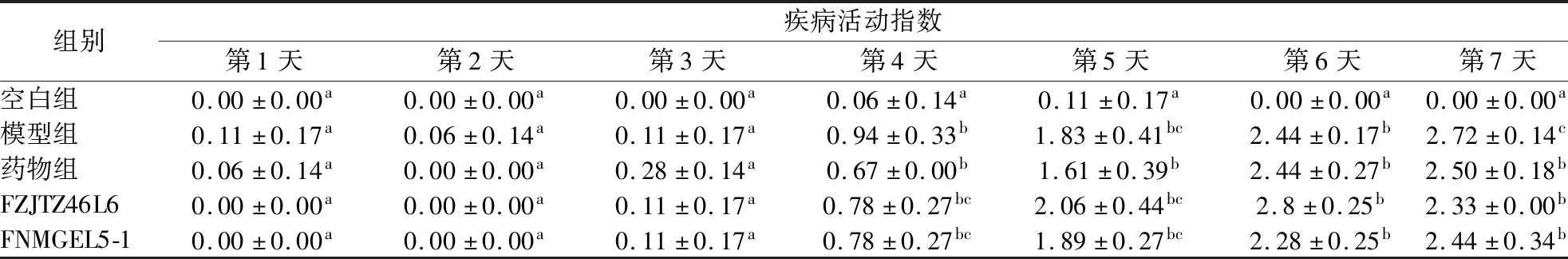
组别疾病活动指数第1天第2天第3天第4天第5天第6天第7天空白组0.00±0.00a0.00±0.00a0.00±0.00a0.06±0.14a0.11±0.17a0.00±0.00a0.00±0.00a模型组0.11±0.17a0.06±0.14a0.11±0.17a0.94±0.33b1.83±0.41bc2.44±0.17b2.72±0.14c药物组0.06±0.14a0.00±0.00a0.28±0.14a0.67±0.00b1.61±0.39b2.44±0.27b2.50±0.18bFZJTZ46L60.00±0.00a0.00±0.00a0.11±0.17a0.78±0.27bc2.06±0.44bc2.8±0.25b2.33±0.00bFNMGEL5-10.00±0.00a0.00±0.00a0.11±0.17a0.78±0.27bc1.89±0.27bc2.28±0.25b2.44±0.34b
注:表中同一列标注相同小写字母表示不同组间无显著差异,否则具有显著差异(P<0.05)(下同)
2.2 鼠李糖乳杆菌降低小鼠结肠中促炎细胞因子含量
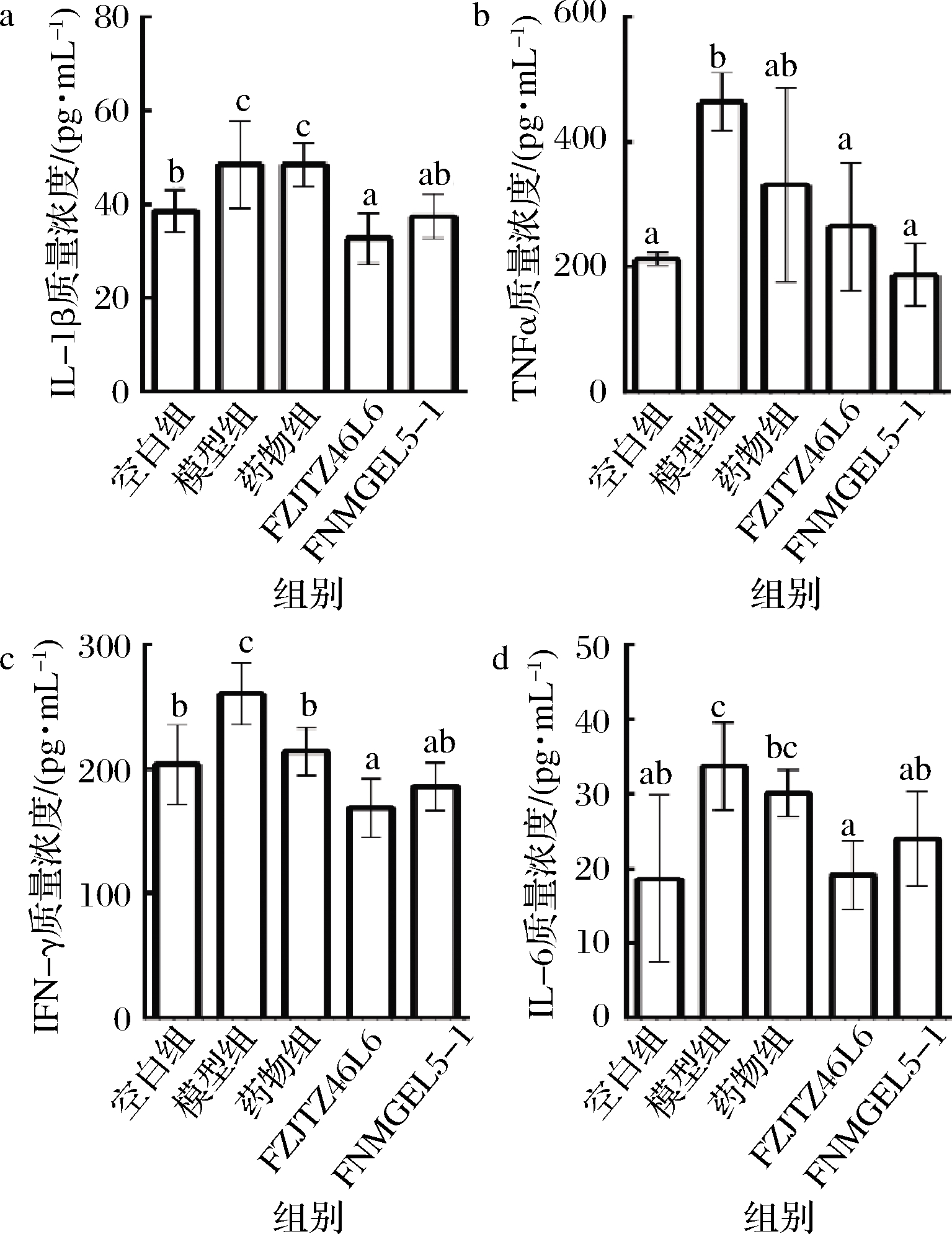
大量研究表明,结肠中TNF-α、IL-1β、IL-6和IFN-γ等细胞因子的含量与结肠炎的发生发展密切相关[14, 21-27]。本文测定了小鼠结肠中TNF-α、IL-1β、IL-6和IFN-γ的含量,结果显示,与对照组相比模型组小鼠结肠中促炎因子TNF-α、IL-1β、IL-6和IFN-γ含量显著增高,尤其是TNF-α和IL-6的水平显著增高;与模型组相比,鼠李糖乳杆菌FZJTZ46L6和FNMGEL5-1显著降低了结肠中TNF-α、IL-1β、IL-6和IFN-γ的含量,且效果优于药物美沙拉嗪(图4)。研究显示,TNF-α与结肠炎的严重程度呈正相关,且IBD患者的IL-6含量可见显著增高[21-23],这与本文的研究结果一致。说明DSS造模后小鼠体内促炎因子含量显著上升,鼠李糖乳杆菌能够通过降低结肠中的促炎因子含量减少结肠炎症反应的产生。
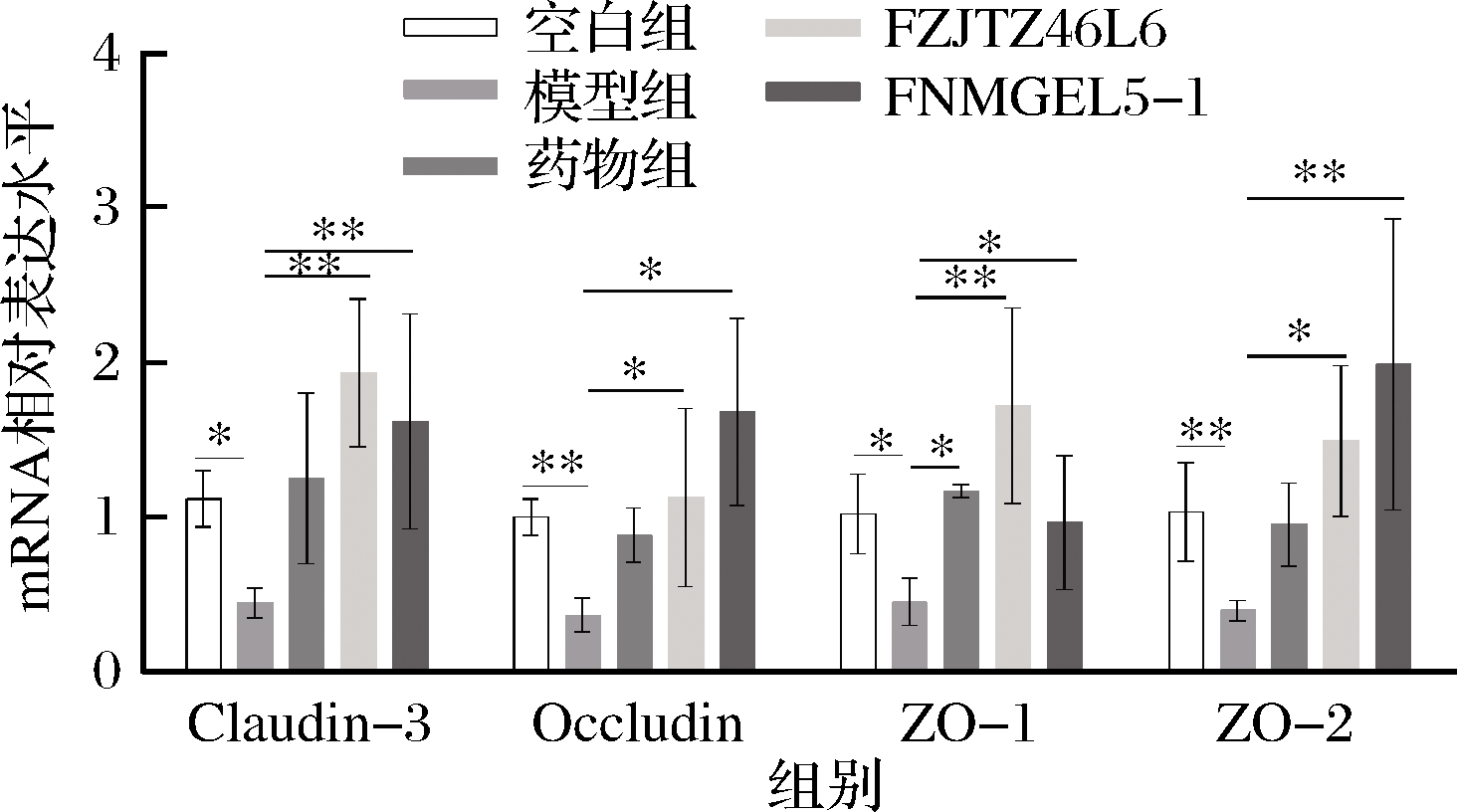
2.3 鼠李糖乳杆菌提高结肠紧密连接蛋白基因转录水平
肠道上皮细胞间的紧密连接相关蛋白在维持肠上皮结构稳定,发挥肠道屏障功能中起到重要的作用[28-30]。本文测定了小鼠结肠中4种主要紧密连接蛋白Claudin-3、ZO-1、ZO-2和Occludin的基因表达水平。结果显示,与空白组相比,模型组小鼠4种紧密连接蛋白转录水平均发生了显著下调,提示DSS造成了肠上皮紧密连接结构的破坏,而本文所用的2株鼠李糖乳杆菌均能在一定程度上提高结肠紧密连接蛋白Claudin-3、ZO-1、ZO-2和Occludin的转录水平(图5),提示鼠李糖乳杆菌FZJTZ46L6和FNMGEL5-1可能通过上调紧密连接蛋白Claudin-3、ZO-1、ZO-2和Occludin的表达,从而增强肠道紧密连接,提高肠道屏障功能。
2.4 鼠李糖乳杆菌提高小鼠粪便中短链脂肪酸含量
短链脂肪酸是肠道菌群的代谢产物,能够为结肠细胞提供能量,调节肠腔内的pH值,参与宿主免疫调节并增强肠道屏障作用[24]。研究显示,IBD患者中短链脂肪酸含量显著减少[25],施用短链脂肪酸合成酶混合物显著改善结肠炎症和疾病活动指数得分并抑制促炎症细胞因子的表达。在本文中,与空白组相比,模型组小鼠粪便中短链脂肪酸总量显著减少,尤其是丁酸含量显著减少;与模型组相比,菌株FZJTZ46L6显著提高了小鼠粪便中短链脂肪酸的含量,包括乙酸、丙酸、丁酸、异戊酸和戊酸;而菌株FNMGEL5-1虽然能在一定程度上提高小鼠粪便中短链脂肪酸含量,但是没有显著差异(表5)。该结果与病理结果基本一致,提示FZJTZ46L6对于小鼠结肠损伤的改善作用与其提高短链脂肪酸含量密切相关。
表5 小鼠粪便中短链脂肪酸含量 单位:pmol/mg
Table 5 Content of short-chain fatty acids in the feces of mice
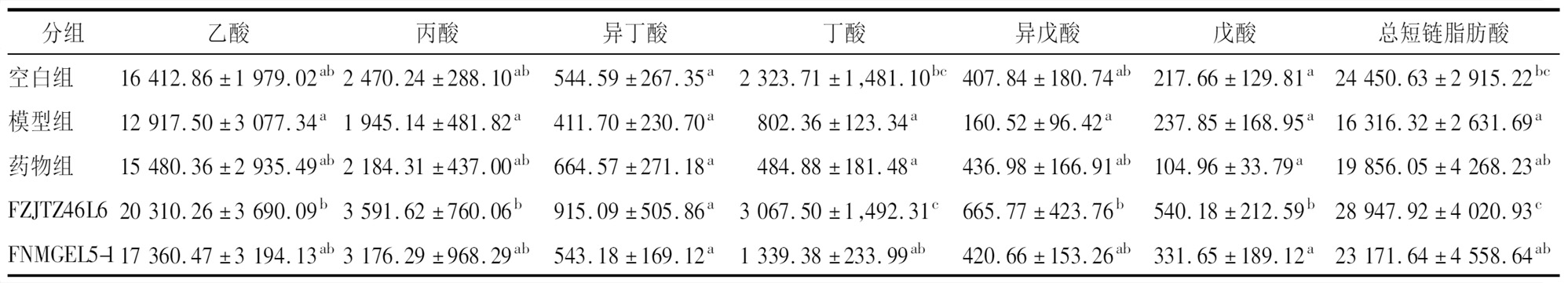
分组乙酸丙酸异丁酸丁酸异戊酸戊酸总短链脂肪酸空白组16412.86±1979.02ab2470.24±288.10ab544.59±267.35a2323.71±1,481.10bc407.84±180.74ab217.66±129.81a24450.63±2915.22bc模型组12917.50±3077.34a1945.14±481.82a411.70±230.70a802.36±123.34a160.52±96.42a237.85±168.95a16316.32±2631.69a药物组15480.36±2935.49ab2184.31±437.00ab664.57±271.18a484.88±181.48a436.98±166.91ab104.96±33.79a19856.05±4268.23abFZJTZ46L620310.26±3690.09b3591.62±760.06b915.09±505.86a3067.50±1,492.31c665.77±423.76b540.18±212.59b28947.92±4020.93cFNMGEL5-117360.47±3194.13ab3176.29±968.29ab543.18±169.12a1339.38±233.99ab420.66±153.26ab331.65±189.12a23171.64±4558.64ab
2.5 鼠李糖乳杆菌调节小鼠肠道菌群
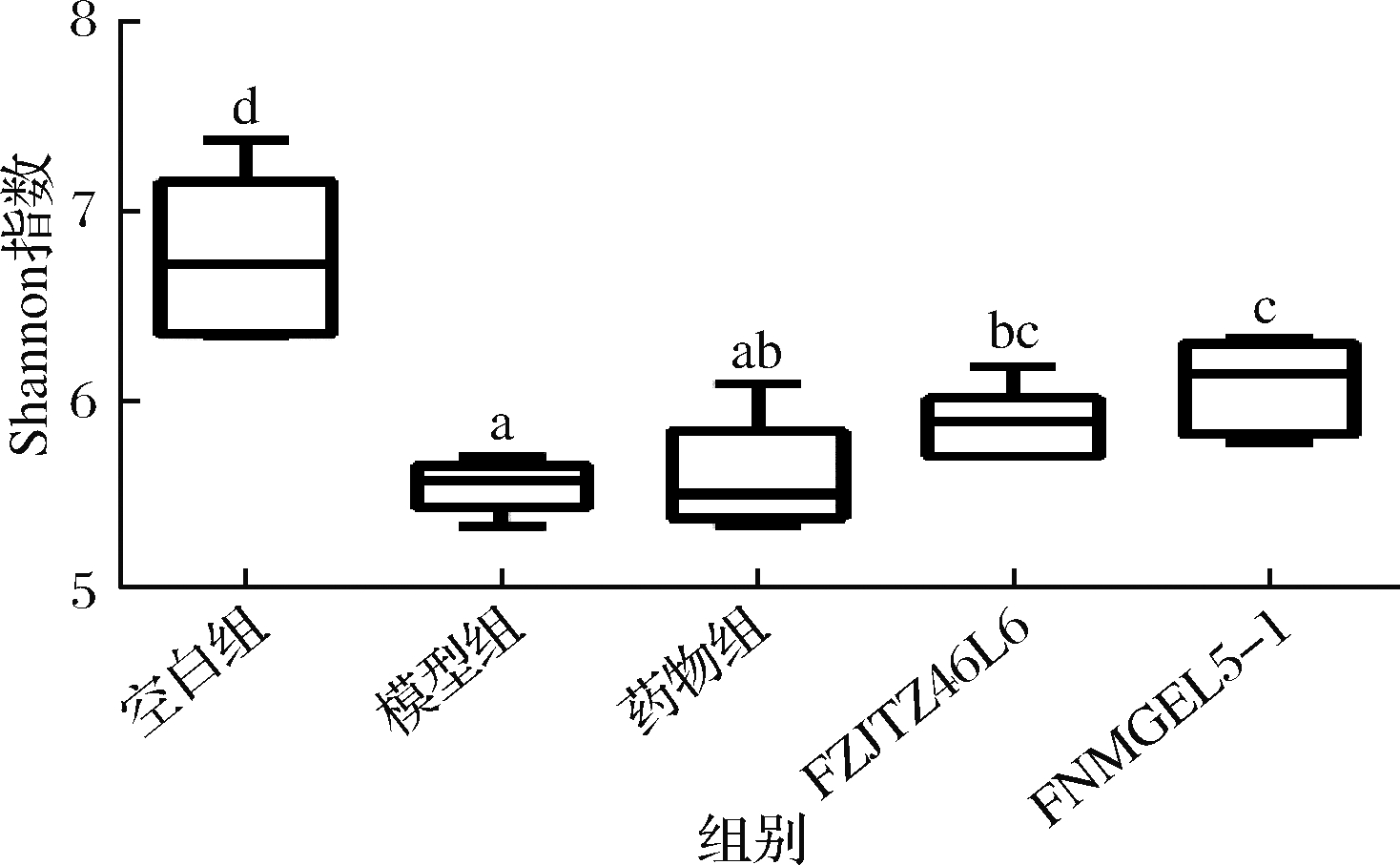
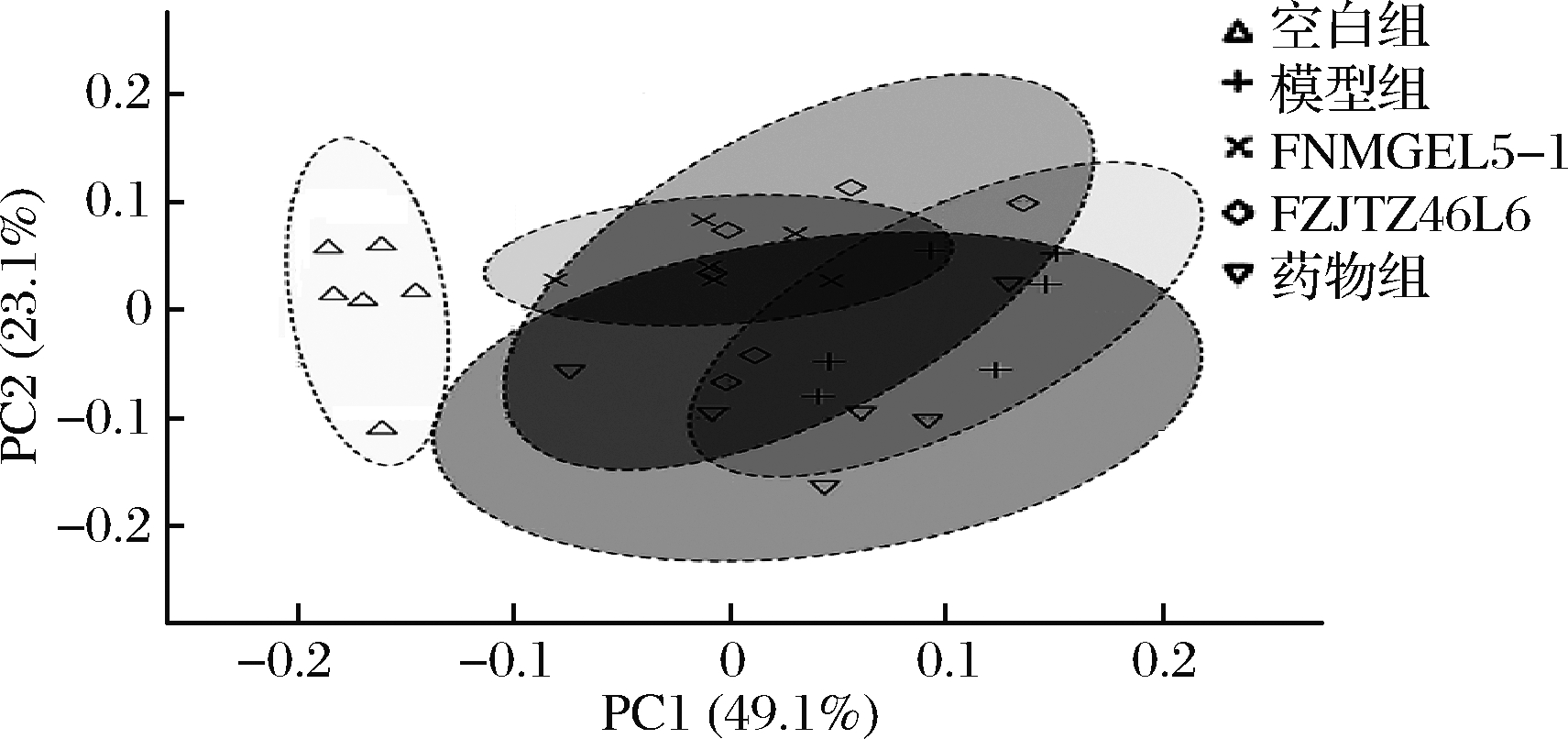
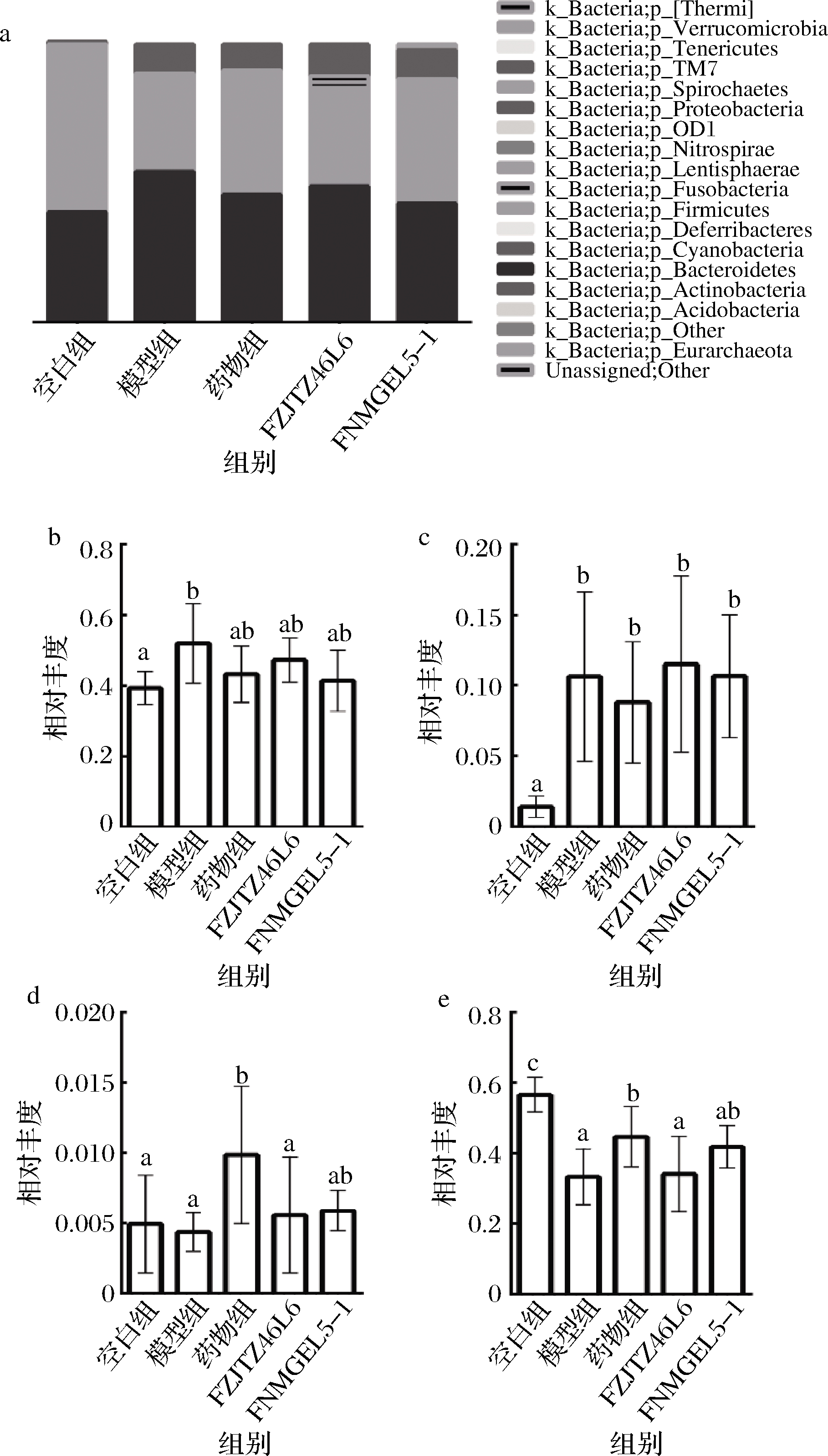
大量研究显示IBD患者肠道菌群表现为多样性降低,菌群组成和结构发生变化,从而导致肠道菌群稳态受到破坏[21,26-27]。在本研究中,与空白组相比,模型组小鼠Shannon指数显著降低,说明DSS结肠炎小鼠肠道菌群多样性显著降低。FZJTZ46L6和FNMGEL5-1显著抑制了DSS引起的Shannon指数降低,提高群落多样性(图6)。此外,beta多样性分析显示,DSS造模后小鼠肠道菌群群落构成与空白组形成明显差异,而FZJTZ46L6和FNMGEL5-1均能在一定程度上减少这种差异(图7)从而维护肠道菌群结构的稳定性。肠道菌群主要由厚壁菌门,拟杆菌门,放线菌门和变形菌门四大类组成[28],如图8-a所示,DSS结肠炎小鼠的肠道菌群组成发生了显著变化。与空白组相比,模型组小鼠中的厚壁菌门(Firmicutes)丰度显著降低,而拟杆菌门(Bacteroidetes)丰度显著升高,即厚壁菌门/拟杆菌门(F/B)的比值下降(图8-b),而F/B比率被作为评估病理状态的生物标志物[28]。Bacteroidetes拥有的参与脂类和碳水化合物代谢的酶基因比Firmicutes要少[29],因此这也可能是造成小鼠体重下降的原因。此外,DSS造模后引起了变形菌门(Proteobacteria)丰度的显著上升(图8-b),表明DSS处理造成了小鼠肠道菌群结构失调。据报道,Proteobacteria等革兰氏阴性菌的LPS与宿主炎症有关[8]。鼠李糖乳杆菌FZJTZ46L6和FNMGEL5-1干预后在一定程度上降低了拟杆菌门的丰度并增加厚壁菌门的丰度,从而减轻厚壁菌门/拟杆菌门的比例失调,改善菌群结构失衡。
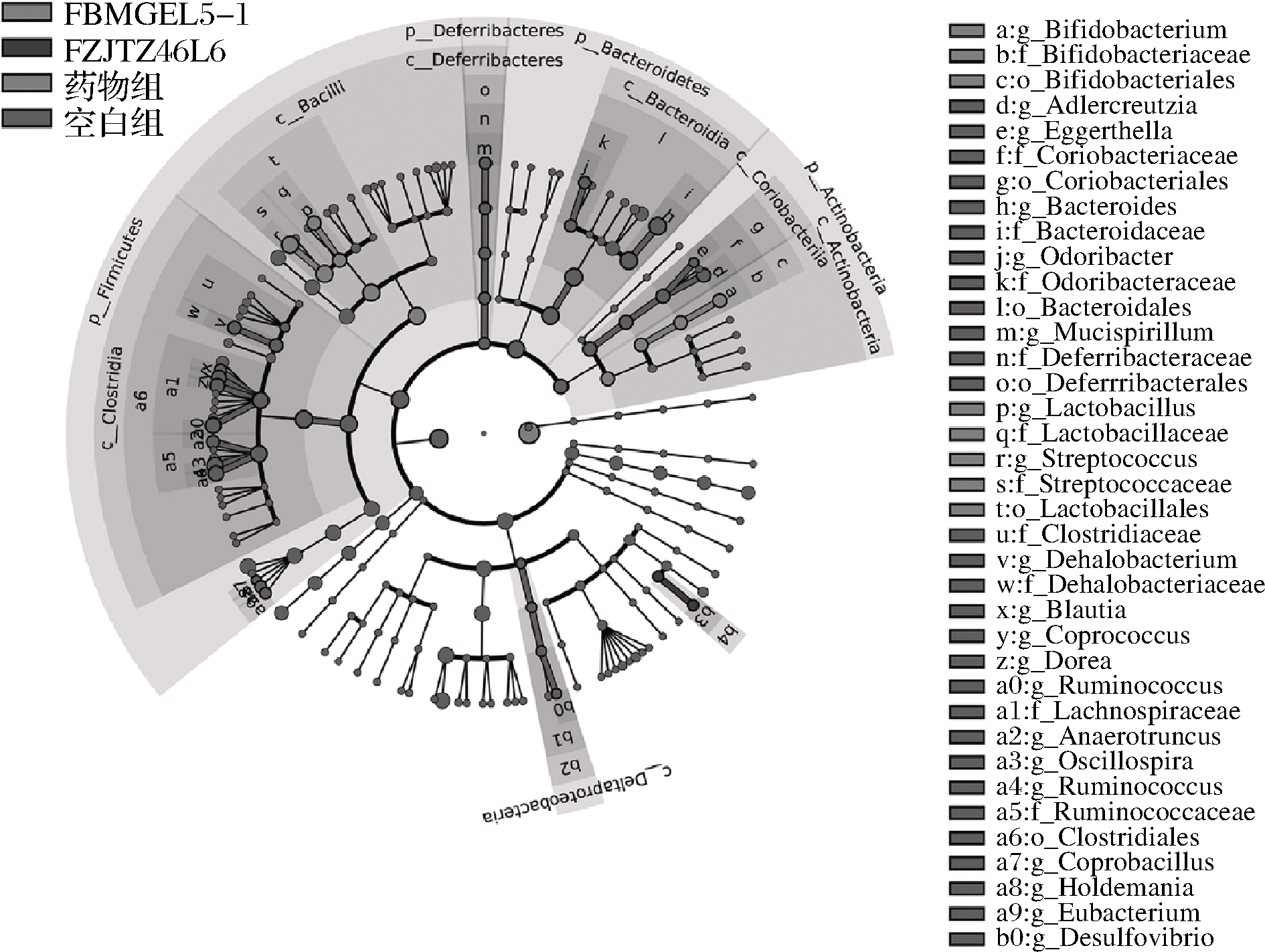
进一步对肠道菌群进行分析,利用LEfSe分析找到不同分组间丰度显著差异的物种,进化树分支图(图9)显示了在不同分组间具有重要影响的标记物种,找出其中具有显著差异的菌属进一步分析,结果显示DSS造模后除了显著增加Bacteroides(拟杆菌属)丰度外,还提高了与炎症反应相关的菌属Fusobacterium丰度,而Coprococcus(粪球菌属)和Oscillospira(颤螺菌属)丰度显著降低,其中Coprococcus是丁酸和丙酸的主要产生菌属,Oscillospira与健康相关,并在炎症人群肠道内丰度减少。与模型组相比,FZJTZ46L6和FNMGEL5-1干预后提高了Coprococcus和Oscillospira的丰度。值得注意的是FNMGEL5-1显著提高了Dorea和Mucispirillum的丰度(图10)。研究显示[30],Dorea在DSS结肠炎小鼠中丰度显著增加,而Mucispirillum是一种黏液层共生菌,在宿主产生炎症时Mucispirillum数量增加,并在一定条件下诱导免疫系统产生IgG反应,故被认为是导致疾病产生的病原体[10]。可见FNMGEL5-1虽然提高了肠道菌群的多样性并减轻肠道菌群失调,但是显著增加了有害菌属Dorea和Mucispirillum的丰度,这很可能是其无法改善结肠黏膜损伤的原因之一。上述结果表明,DSS处理后使肠道中有害菌的数量增加,同时减少有益菌的数量,而鼠李糖乳杆菌FZJTZ46L6干预后缓解了这种情况。
2.6 粪球菌属和短链脂肪酸缓解结肠炎的相关性分析
乙酸盐、丙酸盐和丁酸盐能够经由转运受体MCT1, SMCT1等被结肠细胞吸收并通过细胞表面G蛋白偶联受体参与一系列免疫级联反应中,降低促炎因子TNF-α、IL-6,IL-12、IFN-γ的产生,增加抑炎因子IL-10水平,从而减少炎症反应,维护肠道屏障功能[28]。此外,研究显示[8, 10, 29-30],IBD患者肠道中Coprococcus数量显著减少。说明鼠李糖乳杆菌FZJTZ-46L6对于结肠炎的缓解作用可能主要是通过影响肠道短链脂肪酸产生菌的丰度并增加肠道短链脂肪酸的产量。为进一步确定产短链脂肪酸菌属Coprococcus和短链脂肪酸在FZJTZ46L6缓解结肠炎中的重要作用,本文利用SPSS做了pearson相关性分析。结果显示,Coprococcus与小鼠体重呈极显著的正相关且与DAI评分呈极显著的负相关,此外,Coprococcus与结肠病理评分、TNF-α以及IL-6的含量也呈强相关性,说明鼠李糖乳杆菌对于Coprococcus丰度的影响与其缓解结肠炎疾病症状,改善结肠黏膜损伤和调节肠道免疫反应密切相关。丁酸与结肠IL-6含量呈显著负相关,且与结肠炎各项疾病指标都有强相关性;乙酸和丙酸均与促炎因子IL-1β、IFN-γ呈显著负相关,此外丙酸与紧密连接蛋白Claudin-3表达水平呈显著正相关;值得注意的是,整体上6种短链脂肪酸与结肠促炎因子含量表现出明显的负相关性,与结肠紧密连接相关蛋白基因表达水平呈明显正相关,说明短链脂肪酸与鼠李糖乳杆菌修复肠道紧密连接和降低促炎因子水平密切相关。综上,鼠李糖乳杆菌FZJTZ46L6极可能是通过提高肠道短链脂肪酸产生菌的丰度并增加肠道短链脂肪酸的含量从而抑制促炎因子产生,上调紧密连接蛋白表达水平达到缓解结肠炎的效果。
表5 粪球菌属和短链脂肪酸与结肠炎疾病指标的相关性分析
Table 5 Correlation analysis of coprococcus and scfas with disease indexes of colitis
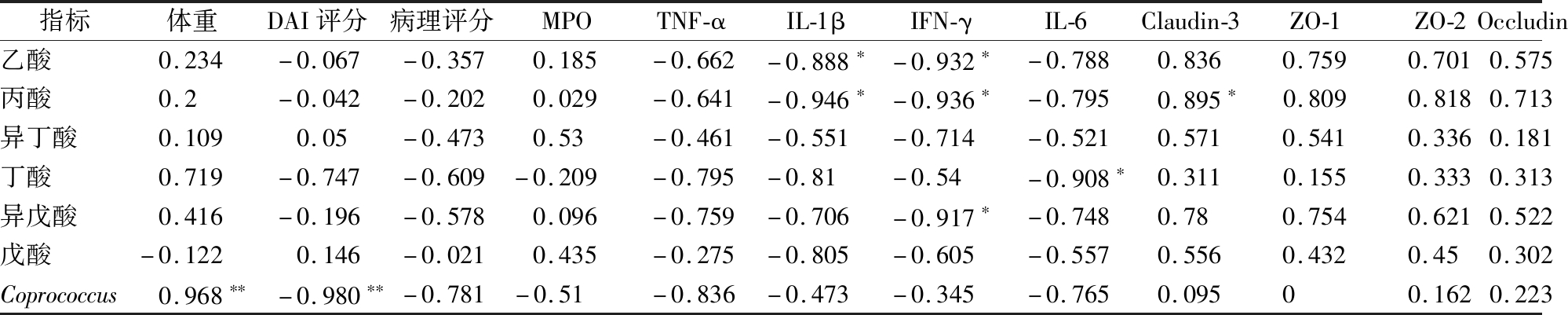
指标体重DAI评分病理评分MPOTNF-αIL-1βIFN-γIL-6Claudin-3ZO-1ZO-2Occludin乙酸0.234-0.067-0.3570.185-0.662-0.888∗-0.932∗-0.7880.8360.7590.7010.575丙酸0.2-0.042-0.2020.029-0.641-0.946∗-0.936∗-0.7950.895∗0.8090.8180.713异丁酸0.1090.05-0.4730.53-0.461-0.551-0.714-0.5210.5710.5410.3360.181丁酸0.719-0.747-0.609-0.209-0.795-0.81-0.54-0.908∗0.3110.1550.3330.313异戊酸0.416-0.196-0.5780.096-0.759-0.706-0.917∗-0.7480.780.7540.6210.522戊酸-0.1220.146-0.0210.435-0.275-0.805-0.605-0.5570.5560.4320.450.302Coprococcus0.968∗∗-0.980∗∗-0.781-0.51-0.836-0.473-0.345-0.7650.09500.1620.223
注:*表示P < 0.05, **表示P<0.01
3 结论
本文使用的2株鼠李糖乳杆菌均能在不同程度上缓解小鼠结肠炎,但2株菌对于结肠炎的缓解效果具有明显差异。鼠李糖乳杆菌FZJTZ46L6的效果优于FNMGEL5-1,FZJTZ46L6不仅显著抑制了小鼠在DSS造模期间的体重下降,改善粪便性状和便血情况,还显著改善了DSS引起的小鼠结肠黏膜损伤,而FNMGEL5-1虽然在一定程度上缓解了DSS引起的疾病症状,但是对于结肠炎症浸润和病理损伤没有改善作用。本研究中,鼠李糖乳杆菌FZJTZ46L6缓解结肠炎的途径主要体现在以下4个方面:(1)提高肠道菌群多样性,增加菌群结构稳定性;(2)提升短链脂肪酸产生菌属丰度,提高短链脂肪酸水平;(3)增强肠道紧密连接蛋白转录水平;(4)降低促炎因子水平,减少炎症反应。相比于FNMGEL5-1,菌株FZJTZ46L6能够更大程度地降低促炎因子IL-1β、IL-6和IFN-γ的含量,且显著增加粪便中短链脂肪酸含量,尤其是乙酸、丙酸和丁酸的含量;而FNMGEL5-1虽然也提高了短链脂肪酸产生菌Coprococcus的丰度,并在一定程度上增加粪便中总的短链脂肪酸含量,但是并不能显著提高乙酸,丙酸和丁酸的含量,此外FNMGEL5-1还增加了有害菌属Dorea和Mucispirillum的丰度。通过进一步的相关性分析,结果显示Coprococcus与改善结肠损伤,缓解结肠炎症状以及降低促炎因子水平显著相关;短链脂肪酸水平的提高与促炎因子含量的降低及紧密连接蛋白转录水平的增加强相关,表明Coprococcus和短链脂肪酸在缓解结肠炎中的重要作用。可见FZJTZ46L6与FNMGEL5-1对于小鼠结肠炎的缓解效果差异主要与肠道菌群变化、短链脂肪酸含量和免疫调节相关,且最关键的是能否通过提高短链脂肪酸产生菌属丰度进一步提高肠道内短链脂肪酸含量。综上所述,说明鼠李糖乳杆菌缓解结肠炎的效果存在个体差异,且鼠李糖乳杆菌FZJTZ46L6对于结肠炎的改善效果主要与其提高肠道短链脂肪酸产生菌丰度,增加短链脂肪酸含量有关。
参考文献
[1] ABRAHAM C, CHO J H. Inflammatory bowel disease[J]. The New England Journal of Medicine, 2009, 361(21): 2 066-2 078.
[2] 王苗, 曲波, 李惠, 等. 炎症性肠病的治疗新进展[J]. 胃肠病学和肝病学杂志, 2016,25(7):736-738.
[3] MATSUOKA K, KANAI T. The gut microbiota and inflammatory bowel disease[J]. Seminars in Immunopathology, 2015, 37(1): 47-55.
[4] TILG H, MOSCHEN A R. Microbiota and diabetes: An evolving relationship[J]. Gut, 2014, 63(9):1 513-1 521.
[5] TIAN P, ZOU R, SONG L, et al. Ingestion of Bifidobacterium longum subspecies infantis strain CCFM687 regulated emotional behavior and the central BDNF pathway in chronic stress-induced depressive mice through reshaping the gut microbiota[J]. Food & Function, 2019, 10(11): 7 588-7 598.
[6] GOPHNA U, SOMMERFELD K, GOPHNA S, et al. Differences between tissue-associated intestinal microfloras of patients with Crohn′s disease and ulcerative colitis[J]. Journal of Clinical Microbiology, 2006, 44(11): 4 136-4 141.
[7] 王俊通. 产共轭亚油酸乳酸菌对DSS诱导小鼠结肠炎的改善作用[D]. 无锡:江南大学,2016.
[8] FINEGOLD S M, SCOT E D, VIKTORIA G, et al. Pyrosequencing study of fecal microflora of autistic and control children[J]. Anaerobe, 2010,16(4): 444-453.
[9] ZELANTE T, IANNITTI R G, CUNHA C, et al. Tryptophan catabolites from microbiota engage aryl hydrocarbon receptor and balance mucosal reactivity via Interleukin-22[J]. Immunity, 2013,39(2): 372-385.
[10] ZHAO Y, CHEN F, WU W, et al. GPR43 mediates microbiota metabolite SCFA regulation of antimicrobial peptide expression in intestinal epithelial cells via activation of mTOR and STAT3[J]. Mucosal Immunology, 2018, 11(3): 752-762.
[11] JUNG-HA P, KOTANI T, KONNO T, et al. Promotion of Intestinal epithelial cell turnover by commensal bacteria: Role of short-chain fatty acids[J]. Plos One, 2016,11(5): e0 156 334.
[12] VENEGAS D P, LA FUENTE M d, LANDSKRON G, et al. Short chain fatty acids (SCFAs)-mediated gut epithelial and immune regulation and its relevance for inflammatory bowel diseases[J]. Frontiers in Immunology, 2019, https://doi.org/10.3389/fimmu.2019.00 277.
[13] SHEN X, LIU L, PEEK R M, et al. Supplementation of p40, a Lactobacillus rhamnosus GG-derived protein, in early life promotes epidermal growth factor receptor-dependent intestinal development and long-term health outcomes[J]. Mucosal Immunology, 2018, 11(5):1 316-1 328.
[14] HERING N A, FROMM M, SCHULZKE J D. Determinants of colonic barrier function in inflammatory bowel disease and potential therapeutics[J]. Journal of Physiology, 2012, 590(5):1 035-1 044.
[15] BERBERAT P O, YI A R, YAMASHITA K, et al. Heme oxygenase-1-generated biliverdin ameliorates experimental murine colitis[J]. Inflammatory Bowel Diseases, 2005, 11(4): 350-359.
[16] 毛丙永. 功能性低聚糖对肠道细菌的影响及机制[D]. 无锡:江南大学, 2015.
[17] MAO B, LI D, ZHAO J, et al. Metagenomic insights into the effects of fructo-oligosaccharides (FOS) on the composition of fecal microbiota in mice[J]. Journal of Agricultural and Food Chemistry, 2015, 63(3): 856-863.
[18] ARATANI Y. Myeloperoxidase: Its role for host defense, inflammation, and neutrophil function[J]. Arch Biochem Biophys, 2018, 640:47-52.
[19] 禹晶. MPO、CD15、P53在大肠癌及溃疡性结肠炎中的表达及意义[D]. 佳木斯:佳木斯大学, 2008.
[20] 周泠, 刘卓志. 雷公藤多甙栓对溃疡性结肠炎大鼠SOD和MPO的影响[J]. 医学动物防制, 2006,22(6):403-405.
[21] JU S, GE Y, LI P, et al. Dietary quercetin ameliorates experimental colitis in mouse by remodeling the function of colonic macrophages via a heme oxygenase-1-dependent pathway[J]. Cell Cycle, 2018, 17(1): 53-63.
[22] YE M, JOOSSE M E, LIU L, et al. Deletion of IL-6 exacerbates colitis and induces systemic inflammation in IL-10-deficient mice[J/OL]. Journal of Crohn′s & Colitis, 2019, https://doi.org/10.1093/ecco-jcc/jjz176.
[23] 王少鑫, 浦江, 刘超群, 等. 炎症因子TNF-α、IL-6和IL-4在溃疡性结肠炎中的表达及临床意义[J]. 胃肠病学和肝病学杂志, 2014,(1):104-106.
[24] ZENG H, UMAR S, RUST B, et al. Secondary bile acids and short chain fatty acids in the colon: A focus on colonic microbiome, cell proliferation, inflammation, and cancer[J]. International Journal of Molecular Sciences, 2019, 20(5):12-14.
[25] ZHUANG X, LI T, LI M, et al. Systematic review and meta-analysis: Short-chain fatty acid characterization in patients with inflammatory bowel disease[J]. Inflammatory Bowel Diseases, 2019, 25(11): 1 751-1 763.
[26] KOWALSKA-DUPLAGA K, GOSIEWSKI T, KAPUSTA P, et al. Differences in the intestinal microbiome of healthy children and patients with newly diagnosed Crohn′s disease[J]. Sci Rep, 2019, 9(1): 18 880.
[27] RUSSO E, GIUDICI F, FIORINDI C, et al. Immunomodulating activity and therapeutic effects of short chain fatty acids and tryptophan post-biotics in inflammatory bowel disease[J]. Frontiers in Immunology, 2019, 10:2 754.
[28] LARABI A, BARNICH N, NGUYEN H T T. New insights into the interplay between autophagy, gut microbiota and inflammatory responses in IBD[J]. Autophagy, 2020, 16(1): 38-51.
[29] KALLUS S J, BRANDT L J. The Intestinal microbiota and obesity[J]. Journal of Clinical Gastroenterology, 2012,46(1): 16-24.
[30] RAMOS G P, PAPADAKIS K A. Mechanisms of disease: Inflammatory bowel diseases[J]. Mayo Clinic Proceedings, 2019, 94(1): 155-165.