结直肠癌(colorectal cancer,CRC)是世界上第四大致命性癌症,每年有近90万人因此死亡[1],死亡率呈上升态势,且发病趋于年轻化[2],一项人群调研的结果表明,在被调查对象中,40~49岁的CRC患者占50岁以下患者的75%[3]。影响CRC发病的因素复杂,越来越多报道表明饮食[4]、肠道菌群[5]甚至生物钟[6]等会对CRC的发病及预后产生一定影响。异常的代谢水平是恶性肿瘤的一个重要标志,肿瘤细胞更倾向通过糖酵解途径来对葡萄糖代谢利用,且对葡萄糖摄取及乳酸产出有着较强的能力,即“Warburg效应”[7]。对此,异常的葡萄糖代谢在一定程度上,对癌症化疗中的耐药性提供了一定的解释,也有望成为一个治疗的靶点[8]。单糖对肿瘤的影响近年来备受瞩目,一项研究表明,给予Apc-/-小鼠高玉米糖浆饮食(果糖与葡萄糖组合)可以加强糖酵解,从而显著性促进结直肠肿瘤的发生与发展程度[9]。但葡萄糖并不是唯一影响肿瘤生长的单糖,另一项研究表明,在体外额外摄入甘露糖和岩藻糖可以延缓多种肿瘤细胞的增殖,前者尤为显著[10]。
甘露糖是一种天然单糖,来源广泛,从植物和微生物中都可以提取,其与葡萄糖互为差向异构体,且二者有着相同的转运载体GLUT1,这或许对细胞葡萄糖的摄取及代谢产生影响。GLUT1主要负责将葡萄糖向红细胞中扩散以及向大脑和其他器官输送,但其表达量则是癌症患者的重要预后指标[11],一项跨越23年的研究表明,GLUT1的过表达与大多数实体瘤患者的低生存率相关[12],因此,通过干扰结直肠肿瘤细胞的GLUT1表达,有望成为一个治疗手段[13]。
一项人群研究表明,将甘露糖混入饮食,受试者出现了葡萄糖吸收下降的症状[14]。这种影响葡萄糖吸收的作用,也可能会对结直肠肿瘤产生类似的效果。但目前尚未有关于甘露糖对结直肠肿瘤GLUT1表达及葡萄糖吸收的影响的报道。本研究以甘露糖为研究对象,以动物模型和细胞模型为实验手段,探究甘露糖存在下对结直肠癌发生、增殖及癌细胞对葡萄糖摄取等影响,并对其中的机理进行探究。研究成果可为甘露糖用以辅助结直肠肿瘤病人的救治及高危人群的预防提供思路。
1.1.1 实验动物
SPF级C57BL/6雄性小鼠,6周龄,体重20~22 g,上海灵畅生物科技有限公司。
1.1.2 实验细胞
人源结直肠癌细胞系HCT116及HT29,购自ATCC细胞库(The Global Bioresource Center)。
1.1.3 抗体
葡萄糖转运蛋白1(GLUT1,12939)、己糖激酶-Ⅱ(Hexokinase-Ⅱ,HK-Ⅱ,2867)、内参β-Actin(4970),购自CST(Cell Signaling Technology)。
1.1.4 实验试剂
MTT细胞增殖及毒性检测试剂盒,南京森贝伽生物科技有限公司;葡萄糖含量检测试剂盒,北京索莱宝科技有限公司;BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;氧化偶氮甲烷(azoxymethane,AOM),无锡莱弗思生物实验器材有限公司;葡聚糖硫酸钠(dextran sulfate sodiuln,DSS),南京百斯凯科技有限公司;甘露糖、葡萄糖、果糖及低聚果糖(fructooligosaccharide,FOS),国药集团化学试剂有限公司。
1.2.1 AOM/DSS诱导原发结直肠肿瘤小鼠模型实验
6周龄SPF级C57BL/6雄性小鼠,饲养于江南大学实验动物中心SPF屏障环境,在屏障环境熟悉1周后,随机分组。模型组(10只),干预组(各7只)接受单次AOM(10 mg/kg)腹腔注射,空白组(7只)及对照组(各4只)注射同体积9 g/L的NaCl水溶液。1周后,模型组和干预组饮用水更换为质量浓度为25 g/L的DSS(分子质量为35 000~50 000 Da)饮用水,持续1周,空白及各对照组始终保持普通饮用水。之后,干预组和对照组开始灌胃相应的糖液,每2 d1次,糖液浓度为20 g/L,每次200 μL,空白及模型组以普通水代替糖液。7周后,根据动物福利原则处死小鼠后,对结直肠等器官进行分离,40 g/L多聚甲醛-PBS固定及液氮冻存,以备后续实验。受试糖为甘露糖、葡萄糖、果糖及FOS。
1.2.2 小鼠结直肠组织标本制作及H&E染色实验
AOM/DSS诱导原发结直肠肿瘤小鼠麻醉处死后,取下结直肠后,纵剖摊平,紧密卷起后,依次经过脱水、透明、浸蜡、包埋及切片等步骤完成标本制作。标本依次经过烤片、脱蜡、水化、染色、脱水、透明及封片等步骤后,于扫描仪下观察。
1.2.3 细胞增殖实验
将HCT116和HT29细胞分别接种于96孔板,每孔1×103个细胞。过夜后,小心吸取上清液,换上额外含有不同糖的相应Dulbecco′s modified eagle medium(DMEM)培养液,FOS质量浓度与其他单糖一致。于不同时间点按照试剂盒说明,吸取上清液,加入110 μL MTT试剂,4 h后吸取上清液,加入110 μL显色液,振荡混匀10 min后,于570 nm处测定光密度。高糖DMEM培养基含有浓度为25 mmol/L的葡萄糖;低糖DMEM培养基含有浓度为5.56 mmol/L的葡萄糖(更接近人体血糖水平[11]),无糖DMEM培养基不含葡萄糖。受试糖为甘露糖、葡萄糖、果糖及FOS。
1.2.4 细胞毒性实验
将HCT116和HT29细胞分别接种于96孔板,每孔5×103个细胞。过夜后,小心吸取上清液,换上含有不同浓度甘露糖的低糖(葡萄糖浓度为5.56 mmol/L)DMEM培养液。48 h后吸去上清液,后续步骤同1.2.3。
1.2.5 培养液葡萄糖消耗量测定
HCT116及HT29细胞每皿7×105个分别接种于10 cm皿,过夜后更换培养液,培养24 h,以稳定细胞代谢,之后换用含有不同浓度甘露糖的低糖(葡萄糖浓度为5.56 mmol/L)DMEM培养基。分别于24、48 h收集上清,根据试剂盒说明测定其中葡萄糖下降量,下降量根据细胞蛋白浓度做单位均一化处理,后计算变化率。
1.2.6 蛋白提取
对于细胞样本,HCT116及HT29细胞每皿7×105个分别接种于10 cm皿,过夜后更换培养液,培养24 h,以稳定细胞代谢。之后换用含有不同浓度甘露糖的低糖(葡萄糖浓度为5.56 mmol/L)DMEM培养基。12 h后收集培养上清液内及贴壁细胞,1 000 r/min条件下离心5 min后,PBS清洗3次,以洗去残余培养基,后用含有磷酸酶抑制剂及蛋白酶抑制剂的RIPA裂解液进行裂解,经组织破碎仪充分裂解后,12 000 r/min离心10 min,弃沉淀,吸上清,后根据BCA蛋白浓度测定试剂盒说明书对蛋白浓度进行测定。加入含有5%(体积分数)β-巯基乙醇的5× loading buffer后,于95 ℃下金属浴10 min,用于蛋白变性;对于小鼠结直肠组织,每个样本称取20 mg,后加入30倍体积含有磷酸酶抑制剂及蛋白酶抑制剂的RIPA裂解液进行裂解,后续操作同细胞样本。
1.2.7 蛋白质印迹法(western blot)分析
30 μg变性后蛋白样本经10%SDS-PAGE分离后,转至PVDF膜,用含有5%体积分数BSA的TBST(TBS溶液,含有体积分数为1%的吐温-20)封闭1 h,后加一抗(GLUT1、HK-Ⅱ及β-Actin抗体,1∶2 000稀释)4 ℃孵育过夜;一抗孵育后,经TBST洗涤(4×5 min)后,二抗孵育1 h(1∶2 000稀释)后,再经TBST洗涤(4×5 min),最后加入显影液,显影观察结果。
平均值±SD用以表示结果,采用Graphpad Prism 7软件进行数理统计分析,对P<0.05的分析结果,认为具有显著性差异。
对于动物实验,采用经典的AOM/DSS诱导的原发结直肠肿瘤小鼠模型,并用不同糖液灌胃干预,图1为实验设计。整个周期平均体重记录如图2所示,经过7周的灌胃干预,模型组平均体重为(26.67±3.32) g,甘露糖干预组为(27.34±1.61) g,葡萄糖干预组为(27.27±3.70) g,FOS干预组为(25.63±3.22) g,果糖干预组为(23.42±3.08) g(P<0.05,与模型组比较,单因素方差分析t检验)。由3位具有丰富小鼠结直肠病理分析经验的实验人员对小鼠结直肠肿瘤结节数进行评估,结果表明甘露糖干预组肿瘤结节数显著小于模型组(P<0.05),而其他组间无显著差别(P>0.05),说明甘露糖具有降低结直肠肿瘤发生率的作用(图3)。我们通过对结直肠组织进行病理学评估,可以发现模型组小鼠结直肠病灶的细胞形态明显发生变化,呈纤维状,隐窝破坏明显,有较大腺瘤产生,而甘露糖干预组结直肠病灶细胞变化程度较低,生成腺瘤较小(图4),说明实验剂量下,甘露糖具有一定缓解结直肠肿瘤发展的作用。而每种糖的对照与空白组相比,未见异常(P>0.05)。

图1 动物实验示意图
Fig.1 Schematic diagram of animal experiment
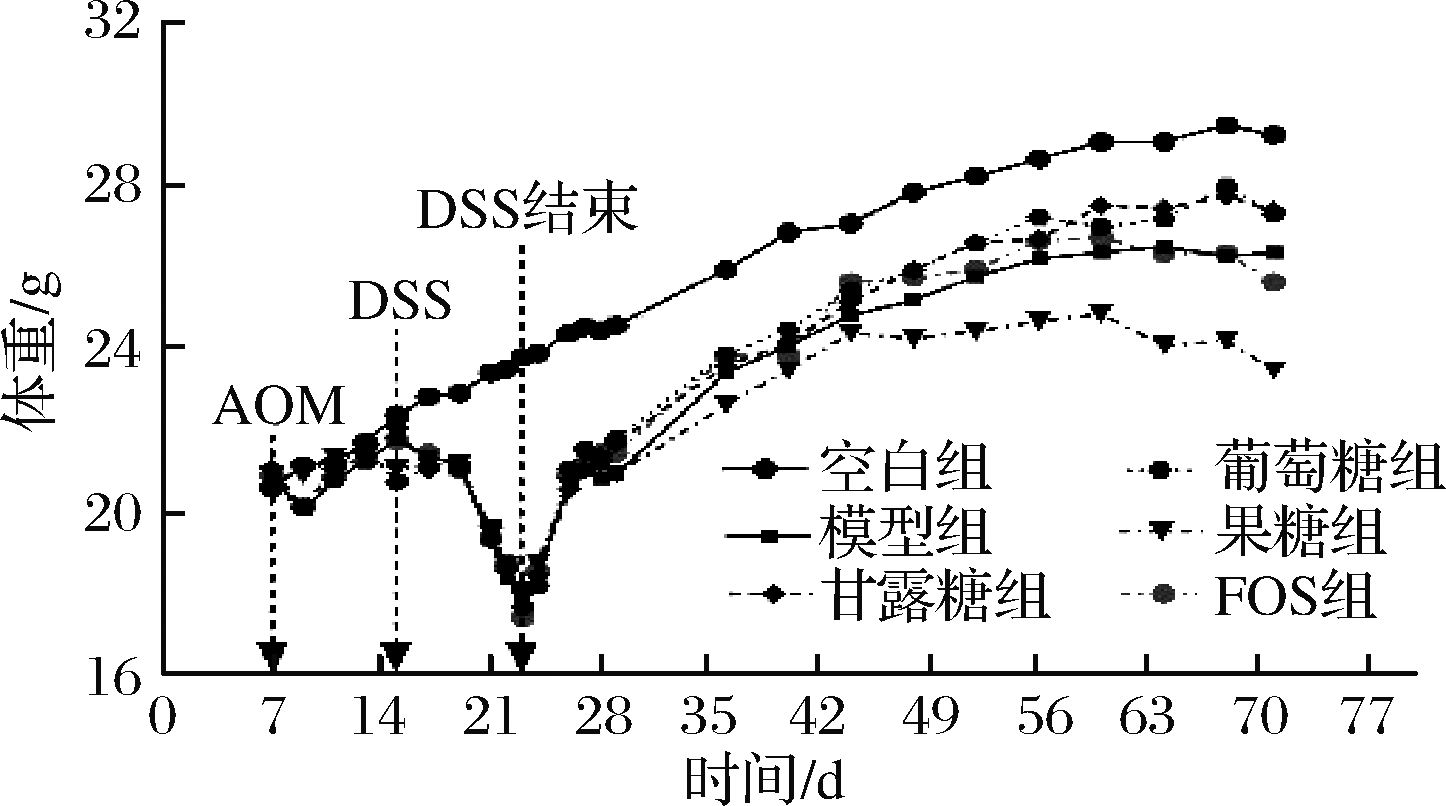
图2 动物体重记录
Fig.2 Animal weight record
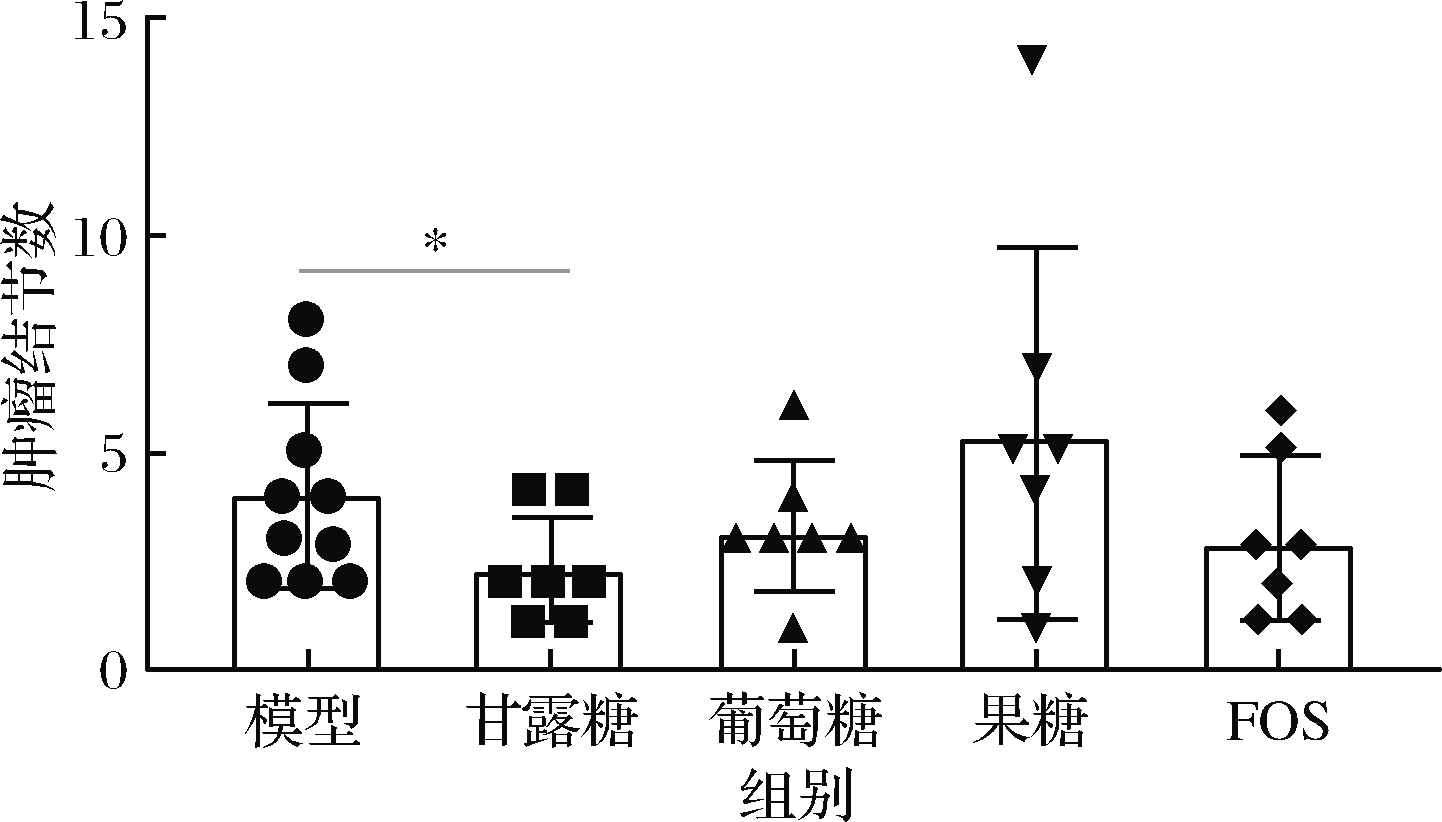
图3 肿瘤结节数
Fig.3 Number of tumor nodules
注:采用单因素方差分析Mann-Whitney U检验。与空白组或模型组
相比,*表示P<0.05,**表示P<0.01,***表示P<0.001(下同)

a-空白组;b-模型组;c-甘露糖干预组
图4 小鼠结直肠组织病理学分析
Fig.4 Histopathological analysis of colorectal in mice
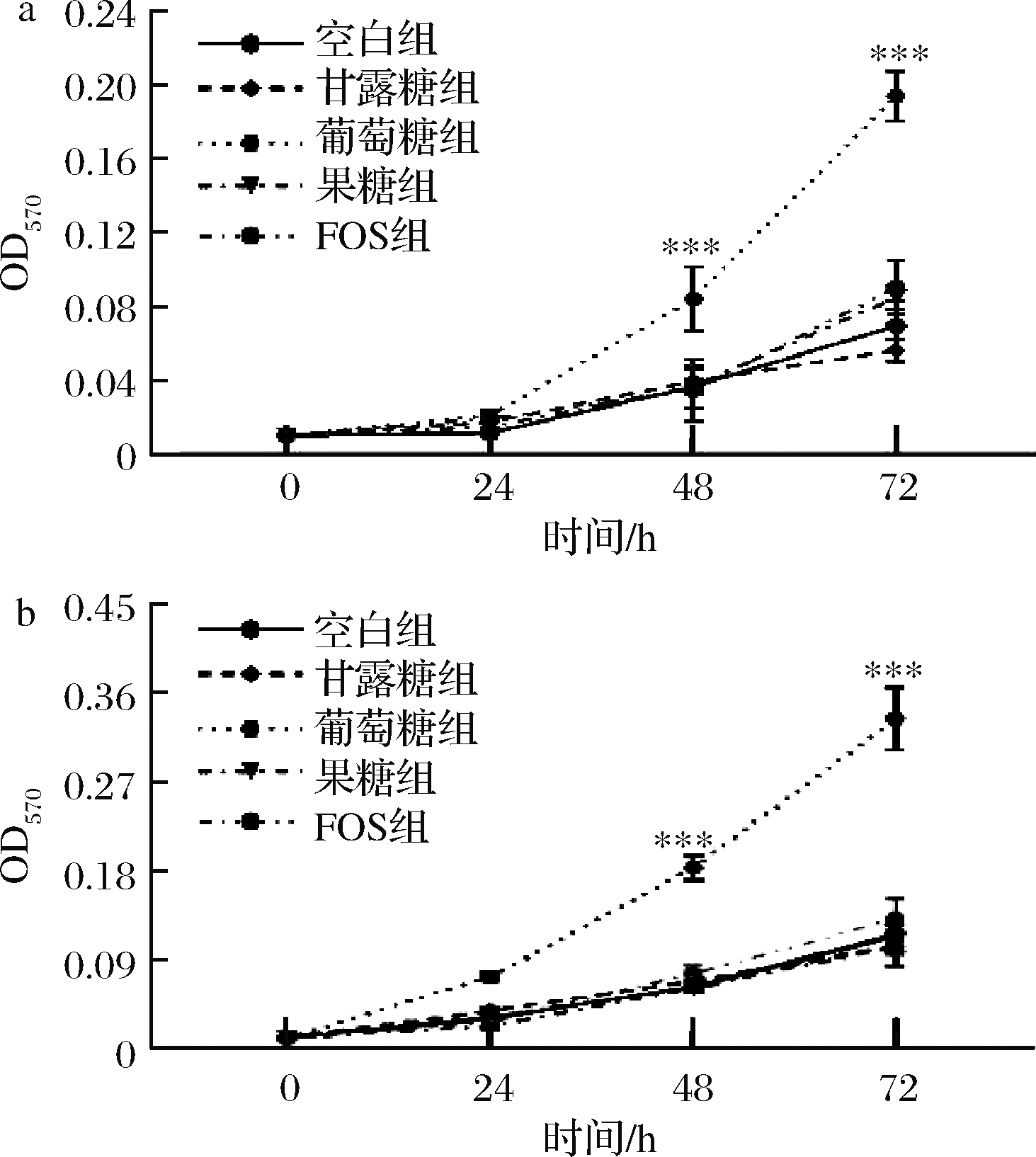
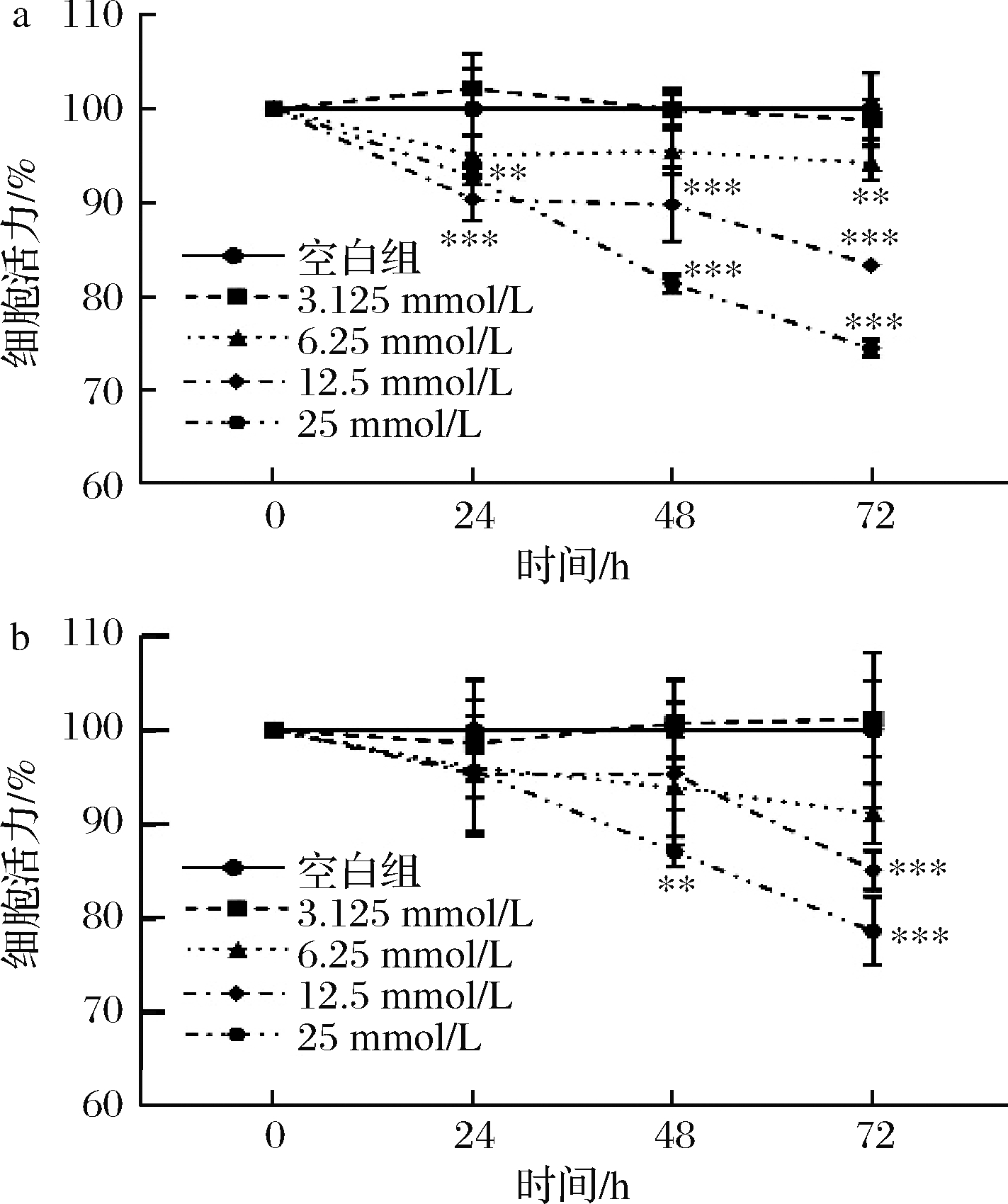
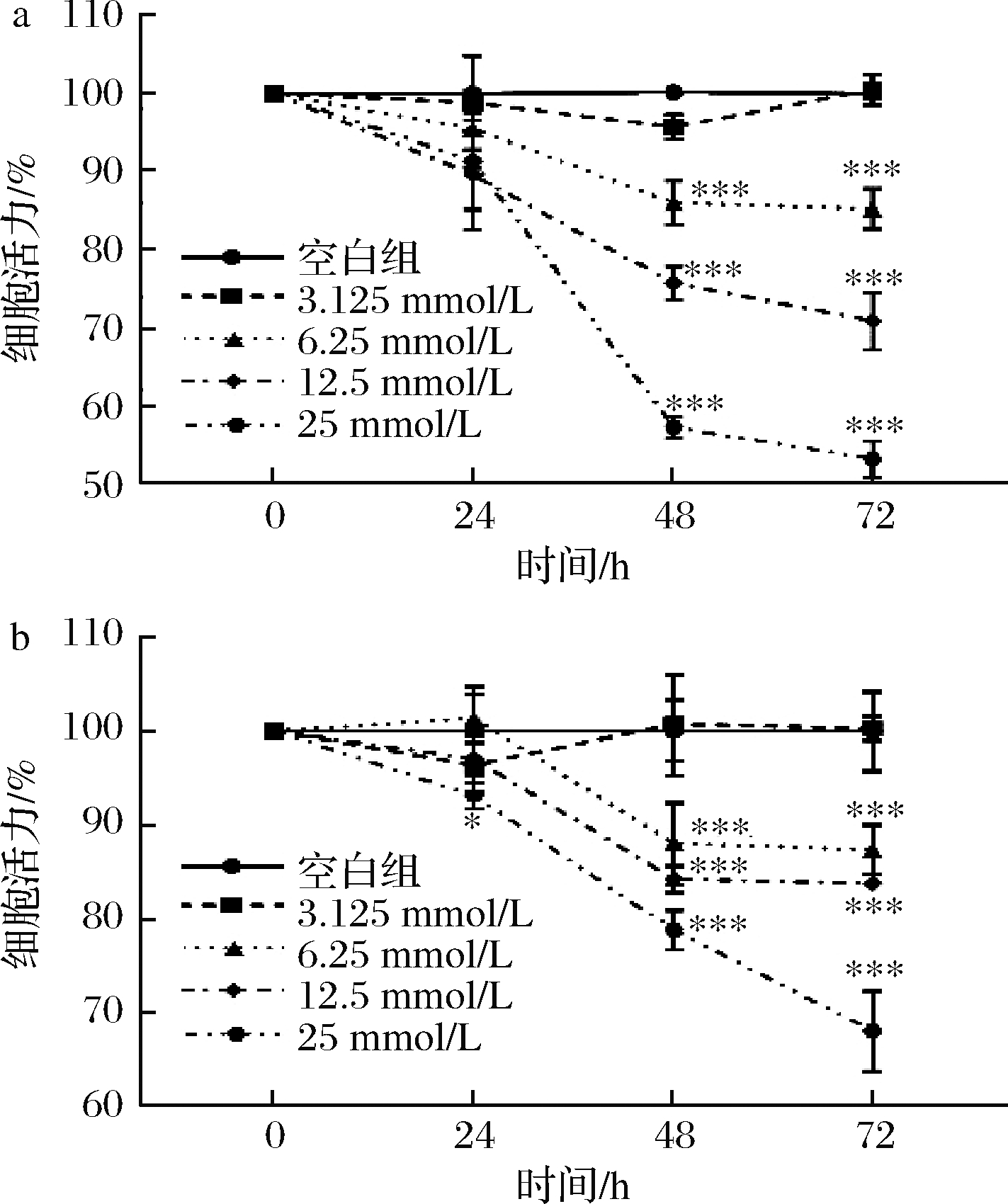
我们选取了HCT116和HT29两株细胞系来探究甘露糖对结直肠癌细胞生长状况的影响。首先验证了葡萄糖为2株细胞系最重要的碳源(图5)。因此,我们分别在高糖(葡萄糖浓度为25 mmol/L)DMEM培养基及低糖(葡萄糖浓度为5.56 mmol/L,更接近人体血糖水平[11])DMEM培养基来验证不同浓度甘露糖对2种细胞系增殖情况的影响,结果表明,在2种培养基下,甘露糖都能够减弱2种细胞系的增殖,且呈现出时间依赖以及剂量依赖性(图6、图7),因此后续实验我们选择了更为接近人体血糖水平的低糖DMEM培养基作为培养介质。
a-HCT116细胞系;b-HT29细胞系
图5 HCT116细胞系及HT29细胞系碳源分析
Fig.5 Analysis of carbon source utilization in HCT116 and HT29
注:采用双因素方差分析Bonferroni检验(图6、图7同)
a-HCT116细胞系;b-HT29细胞系
图6 高糖DMEM培养基中HCT116及HT29增殖分析
Fig.6 Analysis of HCT116 and HT29 proliferation in high-glucose DMEM culture
a-HCT116细胞系;b-HT29细胞系
图7 低糖DMEM培养基中HCT116及HT29增殖分析
Fig.7 Analysis of HCT116 and HT29 proliferation in low-glucose DMEM culture
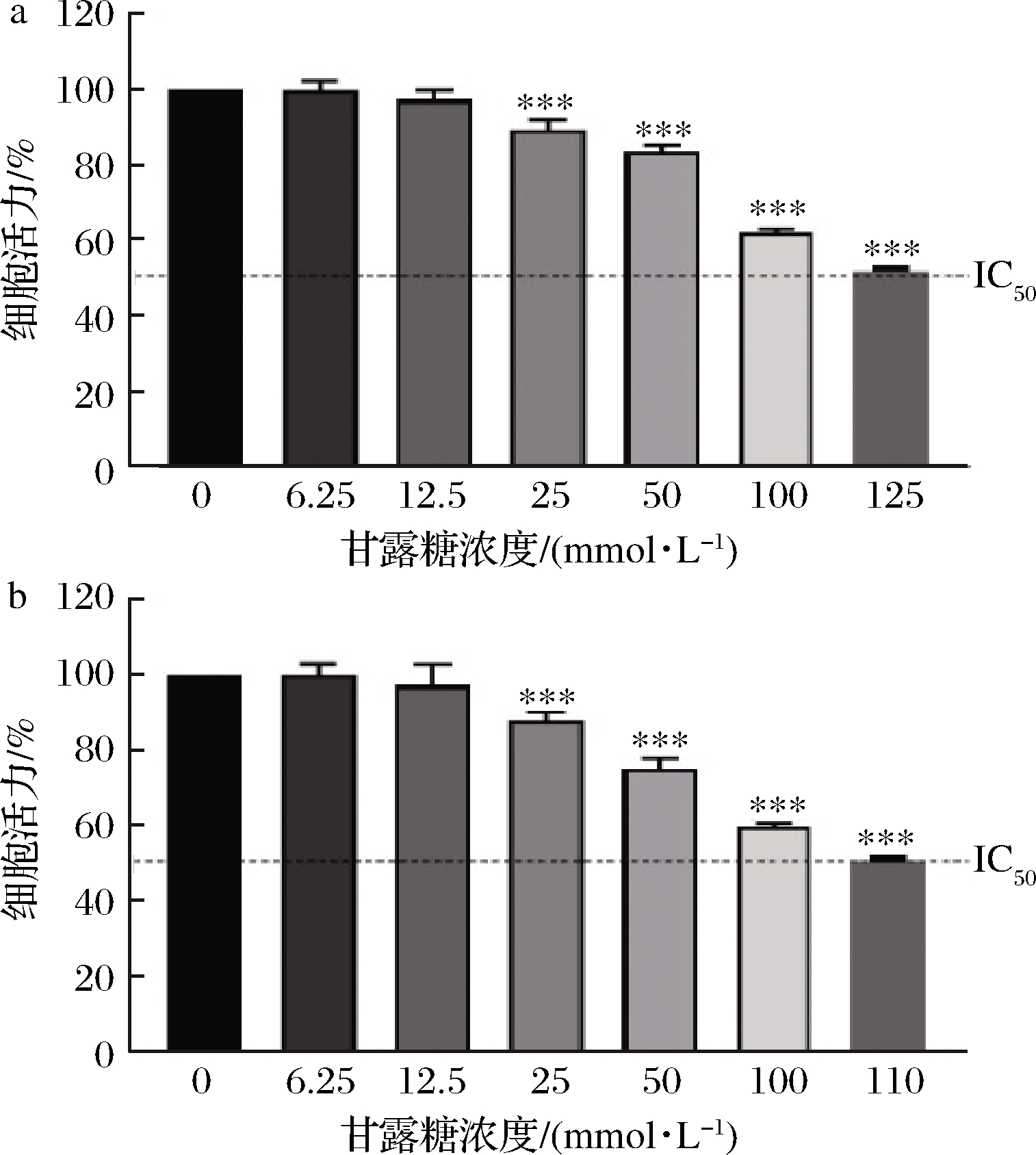
本实验意在探究在前述实验剂量下,甘露糖是否由于其对2种细胞系产生毒性从而造成这种抑制现象。结果表明,甘露糖对HCT116细胞系IC50值约为125 mmol/L,对HT29细胞系IC50值约为110 mmol/L,均远大于增殖实验所用最大剂量(25 mmol/L)(图8)。因此,甘露糖在增殖实验中所用的剂量,对HCT116细胞系及HT29细胞系的毒性作用较小。
a-HCT116细胞系;b-HT29细胞系
图8 甘露糖对HCT116及HT29毒性分析
Fig.8 Analysis of cytotoxicity of mannose to HCT116 and HT29
注:采用单因素方差分析t检验(图11同)
通过对HCT116及HT29两个细胞系培养基中葡萄糖消耗量的测定,以细胞蛋白浓度进行均一化后,结果如图9所示,甘露糖可以降低两者培养液中葡萄糖的消耗量,以25 mmol/L剂量下为例,在48 h时间点降低率达到了(68.40±3.43)%(HCT116)及(58.78±1.27)%(HT29)。

a-HCT116细胞系;b-HT29细胞系
图9 甘露糖对HCT116及HT29葡萄糖摄取的影响
Fig.9 Effects of mannose on glucose uptake of HCT116 and HT29
目前,我们观察到甘露糖能够干扰HCT116及HT29两株细胞系的葡萄糖摄取,因此,我们进一步探究甘露糖是否影响结直肠癌细胞中葡萄糖转运蛋白GLUT1的表达。通过Western Blot分析,我们发现,甘露糖的存在能够降低2株细胞系的GLUT1表达,且表达呈现出剂量负相关性,同时我们也观察到,作为糖酵解的限速酶己糖激酶-Ⅱ(HK-Ⅱ),表达量变化不大(图10)。对各组小鼠结直肠不同部位进行Western Blot分析,结果表明,与模型组相比,甘露糖干预组的肿瘤部位的葡萄糖转运蛋白GLUT1表达显著性低于模型组(P<0.05),说明甘露糖的摄入对小鼠结直肠肿瘤部位葡萄糖的摄取有干扰作用,这和前述细胞实验所观察到的结果一致,并且可以看出,瘤旁组织HK-Ⅱ的表达要低于肿瘤病灶处,与此同时,甘露糖干预组肿瘤病灶的HK-Ⅱ表达与模型组无显著性差异(P>0.05)(图11)。
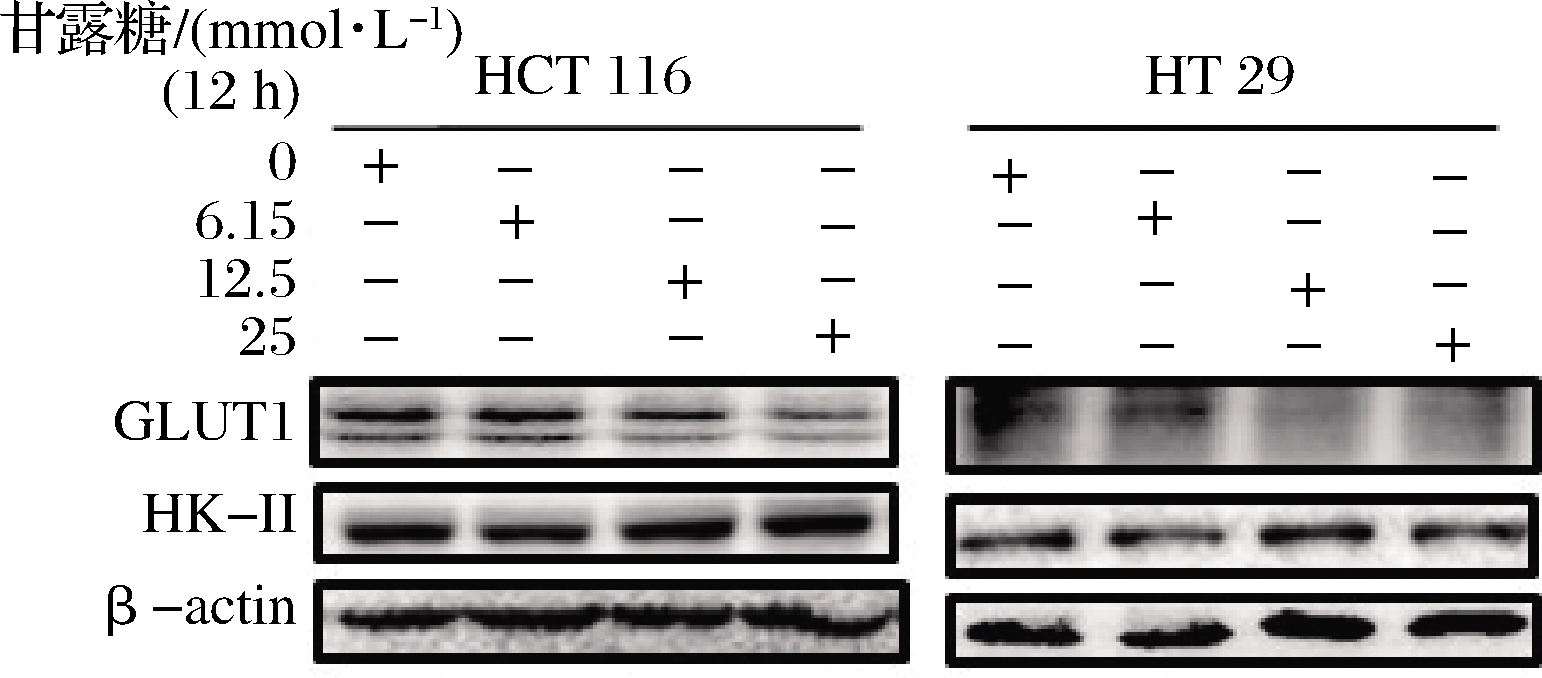
图10 HCT116细胞系及HT29细胞系Western Blot分析
Fig.10 Western Blot analysis of HCT116 and HT29

a-蛋白条带;b-GLUT1蛋白灰度值分析;c-HK-Ⅱ蛋白
灰度值分析
图11 小鼠结直肠组织Western Blot分析
Fig.11 Western Blot analysis of colorectum tissue in mice
葡萄糖含量和脂肪含量高的饮食,即西式饮食,已被证明会诱导肠道发生多种生理及病理变化,继而增加结直肠癌的患病风险[15],不仅在发达国家,在低收入和中等收入国家,结直肠癌的发病率也在迅速上升[16]。葡萄糖的代谢产能为正常细胞以及肿瘤细胞提供能量,而肿瘤细胞有着更强的代谢水平[17],当肿瘤出现异常的葡萄糖代谢时,其自身会发生DNA修复异常及自噬改变等多种生理变化,从而引发肿瘤的增殖、细胞周期及耐药性的改变[18-20]。因此,弱化肿瘤糖代谢是癌症临床治疗中一个重要的思路[21]。
甘露糖与葡萄糖在2号碳位互为差向异构体[22],且两者有着共同的转运载体蛋白GLUT1。GLUT1是多种组织细胞进行葡萄糖摄取时的载体蛋白,尤其是它负责将葡萄糖运输到红细胞中,使血糖浓度水平维持在大约5 mmol/L[11],本研究中所用的低糖(葡萄糖浓度为5.56 mmol/L)DMEM培养基,接近该水平。GLUT1的高表达与大多数癌症患者化疗耐药性及低生存率相关[12,23],同时其表达量也是癌症患者重要的预后指标[11]。虽然糖酵解是结直肠癌细胞的重要代谢途径,但糖酵解途径也广泛存在于正常细胞,因此,在结直肠癌细胞糖酵解通路中特异性高表达的蛋白应作为干扰的重点[24]。葡萄糖转运蛋白GLUT1在结直肠癌细胞中的表达显著性提高[25-27],是其葡萄糖代谢过程中的第一个限速转运蛋白[28],因此GLUT1是一个理想的干扰靶点。抑制GLUT1的表达会减弱癌细胞的增殖[29],有研究表明,抑制人类口腔鳞状癌细胞的GLUT1表达后,其细胞活力及增殖能力显著降低[30]。另一项研究表明,二甲双胍可以抑制人结直肠癌细胞SW480移植瘤小鼠肿瘤的增殖,这与二甲双胍降低肿瘤细胞GLUT1表达有关[31]。本研究表明,在受到甘露糖影响后,在体外实验及体内实验水平,结直肠癌细胞中的GLUT1表达均有所下调,我们认为这是一个影响2种受试细胞系培养液中葡萄糖消耗量降低的重要因素,这也是减弱它们增殖能力的一个重要因素。在肿瘤细胞中,HK-Ⅱ受其催化产物6-磷酸葡萄糖的反馈抑制,但因肿瘤细胞快速的代谢流可以使6-磷酸葡萄糖迅速消耗,故对HK-Ⅱ的抑制作用很小[24],这与我们的实验结果相符,因为甘露糖的存在降低了结直肠癌细胞中GLUT1的表达,细胞的葡萄糖摄取受到抑制,继而代谢流受到影响,对反馈抑制的最终结果无影响,因此本研究中,HK-Ⅱ的表达基本无变化。
本研究表明,一定剂量范围内,甘露糖能够在体外减弱结直肠癌细胞系HCT116和HT29的增殖,并在此剂量范围内,细胞毒性作用较小;在AOM/DSS诱导的原发结直肠肿瘤小鼠模型中,甘露糖干预后,小鼠结直肠肿瘤的个数显著性降低(P<0.05),且肿瘤发展程度低,健康小鼠给予相同方式的甘露糖干预,其体征未发现明显异常;深入探究发现,甘露糖能够降低前述2种结直肠癌细胞系葡萄糖转运蛋白GLUT1的表达,并能够降低两者培养基中葡萄糖的消耗量,在动物模型中也观察到GLUT1表达下调的现象。因此,我们认为在甘露糖的干预下,结直肠癌细胞的葡萄糖摄取因GLUT1下调而被限制,继而其发生及增殖受到影响。本文研究成果对进一步探究甘露糖抑制结直肠癌发生及增殖提供了一些思路。
[1] EVELIEN D, PIETER J T, JASPER L A V, et al. Colorectal cancer[J]. Lancet, 2019, 394(10 207): 1 467-1 480.
[2] KANG YUN PYO, WARD NATHAN P, DENICOLA GINA M. Recent advances in cancer metabolism: A technological perspective[J]. Experimental & molecular medicine, 2018,50(4): 1-16.
[3] MEESTER REINIER G S, MANNALITHARA A, LANSDORP-VOGELAAR I, et al. Trends in incidence and stage at diagnosis of colorectal cancer in adults aged 40 through 49 years, 1975-2015[J]. JAMA, 2019, 321(19): 1 933-1 934.
[4] MA Y, YANG W S, SIMON TRACEY G, et al. Dietary patterns and risk of hepatocellular carcinoma among U.S. men and women[J]. Hepatology (Baltimore, Md.), 2019, 70(2): 577-586.
[5] CYNTHIA L S, WENDY S G. Microbes, microbiota, and colon cancer[J]. Cell Host & Microbe, 2014, 15(3): 317-328.
[6] AMANDINE V, SELMA M. Circadian clocks and cancer: Timekeeping governs cellular metabolism[J]. Trends in Endocrinology & Metabolism, 2019, 30(7): 445-458.
[7] KATO Y, MAEDA T, SUZUKI A, et al. Cancer metabolism: new insights into classic characteristics[J]. Japanese Dental Science Review, 2018, 54(1): 8-21.
[8] LIN J, XIA L, LIANG J, et al. The roles of glucose metabolic reprogramming in chemo-and radio-resistance[J]. Journal of Experimental & Clinical Cancer Research, 2019, 38(1): 218.
[9] GONCALVES M D, LU C, TUTNAUER J, et al. High-fructose corn syrup enhances intestinal tumor growth in mice[J]. Science, 2019, 363(6 433): 1 345-1 349.
[10] GONZALEZ P S, O’PREY J, CARDACI S, et al. Mannose impairs tumour growth and enhances chemotherapy[J]. Nature, 2018, 563(7 733): 719-723.
[11] DENG D, XU C, SUN P, et al. Crystal structure of the human glucose transporter GLUT1[J]. Nature, 2014, 510(7 503): 121-134.
[12] WANG J, YE C, CHEN C, et al. Glucose transporter GLUT1 expression and clinical outcome in solid tumors: A systematic review and meta-analysis[J]. Oncotarget, 2017, 8(10): 16 875-16 886.
[13] FENG W, CUI G, TANG C W, et al. Role of glucose metabolism related gene GLUT1 in the occurrence and prognosis of colorectal cancer[J]. Oncotarget, 2017, 8(34): 56 850-56 857.
[14] VUKSAN V, JENKINS D J, SPADAFORA P, et al. Konjac-mannan (glucomannan) improves glycemia and other associated risk factors for coronary heart disease in type 2 diabetes:A randomized controlled metabolic trial[J]. Diabetes Care, 1999, 22(6): 913-919.
[15] FRANCESCANGELI F, DE ANGELIS M L, ZEUNER A. Dietary factors in the control of gut homeostasis, intestinal stem cells, and colorectal cancer[J]. Nutrients, 2019, 11(12): 2 936.
[16] ARNOLD M, SIERRA M S, LAVERSANNE M, et al. Global patterns and trends in colorectal cancer incidence and mortality[J]. Gut, 2017, 66(4): 683-691.
[17] DEBERARDINIS R J, SAYED N, DITSWORTH D, et al. Brick by brick: Metabolism and tumor cell growth[J]. Current Opinion In Genetics & Development, 2008, 18(1): 54-61.
[18] VALLéE A, LECARPENTIER Y, GUILLEVIN R, et al.Demyelination in multiple sclerosis: reprogramming energy metabolism and potential PPARγ agonist treatment approaches[J]. International journal of Molecular Sciences, 2018, 19(4): 1 212.
[19] KIM J.Regulation of immune cell functions by metabolic reprogramming[J/OL]. Journal of Immunology Research,DOI:10.1155/2018/8605471.
[20] SU B,SU J, ZENG Y, et al. Diallyl disulfide inhibits TGF-β1-induced upregulation of Rac1 and β-catenin in epithelial-mesenchymal transition and tumor growth of gastric cancer[J]. Oncology Reports, 2018, 39(6): 2 797-2 806.
[21] HAMANAKA R B, CHANDEL N S. Targeting glucose metabolism for cancer therapy[J]. Journal of Experimental Medicine, 2012, 209(2): 211-215.
[22] ZHANG D, CHINA C, JIAO X, et al. D-mannose induces regulatory T cells and suppresses immunopathology[J]. Nature Medicine, 2017, 23(9): 1 036-1 045.
[23] WANG T, NING K, LU T X, et al. Elevated expression of TrpC5 and GLUT1 is associated with chemoresistance in colorectal cancer[J]. Oncology Reports, 2017, 37(2): 1 059-1 065.
[24] NAY H. Reprogramming glucose metabolism in cancer: Can it be exploited for cancer therapy?[J]. Nature Reviews Cancer,2016, 16(10): 635-649.
[25] YAMAMOTO T, SEINO Y, FUKUMOTO H, et al.Over-expression of facilitative glucose transporter genes in human cancer[J]. Biochemical and Biophysical Research Communications, 1990, 170(1): 223-230.
[26] WINCEWICZ A SM, KODA M, et al.Significant coexpression of GLUT-1, Bcl-xL, and bax in colorectal cancer[J]. Annals of the New York Academy of Sciences, 2007, 1 095(1): 53-61.
[27] YOUNES M, LECHAGO L V, SOMOANO J R, et al. Wide expression of the human erythrocyte glucose transporter Glut1 in human cancers[J]. Cancer Res, 1996, 56(5): 1 164-1 167.
[28] ZHAO X J, LU C P, CHU W W, et al.MicroRNA-124 suppresses proliferation and glycolysis in non-small cell lung cancer cells by targeting AKT-GLUT1/HKII[J]. Tumor Biology, 2017, 39(5): 1-9.
[29] ZHANG W, XU Y, XU Q, et al. PPARδ promotes tumor progression via activation of Glut1 and SLC1-A5 transcription[J]. Carcinogenesis, 2017, 38(7): 748-755.
[30] KRAUS D, RECKENBEIL J, WENGHOEFER M, et al. Ghrelin promotes oral tumor cell proliferation by modifying GLUT1 expression[J]. Cellular and Molecular Life Sciences, 2016, 73(6): 1 287-1 299.
[31] DING J, GOU Q, JIN J, et al. Metformin inhibits PPARδ agonist-mediated tumor growth by reducing Glut1 and SLC1A5 expressions of cancer cells[J]. European Journal of Pharmacology, 2019, 857: 172 425.