大肠杆菌表达腺苷蛋氨酸合酶及产酶条件优化
毛职医1,2,谈新苑1,2,曹蓉1,2,张晓娟1,2,付静4,徐建国3,4,徐国强1,2*,张晓梅3,许正宏1,2
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学,粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122) 3(江南大学 药学院,江苏 无锡,214122)4(无锡福祈制药有限公司,江苏 无锡,214100)
摘 要 腺苷蛋氨酸(adenosymethionine,SAM)是人体中重要的代谢中间体,在医疗上被广泛应用于治疗肝炎,抑郁症以及关节炎等疾病。酶法进行腺苷蛋氨酸的生产具有良好的工业前景。将来源于酿酒酵母BY4741中的腺苷蛋氨酸合酶基因(sam2)进行密码子优化后,与pET-28a(+)和pET-3b(+)进行连接获得重组质粒pET-28a(+)-sam2和pET-3b(+)-sam2,分别实现其在E. coli BL21(DE3)和E. coli Rosetta(DE3)中的异源表达,结果表明,重组菌E. coli BL21/ pET-28a(+)-sam2的SAM酶活较高,达到0.184 U/mL。对该重组菌株进行发酵条件优化,在最优条件下,SAM合酶最高酶活为0.245 U/mL,比优化前提高34%。
关键词 大肠杆菌;S-腺苷蛋氨酸合酶;异源表达;酶法合成;诱导条件优化
DOI:10.13995/j.cnki.11-1802/ts.023219
引用格式:毛职医,谈新苑,曹蓉,等.大肠杆菌表达腺苷蛋氨酸合酶及产酶条件优化[J].食品与发酵工业,2020,46(10):8-13.MAO Zhiyi,TAN Xinyuan,CAO Rong, et al. Heterologous expression of adenosylmethionine synthase in Escherichia coli and optimization of enzyme-producing conditions[J].Food and Fermentation Industries,2020,46(10):8-13.
第一作者:硕士研究生(徐国强副教授为通讯作者,E-mail:xuguoqiang@jiangnan.edu.cn)
基金项目:江苏省自然基金面上项目(BK20191333)
收稿日期:2019-12-28,改回日期:2020-02-23
Heterologous expression of adenosylmethionine synthase in Escherichia coli and optimization of enzyme-producing conditions
MAO Zhiyi1,2,TAN Xinyuan1,2,CAO Rong1,2,ZHANG Xiaojuan1,2,FU Jing4,XU Jianguo3,4,XU Guoqiang1,2*,ZHANG Xiaomei3,XU Zhenghong1,2
1(The Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)2(National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, China)3(School of Pharmaceutical Sciences, Jiangnan University, Wuxi 214122, China) 4(Wuxi Fuqi Pharmaceutical Co., Ltd., Wuxi 214100, China)
ABSTRACT Adenosylmethionine (SAM) plays a vital role in the organisms’ metabolic activity as an important intermediate metabolite and has been widely used in pharmaceutical industry involving the therapies for liver, nervous systems, osteoarthritis and so on. Thus, production of SAM by enzyme transformation process exhibits potential industrial prospects. Codon optimization of the adenosylmethionine synthase gene sam2 derived from S. cerevisiae BY4741 was performed, and the gene was ligated to pET-28a(+) and pET-3b(+), resulting in recombinant plasmids pET-28a(+)-sam2 and pET-3b(+)-sam2, respectively, and was heterologous expressed in E. coli BL21(DE3) and E. coli Rosseta (DE3) respectively. Results showed that the recombinant strain E. coli BL21/ pET28a(+)-sam2 exhibited higher enzymatic activity up to 0.184 U/mL. Thus, the recombinant strain E. coli BL21/ pET-28a(+)-sam2 was chosen for the optimization of fermentation condition to further improve the enzymatic activity. Under optimal conditions, the enzyme activity of the recombinant adenosylmethionine synthase reached 0.245 U/mL, which was 34% higher than that before optimization.
Key words Escherichia coli; S-adenosylmethionine synthase; heterologous expression; enzymatic synthesis; induction condition optimization
S-腺苷蛋氨酸(S-adenosylemthionine,SAM)广泛存在于各种生物体内,是一种重要的代谢中间体,参与多种类型的生化反应[1],在细胞的甲基化、硫基化以及多胺的合成中起着重要作用[2-3]。自1953年,意大利CATINO等科学家首次发现后[4],腺苷蛋氨酸被广泛地用于临床急、慢性肝病[5-6]、精神抑郁[7]、胆汁郁结以及骨关节炎[8]等疾病的治疗,近几年来还被用来生产具有延缓衰老功能的化妆品[9]。生物发酵法是目前生产SAM的主要方法,大肠杆菌(Escherichia coli)、毕赤酵母(Pichia pastoris)[10]、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[11]都能够进行发酵生产,其中王杰鹏团队通过酿酒酵母SAM0801进行高密度发酵,产量达14.48 g/L,是国内目前报到的最高产量[12]。但由发酵生产得到的SAM纯化分离困难,下游成本较高,因此酶促转化法成了工业生产SAM的研究热点。
酶促转化法是腺苷蛋氨酸合酶直接催化底物L-蛋氨酸和ATP合成SAM[13]。由于该合酶在野生型菌株中活力通常较低,采用外源基因表达潜在具有工业化的方法。表达体系可以选择大肠杆菌[14]、酵母[15]、杆状病毒和哺乳动物细胞,其中大肠杆菌表达体系具有培养条件简单、生长速率较快、发酵性能稳定、基因操作成熟等优点而备受关注,且来自大肠杆菌来源的腺苷蛋氨酸酶编码基因metK是目前选择较多基因 [16-17]。由于酵母是微生物催化生产SAM的产量最高的微生物,采用酵母来源的腺苷蛋氨酸合酶可能具有更大的潜力。酿酒酵母中存在2个同源基因sam1和sam2,其中sam2所编码的SAM合酶对底物L-蛋氨酸的耐受性较好[17],因而本研究经虚拟筛选,选择sam2作为目的基因,重点研究其在大肠杆菌体系中的表达情况。
1 材料与方法
1.1 材料与试剂
1.1.1 质粒与菌株
菌株E. coli JM109、E. coli BL21(DE)、E. coli Rosetta(DE)、表达质粒pET-28a(+)、表达质粒pET-3b(+),均由实验室保藏。
1.1.2 主要试剂
质粒提取试剂盒、DNA凝胶回收试剂盒,上海捷瑞公司;分子操作涉及的工具酶、DNA marker,Takara;葡萄糖、琼脂粉、NaCl等培养基配方试剂,国药试剂有限公司;腺苷蛋氨酸标品,索莱宝公司;L-蛋氨酸、ATP、硫酸卡那霉素,生物工程有限公司。
1.1.3 培养基
SOC培养基需在115 ℃条件下高温灭菌20 min,其余需在121℃条件下高温灭菌20 min。各培养基配方如表1所示。
表1 各种培养基配方
Table 1 Various media formulations
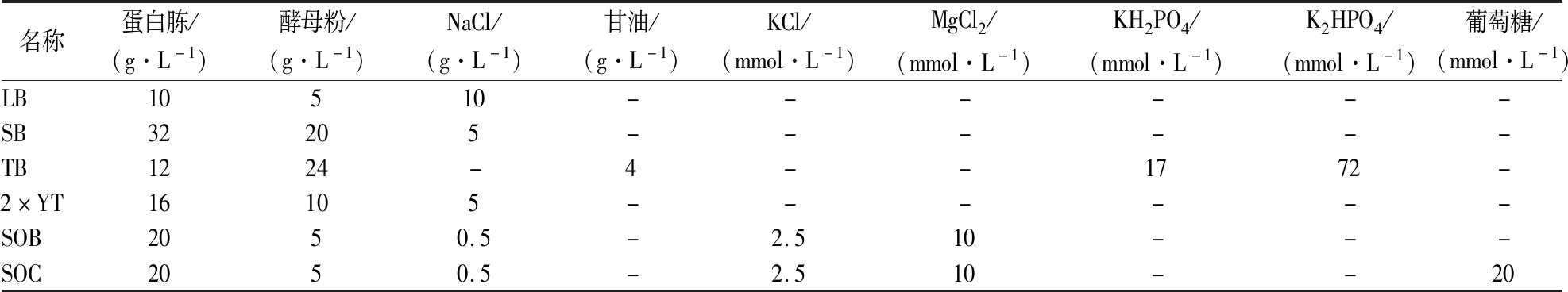
名称蛋白胨/(g·L-1)酵母粉/(g·L-1)NaCl/(g·L-1)甘油/(g·L-1)KCl/(mmol·L-1)MgCl2/(mmol·L-1)KH2PO4/(mmol·L-1)K2HPO4/(mmol·L-1)葡萄糖/(mmol·L-1)LB10510------SB32205------TB1224-4--1772-2×YT16105------SOB2050.5-2.510---SOC2050.5-2.510--20
注:-表示培养基中不添加该物质
1.2 实验方法
1.2.1 腺苷蛋氨酸合酶基因的合成
以NCBI数据库报道的来源于酿酒酵母BY4741的腺苷蛋氨酸合酶基因sam2(登录号NC-001136.10)为模板,根据大肠杆菌密码子的偏好性进行密码子优化,由上海生物工程有限公司进行合成。
1.2.2 目的基因sam2的克隆
基因扩增引物如下:
S1-F:5′-CGGGATCCATGTCCAAGAGCAAAAC-TTTCT-3′;
S2-R:5′-GCTCTAGATTAAAATTCCAATTTCTT-TGGTTT-3′;
引物由上海金唯智公司合成。以合成的基因为模板,以S1,S2为引物进行PCR扩增,反应体系为S1、S2各1 μL,合成基因1 μL,2×PrimeStar 25 μL、ddH2O 22 μL。反应条件为预变性95 ℃,3 min;变性95 ℃,30 s;退火58 ℃,30 s;延伸72 ℃,1 min,35个循环,72 ℃,5 min。PCR反应结束后,将产物进行琼脂糖凝胶电泳分析,利用胶回收试剂盒进行产物回收纯化。
1.2.3 重组菌株的构建
将大肠表达质粒pET-3b(+)和扩增的目的片段分别用限制性内切酶NdeI和XbaI进行酶切处理,纯化回收后利用T4 ligase于16 ℃进行过夜连接。将连接产物化转E.coli JM109感受态细胞中,利用含有氨苄抗性的平板进行筛选,挑取转化子进行菌落PCR验证,将验证正确的进行培养,提取质粒送天霖生物有限公司进行测序,将测序正确的质粒命名为pET-3b(+)-sam2。pET-28a(+)-sam2重组质粒则由上海生物工程有限公司合成。将重组质粒pET-3b(+)-sam2和pET-28a(+)-sam2分别化转E.coli BL21和E.coli Rosetta,得到重组菌株E.coli BL21/pET-28a(+)-sam2、E.coli BL21/pET-3b(+)-sam2、E.coli Rosetta/pET-28a(+)-sam2和E.coli Rosetta/pET-3b(+)-sam2。
1.2.4 重组大肠杆菌的发酵及酶的诱导表达
将构建好的重组菌E.coli BL21/pET-28a(+)-sam2、E.coli BL21/pET-3b(+)-sam2、E. coli Rosetta/pET-28a(+)-sam2和E.coli Rosetta/pET-3b(+)-sam2分别按1%的接种量接入10 mL带有相应抗性的LB种子培养基中过夜培养。之后按10%接种量转接至50 mL含相应抗性的LB发酵培养基中进行发酵培养,重组菌株E.coli BL21/pET-28a(+)-sam2和E.coli Rosetta/pET-28a(+)-sam2于37 ℃培养至适当菌浓(OD600约为0.8)后,加入50 μL IPTG(0.5 mol/L)使其终浓度为0.5 mmol/L, 24 ℃下低温诱导24 h。重组菌株E.coli BL21/pET-3b(+)-sam2和E. coli Rosetta/pET-3b(+)-sam2在37 ℃发酵培养24 h,以空载宿主作为对照。
取2 mL发酵液在4 ℃下8 000 r/min离心5 min,菌体用PBS洗涤2~3次以除去残留发酵液,离心收集菌体进行全细胞酶活检测。离心收集测酶活后的剩余菌体,用PBS重悬后超声破碎细胞,离心收集上清为粗酶液,将粗酶液进行聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gellectrophoresis,SDS-PAGE),检测重组蛋白是否异源表达成功。
1.2.5 发酵条件优化
在LB、SB、TB、2×YT、SOB以及SOC六种培养基中培养细胞,并在相同条件下进行诱导产酶,25 ℃诱导24 h后测定酶活及OD600,以确定适合于重组菌产酶的培养基。
选择最适的IPTG诱导时间,控制IPTG浓度为0.5 mmol/L的情况下,将重组菌在25 ℃下分别诱导6、12、18、24、30、36 h后测定酶活及OD600以确定最适诱导时间。
选择最优的IPTG浓度,在不同浓度的IPTG(0、0.05、0.1、0.2、0.5、1.0、2.0 mmol/L)下,将菌液于25 ℃,220 r/min进行诱导,诱导24 h后,测定酶活及OD600以确定IPTG的最佳浓度。
1.2.6 腺苷蛋氨酸合酶酶活检测
反应母液的配置:L-蛋氨酸 100 mmol/L,三磷酸腺苷100 mmol/L,还原型谷胱甘肽80 mmol/L。
酶活缓冲液:KCl 0.5 mol/L,MgCl2·6H2O 0.2 mol/L,Tris-HCl 0.5 mol/L,pH为8.0。
反应体系:200 μL 100 mmol/L三磷酸腺苷、200 μL 100 mmol/L L-蛋氨酸、100 μL酶活缓冲液、100 μL 80 mmol/L还原型谷胱甘肽、400 μL去离子水,振荡混匀后,37 ℃条件下反应1 h后加入体积分数为20%的高氯酸溶液终止反应。37 ℃,1个酶活单位(U)为1 h、1 mL溶液中生成1 μmol SAM所需要的酶量。
1.2.7 HPLC分析腺苷蛋氨酸产量
色谱柱为Hypercil GOLDTM aQ C18(4.6 mm ×250 mm),流动相为0.01 mol/L甲酸铵和体积分数为3%的甲醇水溶液(pH 3.0),流速1.0 mL/min,检测波长254 nm,进样量为10 μL,采用外标法,根据不同浓度的SAM标准品的峰面积所作标准曲线定量样品SAM的含量。
2 结果与分析
2.1 重组大肠杆菌的构建与筛选
2.1.1 腺苷蛋氨酸合酶基因sam2的克隆
将来源于酿酒酵母BY4741的腺苷蛋氨酸合酶基因sam2基因进行密码子优化,由上海生物科技有限公司进行基因合成,得到经优化后的目的基因与大肠表达质粒pET-28a(+)相连。然后以合成的目的基因为模板,以S1-R、S1-F为引物进行目的片段的扩增并利用1%琼脂糖凝胶电泳进行检测其大小。结果如图1-a所示,在1 100 bp附近有明显条带,与目的基因sam2的大小(1 155 bp)吻合,说明成功从模板中扩增出目的基因片段。
2.1.2 重组大肠杆菌的构建
将带有Amp抗性的pET-3b(+)质粒与扩增得到的目的基因片段进行连接,得到重组质粒pET-3b(+)-sam2。将重组质粒导入E. coli JM109中,挑取转化子进行菌落PCR验证,验证正确的进行培养并提取质粒,双酶切(NdeI和XbaI)进行鉴定。验证结果如图1-b所示,在泳道中出现明显条带(约1 100 bp),与目的基因大小相符。双酶切结果如图1-c所示,在4 600和1 100 bp附近出现了条带,其大小分别与质粒和目的片段的大小相符。将验证正确的质粒进行测序,测序结果显示基因序列正确,即重组质粒pET-3b(+)-sam2构建成功。
将构建成功的重组质粒pET-3b(+)-sam2和上海生工合成的重组质粒pET-28a(+)-sam2同时转入感受态E.coli BL21和E.coli Rosetta中获得重组菌株E.coli BL21/pET-3b(+)-sam2、E.coli Rosetta/pET-3b(+)-sam2、E.coli BL21/pET-28a(+)-sam2和E.coli Rosetta/pET-28a(+)-sam2。
2.1.3 sam2基因在大肠杆菌中的重组表达
对重组菌E.coli BL21/pET-3b(+)-sam2和E.coli BL21/pET-28a(+)-sam2的粗酶液进行SDS-PAGE(以转化空质粒的宿主菌为对照),结果如图2所示。根据氨基酸序列预测该酶的理论分子质量为43 kDa,在约43 kDa处,重组菌产物明显多于只转化空质粒的宿主菌,推测目的基因成功实现了在大肠杆菌中的异源表达。
2.1.4 重组大肠杆菌的筛选
利用原核表达系统上表达目的蛋白的过程中,构建一个合适的原核表达体系需要综合考虑很多的因素,包括挑选合适的表达宿主、构建适合目的基因表达的重组质粒以及优化诱导条件等[20]。
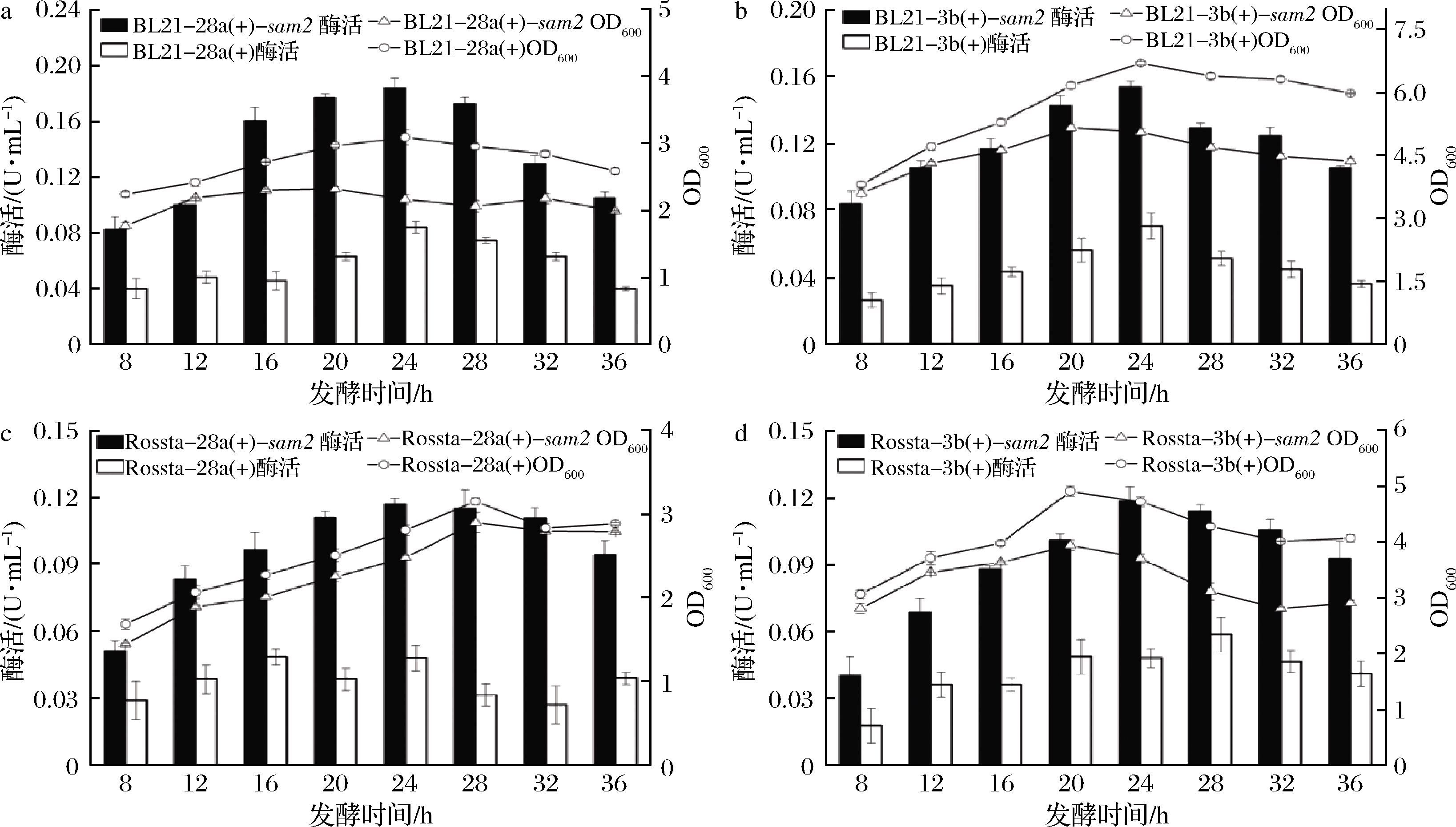
本研究对构建得到的4株重组菌株的产酶能力进行考察,结果如图3所示,与其空载对照相比较,4株菌株的酶活均有明显提高,说明均成功实现了腺苷蛋氨酸合酶的异源表达,其中,重组菌株BL21-pET-28a(+)-sam2的酶活在24 h达到最高值0.184 U/mL(图3-a),明显高于其他3株重组菌株BL21-pET-3b(+)-sam2(图3-b)、E.coli Rosetta-pET-3b(+)-sam2(图3-c)和Rosetta-pET-28a(+)-sam2(图3-d),说明与质粒pET-3b(+)相比,质粒pET-28a(+)更有利于目的蛋白的表达。与E.coli BL21相比,宿主E.coli Rosetta的生长速率较慢,代谢周期更长,酶活表达量较低。因此,选取重组菌株BL21-pET-28a(+)-sam2作为出发菌株进行后续的优化实验。
2.2 发酵条件对腺苷蛋氨酸合酶生产的影响
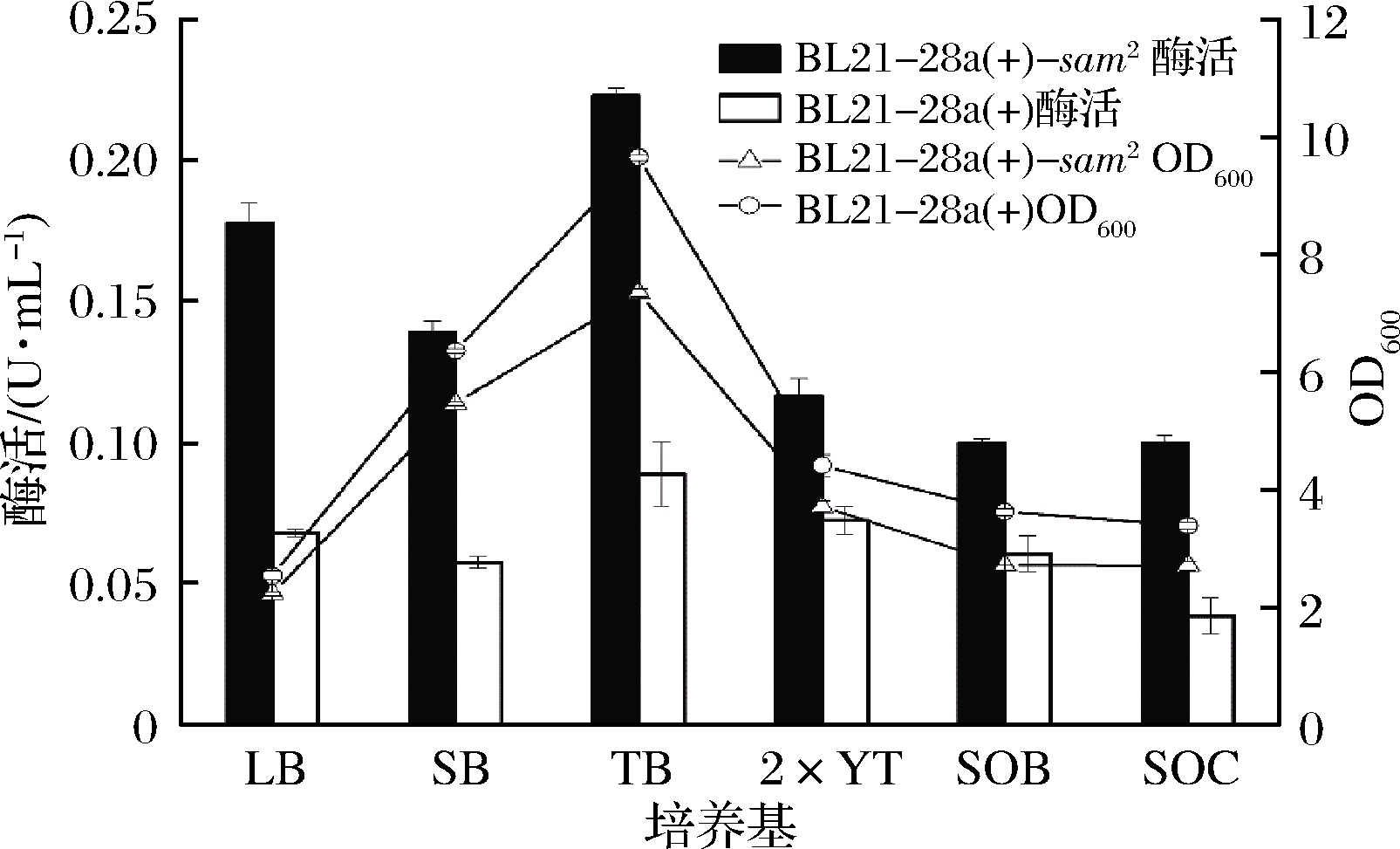
2.2.1 不同培养基对产酶的影响
不同种类的培养基对重组菌的生长与产酶影响较大,因此,需要对重组菌BL21-pET-28a(+)-sam2的培养基进行必要的优化。考察了6种培养基对体生长及酶活的影响,如图4所示,重组菌在TB培养基中生长最好,OD600在生长24 h后能达到9.66,且酶活相对较高,可达0.224 U/mL,较初始培养基LB中的酶活提高了21.7%。因此,选择TB培养基作为重组菌诱导产酶的最适培养基,用于后续试验。
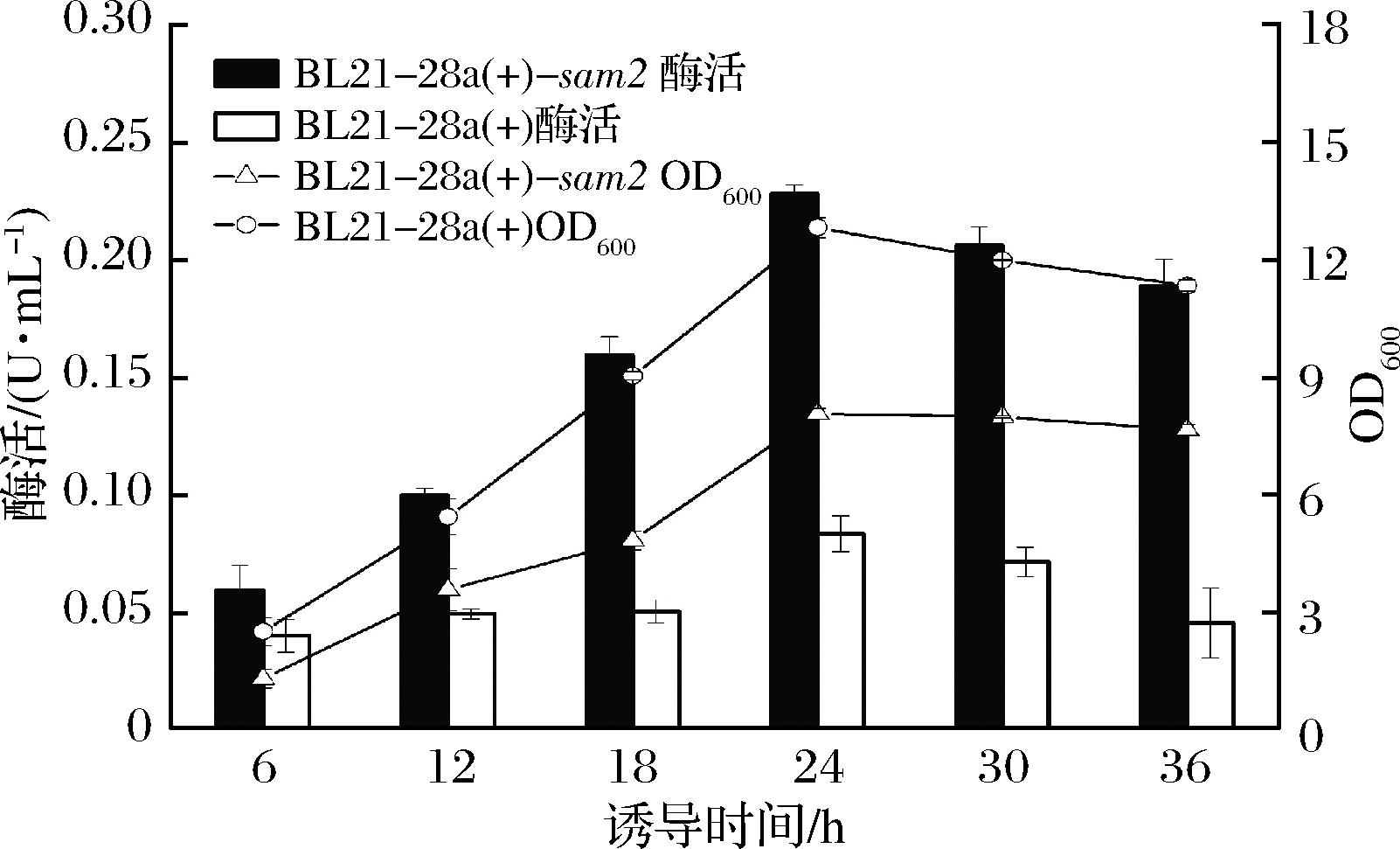
2.2.2 异丙基-β-D-硫代半乳糖苷诱导时间对产酶的影响
异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)的诱导时间对菌体生长至关重要,诱导时间过短会导致菌体生长不彻底,产酶量较低;诱导时间过长则会使发酵成本增高,并且可能导致菌体自溶,降低酶活[21]。本实验考察了IPTG的诱导时间对菌体的生长及产酶的影响,如图5所示,在添加诱导剂诱导之后,重组菌的生物量随着发酵的进行逐渐增加,在发酵24 h后上升趋势趋于平缓,此时酶活可达到0.229 U/mL。综合考虑菌体产酶量以及发酵成本,可以将诱导时间定为24 h。
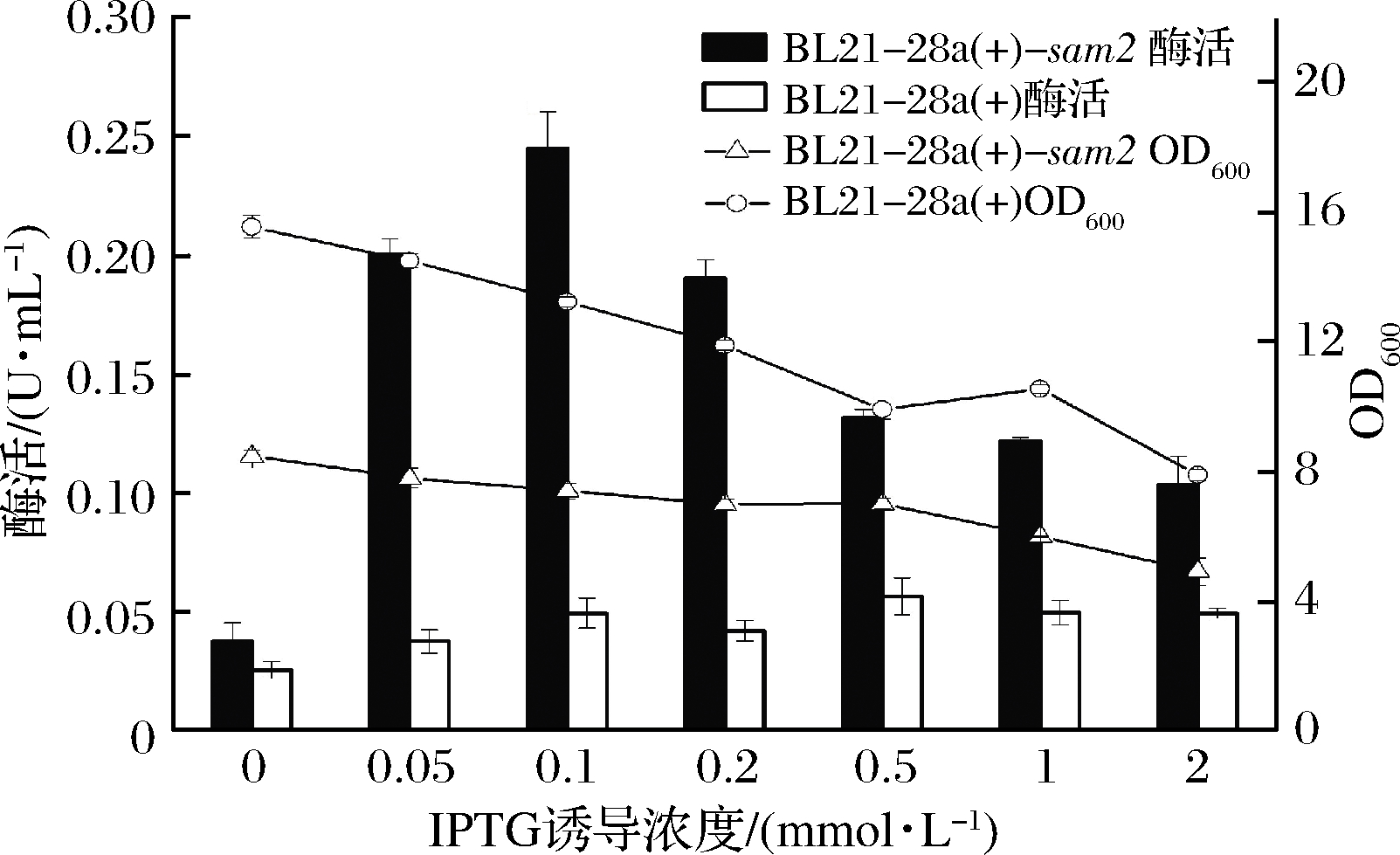
2.2.3 IPTG诱导浓度对产酶的影响
IPTG作为强诱导剂不能被菌体所代谢,而且在培养过程中可以持续的发挥诱导作用,所以较少的添加量就可以起到较好的诱导作用。本实验考察了IPTG的诱导浓度对菌体生长和产酶的影响,研究结果如图6所示,在不添加诱导剂IPTG时,重组菌基本上不产酶,由此推测重组菌为严格的IPTG诱导型菌株;随着IPTG浓度的增大,重组菌的酶活呈现着先增大后减小的趋势,当加入IPTG的终浓度达到0.1 mmol/L时,重组菌的酶活达到最高(0.245 U/mL),较初始的诱导浓度0.05 mmol/L的酶活提高了8.9%;当加入IPTG的终浓度>0.1 mmol/L时,菌体生长和酶活会显著下降,可能的原因是重组蛋白的折叠和转运不能与表达的速率一致,使目的蛋白在体内聚集形成包涵体,从而降低了酶活[22]。
3 结论
本文成功克隆了来源于酿酒酵母酵母BY4741的sam2基因,并对其密码子进行优化以提高与宿主的适配性。进而构建了4株重组菌株E.coli BL21/pET-28a(+)-sam2、E. coli BL21/pET-3b(+)-sam2、E. coli Rosetta/pET-28a(+)-sam2和E. coli Rosetta/pET-3b(+)-sam2,质粒与宿主适配性筛选发现重组菌株E. coli BL21/pET-28a(+)-sam2中相对较高,可达0.184 U/mL。对重组菌株BL21/pET-28a(+)-sam2进行培养基以及培养条件优化,结果表明,在TB培养基中培养,添加0.1 mmol/L的IPTG诱导24 h时的酶活最高,可达0.245 U/mL,较优化前提高了34%。
参考文献
[1] MATO J M,ALVAREZ L,ORTIZ P,et al.S-adenosylmethionine synthesis:Molecular mechanisms and clinical implications[J].Pharmacology Therapeutics,1997,73(3):265-280.
[2] ZHAO Weijun,SHI Feng,HANG Baojian,et al.The improvement of SAM accumulation by integrating the endogenous methionine adenosyltransferase gene SAM2 in genome of the industrial Saccharomyces cerevisiae strain[J].Applied Biochemistry and Biotechnology,2016,178(6):1 263-1 272.
[3] CARMEN GATC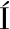 A-RUIZ,MORALES A,COLELL A,et al.Feeding S-adenosyl-L-methionine attenuates both ethanol-induced depletion of mitochondrial glutathione and mitochondrial dysfunction in periportal and perivenous rat hepatocytes[J].Hepatology,1995,21(1):207-214.
A-RUIZ,MORALES A,COLELL A,et al.Feeding S-adenosyl-L-methionine attenuates both ethanol-induced depletion of mitochondrial glutathione and mitochondrial dysfunction in periportal and perivenous rat hepatocytes[J].Hepatology,1995,21(1):207-214.
[4] CANTONI G L.The nature of the active methyl donor formed enzymatically from L-methionine and adenosinetriphosphate[J].Journal of the American Chemical Society,1952,74(11):2 942-2 943.
[5] 张巍巍,刘云顺,王颖,等.S-腺苷蛋氨酸在肝病患者中抗抑郁作用的研究进展[J].现代生物医学进展,2015,15(6):1 196-1 197.
[6] CHRISTOPH J,BERG T,CHENG J,et al.Intrahepatic cholestasis in common chronic liver diseases[J].European Journal of Clinical Investigation,2013,43(10):1 069-1 083.
[7] CARPENTER D J.St John′s wort and S-adenosyl methionine as "natural" alternatives to conventional antidepressants in the era of the suicidality boxed warning:What is the evidence for clinically relevant benefit?[J].Alternative Medicine Review A Journal of Clinical Therapeutic,2011,16(1):17.
[8] MORELLI V,NAQUIN C,WEAVER V.Alternative therapies for traditional disease states:Osteoarthritis[J].American family physician,2003,67(2):339-344.
[9] 魏晓楠.S-腺苷甲硫氨酸(SAM)在大肠杆菌中的合成[D].福建:集美大学,2014.
[10] KAMARTHAPU V,RAGAMPETA S,RAO K V,et al.Engineered Pichia pastoris for enhanced production of S-adenosylmethionine[J].AMB Express,2013,3(1):40.
[11] RUAN Liying,LI Lu,ZOU Dian,et al.Metabolic engineering of Bacillus amyloliquefaciens for enhanced production of S-adenosylmethionine by coupling of an engineered S-adenosylmethionine pathway and the tricarboxylic acid cycle[J].Biotechnology for Biofuels, 2019,12(1):211
[12] 王杰鹏.发酵法生产S-腺苷蛋氨酸前体蛋氨酸补加策略[J].生物工程学报,2008,24(10):1 824-1 827.
[13] MARKHAM G D,DEPARASIS J,GATMAITAN J.The sequence of metK,the structural gene for S-adenosylmethionine synthetase in Escherichia coli[J].Journal of Biological Chemistry,1985,259(23):14 505-14 507.
[14] 刘珞.高产S-腺苷蛋氨酸合成酶基因工程菌的构建[J].北京化工大学学报(自然科学版),2015,40(2):70-73.
[15] HU Xiaoqing,CHU Ju,ZHANG Siliang,et al.A novel feeding strategy during the production phase for enhancing the enzymatic synthesis of S-adenosyl-L-methionine by methylotrophic Pichia pastoris[J].Enzyme and Microbial Technology,2007,40(4):669-674.
[16] DIPPE M,BRANDT W,ROST H,et al.Rationally engineered variants of S-adenosylmethionine (SAM) synthase:Reduced product inhibition and synthesis of artificial cofactor homologues[J].Chem Commun,2015,51(17):3 637-3 640.
[17] KANAI M,MIZUNUMA M,FUJII T,et al.A genetic method to enhance the accumulation of S-adenosylmethionine in yeast[J].Applied Microbiology and Biotechnology,2017,101(4):1 351-1 357.
[18] DIPPE M, BRRANDT W,ROST H,et. Rationally engineered variants of S-adenosylmethionine (SAM) synthase: Reduced product inhibition and synthesis of artificial cofactor homologues[J].Chemical Communications,2019,51(17):3 637-3 640.
[19] 安胜欣.酿酒酵母S-腺苷甲硫氨酸合成酶基因的克隆及表达研究[D].北京:北京化工大学,2006.
[20] RONG Jingjing,DIAO Zhenyu,ZHOU Guohua.Research progress on E.coli expression system[J].Pharmaceutical Biotechnology,2005.
[21] 吴梧桐.生物制药工艺学(第二版)[M].北京:中国医药科技出版社,2006.
[22] DUAN Xuguo,CHEN Jian,WU Jing.Optimization of pullulanase production in Escherichia coli by regulation of process conditions and supplement with natural osmolytes[J].Bioresour Technol,2013,46(10):79-85.


 A-RUIZ,MORALES A,COLELL A,et al.Feeding
A-RUIZ,MORALES A,COLELL A,et al.Feeding