牦牛乳蛋白质质量分数达4.9%~5.9%[1],为普通牛乳的1.6~1.9倍。牦牛乳硬质干酪是喜马拉雅山脉沿途国家重要的传统乳制品,也是富含乳酸菌的活菌产品,成熟周期长,可达2年甚至更长。全脂牦牛乳硬质干酪中脂肪质量分数可达47.5%[2],成熟过程中脂肪和蛋白质同时发生降解,并且微生物数量和菌群结构不断发生改变,因此有复杂生化变化。脱脂干酪是国际常见的一种干酪品种,由于不含脂肪,成熟过程中主要是微生物菌群分泌蛋白酶,水解蛋白质生成各种肽,其中抗氧化活性肽近年受到国内外越来越多的重视。GUPTA等[3]研究表明,普通全脂牛乳切达干酪成熟时间显著影响蛋白肽的抗氧化活性。LU等[4]研究普通全脂牛乳切达干酪水溶性提取物的抗氧化活性,发现随成熟时间的增加,该提取物表现一定的抗氧化特性。目前脱脂牦牛乳硬质干酪水溶性多肽及其抗氧化活性与成熟时间的关系未见报道。现代工业干酪生产所用发酵剂以乳酸菌发酵剂为主,成熟过程中干酪内微生物是一个动态系统,其菌群结构随成熟时间而变化,影响干酪的蛋白降解[5]。ROCHA等[6]研究表明酪蛋白被来自发酵剂微生物菌群分泌的蛋白酶和肽酶水解成各种生物活性肽,微生物数量可影响蛋白质降解,从而影响肽的活性强弱。乳酸菌是重要的益生菌,可直接对宿主产生益生作用或产生有益代谢物[7]。曲秀伟等[8]研究表明切达干酪在益生菌的作用下产生具有抗氧化活性的小分子多肽。宋雪梅等[9]研究了硬质干酪成熟过程中发酵剂乳酸菌自溶以及氨肽酶活性变化。目前对脱脂牦牛乳硬质干酪乳酸菌及菌落总数与成熟时间的相关性以及与水溶性肽浓度的关系未见报道。本试验通过0~6个月的成熟期,探索脱脂牦牛乳硬质干酪成熟期间水溶性多肽浓度、抗氧化活性及微生物数量的动态变化并进行相关性分析,以期为牦牛乳硬质干酪水溶性多肽抗氧化活性的作用机理提供科学依据。
新鲜牦牛乳,采自甘南藏族自治州。
883型发酵剂(保加利亚乳杆菌、嗜热链球菌),丹尼斯克公司;凝乳酶(皱胃酶、牛胃蛋白酶),北京多爱特生物科技有限公司。
Folin酚试剂、DPPH试剂、无水乙醇、三羟甲基氨基甲烷、邻苯三酚、铁氰化钾、三氯乙酸、柠檬酸钠、NaCl、均为分析纯;营养琼脂、蛋白胨、牛肉膏,均为生化试剂。
9NDS-50A型太阳能电动牛奶分离器,青海康平太阳能电动牛奶分离器厂;真空包装机,温州市大江真空包装机械有限公司;723型可见分光光度计,上海光谱仪器有限公司;PHS-3C 精密pH计,上海仪电科学仪器股份有限公司;真空冷冻干燥机,Scientz-ND宁波新芝生物科技股份有限公司;TGL-20M高速台式冷冻离心机,长沙湘仪离心机仪器有限公司。
1.3.1 脱脂牦牛乳硬质干酪制备
脱脂牦牛乳制备工艺流程如下:
新鲜牦牛乳→过滤→检验→脱脂(牛奶分离器,13 000 r/min,脱脂率>99.95%)
脱脂牦牛乳硬质干酪制备,参考马欢等[10]方法:
脱脂牦牛乳→巴氏杀菌(63 ℃,30 min)→冷却(35 ℃)→添加发酵剂(0.006 25 g/L)→添加CaCl2(0.30 g/L)→添加凝乳酶(质量分数0.67%)→凝乳→切割→二次加热→排乳清→搅拌、加盐(用量为凝块质量的2%)→水浴(45 ℃,10 min)→堆酿(30 min)→压榨成型(4~5 h)→真空包装→成熟
1.3.2 牦牛乳硬质干酪出品率测定
参考石永祺等[11]方法,测得脱脂牦牛乳硬质干酪出品率。干酪生产过程中,出品率与水分含量密切相关。为了得到精确的脱脂牦牛乳干酪的出品率,采用校正出品率进行比较。将水分调整到45%,可知脱脂牦牛乳干酪校正出品率。由表1可知,全脂牦牛乳硬质干酪的出品率优于脱脂牦牛乳硬质干酪,全脂干酪的实测出品率较脱脂干酪高25.68%。
表1 脱脂牦牛乳对干酪出品率的影响
Table 1 Effect of skim yak milk on cheese yield

出品率/%脱脂牦牛乳硬质干酪全脂牦牛乳硬质干酪∗实测出品率12.15±0.0215.27±0.33校正出品率9.64±0.0215.60±0.20
注:数据表示形式为平均值±标准误差;*代表数据来源于文献[11]
1.3.3 脱脂牦牛乳硬质干酪基础理化指标测定
1.3.3.1 蛋白质含量测定
参考GB5009.5—2016中的凯氏定氮法进行测定。
1.3.3.2 水分含量测定
参考GB5009.3—2016中的直接干燥法进行测定。
1.3.3.3 pH值测定
参考马欢等[12]方法,称取2 g干酪样品,蒸馏水和干酪以质量比10∶1混合,匀浆后将浆液用pH计测定。
1.3.4 脱脂牦牛乳硬质干酪水溶性多肽提取液制备
参考RIZZELLO等[13]方法制备水溶性多肽提取液(water soluble polypeptide extract,WSPE),将提取液真空冷冻干燥后保存至-18 ℃进行后续的测定,经课题组前期研究已经发现此类提取物为具有活性的肽类物质。
1.3.5 水溶性多肽浓度测定
HERNANDEZ -LEDESMA等[14]研究结果表明,具有抗氧化活性的肽分子质量在1 kDa左右,而Peptone中分子质量<1.4 kDa的小肽组分更为丰富,因此Peptone-folin-酚法可相对准确地测定发酵乳制品蛋白中小分子肽的质量浓度[15]。绘制标准曲线如图1所示,Peptone浓度与吸光值呈现良好的线性关系,回归方程为y=0.008 93+0.563 71x,R2=0.996 46。

图1 多肽浓度标准曲线
Fig.1 Standard curve of polypeptide concentration
参考邢美孜等[15]方法稍作修改。通过对待测样品吸光值A500nm的测定,计算相应水溶性多肽浓度,如公式(1)所示:
C/(g·L-1)=C0×N
(1)
式中,C,样品质量浓度;C0,标准曲线中查得质量浓度;N,稀释倍数。
1.3.6 脱脂牦牛乳硬质干酪水溶性多肽抗氧化活性测定
1.3.6.1 DPPH 自由基清除率测定
参考XIN等[16]方法并稍作修改,称取20 mg DPPH 定容至500 mL无水乙醇,50 g冻干样品溶于1 L去离子水。试验分为样品组(2 mL DPPH溶液+2 mL样品溶液)、对照组(2 mL乙醇+2 mL样品溶液)和空白组(2 mL DPPH溶液+2 mL乙醇)。不同样液充分混匀,静置30 min后在517 nm处测定吸光度。DPPH自由基清除率计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:A0、A1、A2分别为空白组、对照组、样品组的吸光度。
1.3.6.2 超氧阴离子自由基![]() 清除率测定
清除率测定
采用邻苯三酚自氧化法,取0.05 mol/L Tris-HCl缓冲液(pH 8.2)5 mL,分别加入4 mL WSPE(15 g/L),25 ℃水浴20 min。加入3 mmol/L邻苯三酚溶液1 mL,混匀后反应5 min,加入10 mol/L HCl 1 mL终止反应,于320 nm处测定吸光值,空白对照组以相同体积的蒸馏水代替样品。![]() 清除率计算如公式(3)所示:
清除率计算如公式(3)所示:
(3)
式中:![]() 清除率;A空白,不加样液测的值;A样品,加样液测的值。
清除率;A空白,不加样液测的值;A样品,加样液测的值。
1.3.6.3 还原力测定
参考GU等[17]方法。向试管中依次加入1 mL WSPE (15 g/L), 2.5 mL 1%(质量分数)铁氰化钾和2.5 mL磷酸缓冲溶液(0.2 mol/L, pH 6.6),混合均匀后50 ℃保温20 min后放入4 ℃冰箱5 min暂停反应,加入2.5 mL 10%(质量分数)三氯乙酸溶液,放置10 min后离心,取上清液2.5 mL加入2.5 mL去离子水和0.5 mL 1%(质量分数) FeCl3,混匀后室温放置10 min,测其700 nm处的吸光度。还原力以吸光值表示,吸光值越高还原力越强。
1.3.6.4 羟自由基(OH·)清除率测定
羟自由基(OH·)清除率测定如表2所示。37 ℃反应15 min于510 nm处测定反应溶液的吸光值,计算如公式(4)所示[18]:
羟自由基清除率![]()
(4)
式中:Ax为样品组吸光值;Ax0为不加显色剂的吸光值,A0为空白对照吸光值。
表2 羟基自由基(OH·)清除率测定
Table 2 Determination of hydroxyl radical (OH·) clearance
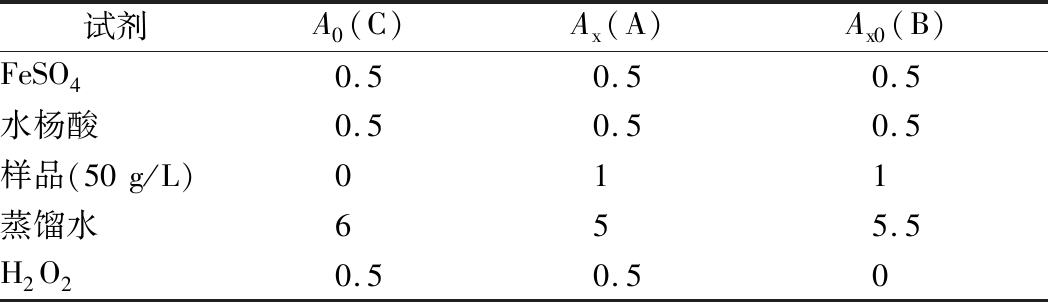
试剂A0(C)Ax(A)Ax0(B)FeSO40.50.50.5水杨酸0.50.50.5样品(50g/L)011蒸馏水655.5H2O20.50.50
1.3.7 脱脂牦牛乳硬质干酪乳酸菌总数和菌落总数测定
1.3.7.1 乳酸菌总数测定
参考GB4789.35—2016的方法进行测定。使用MRS营养琼脂培养基,无菌条件下准确称取1 g干酪置于灭菌器皿中,加入无菌2%(质量分数)柠檬酸钠溶液9 mL进行研磨,充分溶解干酪,搅拌均匀,按体积比1∶10做8个适当稀释度的稀释液,乳酸菌总数采用表面涂布法,于37 ℃培养24 h后计数。
1.3.7.2 菌落总数测定
参考GB4789.2—2016的方法进行测定。使用营养培养基,在无菌条件下准确称取1 g干酪置于灭菌器皿中,加入无菌NaCl溶液9 mL进行研磨,充分溶解干酪,搅拌均匀,按体积比1∶10做8个适当稀释度的稀释液,采用倾倒平板法,于37 ℃培养24 h后计数。
试验每个处理重复3次,各项指标结果均采用3次重复平均值标准误差表示,采用SPSS 22.0进行显著性和相关性分析,用Origin 8.0软件作图。
如表3所示,在干酪样品成熟的第1个月观察到pH值下降,之后pH值呈现上升趋势。这是由于干酪成熟初期乳糖分解产生乳酸导致pH值降低,随着成熟时间的继续增加,蛋白质分解,可溶性氮含量增加,pH值又继而上升。在干酪成熟过程中水分含量呈现下降趋势,成熟0 d全脂干酪的水分含量为41.85%[11],脱脂干酪的水分含量较全脂干酪高25.75%。干酪在成熟过程中排出少量乳清,并且酶和微生物降解蛋白质,使干酪的网络结构受到破坏,蛋白质基质的持水性下降。由表3可知,蛋白质含量在整个成熟期间呈现较小变动,这是由于随成熟时间的延长,在凝乳酶和微生物胞内酶的作用下,酪蛋白不断水解转变成游离氨基酸,同时发酵剂利用干酪中的蛋白质为自身的生长代谢提供营养,导致蛋白质含量变化不大。
表3 基础理化指标
Table 3 Basic physical and chemical index
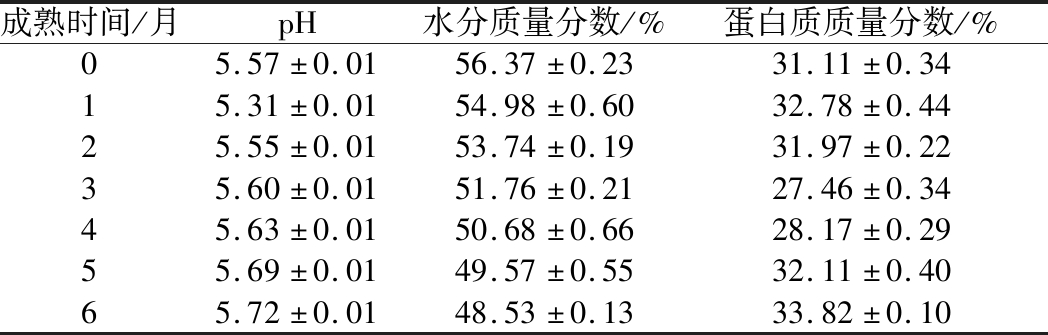
成熟时间/月pH水分质量分数/%蛋白质质量分数/%05.57±0.0156.37±0.2331.11±0.3415.31±0.0154.98±0.6032.78±0.4425.55±0.0153.74±0.1931.97±0.2235.60±0.0151.76±0.2127.46±0.3445.63±0.0150.68±0.6628.17±0.2955.69±0.0149.57±0.5532.11±0.4065.72±0.0148.53±0.1333.82±0.10
根据标准曲线得出的回归方程计算所测样品质量浓度,得到水溶性多肽质量浓度,如图2所示。由图2可知,随成熟时间的增加,脱脂牦牛乳硬质干酪WSPE质量浓度先增加后减小并趋于平稳,且WSPE质量浓度在不同成熟期差异显著(P<0.05)。在第4个月时WSPE质量浓度达到最大值63.34 g/L,是成熟0 d干酪的5.44倍;在成熟至第2个月时WSPE质量浓度增长了98.35%,增长幅度最大。成熟初期,残留凝乳酶降解蛋白质为中等和大分子质量肽,使干酪中的肽质量浓度升高,成熟后期,发酵剂蛋白酶进一步将中等和大分子肽降解为小分子肽和氨基酸残基,相应的干酪中的多肽质量浓度降低。
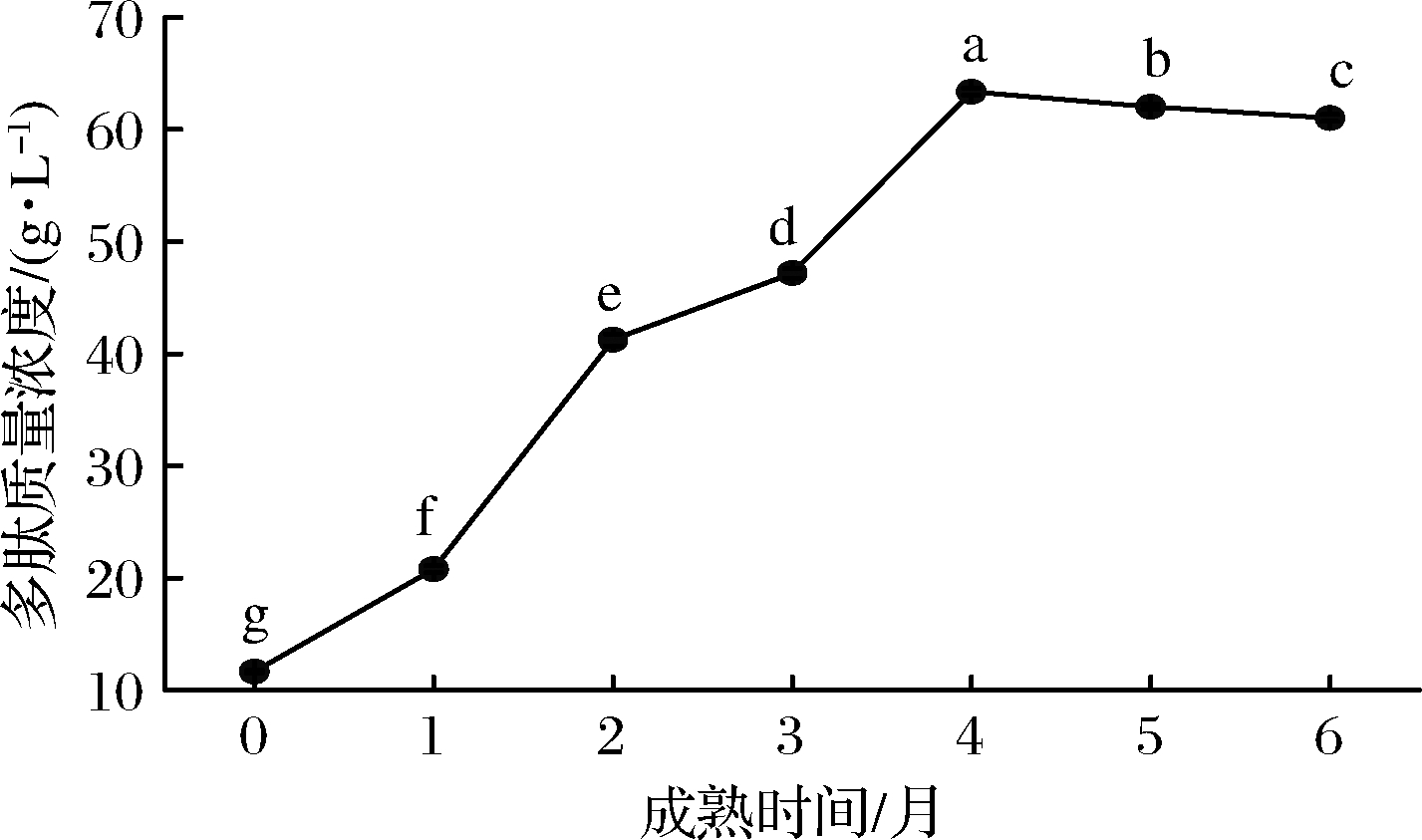
图2 干酪水溶性多肽浓度
Fig.2 Soluble peptide concentration in cheese
注:图中不同小写字母表示不同成熟期差异显著(P<0.05)(下同)
2.3.1 DPPH自由基清除能力
DPPH是稳定的自由基,若能将其清除,则表明样品具有降低H2O2、烷自由基、过氧化自由基或脂质自由基连锁反应的作用[19]。由图3可知,脱脂牦牛乳硬质干酪在成熟过程中,随成熟时间的增加,DPPH自由基清除率先增加后减小,在成熟4个月时达到峰值,且成熟各月份间DPPH自由基清除率存在显著差异(P<0.05)。DPPH自由基清除率在脱脂牦牛乳硬质干酪WSPE中成熟4个月(52.39%)较成熟0 d(13.58%)增长了285.70%。本试验表明,在成熟过程中发生蛋白质降解生成的小分子肽具有抗氧化活性。在4个月之后,DPPH自由基清除率下降,是由于部分小分子肽类物质继续降解成氨基酸。成熟时间与DPPH自由基清除率在成熟0~4个月呈现良好的线性关系,线性拟合方程为y=13.534 49+9.198 32x,R2=0.995 58。
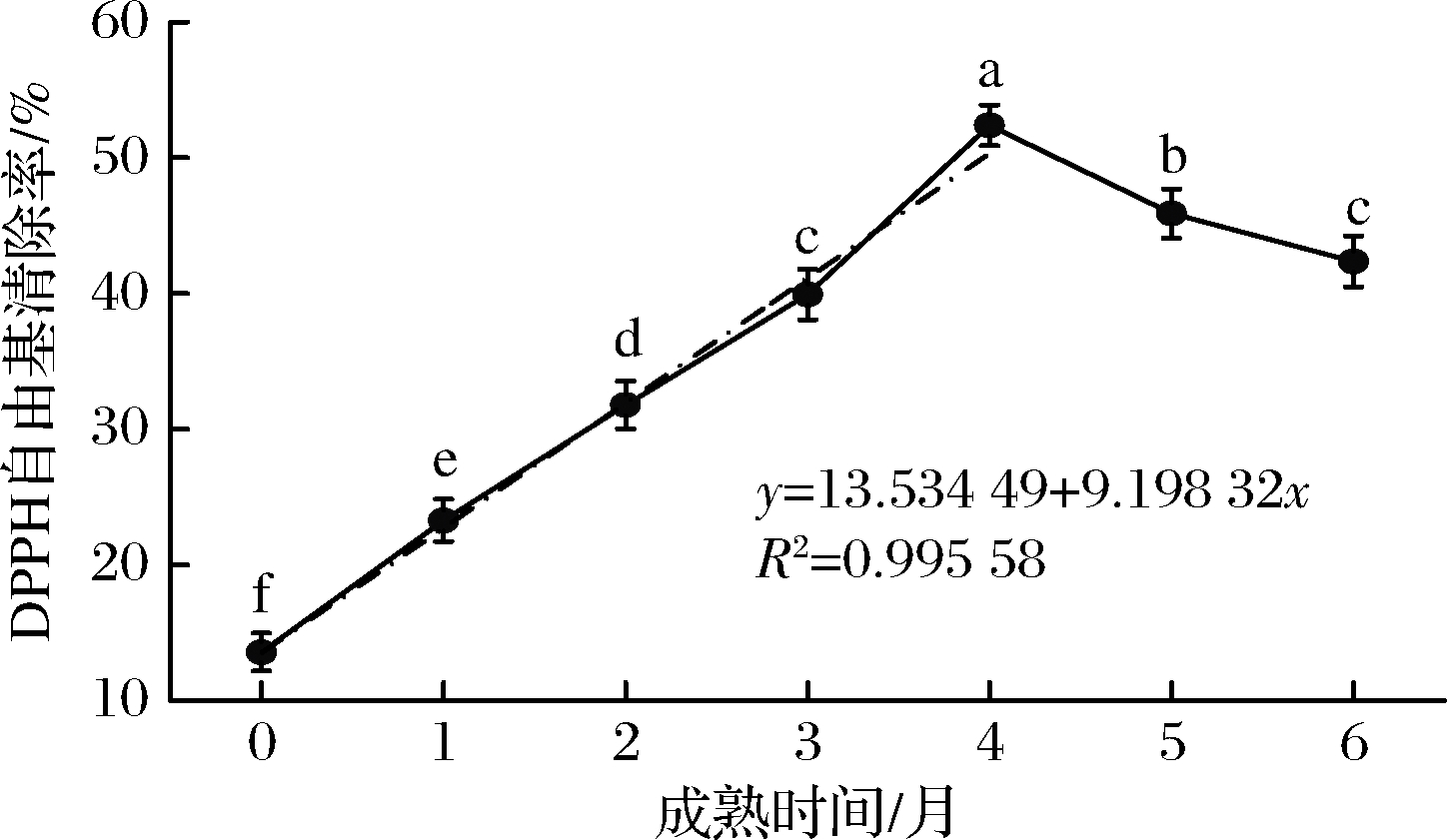
图3 DPPH自由基清除能力
Fig.3 DPPH radical scavenging activity
2.3.2 超氧阴离子自由基![]() 清除能力
清除能力
超氧阴离子![]() 是一类非常活泼的活性氧自由基,具有强烈的氧化能力,在体内会产生对细胞有害的自由基, 导致氢过氧化物的产生,过量的
是一类非常活泼的活性氧自由基,具有强烈的氧化能力,在体内会产生对细胞有害的自由基, 导致氢过氧化物的产生,过量的![]() 会给人体带来多种疾病[20]。由图4可知,随脱脂牦牛乳硬质干酪成熟时间的增加,
会给人体带来多种疾病[20]。由图4可知,随脱脂牦牛乳硬质干酪成熟时间的增加,![]() 清除率先增加后减小,且不同成熟期之间存在显著差异
清除率先增加后减小,且不同成熟期之间存在显著差异![]() 清除率在成熟4个月时值为63.27%,是成熟0 d (17.78%)的2.56倍;
清除率在成熟4个月时值为63.27%,是成熟0 d (17.78%)的2.56倍;![]() 清除率在第5个月开始呈现下降趋势,但是下降后的清除率仍高于第3个月,是成熟3个月的1.25倍。综上,在0~4个月成熟期,成熟时间越长,水溶性肽对
清除率在第5个月开始呈现下降趋势,但是下降后的清除率仍高于第3个月,是成熟3个月的1.25倍。综上,在0~4个月成熟期,成熟时间越长,水溶性肽对![]() 清除率越强。
清除率越强。

图4 超氧阴离子自由基清除能力
Fig.4 Superoxide anion radical scavenging activity
2.3.3 还原力
还原能力的测定是以样品是否为良好的电子供体为指标,还原能力大的样品使吸光值上升,同时与自由基反应,使自由基成为较为稳定的物质,还原力越强则抗氧化性越大[21]。由图5可知,在脱脂牦牛乳硬质干酪成熟过程中,WSPE的还原力呈现先上升后下降的趋势。还原力在脱脂牦牛乳硬质干酪WSPE中成熟5个月时最高,是成熟0 d(0.28)的2.23倍,且在成熟各月份间存在显著差异(P<0.05)。成熟时间与还原力在0~4个月成熟期呈现良好的线性关系,线性拟合方程为y=0.284 37+0.060 54x,R2=0.985 40。李东花等[22]在研究普通全脂牛乳切达干酪水溶性提取物还原力的变化后指出,由于蛋白质在成熟过程中降解生成的小分子肽前期分子质量比后期大,还原力显著低于后期生成的小分子肽。LEE等[23]证明了还原力与还原部分的供氢能力密切相关,而蛋白质水解产生与自由基反应的还原剂,以稳定和终止自由基链反应,提高还原力。
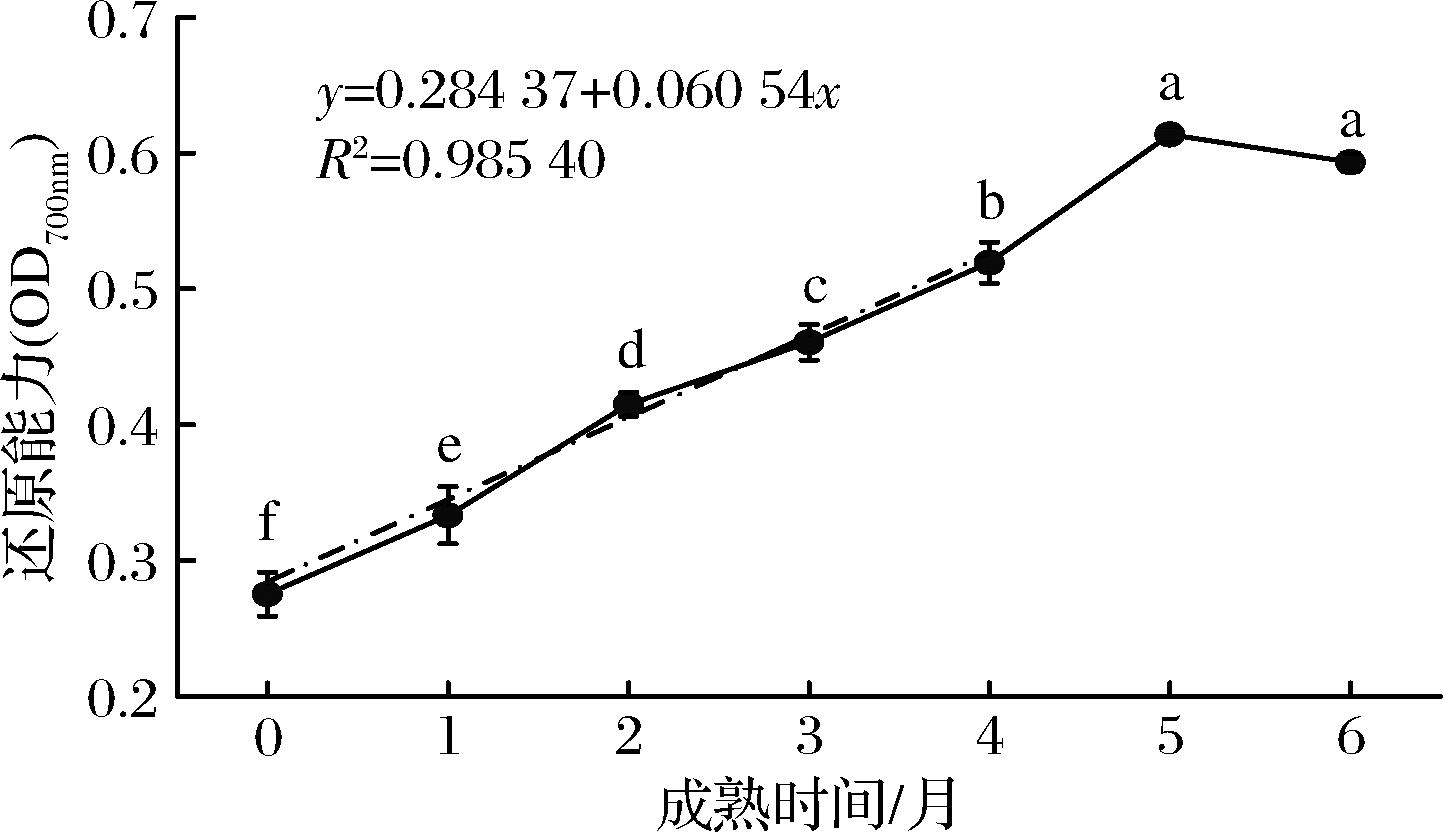
图5 还原能力测定
Fig.5 Deteminarion of reducing power
2.3.4 羟自由基(OH·)清除能力
羟自由基是活泼性最强、氧化性最大的自由基,对DNA、蛋白质和脂类有较强的结合能力,消除过多的氧化自由基,对与老化相关的疾病有预防作用[24-25]。由图6可知,脱脂牦牛乳硬质干酪WSPE的OH·清除率在成熟前4个月随成熟时间的增加而增大。成熟1个月时OH·清除率增长了104.39%;OH·清除率在成熟4个月时(49.54%)是成熟0 d (12.63%)的3.92倍;OH·清除率在脱脂牦牛乳硬质干酪成熟各月份之间存在显著差异(P<0.05)。

图6 羟自由基清除能力
Fig.6 Scavenging capacity against hydroxyl radical
综上所述,在0~4个月的成熟过程中,DPPH自由基清除率![]() 清除率、OH·清除率及还原能力均显著上升,在5~6个月前3种抗氧化指标呈现下降趋势,而还原力持续增加,在第5~6个月达到峰值且差异性不显著(P<0.05)。抗氧化肽相对分子质量小、活性强、易吸收,能捕捉和消除生物体内多余自由基,延缓脂质过氧化[26-27]。但同一干酪水溶性提取物对不同自由基清除能力表现不同,是因为自由基结构不同,与抗氧化物质反应方式也不同。
清除率、OH·清除率及还原能力均显著上升,在5~6个月前3种抗氧化指标呈现下降趋势,而还原力持续增加,在第5~6个月达到峰值且差异性不显著(P<0.05)。抗氧化肽相对分子质量小、活性强、易吸收,能捕捉和消除生物体内多余自由基,延缓脂质过氧化[26-27]。但同一干酪水溶性提取物对不同自由基清除能力表现不同,是因为自由基结构不同,与抗氧化物质反应方式也不同。
2.4.1 成熟时间对牦牛乳硬质干酪乳酸菌总数的影响
乳酸菌总数在脱脂牦牛乳硬质干酪6个月成熟期内的变化情况如图7所示。由图7可知,乳酸菌总数整体呈现下降趋势,成熟各月份间存在显著差异(P<0.05)。乳酸菌总数在成熟0 d时最多,为8.42 lgCFU/g;随成熟时间的延长,成熟4个月时乳酸菌总数减幅为9.89%;在成熟6个月的样品中乳酸菌总数为6.17 lgCFU/g,是成熟0 d的73.28%。成熟时间与乳酸菌总数在6个月成熟期内呈现良好的线性关系,线性拟合方程为y=8.358 78-0.404 12x,R2=0.953 98。KARIMI等[28]研究曾经指出对于益生菌食品,活菌数至少要达到6 lgCFU/g,脱脂牦牛乳硬质干酪在成熟期间保持了较高的乳酸活菌数值。有学者在研究切达干酪指出乳酸菌作为抗氧化剂与羟自由基发生反应,阻止了羟自由基与蛋白质结合,蛋白质发生降解产生抗氧化肽,使得切达干酪具有抗氧化活性[22]。

图7 成熟时间对牦牛乳硬质干酪乳酸菌总数的影响
Fig.7 Effect of ripening time on the total number of Lactobacillus in hard cheese of yak milk
2.4.2 成熟时间对牦牛乳硬质干酪菌落总数的影响
菌落总数在脱脂牦牛乳硬质干酪6个月成熟期内的变化情况如图8所示,由图8可知,随成熟时间的增加,菌落总数整体呈现下降趋势。菌落总数在成熟0 d达到9.51 lgCFU/g;在成熟4个月时减幅最大,减少了8.00%,与乳酸菌总数变化相同;在成熟6个月时值为7.13 lgCFU/g,是成熟0 d的74.97%。菌落总数在脱脂牦牛乳硬质干酪成熟各月份间存在显著差异(P<0.05)。成熟时间与菌落总数在6个月成熟期内呈现良好的线性关系,线性拟合方程为y=9.379 62-0.398 95x,R2=0.957 46。随干酪的成熟,干酪的理化特性越来越不利于微生物的生长,如高盐、低pH以及缺乏可发酵利用的碳源,使得发酵剂乳酸菌及菌落总数的数量缓慢下降,且低贮藏温度使得菌落很难在其中增殖[29]。

图8 成熟时间对牦牛乳硬质干酪菌落总数的影响
Fig.8 Effect of ripening time on the total number of
bacterial colony in hard cheese of yak milk
表4为干酪成熟时间与抗氧化活性指标及微生物数量之间的相关性分析,8个指标间存在显著相关性。成熟时间与WSPE浓度、DPPH自由基清除率![]() 清除率、还原力和OH·清除率均显著正相关,相关系数分别为0.938、0.866、0.875、0.982和0.923;成熟时间与乳酸菌总数和菌落总数显著负相关,相关系数分别为-0.983和-0.985。这说明脱脂牦牛乳硬质干酪成熟时间显著影响WSPE的抗氧化活性和干酪中的微生物数量。在干酪成熟初期由于微生物数量较高,分泌的酶含量高,对蛋白质降解快,因此抗氧化活性值增长较快。干酪成熟过程中微生物数量逐渐下降是由于随成熟时间的增加,干酪中乳糖减少,乳酸菌死亡或自溶,菌落数呈现缓慢下降趋势[30]。微生物对干酪的成熟发挥重要作用,在干酪较长的成熟过程中,蛋白质会被发酵剂乳酸菌的酶系分解成一些短肽和氨基酸,加速蛋白质的水解进程[31],使得WSPE质量浓度上升,进而影响干酪的抗氧化性。
清除率、还原力和OH·清除率均显著正相关,相关系数分别为0.938、0.866、0.875、0.982和0.923;成熟时间与乳酸菌总数和菌落总数显著负相关,相关系数分别为-0.983和-0.985。这说明脱脂牦牛乳硬质干酪成熟时间显著影响WSPE的抗氧化活性和干酪中的微生物数量。在干酪成熟初期由于微生物数量较高,分泌的酶含量高,对蛋白质降解快,因此抗氧化活性值增长较快。干酪成熟过程中微生物数量逐渐下降是由于随成熟时间的增加,干酪中乳糖减少,乳酸菌死亡或自溶,菌落数呈现缓慢下降趋势[30]。微生物对干酪的成熟发挥重要作用,在干酪较长的成熟过程中,蛋白质会被发酵剂乳酸菌的酶系分解成一些短肽和氨基酸,加速蛋白质的水解进程[31],使得WSPE质量浓度上升,进而影响干酪的抗氧化性。
表4 各指标间相关性分析
Table 4 Correlation analysis between various indicators

参数成熟时间WSPE质量浓度DPPH自由基清除率O-2·清除率还原力OH·清除率乳酸菌总数菌落总数成熟时间10.938∗∗0.866∗∗0.875∗∗0.982∗∗0.923∗∗-0.983∗∗-0.985∗∗WSPE质量浓度10.975∗∗0.958∗∗0.960∗∗0.968∗∗-0.976∗∗-0.977∗∗DPPH自由基清除率10.986∗∗0.897∗∗0.978∗∗-0.917∗∗-0.918∗∗O-2·清除率10.893∗∗0.972∗∗-0.923∗∗-0.919∗∗还原力10.938∗∗-0.988∗∗-0.993∗∗OH·清除率1-0.940∗∗-0.944∗∗乳酸菌总数10.999∗∗菌落总数1
注:*表示 P<0.05(双尾),相关性显著;**表示 P<0.01(双尾),相关性极显著
脱脂牦牛乳硬质干酪成熟中蛋白质降解不受脂肪影响,因此更能体现蛋白质降解后的水溶性多肽功能活性。本研究对脱脂牦牛乳硬质干酪0~6个月成熟期WSPE质量浓度、WSPE抗氧化活性和微生物数量进行综合分析,发现脱脂牦牛乳硬质干酪WSPE质量浓度随成熟时间增加显著增加;随成熟时间的增加,4种抗氧化活性指标均呈现显著增加并在第4个月时前三者达到高峰,还原力延续至第5个月达到高峰;微生物数量呈现下降趋势。本试验首次对脱脂牦牛乳硬质干酪成熟期间WEPE、抗氧化活性及微生物变化之间相关性进行研究,这对脱脂牦牛乳硬质干酪的理论研究和产业化发展有重大意义。对于脱脂牦牛乳硬质干酪成熟期间具有抗氧化活性的水溶性多肽分子结构信息有待进一步研究。
[1] LI H,MA Y,DONG A,et al.Protein composition of yak milk[J].Dairy Science & Technology,2010,90(1):111-117.
[2] 杨静,梁琪,宋雪梅,等.牦牛乳与荷斯坦牛乳硬质干酪的抗氧化特性比较[J/OL].食品科学,http://kns.cnki.net/kcms/detail/11.2206.TS.20191015.0928.018.html.
[3] GUPTA A,MANN B,KUMAR R,et al.Antioxidant activity of Cheddar cheeses at different stages of ripening[J].International Journal of Dairy Technology,2009,62(3):339-347.
[4] LU I L, QU X W ,XIA Q N,et al.Effect of Lactobacillus rhamnosus on the antioxidant activity of Cheddar cheese during ripening and under simulated gastrointestinal digestion[J].LWT-Food Science and Technology,2018,95:99-106.
[5] LEE J Y,JOUNG J Y,CHOI Y S,et al.Characterisation of microbial diversity and chemical properties of Cheddar cheese prepared from heat-treated milk[J].International Dairy Journal,2016,63:92-98.
[6] ROCHA G F,KISE F,ROSSO A M,et al.Potential antioxidant peptides produced from whey hydrolysis with an immobilized aspartic protease from Salpichroa origanifolia fruits[J].Food Chemistry,2017,237:350-355.
[7] DONNELLY C, KEHLER M. The Oxford Companion to Cheese[M]. London:Oxford University Press,2016.
[8] 曲秀伟,刘璐,王海霞,等.消化对益生菌干酪抗氧化活性的影响[J].食品科学,2018,39(3):90-96.
[9] 宋雪梅,张炎,梁琪,等.成熟温度对牦牛乳硬质干酪中乳酸菌自溶及氨肽酶活性的影响[J].食品与发酵工业,2016,42(5):38-43.
[10] 马欢,梁琪,宋雪梅,等.不同乳源新鲜干酪中脂肪酸组成和含量的对比[J].食品与发酵科技,2019,55(2):102-108.
[11] 石永祺,梁琪,宋雪梅,等.脂肪含量对牦牛乳硬质干酪质构、流变和微观结构的影响[J/OL].食品科学,http://kns.cnki.net/kcms/detail/11.2206.TS.20190917.1741.121.html.
[12] 马欢,梁琪,宋雪梅,等.发酵剂添加量和成熟时间对牦牛乳硬质干酪脂肪氧化的影响[J].食品与发酵工业,2019,45(15):150-156.
[13] RIZZELLO C G,LOSITO I,GOBBETTI M,et al.Antibacterial activities of peptides from the water-soluble extracts of Italian cheese varieties[J].Journal of Dairy Science,2005,88(7):2 348-2 360.
[14] HERNANDEZ-LEDESMA B,MIRALLES B,RECIO I,et al.I-dentification of antioxidant and ACE-inhibitory peptides in ferment-ed milk[J].Journal of the Science of Food and Agriculture,2005,85 (6):1 041-1 048.
[15] 邢美孜,崔磊,张少辉,等.乳源性生物活性肽的质量浓度测定方法[J].中国乳品工业,2009,37(11):36-38.
[16] XIN L,LIXIA Z,QIANG S,et al.Extraction, identification and structure-activity relationship of antioxidant peptides from sesame (Sesamum indicum L.) protein hydrolysate[J].Food Research International,2018,116:707-716.
[17] GU F,KIM J M,HAYAT K,et al.Characteristics and antioxidant activity of ultrafiltrated maillard reaction products from a casein-glucose model system[J].Food Chemistry,2009,117(1):48-54.
[18] 林佳萍,邵彪,唐梦茹,等.灵芝蛋白质的优化提取及其抗氧化性质研究[J].中国食品学报,2018,18(9):152-158.
[19] KARIMI R,MORTAZAVIAN A M,CRUZ A G.Viability of probiotic microorganisms in cheese during productionand storage:A review[J].Dairy Science & Technology, 2011, 91(3): 283-308.
[20] 程超,薛峰,李伟,等.3种处理方式对葛仙米藻胆蛋白清除超氧阴离子自由基能力的影响[J].食品科学,2014,35(13):26-31.
[21] YEN G C,CHEN H Y.Antioxidant activity of various tea extracts in relation to their antimutagenicity[J].Journal of Agricultural and Food Chemistry,1994,43(1):27-32.
[22] 李东花,李晓东,韩秀娥,等.植物乳杆菌和干酪乳杆菌对契达干酪的抗氧化活性及模拟胃肠道活菌数研究[J].中国食品学报, 2018,18(6):130-138.
[23] LEE Y L,YANG J H,MAU J L.Antioxidant properties of water extracts from Monascus fermented soybeans[J].Food Chemistry, 2008,106(3):1 128-1 137.
[24] KULLISAAR T,ZILMER M,MIKELSAAR M,et al.Two antioxidative lactobacilli strains as promising probiotics[J]. International Journal of Food Microbiology, 2002,72(3):215-224.
[25] HUANG S Q,DING S,FAN L.Antioxidant activities of five polysaccharides from Inonotus obliquus[J].International Journal of Biological Macromolecules,2012,50(5):1 183-1 187.
[26] FERNANDO C G, VICTOR L P. Molecular medicine:Defence against oxidative damage[J]. Nature, 2011, 478(7 367): 42-43.
[27] GALANO A,MAZZONE G,ALVAREZDIDUK R,et al.Food antioxidants: Chemical insights at the molecular level[J].Annual Review of Food Science and Technology,2016,7(1): 335-352.
[28] KARIMI R,MORTAZAVIAN A M,CRUZ A G.Viability of probiotic microorganisms in cheese during production and storage:A review[J].Dairy Science & Technology,2011,91(3):283-308.
[29] ONG L,SHAH N.Probiotic Cheddar cheese: Influence of ripening temperatures on survival of probiotic microorganisms,cheese composition and organic acid profiles[J].LWT-Food Science and Technology,2009,42(7):1 260-1 268.
[30] SETTANNI L,MOSCHETTI G.Non-starter lactic acid bacteria used to improve cheese quality and provide health benefits[J]. Food Microbiology,2010,27(6):691-697.
[31] SPERANZA B,SINIGAGLIA M,CORBO M R.Non-starter lactic acid bacteria biofilms: A means to control the growth of Listeria monocytogenes in soft cheese[J].Food Control,2009,20(11):1 063-1 067.