亚精胺处理对桃果实贮藏品质及内源乙烯和多胺代谢的影响
汪开拓1,2,3*,雷长毅1,2,韦盼盼1,刘群1,黎春红3,蒋永波2
1(重庆三峡学院 生物与食品工程学院,重庆, 404000)2(重庆三峡学院 环境与化学工程学院,重庆, 404000) 3(南京农业大学 食品科技学院,江苏 南京, 210095)
摘 要 研究了亚精胺(spermidine,Spd)处理对采后“白凤”水蜜桃贮藏品质的影响,并从多胺合成与乙烯释放消长变化的角度解析了相关机理。将水蜜桃果实分别浸泡于0、0.5、1和2 mmol/L Spd溶液中10 min(20 ℃),随后于20 ℃下贮藏8 d,期间每隔2 d测定果实各项品质、生理参数、乙烯和多胺含量以及相关基因的表达量。结果显示,相较于其他Spd处理浓度,1 mmol/L Spd处理可显著降低桃果实贮藏期间的腐烂率和褐变度,维持较高的可溶性固形物及有机酸含量并促进总酚、总黄酮和花色苷等抗氧化物质的积累;1 mmol/L Spd处理也能够显著延缓桃果实丙二醛(malondialdehyed,MDA)含量、相对电导率和活性氧水平的上升。此外,1 mmol/L Spd处理可有效上调桃果实PpSAMDC、PpSPDS、PpADC并同时下调PpACS1、PpACO1的转录水平,经Spd处理的桃果实多胺(Spd、Spm和Put)含量显著高于而乙烯释放量和乙烯与多胺比值(E/Spd和E/Spm)则在整个贮藏期间显著低于对照果实。这些结果说明,外源1 mmol/L Spd可直接诱导采后桃果实多胺代谢相关基因的表达以促进果实内源游离多胺的积累,从而反馈抑制果实乙烯合成相关基因的表达和内源乙烯的合成,最终延缓膜脂过氧化进程并维持较高果实品质。
关键词 桃果实;多胺;乙烯;生理;贮藏品质
DOI:10.13995/j.cnki.11-1802/ts.023563
引用格式:汪开拓,雷长毅,韦盼盼,等.亚精胺处理对桃果实贮藏品质及内源乙烯和多胺代谢的影响[J].食品与发酵工业,2020,46(10):92-99;117.WANG Kaituo, LEI Changyi, WEI Panpan, et al. Effects of spermidine treatments on storage quality as well as metabolism of endogenous ethylene and polyamines in postharvest peaches[J].Food and Fermentation Industries,2020,46(10):92-99;117.
第一作者:博士,教授(本文通讯作者,E-mail:wangkaituo83@gmail.com)
基金项目:国家自然基金面上项目(31671913);第五批重庆市高校优秀人才支持计划(2017019);2019年度重庆三峡学院大学生创新创业实验计划项目(201910643034)
收稿日期:2020-02-10,改回日期:2020-02-19
Effects of spermidine treatments on storage quality as well as metabolism of endogenous ethylene and polyamines in postharvest peaches
WANG Kaituo1,2,3*,LEI Changyi1,2,WEI Panpan1,LIU Qun1,LI Chunhong3,JIANG Yongbo2
1(College of Biology and Food Engineering, Chongqing Three Gorges University, Chongqing 404000, China) 2(College of Environmental and Chemistry Engineering, Chongqing Three Gorges University, Chongqing 404000, China) 3(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
ABSTRACT The present study attempted to characterize the involvement of exogenous spermidine (Spd) in the maintenance of quality attributes in postharvest peaches, and further analyze the involved mechanism regarding the interrelationship between polyamines synthesis and ethylene release. The selected peaches were immersed in Spd solutions at different concentrations (0, 0.5, 1 and 2 mmol/L) for 10 min at 20 ℃ respectively, after which the peaches were stored at 20 ℃ for eight days. The quality and physiology parameters, contents of ethylene and polyamines and expression levels of relevant genes were measured at two-day intervals during storage. The results showed that the 1 mmol/L Spd treatment could more significantly decrease the decay incidence, maintain the higher TSS and TA contents as well as enhance the accumulations of total phenol, flavonoids and anthocyanins compared with the either Spd treatment at the concentration of 0.5 or 2 mmol/L. Meanwhile, the 1 mmol/L Spd treatment also remarkably delayed the increase on the MDA content, relative electric conductivity and level of reactive oxygen radicals (ROS) in peaches. In addition, the Spd treatment effectively up-regulated the transcription level of PpSAMDC, PpSPDS, PpADC and down-regulated the levels of PpACS1 and PpACO1 in peaches, contributing to the increase on the polyamines content and the decrease on the ethylene release and ratios of E/Spd and E/Spm over the storage period. These results indicated that reverse suppression of ethylene synthesis and its related genes could be attributed to the promoted expression of genes involved in polyamines metabolism and the polyamines accumulation, which finally delayed the process of membrane-lipid peroxidation and maintain the better quality in peaches.
Key words peach; polyamines; ethylene; physiology; storage quality
植物体在生长发育过程中可通过一系列信号识别和传导机制感知外界环境变化,从而及时对生物性或非生物性因子做出反应,形成应激性的形态或生理生化特性的改变[1]。乙烯作为一种重要的植物激素类小分子,广泛参与到植物各级信号传导通路中,调节植物生长、发育和繁殖以及抗逆反应等各项生命活动[2]。另一方面,多胺是生物体内一类低分子脂肪族含氮碱,植物体中主要有腐胺(putrescine,Put)、精胺(spermine,Spm)和亚精胺(spermidine,Spd),多胺可作为生长调节物质调控植物生长发育,也可作为渗透调节物质在植物遭受胁迫时起保护作用[3]。从合成路径上看,乙烯在植物体中主要以蛋氨酸(Met)为底物,循Met—S-腺苷蛋氨酸(S-adenosyl methionine,SAM)—1-氨基环丙烷-1-羧酸(ACC)—乙烯途径进行合成[4];但在乙烯合成期间,SAM不仅可由ACC合成酶(ACS)的催化作用合成ACC,还可经S-腺苷蛋氨酸脱羧酶(SAMDC)的作用合成多胺[5]。因此,多胺和乙烯共享一个合成前体物质—SAM。乙烯抑制剂氨基乙基乙烯基甘氨酸(AVG)可降低西番莲中SAM合成ACC的速率,同时促进Spm和Spd的合成[6]。而多胺合成抑制剂二氟甲基精氨酸(DFMA)或甲基乙二醛-双脒基腙(MGBG)则可反向促进白蛾藤花瓣外植体中乙烯的合成[7]。
水蜜桃为我国夏季大宗时令水果,因其鲜艳的色泽和鲜甜多汁的口感深受大众青睐。但水蜜桃作为典型的跃变型果实,贮藏期间存在明显的呼吸和乙烯峰及后熟软化效应,导致果实采后品质劣变和生理病害问题突出,因此降低乙烯峰值或推迟其峰值的出现时间有利于维持水蜜桃的采后品质,延长果实货架期[8]。已有相关研究证实外源多胺处理可明显抑制西葫芦[9]和杏[10]等果蔬采后品质的衰败并延长货架期。但现阶段多胺对桃果实采后常温贮藏品质及内源性乙烯合成的影响还未进行详细的量化分析。考虑到多胺和乙烯在合成途径中存在底物竞争关系,因此,本研究以“白凤”水蜜桃为试材,从乙烯释放、多胺含量变化及二者消长关联方面着手,分析外源Spd处理对采后桃果实生理及贮藏品质的影响,以期为揭示多胺延缓果实采后衰老进程的机理提供依据。
1 材料与方法
1.1 材料、试剂与仪器
本研究以“白凤”水蜜桃(Prunus persica Batsch. cv. ‘Baifeng’)为试材,分别于2019年6月3日和7月10日采自四川省遂宁市船山区有机水蜜桃种植基地,采收后3 h内运回实验室。先剔除有机械伤和霉菌斑点果实,再挑选果柄完整、果实大小一致、着色均匀的八成熟果实,摊开置于实验台,通风散去田间热。采摘当天测定桃果实可溶性固形物(TSS)和可滴定酸(TA)含量,其数值分别为(8.74±0.45)%和(0.44±0.03)%。
β-巯基乙醇、苯甲酰氯,上海化学试剂公司;Follin-酚试剂、芦丁标准品、亚精胺标品、精胺标品、腐胺标品,美国Sigma公司;乙烯,重庆瑞信特种气体有限公司;没食子酸、高氯酸、三氯乙酸、硫代巴比妥酸等(分析纯),中国国药集团有限公司;RNAprep Pure Kit,北京天根公司;DCF-DA试剂盒,南京建成生物工程研究所;chamQ universal SYBR qPCR master mix、HiScript III RT SuperMix,南京Vazyme公司。
PAL-1型手持数显折光仪,日本Atago公司;HQF-20型便携式红外线二氧化碳分析仪,金坛市瑞华仪器有限公司;GL-20G-II型冷冻离心机,上海安亭科学仪器厂;DW-86L型超低温冰箱,海尔公司;Technologies 7280A型气相色谱仪,美国Agilent公司;LC-20A型液相色谱分析仪,日本岛津公司;Epoch型全波长酶标仪,美国Biotek公司;SM-24单细胞悬液制备仪,上海净信公司;F-4600型荧光分光光度计,日本日立公司;ABI QuantStudio7型实时荧光定量PCR仪,美国Thermofisher公司。
1.2 处理
2019年6月实验主要探讨Spd处理对桃果实采后腐烂和品质的影响,以筛选最适Spd处理浓度。对上述挑选出的桃果实用75%(体积分数)乙醇进行表面消毒后,随机分成4组:(1)对照组,桃果实浸泡于无菌蒸馏水中,持续10 min(20 ℃);(2)0.5 mmol/L Spd处理组,桃果实浸泡于预先制备好的0.5 mmol/L Spd溶液中,持续10 min(20 ℃);(3)和(4)组Spd处理浓度为1和2 mmol/L,方法同(2)。上述处理完成后将桃果实取出放置于不锈钢钢网上,20 ℃下晾干后分装于60 μm厚的聚乙烯袋中,每袋4颗果实,袋口用橡皮筋缠绕2圈,于(20±1)℃、80%~90%相对湿度的条件下贮藏8 d,期间每2 d取鲜样测定果实腐烂率及品质参数以确定外源Spd的最适处理浓度。各处理组10袋果实,重复3次,整个实验重复2次。
2019年7月实验着重分析Spd处理对桃果实多胺合成和乙烯代谢的影响。将挑选出的桃果实随机分为4组,分别用无菌蒸馏水(对照)和0.5、1和2 mmol/L的Spd溶液进行处理,处理方法和分装同预试验。处理完成后,桃果实同样在(20±1) ℃、80%~90%相对湿度的条件下贮藏8 d,期间每2 d取鲜样测定果实乙烯释放量和呼吸速率,并同时取样经液氮速冻后置于-80 ℃超低温冰箱中保存以测定多胺含量以及相关酶活性和基因表达水平。各处理组16袋果实,重复3次,整个实验重复2次。
1.3 测定指标及方法
1.3.1 腐烂率和褐变度的测定
当桃果实表面出现水渍状斑点或霉菌性病灶即被记为烂果,烂果所占百分比即为腐烂率。
褐变度的测定参考JIANG等[11]的方法,略有改动。称取2 g鲜果肉,研磨后加入10 mL 0.1 mol/L磷酸盐缓冲液(PBS,pH 7.5),充分匀浆后于4 ℃ 10 000×g离心25 min,于410 nm处测定上清吸光值,并以吸光值表示样品褐变度。
1.3.2 可溶性固形物、可滴定酸和pH值的测定
可溶性固形物(total soluble solid,TSS)、可滴定酸(titratable acid,TA)及pH值的测定采用汪开拓等[12]的手持折光仪法、酸碱滴定法及pH计法。
1.3.3 总酚、总黄酮、总花色苷含量测定
取10 g鲜样于20 mL含0.2%(体积分数)甲酸的冷丙酮浸提液,充分匀浆后于4 ℃ 12 000×g离心20 min,收集上清液,再往沉淀中加入20 mL浸提液振荡混匀后再次冷冻离心,合并上清液,定容至50 mL以供总酚、总黄酮和总花色苷含量的测定。总酚含量测定参考Flion-Ciocalteu法[13],总黄酮和总花色苷含量按WANG等[14]的方法测定,结果均以μg/gFW表示。
1.3.4 乙烯释放量和呼吸速率测定
乙烯释放量参考BREGOLI等[15]的方法进行测定。在每个取样时间点从各处理组随机取5个桃果实密闭于4.5 L塑料盒1 h抽气取样,经气相色谱检测乙烯浓度。色谱条件:Porapak Q 80/100 SS安捷伦色谱填充柱,氢火焰离子化检测器,柱温、进样口和检测室温度分别为70、120、150 ℃,载体为N2,外标法定量,结果以μL/(kg FW·h)表示。
呼吸速率参考汪开拓等[12]的方法进行测定,略有调整。从各处理组中随机取5个桃果实密闭于4.5 L塑料盒,用便携式红外线二氧化碳测定仪直接测定30 min内CO2的释放量,以mgCO2/(kg FW·h)表示。
1.3.5 内源多胺含量测定
内源多胺含量按BREGOLI[15]的HPLC方法进行测定,略有修改。取5 g冻样于10 mL 5%(体积分数)高氯酸冰浴研磨匀浆,浸提2 h后于4 ℃ 10 000×g离心25 min。取500 μL上清于10 mL离心管中,加入7 μL苯甲酰氯及1 mL 2 mol/L NaOH,涡漩后于37 ℃水浴0.5 h。随后加入2 mL饱和NaCl溶液,混匀后经2 mL乙醚萃取,离心后取醚相水浴干燥,残留物再经甲醇溶解后备用。流动相由去离子水(A)和甲醇(B)组成。梯度洗脱:0~1 min,50%A: 50% B;15~25 min,20%A: 80%B;26~35 min,70%A: 30%B。流速0.8 mL/min,柱温30 ℃。HPLC装备XBridge反向C18柱(250 mm×4.6 mm,5.0 μm填料粒径),检测波长230 nm。外标法计算样品中内源Spd、Spm和Put含量。
1.3.6 PpSAMDC、PpSPDS、PpADC、PpACS1和PpACO1基因表达量测定
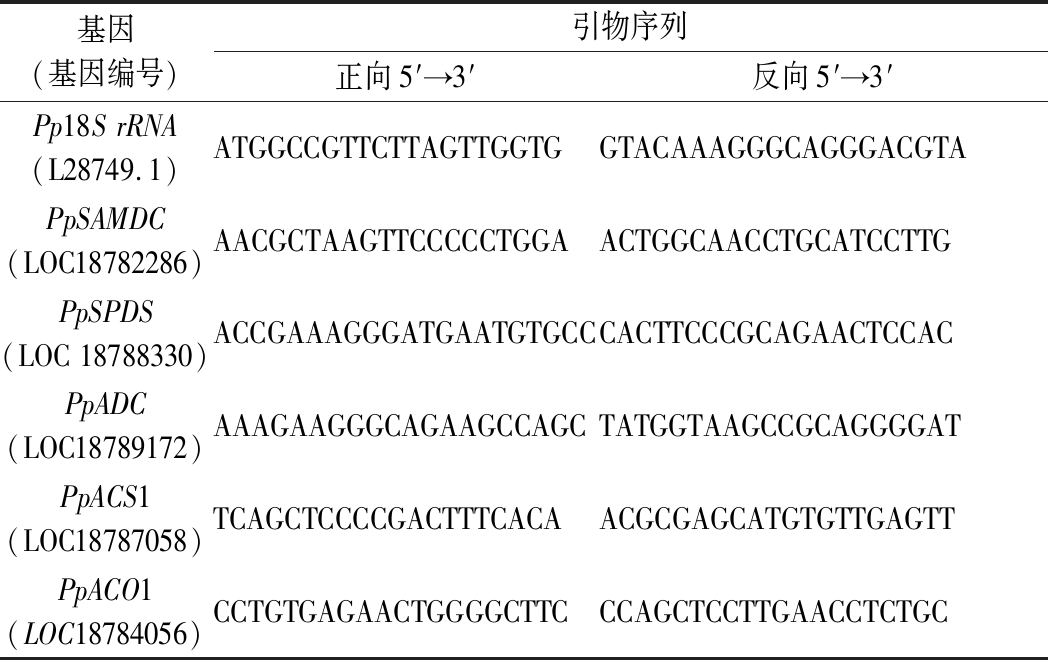
取5 g冻样于液氮充分研磨后用RNAprep Pure Kit提取总RNA,再使用HiScript III RT试剂盒将RNA反转录为cDNA第一条链。参照PpSAMDC、PpSPDS、PpADC、PpACS1、PpACO1基因序列设计特异性引物(表1),以单链cDNA为模板,以管家基因Pp18S rRNA为内参照进行SYBR Green实时荧光定量PCR(qRT-PCR)试验。根据各基因的循环阈值(Ct值)用定量法(2-ΔΔCt)分析各基因mRNA表达丰度,将零点表达量设置为1以校准各基因的相对表达量[16]。
表1相关基因特异性引物序列
Table 1 The sequences of the gene primers used in this study
基因(基因编号)引物序列正向5′→3′反向5′→3′Pp18SrRNA(L28749.1)ATGGCCGTTCTTAGTTGGTGGTACAAAGGGCAGGGACGTAPpSAMDC(LOC18782286)AACGCTAAGTTCCCCCTGGAACTGGCAACCTGCATCCTTGPpSPDS(LOC18788330)ACCGAAAGGGATGAATGTGCCCACTTCCCGCAGAACTCCACPpADC(LOC18789172)AAAGAAGGGCAGAAGCCAGCTATGGTAAGCCGCAGGGGATPpACS1(LOC18787058)TCAGCTCCCCGACTTTCACAACGCGAGCATGTGTTGAGTTPpACO1(LOC18784056)CCTGTGAGAACTGGGGCTTCCCAGCTCCTTGAACCTCTGC
1.3.7 丙二醛、相对电导率和活性氧水平测定
丙二醛(malondialdehyde,MDA)含量与相对电导率的分别采用硫代巴比妥酸(TBA)法及电导率仪法进行测定[12]。果实组织内活性氧水平参考LESHEM等[17]的2′,7′-二氯二氢荧光素二乙酸酯(DCFH-DA)荧光探针法来测定,略有改动。将5 g果实鲜样用20 mL无菌生理盐水匀浆后置于单细胞悬浮制备仪中旋切2 min。吸取2 mL悬液并用300目微孔尼龙膜过滤以获取单细胞悬液并用10 μmol/L DCFH-DA溶液将细胞密度调整至1×107 个/mL,最后使用荧光分光光度计(λem 510 nm,λex 525 nm)测定单细胞悬液荧光强度来表示胞内活性氧水平。
1.4 数据处理
以上各指标测定除腐烂率、TSS、TA和pH值重复测定10 次外,其余指标重复3 次。数据均以平均值±标准误差表示,用Origin 8.5软件作图。运用SAS 8.2软件对数据进行处理,使用Duncan多重比较法分析差异显著性(5%水平)。
2 结果与分析
2.1 外源Spd处理对桃果实采后腐烂率及果肉褐变度的影响
采后贮藏期间桃果实腐烂率呈现不断上升趋势,对照果实在20 ℃贮藏8 d后腐烂率达22.33%,基本丧失商品价值(图1-a)。而适宜浓度的Spd处理(0.5或1 mmol/L Spd)可显著(P<0.05)延缓桃果实采后腐烂的发生,尤其是经1 mmol/L Spd处理过的桃果实于20 ℃贮藏8 d后的腐烂率为13.27%,仅为对照组的0.59倍。同期,0.5或1 mmol/L Spd处理组桃果肉的褐变度较对照组显著(P<0.05)下降,在采后贮藏的8 d内,1 mmol/L Spd处理组果肉的褐变度均显著(P<0.05)低于对照组水平(图1-b)。但2 mmol/L Spd处理反而加剧了桃果实腐烂及果肉褐变症状的发展。
2.2 不同浓度Spd处理对桃果实采后贮藏品质的影响
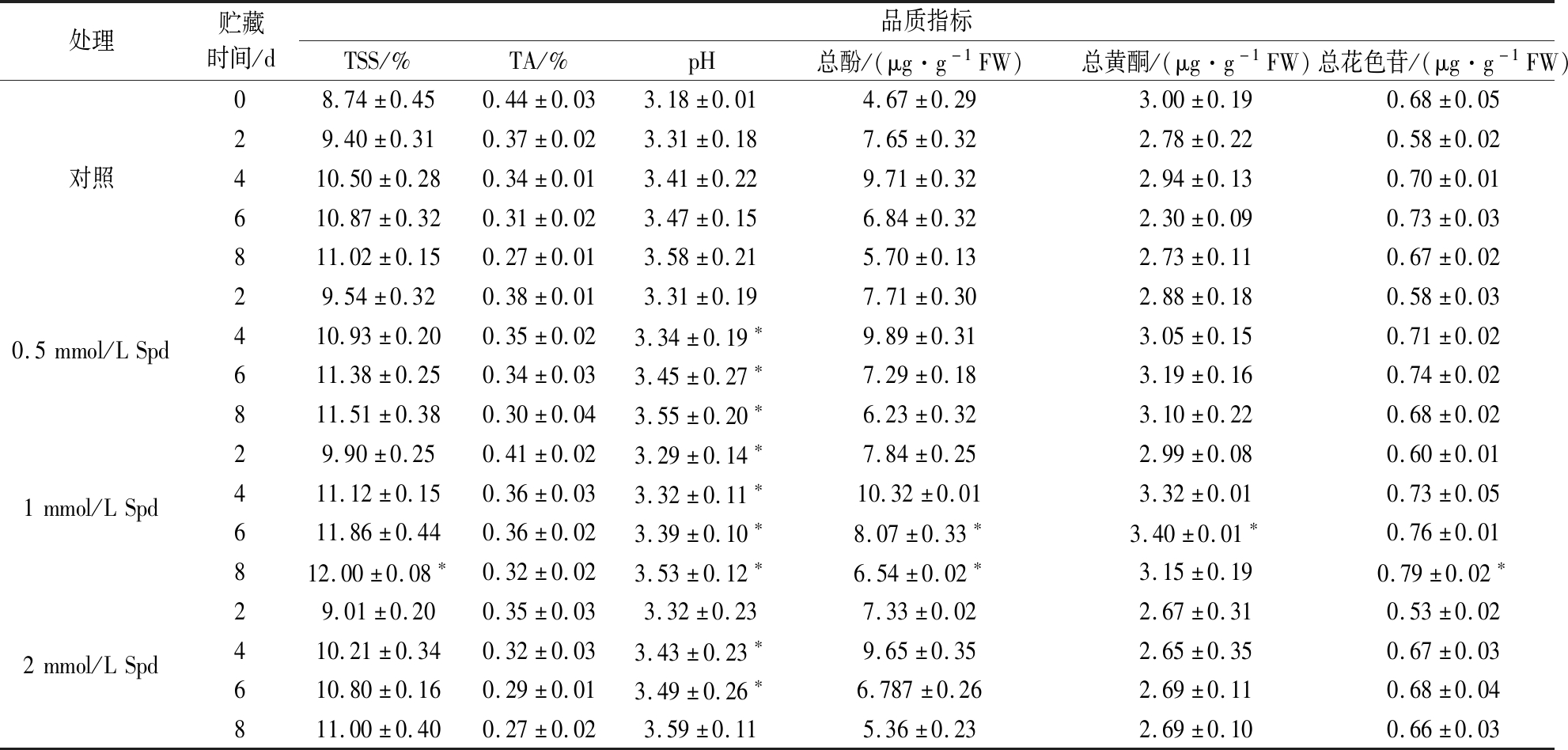
如表2所示,贮藏期间,桃果实TSS及pH值呈现逐渐上升的趋势,TA含量逐渐下降。其中,0.5或1 mmol/L Spd可显著(P<0.05)促进果实TSS和TA的积累并延缓pH值的上升,2 mmol/L Spd处理则降低了桃果实的可溶性固形物及有机酸含量。同时,0.5或1 mmol/L Spd可有效提高果实总酚、总黄酮和总花色苷含量;在贮藏6 d后,1 mmol/L Spd处理最为显著(P<0.05)地促进了上述抗氧化物质的积累。因此,1 mmol/L Spd处理对桃果实采后贮藏品质和抗氧化物质含量的维持效果最佳。
表2 不同浓度Spd处理对桃果实采后贮藏品质的影响
Table 2 Effects of Spd treatments at different concentrations on the quality of postharvest peaches
处理贮藏时间/d品质指标TSS/%TA/%pH总酚/(μg·g-1FW)总黄酮/(μg·g-1FW)总花色苷/(μg·g-1FW)08.74±0.450.44±0.033.18±0.014.67±0.293.00±0.190.68±0.0529.40±0.310.37±0.023.31±0.187.65±0.322.78±0.220.58±0.02对照410.50±0.280.34±0.013.41±0.229.71±0.322.94±0.130.70±0.01610.87±0.320.31±0.023.47±0.156.84±0.322.30±0.090.73±0.03811.02±0.150.27±0.013.58±0.215.70±0.132.73±0.110.67±0.0229.54±0.320.38±0.013.31±0.197.71±0.302.88±0.180.58±0.030.5mmol/LSpd410.93±0.200.35±0.023.34±0.19∗9.89±0.313.05±0.150.71±0.02611.38±0.250.34±0.033.45±0.27∗7.29±0.183.19±0.160.74±0.02811.51±0.380.30±0.043.55±0.20∗6.23±0.323.10±0.220.68±0.0229.90±0.250.41±0.023.29±0.14∗7.84±0.252.99±0.080.60±0.011mmol/LSpd411.12±0.150.36±0.033.32±0.11∗10.32±0.013.32±0.010.73±0.05611.86±0.440.36±0.023.39±0.10∗8.07±0.33∗3.40±0.01∗0.76±0.01812.00±0.08∗0.32±0.023.53±0.12∗6.54±0.02∗3.15±0.190.79±0.02∗29.01±0.200.35±0.033.32±0.237.33±0.022.67±0.310.53±0.022mmol/LSpd410.21±0.340.32±0.033.43±0.23∗9.65±0.352.65±0.350.67±0.03610.80±0.160.29±0.013.49±0.26∗6.787±0.262.69±0.110.68±0.04811.00±0.400.27±0.023.59±0.115.36±0.232.69±0.100.66±0.03
注:同一贮藏时间点,各处理与对照组比较,*表示显著性差异(P<0.05)
2.3 外源Spd处理对桃果实MDA含量、相对电导率及活性氧水平的影响
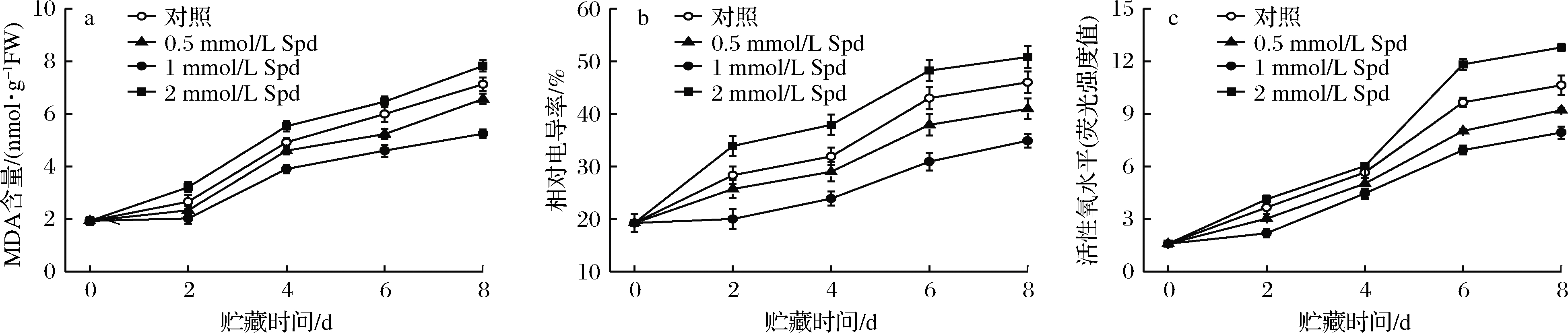
桃果实采后贮藏期间,MDA含量、相对电导率和活性氧水平均呈现出递增趋势(图2)。外源0.5或1 mmol/L Spd处理可一定程度延缓果肉MDA含量及膜透性的上升,其中1 mmol/L Spd处理的作用效果最为显著。2 mmol/L Spd处理反而加剧了贮藏期间桃果肉的膜脂过氧化程度。DCFH-DA作为特异性探针可准确监测细胞活性氧水平[18]。桃果实采后贮藏期间活性氧水平呈现出线性增长模式,但经0.5或1 mmol/L Spd,尤其是经1 mmol/L Spd处理后的桃果实所产生的DCF荧光强度在贮藏期间显著(P<0.05)低于对照果实。
2.4 外源Spd处理对桃果实内源多胺含量的影响
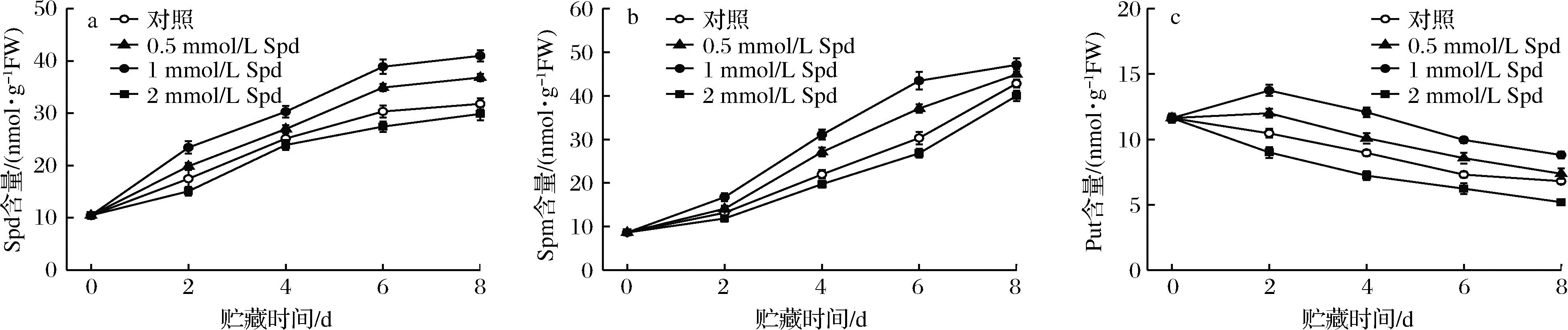
采后贮藏期间,对照桃果实中内源亚精胺(Spd)及精胺(Spm)含量均呈逐渐上升趋势,二者极显著正相关(r=0.92**,P<0.05);而腐胺(Put)含量呈现逐渐下降的变化趋势(图3)。外源Spd处理可促进桃果实内源性游离多胺的积累,其中1 mmol/L Spd处理最为显著的诱导了桃果实内源Spd及Spm的合成,该处理组果实内源Spd及Spm含量在整个贮藏期间均显著(P<0.05)高于0.5或2 mmol/L Spd处理组水平。同期,0.5或1 mmol/L Spd处理可显著延缓Put含量的下降,1 mmol/L Spd处理组果实在贮藏期间始终保持着最高的Put含量。2 mmol/L Spd处理反而导致了桃果实内源多胺的消耗。
2.5 外源Spd处理对桃果实乙烯释放量及呼吸速率的影响
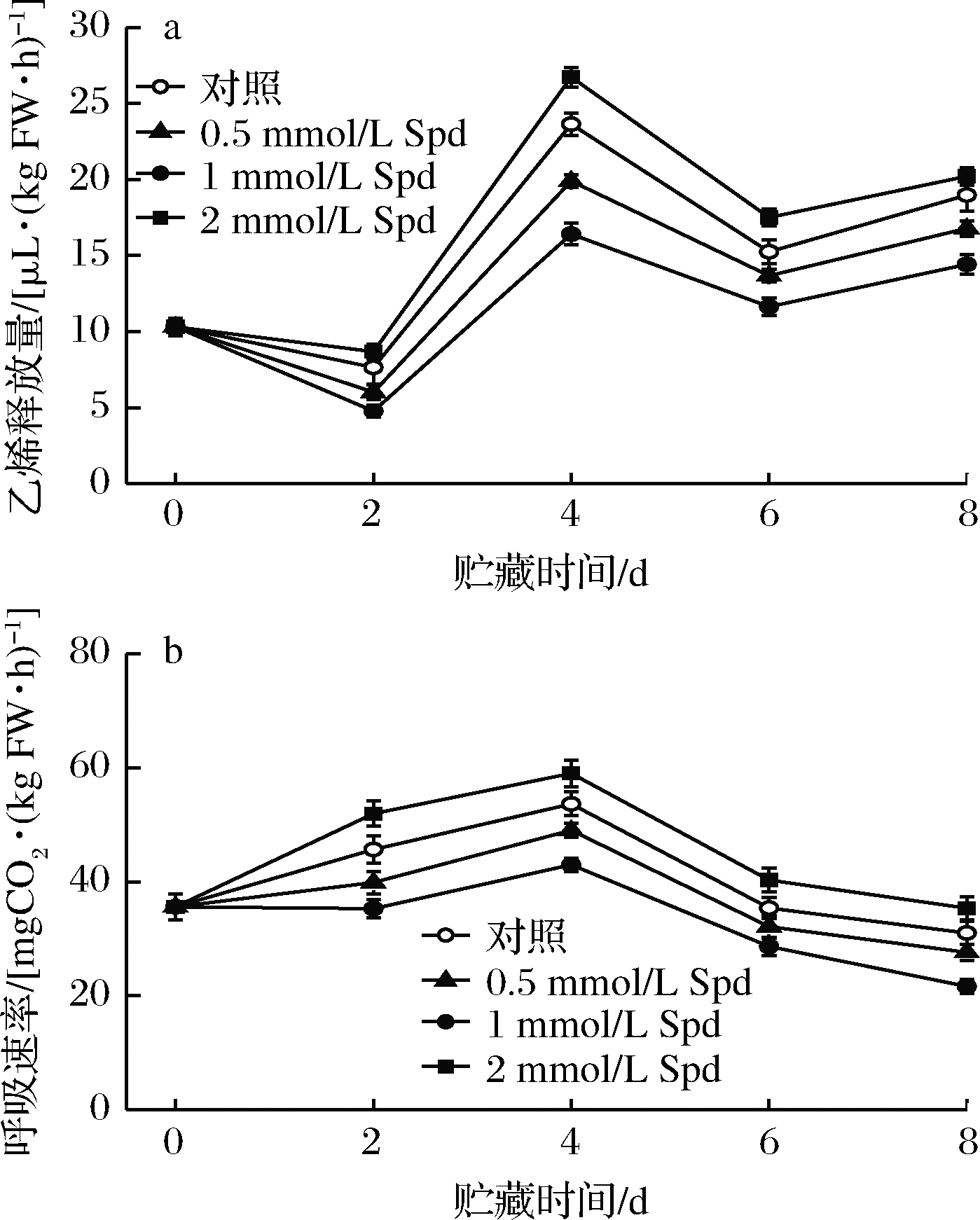
由图4可看出,对照果实均于贮藏的第4天出现乙烯和呼吸峰,其数值为23.64 μL/(kg FW·h)和53.64 mgCO2/(kgFW·h),分别是贮藏前的2.29和1.51倍。外源Spd处理组(0.5或1 mmol/L Spd)果实的呼吸速率的变化趋势同对照保持一致,且适宜浓度的Spd处理(0.5或1 mmol/L Spd)可显著(P<0.05)降低桃果实的乙烯和呼吸峰并始终保持果实乙烯释放量及呼吸速率在较低水平。然而,较高浓度的Spd处理(2 mmol/L Spd)却加剧了采后桃果实的乙烯释放及呼吸速率。
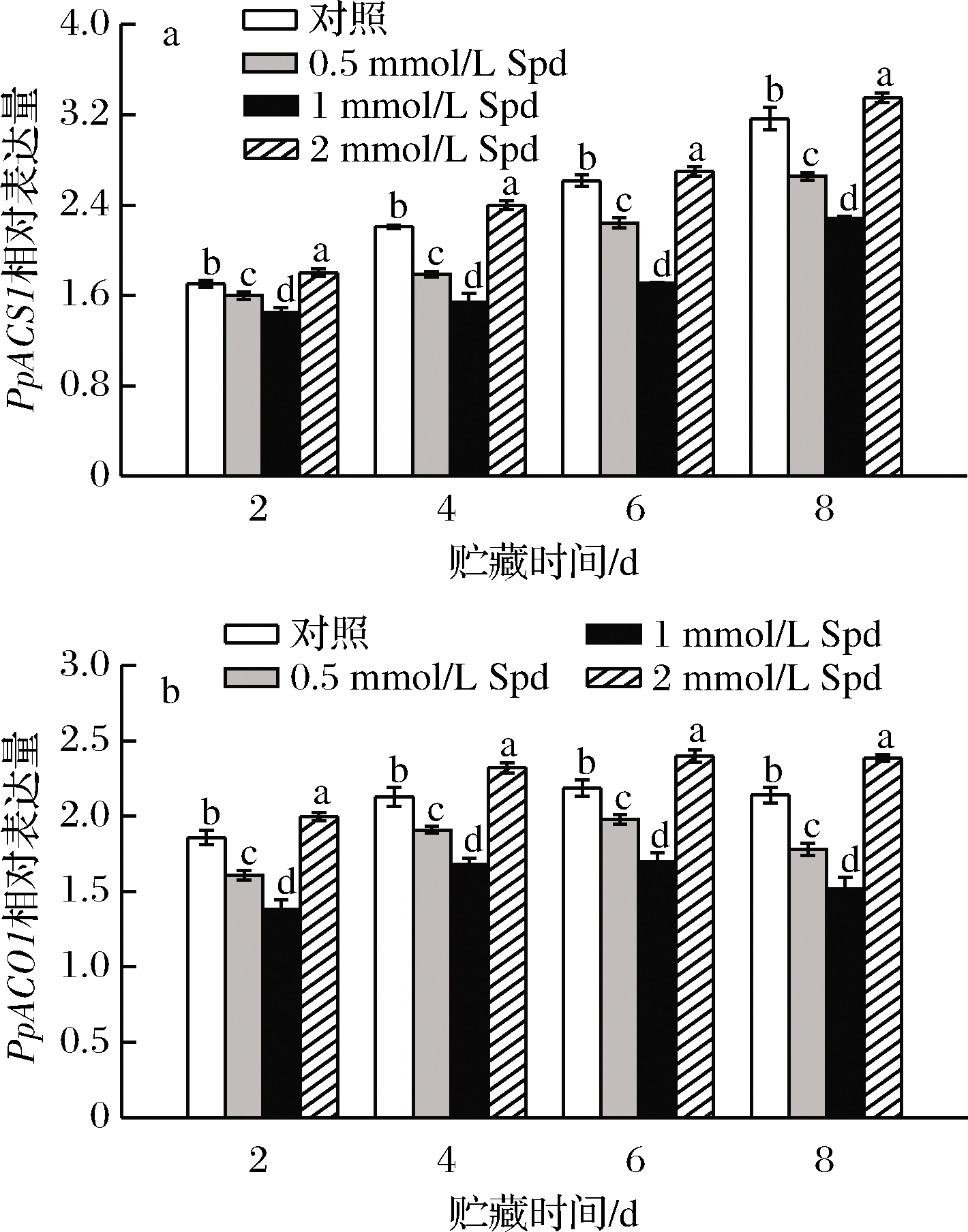
2.6 外源Spd处理对桃果实PpSAMDC、PpSPDS、PpADC相对表达量的影响
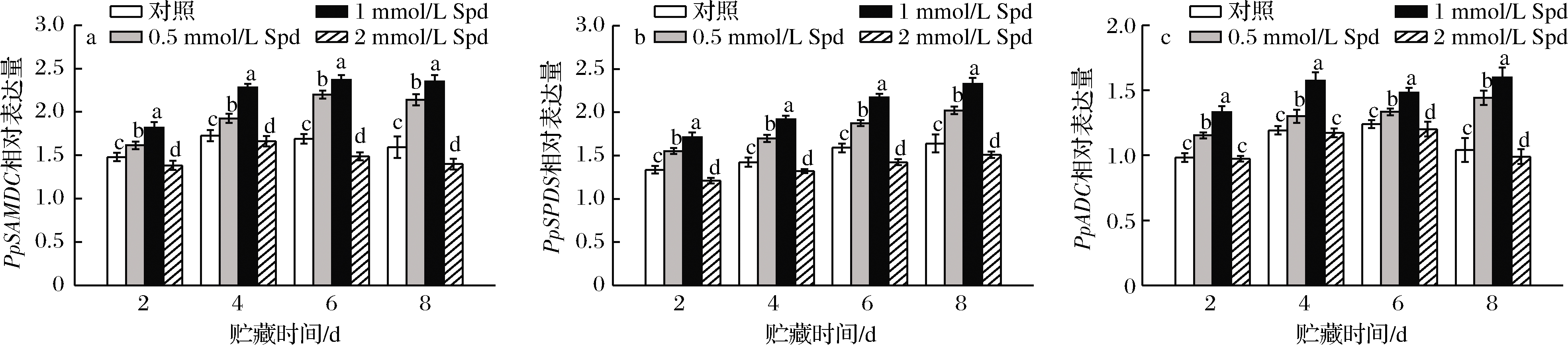
由图5可知,除贮藏第8天外,对照果实采后贮藏期间PpSAMDC、PpSPDS及PpADC的相对表达量呈现逐渐上升的变化趋势。0.5或1 mmol/L Spd处理可显著(P<0.05)上调贮藏期间桃果实PpSAMDC、PpSPDS及PpADC的转录;但较高浓度对PpSPDS及PpADC的转录表达有一定抑制作用。
2.7 外源Spd处理对桃果实PpACS1、PpACO1相对表达量的影响
对照果实采后贮藏期间PpACS1及PpACO1的相对表达量大体呈现逐渐上升的变化趋势;外源Spd处理(0.5或1 mmol/L Spd)显著(P<0.05)下调了PpACS1、PpACO1的表达量,而2 mmol/L Spd处理组果实相应基因的表达量则在贮藏期间显著上调(图6)。
2.8 外源Spd处理对桃果实乙烯释放量和内源多胺消长关系的影响
在多胺生物合成途径中,Spd和Spm与乙烯共同竞争底物S-腺苷-L-蛋氨酸(SAM),桃果实采后贮藏期间乙烯释放量和内源多胺的比值(E/Spd和E/Spm)可反映底物SAM的主要去向[19]。随着采后贮藏时间的延长,E/Spd及E/Spm大体均呈现出与乙烯释放量一致的变化趋势。较对照而言,0.5或1 mmol/L Spd处理组的E/Spd及E/Spm得以大幅下降,然而2 mmol/L Spd处理组的E/Spd及E/Spm始终保持在最高水平(图7)。
3 讨论
多胺作为一类具有独特生物活性的小分子物质,在果实的生理衰老和胁迫响应方面起着重要的调控作用[3]。本研究中,1 mmol/L Spd处理较其他处理浓度更为显著地降低了桃果实在贮藏期间腐烂率和褐变度的上升(图1),并且经1 mmol/L Spd处理的果实中感官品质和抗氧化物质含量也显著高于对照果实(表2)。同时,经1 mmol/L Spd处理的桃果实中呼吸速率、乙烯释放量、MDA含量、相对电导率和细胞活性氧水平等生理参数均显著低于对照水平。这说明,1 mmol/L Spd处理可有效维持桃果实活性氧代谢平衡和细胞膜完整性,延缓生理衰老和品质劣变速度。多胺属于直链阳离子化合物,相对高浓度的Spd(2 mmol/L)处理则可能造成果实内部渗透压和细胞膜电位的改变,故导致其对桃果实的保鲜效果不佳。与本结果相类似,适宜浓度的外源Spd处理(0.5~1 mmol/L)可有效维持葡萄[20]、梨[21]及猕猴桃[22]等果实的采后贮藏品质以延长货架期,而高浓度Spd反而不利于植物次生代谢物的合成[23]。
乙烯与呼吸跃变型果实的后熟、生理衰老和腐烂密切相关[2]。抑制呼吸跃变型果实如香蕉[24]和芒果[25]中内源乙烯合成可有效降低呼吸峰值,延缓后熟进程或品质劣变速率,延长果实货架期。在多胺合成路径中,SAMDC酶可将SAM脱羧为deSAM从而为多胺合成提供底物,ADC和SPDS酶则是合成Put和Spd的关键酶[26],而ACO和ACS酶则是将SAM催化为乙烯的关键酶[27],故乙烯和多胺在合成路径上存在对共同底物SAM的竞争关系。在本研究中,外源1 mmol/L Spd处理可显著诱导PpSAMDC、PpSPDS和PpADC等多胺合成相关基因表达量的上升(图5),从而促进果实中游离多胺(Spd、Spm和Put)的积累(图3),而经Spd处理的水蜜桃果实中PpACS1和PpACO1基因表达丰度以及乙烯释放量则显著低于对照果实,从而导致E/Spd和E/Spm的下降。这些数据表明,Spd处理可通过下调乙烯合成相关基因并上调多胺合成相关基因的表达使得SAM趋于多胺合成方向,从而促进果实多胺合成并降低乙烯释放量和呼吸速率,维持贮藏品质。这与前人的在番茄[28]及中黄瓜[29]中的研究结果保持一致。另一方面,内源多胺常以多聚阳离子状态存在,可中和细胞膜上带负电荷的磷脂,提高细胞膜还原势,避免活性氧自由基的过度积累,从而降低细胞膜中不饱和脂肪酸的过氧化程度,维持膜脂渗透性和流动性[23];外源Spd处理也被证实具有改善由高盐和高温胁迫导致的膜介导的氢离子外渗现象的作用,阻止植物体细胞结构的崩溃[30]。本研究中,1 mmol/L Spd处理可显著降低水蜜桃胞内活性氧水平并抑制MDA含量和相对电导率的上升,这说明外源多胺处理具有维持桃果实细胞膜稳定性、延缓采后衰老速度的作用,这与乙烯峰值的降低和游离多胺合成量的增加密切相关。
4 结论
1 mmol/L Spd处理可显著维持桃果实中可溶性固形物及有机酸的含量,促进总酚、黄酮与花色苷物质的合成,并有效抑制贮藏期间果肉褐变及腐烂的发生。其诱导桃果实PpSAMDC、PpSPDS及PpADC高表达的同时下调PpACS1及PpACO1的转录,促进果实内源性Spd、Spm和Put的合成并抑制内源乙烯的合成,减缓膜脂过氧化程度,从而维持果实采后品质。
参考文献
[1] SERVANE B, JULIE B, LAURIANE G, et al. Pivotal roles of environmental sensing and signaling mechanisms in plant responses to climate change[J]. Global Change Biology, 2018, 24(12): 5 573-5 589.
[2] WENG J K, YE M, LI B, et al. Co-evolution of hormone metabolism and signaling networks expands plant adaptive plasticity[J]. Cell, 2016, 166(4): 881-893.
[3] ANWAR R. Polyamine interactions with plant hormones: Crosstalk at several levels[J]. International Journal of Hydrogen Energy, 2015, 38(2): 1 039-1 051
[4] ZHANG G, SUN Y, SHENG H, et al. Effects of the inoculations using bacteria producing ACC deaminase on ethylene metabolism and growth of wheat grown under different soil water contents[J]. Plant Physiology and Biochemistry, 2018, 125(1): 178-184.
[5] KEIBER J. The formation of ACC and competition between polyamines and ethylene for SAM[J]. Annual Plant Reviews, 2012, 44(1): 53-81.
[6] DIAS L L C, RIBEIRO D M, CATARINA C S, et al. Ethylene and polyamine interactions in morphogenesis of Passiflora cincinnata: effects of ethylene biosynthesis and action modulators, as well as ethylene scavengers[J]. Plant Growth Regulation, 2010, 62(1):9-19.
[7] MOYSSET L, TRULL O, SANTOS M A, et al. Effect of end-of-day irradiations on polyamine accumulation in petal cultures of Araujia sericifera[J]. Physiologia Plantarum, 2002, 114(1): 135-141.
[8] 苏素香, 赵彩平, 曹丽军, 等. 两种不同耐贮性桃果实采后乙烯合成和果实软化相关基因表达的差异[J]. 农业生物技术学报, 2015, 23(4): 450-458.
[9] PALMA F, CARVAJAL F, JAMILENA M, et al. Contribution of polyamines and other related metabolites to the maintenance of zucchini fruit quality during cold storage[J]. Plant Physiology and Biochemistry, 2014, 82(3): 161-171.
[10] 马岳岳, 李永才, 胡培芳, 等. 采后多胺处理对杏果实黑斑病的控制及贮藏品质的影响[J]. 食品科学, 2018, 39(3): 289-294.
[11] JIANG J, JIANG L, LUO H B, et al. Establishment of a statistical model for browning of fresh-cut lotus root during storage[J]. Postharvest Biology and Technology, 2014, 92(3): 164-171.
[12] 汪开拓, 廖云霞, 韩林. 羟丙基甲基纤维素涂膜处理对采后杨梅果实品质、生理及花色苷合成的影响[J]. 食品与发酵工业, 2015, 41(1): 244-251.
[13] SLINKARD K, SINGLETON V L. Total phenol analysis: Automation and comparison with manual methods[J]. American Journal of Enology and Viticulture, 1977, 28(1): 49-55.
[14] WANG K, JIN P, SHANG H, et al. Effect of methyl jasmonate in combination with ethanol treatment on postharvest decay and antioxidant capacity in Chinese bayberries[J]. Journal of Agricultural and Food Chemistry, 2010, 58(17):9 597-9 604.
[15] BREGOLI A M, SCARAMAGLI S, COSTA G, et al. Peach (Prunus persica) fruit ripening: Aminoethoxyvinylglycine (AVG) and exogenous polyamines affect ethylene emission and flesh firmness[J]. Physiologia Plantarum, 2002, 114(3): 472-481.
[16] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[17] LESHEM Y, SERI L, LEVINE A. Induction of phosphatidylinositol 3-kinase-mediated endocytosis by salt stress leads to intracellular production of reactive oxygen species and salt tolerance[J]. Plant Journal, 2007, 51(2): 185-197.
[18] MISHRA P K, KHAN S, BHARGAVA A, et al. Regulation of isocyanate-induced apoptosis, oxidative stress, and inflammation in cultured human neutrophils: isocyanate-induced neutrophils apoptosis[J]. Cell Biology and Toxicology, 2010, 26(3): 279-291.
[19] BISBIS B, KEVERS C, DOMMES J, et al. Interactions between polyamine and ethylene metabolisms in a hormone autonomous sugarbeet callus[J]. Journal of Plant Physiology, 2000, 157(1): 24-30.
[20] CHAMPA HARINDRA W A, GILL M I S, MAHAJAN B V C, et al. Postharvest treatment of polyamines maintains quality and extends shelf life of table grapes (Vitis vinifera L.) cv. Flame Seedless[J]. Postharvest Biology and Technology, 2014, 91(1): 57-63.
[21] 胡培芳, 李永才, 马岳岳, 等. 采后亚精胺处理对‘早酥梨’黑斑病的控制及贮藏品质的影响[J]. 果树学报, 2018, 35(2): 212-221.
[22] JHALEGAR M J, SHARMA R R, PAL R K, et al. Effect of postharvest treatments with polyamines on physiological and biochemical attributes of kiwifruit (Actinidia deliciosa) cv. Allison[J]. Fruits, 2012, 67(1): 13-22.
[23] 郭双, 卢克欢, 张翠平, 等. 外源亚精胺对盐胁迫下颠茄生理特性和生物碱积累的影响[J]. 西南大学学报(自然科学版), 2018, 40(1): 43-49.
[24] GE Y, HU K D, WANG S S, et al. Hydrogen sulfide alleviates postharvest ripening and senescence of banana by antagonizing the effect of ethylene[J]. Plos One, 2018, 13(1): e019 135.
[25] CHIDLEY H G, DESHPANDE A B, OAK P S, et al. Effect of postharvest ethylene treatment on sugar content, glycosidase activity and its gene expression in mango fruit: Effect of postharvest ethylene treatment on mango ripening[J]. Journal of the Science of Food and Agriculture, 2017, 97(5):1 624-1 633.
[26] LIU J, NADA K, PANG X, et al. Role of polyamines in peach fruit development and storage[J]. Tree Physiology, 2006, 26(6): 791-798.
[27] CHOUDHURY S R, ROY S, SENGUPTA D N. Characterization of transcriptional profiles of MA-ACS1 and MA-ACO1 genes in response to ethylene, auxin, wounding, cold and different photoperiods during ripening in banana fruit[J]. Journal of Plant Physiology, 2008, 165(18): 1 865-1 878.
[28] HU X, ZHANG Y, SHI Y, et al. Effect of exogenous spermidine on polyamine content and metabolism in tomato exposed to salinity-alkalinity mixed stress[J]. Plant Physiology and Biochemistry, 2012, 57(1): 200-209.
[29] 李斌, 郭世荣, 孙锦, 等. 外源亚精胺对盐胁迫下黄瓜幼苗游离态多胺含量和多胺合成酶基因表达的影响[J]. 植物科学学报, 2011, 29(4): 480-485.
[30] SUNIL S, SUNIL P, NARASHANS S, et al. Modulatory effects of exogenously applied polyamines on postharvest physiology, antioxidant system and shelf life of fruits: A review[J]. International Journal of Molecular Sciences, 2017, 18(8):1 789-1 806.