心脑血管疾病的发病率逐年增加,严重威胁人类的生命健康,已经成为导致全球人口死亡的首要原因[1-3]。纤维蛋白是由凝血酶和一系列凝血因子作用于可溶性纤维蛋白原形成的不溶性蛋白成分,它在血管内的聚集是引起上述血栓性疾病的主要原因之一[4-5]。
纤溶酶是一种蛋白水解酶,可以催化纤维蛋白水解,达到溶解血栓的目的[4]。含纤溶因子的功能性食物具有增加人体纤溶系统活性的功能[6]。有计划地食用含纤溶因子的功能食品,可使体内纤溶系统活性缓慢适量增强,逐渐恢复其正常生理状态,降低血栓倾向[7]。
食用菌广泛分布于世界各地,它的营养价值和药物特性被广泛使用[8]。食用菌产生的生物活性分子主要有多糖、葡聚糖、萜类化合物凝集素、他汀类等,具有免疫调节、抗氧化、抗肿瘤和其他药效[9-10]。对来自食用菌的纤维蛋白溶解酶的溶栓抗栓作用研究受到广泛关注。迄今为止,已报道从多种食用菌中提取获得纤溶酶,如蛹虫草(Cordyceps militaris) [11-13]、香菇(Lentinus edodes) [14]、冬虫夏草(Cordyceps sinensis)[15]、阿魏菇(Pleurotus ferulae)[16]、平菇(Pleurotus ostreatus)[17]等。
茶树菇是一种生长于亚热带地区的土生木腐菌,营养极其丰富,蛋白质质量分数高达19.55%,具备人体必需的8种氨基酸,并且有丰富的B族维生素和钾、钠、钙、镁、铁、锌等营养元素。研究表明,茶树菇具有抗氧化、提高免疫力和抗肿瘤等作用,极具开发潜力[18-19]。在前期的实验中发现,茶树菇子实体提取物表现出较强的溶解纤维蛋白的能力,但茶树菇来源的纤维蛋白溶解酶未见报道。本研究尝试从茶树菇子实体中提取、纯化纤溶酶,并且对其体外的溶栓活性和抗凝活性进行研究,为以茶树菇为功能性食品基料,用于开发预防具有血栓倾向的心脑血管疾病的功能食品奠定理论基础。
1 材料与方法
1.1 材料与试剂
茶树菇子实体,古田县天鲜农产品有限公司;Sephadex G-25凝胶填料、CM- Fast Flow离子交换色谱填料、Source 15PHE疏水填料、Mono S 5/50离子填料,美国GE公司;牛血清白蛋白、(NH4)2SO4(色谱纯)、NaCl(色谱纯)、SDS-PAGE电泳标准蛋白,上海生工生物工程公司;纤维蛋白原和凝血酶,上海经科生物有限公司;其他试剂均为市售分析纯试剂。
1.2 仪器与设备
BSA124S电子天平和PB-10酸度计,赛多利斯科学仪器(北京)有限公司;CR21G高速冷冻离心机,日立公司;TU1810紫外可见分光光度计,北京普析通用仪器有限责任公司;蛋白质纯化系统(prime)和AKTA Avant蛋白纯化系统,美国GE公司;粉碎机,山东金普分析仪器有限公司。
1.3 试验方法
1.3.1 蛋白质浓度和纤溶酶酶活力测定
采用Folin-酚法[20]测定蛋白质浓度,以牛血清白蛋白为标准蛋白,检测640 nm下的吸光值;纤溶酶活力的测定参考ASTRUP等[21]血纤维蛋白平板法,待测液体在37 ℃条件下反应6 h,测量溶圈直径,计算酶活力。
1.3.2 ACase的分离纯化
(1)粗酶液制备:茶树菇子实体晾干粉碎,取40 g子实体粉末以1∶10 (g∶mL)比例加入生理盐水,4 ℃下浸提6 h,4 ℃、10 000 r/min条件下离心15 min,取上清液置于4 ℃冰箱中备用。
(2)盐析曲线的制作:取18个5 mL的离心管,每管加入2 mL上述离心后的上清液,向管中加入(NH4)2SO4,调整(NH4)2SO4饱和度分别至0%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%和100%,将混匀溶解的盐析液置于4 ℃冰箱中盐析12 h,在4 ℃,10 000 r/min条件下离心得上清液和沉淀,沉淀用2 mL 0.02 mol/L的PBS缓冲溶液 (pH 6.0)溶解,分别测定不同(NH4)2SO4饱和度的上清液以及沉淀样品的纤溶酶酶活力和蛋白含量,绘制(NH4)2SO4盐析曲线。
(3)硫酸铵盐析:取离心后上清液加入硫酸铵0.516 g/mL,4 ℃盐析过夜,在4 ℃、10 000 r/min条件下离心15 min,弃去上清液,沉淀用50 mL 0.02 mol/L PBS (pH 6.0)缓冲液溶解,置于4 ℃冰箱中备用。
(4)Sephadex G-25凝胶色谱:将样品用Sephadex G-25凝胶色谱进行脱色和交换缓冲溶液,洗脱液为0.02 mol/L PBS (pH 6.0)缓冲液,收集活性组分。
(5)CM-Sepharose Fast Flow弱阳离子交换色谱:先用0.02 mol/L PBS(pH 6.0)缓冲液平衡,上样后用含0~0.8 mol/L NaCl的相同缓冲液进行线性梯度洗脱,收集活性组分。
(6)Source 15PHE疏水相互作用色谱:先用含(NH4)2SO4饱和度10%的0.02 mol/L PBS (pH 7.4)缓冲溶液平衡,上样后先用上述缓冲液洗脱,进一步用含(NH4)2SO4饱和度10%~0%的0.02 mol/L PBS (pH 7.4)缓冲溶液进行线性洗脱,收集活性组分。
(7)Mono S 5/50强阳离子交换色谱:将上一步收集的活性组分透析脱盐,用Mono S 5/50离子交换色谱进行最后一步分离,先用0.02 mol/L PBS (pH 5.5)缓溶液平衡,洗脱液为含0.02 mol/L PBS (pH 5.5)缓溶液。上样后用含0~0.8 mol/L NaCl的该缓冲液进行线性梯度洗脱,收集活性组分,检测纤溶酶纯度。
1.3.3 ACase的纯度和相对分子质量的测定
参考LIU等[12]的方法。采用Native-PAGE电泳,观察样品是否为单一条带判断样品纯度;参考张雯舒等[22]方法,采用SDS-PAGE电泳垂直板凝胶测定ACase的相对分子质量。
1.3.4 ACase的N-端序列测定
采用Edman降解法测定ACase的N-端序列,将色谱分离后的样品送到上海新生命有限公司测序。
1.3.5 ACase对人血纤维蛋白原的降解
参考LIU等[12]的方法。取10支0.5 mL离心管,分别加入23 μL 20 mg/mL人血纤维蛋白原和23 μL 0.112 mg/mL ACase,置于37 ℃保温,分别于1、3、5、10、20、30 min、1、1.5、2、3、4和6 h后各取1管,迅速向反应体系中加入46 μL样品缓冲液,再加入10 μL β-巯基乙醇,沸水浴5 min灭活终止反应后,进行电泳分析。
1.3.6 ACase体外抗凝血作用研究
参考LIU等[12]的方法。分别取500 μL ACase (110 U/mL)、生理盐水正常对照组和肝素钠抗凝剂 (100 U/mL)阳性对照组于灭菌的1.5 mL 离心管中,分别加入正常大鼠血1 mL,轻轻摇匀,37 ℃水浴计时,每隔5 s倾斜离心管1次,观察表层血液是否沿离心管移动,至凝固时停止计时,计为体外凝血时间。
2 结果与讨论
2.1 分离纯化
2.1.1 硫酸铵盐析
盐析是指向溶液中加入无机盐类(如(NH4)2SO4、NaCl等)改变蛋白质的溶解性,使其析出沉淀的过程。盐析作为蛋白质纯化过程中的粗提纯方式被广泛应用。此方法操作简便,条件温和,并且在盐析的过程中不会造成蛋白质的变性或失活。茶树菇纤溶酶盐析曲线结果如图1所示。

图1 纤溶酶盐析曲线图谱
Fig.1 Salting out curve of the fibrinolytic enzyme
随着(NH4)2SO4饱和度的逐渐增加,上清液中纤溶酶比活力逐渐降低,沉淀中纤溶酶比活力呈现先上升后下降的趋势。当(NH4)2SO4饱和度为80%时,溶液有明显的絮状沉淀分层,此时,沉淀中纤溶酶比活力达到最大,此条件下上清液中的酶活力几乎为0,有少量的蛋白存在,沉淀中的酶活力较粗酶液中没有较大损失,但蛋白含量明显减少,比活力有所提高。说明在此条件下,盐析可以有效地除去部分杂蛋白,同时使粗酶液浓缩,减小纯化体系,易于后续操作。
2.1.2 粗酶液脱色
粗酶液中存在一些色素物质,在酶的分离过程中色素会吸附到各种色谱填料上不易洗脱,污染填料从而降低填料的载量和使用寿命。因此,在进行酶的色谱分离之前要先除去多数的色素物质。本实验采用Sephadex G-25凝胶对盐析后的酶液进行脱色并将酶液中的(NH4)2SO4除去。Sephadex G-25分离盐析后纤溶酶样品中色素的洗脱曲线如图2所示。
如图2所示,蛋白峰和活性峰相对应,纤溶酶最先被洗脱下来,说明纤溶酶的分子质量大于5 000 kDa,Sephadex G-25的色素物质在洗脱结束的时候出现,实现了纤溶酶和色素物质的分离。同时,该步还能够有效地去除溶液中的高浓度(NH4)2SO4,为接下来的离子交换色谱的低盐上样条件做准备。虽然样品溶液被稀释,但考虑到CM-Sepharose Fast Flow离子交换层析具有浓缩的作用,该步的效果还是很理想的。此步骤只是对蛋白样品进行脱盐和脱色,不涉及到杂蛋白的去除。

图2 Sephadex G-25凝胶过滤色谱洗脱曲线
Fig.2 Elution curve of Sephadex G-25 gel filtration
chromatography
2.1.3 ACase的色谱纯化
考虑到待分离样品酶浓度较低,含有一定盐的特点,利用目的蛋白和杂蛋白之间等电点和疏水性的差异,顺次采用CM-Sepharose FF弱阳离子交换色谱、Source 15PHE疏水相互作用色谱和Mono S强阳离子交换色谱对样品进行分离纯化。
用CM-Sepharose Fast Flow弱阳离子交换色谱分离脱色后样品中纤溶酶的洗脱曲线如图3所示。
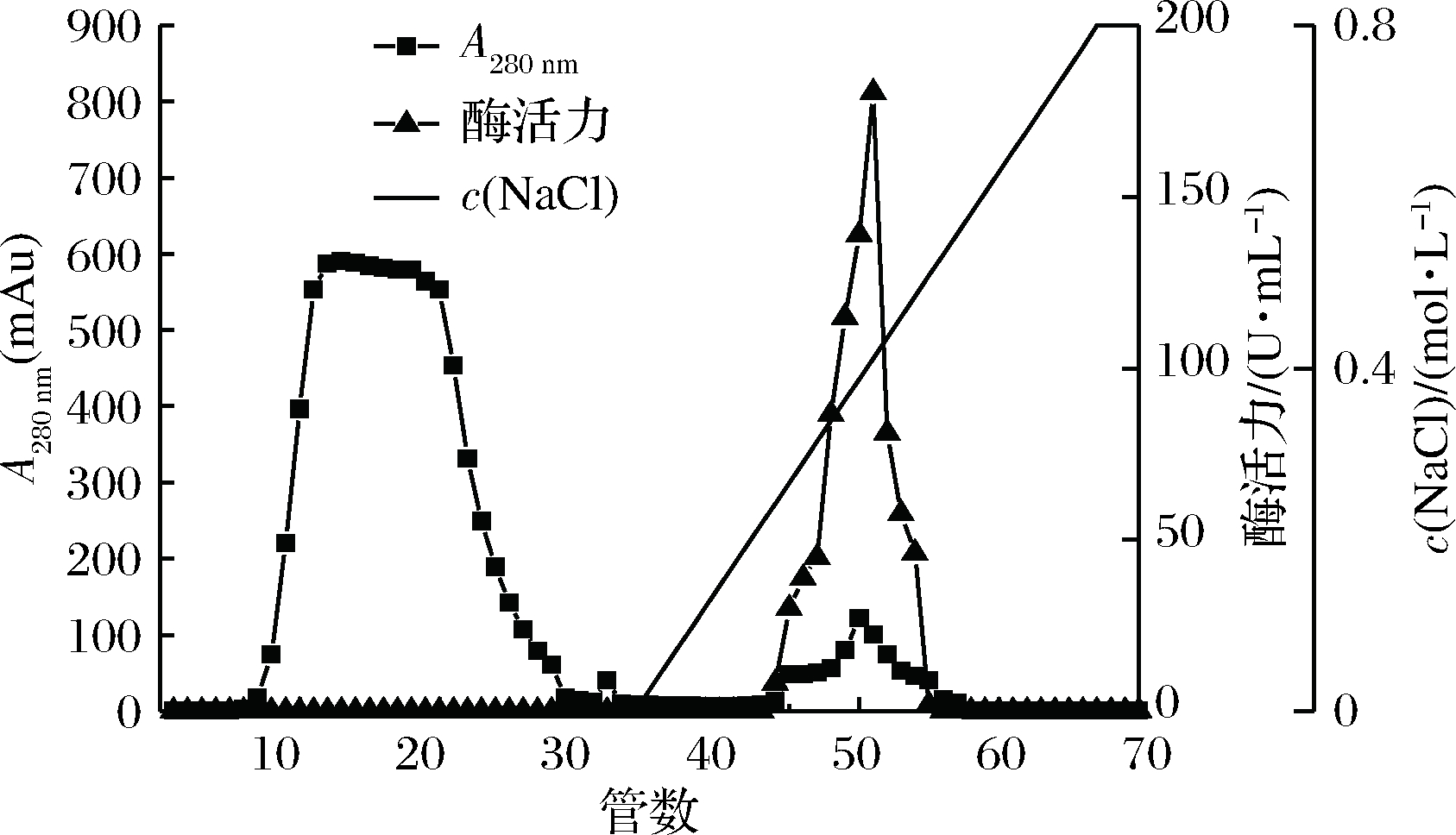
图3 CM-Sepharose Fast Flow弱阳离子交换色谱洗脱曲线
Fig.3 Elution curve of CM-Sepharose Fast Flow IEC
通过离子交换色谱分离该纤溶酶的预试验发现当样品和缓冲液pH值为6.5时,纤溶酶的带正电荷量较少,酶不能与CM-Sepharose FF填料结合,继续降低样品和缓冲液pH至6.3和6.0,发现pH值为6.0时,纤溶酶可以与填料结合。由图3可以看出,纤溶酶在离子强度为0~0.8 mol/L线性洗脱阶段被洗脱下来,蛋白峰和酶活性峰相对应,分离效果较好。试验结果还表明,该纤溶酶在pH值为6.0的条件下带正电荷,其等电点pI一定大于6.0。
将经离子交换色谱分离后收集的活性组分透析交换缓冲溶液,透析液为此步骤的起始缓冲溶液,然后进行Source 15PHE疏水层析,结果如图4所示。

图4 Source 15PHE疏水相互作用色谱洗脱曲线
Fig.4 Elution curve of Source 15PHE HIC
由图4可以看出,在此条件下,纤溶酶与疏水性填料结合较好,未与填料结合的疏水性较弱的杂蛋白在上样后的恒洗阶段被洗脱下来,纤溶酶在(NH4)2SO4饱和度降低的线性洗脱结束后被分离出来,表明纤溶酶的疏水性较强,与填料结合的较牢固,蛋白峰与酶活性峰对应良好,分离效果较为理想。
将Source 15PHE疏水层析分离后收集的活性组分透析脱盐、冻干后,进行了Mono S强阳离子交换色谱,用此步骤的起始缓冲液溶解后上样,分离结果如图5所示。
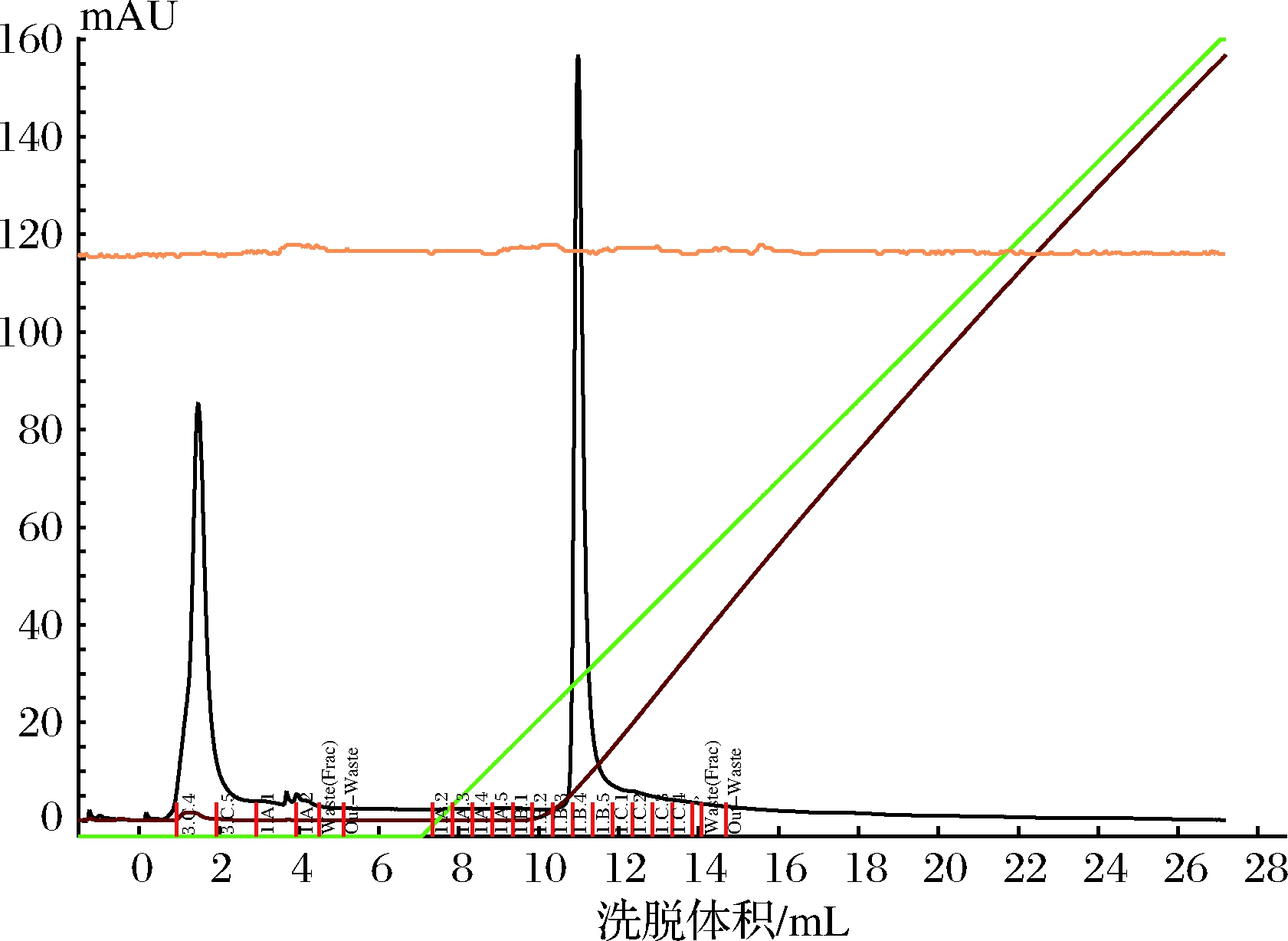
图5 Mono S离子交换色谱洗脱曲线
Fig.5 Elution curve of Mono S IEC
上样后,未与填料结合的杂蛋白直接被洗脱下来,随着盐离子浓度增加,在线性洗脱的过程中出现了一个峰形对称性较好的蛋白峰,经检测该峰具有纤溶活性,且与蛋白峰完全对应,说明此纤溶酶的纯化已经达到较好的效果,酶得到更加精细的纯化。
综上所述,通过盐析、Sephadex G-25凝胶色谱、CM-Sepharose FF离子交换色谱、Source 15PHE疏水色谱和Mono S离子交换色谱对茶树菇子实体中的纤溶酶进行分离纯化,获得了较好的效果。ACase的活力回收率和纯化情况统计如表1所示。
表1 茶树菇纤溶酶纯化统计
Table 1 Purification steps of the fibrinolytic enzyme from
Agrocybe aegerita

纯化步骤总体积/mL总蛋白/mg总活力/U回收率/%比活力/(U·mg-1)纯化倍数粗酶液1701 988.1513 945.101007.01180%硫酸铵盐析50664.4511 909.0085.3917.922.56G-25凝胶色谱124199.529 555.4468.5247.896.83CM- Sepharose FF15032.856321.0045.33192.4227.45Source 15PHE154.234 176.8729.95987.44140.86Mono S41.021 765.6712.661 731.05246.94
注:表中数据为40 g子实体粉末提取
从表1可知,经多步提纯后目标纤溶比活力由7.01 U/mg提高到1 731.05 U/mg,活力回收率为12.66%,总纯化倍数为246.94倍,得到了较好的分离。
2.2 理化分析
2.2.1 ACase的纯度分析
用Native-PAGE检验经纯化后ACase的纯度情况,结果如图6所示。ACase在 Native-PAGE电泳中呈单一条带,表明样品已经达到了电泳纯,将胶条放置在血纤维蛋白平板上,在37 ℃保温孵育,发现在血纤维蛋白平板中对应的凝胶条带处出现透明带,说明该条带具有纤溶活性,为目标蛋白。

1-Native-PAGE电泳;2-血纤维蛋白平板印迹活性
图6 Native-PAGE电泳图和血纤维蛋白平板印迹活性
Fig.6 Native-PAGE and the fibrinolytic zymogram on
fibrin plate of the ACase
2.2.2 ACase的相对分子质量确定
ACase的SDS-PAGE电泳结果如图7所示。由图7可以看出,ACase在变性电泳中显示出2条带,由SDS-PAGE电泳原理可知,在样品和凝胶中加入SDS和还原剂后,分子间和分子内的氢键断裂,破坏蛋白质分子的二级和三级结构,蛋白质分子被解聚、组成它们的多肽链[22]。在Native-PAGE电泳实验中已经测定到样品为单一组分,这些试验结果表明,ACase是由2个亚基组成。凝胶成像系统的Labworks软件分析出该2个亚基相对分子质量约为31.4 kDa和21.2 kDa。
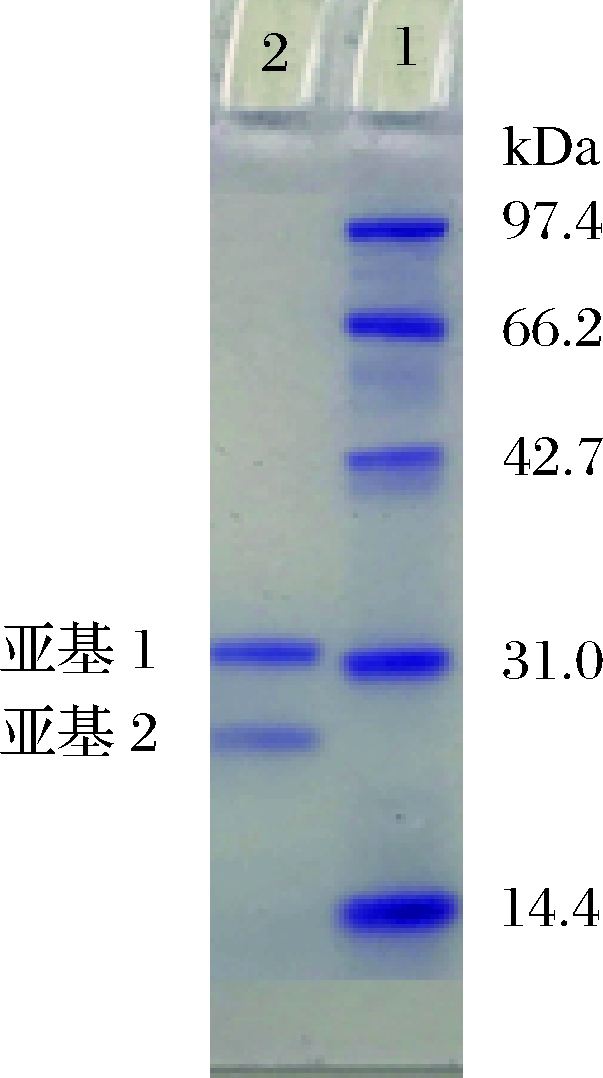
泳道1-标准蛋白Maeker;泳道2-ACase
图7 ACase的SDS-PAGE电泳图谱
Fig.7 SDS-PAGE of the ACase
目前已报道的纤溶酶分子质量分布范围较广,已报道纤溶酶的大多数为单亚基蛋白,鲜有二聚体蛋白。仅有DENG等[23]从脉孢霉发酵产物中提取的纤溶酶为二聚体蛋白,分子质量分别为30 kDa和17.5 kDa。臧婉婷等[15]从冬虫夏草固态培养菌丝中提取的纤溶酶OSP-1由2个亚基组成,相对分子质量分别为27.60 kDa和23.83 kDa。
2.2.3 ACase的N-端序列分析
经过Edman法对2个亚基的N-端12个氨基酸进行测定,亚基1(31.4 kDa)的序列为AIVTQTNAPWGL,亚基2(21.2 kDa)的序列为SNADGNGHGTHV。通过NCBI数据库比对,结果如表2所示,发现该纤溶酶为一种新型纤溶酶。
表2 茶树菇纤溶酶N-端序列与NCBI已知酶的对比情况
Table 2 Comparison of N-terminal sequence of fibrinolytic
enzyme from Agrocybe aegerita
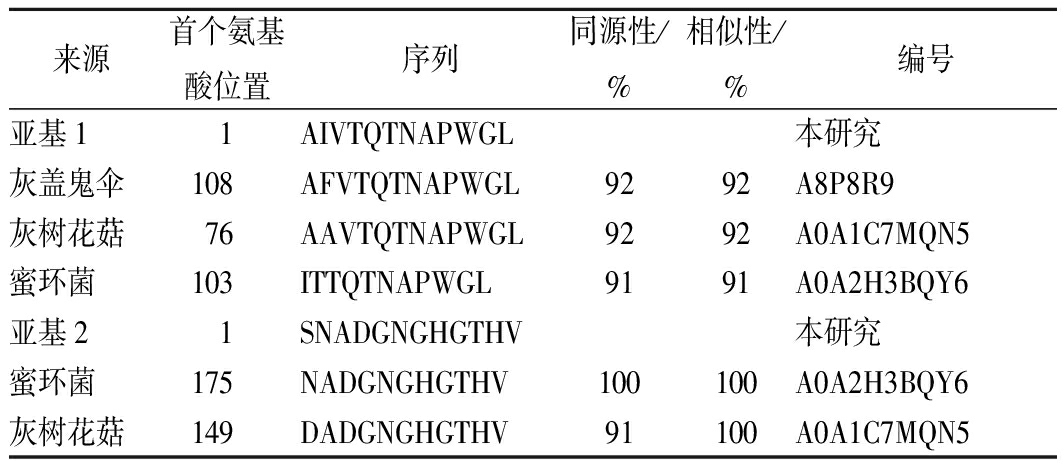
来源首个氨基酸位置序列同源性/%相似性/%编号亚基11AIVTQTNAPWGL本研究灰盖鬼伞108AFVTQTNAPWGL9292A8P8R9灰树花菇76AAVTQTNAPWGL9292A0A1C7MQN5蜜环菌103ITTQTNAPWGL9191A0A2H3BQY6亚基21SNADGNGHGTHV本研究蜜环菌175NADGNGHGTHV100100A0A2H3BQY6灰树花菇149DADGNGHGTHV91100A0A1C7MQN5
2.3 溶栓抗凝性分析
2.3.1 Acase对人血纤维蛋白原的降解作用
ACase对人血纤维蛋白原的降解情况如图8所示。纤维蛋白原由α、β和γ三个亚基组成,ACase可以降解人血纤维蛋白原,其降解各亚基的次序为α的降解速率大于β和γ亚基。在反应1 min后茶树菇纤溶酶将人血纤维蛋白原的α链完全降解,10 min后人血纤维蛋白原的β链降解完全,γ链在1.5 h后完全降解。这一降解顺序与人纤溶酶降解纤维蛋白原各亚基的情况基本一致。
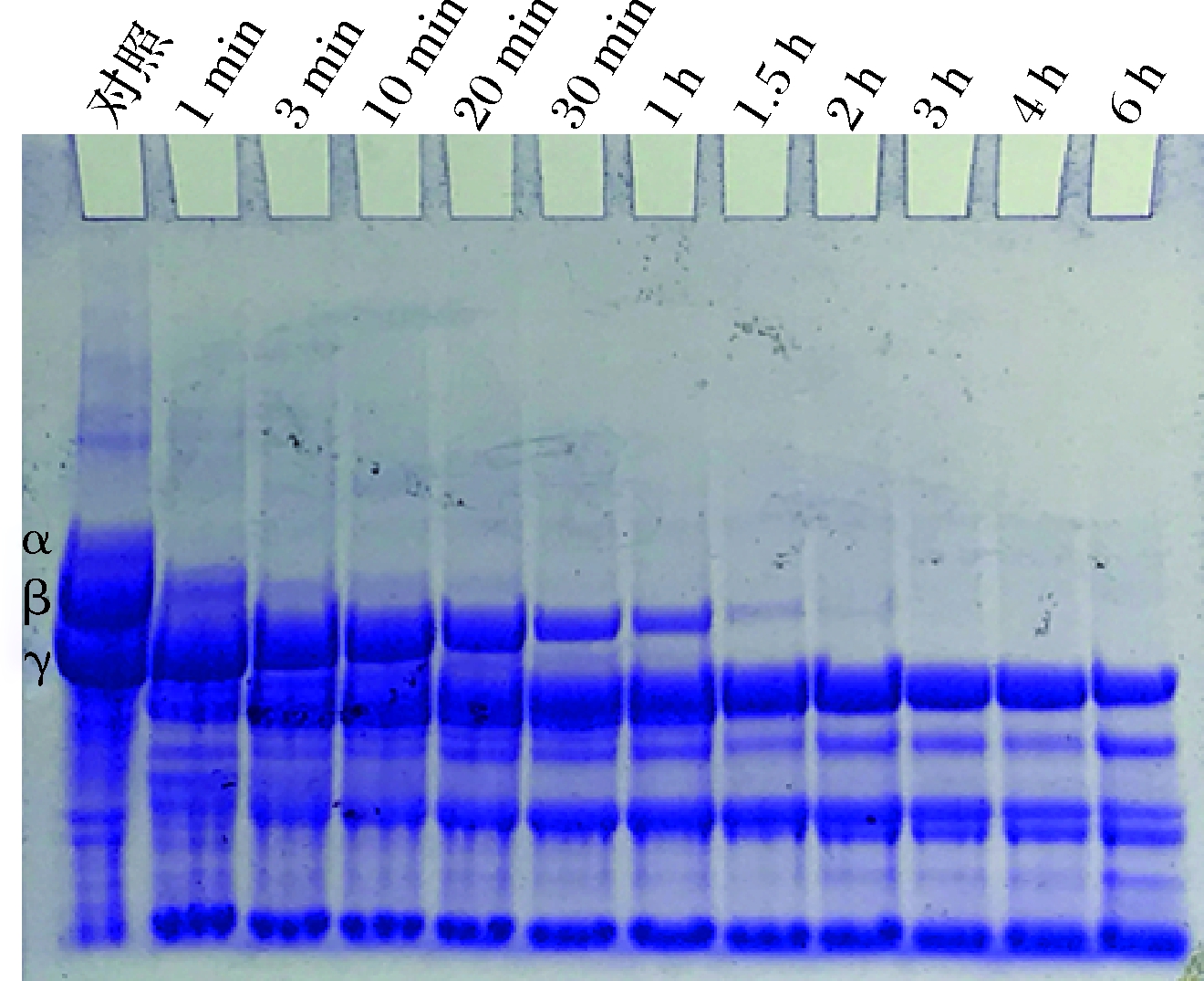
图8 ACase对人血纤维蛋白原的降解情况
Fig.8 Process of human fibrinogen degradation by the ACase
已报道的外源纤溶酶中,只有一部分可以降解纤维蛋白原的3个亚基,来源于银耳和糙皮侧耳的纤溶酶被发现可以降解纤维蛋白原的α和β链,但不能降解γ链[24-25];来源于猴头菌的纤溶酶[26]只能降解α和γ链,而不能降解β链;但来源于蛹虫草菌[27]的纤溶酶能够先降解纤维蛋白原的α链,紧随其后的是γ链,最后是β链。本研究中的ACase与LIU等[12]纯化的蛹虫草纤溶酶相似,可水解纤维蛋白原的3个亚基,其降解的顺序为α、β和γ链。
2.3.2 ACase体外抗凝血作用
将ACase与血液混合后置于37 ℃水浴保温,记录血液凝固时间。加入血液后,生理盐水对照组509 s后全部凝固,肝素钠阳性对照组和ACase组在4 h内均未凝固;24 h后,肝素钠阳性对照组出现了含量不等的部分血块,而ACase组仍未出现血凝块,且血液流动性较好,抗凝效果非常显著,结果表明,该酶具有明显的抗凝血作用,其抗凝血活性明显高于肝素。
3 结论
本研究从茶树菇子实体中分离纯化得到一种纤溶酶ACase,经N-端序列测定比对发现,该酶为一种新型纤溶酶。SDS-PAGE和Native-PAGE电泳分析显示,该纤溶酶含有2个亚基,分子质量分别为31.4 kDa和21.2 kDa。体外实验显示,ACase可顺次降解人血纤维蛋白原α、β和γ链,并且具有明显的抗凝血作用。因此,该茶树菇可以作为功能性食品基料用于开发降低血栓倾向的功能食品。
[1] 《中国血栓性疾病防治指南》专家委员会.中国血栓性疾病防治指南[J].中华医学杂志,2018,98(36):2 861-2 888.
[2] WHO.全球非传染性疾病现状报告[J/OL].2017. https://www.who.int/zh/news-room/fact-sheets/detail/cardiovascular-diseases.
[3] 胡盛寿,高润霖,刘力生,等.《中国心血管病报告2018》概要[J].中国循环杂志,2019,34(3):209-220.
[4] 王鸿利,王学锋.血栓病临床新技术[M].北京:人民军医出版社,2003.
[5] PENG Y, YANG X, ZHANG Y. Microbial fibrinolytic enzymes: an overview of source, production, properties, and thrombolytic activity in vivo[J]. Applied Microbiology and Biotechnology, 2005, 69(2):126-132.
[6] 李冠龙,郑喜群,刘晓兰,等.蛹虫草玉米肽功能性饮料的研制及其抗氧化活性研究[J].食品与发酵工业,2019,45(14):163-169.
[7] MAN L L, XIANG D J, ZHANG C L. Strain screening from traditional fermented soybean foods and induction of nattokinase production in Bacillus subtilis MX-6[J]. Probiotics and Antimicrobial Proteins, 2018, 11(1):283-294.
[8] 赵睿秋,马高兴,杨文建,等.6种食用菌子实体水提物对肠道菌群的影响[J].食品科学,2017,38(5):116-121.
[9] XU JT. Chinese Medicinal Mycology[M]. Beijing: Combined Press of Beijing Medical University and Peking Union Medical College, 1997.
[10] 陈子涵,刘金娟.六种食用菌体外抗氧化及抗细胞增殖活性研究[J].生物技术通报,2019,35(11):104-108.
[11] CHOI D B, CHA W S, PARK N, et al. Purification and characterization of a novel fibrinolytic enzyme from fruiting bodies of Korean Cordyceps militaris[J]. Bioresour Technology, 2011, 102(3):3 279-3 285.
[12] LIU XL, KOPPARAPU N, SHI X, et al. Purification and biochemical characterization of a novel fibrinolytic enzyme from culture supernatant of Cordyceps militaris[J]. Journal of Agricultural & Food Chemistry, 2015, 63(8):2 215-2 224.
[13] LIU XL, KOPPARAPU N, LI Y, et al. Biochemical characterization of a novel fibrinolytic enzyme from Cordyceps militaris[J]. International Journal of Biological Macromolecules, 2016, 94(Pt B):793-801.
[14] CHOI J H, KIM K J, KIM S. Purification and antithrombotic potential of a fibrinolytic enzyme from shiitake culinary-medicinal mushroom, Lentinus edodes GNA01 (Agaricomycetes)[J]. International Journal of Medicinal Mushrooms, 2018, 20(1):47-59.
[15] 臧琬婷,梅余霞,梁运祥.冬虫夏草固态培养菌丝中纤溶酶的纯化和酶学性质[J].微生物学通报, 2020,47(2):562-570.
[16] CHOI J H, KIM D W, KiIM S, et al. Purification and partial characterization of a fibrinolytic enzyme from the fruiting body of the medicinal and edible mushroom Pleurotus ferulae[J]. Prep Biochem Biotechnol, 2016, 47(6):539-546.
[17] LIU XL, ZHENG XQ, QIAN PZ, et al. Purification and characterization of a novel fibrinolytic enzyme from culture supernatant of Pleurotus ostreatus[J]. Journal of Microbiology & Biotechnology, 2014, 24(2):245-253.
[18] ZHAO H, LI J, ZHANG J, et al. Purification, in vitro, antioxidant and, in vivo, anti-aging activities of exopolysaccharides by Agrocybe cylindracea[J]. International Journal of Biological Macromolecules, 2017, 102:351-357.
[19] MUZGONJA N, MILOVANOVIC I, VUKOJEVIC J, et al. Antioxidant and antifungal potential of Pleurotus ostreatus and Agrocybe cylindracea basidiocarps and mycelia[J]. Current Pharmaceutical Biotechnology, 2015, 16(2):179-186.
[20] LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the flin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1):265-275.
[21] ASTRUP T, STEN M. The fibrin plate method for estimating fibrinolytic activity[J]. Archives of Biochemistry and Biophysics, 1952, 40(2):346-351.
[22] 张雯舒,刘晓兰,郑喜群,等. 蛹虫草无性型深层培养液中纤溶酶的分离纯化和酶学性质研究[J].微生物学通报,2012,39(12):1 787-1 795.
[23] DENG Y, LIU X, KATROLIA P, et al. A dual-function chymotrypsin-like serine protease with plasminogen activation and fibrinolytic activities from the GRAS fungus, Neurospora sitophila[J]. International Journal of Biological Macromolecules, 2018, 109:1 338-1 343.
[24] CHOI J H, KIM D W, PARK S E. Purification and partial characterization of TFase, a fibrinolytic enzyme from the fruiting bodies of the medicinal and edible mushroom, Tremella fuciformis[J]. Applied Biochemistry and Microbiology, 2015, 51(6):712-719.
[25] CHA W S, PARK S S, KIM S J, et al. Biochemical and enzymatic properties of a fibrinolytic enzyme from Pleurotus eryngii cultivated under solid-state conditions using corn cob[J]. Bioresource Technology, 2010, 101(16):6 475-6 481.
[26] CHOI B S, SAPKOTA K, JUN-HUI C. Herinase: a novel bi-functional fibrinolytic protease from the monkey head mushroom, Hericium erinaceum[J]. Applied Biochemistry and Biotechnology, 2013, 170(3):609-622.
[27] KIM J S, SAPKOTA K, PARK S E, et al. A fibrinolytic enzyme from the medicinal mushroom Cordyceps militaris[J]. The Journal of Microbiology, 2007, 44(6):622-631.