酱油发酵后经压榨或抽油产生的剩余残渣即为酱油渣[1]。据中国调味品协会统计,2017年我国酱油产量接近860万t[2],按照每生产1 t酱油产生0.67 t酱油渣计算,酱油渣年产量可达580万t,而酱油渣原料中富含蛋白质、纤维素、脂肪等营养成分,容易发生腐败变质,处理不当还会污染环境[3]。目前酱油渣再利用的主要途径是饲料或饲料添加物,由于其中盐分和油脂含量较高,在一定程度上限制了酱油渣饲料的应用[4]。
酱油生产过程中大豆中的蛋白质利用率在60%左右[5],部分蛋白质还残留在酱油渣中。经测定,酱油渣中蛋白质含量约为26%(干基)。近年来,已有学者对酱油渣中蛋白质的性质[6]、多肽的提取工艺[7-8]及提取物的抗氧化活性[9-11]进行了研究,但对酱油渣中蛋白质进行酶解,制备免疫活性肽[12-13]的研究鲜有报道。本研究采用条件温和、安全系数高、可控性强、生产可规模化等优点的酶解法[14]制备免疫活性肽[15-16],使用单因素和响应面优化试验探究碱性蛋白酶酶解酱油渣蛋白制备免疫活性肽的最优工艺条件,以期为充分利用酱油渣资源,实现废物再利用,开发绿色、安全、高效的食源性免疫制剂提供参考。
1 材料与方法
1.1 材料与仪器
酱油渣,湖南加加酱油股份有限公司;RAW264.7小鼠巨噬细胞,赢润生物技术有限公司;石油醚,国药集团化学试剂有限公司;福林酚,合肥博美生物科技责任有限公司;L-酪氨酸,上海哈灵生物科技有限公司;碱性蛋白酶(27.6×104 U/g),诺维信公司;D201C大孔吸附树脂,江苏苏青有限公司;96孔培养板,康宁公司corning公司;JJ-T电动搅拌器,江苏国胜实验仪器有限公司;TDL-5-A离心机,上海安亭科学仪器有限公司;EV 311旋转蒸发器,河南予华仪器有限责任公司;FD-1真空冷冻干燥机,北京博医康实验仪器有限公司;HHCP-01二氧化碳细胞培养箱,上海博讯医疗设备厂;MLS-3 750灭菌锅,日本三洋有限公司;DNM-9 602酶标分析仪,北京普朗新技术有限公司。
1.2 试验方法
1.2.1 酱油渣的预处理
将酱油渣原料在60 ℃烘箱中烘干,粉碎后过60目筛,石油醚脱脂,干燥后备用。
1.2.2 酱油渣蛋白的提取制备
1 kg脱脂酱油渣溶于10 L蒸馏水中,用2 mol/L NaOH调节溶液pH至10→室温搅拌2 h→离心(3 500 r/min,30 min)→取上清液→用2 mol/L HCl滴定至pH 4.0→离心(3 500 r/min,10 min)→水洗3次(3 500 r/min,10 min)→取沉淀→冷冻干燥备用[7]
1.2.3 酱油渣蛋白酶解物的制备
酱油渣蛋白悬浮液→50 ℃恒温搅拌30 min→调至酶最适温度→调至酶最适pH→加酶酶解→灭酶活力(15 min,90 ℃)→离心取上清液→大孔吸附树脂脱盐→真空浓缩→冷冻干燥[7]
1.2.4 酶解物对脂多糖(lipopolysaccharide, LPS)炎症模型细胞内NO释放量影响的测定
当培养皿中的小鼠巨噬细胞生长到对数期时,弃掉培养皿中的细胞培养基上清液,用1 mL移液枪分2次吸取2 mL培养基将培养皿中贴壁的细胞轻轻吹下,12 000 r/min、4 ℃离心收集细胞,在96孔培养板中接种3×104个/孔的细胞,每孔200 μL细胞液,在37 ℃、体积分数为5% CO2培养箱中培养过夜,待细胞贴壁后,以6复孔为一组,分为阴性对照组、LPS炎症模型组、阳性对照组和酱油渣蛋白酶解物预处理组,参考文献[17],具体如下:
(1)阴性对照组:加入含体积分数10%的胎牛血清的DMEM培养基;
(2)LPS炎症模型组:加入含体积分数10%胎牛血清的DMEM培养基,培养12 h,再加入用DMEM培养基稀释的LPS溶液20 μL,培养24 h;
(3)阳性对照组:加入含体积分数10%胎牛血清的DMEM培养基,培养12 h,再加入用无菌水稀释的免疫球蛋白(IgG)20 μL,培养24 h;
(4)酱油渣蛋白酶解物样品预处理组:加入无菌水溶解的样品溶液,使样品的终质量浓度为6.25 μg/mL,培养12 h,加入用DMEM培养基稀释的LPS溶液,培养24 h。
收集小鼠巨噬细胞培养基上清液,在12 000 r/min、4 ℃低温离心5 min以除去细胞杂质。根据格里斯(GRIESS)法测定上清液中NO含量。其中NO抑制率如公式(1)所示:
NO抑制率![]()
(1)
式中:C1,LPS刺激产生NO浓度;C2,样品预处理后产生的NO浓度。
1.2.5 酱油渣蛋白酶解工艺的单因素试验
1.2.5.1 底物浓度对小鼠巨噬细胞内NO释放量的影响
固定反应条件酶解时间3 h、加酶量6 000 U/g、温度55 ℃、pH 8.0,设定底物质量分数为1.25%、2.5%、5%、7.5%、10%,以脂多糖炎症模型中小鼠巨噬细胞内NO的释放量为考察指标,考察不同底物浓度酶解所得酶解物对RAW264.7细胞内NO释放量的影响。
1.2.5.2 pH对小鼠巨噬细胞内NO释放量的影响
固定反应条件:酶解时间3 h、加酶量6 000 U/g、温度55 ℃、底物质量分数5%,设定pH为7.0、7.5、8.0、8.5、9.0,以脂多糖炎症模型中小鼠巨噬细胞内NO的释放量为考察指标,考察不同pH下酶解所得酶解物对RAW264.7细胞内NO释放量的影响。
1.2.5.3 酶解温度对小鼠巨噬细胞内NO释放量的影响
固定反应条件:酶解时间3 h、加酶量6 000 U/g、底物质量分数5%、pH 8.0,设定酶解温度为45、50、55、60、65 ℃,以脂多糖炎症模型中小鼠巨噬细胞内NO的释放量为考察指标,考察不同温度下酶解所得酶解物对RAW264.7细胞内NO释放量的影响。
1.2.5.4 酶解时间对小鼠巨噬细胞内NO释放量的影响
固定反应条件:加酶量6 000 U/g、温度55 ℃、pH 8.0、底物质量分数5%,设定酶解时间为1、2、3、4、5 h,以脂多糖炎症模型中小鼠巨噬细胞内NO的释放量为考察指标,考察不同时间下酶解所得酶解物对RAW264.7细胞内NO释放量的影响。
1.2.5.5 加酶量对小鼠巨噬细胞内NO释放量的影响
固定反应条件:酶解时间3 h、温度55 ℃、pH 8.0、底物质量分数5%,设定加酶量为5 000、5 500、6 000、6 500、7 000 U/g,以脂多糖炎症模型中小鼠巨噬细胞内NO的释放量为考察指标,考察不同加酶量时酶解所得酶解物对RAW264.7细胞内NO释放量的影响。
1.2.6 响应面试验
根据单因素试验结果,确定出碱性蛋白酶酶解酱油渣蛋白所得酶解物对LPS炎症模型细胞内NO释放量抑制作用的酶解工艺中有显著影响的3个因素:酶解温度、酶解时间及加酶量。运用Design Expert 10.0软件的Box-Behnken试验设计,对以上3个因素做进一步分析,确定各因素的最佳取值,各因素及水平取值如表1所示。
表1 响应面试验因素水平表
Table 1 Response surface test factors and levels
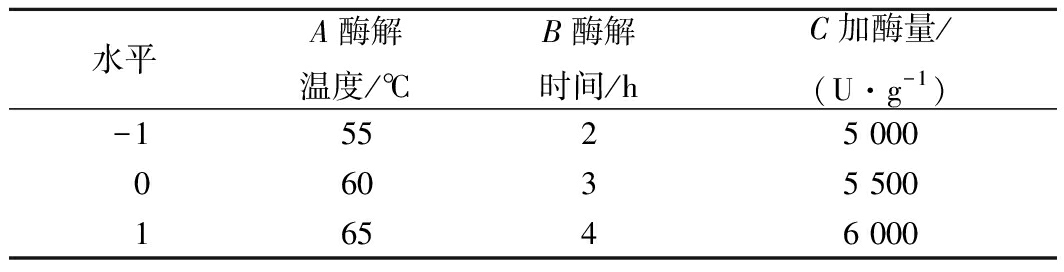
水平A酶解温度/℃B酶解时间/hC加酶量/(U·g-1)-15525 00006035 50016546 000
2 结果与分析
2.1 酶解工艺条件的优化
2.1.1 底物浓度对小鼠巨噬细胞内NO释放量的影响
由图1可知,当底物质量分数在1.25%~5%范围内时,小鼠巨噬细胞内NO的浓度随着底物浓度的升高而降低;底物质量分数在5%以上时,细胞内NO浓度增加。在酶解体系里底物浓度未饱和前,酶解程度与底物浓度存在正相关性[18]。而继续增加底物浓度,体系中的黏稠度上升,蛋白质分子的扩散受到阻碍,导致酶与蛋白质的结合效率下降,进而造成免疫活性肽的释放速率降低。当底物质量分数为5%时,细胞内NO的浓度最小且极显著低于阳性对照组IgG,因此本研究选择底物质量分数为5%。
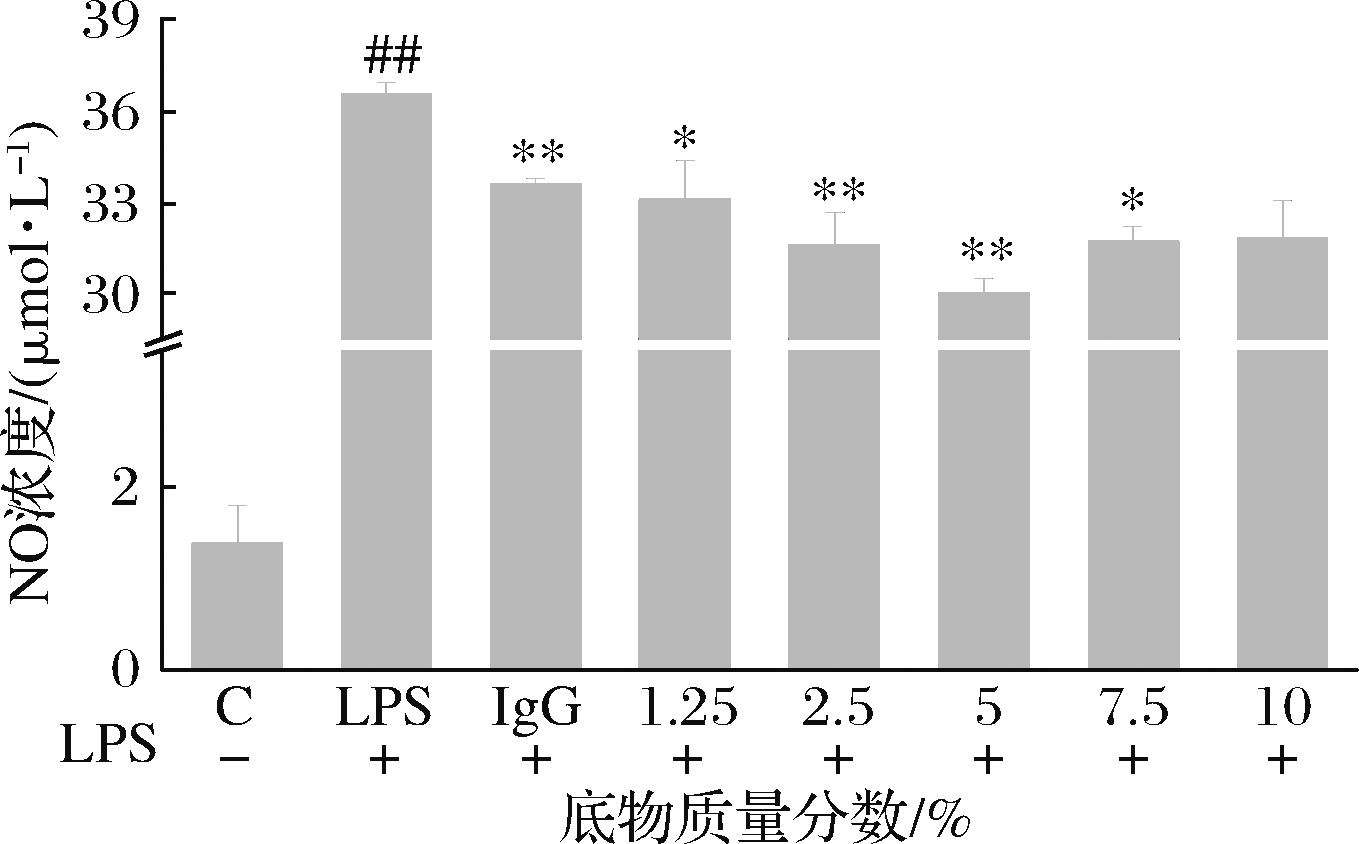
图1 底物质量分数对RAW264.7细胞内NO浓度的影响
Fig.1 Effect of substrate concentration on NO concentration
in RAW264.7 cells
注:##:与阴性对照组比有极显著差异(P<0.01);*:与LPS组比
有显著差异(P<0.05);**:与LPS组比有极显著差异(P<
0.01);样品质量浓度均为6.25 μg/mL(下同)
2.1.2 pH对小鼠巨噬细胞内NO释放量的影响
由图2可知,当pH值为7.5时,小鼠巨噬细胞内NO的浓度最低;pH>7.5时,细胞内NO的浓度升高。这可能是因为较高的pH环境对蛋白质的空间结构产生影响。由于pH的不断升高,高净电荷引起强烈的分子静电排斥作用,使酱油渣蛋白质分子膨胀和伸展,埋藏在酱油渣蛋白质分子内部的部分羧基、酚羟基和巯基产生离子化,暴露在水环境中的离子基团导致多肽链分散,蛋白酶活性部位和酱油渣蛋白的解离受到抑制,进而影响了酱油渣蛋白中免疫活性肽的释放[14]。因此,选择在pH 7.5的环境下对酱油渣蛋白进行酶解。
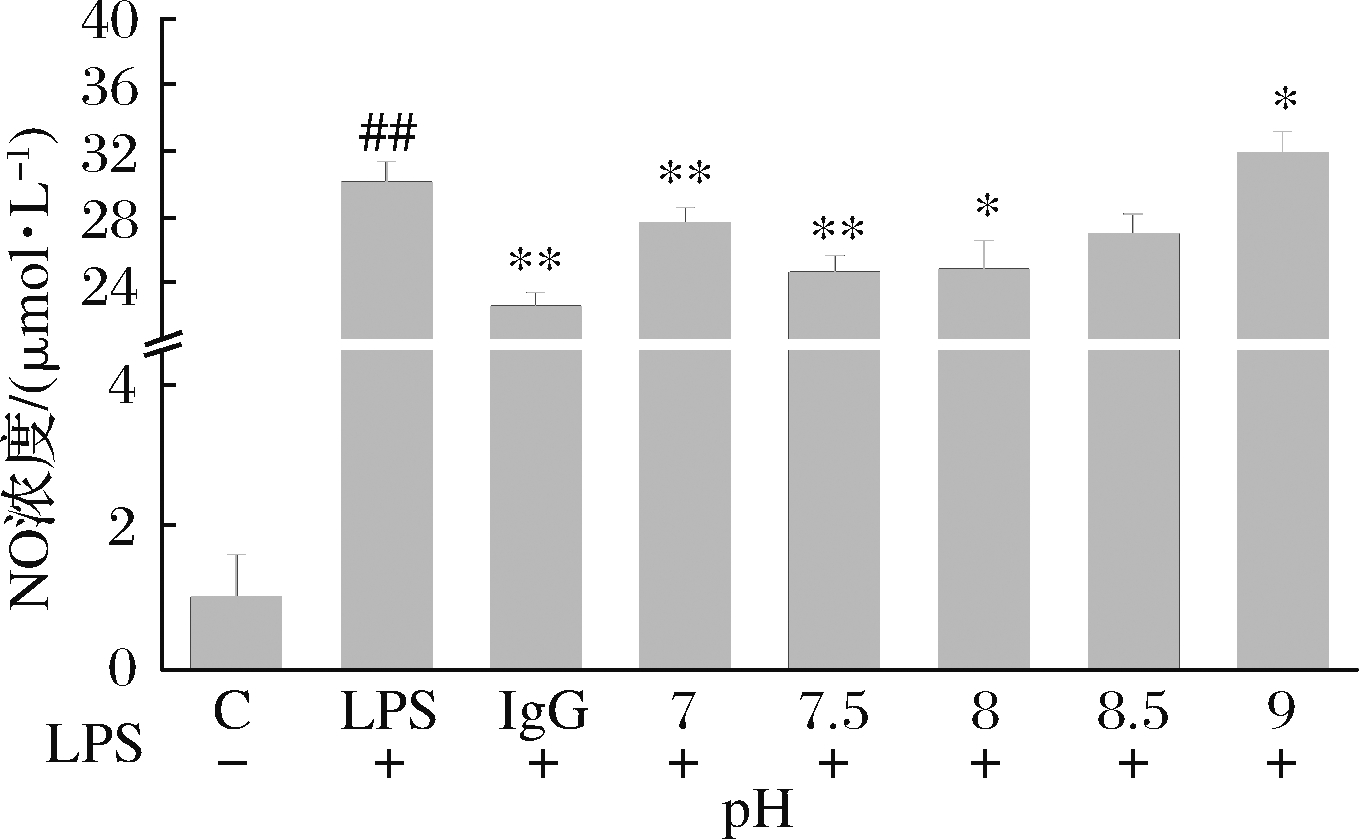
图2 pH对RAW264.7细胞内NO浓度的影响
Fig.2 Effect of pH on NO concentration in RAW264.7 cells
2.1.3 酶解温度对小鼠巨噬细胞内NO释放量的影响
由图3可知,酶解温度在45~60 ℃范围内,小鼠巨噬细胞内NO浓度随着温度的升高而降低,而当温度>60 ℃时,小鼠巨噬细胞内NO浓度增加。这是因为当温度升高时有利于酶的激活,使得细胞内NO的浓度明显降低;而温度过高容易导致部分蛋白酶变性失活[19-20]。当温度在60 ℃时,酶解物对小鼠巨噬细胞内NO的释放量抑制效果最好且显著优于阳性对照组,因此本研究选择在60 ℃条件下对酱油渣蛋白进行酶解。
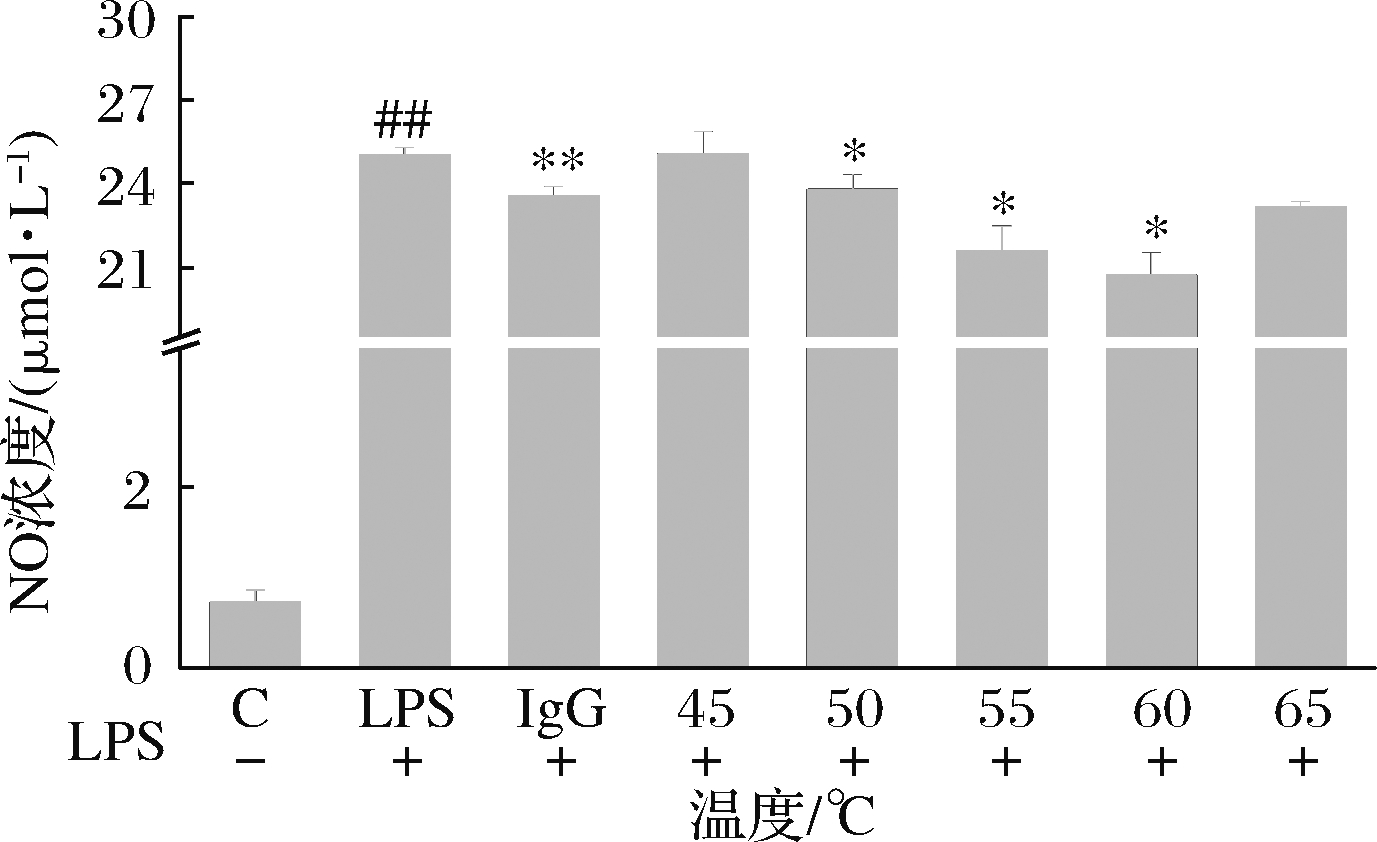
图3 酶解温度对RAW264.7细胞内NO浓度的影响
Fig.3 Effect of enzymolysis temperature on NO concentration
in RAW264.7 cells
2.1.4 酶解时间对小鼠巨噬细胞内NO释放量的影响
由图4可知,在1~3 h内,小鼠巨噬细胞内NO的浓度随着酶解时间的延长而降低,当酶解时间超过3 h时,小鼠巨噬细胞内NO浓度增加。由此推测,随着时间的延长酱油渣蛋白会被过度水解。当在3 h时小鼠巨噬细胞内NO浓度最小且显著低于阳性对照组,故本研究将酶解时间定为3 h。
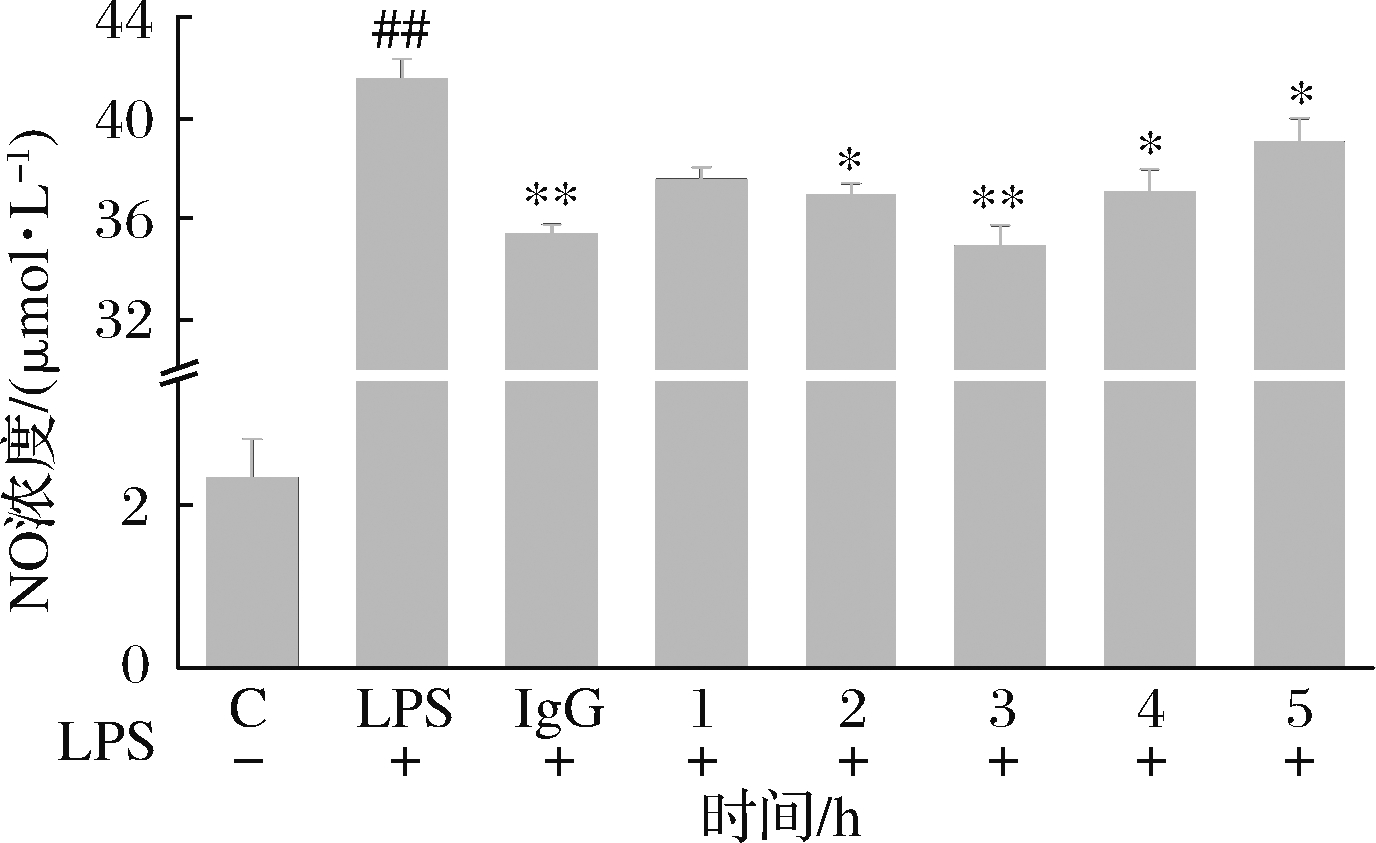
图4 酶解时间对RAW264.7细胞内NO浓度的影响
Fig.4 Effect of enzymolysis time on NO concentration in
RAW264.7 cells
2.1.5 加酶量对小鼠巨噬细胞内NO释放量的影响
由图5可知,当加酶量为5 500 U/g时,小鼠巨噬细胞内NO浓度最小且极显著低于阳性对照组,继续往体系中添加碱性蛋白酶,小鼠巨噬细胞内NO浓度逐渐升高。随着加酶量的不断增加,同种酶之间产生了竞争关系,对酱油渣蛋白与碱性蛋白酶的结合产生了影响[14],酶解酱油渣蛋白释放免疫活性肽受到抑制。因此,本研究将加酶量定为5 500 U/g。
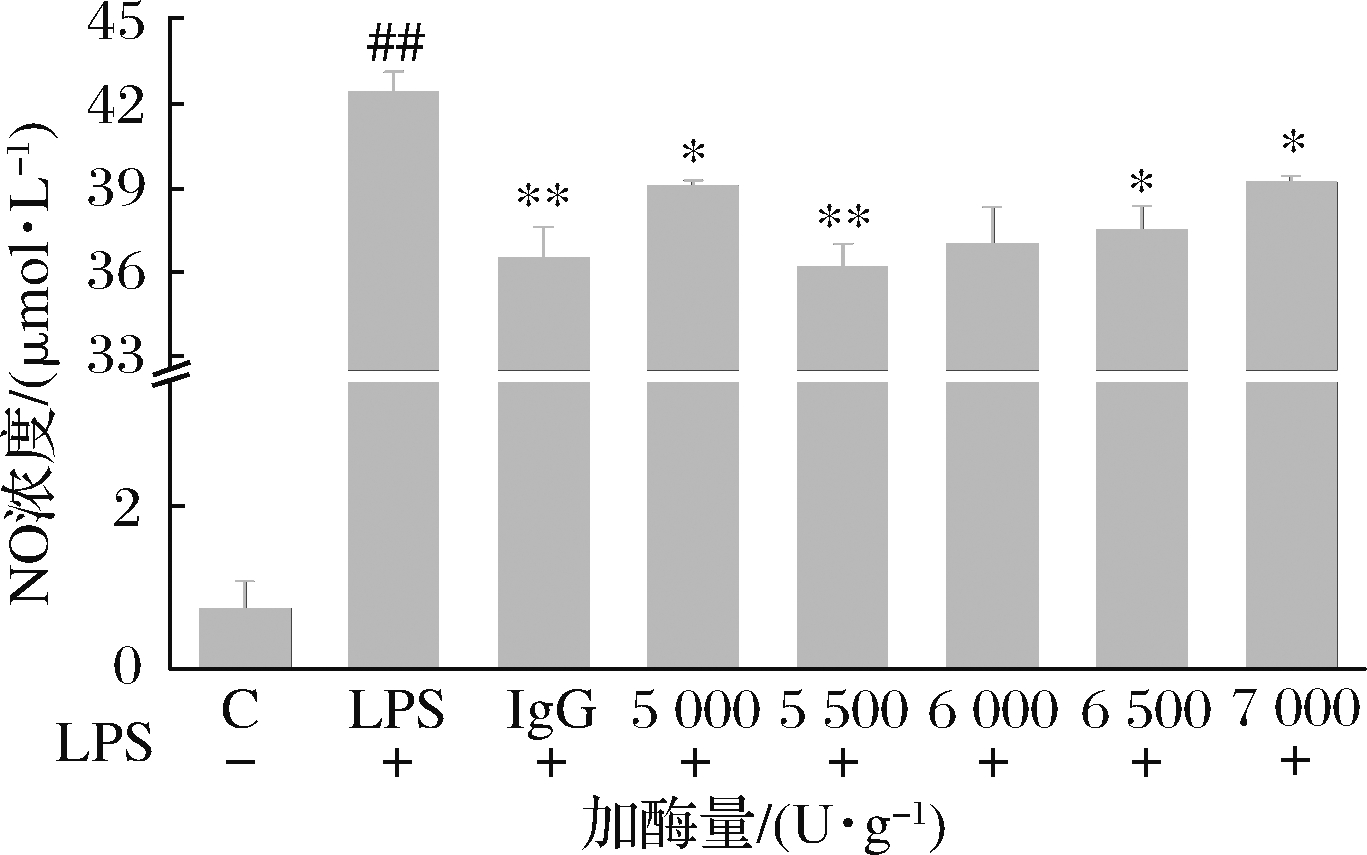
图5 加酶量对RAW264.7细胞内NO浓度的影响
Fig.5 Effect of enzyme amount on NO concentration in
RAW264.7 cells
2.2 酶解工艺的响应面优化试验
根据单因素试验结果,固定pH为7.5、底物质量分数为5%,以酶解温度、酶解时间及加酶量3个因素为自变量,酶解物对LPS炎症模型细胞内NO释放量的浓度为响应值,运用Design Expert10.0软件的Box-Behnken试验设计进行响应面优化试验,试验设计和结果如表2所示。
表2 响应面试验设计和结果
Table 2 Response surface experiment design and results
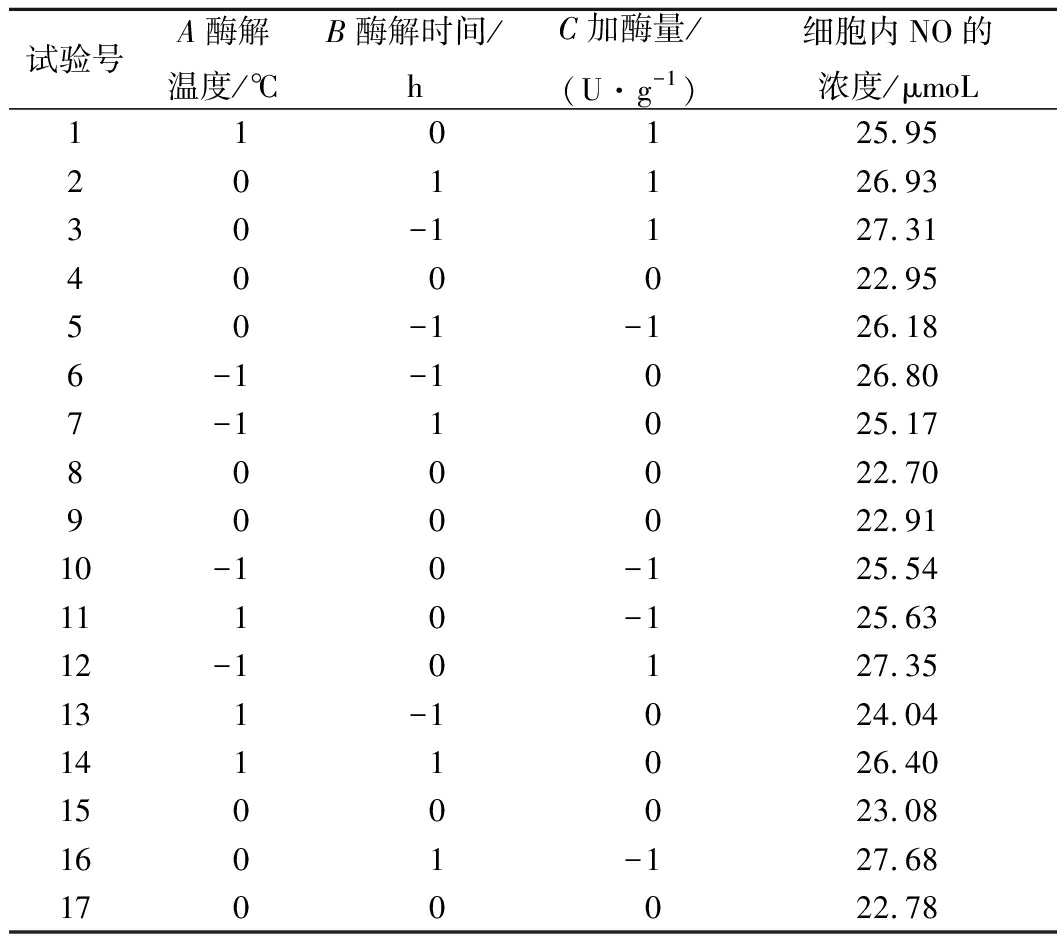
试验号A酶解温度/℃B酶解时间/hC加酶量/(U·g-1) 细胞内NO的浓度/μmoL110125.95 201126.93 30-1127.31400022.95 50-1-126.18 6-1-1026.80 7-11025.17 800022.70 900022.91 10-10-125.54 1110-125.6312-10127.35 131-1024.04 1411026.40 1500023.08 1601-127.68 1700022.78
对表2中的试验结果进行回归分析,得到RAW264.7细胞内NO的浓度值(Y)与酶解温度(A)、酶解时间(B)、加酶量(C)之间的二次多元回归拟合方程为:
Y=22.88-0.35A+0.23B+0.31C+1.00AB-0.37AC-0.47BC+0.90A2+1.81B2+2.33C2
对试验结果进行多元回归分析,由回归方程各项的方差分析结果(表3)可知,模型的F=80.97,p<0.000 1,表明模型极显著,同时A-酶解温度是极显著因素,A-酶解温度、B-酶解时间和C-加酶量的二次方、A-酶解温度与B-酶解时间的交互作用、B-酶解时间与C-加酶量的交互作用也是极显著影响;B-酶解时间、C-加酶量、A-酶解温度与C-加酶量的交互作用是显著影响。而失拟项的F=6.33,P=0.053 4,不显著(P>0.05),说明该模型与碱性蛋白酶酶解酱油渣蛋白制备免疫活性肽的实际情况拟合程度较好;拟合模型的R2=0.990 5,表明试验数据与模型预测数据相关性很好。
表3 回归模型方差分析
Table 3 Regression model analysis of variance
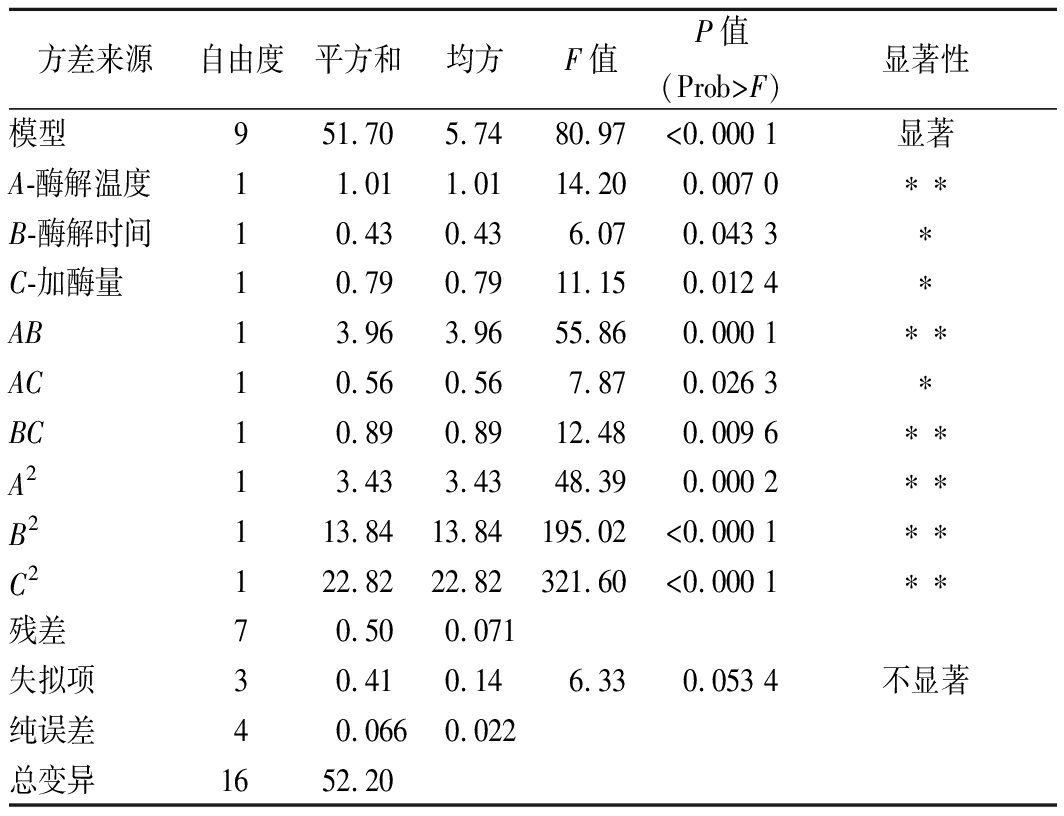
方差来源自由度平方和均方F值P值(Prob>F)显著性模型951.705.7480.97<0.000 1显著A-酶解温度11.011.0114.200.007 0∗∗B-酶解时间10.430.436.070.043 3∗C-加酶量10.790.7911.150.012 4∗AB13.963.9655.860.000 1∗∗AC10.560.567.870.026 3∗BC10.890.8912.480.009 6∗∗A213.433.4348.390.000 2∗∗B2113.8413.84195.02<0.000 1∗∗C2122.8222.82321.60<0.000 1∗∗残差70.500.071失拟项30.410.146.330.053 4不显著纯误差40.0660.022总变异1652.20
注:*为P<0.05,具有显著性;**为P<0.01,具有极显著性
图6~图8为以上模型所对应的响应面曲面图,从外形可以清晰看出拟合的响应面是典型的凹面图,其所对应的等高线图呈现向内递减的变化趋势,其中心点即有最小的响应值。运用软件的优化算法可确定出最小的响应值为小鼠巨噬细胞内NO浓度为22.81 μmol/L,抑制率为19.43%,此时各因素对应值分别为:加酶量5 468 U/g,酶解时间2.86 h,酶解温度61.31 ℃。

图6 时间与温度对RAW264.7细胞内NO浓度的影响
Fig.6 Effect of time and temperature on NO concentration
in RAW264.7 cells
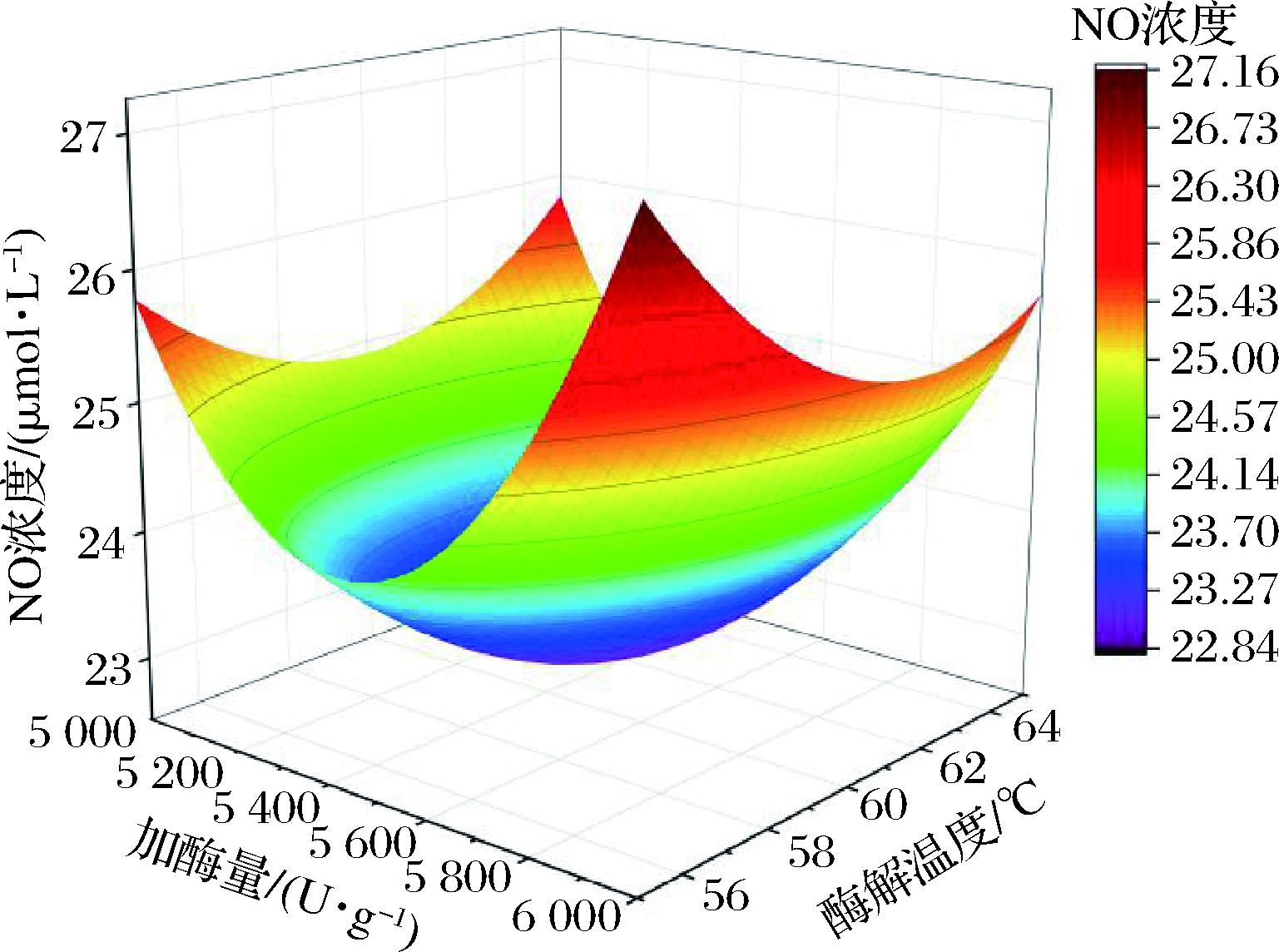
图7 加酶量与温度对RAW264.7细胞内NO浓度的影响
Fig.7 Effect of enzyme amount and temperature on NO
concentration in RAW264.7 cells

图8 加酶量与时间对RAW264.7细胞内NO浓度的影响
Fig.8 Effects of enzyme amount and time on NO
concentration in RAW264.7 cells
综合以上单因素和响应面优化的试验结果确定碱性蛋白酶酶解酱油渣蛋白制备免疫活性肽的工艺条件为:底物质量分数5%,pH 7.5,温度 61.31 ℃,酶解时间2.86 h,加酶量 5 468 U/g。在此条件下,酱油渣蛋白酶解物的小鼠巨噬细胞内NO释放量的抑制率可达18.92%。结合生产实际,调整酱油渣蛋白酶解工艺条件为:底物质量分数5%,pH 7.5,温度60 ℃,酶解时间 2.9 h,加酶量 5 500 U/g,在此条件下进行验证试验,3次独立试验的平均抑制率为(18.93±0.22)%,这与模型的预测值基本一致,进一步验证了上述模型的可靠性。
3 结论
通过酶解法制备酱油渣蛋白免疫活性肽,在单因素试验基础上,运用响应面法进行优化,得到最佳工艺条件为:底物质量分数5%,pH7.5,温度60 ℃,酶解时间2.9 h,加酶量5 500 U/g。此条件下,酶解物对LPS炎症模型细胞内NO释放量的抑制率可达(18.93±0.22)%。结果表明通过优化酶解工艺提高了酱油渣蛋白酶解产物的免疫活性,为食源性免疫制剂的进一步研究提供理论依据。
[1] 王帅,朱新贵,李学伟.酱油渣中色素及大豆异黄酮的提取研究[J].中国酿造,2017,36(5):46-52.
[2] 黄桂东,唐素婷,程云辉,等.酱油渣中乳酸乳球菌分离鉴定及对模拟胃肠环境的耐受性[J].食品与机械,2019,35(8):15-19;26.
[3] 陈媛,张志国.酱油渣残余蛋白有效利用研究进展[J].中国调味品,2016,41(3):153-157.
[4] 杨玉龙,王玮罡,宗波.酱油渣在养殖业中再利用的方法研究与优点分析[J].当代畜禽养殖业,2019(5):36-37.
[5] 高献礼,赵斯薇,孙鹏飞,等.酱油渣蛋白质的分离、鉴定和氨基酸组成特征研究[J].现代食品科技,2013,29(10):2 512-2 516.
[6] 肖盼盼,章骞,翁凌,等.凡纳滨对虾蛋白酶对酱油渣蛋白质的降解作用[J].食品科学,2019,40(9):1-11.
[7] 肖诗英.从酱油渣中回收制备异黄酮及多肽的工艺研究[D].湖北:湖北工业大学,2013.
[8] CHEN Xiangrong,LUO Yijie,QI Benkun,et al.Improving the hydrolysis efficiency of soy sauce residue using ultrasonic probe-assisted enzymolysis technology[J]. Ultrasonics-Sonochemistry,2017,35.
[9] 唐素婷,区锡敏,黄桂东,等.酱油渣中副干酪乳杆菌的分离鉴定及抗氧化特性研究[J].食品与机械,2019,35(10):11-17;23.
[10] 张兴茂.酱油渣蛋白质乳化特性以及水解产物抗氧化研究[D].广州:华南理工大学,2012.
[11] 邓开野,何泳欣.酱油渣中抗氧化性物质的提取工艺研究[J].中国调味品,2011,36(8):50-53.
[12] HOU Hu,FAN Yan,LI Bafang,et al.Purification and identification of immunomodulating peptides from enzymatic hydrolysates of Alaska pollock frame[J].Food Chemistry,2012,134(2):822-828.
[13] 王昊天. 酶解法提取鹿茸多肽及其抗炎活性研究[D].长春:长春工业大学,2018.
[14] 王璋,许时婴,汤坚,等.食品化学[M].北京:中国轻工业出版社,1999:174.
[15] 曾珍,李诚,付刚,等.猪骨免疫活性肽的分离纯化[J].食品与发酵工业,2014,40(11):116-120.
[16] 周洁静,侯银臣,刘旺旺,等.羊胎盘提取残余物免疫肽制备工艺的优化[J].食品与发酵工业,2015,41(3):129-134.
[17] WEN Li,CHEN Yuehua,ZHANG Li, et al.Rice protein hydrolysates (RPHs) inhibit the LPS-stimulated inflammatory response and phagocytosis in RAW264.7 macrophages by regulating the NF-κB signaling pathway[J]. Rsc Advances,2016,6(75):71 295-71 304.
[18] 王龙,叶克难.水产蛋白资源的酶解利用研究现状与展望[J].食品科学,2006,27(12):807-812.
[19] 王璐. 从大米蛋白胰蛋白酶酶解物中分离纯化免疫活性肽[D].长沙:长沙理工大学,2015.
[20] 何佳易,徐鑫,刘国艳,等.小黄鱼免疫肽制备条件的响应面优化[J].食品科学,2012,33(3):151-156.