膳食纤维被称为第七大营养素[1]。豆渣中膳食纤维含量可达50%~60% (干基),分为可溶性膳食纤维和不溶性膳食纤维,其中不溶性膳食纤维含量占总膳食纤维的90%[2-3],多作为废物被丢掉或用作饲料,其营养价值没有得到充分利用。因此,对大豆不溶性膳食纤维 (soybean insoluble dietary fiber, SIDF) 的开发和利用具有重要意义。
肠道菌群是人体生态系统的一个重要组成部分,可调节人体健康[4]。膳食纤维不能在体内消化吸收,大部分直接到达大肠 (盲肠和结肠) 中,可被肠道菌群发酵产生短链脂肪酸 (short-chain fatty acids, SCFAs),如乙酸,丙酸,丁酸等[5-7],可调节肠道内的pH,对肠道上的致病菌有抑制作用[8-9],并可为结肠细胞提供能量[10-12],除了可以作为能源外,还可以激活G蛋白偶联受体,充当信号分子并调节宿主中的不同生物过程[13-14],在调节宿主代谢[15-17]、免疫系统和细胞增殖中具有关键作用[18-20],并可促进肠道健康进而维持人体健康[21-22]。吴洪斌等[23]发现体外发酵番茄皮膳食纤维可产生SCFAs;赵兰涛[24]对燕麦、大麦中的膳食纤维进行体外发酵,发现SCFAs的浓度在发酵10 h后显著增加。陈雷[25]体外发酵苦荞粉,产生的SCFAs中乙酸含量最大。目前,对SIDF体外发酵的研究鲜有报道。
本文探究4种外源菌不同时间体外发酵SIDF的pH变化及产生SCFAs的含量变化。为体内发酵SIDF调节肠道健康和SIDF开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
SIDF,本实验室提取得到。两歧双歧杆菌 (Bifidobacterium bifidum) BNCC186304、粪肠球菌(Enterococcus faecalis) BNCC102668,北纳生物科技有限公司;乳杆菌 (Lactobacillus) LP5,大肠杆菌 (Escherichia coli) ATCC 25922,为实验室留存。LB培养基、MRS培养基、BBL培养基,青岛海博生物技术有限公司;乙酸、丙酸、丁酸标准品,上海阿拉丁生化科技股份有限公司;厌氧发酵培养基,北京陆桥技术股份有限公司。
1.2 仪器与设备
DG250厌氧工作站,英国Don Whitely Scientific;BXM-30R立式电热压力蒸汽锅、YP4002电子分析天平,上海佑科仪器仪表有限公司;LXJ-IIB离心机,上海化科实验器材有限公司;SW-CJ-2D超净工作台,上海析域仪器设备有限公司;GC-2010plus气相色谱仪,日本岛津公司。
1.3 试验方法
1.3.1 菌种活化及计数
将保存在甘油的乳酸杆菌LP5、大肠杆菌ATCC25922以体积分数5%接种量接到相应培养基上进行活化(表1)。两歧双歧杆菌BNCC186304、粪肠球菌BNCC102668为冻干菌粉,在超净台内用体积分数75%酒精擦拭管壁,在火焰上灼烧上部后迅速滴加无菌水后用镊子敲碎,然后取400 μL相应培养基加入冻干菌粉管中轻轻吹打至完全溶解,成悬浮状态,将其全部加入10 mL相应培养基中,培养条件见表1。每种菌种活化3次,平板涂布计算菌落数后进行后续实验。
表1 菌种培养基类型及培养条件
Table 1 Media types and culture conditions of bacteria

菌种培养基类型培养时间/h培养条件乳酸杆菌MRS培养基2437 ℃,厌氧两歧双歧杆菌BBL培养基4837 ℃,厌氧粪肠球菌MRS培养基2437 ℃,微好氧大肠杆菌LB培养基2437 ℃,厌氧
1.3.2 体外发酵
取SIDF 250 mg,活化后的菌种1.5 mL加入到厌氧发酵培养基 (30 mL) 中,以不加SIDF组为对照,在37 ℃,厌氧工作站中厌氧发酵48 h,分别在发酵的0、6、12、24、48 h取发酵液分别进行pH、SCFAs的测定,分析不同菌种在不同发酵时间发酵液的pH变化以及产生SCFAs含量的变化。
1.3.3 pH测定
分别在发酵的0、6、12、24、48 h取发酵液,在4 500 r/min的条件下离心15 min,离心后进行pH的测定。
1.3.4 SCFAs测定
取各个时间段的发酵液1 mL加入0.2 mL偏磷酸(体积分数25%)于1.5 mL离心管中,涡旋2 min,充分混合均匀后,在10 000 r/min 条件下离心15 min,离心后取上清,通过0.22 μm滤膜后上机检测。采用外标法进行SCFAs测定。
气相色谱条件:检测器FID,色谱柱Nukol (30 m×0.32 mm×0.25 μm) 毛细管柱。测定条件:载气N2流速为75 mL/min; H2流速为70 mL/min;空气流速为50 mL/min,进样量体积为1 μL。进样口温度为220 ℃;检测器温度250 ℃,升温程序:60 ℃,以20 ℃/min 升到190 ℃,保持3 min,分流比20∶1。

图1 短链脂肪酸气相色谱图
Fig.1 The gas chromatogram of SCFAs
1.4 数据处理与分析
所有数据重复测定3次,以![]() 表示,数据采用SPSS 24软件分析,P<0.05时,具有显著性,采用Origin 2017软件作图。
表示,数据采用SPSS 24软件分析,P<0.05时,具有显著性,采用Origin 2017软件作图。
2 结果与分析
2.1 原菌液菌落数
原菌液菌落数如表2所示。
表2 外源菌活菌数
Table 2 Viable counts of exogenous bacteria

外源菌活菌数×10-7/(CFU·mL-1)乳酸杆菌192.67±8.73两歧双歧杆菌96.00±8.00大肠杆菌144.00±5.29粪肠球菌108.50±4.50
2.2 发酵液中pH变化
2.2.1 乳酸杆菌体外发酵的pH变化
由图2可以看出,乳酸杆菌 (Lacto.) 组和Lacto.+SIDF组发酵液的pH在0~6 h急剧下降,Lacto.从6.71下降到5.05,Lacto.+SIDF组从6.70下降至4.98,这主要是因为在0~6 h乳杆菌利用厌氧培养基中大量的碳源产酸使pH急剧下降,Lacto.组在12 h时pH达到最低为4.91,之后pH基本恒定。而Lacto.+SIDF组在24 h时达到最低为4.49,Lacto.+SIDF组pH显著低于Lacto.组 (P<0.05),说明乳酸杆菌利用SIDF 发酵产酸。

图2 乳杆菌体外发酵SIDF的pH变化
Fig.2 Changes of pH in vitro fermentation by Lacto.
2.2.2 两歧双歧杆菌体外发酵的pH变化
由图3可知,两歧双歧杆菌 (Bifido.) 组和Bifido.+SIDF组发酵液的pH在0~12 h急剧下降,Bifido.组从6.37下降到3.54,Bifido.+SIDF组从6.28下降至3.51,Bifido.在12 h时pH达到最低为3.54,12 h之后发酵稳定,而Bifido.+SIDF组在48 h时达到最低为3.29,两歧双歧杆菌发酵液的最低pH比乳酸杆菌发酵液低,这说明两歧双歧杆菌利用SIDF产酸比乳酸杆菌发酵SIDF产生的酸多。
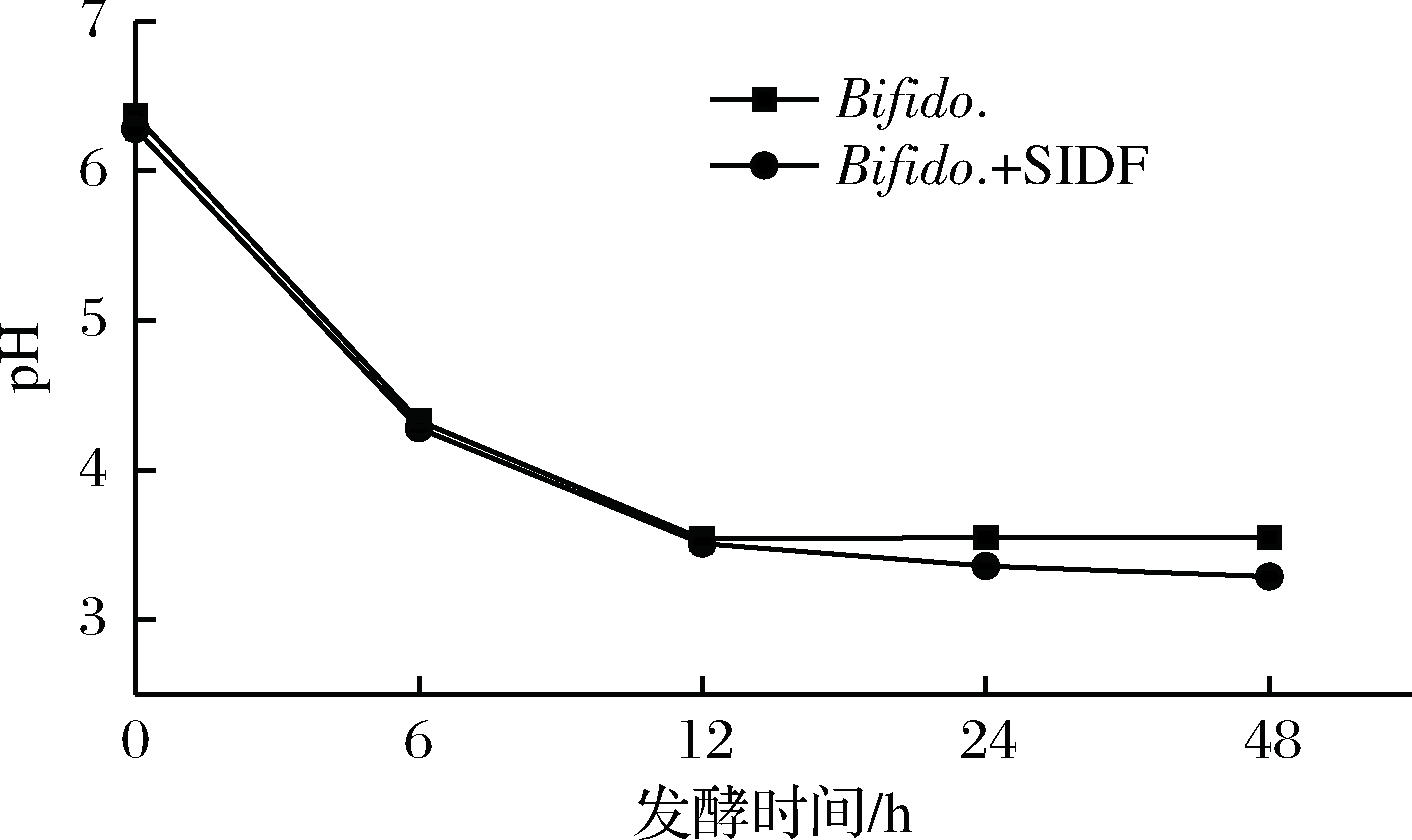
图3 两歧双歧杆菌杆菌体外发酵的pH变化
Fig.3 Changes of pH in vitro fermentation by Bifido.
2.2.3 粪肠球菌体外发酵的pH变化
由图4可见,粪肠球菌 (Entero.) 组和Entero. + SIDF组发酵液的pH在0~12 h变化趋势与两歧双歧杆菌发酵液变化相似。当发酵到24 h,Entero.+SIDF组pH显著低于Entero.组 (P<0.05),随着发酵时间的延长,Entero.+SIDF组pH持续下降,在48 h达到最低为4.36,其最低pH比两歧双歧杆菌高,这说明其产酸没有两歧双歧杆菌发酵SIDF产酸多。发酵24 h后 Entero.组pH值略有上升趋势,这主要是Entero.组随着发酵时间延长将碳源全部利用完毕,发酵液中代谢产物增多,菌体死亡并产生菌体自溶,使pH略有上升。
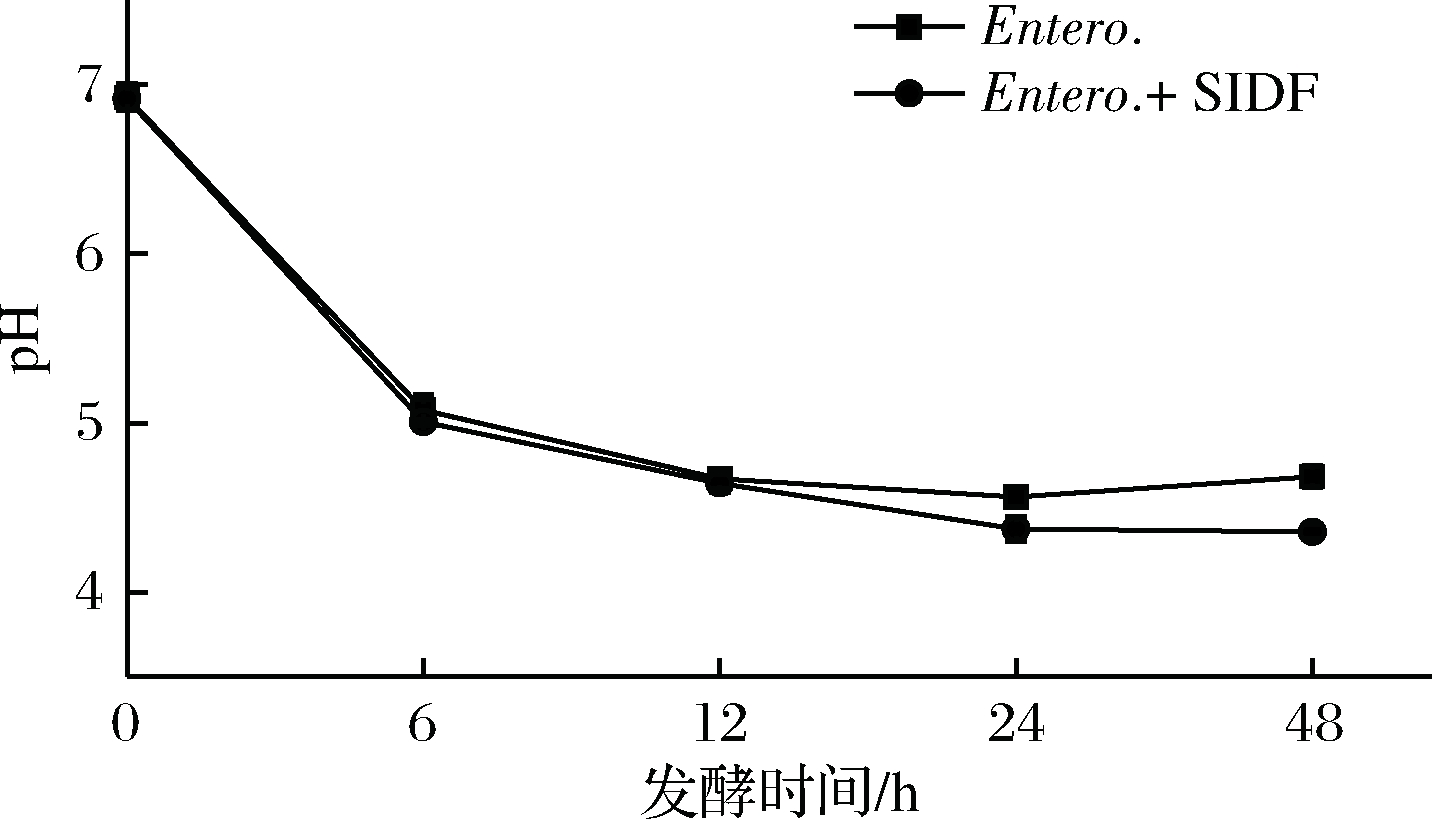
图4 粪肠球菌体外发酵的pH变化
Fig.4 Changes of pH in vitro fermentation by Entero.
2.2.4 大肠杆菌体外发酵的pH变化
由图5可知,大肠杆菌 (Escher.) 组和Escher.+SIDF组发酵液的pH在0~6 h急剧下降,Escher.组从7.35下降到5.27,Escher.+SIDF组从7.36下降至5.13,这主要是因为在0~6 h大肠杆菌利用厌氧培养基中大量的碳源使pH急剧下降,在发酵24 h,2组发酵液的pH基本保持恒定,Escher.组在48 h时pH达到最低为4.68,而Escher.+SIDF组在48 h时达到最低为4.59;大肠杆菌发酵的最低pH比粪肠球菌最低pH高,这说明大肠杆菌发酵SIDF产生的酸没有粪肠球菌发酵产酸多。Escher.+SIDF组pH显著低于Escher.组 (P<0.05)。Escher.组在发酵12 h之后,pH有所上升,这主要是因为大肠杆菌充分利用了培养基中的碳源后产生代谢产物,利用蛋白质等物质,使pH有上升趋势[12],Escher.+SIDF组pH在发酵12 h后仍继续下降。

图5 大肠杆菌体外发酵的pH变化
Fig.5 Changes of pH in vitro fermentation by Escher.
2.2.5 外源菌体外发酵SIDF的pH变化
4种外源菌体外发酵SIDF的发酵液pH变化如图6所示。乳酸杆菌、粪肠球菌、大肠杆菌发酵液pH在12 h时相近,分别为(4.62±0.04)、(4.64±0.05)、(4.68±0.06),随着发酵时间的增长,变化趋势平稳,pH值最低分别为(4.49±0.06)、(4.36±0.05)、(4.59±0.05),与另外3种外源菌相比,两歧双歧杆菌在发酵过程中pH变化最大,最低pH值为(3.29±0.05)。这说明两歧双歧杆菌发酵SIDF产生的酸最多。

图6 四种外源菌体外发酵SIDF的pH变化
Fig.6 Changes of pH in vitro fermentation of SIDF
by 4 exogenous intestinal bacteria
2.3 不同外源菌及不同发酵时间产SCFAs变化
乙酸、丙酸、丁酸的标准曲线方程见表3。
表3 短链脂肪酸标准方程
Table 3 Standard equation of SCFAs

短链脂肪酸保留时间/min标准曲线R2乙酸7.245±0.018y=309 078X+32 4750.999丙酸9.274±0.015y=403 294X-323.730.998丁酸11.448±0.010y=387 431X+154.470.999
2.3.1 乳酸杆菌体外发酵产SCFAs
由图7-a和图7-c可以看出,各组乙酸、丁酸含量随着发酵时间延长而逐渐增加,在48 h时Lacto.+SIDF组含量达到最大,分别为(1.19±0.015)、(0.082±0.001)g/L,在发酵24 h产生的丙酸最多,为(0.12±0.002)g/L(图7-b);SCFAs总的含量在发酵48 h达到最大为(1.35±0.031)g/L (图7-d),乳酸杆菌体外发酵产生的乙酸含量最多,丙酸次之,丁酸最少。发酵的整个过程中,Lacto.与Lacto.+SIDF组相比产生的SCFAs具有显著性差异 (P<0.05)。在发酵48 h时,乙酸和丁酸含量最大,连晓蔚等[26]利用低聚麦芽糖体外发酵,在24 h时乙酸、丁酸含量最高,本研究延长了发酵时间,在发酵48 h乙酸、丁酸含量最大。在发酵48 h时,丙酸含量大幅减少,可能是因为随着发酵时间的增加丙酸不再产生并发生挥发所致。
2.3.2 两歧双歧杆菌体外发酵产SCFAs
由图8-a和图8-b可以看出, Bifido.+SIDF在发酵24 h时乙酸、丙酸含量达到最大,分别为(4.05±0.024)、(0.13±0.014)g/L;丁酸在发酵48 h含量最高为(0.024±0.000 4)g/L (图8-c)。两歧双歧杆菌发酵SIDF产生的总SCFAs在24 h时达到最大为(4.20±0.11)g/L (图8-d)。在整个发酵过程中,Bifido.与Bifido.+SIDF组产生的SCFAs具有显著性差异 (P<0.05)。两歧双歧杆菌发酵产生的总SCFAs最大值比乳酸杆菌大。发酵时间24~48 h,乙酸、丙酸含量大幅下降,乙酸、丙酸随着发酵时间的增加不再产生并发生挥发所致。这与刘露等[27]报道的结果相似。丁酸在此过程中继续产生,丁酸含量累积增加。
2.3.3 粪肠球菌体外发酵产SCFAs
由图9-a可以看出,乙酸含量随着发酵时间的增加,其含量逐渐积累,在48 h时达到最大为(0.49±0.011)g/L,在6 h时, Entero.+SIDF组丙酸 (图9-b) 开始产生,而Entero.组在24 h才开始产生丙酸,

图7 乳酸杆菌体外发酵产SCFAs含量
Fig.7 Production of SCFAs by Lacto.
注:同一时间不同小写字母表示具有显著性差异(P<0.05)(下同)

图8 两歧双歧杆菌体外发酵产SCFAs含量
Fig.8 Production of SCFAs by Bifido
在发酵48 h时Entero.+SIDF组丙酸含量达到最大为(0.07±0.003)g/L,如图9-c所示,Entero.组丁酸在12 h产生,而Entero.+SIDF组在6 h时开始产生丁酸,并随着时间积累逐渐增多,在48 h时达到最多为(0.013±0.001 4)g/L;如图9-d所示,在发酵48 h时Entero.+SIDF组总SCFAs含量为(0.57±0.026)g/L。粪肠球菌发酵产生的总SCFAs最大值没有两歧双歧杆菌大。
2.3.4 大肠杆菌体外发酵产SCFAs
由图10-a可以看出,2组乙酸都是在发酵6 h时开始产生,在48 h达到最大,Escher.+SIDF组为(1.06±0.021)g/L;在0~24 h内,Escher.组没有产生丙酸 (图10-b), Escher.+SIDF在24 h时丙酸含量最大为(0.006±0.000 3)g/L;Escher.+SIDF组在24 h产生的丁酸最多为(0.006±0.000 8)g/L (图10-c);整个发酵过程中,48 h时总SCFAs最多为(1.07±0.031)g/L (图10-d)。大肠杆菌发酵产生的总SCFAs最大值比粪肠球菌大。有文献报道[28-29],体外发酵淀

图9 粪肠球菌体外发酵产SCFAs
Fig.9 Production of SCFAs by Entero.

图10 大肠杆菌体外发酵产SCFAs
Fig.10 Production of SCFAs by Escher.
粉产生乙酸的含量最高,这与本研究相一致;彭喜春等[30]利用直肠菌群体外发酵麦麸和甘蔗渣2种不溶性膳食纤维产丙酸含量最大,与本研究不一致,这可能是菌群种类不同,发酵的纤维不同所致。
2.3.5 外源菌体外发酵产SCFAs
4种外源菌发酵产生SCFAs中乙酸均为最高,丁酸最低。乳酸杆菌、粪肠球菌、大肠杆菌在发酵0~48 h,产生的乙酸含量随时间增加而增大,在48 h达到最大,两歧双歧杆菌发酵产生的乙酸含量先增加后减少,与另外3种外源菌相比,两歧双歧杆菌发酵产生的乙酸、丙酸含量最多,在24 h达到最大分别为(4.05±0.024)、(0.13±0.014)g/L (图11-a、b),乳酸杆菌发酵产生的丁酸最多为(0.082±0.001)g/L (图11-c)。两歧双歧杆菌发酵产生的总SCFAs最多,在发酵24 h时产量最大为(4.20±0.11)g/L,两歧双歧杆菌发酵SIDF产生SCFAs能力最强,粪肠球菌发酵产SCFAs能力最弱 (图11-d)。
3 结论与讨论
本研究以乳酸杆菌、两歧双歧杆菌、大肠杆菌、粪肠球菌4种外源菌体外发酵SIDF,从单一菌群角度研究发酵过程中的pH变化、SCFAs含量,发现4种外源菌发酵SIDF都可使pH降低,产生SCFAs。但是,在pH最低时,产生的SCFAs并不是最高,这说明菌群发酵SIDF产生多种酸,不仅是SCFAs。试验中还存在不足,比如单一菌群虽然能清楚表现出产生SCFAs的总类和含量,但没能体现肠道菌群的多样性,体内发酵SIDF可能更好地调节肠道健康,更深入地研究多菌群试验将进行体内试验研究。

图11 外源菌发酵SIDF产短链脂肪酸
Fig.11 SIDF was fermented in vitro by exogenous intestinal bacteria to produce SCFAs
试验结果表明,乳酸杆菌、两歧双歧杆菌、大肠杆菌、粪肠球菌4种外源菌可体外发酵SIDF使pH降低。两歧双歧杆菌发酵液中pH最低。两歧双歧杆菌在发酵24 h 产乙酸、丙酸含量最多,分别为(4.05±0.024)、(0.13±0.014)g/L。乳酸杆菌在发酵24 h时,产生的丁酸最多为(0.082±0.001)g/L。整个发酵过程中,产生的乙酸含量最大,大肠杆菌产生的丁酸比丙酸含量多,而其他3种菌产生的丁酸含量比丙酸少。两歧双歧杆菌发酵SIDF产SCFAs能力最强。SIDF可通过外源菌群体外发酵产生对人体有益的SCFAs,使发酵液的pH发生变化,这可为SIDF在体内发酵产生有益的SCFAs奠定基础。
[1] 陈月安.膳食纤维与人体健康[J].内蒙古民族大学学报, 2009, 15(2): 142-143.
[2] PRESTMO G, RUPEREZ P, ESPINOSA M I, et al. The effects of okara on rat growth, cecal fermentation, and serum lipids [J]. European Food Research and Technology, 2006, 225(5-6): 925-928.
[3] ZHU Y, CHU J, LU Z, et al. Physicochemical and functional properties of dietary fiber from foxtail millet (Setaria italic) bran [J]. Journal of Cereal Science, 2018, 79: 456-461.
[4] MULLISH B H, PECHLIVANIS A, BARKER G F, et al. Functional microbiomics: evaluation of gut microbiota-bile acid metabolism interactions in health and disease [J]. Methods, 2018, 149: 49-58.
[5] CHANG S, CUI X, GUO M, et al. Insoluble dietary fiber from pear pomace can prevent high-fat diet induced obesity in rats mainly by improving the structure of gut microbiota [J]. Journal of Microbiology & Biotechnology, 2017, 27(4): 856-867.
[6] PATURI G, BUTTS C A, MONRO J A, et al. Effects of blackcurrant and dietary fibers on large intestinal health biomarkers in rats [J]. Plant Foods for Human Nutrition, 2018, 73(1): 54-60.
[7] 韩伟,庄绪会,张云鹏,等.大豆乳清粉对小鼠肠道菌群及其产生短链脂肪酸的影响[J].大豆科学, 2019, 38(1): 104-110.
[8] R OS-COVI
OS-COVI N D, PATRICIA R M, ABELARDO M, et al. Intestinal short chain fatty acids and their link with diet and human health [J]. Frontiers in Microbiology, 2016, 7: 185.
N D, PATRICIA R M, ABELARDO M, et al. Intestinal short chain fatty acids and their link with diet and human health [J]. Frontiers in Microbiology, 2016, 7: 185.
[9] HU J L, NIE S P, MIN F F, et al. Polysaccharide from seeds of plantago asiatica l. increases short-chain fatty acid production and fecal moisture along with lowering ph in mouse colon [J]. Journal of Agricultural and Food Chemistry, 2012, 60(46): 11 525-11 532.
[10] MAKKI K, DEEHAN E C, WALTER J, et al. The impact of dietary fiber on gut microbiota in host health and disease [J]. Cell Host & Microbe, 2018, 23(6): 705-715.
[11] KOH A, DE F, KOVATCHEVA-DATCHARY P, et al. From dietary fiber to host physiology: short-chain fatty acids as key bacterial metabolites [J]. Cell, 2016, 165(6): 1 332-1 345.
[12] 俞东宁.不同抗性淀粉理化特性及其体外发酵的研究[D].杭州: 浙江工商大学, 2018.
[13] DING Q, NIE S, HU J, et al. In vitro and in vivo gastrointestinal digestion and fermentation of the polysaccharide from Ganoderma atrum [J]. Food Hydrocolloids, 2017, 63: 646-655.
[14] GAMAGE H K A H, TETU S G, CHONG R W W, et al. Fiber supplements derived from sugarcane stem, wheat dextrin and psyllium husk have different in vitro effects on the human gut microbiota [J]. Frontiers in Microbiology, 2018, 9: 1 618.
[15] KONG Q, DONG S, GAO J, et al. In vitro fermentation of sulfated polysaccharides from E. prolifera and L. japonica by human fecal microbiota [J]. International Journal of Biological Macromolecules, 2016, 91:867-871.
[16] HUANG J Q, WANG Q, XU Q X, et al. In vitro fermentation of O acetyl arabinoxylan from bamboo shavings by human colonic microbiota [J]. International Journal of Biological Macromolecules, 2019, 125: 27-34.
[17] 杨东明,赵鑫婧,赵德明,等.短链脂肪酸在宿主能量代谢方面的调节作用[J].中国微生态学杂志, 2019, 31(9): 1 100-1 104.
[18] 聂启兴,胡婕伦,钟亚东,等.几类不同食物对肠道菌群调节作用的研究进展[J].食品科学, 2019, 40(11): 321-330.
[19] LANGE K, HUGENHOLTZ F, JONATHAN M C, et al. Comparison of the effects of five dietary fibers on mucosal transcriptional profiles, and luminal microbiota composition and SCFA concentrations in murine colon [J]. Molecular Nutrition & Food Research, 2015, 59(8): 1 590-1 602.
[20] 季晓梅.嗜酸乳杆菌对β-乳球蛋白过敏小鼠肠道菌群及其代谢的影响[D].哈尔滨: 东北农业大学, 2015.
[21] CUMMINGS J H, MACFARLANE G T. The control and consequences of bacterial fermentation in the human colon [J]. Journal of Applied Microbiology, 2008, 70(6): 443-459.
[22] SCHROEDER B O, BIRCHENOUGH G M H, STAHLMAN M, et al. Bifidobacteria or fiber protects against diet-induced microbiota-mediated colonic mucus deterioration [J]. Cell Host Microbe, 2018, 23: 27-40.
[23] 吴洪斌,王永刚,李烁,等.不同处理番茄皮膳食纤维对体外发酵体系短链脂肪酸的影响[J].食品工业科技, 2012, 33(4): 209-212;226.
[24] 赵兰涛.全谷物对肠道菌群益生作用的研究[D].无锡: 江南大学, 2013.
[25] 陈蕾.苦荞对肠道菌群影响的研究[D].上海: 上海师范大学, 2016.
[26] 连晓蔚,彭喜春.不同肠道菌群利用低聚异麦芽糖体外发酵产短链脂肪酸的初步研究[J].食品与发酵工业, 2011, 37(6):39-41.
[27] 刘露,张雁,魏振承,等.肠道益生菌体外发酵山药低聚糖产短链脂肪酸的研究[J].食品科学技术学报, 2019, 37(4): 49-56.
[28] 连晓蔚.肠道菌群利用几种膳食纤维体外发酵产短链脂肪酸的研究[D].广州: 暨南大学, 2011.
[29] 方建东.抗性淀粉对小鼠肠道菌群的影响以及作用机制的研究[D].杭州: 浙江工商大学, 2014.
[30] 彭喜春,庞秋芳,吴希阳,等.直肠菌群对两种不溶性膳食纤维的体外发酵[J].卫生研究, 2010, 39(5): 611-614.