红曲色素分为红色素、黄色素、橙色素3类,目前市面上的产品主要为红曲红色素[1-2]。一般认为,红曲色素的稳定性较差,尤其是对光的稳定性差[3-8]。色素的稳定性包含色素种类的稳定性及色素含量的稳定性,即色素产品不易“变色”及“褪色”。
天然红曲橙、黄色素因发酵产物的色价较低而未能实现工业化生产,随着研究人员的不懈努力,色素的产量在不断提高[9-19]。在产品的制备及应用过程中,涉及到这些新型色素稳定性的问题必将出现。如张慧娟[20]研究发现红曲橙色素光稳定性较差,热稳定性良好,且红曲橙色素在酸性条件下较为稳定。代春华等[21]发现红曲黄色素对光较为敏感。杨强等[22]的研究也表明,红曲黄色素对光较为敏感,金属离子对色素稳定性有一定影响。因此从发酵液到产品阶段,如何在保持红曲橙、黄色素稳定性的前提下大批量生产红曲橙、黄色素产品,是必须面对的问题。
本研究以紫色红曲菌W-2液态发酵生产的红曲橙、黄色素发酵液为研究对象,采用光谱扫描(spectral scanning)及薄层层析(thin layer chromatography, TLC)的检测方法,对红曲橙、黄色素在制备及应用过程中的稳定性进行探究。
1 材料与方法
1.1 材料
红曲橙、黄色素发酵液由本实验室采用紫色红曲菌W-2通过100 L机械搅拌发酵罐,在通气量为0.5 vvm、装料量为70%、罐压为0.05 MPa、温度为30 ℃、转速控制在200~400 r/min的条件下通过补料发酵5 d制得。其中黄色素色价为465 U/mL、橙色素色价为451 U/mL。
1.2 主要仪器设备
UV1600紫外可见光分光光度计,上海菁华科技有限公司生产;ML204电子天平,梅特勒-托利多仪器有限公司生产;P-1;200 cm×200 cm层析缸,垒固科技有限公司生产; TLC硅胶(60 F254。25 Aluminium sheets 20 cm×20 cm)Merck生产。
1.3 试验方法
1.3.1 红曲色素萃取液的波长扫描
取1 mL发酵液或0.5 g烘干后红曲物料于50 mL比色管中,用体积分数70%的乙醇定容到50 mL,然后用定性滤纸过滤,再用体积分数70%乙醇稀释到一定浓度,用紫外可见光分光光度计在300~600 nm的范围内进行波长扫描。
1.3.2 红曲色素萃取液薄层层析分析方法
取1 mL发酵液或1 g烘干后红曲物料于试管中,加入9 mL的无水乙醇萃取30 min,期间每10 min充分混匀1次,然后用定性滤纸进行过滤。过滤后样品用点样毛细管点样,以V(甲苯)∶V(乙酸乙酯)∶V(甲酸)=7∶3∶1作为展开剂进行TLC分析。
(1)
1.3.3 红曲橙、黄色素色价及残存率计算
将发酵结束后的发酵液或干燥后的红曲橙、黄色素产品充分混匀,用移液器准确吸取1 mL发酵液或准确称取0.5 g红曲产品置于50 mL比色管中并用体积分数70%的乙醇定容到50 mL,萃取30 min,期间每10 min充分混匀1次,然后用定性滤纸过滤,而后稀释到适宜浓度在300~600 nm处进行波长扫描。
橙色素色价=OD(460~480)max×总稀释倍数
黄色素色价=OD(390~420)max×总稀释倍数
橙色素残存率![]()
黄色素残存率![]()
2 结果与讨论
2.1 光照对红曲橙、黄色素稳定性的影响
研究了光照对红曲橙、黄色素的影响,用无水乙醇将红曲橙、黄色素发酵液稀释100倍,然后放于平均光照强度为80 000 LUX的日光下照射0、2、4、6、8 h。光照结束后将样品再稀释10倍,用分光光度计进行波长扫描,结果如图1所示。
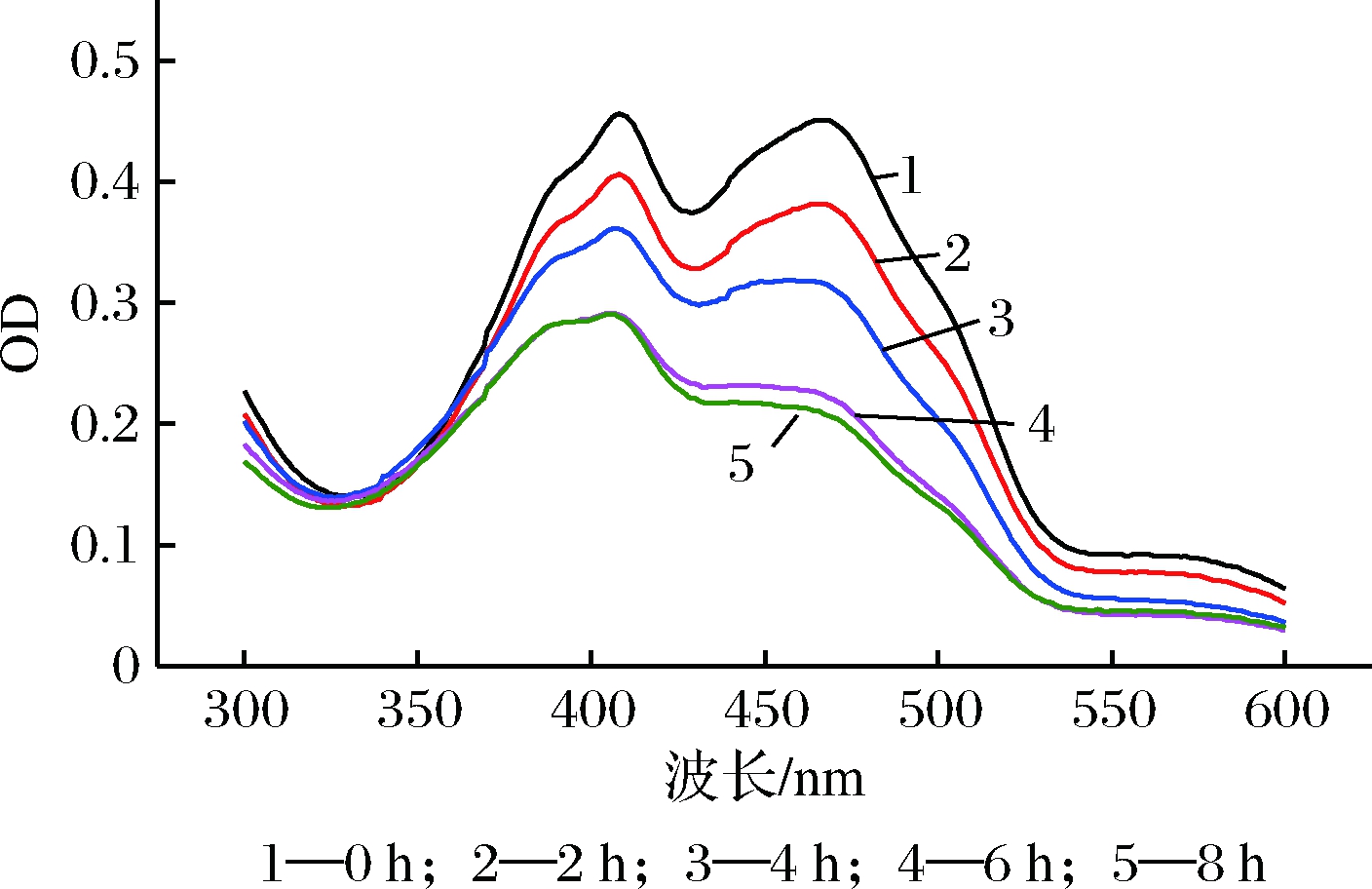
图1 光照对红曲橙、黄色素稳定性的影响
Fig.1 Influence of illuminative time on the stability of
monascorubrin and monascin from Monascus
从图1可以看出,随着光照时间的延长,红曲橙、黄色素的OD值在不断下降。光照8 h后最大吸收波长为408 nm的红曲黄色素的色素残存率仅有63.16%,而最大吸收波长为466 nm的红曲橙色素的色素残存率仅有46.56%。由此可见2种色素的光稳定性较差,且红曲橙色素的光稳定性较红曲黄色素更差。
选用光照0、4、8 h的红曲橙、黄色素样品进行TLC分析,点样量均为400 μL,结果如图2及表1所示。
从图2可以看出,随着光照时间的延长,色素条带的种类及含量均发生了变化。其中编号1和3所对应的Rf 2条红色素条带几乎消失,说明这2种红色素极不稳定;编号为9和10对应的2条橙色素条带随着光照时间的延长而变淡,而在光照4及8 h的层析图谱上可以看到多出3条黄色素条带,编号分别为5、6和7,相对应Rf值分别为0.209、0.470及0.489,编号为2、4对应的2个黄色素条带颜色明显加深。这可能是由于在日光照射下部分红曲橙色素转化为红曲黄色素,这也是红曲橙色素在光照条件下其OD值下降更快的原因之一。

1-光照0 h;2-光照4 h;3-光照8 h
图2 薄层层析图谱
Fig.2 Monascus pigments of the TLC
表1 薄层层析主要数据
Table 1 Main data of TLC
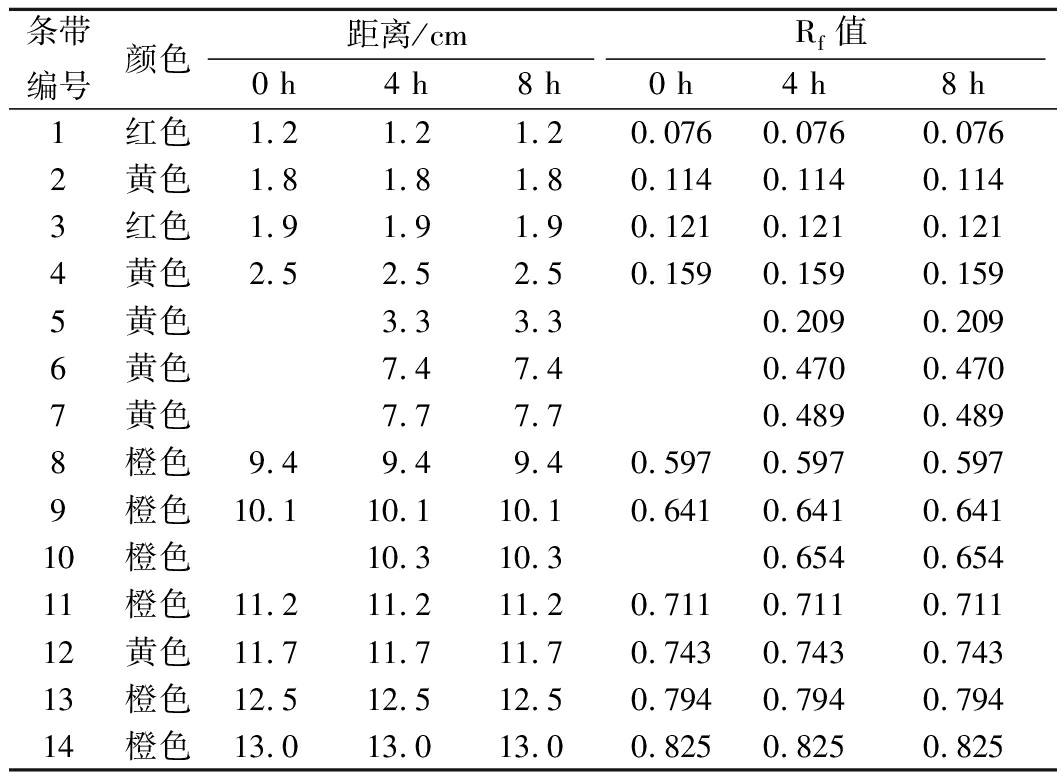
条带编号颜色距离/cmRf值0 h4 h8 h0 h4 h8 h1红色1.21.21.20.076 0.076 0.0762黄色1.81.81.80.114 0.114 0.1143红色1.91.91.90.121 0.121 0.1214黄色2.52.52.50.159 0.159 0.1595黄色3.33.30.209 0.2096黄色7.47.40.470 0.4707黄色7.77.70.489 0.4898橙色9.49.49.40.597 0.597 0.5979橙色10.110.110.10.641 0.641 0.64110橙色10.310.30.654 0.65411橙色11.211.211.20.711 0.711 0.71112黄色11.711.711.70.743 0.743 0.74313橙色12.512.512.50.794 0.794 0.79414橙色13.013.013.00.825 0.825 0.825
2.2 发酵液与不同物料混合并干燥后的色素稳定性
红曲橙、黄色素主要应用于食品行业,把色素加入到食品中或与食品原料混合时,色素颜色是否发生变化,是首先需要考虑的问题。为此,尝试将红曲橙、黄色素发酵液分别与谷物粉、淀粉、麦芽糊精、环糊精、变性淀粉及蛋白粉混合并干燥,观察色素变色情况。如图3所示,红曲黄、橙色素的发酵液与谷物粉或蛋白粉混合并干燥的过程中,物料颜色由橙黄色逐渐变为紫红色;与淀粉、麦芽糊精、环糊精及变性淀粉混合并干燥,物料颜色始终保持为橙、黄色。因此可以确定,加入到谷物粉及蛋白粉中的黄、橙色素种类已经发生改变,而与淀粉、麦芽糊精、环糊精及变性淀粉混合后,色素则没有变化。进一步用分光光度计对红曲黄、橙色素发酵液及发酵液与各种物料混合并干燥后的物料萃取物进行光谱扫描,结果如图4所示。

a-红曲橙、黄色素发酵液;b-发酵液+谷物粉;c-发酵液+淀粉
图3 发酵液加入谷物粉或淀粉烘干后的颜色变化
Fig.3 Color change of fermented broth after adding cereal
flour or starch after drying
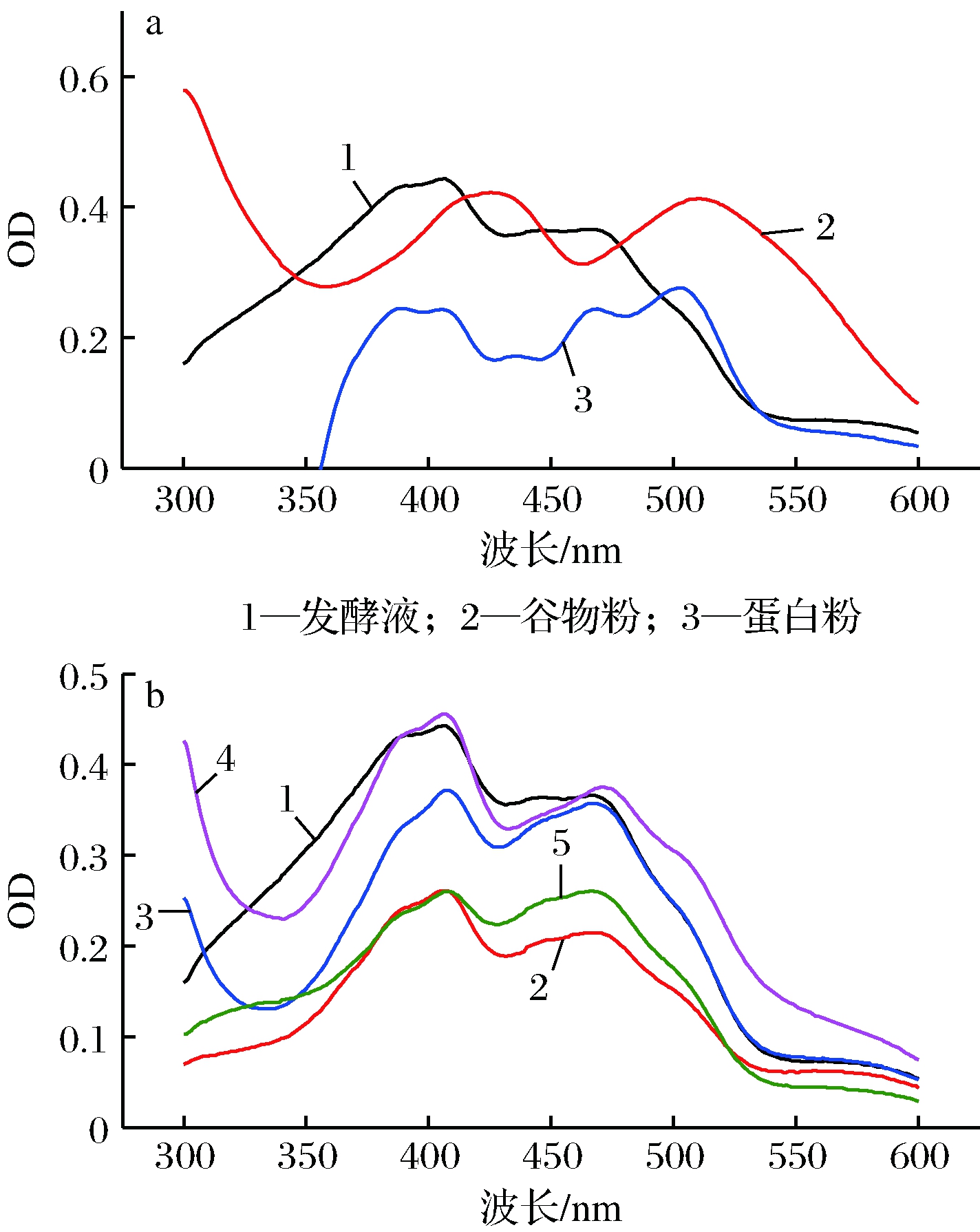
a-发酵液+含蛋白类物质;b-发酵液+不含蛋白类物质
1-发酵液;2-淀粉;3-麦芽糊精;4-环糊精;5-变性淀粉
图4 发酵液与不同物料混合后的萃取物的扫描图
Fig.4 Scanning of extracts of fermentation broth mixed
with different materials
从图4可以看出,谷物粉、蛋白粉与红曲发酵液混合后,从物料中萃取的色素最大吸收波长发生了变化。红曲橙、黄色素发酵液萃取液的最大吸收波长为406及466 nm,发酵液与谷物粉混合并烘干的物料萃取液的最大吸收波长为425及510 nm,发酵液与蛋白粉混合并烘干的物料萃取液的最大吸收波长变为406及502 nm,这2种情况波峰对应的波长均发生了偏移。而发酵液与不含蛋白质的淀粉类物质混合并烘干的物料萃取液的最大吸收波长与发酵液萃取物相比,均无明显变化。由此可以判断,红曲橙、黄色素确实与某些蛋白结合从而发生结构上的改变。合理的解释是特征波长数值较小的橙、黄色素转变成了特征波长数值更大的红色素。
谷物粉、淀粉、蛋白粉与发酵液混合干燥后得到的红曲产品及发酵液的TLC分析结果如图5和表2所示。
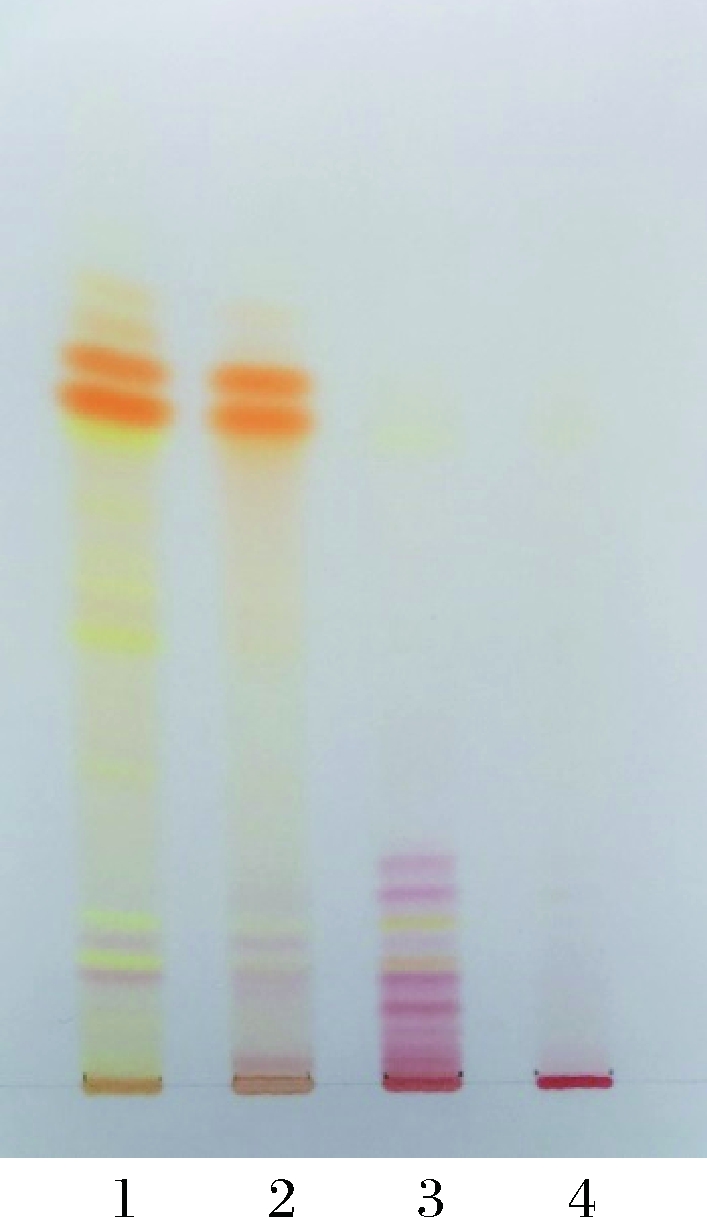
1-橙、黄色素发酵液;2-发酵液加淀粉萃取物;
3-发酵液加谷物粉萃取物;4-发酵液加蛋白粉萃取物
图5 发酵液与不同物料混合后的萃取物的薄层层析图谱
Fig.5 TLC of extracts from fermentation broth mixed with
different materials
从图5可以看出,以淀粉与红曲橙、黄色素发酵液混匀干燥得到的红曲产品与红曲橙、黄色素发酵液的TLC图谱较为一致。而谷物粉与红曲橙、黄色素发酵液混匀干燥得到的红曲产品橙色素条带消失,即编号为16、17、18及19的色素条带消失,但增加了编号分别为3、4、5、10及11的条带,这些条带均为红色,且其Rf值相对较小,说明色素条带的亲水性增强,这可能是谷物粉与红曲橙、黄色素发酵液混匀后,谷物粉中的某些物质与红曲橙、黄色素结合变成红色;蛋白粉与红曲橙、黄色素发酵液混匀干燥得到的红曲产品中没有橙色、黄色及红色色素条分离出来,这可能是由于红曲橙、黄色素与蛋白粉中的某些物质结合后,由疏水性红曲橙、黄色素变为亲水性红曲红色素,因此TLC图谱上只有点样的初始出发线上的红色素条带,而看不到其他色素条带。由于谷物粉和蛋白粉都含有蛋白质且蛋白粉蛋白含量更高,因此猜测红曲橙、黄色素能与蛋白质结合变为亲水性红曲红色素。由此可见红曲橙、黄色素产品应用于含有蛋白的物料中会变成红色,但若生产水溶性红曲红色素可以考虑在处理发酵液过程中加入适量蛋白粉,促进其他色素转化为亲水性红曲红色素。
表2 薄层层析分离数据
Table 2 Rf data of the pigments in the TLC
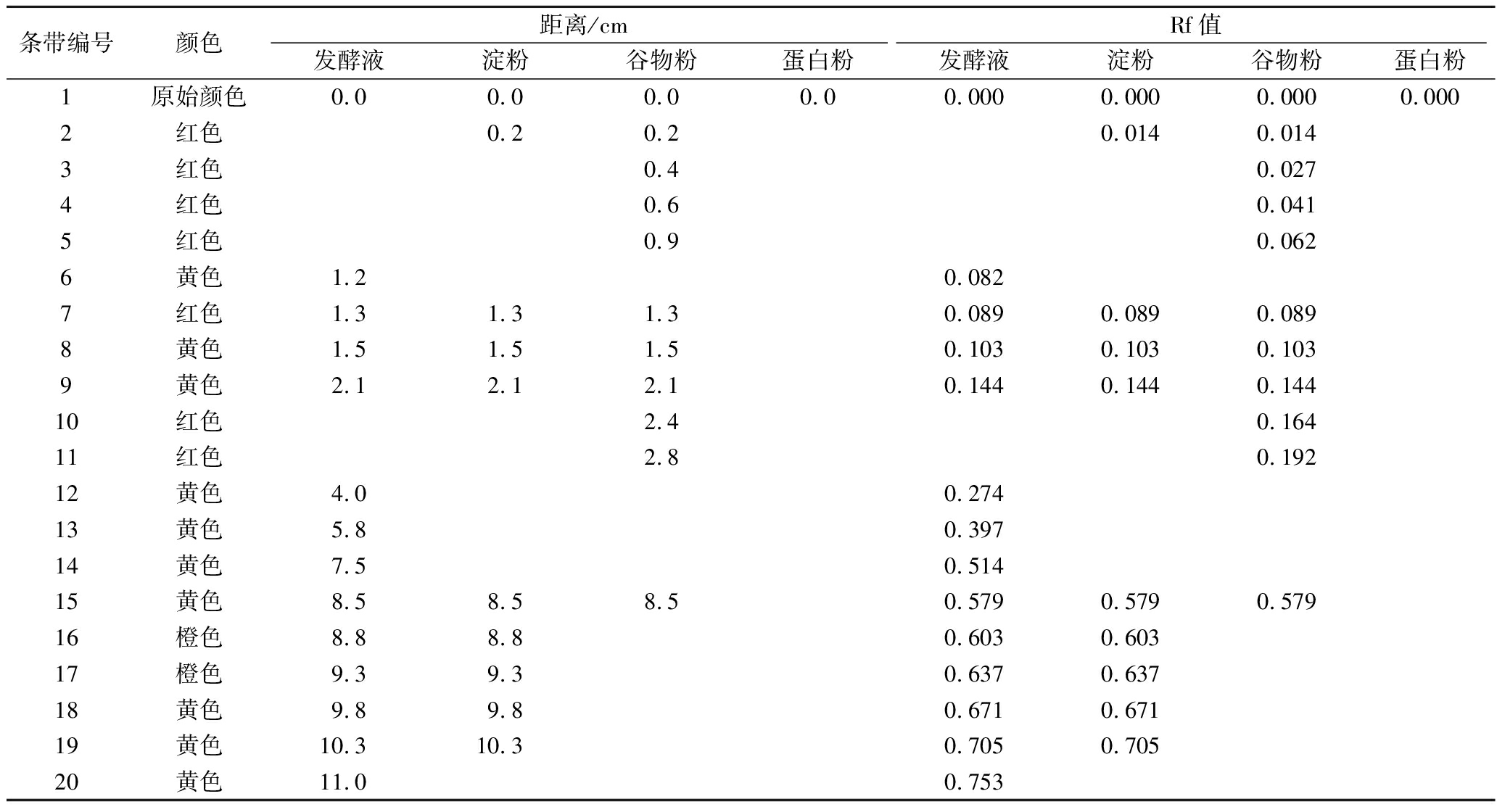
条带编号颜色距离/cmRf值发酵液淀粉谷物粉蛋白粉发酵液淀粉谷物粉蛋白粉1原始颜色0.00.00.00.00.0000.0000.0000.0002红色0.20.20.0140.0143红色0.40.0274红色0.60.0415红色0.90.0626黄色1.20.0827红色1.31.31.30.0890.0890.0898黄色1.51.51.50.1030.1030.1039黄色2.12.12.10.1440.1440.14410红色2.40.16411红色2.80.19212黄色4.00.27413黄色5.80.39714黄色7.50.51415黄色8.58.58.50.5790.5790.57916橙色8.88.80.6030.60317橙色9.39.30.6370.63718黄色9.89.80.6710.67119黄色10.310.30.7050.70520黄色11.00.753
2.3 温度对红曲橙、黄色素稳定性的影响
温度也是发酵液储存及处理过程中一个必需考虑的因素。将发酵液分别置于20、40、60、80、100 ℃的水浴锅中处理2 h,研究温度对红曲橙、黄色素稳定性的影响。
从图6可以看出,当温度不高于80 ℃时,红曲橙、黄色素残存率在95%以上,说明2种色素可耐受80 ℃高温。但温度达到100 ℃时,红曲橙、黄色素残存率低于90%。因此红曲橙、黄色素发酵液在储存及处理过程中温度尽量低于80 ℃。
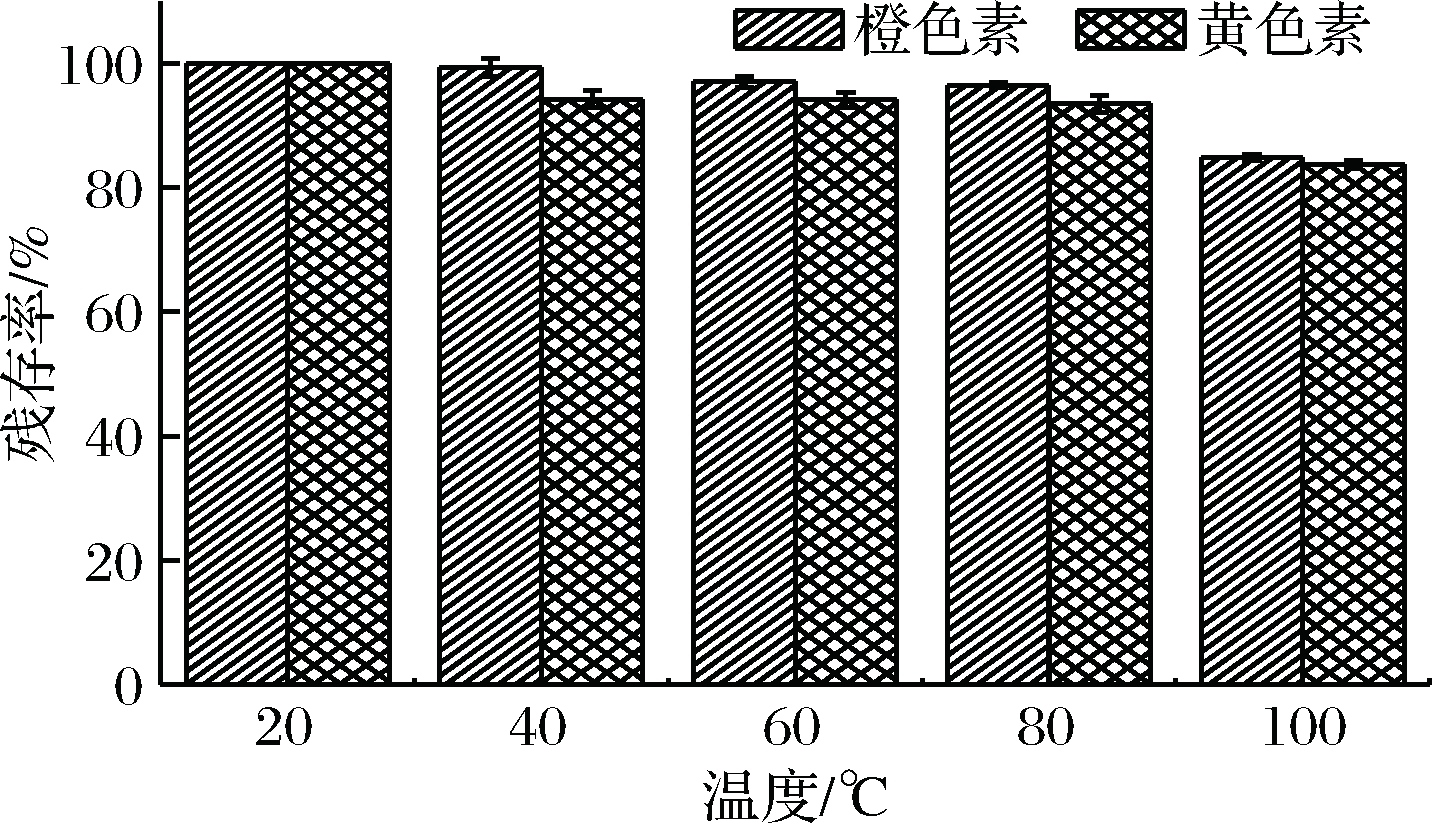
图6 温度对红曲橙、黄色素残存率的影响
Fig.6 Effect of different temperatures on monascorubrin
and monascin from Monascus
3 结论
红曲橙、黄色素对光照较为敏感,因此在生产及储存过程中都应避免日光直接照射。此外红曲橙、黄色素发酵液可以与谷物粉及蛋白粉中的某些蛋白结合而发生结构上的改变,因此在生产及应用过程中应避免与蛋白类物质接触。红曲橙、黄色素虽然耐热性良好,但在仍应避免加工温度高于80 ℃。影响红曲橙、黄色素稳定性的因素较多,在后续研究过程中,期望能对影响红曲橙、黄稳定性的因素进行更为全面的探究,同时期望能借助更为精密的仪器对色素的变化过程进行监测,探索转化机理,增加认知,以便更好地开发利用红曲橙、黄色素。
[1] 田园.微生物和铵盐对红曲色素代谢合成的影响及其机理的初步研究[D].长沙:中南林业科技大学,2016.
[2] 刘青青,任剑波,刘向阳,等.浅谈色素红曲的应用及其发展[J],酿酒科技,2015(8):79-82.
[3] 张庆庆,张帝,汤文晶,等.水溶性和醇溶性红曲色素的光稳定性[J],食品科学, 2015,36(1):94-98.
[4] 刘立增,董世瑞,连喜军,等.马铃薯淀粉对红曲红色素的吸附及光褪色与热稳定性研究[J].食品工业科技,2015,36(6):82-85.
[5] 陈发贵,刘敏,熊燕,等.青稞红曲色素稳定性影响因素的分析[J],食品科技, 2016,41(2).300-303.
[6] LIH R,DU Z W, ZHANG J R.Study on the stability of Monascus pigment[J].Food Science,2003,24(11):59-62.
[7] 邓加聪,杜可,韩艳丽,等.红曲霉液态发酵产色素及稳定性的研究[J].中国调味品,2019,44(10):26-30.
[8] ZHANG X W,WANG J H,CHEN M H,et al.Effect of nitrogen sources on production and photostability of Monascus pigments in liquid fermentation[J].Ieri Procedia,2013,(5),344-350.
[9] 张慧娟,朱效刚,毛鹏,等.溶氧对红曲菌发酵生物合成橙色素的影响[J].食品科学技术学报,2015,33(6):72-77.
[10] 张薄博,管宏伟,陈磊,等.红曲黄色素的多样性及产品标准的讨论[J].食品与发酵工业,2018,44(12):261-266.
[11] 侯敏.金华及其周边地区红曲中红曲菌种类和红曲色素的研究[D].金华:浙江师范大学,2015.
[12] 彭真,吴振强,李运南,等.红曲黄色素固态发酵条件的研究[J].现代食品科技,2009,25(6):669-673.
[13] 蒋琼凤,陈莫林,袁志辉.红曲米中红曲色素的提取及稳定性研究[J].中国调味品,2014,39(9):1-3;10.
[14] HOU J H,YAN Y,Xu X B,et al.Optimization of fermentation conditions and mensuration of antimicrobial activities of Monascus pigment[J].Journal of Shanghai Jiaotong University, 2009,27(4):363-367.
[15] 周波,钟海雁,林亲录.食用植物油对红曲黄色素合成代谢的影响[J].食品工业科技,2012,33(13):92-95;99.
[16] 李瑞杰,谢玉梅,何思琴,等.液态发酵生产水溶性红曲黄色素的条件优化[J].中国酿造,2016,35(11):73-77.
[17] 许赣荣,黄艳,毛鹏,等.一种偶联原位发酵萃取红曲橙色素的双液相发酵方法:中国,CN201410117001.4[P].2015-09-30.
[18] 张薄博,吕俊,何鑫,等.一种促进红曲菌液态发酵生产红曲橙色素的方法:中国,CN201710071293.6[P].2017-05-31.
[19] XIONG X,ZHANG X,WU Z,et al.Accumulation of yellow Monascus pigments by extractive fermentation in nonionic surfactant micelle aqueous solution[J].Applied Microbiology & Biotechnology,2015,99(3):1 173-1 180.
[20] 张慧娟.红曲橙色素的研究[D].无锡:江南大学,2006.
[21] 代春华,邓思珊,甘纯玑.红曲黄色素的分离、纯化及光稳定性探讨[J].中国食品学报,2004,4(3):63-67.
[22] 杨强,王成涛.红曲黄色素的稳定性研究[J].食品工业,2016,37(3):38-40.