果胶是一种酸性多糖,由超过65%的半乳糖醛酸组成,还含有一些中性糖以及少量的蛋白质和酚类物质。果胶按照其酯化度的不同分为高甲氧基果胶和低甲氧基果胶,自然界中绝大部分果实中存在的果胶都是高甲氧基果胶(即高脂果胶)[1]。目前国际上商品类果胶主要来源于柑橘皮和苹果渣。近年来也开发出甜菜果胶、柠檬皮果胶等新来源果胶。百香果又名西番莲,是我国主要的热带水果之一,果实由30%的果汁、50%~55%的果皮及5%~8%的种子组成[1-2],果皮占比较大且含有丰富的果胶物质,若将其加以利用,则可变废为宝。
酸性乳饮料(acidified milk drink,AMD)是非常受欢迎的蛋白质类饮料之一,为了获得更好的口感,其pH范围一般控制在4.7左右,但乳液中的酪蛋白容易发生聚集和沉淀,影响自身的口感。因此,在生产过程中常利用稳定剂抑制这种聚集沉淀。果胶为常见的乳品稳定剂,可以与酪蛋白产生静电相互作用和空间位阻效应,从而有效地防止蛋白质聚集沉淀以及乳清分离[3-5]。然而果胶亲水性高、疏水性低对酸性乳饮料的稳定效果有限,利用食品工业级的酯化衍生法来提高果胶分子的疏水性,有利于促进果胶在酸性乳品饮料的稳定效果。
本研究提取百香果果皮中的果胶(passion fruit pectin,PFP),进而制备含疏水性辛烯基琥珀酸酐(octenyl succinic anhydride,OSA)基团的果胶衍生物,以市售的柑橘果胶(citrus pectin,CP)作为参考,探讨3种果胶样品的添加对酸性乳饮料酸化过程中的稳定效果,确定较适宜的稳定条件和果胶种类。
1 材料与方法
1.1 材料与试剂
百香果果皮,云南猫哆哩集团;柑橘果胶(JMJ-YM150-H),美国CPKelco公司;脱脂乳粉,上海恒天然有限公司;HCl、OSA、HNO3、苯酚、葡萄糖酸-δ-内酯(glucono-delta-lactone, GDL)、异硫氰酸荧光素(fluorescein isothiocyanate isomer, FITC)等试剂采购于上海源叶生物技术有限公司;乙醇、NaOH等试剂,上海泰坦股份科技有限公司。
1.2 主要仪器与设备
PL2002型分析天平,瑞士Mettler-Toledo公司;RRH-A1000高速多功能粉碎机,上海缘沃工贸有限公司;OSB-2100旋转蒸发仪,日本EYELA公司;冷冻干燥机,美国Labconco公司;SP-752冷冻离心机,美国贝克曼库尔特公司;真空干燥箱,上海一恒科学仪器有限公司;T25数显型分散机,德国IKA公司;马尔文zeta电位仪Nano ZS,英国马尔文公司;173 plus多角度激光光散射粒径分析仪,美国Brookhaven公司;Discovery HR-3流变仪,美国TA仪器公司;A1R型激光共聚焦显微镜,日本尼康公司。
1.3 实验方法
1.3.1 百香果果胶的提取与酯化度测定
将百香果果皮烘干,磨粉,过120目筛,称取粉末按料液比1∶20(g∶mL)加入去离子水,搅拌溶解,用1 mol/L HNO3调节pH为2.1,静置30 min,85 ℃水浴加热3 h得到粗提液。粗提液经8 000 r/min离心15 min,得到上层提取液,蒸发浓缩至1/3~1/2体积,缓慢向浓缩液中加入2倍体积的95%乙醇(体积分数),静置1 h,8 000 r/min离心15 min得到下层沉淀,用无水乙醇脱水,搅拌细碎化,4层纱布过滤,沉淀物置于50 ℃真空干燥箱72 h得到粗提果胶。然后将粗提果胶复溶,用3倍体积95%乙醇醇沉,经离心后再细碎化以及干燥,最终得到百香果果胶。
酯化度采用GUZEL等[6]的滴定法进行测定。
1.3.2 果胶分子修饰及取代度测定
根据ZHAO等[7]的方法,称取10 g PFP样品,加入90 mL去离子水,60 ℃搅拌溶解2 h,用0.5 mol/L NaOH调节pH至8.5,按照m(OSA)∶m(PFP)=1∶7的比例缓慢加入OSA,期间维持溶液pH在8.5附近,反应1 h后,调节pH至6.0终止反应,用截留量8 000~14 000 Da透析袋于4 ℃下透析48 h,浓缩后冻干得到果胶衍生物POSA。
取代度采用滴定法[8]。称取2 g POSA样品溶解于25 mL含有体积分数90%异丙醇配制的2.5 mol/L HCl中,离心过滤,残留物用90%异丙醇洗涤3次,干燥去除多余的异丙醇,将产物溶解于300 mL去离子水中,加入几滴酚酞,用0.1 mol/L NaOH进行标定,记录NaOH消耗体积为V1,以PFP为空白组,得到NaOH消耗体积V0,按公式(1)计算取代度:
取代度![]()
(1)
式中:V0,空白组NaOH消耗体积,mL;V1,样品组NaOH消耗体积,mL;c,NaOH浓度,mol/L;m,样品质量, g。
1.3.3 酸化乳饮料制备
取脱脂乳粉配制100 g/L的脱脂乳,室温搅拌1 h,静置2 h,90 ℃加热灭菌15 min,冷却至室温,分别移取50 mL于容器中,分别加入2 g/L的PFP、POSA或CP,搅拌溶解,乳液以8 000 r/min均质2 min后分别加入0、5、10、14和16 g/L的GDL,40 ℃保温4 h,使乳液pH分别达到6.5、5.48、4.68、4.25和4.1,4 ℃过夜,使用前400 r/min搅拌15 min,使样品恢复至室温。
1.3.4 ζ-电位测定
使用配备有4 mol/L He/Ne激光器的Malvern Zetasizer Nano ZS装置在633 nm处进行ζ-电位测定。测定前,样品溶液用对应pH值去离子水稀释10倍。仪器参数设置为等待时间120 s,平衡时间180 s,在室温下使用Zetasizer软件进行数据收集与分析。
1.3.5 粒径测定
使用173 plus多角度激光散射粒径分析仪对样品溶液的光散射特征进行分析。测定前,样品溶液用对应pH值的去离子水稀释10倍,过0.45 μm滤膜。仪器参数设置:测试角度90°;温度25 ℃;平衡时间300 s;检测时间120 s。
1.3.6 流变学测定
使用配备有Peltier温度控制器和恒温循环水浴装置的Discovery HR-3流变仪和不锈钢平板(直径:40 mm;间隙:1 000 μm)进行流变参数测试。为了避免干燥引起的误差,采用蒸馏水密封蒸汽屏蔽。采用TRIOS软件对样品的实验数据进行采集和分析。
静态剪切流变测试:取1.5 mL样品置于平板上,于温度25 ℃下剪切速率在0.01~1 000 s-1范围内测试表观黏度随剪切速率的变化。
动态黏弹性测试:在25 ℃,2%应变下(线性黏弹区内),测定其弹性模量(G′)和黏性模量(G″),扫描范围:0.1~100 rad/s。
1.3.7 微观分析—激光共聚焦测定
用1 mg/mL FITC乙醇溶液对AMD中蛋白质进行染色,FITC终浓度为40 μg/mL。将染色好的AMD置于单凹片上,盖上载玻片,使用配备有Ne/Ar激光器的激光共聚焦显微镜(confocal laser scanning microscope, CLSM)进行测定。测定条件:激发波长488 nm,发射波长范围500~550 nm,放大倍数400倍。
2 结果与分析
2.1 果胶的提取与分析
由表1可以看出,百香果果胶的平均得率为10.59%,稍低于KULKARNI等[9]报道的果胶提取率,分子修饰之后的POSA果胶取代度为0.016。PFP和POSA果胶的酯化度平均为84.9%~87.6%,大于CP的76.8%,表明3种果胶都属于高甲氧基果胶(酯化度>50%)。
表1 果胶样品的得率、取代度与酯化度
Table 1 Yields, degree of substitution, and degree of
esterification of pectin samples
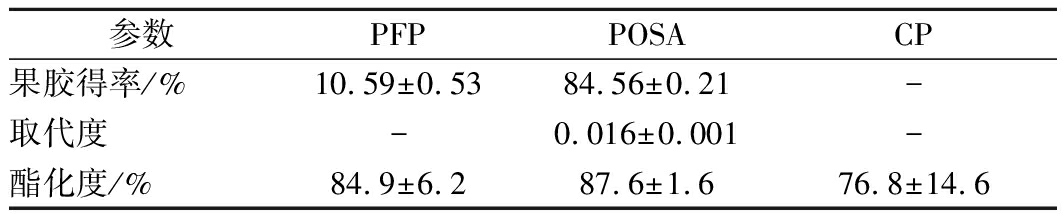
参数PFPPOSACP果胶得率/%10.59±0.5384.56±0.21-取代度-0.016±0.001-酯化度/%84.9±6.287.6±1.676.8±14.6
2.2 三种果胶对酸化过程中ζ-电位的影响
由于果胶是酸性多糖,乳液中主要的蛋白质酪蛋白也是带电基团,通过ζ-电位来表征分子之间的相互作用以及表面电荷密度,ζ-电位的绝对值越大说明稳定效果越好[10-11]。从图1可以看出,当未添加果胶的空白组AMD在pH 6.5到4.1,ζ-电位值的绝对值逐渐变小,并在酸性pH<4.5时由负转正[11],说明体系在酸化过程逐渐失稳。当体系中加入PFP、POSA和CP时,在pH>5.5时对ζ-电位值没有明显影响,这可能是由于此时的pH值与果胶溶液本身的pH值相近所致,随着体系pH降低至酪蛋白等电点(pI 4.7)附近,加入果胶的3个体系ζ-电位值增大,说明果胶吸附在蛋白质的表面,改变了表面电荷密度,与溶液中的阴离子多糖产生静电排斥,阻止了大颗粒聚集物的形成。实验表明,3种果胶均具有稳定效果,且在pH 4.7附近,PFP和POSA的稳定效果优于CP,在pH<4.7时,PFP和POSA乳体系的ζ-电位值增长较快,说明稳定效果变差。

图1 三种果胶对脱脂乳悬浮液酸化过程中
ζ-电位的影响
Fig.1 Effects of PFP, POSA and CP on ζ-potential during
acidification of skimmed milk dispersions
2.3 三种果胶对酸化过程中粒径大小的影响
因果胶为酸性阴离子多糖,可吸附在脱脂乳中酪蛋白的表面,运用动态光散射法测量聚合物的有效粒径,进而评估分子间的相互作用[12-13]。由图2可知,空白组AMD的有效粒径在pH 6.5~4.68范围内逐渐增大,并在pH 4.68时达到最大值1 803 nm;当pH继续降低,有效粒径降低。添加PFP的乳液在偏中性的条件下未发现明显的结合,在酸化至pH 4.68附近时,相对于空白组,PFP组体系的粒径较小,在pH<4.68时则明显增大了体系的粒径,说明PFP在此范围内稳定效果不佳,这一点与电位分析结果一致。而POSA从偏中性开始与体系中蛋白质发生结合,并在pH 4.68时明显减小了体系粒径,随着pH进一步降低,这种稳定效果逐渐变差。商品果胶CP对抑制大颗粒形成的效果与PFP类似,在pH<4.68的范围内,POSA呈现更好的稳定效果。综上,分子修饰之后的果胶POSA有着更好的稳定效果,但在酸化后期的稳定效果较差。

图2 三种果胶对脱脂乳悬浮液酸化过程中
有效粒径的影响
Fig.2 Effect of PFP, POSA and CP on effective particle
size during acidification of skimmed milk dispersions
2.4 三种果胶对酸化过程中流变性质的影响
流变性是研究物质在力的作用下的流动和变形,是果胶的重要属性之一。当果胶作为稳定剂加入到乳饮料中,黏度是评价果胶效果的重要指标[14-15]。图3为PFP、POSA和CP对脱脂乳酸化过程中表观黏度随剪切速率变化的影响。

a-AMD;b-PFP-AMD;c-POSA-AMD;d-CP-AMD
图3 PFP、POSA和CP对脱脂乳悬浮液酸化过程中表观黏度的影响
Fig.3 Effects of PFP, POSA and CP on apparent viscosities of skimmed milk dispersions during
acidification as a function of shear rate
图3-a中,未添加果胶的乳液在酸化过程中表现出明显的剪切稀化行为,其中在pH 4.68时剪切变稀更为明显,且对应的黏度也较低,这与体系失稳有着必然的联系[16]。而添加PFP、POSA和CP后,明显抑制了乳液在酪蛋白等电点时的不稳定性,宏观表现为表观黏度对剪切速率依赖性降低。其中修饰之后的果胶POSA有着更低的剪切速率依赖性,在LIU等[17]的研究中也发现类似的现象。而添加PFP和CP的乳液在pH 4.68时有着相对较高的黏度,这可能是因为PFP和CP与乳液中蛋白质颗粒之间有着更强的分子缠绕,使得分子间相对流动减弱,表现为表观黏度增大[18]。
为了模仿人体口腔环境,选取剪切速率为40 s-1的表观黏度[19]作图。从图4可以看出,AMD组在pH 4.68时表观黏度下降到最低,随着酸化的进行,表观黏度有明显的升高。3种果胶的加入明显增加了乳液在pH 4.68时的表观黏度,PFP在pH<4.68的范围内有很好的稳定性,而POSA在pH>4.68时对乳液的表观黏度的稳定性较好,随着pH的进一步降低,乳液的表观黏度明显上升。CP在酸化开始时显著增加了体系的表观黏度,在pH≤4.68的范围,乳液的表观黏度呈现上升趋势。说明PFP和CP在pH<4.68的范围内对乳液的表观黏度有较好的稳定性,分子修饰之后的果胶POSA在偏中性条件下对表观黏度的稳定效果较好。
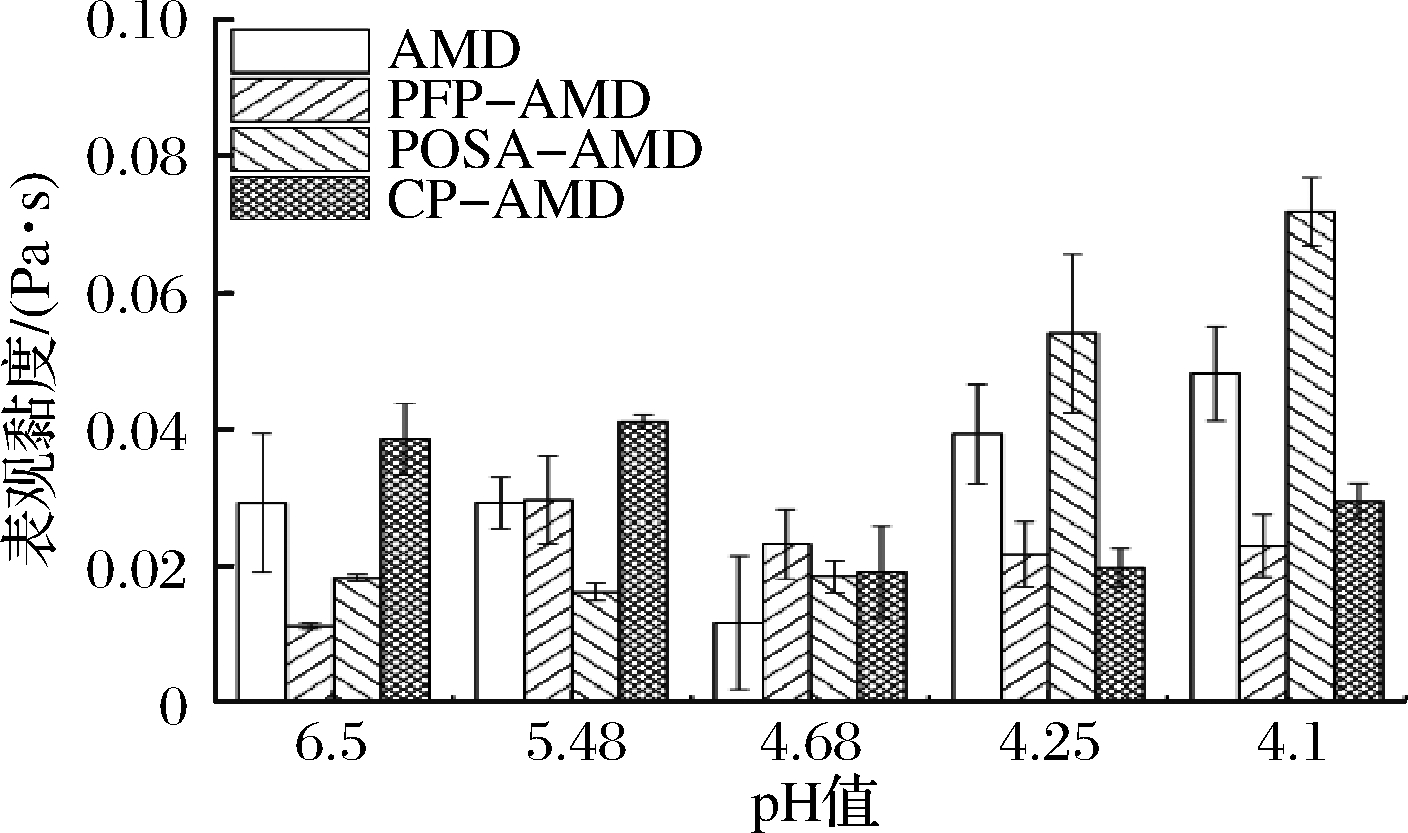
图4 脱脂乳-果胶系统在剪切速率40 s-1下的表观
黏度随pH值的变化
Fig.4 Changes in apparent viscosity at a shear rate of
40 s-1 with pH value for skim milk-pectin systems
物质的黏弹特性反映着溶液的凝胶性质,同时与胶体的实际生产应用有着很大的关联性。储能模量(G′)代表能量贮存而可恢复的弹性性质,损耗模量(G″)代表流体流动的黏性性质。从图5可以看出,4种乳体系下的G′和G″均表现出频率依赖性,在pH 4.68时,AMD、PFP-AMD和CP-AMD体系的G′<G″,这与JENSEN等[20]研究的高脂果胶对酸化脱脂乳的稳定作用的结果一致,而POSA-AMD体系在>15 rad/s的范围G′>G″,表现出弹性特征。与空白组AMD相比较,PFP和POSA组增大了其在pH 4.25时的模量值,在高频区表现出G′>G″的类流体性质,说明PFP和POSA在pH<4.7时对体系的凝胶性质有着很大的影响,而含CP的乳体系则表现出在偏中性的环境下有利于G′和G″值的提高,当pH<4.7时有着相对较高的模量值,但与空白组AMD比较,这种数值变化较小。
综合稳态剪切黏度(图3)和动态黏弹性模量(图5)的分析,可以看出CP对乳体系下的流变性质影响较小,而PFP和POSA则增大了乳体系的抗剪切能力以及高频区的凝胶性质,这可能是由于PFP和POSA与乳液中蛋白质的相互作用更强,分子之间的缠绕更为紧密,形成的凝胶网络不易发生“滑动”所致[21]。
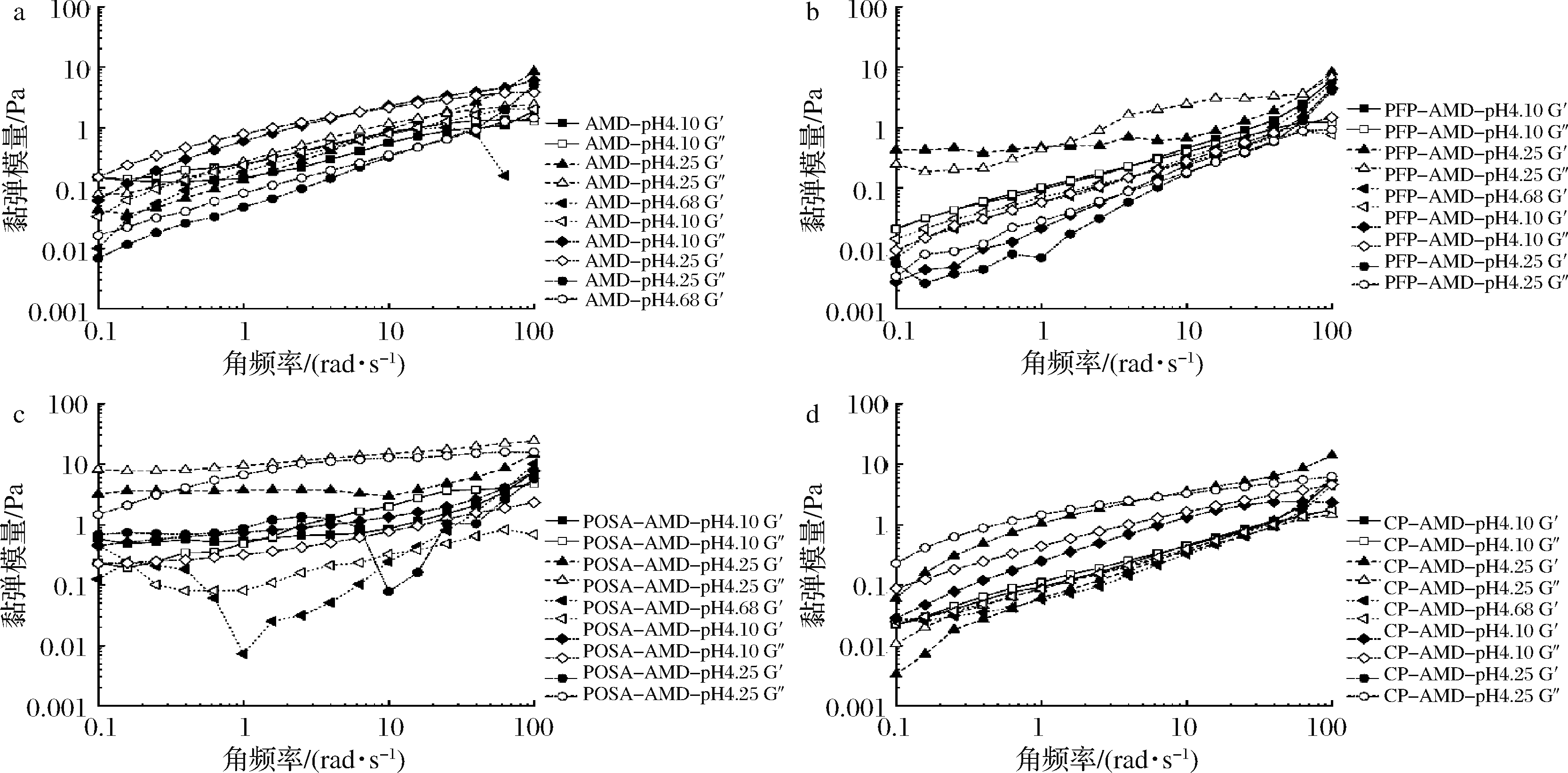
a-AMD;b-PFP-AMD;c-POSA-AMD;d-CP-AMD
图5 三种果胶对脱脂乳悬浮液酸化过程中动态黏弹性模量的影响
Fig.5 Effects of PFP, POSA and CP on dynamic moduli during acidification of skimmed milk dispersions
2.5 三种果胶对酸化过程中的微观结构影响
通过对体系中蛋白质进行荧光标记,在一定的激发波长和发射波长下,用激光共聚焦显微镜观察,可以更加直观地反映果胶对乳体系的稳定性作用。从图6可以看出,空白组AMD可以清楚的看出大面积的聚集,且聚集体呈絮状,较为厚实,这与JORDAN等[22]的研究结果一致。而添加PFP的乳体系表现为局部较为细小的聚集。分子修饰之后的果胶POSA呈现出分布均匀但较为分散的聚集体,这可能是由于OSA具有一定的疏水性质[23-24] 导致的。而商品果胶CP在pH 4.68时表现出局部的、松散絮状的大颗粒聚集。因此,从微观图像看,PFP抑制乳体系中大颗粒聚集的效果要优于POSA, 而POSA又稍优于CP。
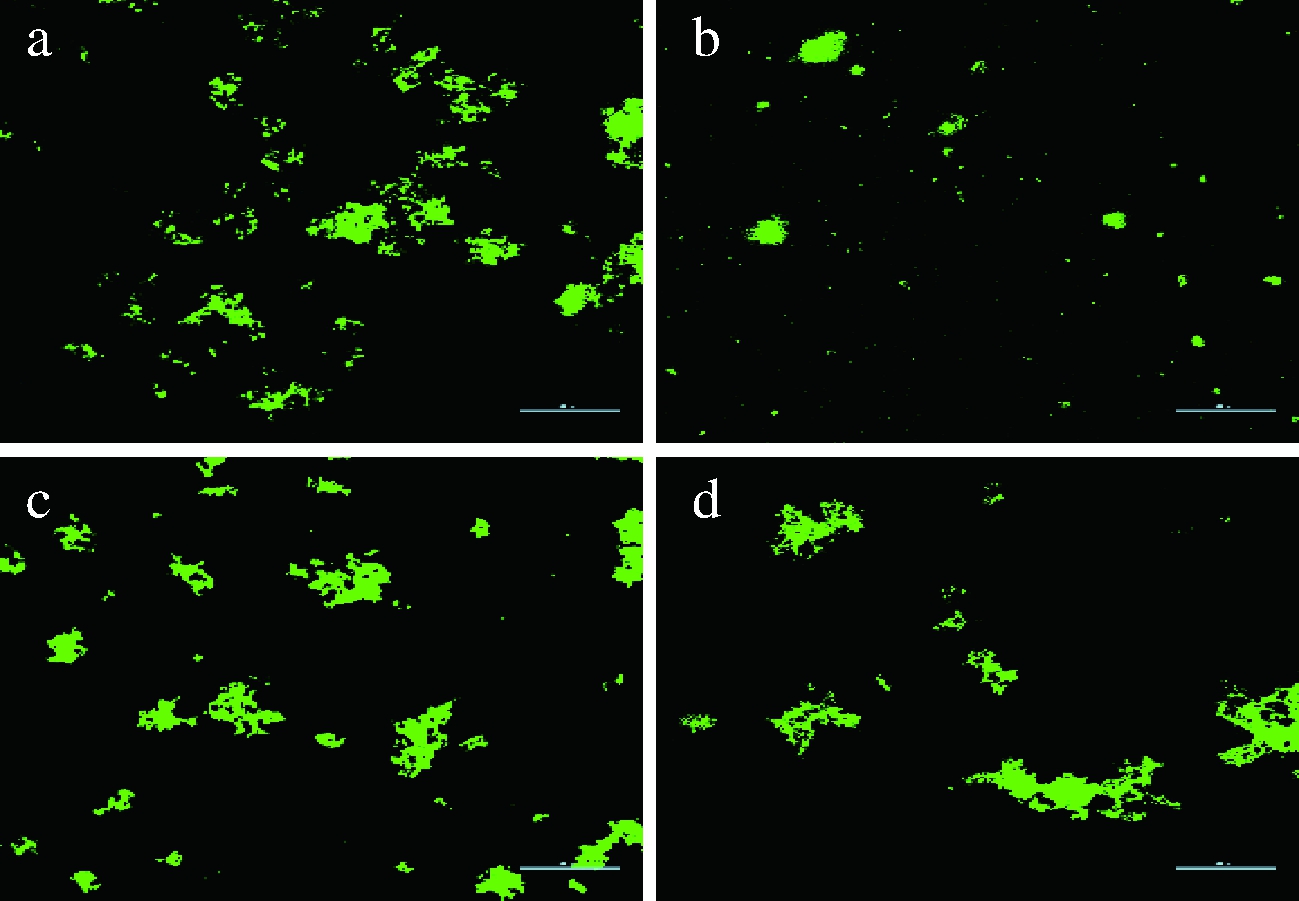
a-AMD;b-PFP-AMD;c-POSA-AMD;d-CP-AMD;标尺为50 μm
图6 三种果胶对脱脂乳悬浮液在pH 4.68时的
CLSM图像
Fig.6 CLSM images of skimmed milk dispersions with PFP,
POSA and CP at pH 4.68
3 结论
通过测定ζ-电位、粒径、流变学特性以及微观分析,研究了百香果果胶PFP,分子修饰后的果胶POSA以及商品类柑橘果胶CP对脱脂乳酸化过程中的稳定效果。PFP、POSA和CP在添加量为2.0 g/L下,均提高了脱脂乳体系在酪蛋白等电点pH 4.7附近的ζ-电位绝对值,降低了有效粒径。但是随着pH继续下降,PFP和POSA体系下的稳定效果变差。另一方面,PFP和POSA提高了脱脂乳体系在酸化过程的抗剪切能力,以及动态黏弹模量(G′、G″),改变体系的凝胶性质。通过CLSM图像分析可以看出PFP和POSA均具有较好的抑制乳液中聚集物的形成效果,具有发展成商品类果胶的潜质。
[1] 朱文, 郑荣珍, 肖开恩,等. 以西番莲果皮为原料制备LM-果胶[J]. 食品与发酵工业, 2001, 27(5):47-49.
[2] CORREA J V, ZAPATA A D. Enzymatic extraction of pectin from passion fruit peel (Passiflora edulis f. flavicarpa) at laboratory and bench scale[J]. LWT-Food Science and Technology, 2017(80):280-285.
[3] GLAHN P E. Hydrocolloid stabilisation of protein suspensions at low pH[J]. Progress in Food and Nutrition Science, 1982(6):171-177.
[4] 杜柏桥. 羟甲基纤维素钠(CMC)与酪蛋白的相互作用及其稳定酸性乳体系机理的研究[D]. 上海:上海交通大学, 2008.
[5] BOULENGUER P, LAURENT M A. Comparison of the stabilisation mechanism of acid dairy drinks (ADD) induced by pectin and soluble soybean polysaccharide[M]. Advances in Pectin and Pectinase Research, Springer Netherlands, 2003:467-480.
[6] GUZEL M, AKPINAR O. Valorisation of fruit by-products: Production characterization of pectins from fruit peels[J]. Food and Bioproducts Processing, 2019(115):126-133.
[7] ZHAO R X, QI J R, LIU Q R, et al. Fractionation and characterization of soluble soybean polysaccharide esterified of octenyl succinic anhydride and its effect as a stabilizer in acidified milk drinks[J]. Food Hydrocolloids, 2018(85):215-221.
[8] SAV A K, FULE R A, ALI M T, et al. Synthesis and evaluation of octenyl succinate anhydride derivative of fenugreek gum as extended release polymer[J]. Journal of Pharmaceutical Investigation, 2013(43):417-429.
[9] KULKARNI S G, VIJAYANAND P. Effect of extraction conditions on the quality characteristics of pectin from passion fruit peel (Passiflora edulis f. flavicarpa L.)[J]. LWT-Food Science and Technology, 2010(43):1 026-1 031.
[10] KINZL M, REICHMANN K, ANDREJS L. Electrophoretic deposition of silver from organic PDADMAC-stabilized suspensions[J]. Journal of Materials Science, 2009, 44(14):3 758-3 763.
[11] MIZUNO R, LUCEY J A. Effects of emulsifying salts on the turbidity and calcium-phosphate-protein interactions in casein micelles[J]. Journal of Dairy Science, 2005,88(9):3 070-3 078.
[12] ANEMA S G, KLOSTERMEYER H. Zeta-potentials of casein micelles from reconstituted skim milk heated at 120 ℃[J]. International Dairy Journal, 1996, 6(7):673-687.
[13] KRUIF C G D, TUINIER R. Polysaccharide protein interactions[J]. Food Hydrocolloids, 2001, 15(4):555-563.
[14] 陈倩茜, 张萌, 刘凤霞,等. 高场强超声处理对柑橘果胶分子结构及其功能特性的影响[J]. 食品与发酵工业, 2019, 45(2):87-94.
[15] 刘江, 雷激,等. 稳定剂对调配型酸性乳饮料的稳定性作用[J]. 食品与发酵工业, 2019, 45(17):151-157.
[16] YULIARTI O, MEI K H, TING Z K X, et al. Influence of combination carboxymethylcellulose and pectin on the stability of acidified milk drinks[J]. Food Hydrocolloids, 2019(89):216-223.
[17] LIU Q R, QI J R, YIN S W, et al. Preparation and stabilizing behavior of octenyl succinic esters of soybean soluble polysaccharide in acidified milk beverages[J]. Food Hydrocolloids, 2017(63):421-428.
[18] 侯晓龙. 3种食品胶对酪蛋白酸钠强化型酸化凝乳品质的影响[D]. 武汉:华中农业大学, 2016.
[19] MASSON L M P, ROSENTHAL A, CALADO V M A, et al. Effect of ultra-high-pressure homogenization on viscosity and shear stress of fermented dairy beverage[J]. LWT-Food Science and Technology, 2011, 44(2):495-501.
[20] JENSEN S, ROLIN C, IPSEN R. Stabilization of acidified skimmed milk with HM pectin[J]. Food Hydrocolloids, 2010(24):291-299.
[21] 张倩钰, 徐秋雄, 郑炯,等. 竹笋膳食纤维对高脂果胶流变及其凝胶质构特性的影响[J]. 食品与发酵工业, 2016, 42(7):91-95.
[22] JORDAN A G, THOMAR P, NICOLAI T, et al. The effect of pH on the structure and phosphate mobility of casein micelles in aqueous solution[J]. Food Hydrocolloids, 2015(51):88-94.
[23] CHEN H M, FU X, LUO Z G. Esterification of sugar beet pectin using octenyl succinic anhydride and its effect as an emulsion stabilizer[J]. Food Hydrocolloids, 2015(49):53-60.
[24] MONFREGOLA L, LEONE M, et al. Chemical modification of pectin: Environmental-friendly process for new potential material development[J]. Polymer Chemistry, 2011(2):800-804.