辣椒碱是一种含酚羟基的生物碱,分子式为C18H27O3N,化学名为反-8-甲基-N-香草基-6-壬烯酰胺,又名辣椒素或辣椒辣素,是辣椒中重要的辣椒素类物质,约占辣椒素类物质的69%[1-2],是衡量辣椒品质的重要指标。具有抗氧化、抗菌消炎、镇痛止痒、促进脂肪代谢等多种生理活性[3-7]。
我国是辣椒生产、消费大国[8],我国的辣椒品种及辣椒制品种类繁多。辣椒碱含量已成为评价辣椒品种及其加工品品质的重要指标,在辣椒品种的选育方面、食品行业和制药工业上有重要地位[9]。尤其是辣味卤制品卤煮过程中,需及时检测卤汁中的辣椒碱含量,确保添加适量的辣椒使辣椒碱含量维持在较高的水平,这就迫切需要建立辣椒碱的快速检测方法。
目前,辣椒碱的测定方法主要有感官测定法、比色法、液相色谱法(high performance liquid chromatography,HPLC)、液相色谱质谱法(liquid chromatography-mass spectrometry, HPLC-MS)、气相色谱质谱法(gas chromatography mass spectrometry, GC-MS)、酶联免疫法(enzyme linked immunosorbent assay, ELISA)和电化学(electrochemistry)等方法[10-15]。但是感官测定法受主观和客观因素影响较大;比色法操作繁琐、费时费事、灵敏度和准确度低;HPLC是最常用的检测方法,但所用仪器价格昂贵、成本高、步骤繁琐;酶联免疫法和质谱法同样存在检测成本高、周期时间长的问题,无法满足经济薄弱的中小型企业需求。而电化学的方法具有操作简单、检测效率高、稳定性好等优点[16]。目前关于印刷电极测定辣椒碱的报道大都是将印刷电极进行修饰,如已经被报道的氨基功能化碳微球修饰的印刷电极[17]及聚(4-苯乙烯磺酸钠)功能化石墨修饰丝网印刷电极(screen-printed electrode,SPE)[18],但成本高、步骤繁琐。因此,制备价格低廉、灵敏度高、稳定的未修饰印刷电极在辣椒碱的测定上具有显著的优势。
本研究建立了一种未修饰的印刷电极测定辣椒碱的方法,与HPLC相比,具有方便快速、成本低、检测限低的优点。
1 材料与方法
1.1 材料和仪器
贵州辣椒3批(分别记为A、B、C)、重庆辣椒2批(分别记为A、B)、湖北辣椒2批(分别记为A、B)、四川辣椒、河南辣椒、福建辣椒各1批,由周黑鸭国际控股有限公司提供,共10个批次的干辣椒试样。
辣椒碱(纯度≥98%),上海源叶生物科技有限公司;四氢呋喃、无水乙醇、NaOH、硼酸、H3PO4、乙酸、KOH、醋酸钠、NaH2PO4、Na2HPO4、HCl均为分析纯,国药集团化学试剂有限公司;乙腈、甲醇(色谱级),赛默飞世尔公司。
CHI850D型电化学工作站,上海辰华仪器有限公司;Waters 2695高效液相色谱仪,美国沃特世公司;PHS-3电子精密pH计,上海雷磁仪器厂;丝网印刷电极(三电极系统组成:碳电极为工作电极,Ag/AgCl电极为参比电极,碳电极为辅助电极),武汉市农业科学院环境与安全研究所;DL150-2氮吹仪,杭州佑宁仪器有限公司。
1.2 实验方法
1.2.1 样品的预处理及辣椒碱的提取
样品的预处理:将辣椒样品除蒂除杂后,在60 ℃干燥箱中烘干,粉碎过100目筛,称量、装瓶备用。
干辣椒辣椒碱的提取:参考GB/T 21266—2007并稍作改动[19],称取2.50 g烘干的辣椒样品于100 mL烧杯中,加入V(甲醇)∶V(四氢呋喃)=1∶1混合溶剂25 mL,保鲜膜封口,50 ℃超声提取30 min,过滤,滤渣重复提取2次,合并滤液,60 ℃条件下经真空旋转蒸发仪浓缩,冷却后定容至50 mL,取1 mL滤液用氮气吹干,加体积分数10%乙醇溶解,4 ℃储存,备用。
辣椒卤水的制备:取烘干的辣椒2.60 g,添加蒸馏水186.00 g、玉米油14.00 g,130 ℃加热20 min,得到辣椒卤水。
辣椒卤水辣椒碱的提取:将卤水倒入分液漏斗,取上层油相,降至室温后参考文献[20]提取辣椒碱,取1 mL提取液经氮气吹干后,加体积分数10%乙醇溶解,4 ℃储存,备用。
1.2.2 电化学测定条件的优化
1.2.2.1 乙醇体积分数的优化
选择KCl浓度为40 mmol/L,电解质溶液体系为Britton-Robison(BR)溶液,pH值为2,采用循环伏安(cyclic voltammetry,CV)法研究5%、10%、20%、30%、40%、50%的乙醇体积分数分别对未修饰印刷电极测定辣椒碱的影响。
1.2.2.2 电解质溶液体系的优化
选择KCl浓度为40 mmol/L,用0.20 mol/L的NaOH溶液调节BR缓冲液、用1.00 mol/L的HCl溶液调节CH3COOH-CH3COONa、NaH2PO4-Na2HPO4缓冲液,使3种电解质溶液的pH值均为2,辣椒碱溶液中乙醇体积分数为10%,采用CV法研究浓度均为40 mmol/L的BR、CH3COOH-CH3COONa、NaH2PO4-Na2HPO4电解质溶液分别对未修饰印刷电极测定辣椒碱的影响。
1.2.2.3 pH的优化
选择KCl浓度为40 mmol/L,电解质溶液体系为BR溶液,辣椒碱溶液中乙醇体积分数为10%,采用CV法研究pH值分别为1、2、3、4、5、6对未修饰印刷电极测定辣椒碱的影响。
1.2.2.4 KCl浓度的优化
选择电解质溶液体系为BR溶液,pH值为1,辣椒碱溶液中乙醇体积分数为10%,采用CV法研究KCl浓度分别为10、20、40、80、160 mmol/L对未修饰印刷电极测定辣椒碱的影响。
1.2.3 电化学方法学考察
1.2.3.1 标准曲线和检测限的测定
分别选取浓度为0.80、1.68、3.36、6.73、13.46、26.93、53.86、107.72 μmol/L辣椒碱标液,采用方波伏安法测定辣椒碱氧化峰电流值,以辣椒碱的浓度为横坐标,以峰电流值为纵坐标绘制辣椒碱的标准曲线,根据标准曲线的斜率(k)和空白样测定的标准偏差(standard deviation, SD),求得其检测限(LOD = 3SD/k)。
1.2.3.2 方法精密度和稳定性的测定
选择浓度为107.72 μmol/L的辣椒碱溶液平行测定5次,计算平行测定值的相对标准偏差(relative standard deviation, RSD)来表示精密度大小;选择浓度为107.72 μmol/L的辣椒碱溶液分别在0、12、24、48、60 h测定其峰电流值,计算不同时间测定值的RSD来表示稳定性大小。
1.2.3.3 方法加标回收率的测定
取已知辣椒碱含量的样品9份,分别加入等体积不同浓度的辣椒碱标液,得到加标浓度为10.00、20.00、40.00 μmol/L的加标样品,各浓度下的加标回收率按公式(1)计算:
加标回收率![]()
(1)
1.2.4 HPLC测定辣椒碱
色谱柱为TOSOH TSKgel ODS-100V (5 μm,250 mm×4.6 mm);柱温25 ℃;梯度洗脱条件:V(水)∶V(乙腈)=50∶50,等度洗脱30 min;流速1.0 mL/min;检测波长280 nm;进样量40 μL。
分别配制质量浓度为25、50、100、150、200、250 μg/mL的辣椒碱溶液,现配现用,采用HPLC对各浓度标准溶液进行测定。以辣椒碱的浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.3 数据处理
所有试验均重复3次,经CHI850D型电化学工作站测得的数据,采用SPSS 16.0进行统计分析,显著性水平设置为P<0.05,采用GraphPad Prism绘图,结果以![]() 表示。
表示。
2 结果与讨论
2.1 乙醇体积分数的优化
不同乙醇体积分数对CV法测定辣椒碱的影响如图1所示。辣椒碱溶液中乙醇体积分数为5%时,辣椒碱氧化峰电流最高,随着乙醇体积分数的增加,辣椒碱的氧化峰电流值减小(图1-a),这与SØPSTAD等[21]的研究结果一致,因为乙醇会影响辣椒碱的电荷转移,抑制辣椒碱的氧化还原反应。但辣椒碱作为脂溶性化合物,易溶于有机溶剂,过低的乙醇体积分数会导致辣椒碱的溶解度降低。因此,选择10%乙醇体积分数作为适宜的测定条件。
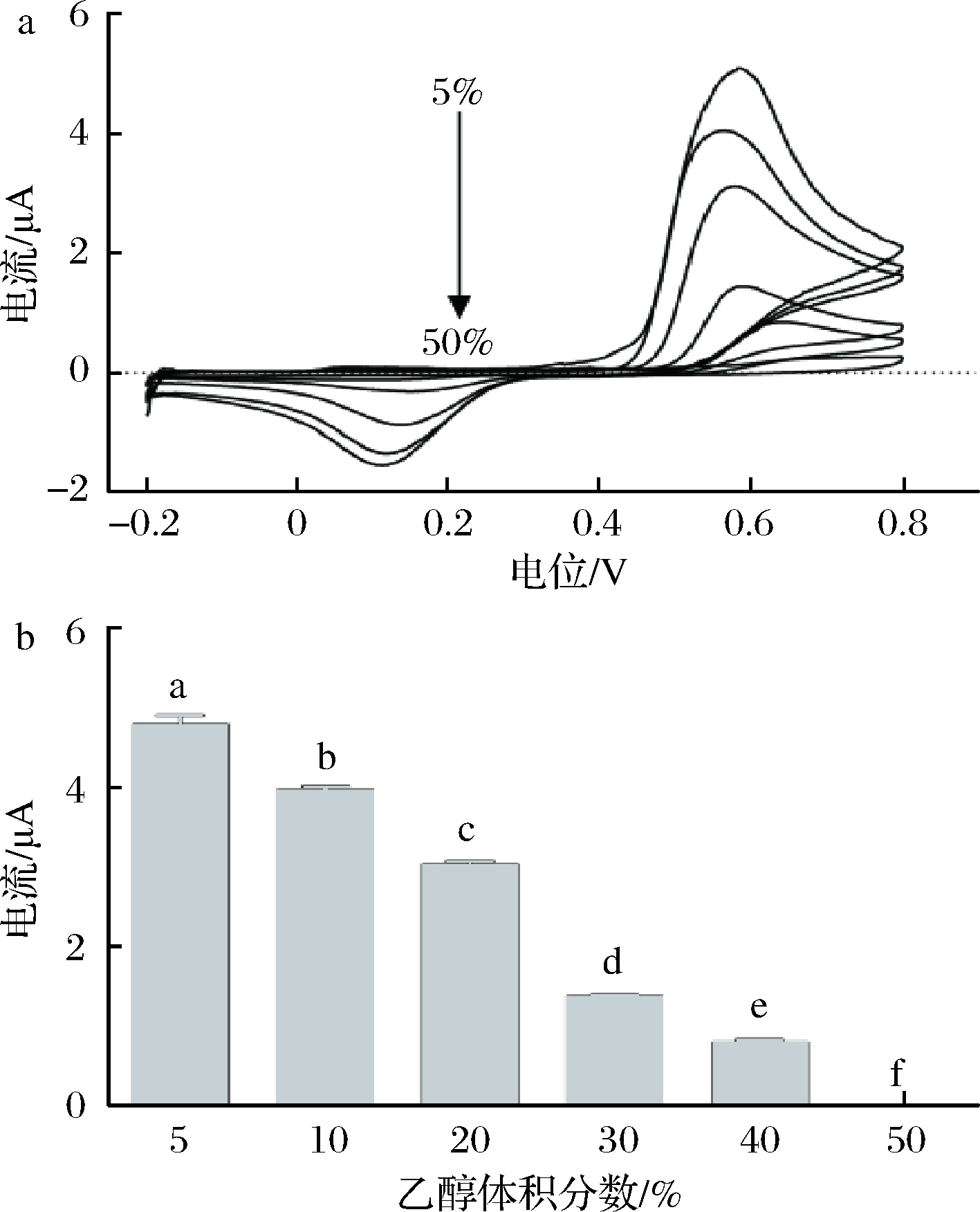
a-不同乙醇体积分数下辣椒碱的CV曲线;
b-不同乙醇体积分数下辣椒碱的的氧化峰电流值
图1 乙醇体积分数对CV法测定辣椒碱的影响
Fig.1 The influence of ethanol concentration on measuring
capsaicin with CV
2.2 电解质溶液体系的优化
不同电解质溶液对CV法测定辣椒碱的影响如图2所示。
由图2可知,BR、CH3COOH-CH3COONa、NaH2PO4- Na2HPO4三种电解质溶液会影响辣椒碱的氧化峰电位值,BR的氧化峰电位值最小(图2-a),但3种电解质溶液对辣椒碱的氧化峰电流值没有显著性影响(图2-b),3种电解质溶液也在多种电极测定辣椒碱电化学方法中使用。因此,BR、CH3COOH-CH3COONa和NaH2PO4-Na2HPO4电解质溶液均可用于此电极测定辣椒碱。
2.3 pH的优化
不同pH对CV法测定辣椒碱的影响如图3所示。由图3可知,pH值为1时,辣椒碱氧化峰电位(图3-a)和电流值(图3-b)最大。随着pH值从1升高至4,辣椒碱的氧化峰电位值和电流值逐渐降低,这是因为pH的升高导致辣椒素分子中酚醛结构的部分去质子化,这与pH对碳微球修饰丝网印刷电极[17]及钯修饰的还原型氧化石墨烯电极[2]测定辣椒碱的电流值影响一致。随着pH值由4升高至6,氧化峰电流值不变,但氧化峰电位继续左移。考虑到灵敏度,选择pH 1作为最佳pH条件。
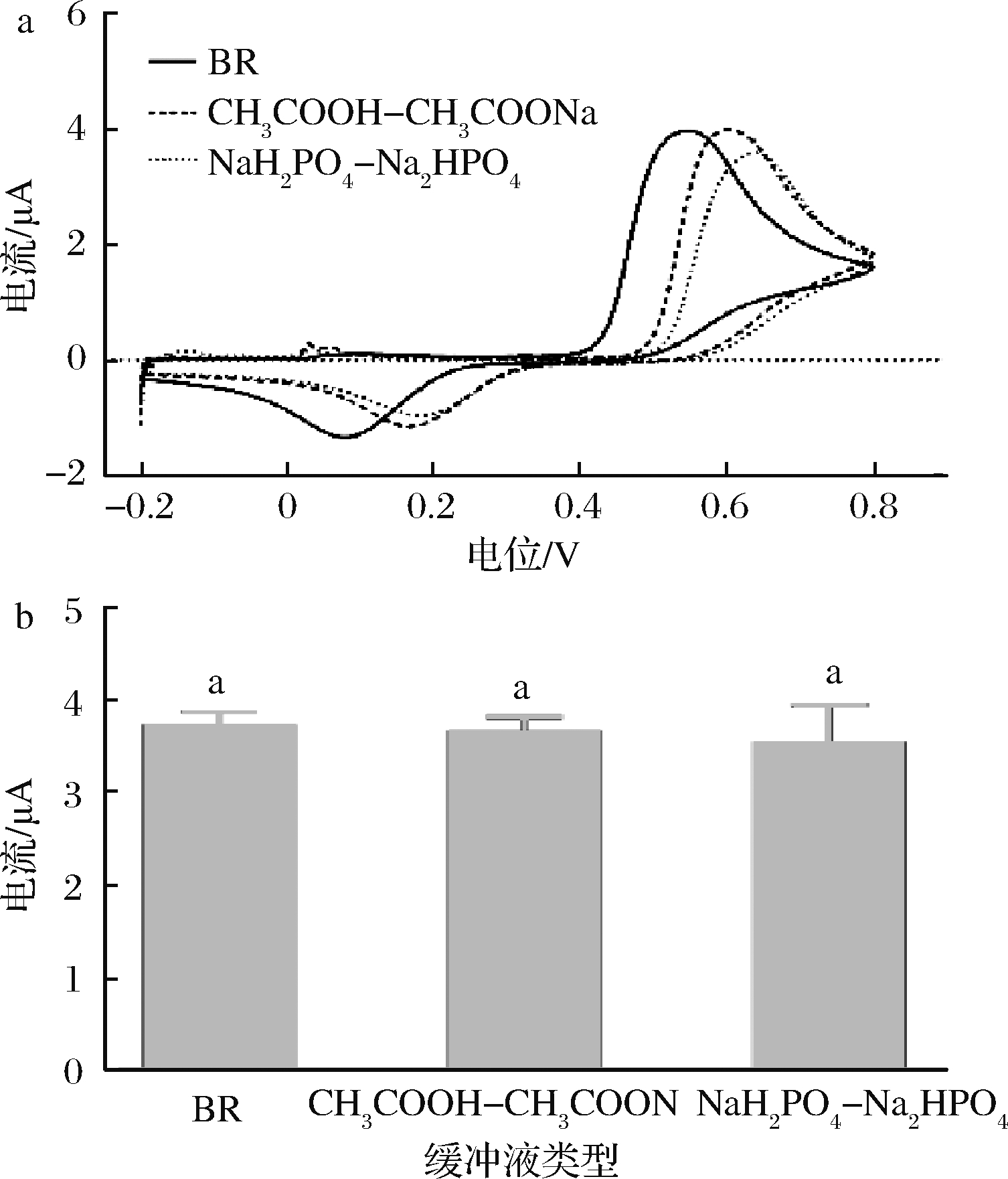
a-不同缓冲溶液下辣椒碱的CV曲线;b-不同缓冲溶液下
辣椒碱的氧化峰电流值
图2 缓冲溶液对CV法测定辣椒碱的影响
Fig.2 The influence of buffer systems on measuring
capsaicin with CV
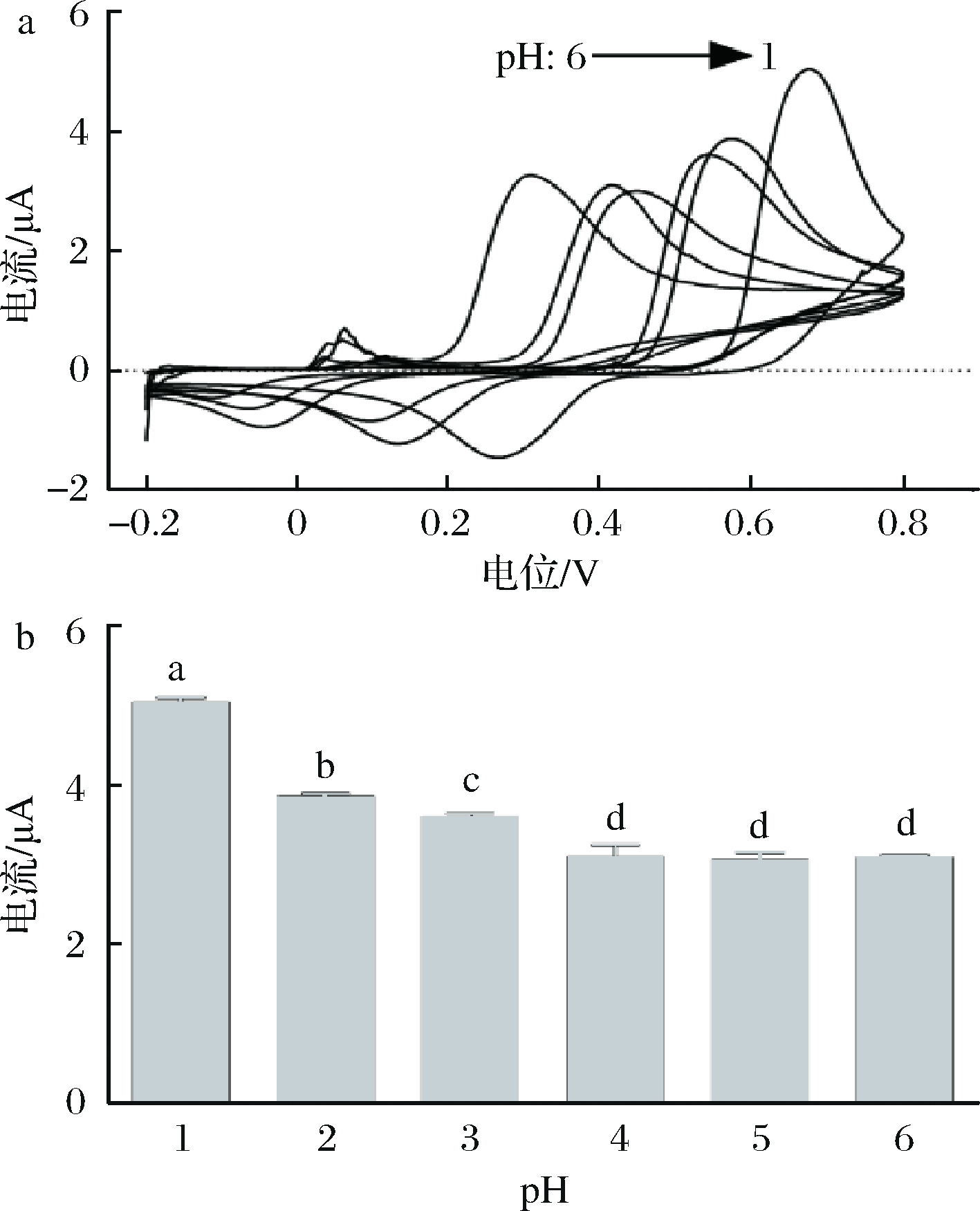
a-不同pH下辣椒碱的CV曲线;b-不同pH下辣椒碱的
氧化峰电流值
图3 pH对CV法测定辣椒碱的影响
Fig.3 The influence of pH values on measuring capsaicin
with CV
2.4 KCl浓度的优化
不同KCl浓度对CV法测定辣椒碱的影响如图4所示。KCl的浓度对辣椒碱的氧化峰电位值没有显著性影响(图4-a),由图4-b可知,当KCl 浓度达到80 mmol/L时,辣椒碱氧化峰电流值趋于稳定, 含80 mmol/L KCl的辣椒碱溶液的氧化峰电流值显著高于含10、20、40 mmol/L KCl的辣椒碱溶液的氧化峰电流值,与含160 mmol/L KCl的辣椒碱溶液没有显著性差异,表明80和160 mmol/L的KCl浓度下电极反应容易发生。因此,选取KCl浓度为80 mmol/L即可满足要求。
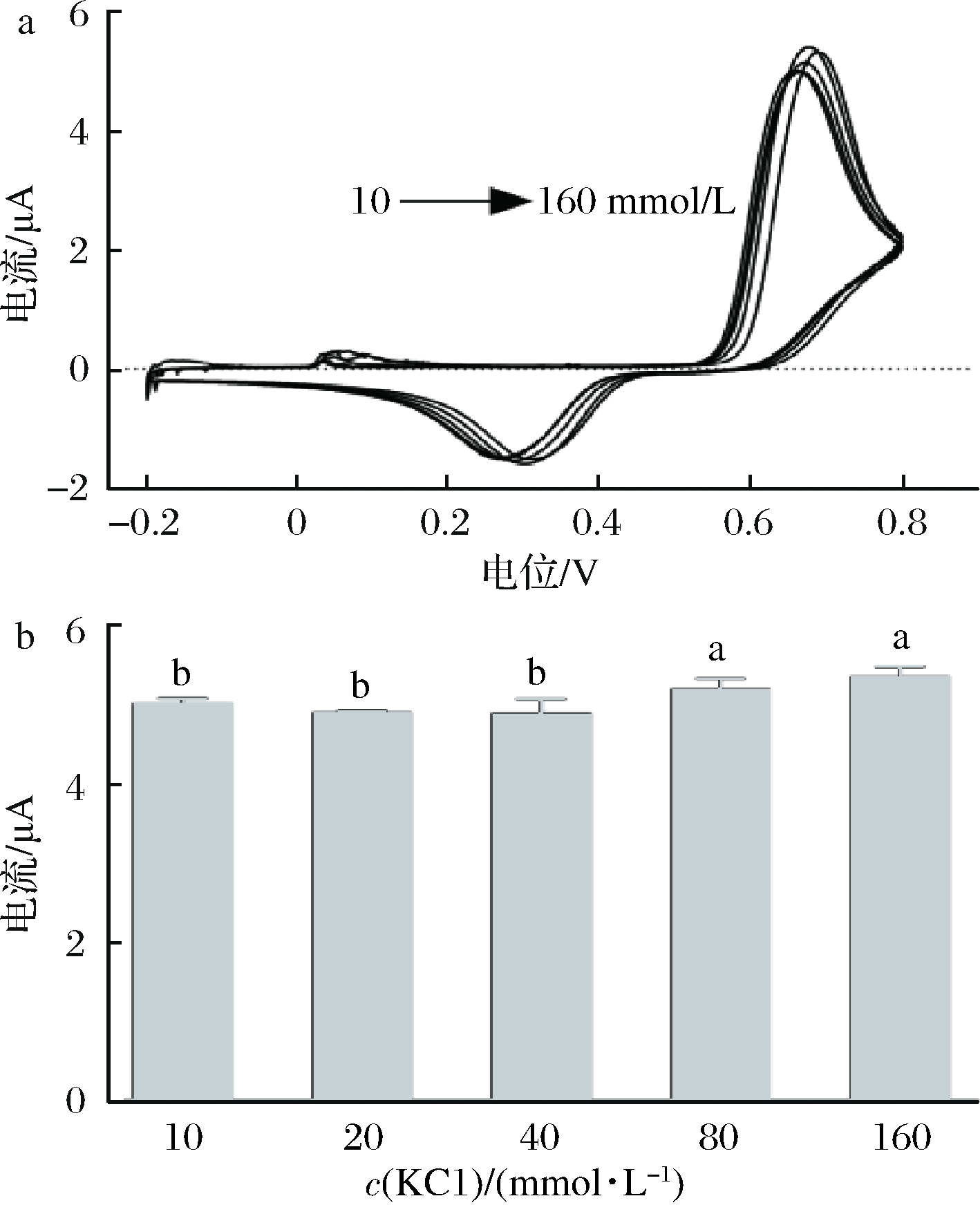
a-不同KCl浓度下辣椒碱的CV曲线;b-不同KCl浓度下
辣椒碱的氧化峰电流值
图4 KCl浓度对CV法测定辣椒碱的影响
Fig.4 The influence of KCl concentration on measuring
capsaicin with CV
2.5 标准曲线和检测限的测定
如图5所示,在优化的检测条件下,随着辣椒碱浓度的增加,辣椒碱氧化峰电流显著增加。辣椒碱响应电流值Y与其辣椒碱浓度X在0.80~107.72 μmol/L范围内呈良好线性关系,线性方程为Y=0.063 5X+0.385 8,R2为0.981 6。该线性范围比报道的氧化钇(Y2O3)纳米粒子修饰的石墨糊电极(1~80 μmol/L)[22]以及Ag/Ag2O纳米粒子和还原型氧化石墨烯复合修饰的印刷电极(1~60 μmol/L)[23]测定辣椒碱的线性范围宽。
根据标准曲线的斜率(k)和空白样测定的标准偏差(SD),得到该未修饰印刷电极测定辣椒碱的检出限为0.13 μmol/L,该检测限低于本文HPLC测定的辣椒碱检测限(24.56 μmol/L),且低于已报道的多壁碳纳米管纳米金粒子复合材料修饰玻碳电极[15]和碳纳米管修饰石墨电极[24]测定辣椒碱的检测限(0.89和0.31 μmol/L)。
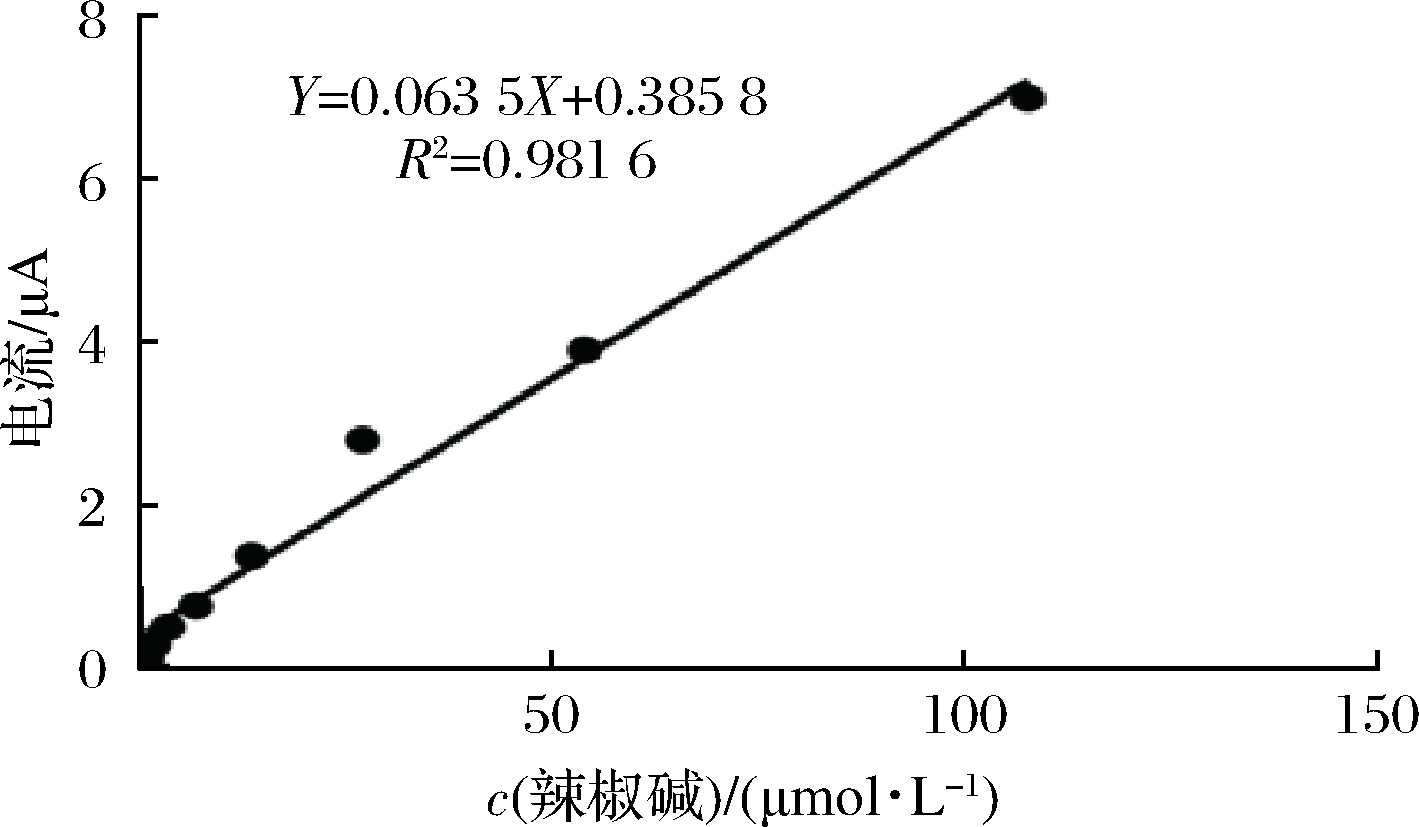
图5 辣椒素的标准曲线图
Fig.5 The calibration plot of capsaicin
2.6 方法精密度和稳定性的测定
由表1可知,平行测定的同一辣椒碱标准液(107.72 μmol/L)氧化峰电流值大小的RSD为2.10%,表明精密度好。由表2可知,在0~60 h内测定同一辣椒碱标准液的氧化峰电流值大小的RSD为6.53%,具有较好的稳定性。以上结果表明该未修饰印刷电极测定辣椒碱具有良好的精密度和稳定性。
表1 精密度实验结果
Table 1 Results of precision test
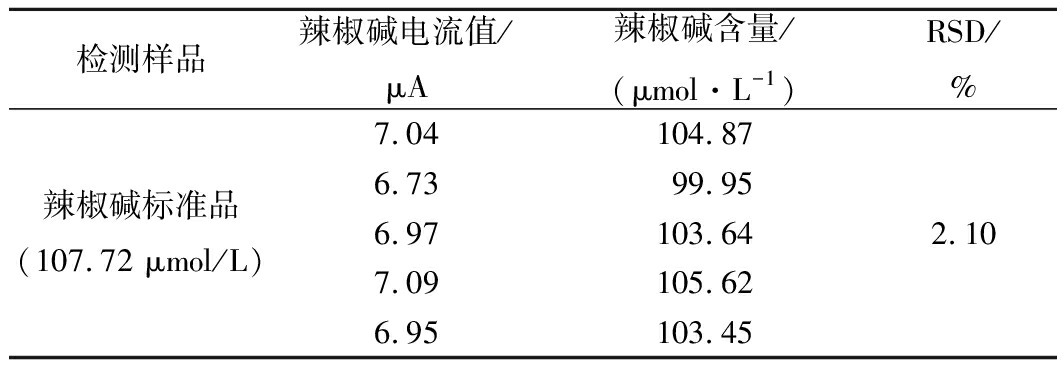
检测样品辣椒碱电流值/μA辣椒碱含量/(μmol·L-1)RSD/%辣椒碱标准品(107.72 μmol/L)7.04104.876.7399.956.97103.647.09105.626.95103.452.10
表2 稳定性实验结果
Table 2 Results of stability test
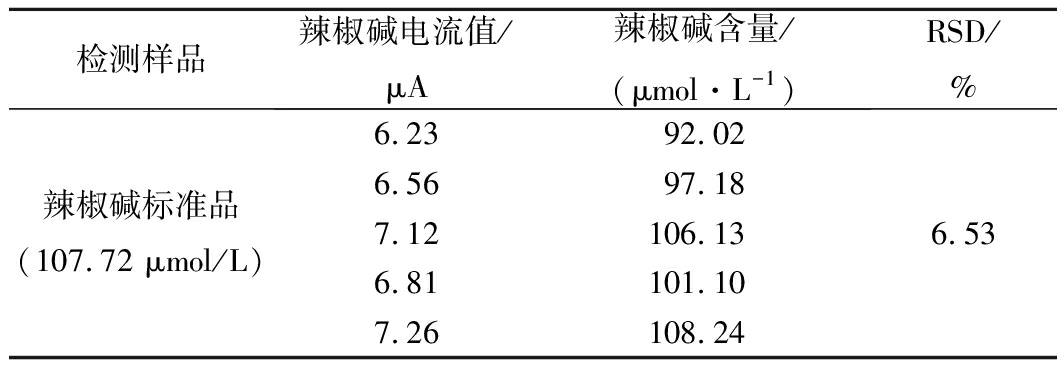
检测样品辣椒碱电流值/μA辣椒碱含量/(μmol·L-1)RSD/%辣椒碱标准品(107.72 μmol/L)6.2392.026.5697.187.12106.136.81101.107.26108.246.53
2.7 方法加标回收率的测定
从表3可知,10、20、40 μmol/L三个不同浓度辣椒碱的样品的加标回收率在91.87%~100.86%之间。结果表明,此未修饰印刷电极测定辣椒碱的结果准确可靠,可以应用于实际辣椒样品中辣椒碱的测定。
表3 辣椒碱的加标回收率
Table 3 Results of the recovery analysis of capsaicin in
the extract of pepper samples

样品中辣椒碱含量/(μmol·L-1)加标量/(μmol·L-1)测定量/(μmol·L-1)回收率/%10.0012.65±0.8591.87±8.463.4620.0023.63±3.11100.86±15.5340.0040.52±1.2392.65±3.06
2.8 电化学和液相色谱测定辣椒碱的结果比较
5种不同产地的干辣椒及5种辣椒卤水中辣椒碱的电化学和液相色谱测定结果如表4和表5所示。由表4、表5可知,所有干辣椒及辣椒卤水中辣椒碱的电化学测定结果与HPLC测定结果基本一致,2种方法测定干辣椒及辣椒卤水中辣椒碱的RSD较小,分别在0.41%~6.78%、0.80%~8.80%之间,这表明该电化学检测方法准确、可靠,可以作为替代HPLC的方法,应用于辣椒及其辣椒制品辣椒碱的测定。
表4 电化学和液相色谱测定干辣椒辣椒碱的结果比较
Table 4 Comparison of capsaicin content in dried pepper
determined by electrochemistry and HPLC
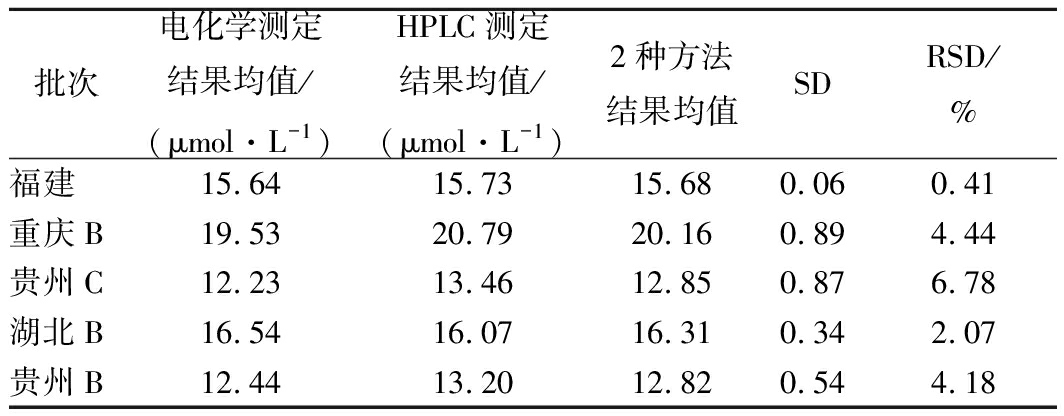
批次电化学测定结果均值/(μmol·L-1)HPLC测定结果均值/(μmol·L-1)2种方法结果均值SDRSD/%福建15.6415.7315.680.060.41重庆B19.5320.7920.160.894.44贵州C12.2313.4612.850.876.78湖北B16.5416.0716.310.342.07贵州B 12.4413.2012.820.544.18
表5 电化学和液相色谱测定卤水辣椒碱的结果比较
Table 5 Comparison of capsaicin content in bittern
determined by electrochemistry and HPLC
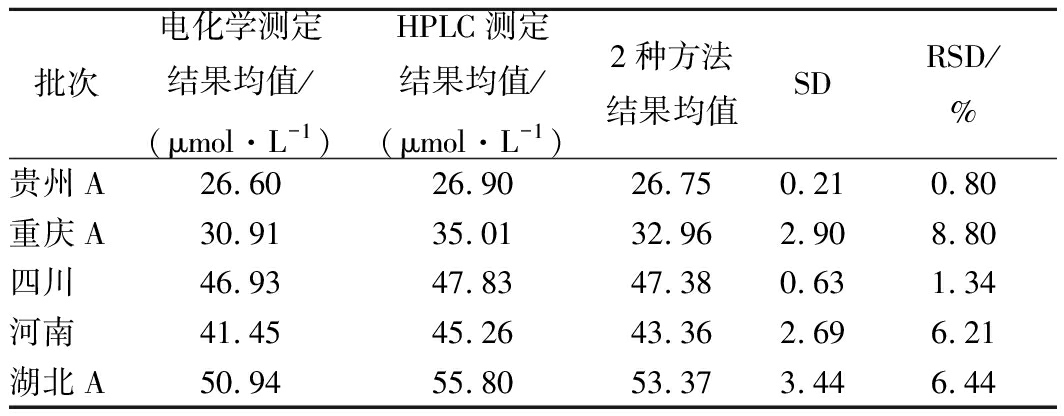
批次电化学测定结果均值/(μmol·L-1)HPLC测定结果均值/(μmol·L-1)2种方法结果均值SDRSD/%贵州A26.6026.9026.750.210.80重庆A30.9135.0132.962.908.80四川46.9347.8347.380.631.34河南41.4545.2643.362.696.21湖北A50.9455.8053.373.446.44
3 结论
本实验对未修饰的印刷电极应用于辣椒碱的测定条件进行优化,建立了此印刷电极测定辣椒碱的电化学方法。此印刷电极测定辣椒碱的适宜条件为:乙醇体积分数10%、KCl浓度80 mmol/L、pH 1,3种电解质溶液BR、CH3COOH-CH3COONa、NaH2PO4-Na2HPO4溶液均适宜。该方法在0.80~107.72 μmol/L范围内辣椒碱氧化峰电流值与辣椒碱的浓度呈良好线性关系,检出限为0.13 μmol/L,具有较好的精密度、稳定性及加标回收率。此外,该方法可代替传统的HPLC法测定辣椒碱,具有操作简单、成本低、检测效率高等优点,为辣椒碱的快速、准确测定方法提供了借鉴。
[1] BENNETT D J, KIRBY G W. Constitution and biosynthesis of capsaicin[J]. Journal of the Chemical Society C: Organic, 1968, 4: 442-446.
[2] ZHONG F, LIU Z, HAN Y, et al. Electrochemical sensor for sensitive determination of capsaicin using Pd decorated reduced graphene oxide[J]. Electroanalysis, 2019, 31(6): 1 182-1 188.
[3] FATTORI V, HOHMANN M S N, ROSSANEIS A C, et al. Capsaicin: current understanding of its mechanisms and therapy of pain and other pre-clinical and clinical uses[J]. Molecules, 2016, 21(7): 844-876.
[4] SHIN Y H, KIM J M, PARK K. The effect of capsaicin on salivary gland dysfunction[J]. Molecules, 2016, 21(7): 835-844.
[5] O′NEILL J, BROCK C, OLESEN A E, et al. Unravelling the mystery of capsaicin: a tool to understand and treat pain[J]. Pharmacological Reviews, 2012, 64(4): 939-971.
[6] SHARMA S K, VIJ A S, SHARMA M. Mechanisms and clinical uses of capsaicin[J]. European Journal of Pharmacology, 2013, 720(1-3): 55-62.
[7] SATYANARAYANA M N. Capsaicin and gastric ulcers[J]. Critical Reviews in Food Science and Nutrition, 2006, 46(4): 275-328.
[8] 刘晓庚, 徐欣东, 刘琴, 等. 循环伏安法测定辣椒中辣椒碱的检测条件优化[J]. 食品工业科技,2020,41(4):218-223;228.
[9] YARD M Y,
M Y,  ENTÜRK Z. Electrochemical evaluation and adsorptive stripping voltammetric determination of capsaicin or dihydrocapsaicin on a disposable pencil graphite electrode[J]. Talanta, 2013, 112: 11-19.
ENTÜRK Z. Electrochemical evaluation and adsorptive stripping voltammetric determination of capsaicin or dihydrocapsaicin on a disposable pencil graphite electrode[J]. Talanta, 2013, 112: 11-19.
[10] GIBBS H A A, O'GARRO L W. Capsaicin content of West Indies hot pepper cultivars using colorimetric and chromatographic techniques[J]. HortScience, 2004, 39(1): 132-135.
[11] ZHANG Q, HU J, SHENG L, et al. Simultaneous quantification of capsaicin and dihydrocapsaicin in rat plasma using HPLC coupled with tandem mass spectrometry[J]. Journal of Chromatography B, 2010, 878(24): 2 292-2 297.
[12] GARCÉS-CLAVER A, ARNEDO-ANDRÉS M S, ABAD A J, et al. Determination of capsaicin and dihydrocapsaicin in capsicum fruits by liquid chromatography-electrospray/time-of-flight mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2006, 54(25): 9 303-9 311.
A J, et al. Determination of capsaicin and dihydrocapsaicin in capsicum fruits by liquid chromatography-electrospray/time-of-flight mass spectrometry[J]. Journal of Agricultural and Food Chemistry, 2006, 54(25): 9 303-9 311.
[13] PE A-ALVAREZ A, RAM
A-ALVAREZ A, RAM REZ-MAYA E, ALVARADO-SU
REZ-MAYA E, ALVARADO-SU REZ L
REZ L  . Analysis of capsaicin and dihydrocapsaicin in peppers and pepper sauces by solid phase microextraction-gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(14): 2 843-2 847.
. Analysis of capsaicin and dihydrocapsaicin in peppers and pepper sauces by solid phase microextraction-gas chromatography-mass spectrometry[J]. Journal of Chromatography A, 2009, 1216(14): 2 843-2 847.
[14] YANG Q, ZHU J, MA F, et al. Quantitative determination of major capsaicinoids in serum by ELISA and time-resolved fluorescent immunoassay based on monoclonal antibodies[J]. Biosensors and Bioelectronics, 2016, 81: 229-235.
[15] MPANZA T, SABELA M I, MATHENJWA S S, et al. Electrochemical determination of capsaicin and silymarin using a glassy carbon electrode modified by gold nanoparticle decorated multiwalled carbon nanotubes[J]. Analytical Letters, 2014, 47(17): 2 813-2 828.
[16] DE LE N ZAVALA E D, RODR
N ZAVALA E D, RODR GUEZ L M T, MONTES-ROJAS A, et al. Study of electrochemical determination of capsaicin and dihydrocapsaicin at carbon paste electrodes modified by β-cyclodextrin[J]. Journal of Electroanalytical Chemistry, 2018, 814: 174-183.
GUEZ L M T, MONTES-ROJAS A, et al. Study of electrochemical determination of capsaicin and dihydrocapsaicin at carbon paste electrodes modified by β-cyclodextrin[J]. Journal of Electroanalytical Chemistry, 2018, 814: 174-183.
[17] 王燕. 基于碳材料的辣椒素电化学传感器的制备及应用研究[D]. 广州: 华南理工大学, 2017.
[18] WANG Y, HUANG B B, DAI W L, et al. Sensitive electrochemical capsaicin sensor based on a screen printed electrode modified with poly(sodium 4-styrenesulfonate) functionalized graphite[J]. Analytical Sciences, 2017, 33(7): 793-799.
[19] GB/T 21266—2007, 辣椒及辣椒制品中辣椒素类物质测定及辣度表示方法[S]. 北京: 中国标准出版社, 2007.
[20] 国家食品药品监督管理总局. 总局关于发布《食用油脂中辣椒素的测定》食品补充检验方法的公告(2018年第26号)[EB/OL]. (2018-02-27)[2020-02-16]. http://samr.cfda.gov.cn/WS01/CL0087/225540.html.
[21] SØPSTAD S, IMENES K, JOHANNESSEN E A. Hybrid electrochemical sensor platform for capsaicin determination using coarsely stepped cyclic squarewave voltammetry[J]. Biosensors and Bioelectronics, 2019, 130: 374-381.
[22] NASKAR H, GHATAK B, BISWAS S, et al. Electrochemical detection of capsaicin using yttrium oxide nanoparticles modified graphite paste electrode (Y2O3/GPE)[C]. 2019 IEEE International Symposium on Olfaction and Electronic Nose (ISOEN). Fukuoka: IEEE, 2019: 1-3.
[23] WANG Y, HUANG B, DAI W, et al. Sensitive determination of capsaicin on Ag/Ag2O nanoparticles/reduced graphene oxide modified screen-printed electrode[J]. Journal of Electroanalytical Chemistry, 2016, 776: 93-100.
[24] KACHOOSANGI R T, WILDGOOSE G G, COMPTON R G. Carbon nanotube-based electrochemical sensors for quantifying the ‘heat’of chilli peppers: the adsorptive stripping voltammetric determination of capsaicin[J]. Analyst, 2008, 133(7): 888-895.