由于电镀、冶金和制革等工业废水的排放,铬污染已成为全球重金属污染的主要问题[1-2]。铬能以7种氧化态形式存在(0~VI)[3],其中Cr(VI)的毒性是Cr(III)的100倍[4]。在体内会不断积累并给人体造成诸多危害,如癌症、皮炎、哮喘、慢性支气管炎、基因突变、睾丸损害和肾脏病变等[5-7]。针对食品安全,寻找一种高效、绿色的Cr(VI) 去除方法有重要意义。目前化学工业上用于Cr(VI)污染治理的方法主要有:化学沉淀、生物修复、电化学法、吸附法和光催化还原等[8-9]。这些方法大多无法在食品体系下操作,只有吸附法有潜在应用价值[10]。显然,如能利用食品加工副产物开发新型Cr(VI)吸附材料,可以实现食品安全与废弃物高值化利用双赢的局面。木质素是自然界中储量仅次于纤维素的生物质资源,据统计,每年全球木质素年产量高达1.5×1011t[11],但只有约5%得到了开发和利用[12]。木质素是高等植物细胞壁中由对香豆醇、松柏醇和芥子醇等构成的酚类聚合物[12],含有大量羟基、羧基和羰基等含氧官能团[13-14]。木质素能够通过配位螯合、离子交换或静电吸附等方式有效捕获重金属离子(如铅、铬、汞等)[14]。GUO等[15]研究发现造纸黑液中的木质素对重金属离子有很好的吸附作用,其结构中的酚羟基和羧基是主要吸附位点。BRDAR等[16]发现造纸废液硫酸木质素对Cr(VI)的吸附符合Redlich-Peterson模型,最大吸附量可达11.8 mg/g。ALBADARIN等[17]发现碱木质素在pH 2时对Cr(VI)的吸附能力最强(31.6 mg/g),吸附过程符合准二级动力学模型和Freundlich模型。很显然,这些木质素都存在安全隐患,无法在食品体系中使用。从安全角度考虑,从食品加工剩余物中制取可用于吸附Cr(VI)的木质素是一个很好的策略。GONG等[18]研究发现从麻竹笋笋壳中获得的醋酸木质素有较多的酚羟基和羧基,具备吸附Cr(VI)的结构基础。因此,本研究拟对笋壳醋酸木质素(bamboo shoot shell acetic acid lignin, BSS-AL)吸附Cr(VI)的条件及潜在机制进行研究,以期为食品中铬污染治理提供新的思路。
1 材料与方法
1.1 材料与试剂
麻竹笋笋壳,收集于竹笋加工厂。
重铬酸钾(分析纯),成都市科龙化工试剂厂;HCl、丙酮、冰醋酸,重庆川东化工集团有限公司;二苯碳酰二肼,天津市大茂化学试剂厂。
1.2 仪器与设备
UV-2450紫外分光光度计,日本岛津公司;ZWYR-2102C型恒温摇床,上海智城分析仪器制造有限公司;S-4800型扫描电镜,日本日立公司;Spectrum100型红外光谱仪,美国Perkin Elmer公司;Zetasizer Nano ZS激光粒度仪,英国马尔文仪器;Thermo escalab 250Xi X射线光电子能谱仪,美国Thermo Fisher公司。
1.3 试验方法
1.3.1 BSS-AL的提取及表征
1.3.1.1 BSS-AL的提取
参照文献[18]的方法,将收集的麻竹笋笋壳洗净烘干,剪切成小块并粉碎成40~60目的粉末。然后以料液比1∶10(g∶mL)将粉末加入纯水中,在368 K热水浴中浸提2 h,以除去笋壳中的淀粉、蛋白质和色素等水溶性成分。热水浴浸提后过滤,将滤渣在328 K温度下烘干,得到粗膳食纤维。称取适量粗膳食纤维,用体积分数87%冰醋酸溶液按照料液比1∶20(g∶mL)在387 K油浴条件下浸提80 min,质量分数6%的HCl作为催化剂。通过真空抽滤,将得到的滤液减压浓缩至50 mL,浓缩液逐滴加入至500 mL的纯水中,产生絮状沉淀。离心分离,用pH 2的稀HCl冲洗沉淀3次,冷冻干燥,即得BSS-AL。
1.3.1.2 Zeta电位测定
在0.1 mol/L NaCl溶液中加入0.05 g待测样品,以固定离子强度,先用0.1 mol/L NaOH溶液将悬浮液pH调至12,再用0.1 mol/L HCl将pH调至不同pH值,在298 K温度下测定不同pH下样品的Zeta电位。
1.3.1.3 傅里叶变换红外光谱(fourier transform infrared spectroscopy, FTIR)分析
称取0.10 g样品,置于20 mL质量浓度为25 mg/L的Cr(VI)溶液中,恒温振荡24 h后离心过滤并清洗,将冷冻干燥后的样品采用KBr压片法,用Spectrum100型红外光谱仪进行分析,设定的扫描范围为4 000~400 cm-1,分辨率为4 cm-1。
1.3.1.4 X射线光电子能谱(X-ray photoelectron spectroscopy, XPS)分析
称取样品0.10 g,利用Thermo escalab 250Xi X射线光电子能谱仪对样品表面元素和官能团变化进行表征,其工作条件为:真空度约为7×10-8 Pa,单色化的Al Kα (0.8 eV)为X光源,在15 kV,20 mA条件下进行XPS分析。
1.3.1.5 扫描电子显微镜(scanning electron microscope, SEM)分析
用SEM测试样品表面形态,将适量的样品粉末固定在测试平台上,表面进行高压喷金处理,在加速电压为30 kV条件下,开始观察并摄像。
1.3.2 批量吸附实验
取20 mL一定浓度梯度、初始pH的Cr(VI)溶液于一系列50 mL锥形瓶中,分别添加一定质量的BSS-AL,在不同温度环境中以200 r/min转速在摇床中振荡一定的时间。吸附后的悬浊液在8 000 r/min条件下离心,并通过0.22 μm的微孔滤膜,利用二苯碳酰二肼分光光度法测定滤液中残留的Cr(VI)浓度,并按公式(1)和公式(2)计算Cr(VI)的清除率和平衡吸附量[19]:
(1)
(2)
式中: η,清除率,%;C0,Cr(VI)溶液的初始质量浓度,mg/L;Ce,吸附平衡后Cr(VI)溶液的质量浓度,mg/L;qe,平衡吸附量,mg/g;V,溶液体积,L;m,BSS-AL的添加量,g。
1.3.3 解吸回收实验
将0.10 g BSS-AL添加到25 mg/L的Cr(VI)溶液中进行静态吸附实验,达到吸附平衡后,将BSS-AL从Cr (VI)溶液中分离出来,置于装有20 mL脱附剂(0.1 mol/L HCl)的塑料离心管中。在298 K温度下,将整个体系置于摇床中,于200 r/min条件下进行脱附,用比色法测定从上清液中分离出Cr(VI)的浓度。将脱附后的BSS-AL洗涤至中性,在328 K温度下烘干,并重复上述步骤。记录吸附-脱附次数,并计算Cr(VI)的清除率。
1.3.4 数据处理
对于每个样品重复测定3次,结果均采用“平均值±标准差”表示。方差分析采用One-Way ANOVA单因素方差分析,P<0.05为差异显著。
2 结果与分析
2.1 BBS-AL的表征
2.1.1 Zeta电位
图1-a所示为BSS-AL的Zeta电位随pH变化的曲线,在0.1 mol/L背景电解质溶液中,Zeta电位随着pH的增大而降低,BSS-AL的零电荷(pHpzc)约为2.8。在pH处于2.8~10的范围内,BSS-AL表面被大量负电荷包围而表现为去质子化。
2.1.2 FTIR分析
吸附剂表面的活性基团是Cr(VI)的主要吸附位点,FTIR分析方法可以用来确定吸附前后吸附剂表面官能团的变化情况,通过基团的吸收峰变化来确定参与吸附的官能团。图1-b所示为BSS-AL吸附Cr(VI)前后的红外光谱图,参考相关文献,3 390 cm-1处的峰是-OH的伸缩振动吸收峰[20];2 934和2 853 cm-1处的峰是—CH3或—CH2中C—H的伸缩振动吸收峰[20];1 800~900 cm-1是BSS-AL的指纹区[21],1 716 cm-1处的峰是C![]() O的伸缩振动吸收峰[20],1 622 cm-1处的峰是苯环中C
O的伸缩振动吸收峰[20],1 622 cm-1处的峰是苯环中C![]() C伸缩振动吸收峰[22],1 040 cm-1处的峰是伯醇中C—O伸缩振动吸收峰[20]。当BSS-AL吸附Cr (VI)后,其3 390和1 622 cm-1处的峰分别向高波数移动了10和9 cm-1;1 716 cm-1处的峰向低波数移动了5 cm-1;在1 716和1 040 cm-1处峰的强度有所减弱。这些峰的移动或变化表明,在吸附过程中Cr(VI)与BSS-AL的羟基、羰基和羧基等发生了相互作用。在强酸性条件下(pH 2),BSS-AL表面带正电荷,以阴离子基团存在的Cr(VI)
C伸缩振动吸收峰[22],1 040 cm-1处的峰是伯醇中C—O伸缩振动吸收峰[20]。当BSS-AL吸附Cr (VI)后,其3 390和1 622 cm-1处的峰分别向高波数移动了10和9 cm-1;1 716 cm-1处的峰向低波数移动了5 cm-1;在1 716和1 040 cm-1处峰的强度有所减弱。这些峰的移动或变化表明,在吸附过程中Cr(VI)与BSS-AL的羟基、羰基和羧基等发生了相互作用。在强酸性条件下(pH 2),BSS-AL表面带正电荷,以阴离子基团存在的Cr(VI) ![]() 通过静电相互作用优先吸附在BSS-AL表面[23],而另一部分Cr(VI)能与木质素颗粒表面的供电子基团(如—C
通过静电相互作用优先吸附在BSS-AL表面[23],而另一部分Cr(VI)能与木质素颗粒表面的供电子基团(如—C![]() O或—OCH3) 发生相互作用[18, 24]。
O或—OCH3) 发生相互作用[18, 24]。
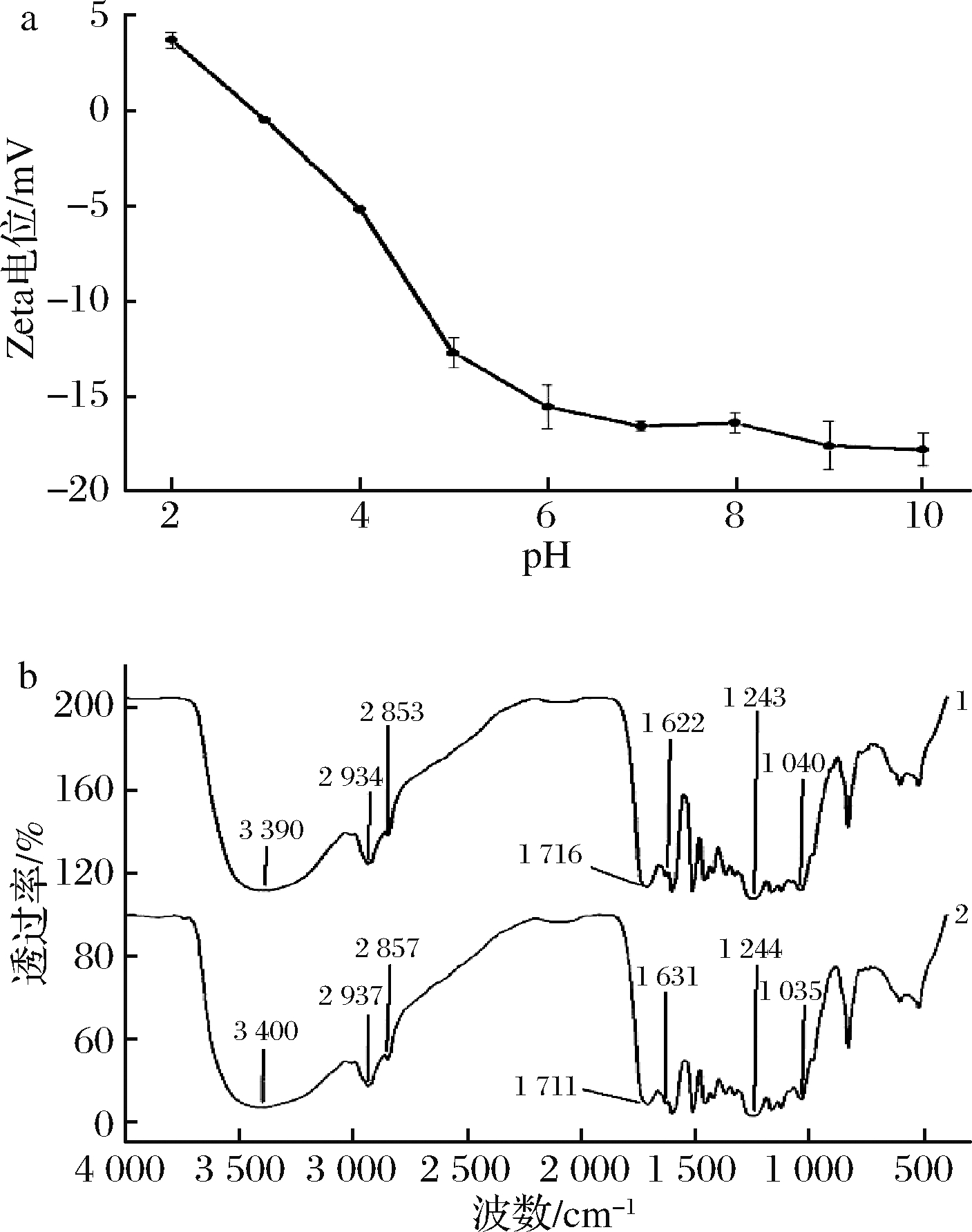
1-吸附前;2-吸附后
图1 BSS-AL的Zeta电位(a)和红外光谱图(b)
Fig.1 Zeta potential(a) and FTIR spectrum(b) of BSS-AL
2.1.3 XPS分析
利用XPS对吸附过程中BSS-AL表面元素、官能团及Cr的价态进行了分析。由图2-a可见,在宽扫描光谱图中,吸附Cr(VI)前后的BSS-AL表面有C1s和O1s主要特征峰,在吸附Cr(VI)后,发现在577和587 eV处分别出现了对应于Cr 2p3/2和 Cr 2p1/2轨道的新峰,表明BSS-AL表面有Cr元素存在。通过分峰拟合,将C1s轨道的峰分为4种:C—C、C—O、O—C—O和O![]() C—O,吸附前后C1s轨道的高分辨率光谱如图2-b、2-c所示,吸附Cr(VI)之后,C1s轨道结合能位置发生了变化,如C—O和O
C—O,吸附前后C1s轨道的高分辨率光谱如图2-b、2-c所示,吸附Cr(VI)之后,C1s轨道结合能位置发生了变化,如C—O和O![]() C—O的结合能位置由原来的286.5、289.4 eV变为285.5、288.3 eV。因此C—O和O
C—O的结合能位置由原来的286.5、289.4 eV变为285.5、288.3 eV。因此C—O和O![]() C—O参与了吸附过程,这与FTIR的分析结果一致,Cr(VI)可能是通过离子交换作用被吸附到BSS-AL表面。利用Cr 2p高分辨率的精细光谱图对Cr的价态进行分析(图2-d),在Cr 2p3/2区域,578 eV处的峰和Cr(VI)有关;而Cr 2p1/2区域被分成2个部分,588.05 eV处的峰和Cr(VI)有关,而586.65 eV处的峰和Cr(III)有关。BBS-AL表面同时存在Cr(VI)和Cr(III),说明在吸附过程中,其中一部分的Cr(VI)被还原为Cr(III),然后二者被共同吸附至BSS-AL表面,这符合SAHA等[25]提出的吸附机制,即“阴离子和阳离子吸附”。
C—O参与了吸附过程,这与FTIR的分析结果一致,Cr(VI)可能是通过离子交换作用被吸附到BSS-AL表面。利用Cr 2p高分辨率的精细光谱图对Cr的价态进行分析(图2-d),在Cr 2p3/2区域,578 eV处的峰和Cr(VI)有关;而Cr 2p1/2区域被分成2个部分,588.05 eV处的峰和Cr(VI)有关,而586.65 eV处的峰和Cr(III)有关。BBS-AL表面同时存在Cr(VI)和Cr(III),说明在吸附过程中,其中一部分的Cr(VI)被还原为Cr(III),然后二者被共同吸附至BSS-AL表面,这符合SAHA等[25]提出的吸附机制,即“阴离子和阳离子吸附”。

a-宽扫描光谱图;b-吸附Cr(VI)前的C1s高分辨率光谱图; c-吸附Cr(VI)后的C1s高分辨率光谱图; d-Cr 2p光谱图
图2 BSS-AL的XPS谱图
Fig.2 XPS spectra of BSS-AL
2.1.4 SEM分析
利用SEM技术对BSS-AL的表面微观形貌进行分析,在不同放大倍数下的样品表面SEM图像如图3所示,BSS-AL颗粒呈圆球状,表面粗糙,在冷冻干燥过程中小颗粒易发生聚集,形成小的团聚体,这种微观结构赋予BSS-AL具有吸附重金属离子的潜力。

a-×7 000;b-×15 000
图3 BSS-AL的扫描电镜图
Fig.3 Scanning electron microphotographs of BSS-AL
2.2 pH对Cr(VI)吸附效果的影响
溶液的pH值揭示了与水环境中金属离子的界面性质以及吸附剂的活性位点相关的信息,与阐述吸附材料潜在的吸附机制密切关联[26]。如图4-a所示,吸附过程受pH的影响很大,在pH 2的酸性环境中,BSS-AL具有最佳的吸附效果,当pH从2升高到10时,体系中Cr(VI)的清除率η由95.5%降至79.4%。KWAK等[23]利用改性的木质素微球作为Cr(VI)吸附材料,发现在低酸性条件下改性木质素微球能够对Cr(VI)发挥较强的吸附作用,这主要基于两者之间的静电相互作用。这种吸附行为是由于Cr(VI)与水环境中的质子竞争木质素表面的活性位点。在pH>pHpzc时,BSS-AL表面被大量H+包围而质子化,从而增加了Cr(VI)对BSS-AL表面活性位点的亲和力[27]。在pH 2~6.5时,Cr(VI)以![]() 形式为主导[28],因此带负电荷的
形式为主导[28],因此带负电荷的![]() 与BSS-AL表面所带的正电荷基团发生静电相互作用。当pH较高时,环境中存在的H+减少,使得BSS-AL表面去质子化,OH-与带负电荷的Cr(VI)共同竞争BSS-AL表面的活性位点,从而导致较低的吸附效果。
与BSS-AL表面所带的正电荷基团发生静电相互作用。当pH较高时,环境中存在的H+减少,使得BSS-AL表面去质子化,OH-与带负电荷的Cr(VI)共同竞争BSS-AL表面的活性位点,从而导致较低的吸附效果。
2.3 BSS-AL的添加量对吸附效果的影响
图4-b揭示了体系中BSS-AL的添加量与平衡吸附量和清除率之间的关系。当BSS-AL添加量为0.10 g时,Cr(VI)的清除率已逾98%,继续添加BSS-AL,清除率趋于饱和。Cr(VI)的清除率随BSS-AL剂量的增加而增加主要归因于吸附剂数量增多,表面积增大,其表面孔隙及活性位点增多。与清除率相反,当BSS-AL添加量从0.01 g增加到0.10 g,平衡吸附量从(15.41±0.57)mg/g下降到(4.64±0.043)mg/g,过量的活性位点和较低浓度的Cr(VI)溶液可能是造成这一现象的主要原因。在整个吸附质-吸附剂体系中,低剂量的吸附剂之间避免了较大的颗粒相互作用,导致其表面的活性位点对吸附质的最大可利用性;而高剂量的吸附剂颗粒可能会发生聚集或团聚,减少了与吸附质结合的有效表面积[29]。
2.4 接触时间对吸附效果的影响
将0.10 g BSS-AL添加到20 mL浓度为25 mg/L的Cr(VI)溶液中,在10~300 min内研究了吸附量与时间的关系。如图4-c所示,前120 min内BSS-AL对Cr(VI)的吸附速度很快,而在含有Cr(VI)的体系中暴露240 min后,BSS-AL对Cr(VI)的清除率已超过97%,随后达到平衡。

a-pH; b-BSS-AL添加量; c-接触时间; d-Cr(VI)溶液的初始质量浓度
图4 外界因素对BSS-AL吸附Cr(VI)的影响
Fig.4 Effects of experimental conditions on Cr(VI) adsorption
吸附动力学是通过控制吸附剂的剂量、吸附质的初始浓度和温度,来考察吸附量随时间的变化关系。本研究利用准一级动力学模型、修正准一级动力学模型、准二级动力学模型和粒子内扩散模型来了解和掌握吸附过程的传质机制和规律。
准一级动力学模型的方程表达式为:
ln(qe-qt)=lnqe-k1t
(3)
式中:qt,t时刻的吸附量,mg/g;k1,一级吸附速率常数,min-1;qe,平衡吸附量,mg/g;t,吸附时间,min。将ln(qe-qt)对时间t作图得到一条直线,见图5-a。
修正准一级动力学模型的方程表达式为:
(4)
式中:![]() 修正准一级动力学模型方程的速率常数,min-1;其他物理量符号同公式(3)。将qt/qe+ln(qe-qt)对时间t作图得到一条直线,见图5-b。
修正准一级动力学模型方程的速率常数,min-1;其他物理量符号同公式(3)。将qt/qe+ln(qe-qt)对时间t作图得到一条直线,见图5-b。
准二级反应动力学模型的方程表达式为:
t/qt=1/k2qe2+t/qe
(5)
式中:k2,准二级动力学模型方程的速率常数,g/(mg·min-1);其他物理量符号同公式(3)。将t/qt对时间t作图得到一条直线,见图5-c。
粒子内扩散模型的方程表达式为:
qt=kint t1/2+θ
(6)
式中:kint,与扩散系数有关的常数,mg/(g·min1/2);θ,截距;其他物理量符号同式(3)。将qt对t作图,并进行线性拟合,得到的直线如图5-d所示。
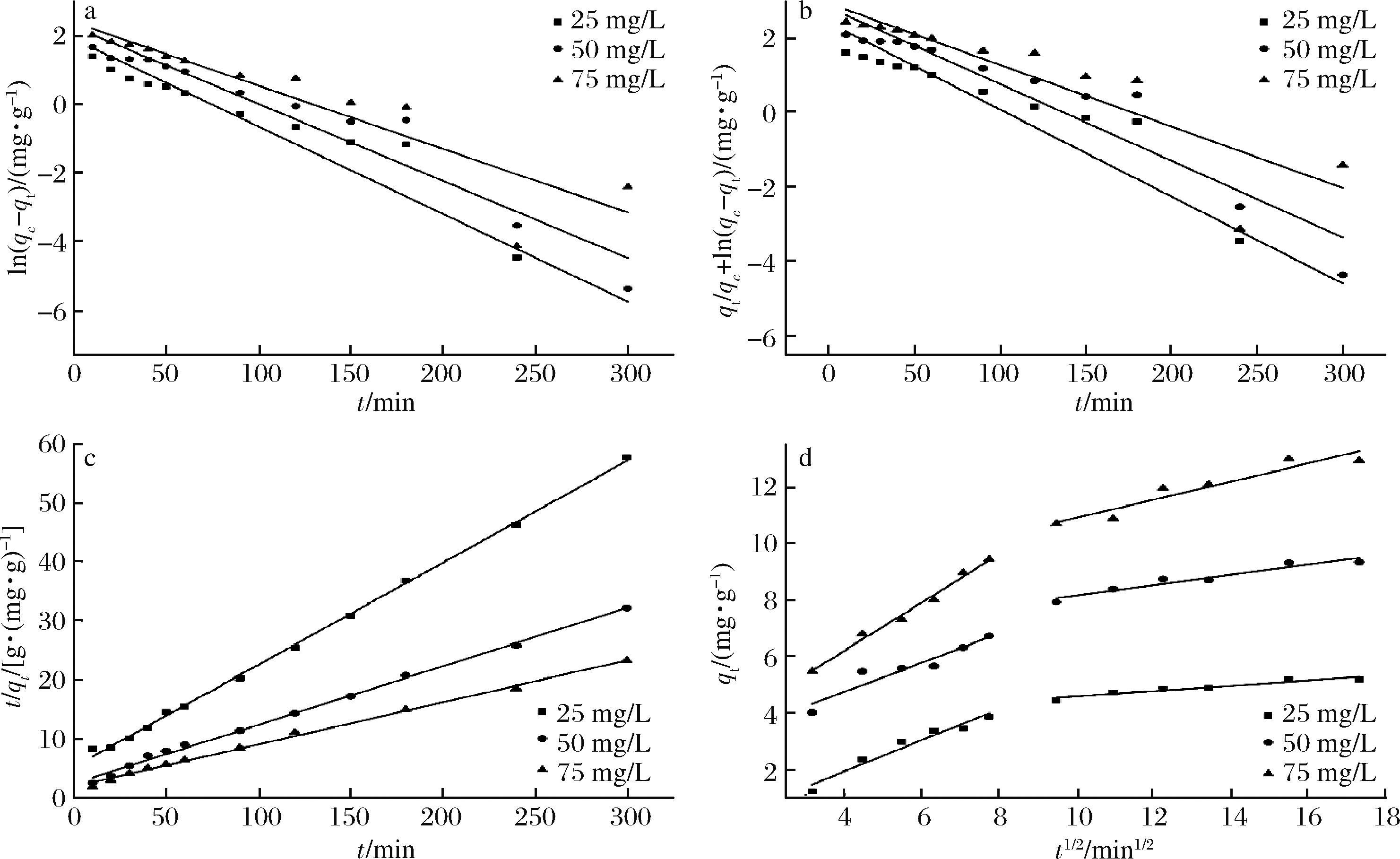
a-准一级反应动力学模型; b-修正准一级反应动力学模型; c-准二级反应动力学模型; d-粒子内扩散模型
图5 BSS-AL吸附Cr(VI)的动力学模型
Fig.5 Kinetic models of Cr(VI) adsorption onto BSS-AL
由表1可知,不同的初始Cr(VI)浓度下,准一级动力学模型的相关系数R2范围为0.822~0.922,说明吸附过程不遵循准一级动力学模型;修正准一级动力学模型的相关系数R2维持在0.781~0.892范围内,不适合拟合该吸附过程。而准二级动力学模型的相关系数R2为0.999、0.997、0.997,该模型能够描述该吸附过程,表明控制吸附速率的步骤可能是化学吸附[14];粒子内扩散模型是用来描述溶液体系中吸附质粒子向吸附剂内部传递过程,在吸附质被吸附的过程中,通常不仅仅伴随液相传质,还有内部粒子扩散传质,因此该模型认为粒子内部扩散是控制吸附速率的步骤,而膜扩散在整个吸附过程中忽略不计[30]。如图5-d所示,该图线不经过原点,表明该吸附过程受多种因素控制。可以看出整个吸附过程分为2个阶段,第1阶段表示膜扩散,即Cr(VI)从整体溶液向BSS-AL移动过程中受到外部阻力的影响;第2阶段表示Cr(VI)向BSS-AL表面的孔隙中进行扩散并达到平衡[31]。表1中kint1和kint2可以反映吸附速率的大小,kint1明显大于kint2,说明随着溶液中吸附质Cr(VI)质量浓度的降低,导致第2阶段吸附速率明显减小。
表1 BSS-AL吸附Cr(VI)的动力学模型相关参数
Table 1 Simulated parameters of kinetic models for
Cr(VI) sorption on BSS-AL
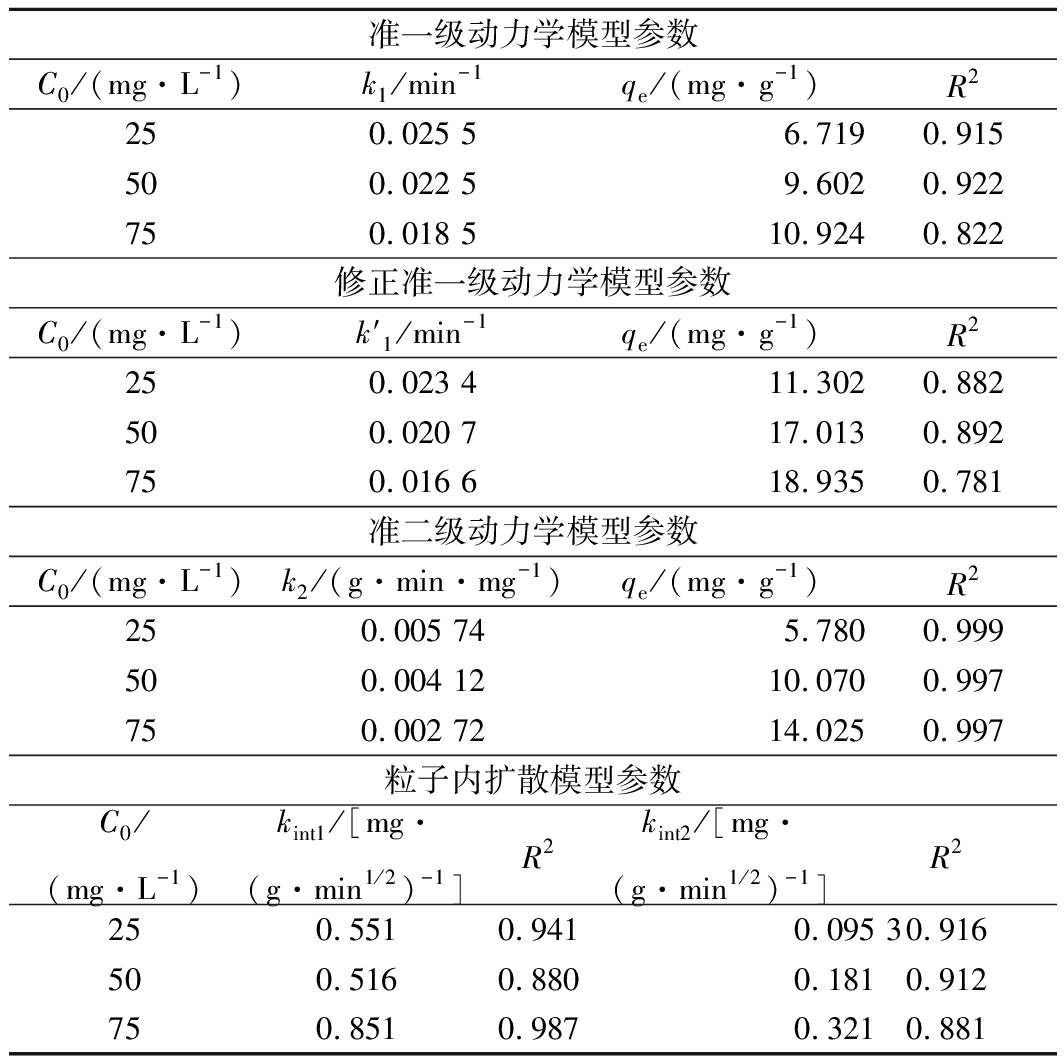
准一级动力学模型参数C0/(mg·L-1)k1/min-1qe/(mg·g-1)R2250.025 56.7190.915500.022 59.6020.922750.018 510.9240.822修正准一级动力学模型参数C0/(mg·L-1)k′1/min-1qe/(mg·g-1)R2250.023 411.3020.882500.020 717.0130.892750.016 618.9350.781准二级动力学模型参数C0/(mg·L-1)k2/(g·min·mg-1)qe/(mg·g-1)R2250.005 745.7800.999500.004 1210.0700.997750.002 7214.0250.997粒子内扩散模型参数C0/(mg·L-1)kint1/[mg·(g·min1/2)-1]R2kint2/[mg·(g·min1/2)-1]R2250.5510.9410.095 30.916500.5160.8800.1810.912750.8510.9870.3210.881
2.5 Cr(VI)溶液的初始浓度对吸附效果的影响
图4-d所示为298 K温度下,不同初始质量浓度Cr(VI)溶液对吸附效果的影响。随着初始质量浓度的增大,BSS-AL表面的活性位点在短时间内被占满,负载能力增强,使平衡吸附量逐渐增大。在较高的Cr(VI)质量浓度下,BSS-AL表面参与吸附的活性位点越多,当吸附达到饱和时,平衡吸附量达到了12.380 mg/g。
等温吸附模型是指在一定温度下,表达平衡吸附量与溶质浓度之间关系的方程式,可用于确定吸附过程中的最大吸附量。本研究采用Langmuir和Freundlich这2种经典等温吸附模型来拟合该吸附过程。Langmuir等温吸附模型适用于单分子层吸附,认为吸附剂表面各个吸附位点对吸附质的吸附能力相同[14]。其方程式如公式(7):所示
Ce/qe=1/kL qm+Ce/qm
(7)
式中:qm,最大吸附量,mg/g;kL,Langmuir 吸附常数,L/g;其他物理量符号同公式(1)。以Ce对Ce/qe作图,运用最小二乘法(least square method)进行线性拟合,得到直线如图6-a所示,根据曲线的斜率和截距可以确定吸附过程中的kL和qm,相关参数见表2。
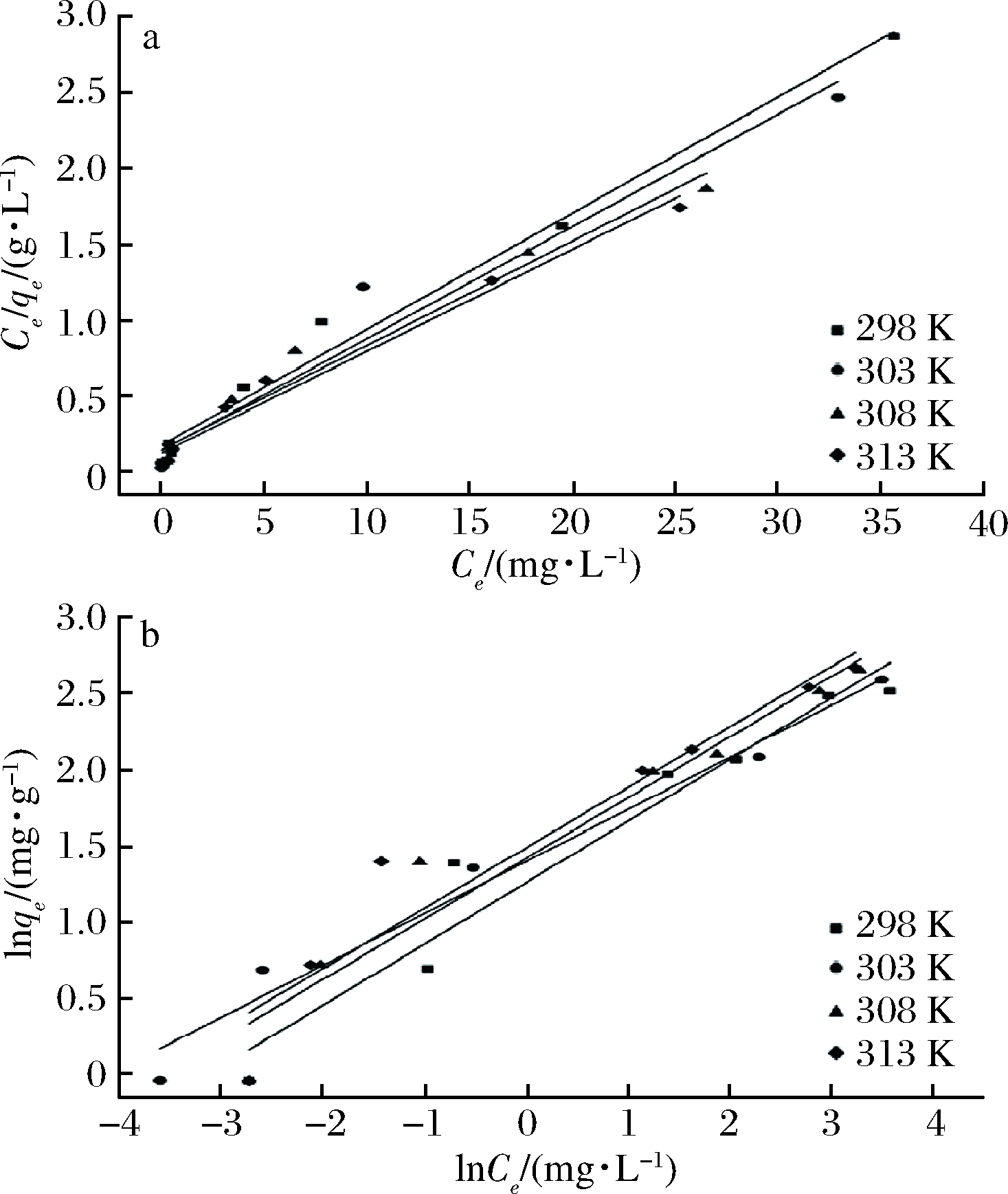
a-Langmuir模型;b-Freundlich模型
图6 BSS-AL吸附Cr(VI)的等温模型
Fig.6 Adsorption isotherm of Cr(VI) by BSS-AL
由表2可知,在298、303、308、313 K条件下,Langmuir吸附等温方程拟合的相关系数R2分别为0.986、0.952、0.967、0.976,相对应的最大吸附量为13.089、13.552、14.556、14.908 mg/g。
Freundlich等温吸附模型是一种经验公式,用于描述非均质表面的吸附过程[14],其方程式如公式(8)所示:
表2 BSS-AL吸附Cr(VI)的Langmuir和Freundlich
等温模型拟合参数
Table 2 Langmuir and Freundlich isotherms parameters
for Cr(VI) adsorption on BSS-AL
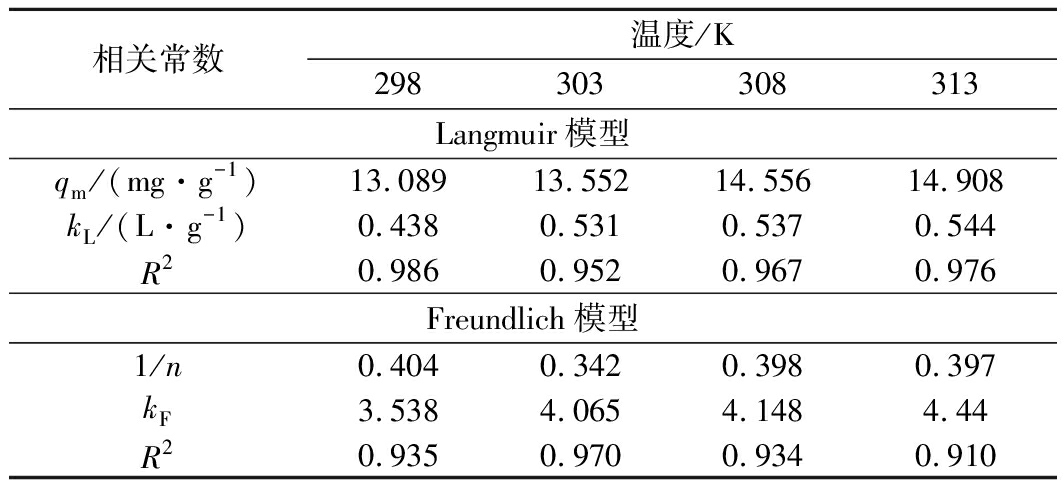
相关常数温度/K298303308313Langmuir模型qm/(mg·g-1)13.08913.55214.55614.908kL/(L·g-1)0.4380.5310.5370.544R20.9860.9520.9670.976Freundlich模型1/n0.4040.3420.3980.397kF3.5384.0654.1484.44R20.9350.9700.9340.910
lnqe=lnkF+1/n·ln Ce
(8)
式中:n和kF为经验常数;其他物理量符号同公式(1)。以lnCe对ln qe作图,如图6-b,运用最小二乘法进行线性拟合,根据曲线的斜率和截距可以确定吸附过程中的经验常数n和kF。该模型中,kF表示吸附剂的吸附能力,1/n代表了吸附强度,当1/n介于0和1之间时,表明吸附剂对吸附质具有较强的吸附能力[32]。因此本研究中,BSS-AL对Cr(VI)具有较好的吸附能力。
从这2个模型的相关系数R2可知,Langmuir模型具有最佳的拟合度,可以更好的描述BSS-AL对Cr(VI)的吸附过程,并且最大吸附量为14.908 mg/g。
2.6 热力学吸附模型
热力学函数可以描述吸附过程是否是自发的,以及吸附相对稳定性。吸附过程中吉布斯自由能变化(ΔG0)、焓变(ΔH0)以及熵变(ΔS0)可通过方程(9)、(10)得到:
ΔG0=-RTln kL
(9)
lnkL=-ΔH0/RT+ΔS0/R
(10)
式中:R,气体吸附常数,8.314 J/mol·K;T,热力学温度,K;kL,不同温度下的Langmuir等温吸附方程常数。表3列出了热力学相关参数,ΔG0<0,ΔH0>0,ΔS0>0说明该吸附过程是自发的吸热过程,在一定范围内,较高的温度有利于克服反应阻力,加速吸附过程。
表3 BSS-AL吸附Cr(VI)的热力学参数
Table 3 Thermodynamic parameters for Cr(VI)
adsorption on BSS-AL

T/KΔG0/(kJ·mol-1)ΔH0/(kJ·mol-1)ΔS0/[kJ·(K·mol)-1]298-7.744303-8.359308-8.526313-8.69810.170.061
2.7 解吸回收实验
从经济和环保角度来看,吸附剂的解吸再生性能是推动吸附剂大规模应用的关键属性,解吸附应用是提高吸附剂回收利用率的一个重要指标[33]。本研究用0.1 mol/L的HCl溶液对吸附Cr(VI)的BSS-AL进行解吸附研究。数次解吸过程中Cr(VI)的清除率变化如图7所示,在经过5次吸附-解吸附循环之后,BSS-AL对Cr(VI)的清除率是逐步递减的,在第4次解吸后,BSS-AL对Cr(VI)的清除率明显下降,在第5次解吸附之后,BSS-AL对Cr(VI)的清除率仍然有56%。在吸附-解吸附循环中,BSS-AL对Cr(VI)的清除效率下降的原因主要有以下几种:(1) BSS-AL在解吸附和不断清洗过程中,质量有所损耗;(2)不断地吸附-解吸附循环过程使得BSS-AL孔隙结构发生改变,表面的活性基团被弱化[24]。通过吸附-解吸附研究,说明BSS-AL在吸附Cr(VI)后可通过HCl溶液解吸附得到再生利用。
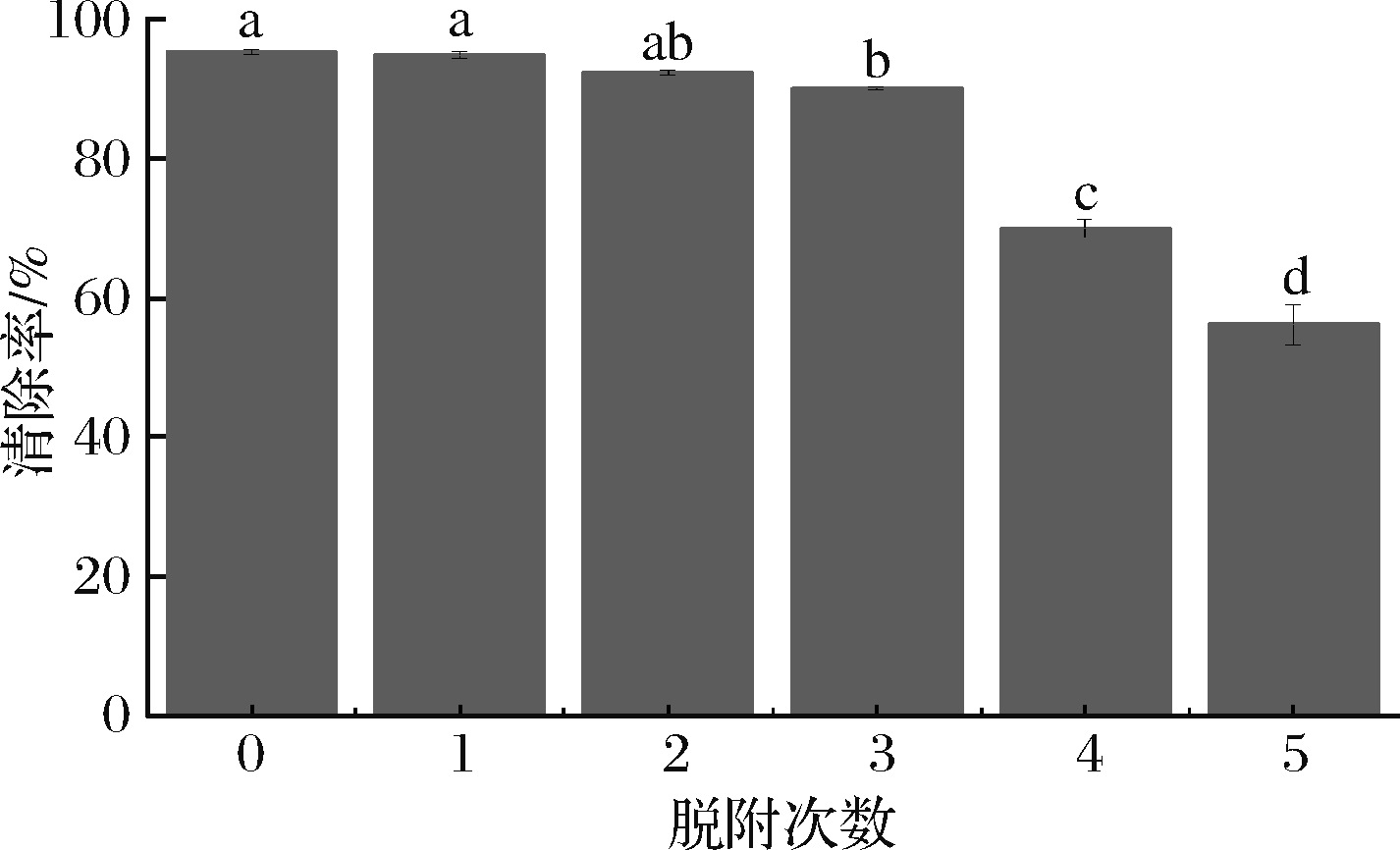
图7 BSS-AL对Cr(VI)连续吸附-解吸附性能
Fig.7 Consecutive adsorption-desorption capacity of
BSS-AL for Cr(VI) adsorption
注:不同小写字母表示同一指标间差异显著(P<0.05)
2.8 吸附机制
在酸性介质中,Cr(VI) 以![]() 形式与BSS-AL表面所带的正电荷基团发生静电相互作用;BSS-AL结构中的官能团,如—OH、—COOH等参与Cr(VI)的吸附,Cr(VI) 通过离子交换作用取代BSS-AL表面的氢原子而被结合到BSS-AL表面;同时BSS-AL结构中的—OH作为还原性基团使体系中一部分Cr(VI)还原为Cr(III),然后两者被吸附到BSS-AL表面。综合以上分析结果,本研究提出的BSS-AL吸附Cr(VI)的可能机制如图8所示。
形式与BSS-AL表面所带的正电荷基团发生静电相互作用;BSS-AL结构中的官能团,如—OH、—COOH等参与Cr(VI)的吸附,Cr(VI) 通过离子交换作用取代BSS-AL表面的氢原子而被结合到BSS-AL表面;同时BSS-AL结构中的—OH作为还原性基团使体系中一部分Cr(VI)还原为Cr(III),然后两者被吸附到BSS-AL表面。综合以上分析结果,本研究提出的BSS-AL吸附Cr(VI)的可能机制如图8所示。
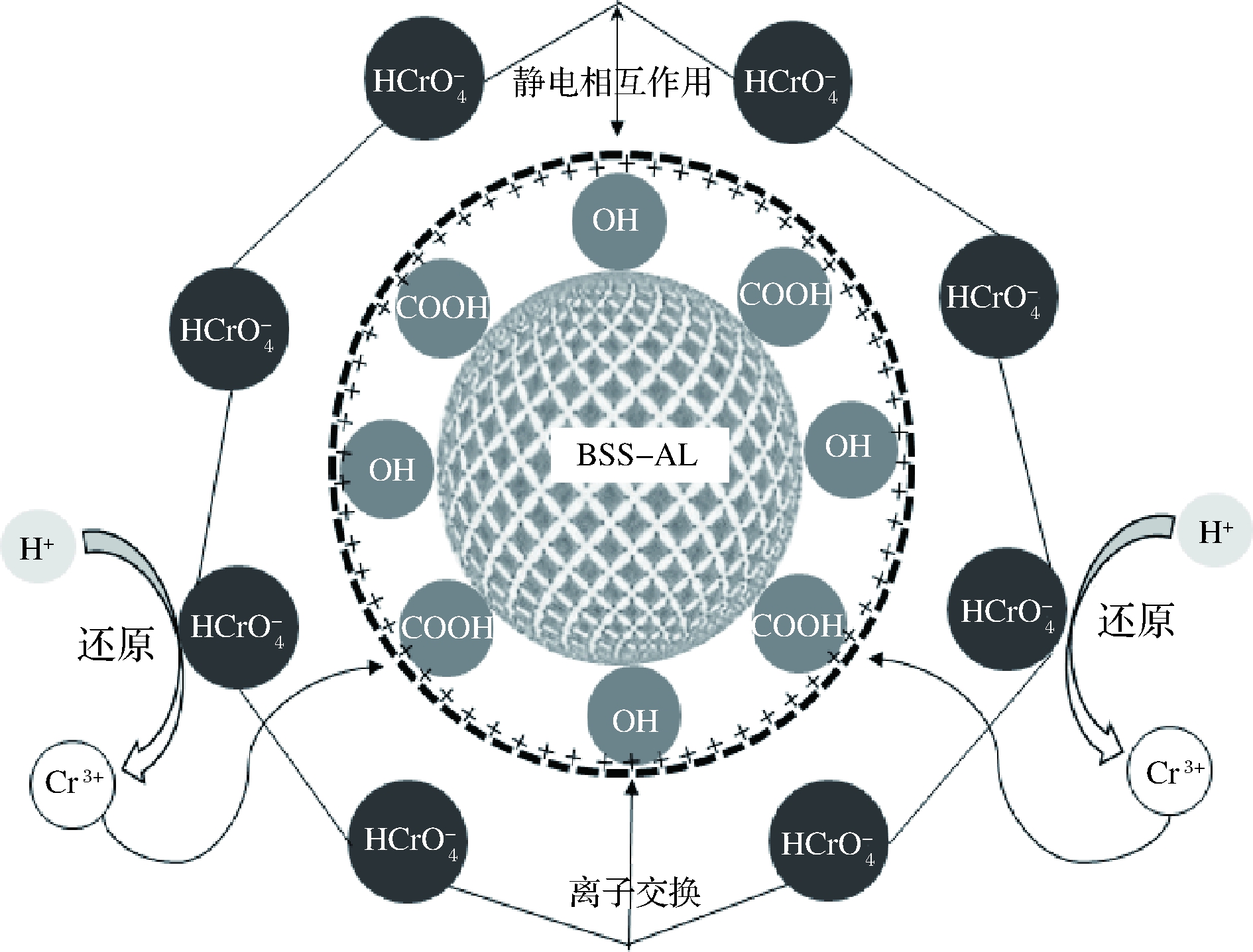
图8 BSS-AL吸附Cr(VI)的潜在机制示意图
Fig.8 Schematic diagram of Cr(VI) adsorption potential
mechanism on BSS-AL
3 结论
以从食品加工废弃物笋壳中获得的木质素为研究对象,利用静态吸附实验评价了BSS-AL对Cr(VI)的吸附性能,发现在含Cr(VI)的体系中暴露240 min后,BSS-AL对Cr(VI)的清除率已超过97%,吸附动力学符合准二级动力学模型;BSS-AL对Cr(VI)的最大吸附量为14.908 mg/g,等温吸附模型符合Langmuir模型。在解吸实验中,通过5轮的吸附-解吸附过程,BSS-AL对Cr(VI)的清除效率依然可以达到50%以上,说明可以通过一定的解吸附手段回收利用这种吸附材料。利用FTIR和XPS分析手段对比吸附前后的BSS-AL,结果表明在BSS-AL结构中,存在大量含氧基团,如—OH、—COOH等,它们在吸附过程中扮演着重要的角色。其中涉及的吸附机制包括静电相互作用、离子交换、一部分Cr(VI)被还原为Cr(III)后再吸附。在后续的研究中,可将BSS-AL应用于含Cr(VI)的食品体系中,对BSS-AL吸附重金属的机制做进一步探讨,以期为食品中有害重金属离子污染物的消减及无害化奠定基础。
[1] JOBBY R, JHA P, YADAV A K, et al. Biosorption and biotransformation of hexavalent chromium [Cr(VI)]: A comprehensive review[J]. Chemosphere, 2018, 207: 255-266.
[2] GUAN Q, GAO K, NING P, et al. Efficient removal of low-concentration Cr(VI) from aqueous solution by 4A/HACC particles[J]. New Journal of Chemistry, 2019, 43(44): 17 220-17 230.
[3] DESMARAIS T L, COSTA M. Mechanisms of chromium-induced toxicity[J]. Current Opinion in Toxicology, 2019, 14: 1-7.
[4] GOMEZ V, CALLAO M P. Chromium determination and speciation since 2000[J]. Trends in Analytical Chemistry, 2006, 25(10): 1 006-1 015.
[5] PAVITHRA K G, JAIKUMAR V, KUMAR S P, et al. A review on cleaner strategies for chromium industrial wastewater: Present research and future perspective[J]. Journal of Cleaner Production, 2019, 228: 580-593.
[6] MIRETZKY P, CIRELLI A F. Cr(VI) and Cr(III) removal from aqueous solution by raw and modified lignocellulosic materials: A review[J]. Journal of Hazardous Materials, 2010, 180(1-3): 1-19.
[7] HAMILTON E M, YOUNG S D, BAILEY E H, et al. Chromium speciation in foodstuffs: A review[J]. Food Chemistry, 2018, 250: 105-112.
[8] PRADHAN D, SUKLA L B, SAWYER M, et al. Recent bioreduction of hexavalent chromium in wastewater treatment: A review[J]. Journal of Industrial and Engineering Chemistry, 2017, 55: 1-20.
[9] WANG R, LIANG R, DAI T, et al. Pectin-based adsorbents for heavy metal ions: A review[J]. Trends in Food Science & Technology, 2019, 91: 319-329.
[10] NAKKEERAN E, PATRA C, SHAHNAZ T, et al. Continuous biosorption assessment for the removal of hexavalent chromium from aqueous solutions using Strychnos nux vomica fruit shell[J]. Bioresource Technology Reports, 2018, 3: 256-260.
[11] BEISL S, MILTNER A, FRIEDL A. Lignin from micro- to nanosize: Production methods[J]. International Journal of Molecular Sciences, 2017, 18(6): 1 244.
[12] SUPANCHAIYAMAT N, JETSRISUPARB K, KNIJNENBURG J T N, et al. Lignin materials for adsorption: Current trend, perspectives and opportunities[J]. Bioresource Technology, 2019, 272: 570-581.
[13] NERIS J B, LUZARDO F H M, DA SILVA E G P, et al. Evaluation of adsorption processes of metal ions in multi-element aqueous systems by lignocellulosic adsorbents applying different isotherms: A critical review[J]. Chemical Engineering Journal, 2019, 357: 404-420.
[14] GE Y, LI Z. Application of lignin and its derivatives in adsorption of heavy metal ions in water: A review[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(5): 7 181-7 192.
[15] GUO X, ZHANG S, SHAN X. Adsorption of metal ions on lignin[J]. Journal of Hazardous Materials, 2007, 151(1): 134-142.
[16] BRDAR M, ![]() A, et al. Comparison of two and three parameters adsorption isotherm for Cr (VI) onto Kraft lignin[J]. Chemical Engineering Journal, 2012, 183: 108-111.
A, et al. Comparison of two and three parameters adsorption isotherm for Cr (VI) onto Kraft lignin[J]. Chemical Engineering Journal, 2012, 183: 108-111.
[17] ALBADARIN A B, ALA’A H, AL-LAQTAH N A, et al. Biosorption of toxic chromium from aqueous phase by lignin: mechanism, effect of other metal ions and salts[J]. Chemical Engineering Journal, 2011, 169(1-3): 20-30.
[18] GONG W, RAN Z, YE F, et al. Composition and structure of an antioxidant acetic acid lignin isolated from shoot shell of bamboo (Dendrocalamus latiforus)[J]. Industrial Crops and Products, 2016, 91: 340-349.
[19] MOUSSAVI G, BARIKBIN B. Biosorption of chromium (VI) from industrial wastewater onto pistachio hull waste biomass[J]. Chemical Engineering Journal, 2010, 162(3): 893-900.
[20] THIRUMAVALAVAN M, LAI Y L, LEE J F. Fourier transform infrared spectroscopic analysis of fruit peels before and after the adsorption of heavy metal ions from aqueous solution[J]. Journal of Chemical & Engineering Data, 2011, 56(5): 2 249-2 255.
[21] PANDEY K K. A study of chemical structure of soft and hardwood and wood polymers by FTIR spectroscopy[J]. Journal of Applied Polymer Science, 1999, 71(12):1 969-1 975.
[22] EMAHI I, SAKYI P O, BRUCE-VANDERPUIJE P, et al. Effectiveness of raw versus activated coconut shells for removing arsenic and mercury from water[J]. Environment and Natural Resources Research, 2019, 9(3): 127-134.
[23] KWAK H W, LEE H, LEE K H. Surface-modified spherical lignin particles with superior Cr(VI) removal efficiency[J]. Chemosphere, 2020, 239(12): 124 733.
[24] WANG X, CHEN L, LI F, et al. Removal of Cr (VI) with wheat-residue derived black carbon: Reaction mechanism and adsorption performance [J]. Journal of Hazardous Materials, 2010, 175(1-3): 816-822.
[25] SAHA B, ORVIG C. Biosorbents for hexavalent chromium elimination from industrial and municipal effluents[J]. Coordination Chemistry Reviews, 2010, 254(23-24): 2 959-2 972.
[26] AKSU Z, AKPINAR D. Competitive biosorption of phenol and chromium(VI) from binary mixtures onto dried anaerobic activated sludge[J]. Biochemical Engineering Journal, 2001, 7(3): 183-193.
[27] AHMED M J K, AHMARUZZAMAN M. A review on potential usage of industrial waste materials for binding heavy metal ions from aqueous solutions[J]. Journal of Water Process Engineering, 2016, 10: 39-47.
[28] ALMEIDA J C, CARDOSO C E D, TAVARES D S, et al. Chromium removal from contaminated waters using nanomaterials-A review[J]. Trends in Analytical Chemistry, 2019, 118: 277-291.
[29] SHAKYA A, ![]() A, AGARWAL T. Biochar synthesis from sweet lime peel for hexavalent chromiumremediation from aqueous solution[J]. Journal of Environmental Management, 2019, 251: 109 570.
A, AGARWAL T. Biochar synthesis from sweet lime peel for hexavalent chromiumremediation from aqueous solution[J]. Journal of Environmental Management, 2019, 251: 109 570.
[30] KARTHIKEYAN T, RAJGOPAL S, MIRANDA L R. Chromium(VI) adsorption from aqueous solution by Hevea Brasilinesis sawdust activated carbon[J]. Journal of Hazardous Materials, 2005, 124(1-3): 192-199.
[31] MA H, YANG J, GAO X, et al. Removal of chromium(VI) from water by porous carbon derived from corn straw: Influencing factors, regeneration and mechanism[J]. Journal of Hazardous Materials, 2019, 369: 550-560.
[32] FOO K Y, HAMEED B H. Insights into the modeling of adsorption isotherm systems[J]. Chemical Engineering Journal, 2009, 156(1): 2-10.
[33] SUN C, LI C, WANG C, et al. Comparison studies of adsorption properties for Hg(II) and Au(III) on polystyrene-supported bis-8-oxyquinoline-terminated open-chain crown ether[J]. Chemical Engineering Journal, 2012, 200: 291-299.