宁夏贺兰山东麓是我国生态最佳、酿酒葡萄质量最优产区之一,具备了生产高端葡萄酒的地理优势[1]。葡萄酒含有多种氨基酸、矿物质、维生素和多酚物质,具有增强免疫力及预防多种癌症和生理保健功效[2]。随着人们生活水平的提高和健康意识的增强,饮酒习惯逐渐发展成为保健型、营养型和享受型,这种消费观念的转变促进了葡萄酒产业的快速发展。对于葡萄酒而言,安全与健康同样重要。但是,除了已知酒精的副作用,酒精饮料也可能是一些毒物和污染物的来源[3]。特别是不良代谢物氨基甲酸乙酯被国际癌症研究机构划分为2A类致癌物质[4],且具有遗传毒性[4]。氨基甲酸乙酯(ethyl carbamate,EC)是酒精发酵饮料中最常见的有毒污染物[5],主要来自于尿素以及酒精发酵过程中的酒精反应和细菌污染[6]。
近年来,国内外研究者对葡萄酒的安全也开始重视,对葡萄酒中氨基甲酸乙酯进行了限量控制,研究者也在不断探索葡萄酒中氨基甲酸乙酯的控制[7]。1976年,MAYER通过对葡萄酒的研究,发现酿酒片球菌属的乳酸菌会产生组胺。并在苹果酸-乳酸发酵时,还会产生酪胺、腐胺和苯乙胺等其他几种胺[8],王慧娟等[9]利用固相萃取结合气相色谱-质谱联用技术对甘肃市售的部分葡萄酒的氨基甲酸乙酯含量进行检测。张凯婷等[10]通过将葡萄汁中加入不同浓度前体氨基酸进行酒精和苹果酸-乳酸发酵,发现不同浓度不同种类的前体氨基酸对生物胺影响都各不相同。国内外研究发现,氨基甲酸乙酯和生物胺的形成受多种条件的影响,还需进一步去研究探索。
本研究通过高效液相色谱技术分析不同温度、接种量、pH以及高糖酒精发酵和苹果酸-乳酸发酵过程中宁夏贺兰山东麓葡萄酒中氨基甲酸乙酯和生物胺含量,对今后通过优化酿造工艺尽可能减少有害物质的产生具有指导意义。
1 材料与方法
1.1 材料与试剂
葡萄为贺兰山东麓葡萄酒产区2017年赤霞珠。
酵母菌:ADT,安琪酵母有限公司;BO213、F33、AC、FX10、71B、F15、X16,法国Laffort公司;EC1118、D254、2323、71B,法国LALVIN公司;KD,法国Vitilevure公司;XR,法国Lamothe-Abiet公司。
乳酸菌为法国诺盟公司OENO 1型,菌种活性≥1 011 CFU/g。
氨基甲酸乙酯、苯丙氨酸、鸟氨酸、赖氨酸、组氨酸、酪氨酸、精氨酸、β-苯乙胺、腐胺、尸胺、组胺、酪胺、精胺、2, 4-二硝基氟苯1-二甲氨基萘-5-磺酰氯(分析纯),西格玛奥德里奇贸易有限公司;氨基硫尿素、尿素、甲醇、乙腈、正己烷(色谱纯),天津市大茂化学试剂厂。
1.2 仪器与设备
1100 Series高效液相色谱仪,美国安捷伦公司;NBS-I氮吹仪,合肥艾本森科学仪器有限公司;HHS-21-6电热恒温水浴锅,上海博讯实业有限公司医疗设备厂。
1.3 实验方法
1.3.1 对照组设置
以葡萄汁氨基甲酸乙酯、生物胺、尿素作对照组。
1.3.2 实验要点
干红葡萄酒工艺流程如下:
原料→分选→除梗→破碎→果胶酶、亚硫酸→25 ℃发酵→10 ℃皮渣浸渍→接种酵母→皮渣分离→生葡萄酒
(1)预处理
将葡萄破碎除梗后按60和40 mg/L的添加量加入亚硫酸和果胶酶,调整pH值为3.3,静置8 h。
(2)14种不同酵母菌的发酵实验
将处理的后葡萄汁加入10倍的超纯水,接入酵母菌,25 ℃发酵,发酵期间每24 h取1次样进行测定。
(3)安琪酵母菌(ADT)发酵实验
不同发酵条件实验:实验选用ADT酵母按不同温度(0.2 g/L接种量)、不同接种量(25 ℃温度)进行发酵实验、不同pH(0.2 g/L、25 ℃温度)的条件发酵,按1.3.2方法酿造并测定。
高糖发酵葡萄酒实验:将葡萄进行阴晾,使糖度达到30%进行酿制,酿制方法相同,并测定相关指标。
1.3.3 苹果酸-乳酸发酵
以经接种安琪酵母菌(ADT)(接种量0.2 g/L),发酵温度(25 ℃)酿造所得葡萄酒为实验对象,接种乳酸菌,分别在不同接种量(0.005、0.01、0.02、0.03、0.04 g/L)、不同温度(15、18、21、24 ℃)下进行2次发酵,发酵结束后,测定相关指标。
1.4 测定方法
1.4.1 酒精度测定
酒精度的测定参考GB/T15038—2006蒸馏法[11]。
1.4.2 氨基酸测定
采用高效液相色谱法,参照冯玲玲等[12]和王小琴[13]的方法进行溶液配制与测定。
1.4.3 氨基甲酸乙酯测定
采用高效液相色谱法,参考付方圆等[14]的方法进行样品处理与测定。
1.4.4 生物胺测定
采用高效液相色谱法,参考王振等[15]和陆永梅等[16]的方法进行测定。
1.4.5 尿素测定
采用分光光度法,参考梁新红等[17]的方法进行测定。
2 结果与分析
2.1 14种不同酵母菌发酵对葡萄酒氨基甲酸乙酯、生物胺的影响
2.1.1 不同酵母菌发酵对葡萄酒氨基甲酸乙酯的影响
随着发酵的进行与发酵结束,由图1可知在相同的发酵条件下,接种不同酵母菌的发酵过程中氨基甲酸乙酯的曲线变化规律大致相同,但不同酵母菌对葡萄酒发酵过程中氨基甲酸乙酯含量差异极显著(P<0.01)。氨基甲酸乙酯作为酵母菌的氮代谢产物,是由酵母在精氨酸代谢过程中产生并逐渐积累的中间产物尿素在发酵液中与乙醇反应形成的[18]。但是由于不同酵母菌尿素循环氮代谢能力不同或代谢途径不同,释放到发酵液中的尿素会有所不同,因此对氨基甲酸乙酯形成的影响不同,这与于英等[19]、王根杰等[20]研究结果相吻合。

a-第一组酵母菌;b-第二组酵母菌
图1 不同酵母菌发酵葡萄酒对氨基甲酸乙酯的影响
Fig.1 Effect of wine fermentation by different yeasts on ethyl carbamate
2.1.2 不同酵母菌发酵葡萄酒生物胺的影响
如图2所示生物胺初始浓度来自于葡萄汁。由方差分析可知,不同酵母菌发酵葡萄酒中生物胺含量变化差异极显著(P<0.01)。由图2可知,生物胺在发酵过程中并无明显的变化,这与大部分酵母菌在发酵过程不生成生物胺有关[21];但当到达发酵后期特别是接近结束时,产生了部分生物胺,因此含量有所上升,这是由于酵母细胞在自身产生的蛋白酶的酶解作用下开始自溶解体,许多活性物质包括生物胺被释放出来[22],使最后的生物胺测定值升高,但是由于不同的酵母菌自溶能力有差异,所以最后的测定值不同[23]。
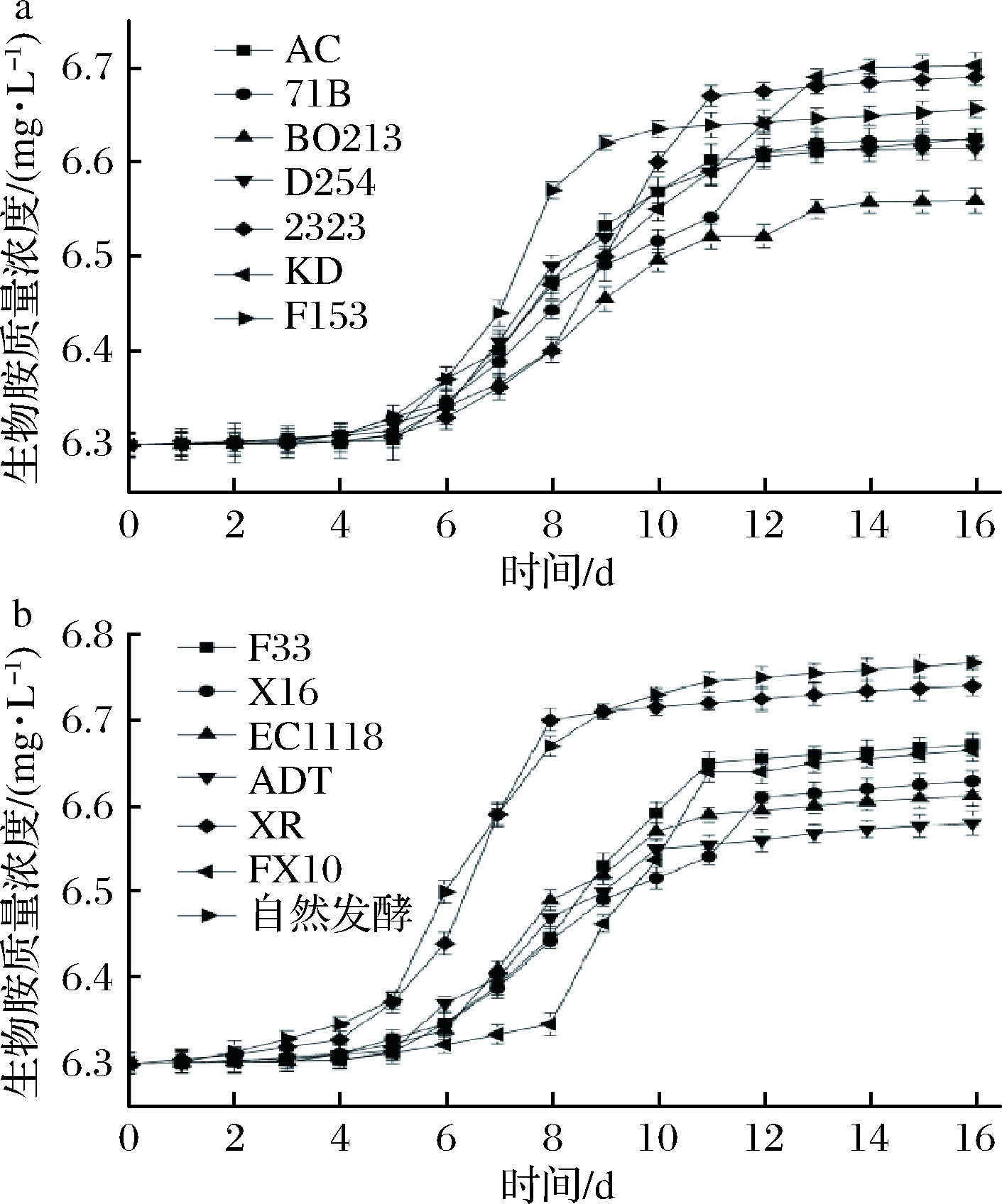
a-第1组酵母菌;b-第2组酵母菌
图2 不同酵母菌发酵葡萄酒对生物胺的影响
Fig.2 Effect of wine fermentation by different yeasts on biogenic amines
2.2 安琪酵母菌(ADT)发酵实验结果
2.2.1 不同发酵条件对氨基甲酸乙酯和生物胺的影响
2.2.1.1 发酵温度的影响
由图3可知,不同温度下氨基甲酸乙酯和生物胺含量组间均表现为差异极显著(P<0.01)。温度升高加快了酵母代谢精氨酸产生尿素的速度以及尿素和乙醇反应生成氨基甲酸乙酯的速度,曲线坡度变大,但当精氨酸被消耗完后,氨基甲酸乙酯变化很小。同时,生物胺在发酵前期变化不大,但是随着温度升高,酵母自溶程度加大,生物胺测定值也加大的现象。董兴全等[24]研究发现发酵温度是影响氨基甲酸乙酯的最重要因素。
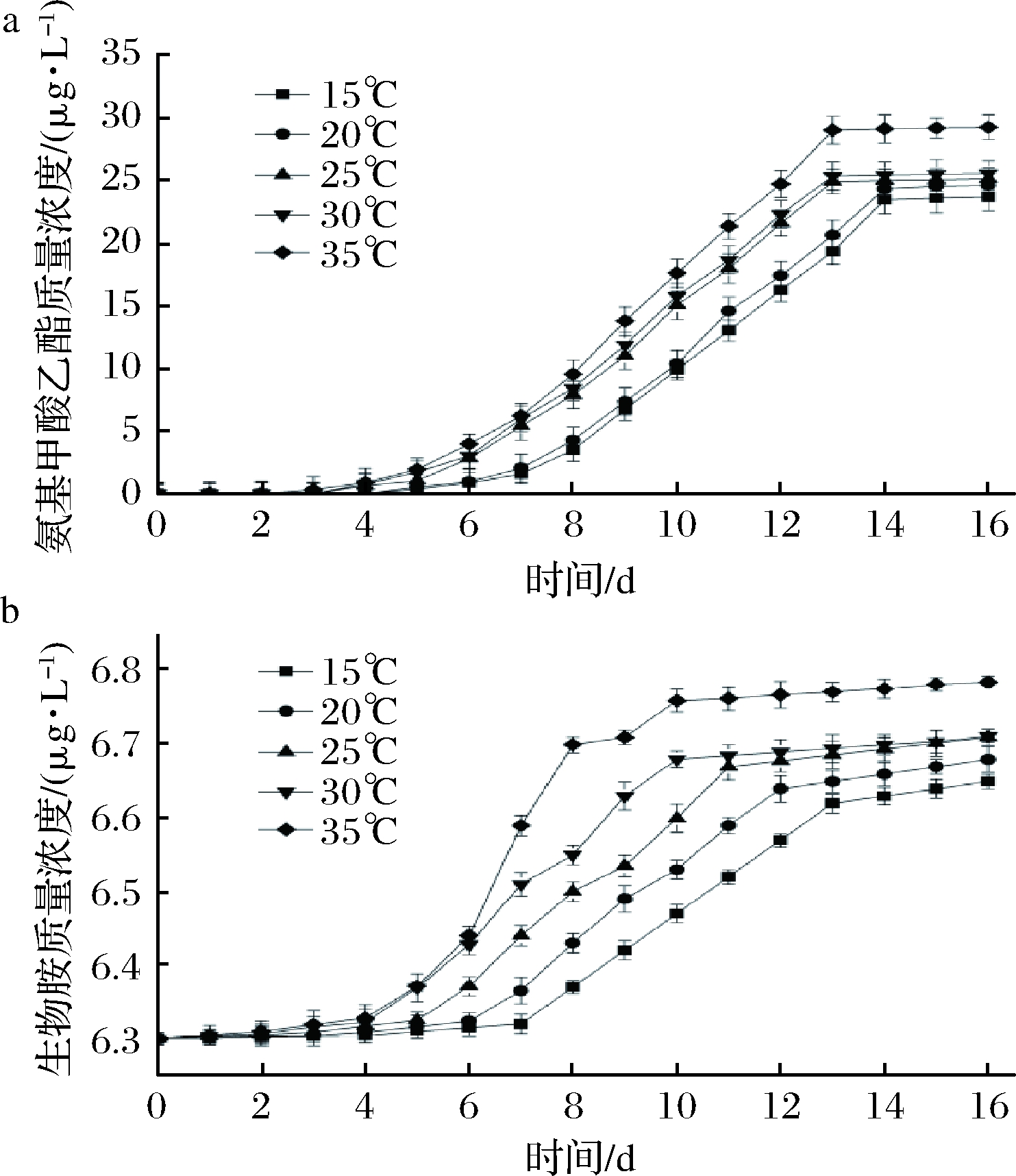
a-氨基甲酸乙酯;b-生物胺
图3 不同温度下发酵葡萄酒对氨基甲酸乙酯和生物胺的影响
Fig.3 Effect of wine fermentation at different temperatures on ethyl carbamate and biogenic amines
2.2.1.2 不同接种量的影响
由图4可知,接种量不同,氨基甲酸乙酯和生物胺含量也会不同。各组间具有极显著差异(P<0.01)。接种量大,酵母代谢旺盛,产生的氨基甲酸乙酯也会增多,氨基甲酸乙酯形成受接种量的影响较小。接种量增大后,发酵后期酵母菌自溶解体量就会增大,生物胺含量随之升高,与王瑞等[25]研究结果一致。
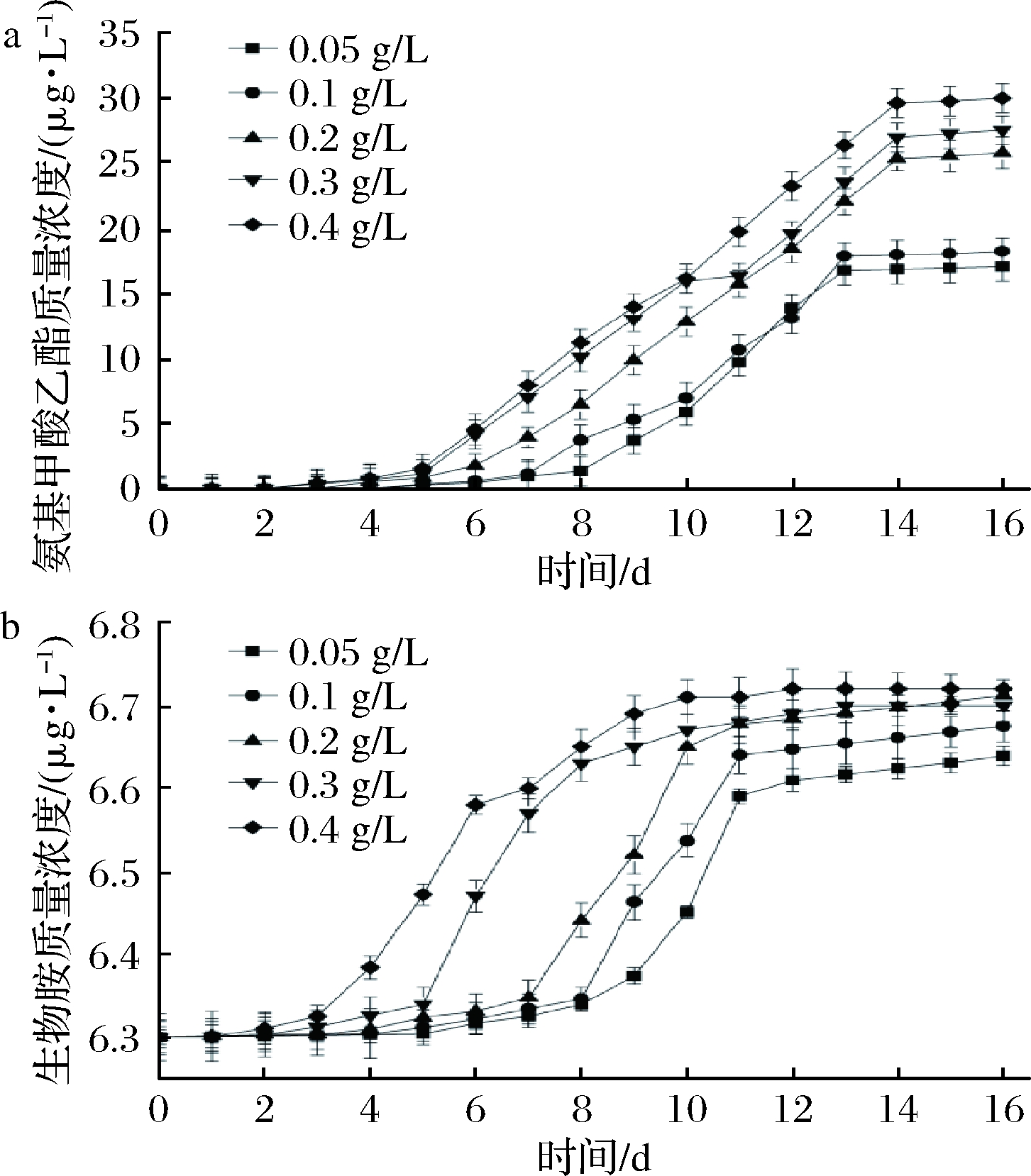
a-氨基甲酸乙酯;b-生物胺
图4 不同接种量下发酵葡萄酒对氨基甲酸乙酯和生物胺的影响
Fig.4 Effect of fermented wine on ethyl carbamate and biogenic amines under different inoculums
2.2.1.3 不同pH值的影响
由图5可知,pH在2.3~4.3,氨基甲酸乙酯与pH值呈正相关,各组间差异极显著(P<0.01)。但是pH值比较低的葡萄酒中氨基甲酸乙酯形成速率稍高,这也证明了氨基甲酸乙酯形成了酸催化机制[26]。
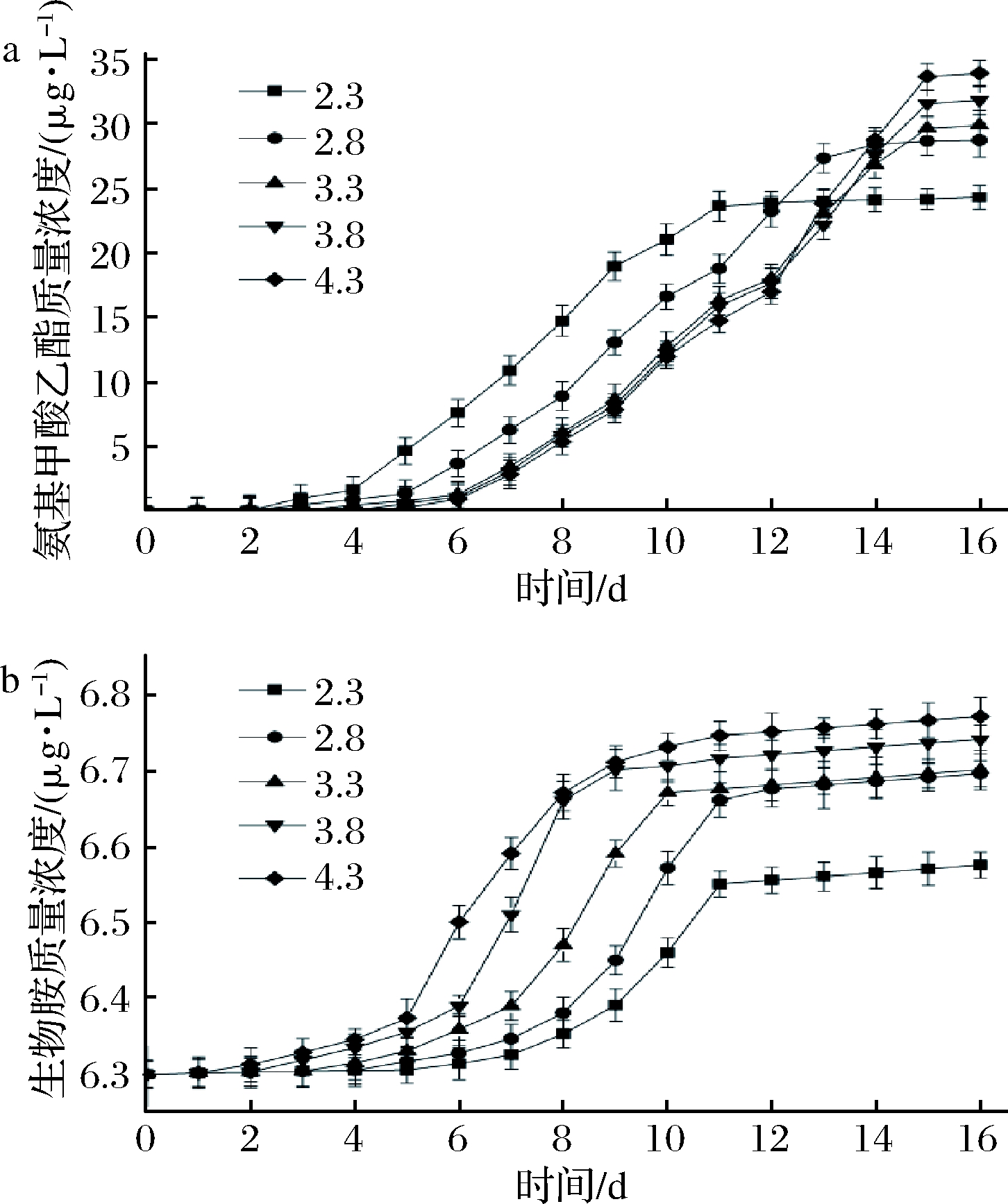
a-氨基甲酸乙酯;b-生物胺
图5 不同pH值下发酵葡萄酒对氨基甲酸乙酯和生物胺 的影响
Fig.5 Effect of fermented wine on ethyl carbamate and biogenic amines at different pH
氨基酸脱羧酶是影响生物胺含量的重要因素, pH值与生物胺含量呈正相关,各组差异极显著(P<0.01)。pH值越低,氨基酸脱羧酶活性也随之降低,从而影响生物胺含量。此结论与张无疾等[27]研究结果一致。
2.2.2 高糖发酵对氨基甲酸乙酯和生物胺的影响
由表1可知,高糖发酵导致酒精度升高,酒精度可达17.60 %vol,而由新鲜葡萄酿造的葡萄酒酒精度只在12.8 %vol。经过方差分析,差异极显著(P<0.01),酒精度对氨基甲酸乙酯的形成影响较大,因为酒精是氨基甲酸乙酯的前体物质,外源性尿素及代谢产生的尿素与乙醇相互作用,可以生成氨基甲酸乙酯[28]。说明不同糖度葡萄酒发酵对氨基甲酸乙酯含量影响较大。
表1 不同糖度下发酵葡萄酒对氨基甲酸乙酯的影响
Table 1 Effect of wine fermentation on ethyl carbamate under different sugar degrees

原料处理方式糖含量/(g·L-1)酒精度/%vol氨基甲酸乙酯含量/(μg·L-1)RSD/%阴晾干化300a17.6a27.642 3a0.461 9新鲜217b12.8b18.517 7b0.708 2
注:表中不同小写字母代表差异显著(P<0.05)
由表2可知,高糖发酵后的葡萄酒生物胺含量大于新鲜葡萄发酵的葡萄酒。通过方差分析,组间差异极显著(P<0.01),在酿造过程中,阴晾干化过的葡萄果实氨基酸浓度要高于新鲜果实,导致生物胺含量增多。说明不同酒精度对葡萄酒苹果酸-乳酸发酵后生物胺含量影响较大。
表2 不同酒精度下葡萄酒苹果酸-乳酸发酵对生物胺的影响
Table 2 Effect of malolactic fermentation on biogenic amines in wine with different alcohol degrees

酒精度/%vol2-苯乙胺/(mg·L-1)腐胺/(mg·L-1)尸胺/(mg·L-1)组织胺/(mg·L-1)酪胺/(mg·L-1)精胺/(mg·L-1)总含量/(mg·L-1)RSD/%17.65.674a43.911a—1.096b17.238a3.231a71.150a1.932 412.83.470b32.087b—1.494a15.995b2.975b56.021b2.470 4
注:-表示未检出
2.3 苹果酸-乳酸发酵对葡萄酒中氨基甲酸乙酯和生物胺的影响
2.3.1 不同发酵条件对葡萄酒中氨基甲酸乙酯的影响
2.3.1.1 发酵温度的影响
由表3可知,在苹果酸-乳酸发酵过程中,氨基甲酸乙酯有所增加。经过方差分析发现,精氨酸、瓜氨酸、尿素、氨基甲酸乙酯各组间呈现显著差异性(P<0.01)。一方面,乳酸菌的精氨酸脱亚胺反应,产生较多的瓜氨酸释放到葡萄醪中[29]。另一方面,是氨基甲酸乙酯形成的延续,而且温度高反应速度加快。
表3 不同发酵温度对氨基甲酸乙酯的影响
Table 3 Effect of different fermentation temperature on ethyl carbamate
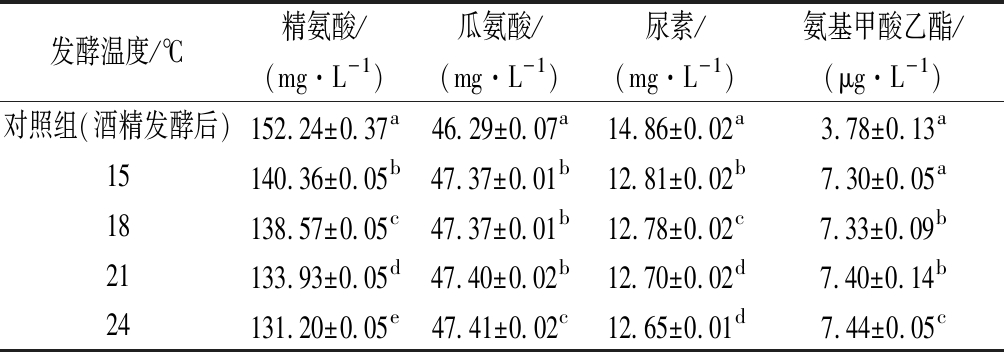
发酵温度/℃精氨酸/(mg·L-1)瓜氨酸/(mg·L-1)尿素/(mg·L-1)氨基甲酸乙酯/(μg·L-1)对照组(酒精发酵后)152.24±0.37a46.29±0.07a14.86±0.02a3.78±0.13a15140.36±0.05b47.37±0.01b12.81±0.02b7.30±0.05a18138.57±0.05c47.37±0.01b12.78±0.02c7.33±0.09b21133.93±0.05d47.40±0.02b12.70±0.02d7.40±0.14b24131.20±0.05e47.41±0.02c12.65±0.01d7.44±0.05c
2.3.1.2 接种量的影响
经过方差分析发现,精氨酸、瓜氨酸、尿素、氨基甲酸乙酯各组间呈现显著差异性(P<0.01)。由表4可知,接种量大,乳酸菌生物量增多,发酵速度加快,精氨酸消耗加快,氨基甲酸乙酯的量有所增加。
表4 不同接种量对氨基甲酸乙酯的的影响
Table 4 Effect of different inoculation amount on ethyl carbamate
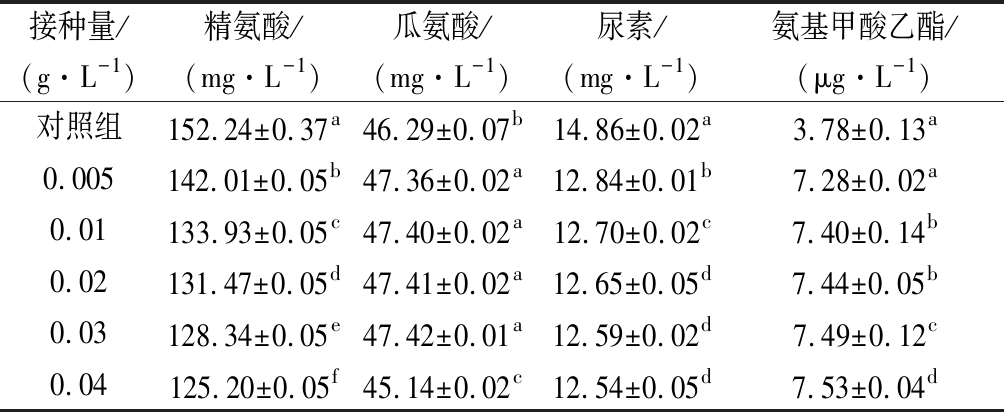
接种量/(g·L-1)精氨酸/(mg·L-1)瓜氨酸/(mg·L-1)尿素/(mg·L-1)氨基甲酸乙酯/(μg·L-1)对照组152.24±0.37a46.29±0.07b14.86±0.02a3.78±0.13a0.005142.01±0.05b47.36±0.02a12.84±0.01b7.28±0.02a0.01133.93±0.05c47.40±0.02a12.70±0.02c7.40±0.14b0.02131.47±0.05d47.41±0.02a12.65±0.05d7.44±0.05b0.03128.34±0.05e47.42±0.01a12.59±0.02d7.49±0.12c0.04125.20±0.05f45.14±0.02c12.54±0.05d7.53±0.04d
2.3.2 不同发酵条件对葡萄酒中生物胺的影响
2.3.2.1 不同发酵温度的影响
葡萄酒中的生物胺除了少量来自于葡萄果实外,主要来自苹果酸-乳酸发酵过程。由表5可知,发酵温度为18~21 ℃时,乳酸菌生长最适宜,产生不同的脱羧酶作用于相对应的氨基酸,氨基酸开始脱去羧基生成相应的生物胺[30]。温度较高时,脱羧酶的活性增强,脱羧反应增强产生较多的生物胺,另外还有可能在接近发酵结束时乳酸菌部分解体产生。各组间差异极显著(P<0.01),不同温度发酵对葡萄酒中生物胺的影响较大。
表5 不同温度发酵对葡萄酒中生物胺的影响 单位:mg/L
Table 5 Effect of different temperature fermentation on biogenic amines in wine

发酵温度/℃β-苯乙胺腐胺尸胺组胺酪胺精胺总胺对照组0.52±0.011.05±0.050.38±0.011.81±0.021.14±0.022.12±0.017.02±0.01a150.83±0.011.11±0.050.60±0.012.01±0.012.01±0.013.97±0.0210.53±0.12b181.09±0.021.36±0.010.67±0.012.32±0.022.36±0.014.16±0.0111.96±0.04c211.45±0.021.86±0.020.95±0.023.06±0.012.91±0.014.48±0.0214.71±0.14d241.59±0.012.09±0.021.01±0.013.20±0.012.97±0.024.75±0.0115.61±0.03e
2.3.2.2 接种量的影响
由表6可知,生物胺含量受接种量的影响。根据方差分析结果得出,不同接种量间差异极显著(P<0.01)。接种量大,乳酸菌生物量大,繁殖速度加快,所产生的脱羧酶相应增多,生物胺的形成的量也愈大,但是接种量过大,使乳酸菌呼吸过快生长受抑制,生物胺不会大幅度增大[31]。
表6 不同接种量发酵对葡萄酒中生物胺的影响 单位:mg/L
Table 6 Effect of fermentation with different inoculums on biogenic amines in wine
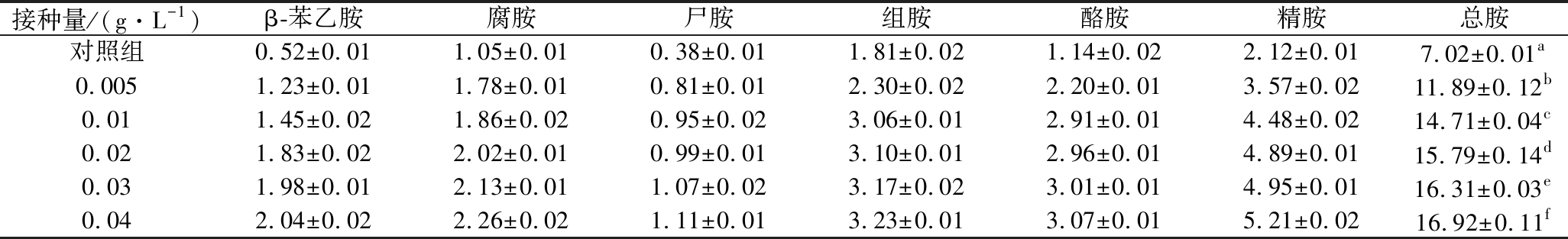
接种量/(g·L-1)β-苯乙胺腐胺尸胺组胺酪胺精胺总胺对照组0.52±0.011.05±0.010.38±0.011.81±0.021.14±0.022.12±0.017.02±0.01a0.0051.23±0.011.78±0.010.81±0.012.30±0.022.20±0.013.57±0.0211.89±0.12b0.011.45±0.021.86±0.020.95±0.023.06±0.012.91±0.014.48±0.0214.71±0.04c0.021.83±0.022.02±0.010.99±0.013.10±0.012.96±0.014.89±0.0115.79±0.14d0.031.98±0.012.13±0.011.07±0.023.17±0.023.01±0.014.95±0.0116.31±0.03e0.042.04±0.022.26±0.021.11±0.013.23±0.013.07±0.015.21±0.0216.92±0.11f
3 结论
伴随着我国经济的蓬勃发展,葡萄酒已经成为大众葡萄消费品。但是,近年来研究者发现葡萄酒中含有氨基甲酸乙酯和生物胺,这些物质如果超过一定量会对人体有毒害作用。氨基甲酸乙酯是由精氨酸代谢中间产物尿素进一步代谢与乙醇自发反应生成。生物胺是在氨基酸脱羧酶作用下,氨基酸脱羧而形成。
本研究发现,不同酵母菌对葡萄酒中氨基甲酸乙酯的影响不同,大部分酵母菌酒精发酵时不产生生物胺。高温、高糖、高接种量进行酒精发酵都会增加氨基甲酸乙酯的含量。在苹果酸-乳酸发酵时,高接种量和高温发酵直接导致生物胺含量增高,也会间接使氨基甲酸乙酯增加。
[1] 李学平.银川市贺兰山东麓葡萄酒产业发展现状与对策研究[J].宁夏农林科技, 2017, 58(7):58-60.
[2] 朱会霞.家庭酿造葡萄酒技术[J].现代农村科技, 2011(18):56.
[3] LIN Luo, HONG Taolei, JIN Yiyang, et al. Development of an indirect ELISA for the determination of ethyl carbamate in Chinese rice wine[J]. Analytica Chimica Acta,2017,950:162-169.
[4] LEE J B, KIM M K, KIM B K, et al. . Analysis of ethyl carbamate in plum wines produced in Korea[J]. Food science and Biotechnology,2018,27(1):277-282.
[5] BAI W D, SUN S G, ZHAO W H, et al. Determination of ethyl carbamate (EC) by GC-MS and characterization of aroma compounds by HS-SPME-GC-MS during wine frying status in hakka yellow rice wine[J]. Food Analytical Methods, 2017, 10(6):2 068-2 077.
[6] XIAN Yanping, WU Yuluan, DONG Hao, et al. Ice-bath assisted sodium hydroxide purification coupled with GC-MS/MS analysis for simultaneous quantification of ethyl carbamate and 12 N-nitrosoamines in yellow rice wine and beer [J]. Food Chemistry,2019,300:125 200.
[7] MAYER K. Biogene amine in lebensmitteln. eigene untersuchungen in wein und sauerkraut[J]. Plant Foods for Human Nutrition, 1976,26(1-3):263-269.
[8] 梁新红. 中国葡萄酒中氨基甲酸乙酯的研究[D].杨凌:西北农林科技大学,2007.
[9] 王慧娟,孙建云,马文杰.甘肃部分酒类产品中氨基甲酸乙酯污染状况调查[J].中国酿造,2018,37(8):182-185.
[10] 张凯婷,王瑞,翟银成,等.前体氨基酸对赤霞珠干红葡萄酒中生物胺含量的影响[J].中国酿造, 2017, 36(7):148-152.
[11] 杨华峰.银朗姆酒风味形成及氨基甲酸乙酯控制研究[D].广州:华南理工大学, 2017.
[12] 冯玲玲,岳淑梅,万绍晖,等.反相高效液相色谱-柱前衍生化法测定大青叶中氨基酸的含量[J]. 中国药房, 2006(9):694-695.
[13] 王小琴,邹玉安,郭春燕,等.DNFB柱前衍生化RP-HPLC测定大鼠肝组织18种氨基酸[J].河北北方学院学报(自然科学版), 2015, 31(5):4-8.
[14] 付方圆,薛洁,梁萌萌,等.葡萄酒贮存过程中氨基甲酸乙酯含量的变化[J].食品与发酵工业, 2014, 40(8):34-39.
[15] 王振, 孔程仕, 翟映雪.利用HPLC法检测葡萄酒中的生物胺[J].酿酒科技, 2013(10):100-103.
[16] 陆永梅, 董明盛, 吕欣,等.高效液相色谱法测定黄酒中生物胺的含量[J].食品科学, 2006, 27 (1):196-199.
[17] 梁新红, 杨大光, 孙俊良,等.分光光度法测定葡萄酒中尿素含量[J].食品工业科技, 2012, 33(4):76-79.
[18] 高年发, 刘欠欠,韩德新,等.氨基甲酸乙酯含量随葡萄酒酿造过程变化趋势的研究[J].食品工业科技, 2010, 31(7):191-193.
[19] 于英,李记明,沈志毅,等.葡萄酒中氨基甲酸乙酯的含量测定及酿造工艺对其含量的影响[J].食品与发酵工业, 2012, 38(1):152-155.
[20] 王根杰,李德美,张亚东,等.不同发酵处理对赤霞珠葡萄酒中氨基甲酸乙酯产量的影响[J].食品与发酵工业, 2018, 44(8):172-176.
[21] 吕雪峰.发酵乳制品中酿酒酵母安全性评价的初步研究[D].长春:吉林农业大学, 2013.
[22] 姚晓红,吴逸飞,汤江武,等.酵母细胞自溶条件的研究[J].饲料研究,2007(12):5-8.
[23] 卢丕超,刘宗昭.葡萄酒中氨基甲酸乙酯控制技术的研究[J].农家参谋, 2019(13):182;211.
[24] 董兴全,丁燕.葡萄酒中氨基甲酸乙酯的形成机理及影响因素[J].酿酒科技, 2014(12):47-52.
[25] 王瑞,董荣,乔丹,等.葡萄酒酿造过程中不同工艺参数对生物胺含量的影响[J].酿酒科技, 2019(1):41-47.
[26] STEVENS D F, OUGH C S. Ethyl formation:Reaction of urea and citrulline with ethanol in wine under low to normal temperature conditions[J].American Journal of Enologyand Viticulture, 1993, 44(3):309-311.
[27] 张无疾,夏小乐,张斌,等.黄酒前酵中生物胺生成规律的研究[J].现代食品科技,2015,31(10):269-274;300.
[28] 方若思,董亚晨,焦志华,等.传统黄酒发酵氨基甲酸乙酯产生的代谢规律及机制初探[J].中国食品学报, 2013, 13(8):21-26.
[29] 林宜锦, 欧梦莹,关统伟,等.酿造酒中氨基甲酸乙酯的研究进展[J].食品工业科技, 2019, 40(11):358-364.
[30] 王光强,俞剑燊, 胡健,等.食品中生物胺的研究进展[J].食品科学, 2016, 37(1):269-278.
[31] 张吉明, 赵燕梅,许庆方.产生物胺乳酸菌研究概述[J].山西农业科学, 2014, 42(5):521-525.