胞外多糖(exopolysaccharide,EPS)是乳酸菌的主要代谢产物之一,其以黏液多糖的形式分泌到环境中,或黏附在细胞表面形成荚膜多糖[1]。EPS有助于细菌形成生物被膜,是细菌生物被膜的重要组成部分,可以帮助细菌抵御不良环境,如干燥、渗透胁迫或噬菌体侵袭等[2-3]。EPS因为具有安全性高、副作用小、独特的物理和流变性能,在石油、化工、食品、医药等行业中被广泛用作乳化剂、胶凝剂、增稠剂、成膜剂和润滑剂等[4-5];此外,乳酸菌EPS具有良好的生物活性,国内外多项研究表明,乳酸菌EPS具有抗氧化[6-7]、免疫调节[8]、抗菌[9]、降血糖[2]等功能。氧化应激是导致衰老和疾病的一个重要因素,现有合成抗氧化剂有较高的抗氧化活性,但同时也具有细胞毒性和致癌风险[10-11],而天然抗氧化剂分布广泛且具有安全、高效等特点,不失为替代合成抗氧化剂的一种可行选择,乳酸菌EPS具有较强的抗氧化能力,在作为天然抗氧化剂方面具有巨大潜力。
乳酸菌EPS因其卓越的生理功能引起研究人员的广泛关注,但由于其产量较低,提取成本较高,生产应用受到限制,因此提升EPS产量势在必行。诱变育种可以改良微生物的遗传性状,是现代食品工业及发酵工业中的重要育种途径,也是近年来研究的热点[12]。紫外诱变具有方法简单,效果好,可在短时间内获得大量突变体等优势,在诱变育种中得到广泛运用[13]。
乳酸菌及其EPS的应用一直受到国内外研究者的广泛关注,目前虽已有较多关于此方面的研究,但不同的乳酸菌及其EPS的功能、结构均有所不同,因此对不同乳酸菌的益生功能还有待研究。我国各类自然发酵产品(如开菲尔粒[14]、果蔬自然发酵产品[15]等)不仅具有食用价值,同时蕴含着丰富的乳酸菌资源,对其利用还有待进一步开发。本研究从实验室保藏乳酸菌(各类发酵产品中分离获得)中筛选高产EPS菌株,并对其进行诱变,筛选正向突变菌株,比较原始菌株及诱变菌株对酸、胆盐及人工模拟胃、肠液的耐受性,并对其EPS的抗氧化活性进行了测定,以期为扩大乳酸菌的综合利用,以及乳酸菌EPS作为天然抗氧化剂提供理论基础依据。
1 材料与方法
1.1 材料与试剂
L1~L22均为实验室保存乳酸菌菌株,其中L1~L12从市售益生菌粉、酸奶中分离获得,L13~L18来源于甜橙、柚子自然发酵液,L18~L22从开菲尔粒中分离获得。
透析袋,北京索莱宝科技有限公司;95%乙醇,广州市泉硕贸易有限公司;三氯乙酸,天津市福晨化学试剂厂;牛胆盐、胰蛋白酶,上海源叶生物科技有限公司;水杨酸、浓硫酸、苯酚,广州市化学试剂厂;1,1-二苯基-2-三硝基苯肼[1,1-Diphenyl- -1-(2,4,6-trinitrophenyl) hydrazyl,DPPH]、2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2,2′-Azinobis-(3-ethylbenzthiazoline-6-sulfonic acid),ABTS],美国Sigma公司。
1.2 培养基及试剂配制
MRS培养基(g/L):胰蛋白胨10.0,牛肉膏5.0,酵母粉4.0,葡萄糖20.0,吐温-80 1.0,K2HPO4·7H2O 2.0,CH3COONa·3H2O 5.0,柠檬酸三胺 2.0,MgSO4·7H2O 0.2,MnSO4·4H2O 0.05,pH 6.0,121℃灭菌20 min。
人工模拟胃液:125 mmol/L NaCl、7 mmol/L KCl、45 mmol/L NaHCO3、3 g/L胃蛋白酶,pH调至3.0,0.22 μm滤头过滤除菌。
人工模拟肠液:1 g/L胰蛋白酶、3 g/L牛胆盐,pH调至7.5,0.22 μm滤头过滤除菌。
ABTS+工作液:7.4 mmol/L ABTS与等体积2.6 mmol/L K2S2O8混合后于黑暗条件下静置12 h,使用前用pH 7.4的PBS稀释,使其在734 nm的吸光值为0.7±0.2。
1.3 仪器与设备
1285生物安全柜,美国Thermo Electron公司;Avanti J-E落地式高速大容量离心机,美国贝克曼库尔特有有限公司;SpectraMax i3x连续波长多功能微孔板检测平台,美国Molecular Devices公司;Scientz-12N冷冻干燥机,宁波新芝生物科技股份有限公司。
1.4 实验方法
1.4.1 菌株的活化
乳酸菌按2%接种量接种于MRS液体培养基中,于37 ℃条件下静置培养12 h,活化2代备用。
1.4.2 EPS的提取及测定
参照WANG等的方法[16]并略作修改。活化后的乳酸菌按2%接种量接种于MRS液体培养基中,37 ℃培养24 h后于4 ℃,10 000 r/min条件下离心10 min,去沉淀,上清液中加入质量浓度为800 g/L的三氯乙酸,使其终质量浓度为4 g/L,于4 ℃下静置6~8 h。4 ℃,10 000 r/min离心15 min,取上清液,加入3倍体积体积分数为95%的乙醇,在4 ℃冰箱中放置12~15 h后4 ℃,10 000 r/min条件下离心15 min,取沉淀,加入一级水溶解后,4 ℃离心10 min去除灰色不溶物。上清液移至透析袋中,蒸馏水透析,3 h后第1次换水,后每隔8 h换1次水,透析2 d,收集透析液进行真空冷冻干燥,即得粗多糖。以葡萄糖作为标准曲线,苯酚-硫酸法[12]测定EPS含量。
1.4.3 紫外诱变时间的选择
乳酸菌活化后离心收集菌体,用9 g/L的生理盐水清洗后稀释至107 CFU/mL,取2 mL于灭菌平皿中,在紫外灯(30 W,距离30 cm)下分别照射0、20、40、60、80、100、120、150、200、250 s。适当稀释菌液后各取100 μL涂布于MRS平板中,在黑暗条件下37 ℃培养48 h,计数,计算致死率,如公式(1)所示:
致死率![]()
(1)
1.4.4 紫外诱变及突变株稳定性测定
乳酸菌经紫外诱变后适当稀释,涂布于MRS培养基中,37 ℃避光培养48 h,观察菌落生长情况。挑取直径较大,菌质稠厚的菌落进行培养,测定其EPS含量。对EPS产量显著提高的乳酸菌进行二次紫外诱变并筛选出高产EPS突变菌株,将EPS产量提高的菌株连续培养10代,每隔2代进行发酵检测其EPS含量,观察其产EPS的稳定性。
1.4.5 菌株对酸、胆盐及人工模拟胃、肠液的耐受性
1.4.5.1 对酸的耐受性
采用黄燕燕等的方法[17]并略作修改。活化菌株取500 μL接种到pH值为2.0、3.0、4.0的9.5 mL MRS培养基中,37 ℃培养3 h后适当浓度稀释,微量点样法点样,于37 ℃培养48 h计数,按照公式(2)计算菌株对酸的耐受性:
耐酸性![]()
(2)
式中:A1为接种到MRS培养基中培养3 h后的活菌数;A0为接种到MRS培养基中培养0 h后的活菌数。
1.4.5.2 对胆盐的耐受性
参照文献方法[17]并稍作修改。活化菌株取250 μL接种到含2.0、3.0、4.0 g/L牛胆盐的5 mL MRS液体培养基中,37 ℃培养24 h,适当浓度稀释后点样,于37 ℃条件下培养48 h后计数,计算活菌数。
1.4.5.3 对人工模拟胃、肠液的耐受性
根据李岩岩的方法[18]并略作修改。菌株活化后,取1 mL菌液于4 ℃条件下10 000 r/min离心5 min,收集菌体,无菌生理盐水洗涤2次,接种于9 mL人工模拟胃液中,以无菌生理盐水作为对照,37 ℃培养2 h后点样,于37 ℃培养48 h后计数。另取1 mL经人工模拟胃液处理的菌液于9 mL人工模拟肠液中处理8 h,每2 h取样测定其活菌数。
1.4.6 乳酸菌EPS的抗氧化活性的测定
将粗提EPS溶于蒸馏水中配置成不同浓度的溶液,参照文献的方法[1,19-20] 并稍作修改进行抗氧化活性的测定,以相同浓度的抗坏血酸(ascorbic acid,VC)作为阳性对照。
1.4.6.1 清除DPPH自由基的能力
A1,150 μL EPS溶液加入150 μL 0.2 mmol/L DPPH-乙醇溶液;A2,150 μL EPS溶液加入150 μL无水乙醇;A0,150 μL无水乙醇加入150 μL 0.2 mmol/L DPPH-乙醇溶液。配制A0、A1、A2 3种溶液,混匀后于黑暗下静置30 min,测其OD517nm,以VC为阳性对照,按公式(3)计算DPPH清除率:
DPPH清除率![]()
(3)
式中:A0、 A1、 A2分别为A0、 A1、 A2 3种溶液的OD517nm。
1.4.6.2 清除ABTS自由基的能力
A1,30 μL EPS溶液加入1.5 mL ABTS+工作液中;A2,30 μL EPS溶液加入1.5 mL K2S2O8中;A0,30 μL蒸馏水加入1.5 mL ABTS+工作液中。配制A0、A1、A2 3种溶液,混匀后于37 ℃条件下反应5 min,测其OD734nm,以VC为阳性对照,按照公式(4)计算ABTS清除率:
ABTS清除率![]()
(4)
式中:A0、 A1、 A2分别为A0、 A1、 A2 3种溶液的OD734nm。
1.4.6.3 清除羟自由基(·OH)的能力
配制A0、 A1、 A2 3种溶液:A1,各取50 μL硫酸亚铁溶液(9 mmol/L)、水杨酸-乙醇(9 mmol/L)、H2O2(8.8 mmol/L)加入50 μL EPS溶液中;A2,以蒸馏水替代过氧化氢;A0,以蒸馏水替代EPS溶液。混匀后于37 ℃黑暗条件下反应30 min,测其OD510nm,以VC为阳性对照,按公式(5)计算·OH清除率:
·OH清除率![]()
(5)
式中:A0、 A1、 A2分别为A0、 A1、 A2 3种溶液的OD510nm。
1.4.6.4 清除超氧阴离子![]() 的能力
的能力
40 μL多糖溶液中加入3倍体积Tris-HCl(pH 8.2),在30 ℃条件下反应20 min后自然冷却,加入120 μL焦性没食子酸(7 mmol/L),摇匀反应3 min后加入40 μL 浓HCl停止反应,测其OD320nm,以VC为阳性对照,按照公式(6)计算![]() 清除率:
清除率:
![]() 清除率
清除率![]()
(6)
式中:A0、 A1、 A2分别为A0、 A1、 A2 3种溶液的OD320nm。
1.5 统计分析
试验涉及的数据均重复3次或3次以上,采用SPSS 16.0对数据进行统计分析,以P<0.05表示数据具有统计学差异。
2 结果与分析
2.1 高产EPS菌株的筛选
采用苯酚-硫酸法检测乳酸菌的EPS产量,以葡萄糖制作标准曲线得到方程为y=0.006 8x+0.101 2,R2=0.998 2。由图1可知22株乳酸菌的EPS产量在79.70~171.95 mg/L,L3、L15、L16的EPS产量明显高于其他乳酸菌,其中L15最高,产量达到175.88 mg/L,因此后续实验选取L15为试验菌株进行研究。
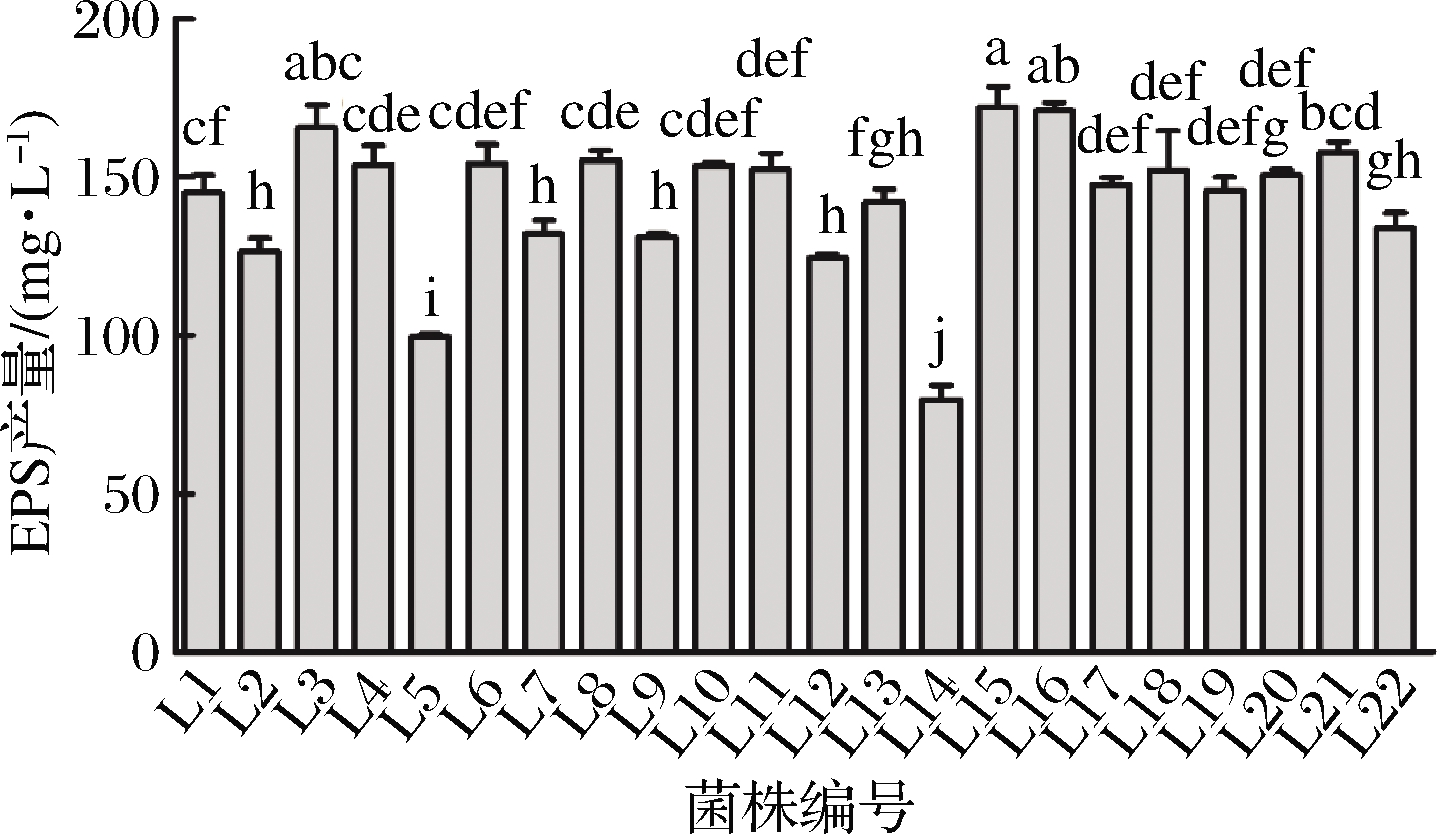
图1 不同乳酸菌的EPS产量
Fig.1 The EPS production of the different strains of Lactobacillus
注:图中不同字母表示差异显著性(P<0.05)(下同)
2.2 诱变时间的确定
对L15菌悬液进行紫外照射处理后,计算不同照射时间对菌株的致死情况。由图2可知,随着紫外处理时间的增加,菌株的致死率也随之提升,L15对紫外较为敏感,当诱变时间为20 s时,菌株致死率为78.49%,40~150 s时,致死率均已达90%以上。采用致死率70%~80%的诱变剂量有利于提高菌株正突变率[21],因此选择20 s为最佳诱变时间。
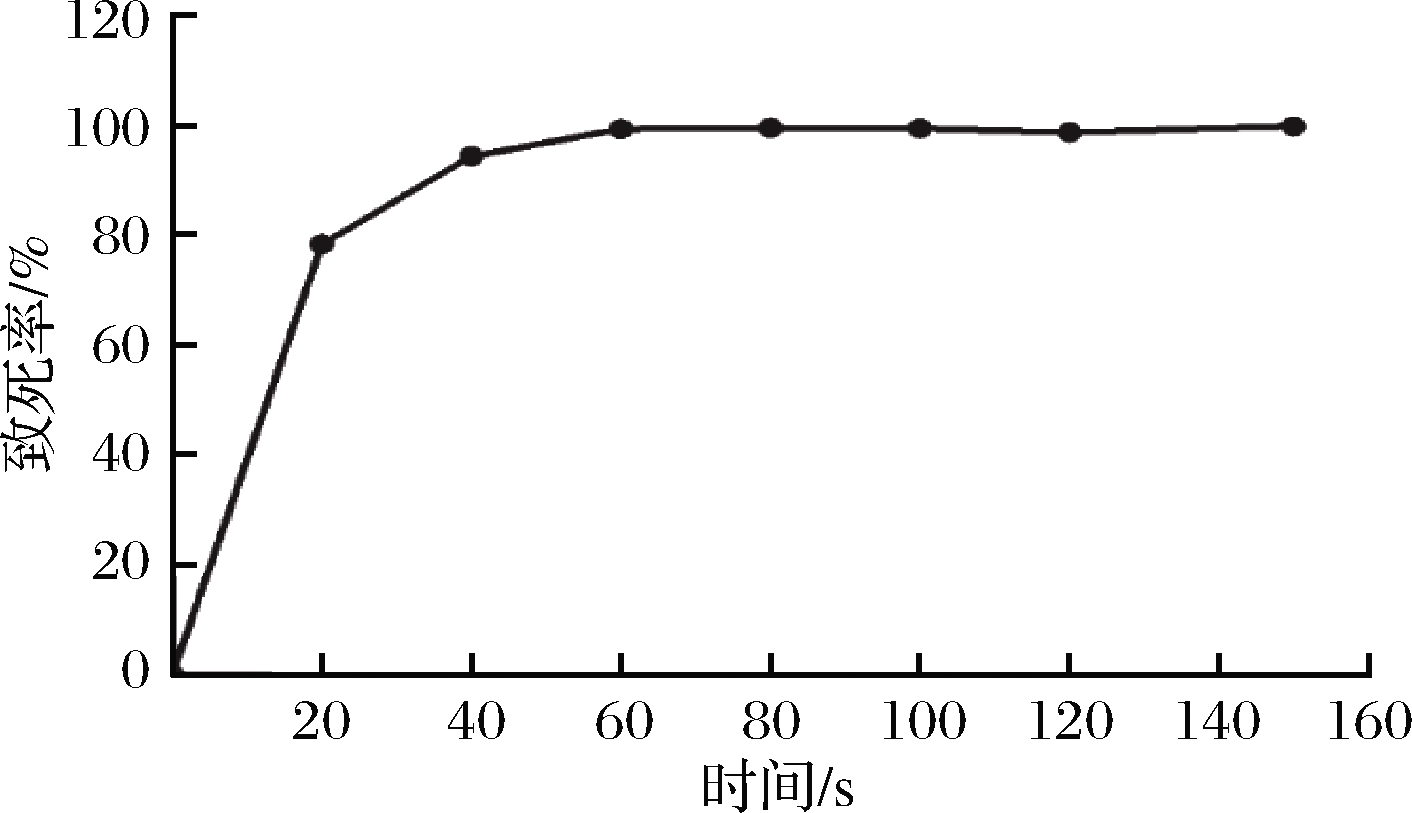
图2 紫外诱变时间对L15致死率的影响
Fig.2 Effect of UV mutation time on the mortality of L15
2.3 高产EPS突变菌株的筛选
L15菌悬液经紫外照射20 s后,涂布于MRS平板37 ℃培养48 h。直径较大,菌质稠厚的菌落可能为产EPS能力较强的菌株,因此挑选此类菌株进行发酵,测定其EPS含量,各突变株EPS产量如表1所示。挑取的25株突变菌株与原始菌株相比,EPS产量都有了不同幅度的提升,其中L15U1-3产量最高,达到224.52 mg/L,与原始菌株的EPS产量(175.88 mg/L)相比提高了27.66%。
表1 一轮紫外诱变突变菌株EPS产量(x±SD,n=4)
Table 1 Yield of EPS of the strains mutated by first round of UV-mutation
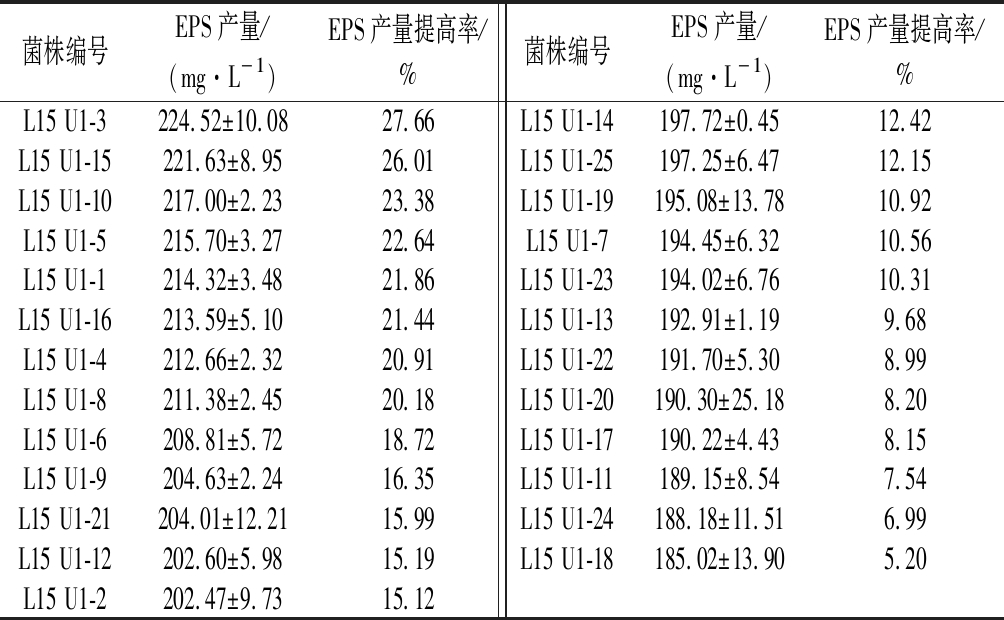
菌株编号EPS产量/(mg·L-1)EPS产量提高率/%菌株编号EPS产量/(mg·L-1)EPS产量提高率/%L15 U1-3224.52±10.0827.66L15 U1-14197.72±0.4512.42L15 U1-15221.63±8.9526.01L15 U1-25197.25±6.4712.15L15 U1-10217.00±2.2323.38L15 U1-19195.08±13.7810.92L15 U1-5215.70±3.2722.64L15 U1-7194.45±6.3210.56L15 U1-1214.32±3.4821.86L15 U1-23194.02±6.7610.31L15 U1-16213.59±5.1021.44L15 U1-13192.91±1.199.68L15 U1-4212.66±2.3220.91L15 U1-22191.70±5.308.99L15 U1-8211.38±2.4520.18L15 U1-20190.30±25.188.20L15 U1-6208.81±5.7218.72L15 U1-17190.22±4.438.15L15 U1-9204.63±2.2416.35L15 U1-11189.15±8.547.54L15 U1-21204.01±12.2115.99L15 U1-24188.18±11.516.99L15 U1-12202.60±5.9815.19L15 U1-18185.02±13.905.20L15 U1-2202.47±9.7315.12
对L15U1-3进行二轮紫外诱变,测定36株菌落直径较大,菌质稠厚的菌株的EPS产量。36株突变菌株中共有32株菌呈现正向突变,EPS产量有所提高,其中L15U2-26产量与原始菌株相比提高了32.10%,达到232.34 mg/L,但与L15U1-3相比,其EPS产量并无太大提升。
表2 二轮紫外诱变突变菌株EPS产量(x±SD,n=4)
Table 2 Yield of EPS of the strains mutated by second round of UV-mutation
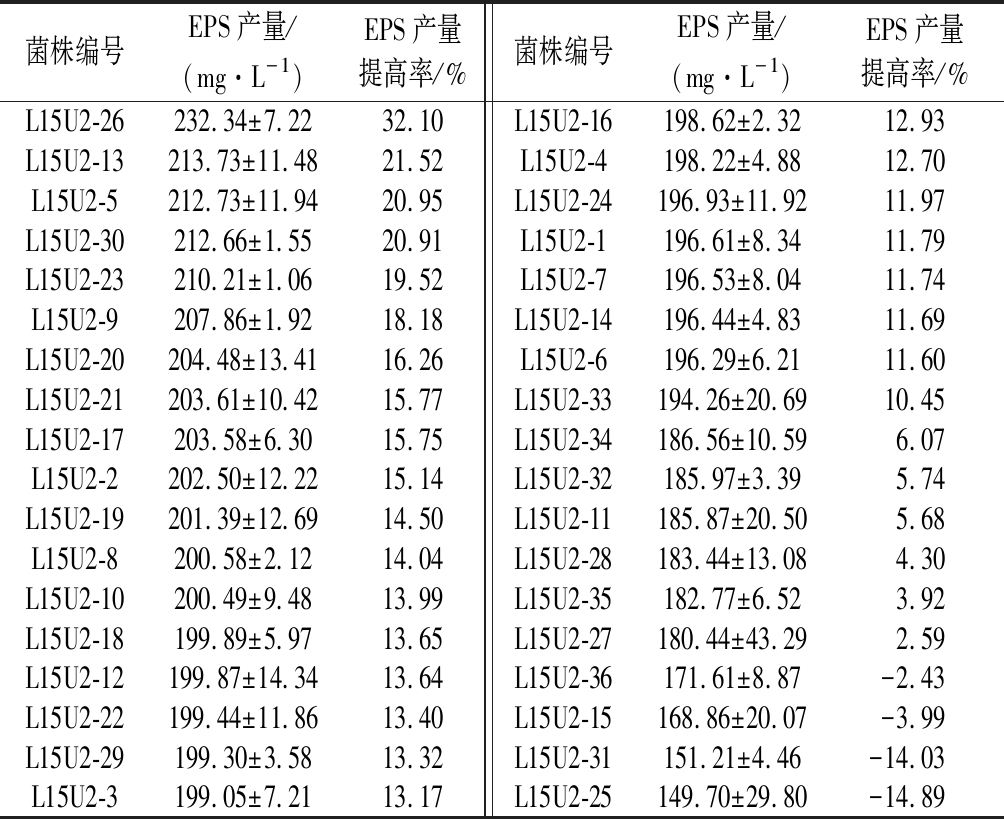
菌株编号EPS产量/(mg·L-1)EPS产量提高率/%菌株编号EPS产量/(mg·L-1)EPS产量提高率/%L15U2-26232.34±7.2232.10L15U2-16198.62±2.3212.93L15U2-13213.73±11.4821.52L15U2-4198.22±4.8812.70L15U2-5212.73±11.9420.95L15U2-24196.93±11.9211.97L15U2-30212.66±1.5520.91L15U2-1196.61±8.3411.79L15U2-23210.21±1.0619.52L15U2-7196.53±8.0411.74L15U2-9207.86±1.9218.18L15U2-14196.44±4.8311.69L15U2-20204.48±13.4116.26L15U2-6196.29±6.2111.60L15U2-21203.61±10.4215.77L15U2-33194.26±20.6910.45L15U2-17203.58±6.3015.75L15U2-34186.56±10.596.07L15U2-2202.50±12.2215.14L15U2-32185.97±3.395.74L15U2-19201.39±12.6914.50L15U2-11185.87±20.505.68L15U2-8200.58±2.1214.04L15U2-28183.44±13.084.30L15U2-10200.49±9.4813.99L15U2-35182.77±6.523.92L15U2-18199.89±5.9713.65L15U2-27180.44±43.292.59L15U2-12199.87±14.3413.64L15U2-36171.61±8.87-2.43L15U2-22199.44±11.8613.40L15U2-15168.86±20.07-3.99L15U2-29199.30±3.5813.32L15U2-31151.21±4.46-14.03L15U2-3199.05±7.2113.17L15U2-25149.70±29.80-14.89
2.4 突变菌株遗传稳定性的检验
对EPS产量提高较大的突变菌株连续传代10次,每2代测定1次EPS产量,观察其产EPS稳定性,结果如图3所示。7株EPS产量较高的菌株中,L15U2-26稳定性最好,在传代10次中,其EPS产量均无明显差异。而其他菌株的EPS产量在传代过程中,均呈现出显著性差异,遗传性状不够稳定。

图3 突变菌株产EPS的稳定性
Fig.3 The genetic stability of the mutant strains for producing EPS
2.5 诱变菌株对酸、胆盐及人工模拟胃肠液耐受性的测定
乳酸菌必须以活菌形态到达消化道,才能发挥其体内益生性能。而影响乳酸菌在胃肠道中定植的因素主要包括胃液的低pH、高浓度的胆盐胁迫以及胃肠道中的消化酶。
乳酸菌的耐酸性是确保其通过胃液进入肠道的必要条件之一,L15、L15U2-26在pH值为2.0的MRS培养基中培养3 h后,存活率均为0%;而在pH值为3.0、4.0时,其存活率不降反增,分别为123.49%、155.31%,L15U2-26的存活率则分别为132.40%、158.45%(图4-a)。人在进食后胃液的pH值在3.0~3.5[22],2株菌在胃液的低pH值环境下能够良好存活甚至缓慢生长,均具有很好的耐酸性能。
乳酸菌经过胃液后,还需能够耐受十二指肠中高浓度的胆盐,正常人体小肠的胆盐波动在0.03%~0.3%即0.3~3.0 g/L[17]。由图4-b可知,在胆盐处理0 h时,2株乳酸菌的活菌数均在107CFU/mL以上,在含胆盐的MRS培养基中培养24 h后,随着胆盐质量浓度的增加,其活菌数也随之减少,在胆盐质量浓度为2.0、3.0 g/L时,其活菌数均在105 CFU/mL以上,在胆盐质量浓度为4.0 g/L时,其活菌数降到了104 CFU/mL。
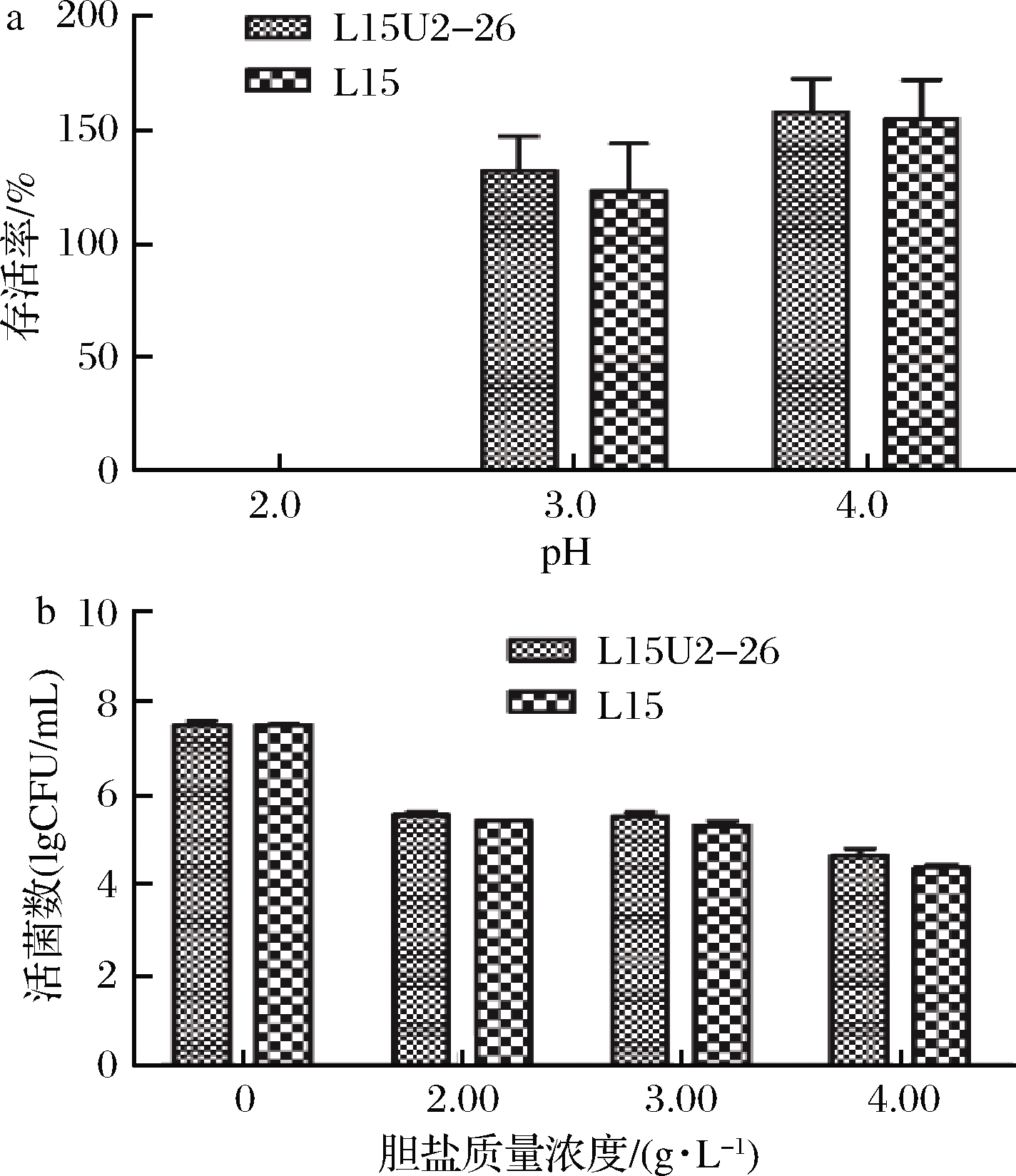
a-耐酸性;b-胆盐耐受性
图4 乳酸菌对酸、胆盐的耐受性测定
Fig.4 Determination of the tolerance of Lactobacillus to acids and bile salts
乳酸菌在消化道中定植,除了要耐受胃肠液中的低pH环境和高浓度胆盐外,还需经受胃肠道中消化酶(胃蛋白酶、胰蛋白酶等)的考验。如图5所示,人工胃液消化2 h后,2株菌的活菌数没有显著变化,均保持在108 CFU/mL以上,取经胃液消化的菌液进行肠液处理,2 h后,活菌数显著下降,从107 CFU/mL下降至105CFU/mL,随着时间延长,其活菌数缓慢下降,但仍维持在105 CFU/mL以上。在8 h后,L15的活菌数下降至104 CFU/mL,但L15U2-26仍维持在105 CFU/mL。
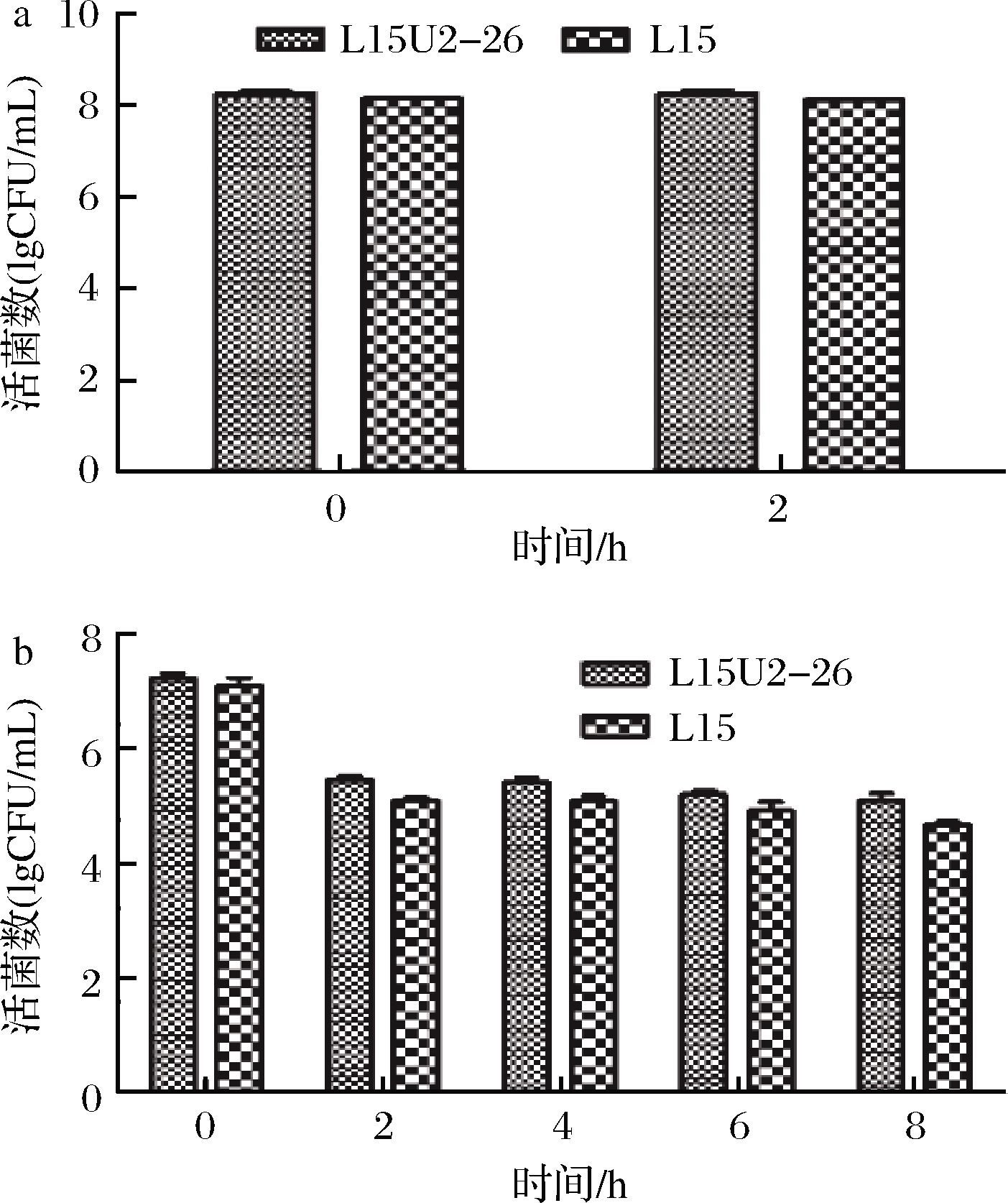
a-胃液;b-肠液
图5 乳酸菌对人工模拟胃、肠液的耐受性测定
Fig.5 Tolerance of Lactobacillus to artificial simulated gastric and intestinal fluid
EPS可以增强细菌的抗逆性,同时也为其在各种生物或者非生物表面定植及生物被膜的附着提供条件[23]。乳酸菌EPS有利于其在消化道定植,发挥其益生功能。FEDORV 等发现高产EPS(121~650 mg/L)的罗伊氏乳杆菌对胆盐、胃液、肠液的耐受性显著高于不产EPS(<20 mg/L)的罗伊氏乳杆菌,且对胃肠液的耐受性与EPS的产量呈现正相关[24]。本研究中L15U2-26对低pH、胃肠液的耐受性稍高于L15,但并未达到显著性差异,猜测可能是两者的EPS产量相差不大,不足以使L15U2-26更好地适应环境。
等发现高产EPS(121~650 mg/L)的罗伊氏乳杆菌对胆盐、胃液、肠液的耐受性显著高于不产EPS(<20 mg/L)的罗伊氏乳杆菌,且对胃肠液的耐受性与EPS的产量呈现正相关[24]。本研究中L15U2-26对低pH、胃肠液的耐受性稍高于L15,但并未达到显著性差异,猜测可能是两者的EPS产量相差不大,不足以使L15U2-26更好地适应环境。
2.6 诱变菌株及原始菌株的抗氧化活性
活性氧(reative oxygen species,ROS)是一类含氧小分子,包括DPPH自由基、ABTS自由基、羟自由基(·OH)、超氧化物自由基![]() 等,相对不稳定且十分活跃,当人体内ROS失衡时容易引起氧化应激,对细胞的组成及完整性都有危害[11]。合成抗氧化剂抗氧化活性好,但研究证明其对人体具有潜在的安全风险[25],因此寻找安全、有效的抗氧化剂是必然的发展趋势。微生物EPS是一种天然多糖,安全性高且具有良好的抗氧化活性,不失为现有合成抗氧化剂的有效替代,目前已有较多关于微生物EPS的抗氧化活性研究,包括乳酸菌[26]、曲霉[27]、酵母[28]等。
等,相对不稳定且十分活跃,当人体内ROS失衡时容易引起氧化应激,对细胞的组成及完整性都有危害[11]。合成抗氧化剂抗氧化活性好,但研究证明其对人体具有潜在的安全风险[25],因此寻找安全、有效的抗氧化剂是必然的发展趋势。微生物EPS是一种天然多糖,安全性高且具有良好的抗氧化活性,不失为现有合成抗氧化剂的有效替代,目前已有较多关于微生物EPS的抗氧化活性研究,包括乳酸菌[26]、曲霉[27]、酵母[28]等。
本文检测不同浓度多糖对DPPH自由基、ABTS自由基、羟自由基、超氧阴离子的抗氧化活性,并对诱变前后菌株所产多糖的抗氧化活性进行比较。DPPH自由基是相对稳定的自由基,清除DPPH自由基是评估抗氧化能力最广泛使用的指标。图6-a中L15、L15U2-26 EPS质量浓度为0.50~8.00 mg/mL时,对DPPH清除率分别为18.38%~76.88%、17.35%~72.41%,随着EPS浓度的上升,清除率也呈上升趋势,具有明显的剂量依赖性。MIN等[6]发现植物乳杆菌EPS(10 mg/mL)对DPPH自由基的清除率为60.5%,LIU等[29]研究中,副干酪乳杆菌和植物乳杆菌在EPS质量浓度为10 mg/mL对DPPH的清除率分别为91.82%、81.15%,本研究结果优于MIN等[6],与LIU等[29]的相似。ABTS自由基清除率也是评价抗氧化能力常用的指标之一,L15、L15U2-26对ABTS的清除率分别为12.87%~71.79%、10.73%~76.25%(图6-b),呈现一定的浓度依赖性。羟自由基被认为是最具反应活性的自由基,易与周围细胞生物分子发生反应,对细胞或生物分子造成严重的氧化损伤,导致衰老、癌症等疾病[16]。L15、L15U2-26 EPS对羟自由基的清除率弱于DPPH及ABTS(图6-c),分别为29.70%~44.16%、30.94%~49.51%,与刘煜君等的结果相似[30]。超氧阴离子2株菌的EPS对超氧阴离子的清除能力较低,分别为8.11%~15.38%、13.64%~23.94%(图6-d),研究发现3株副干酪乳杆菌EPS在质量浓度为400 mg/L时,对超氧阴离子的清除率分别为24.86%、34.55%、19.44%[31],与本研究结果相近。
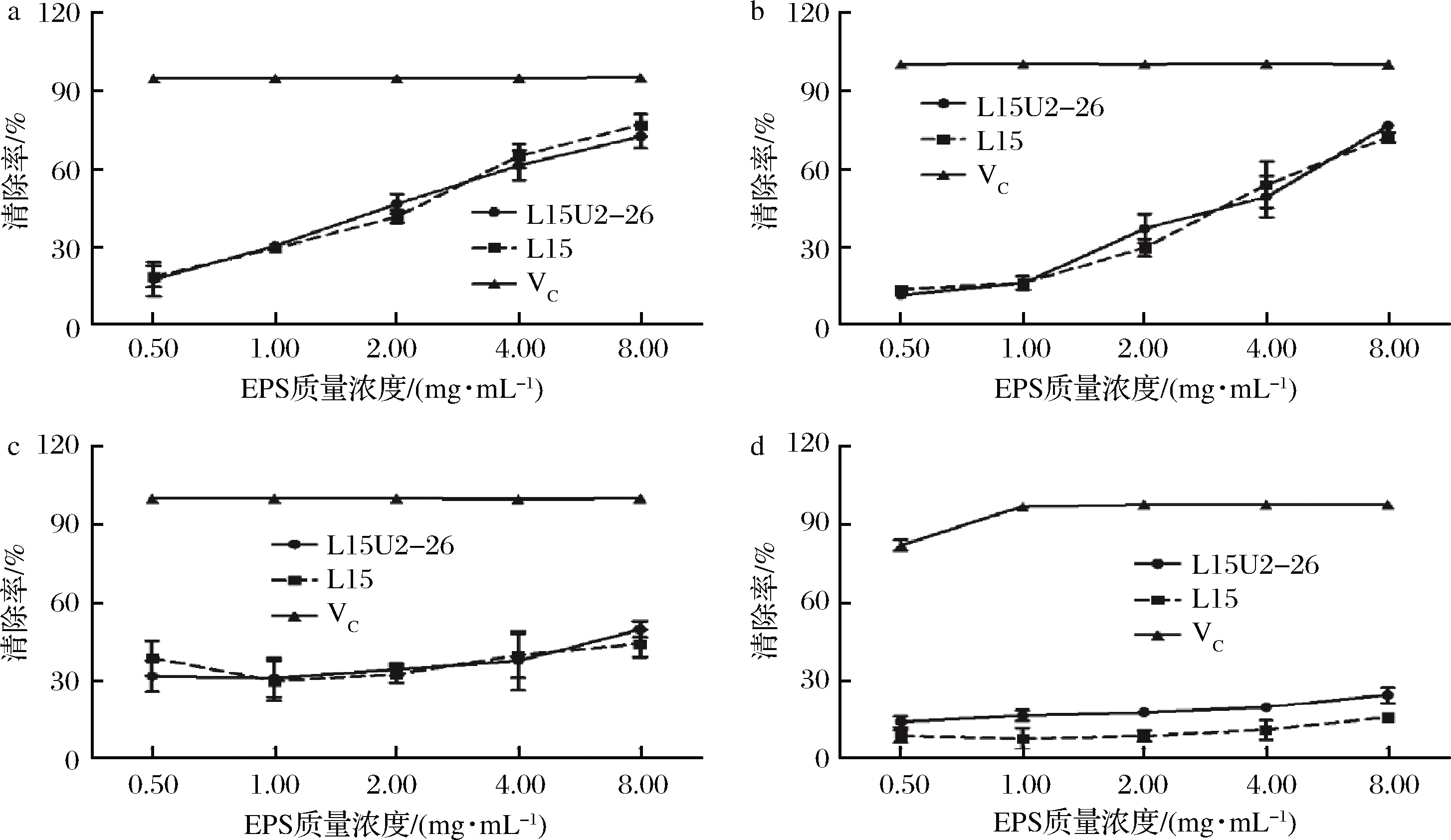
a-DPPH自由基;b-ABTS自由基;c-羟自由基;d-超氧阴离子
图6 EPS的抗氧化活性测定
Fig.6 Determination of the antioxidant activity of EPS
总的来说,突变菌株及原始菌株所产EPS均具有良好的抗氧化活性,但两者的抗氧化效果并未出现明显差异,可能紫外诱变只提升了菌株产EPS的能力,并未改变其结构。
3 结论
对高产EPS菌株进行两轮紫外诱变并对突变菌株进行遗传稳定性实验,最终得到1株高产EPS且稳定性良好的菌株L15U2-26,对原始菌株及突变菌株的益生特性进行了测定比较。发现原始菌株及突变菌株对酸、胆盐、人工模拟胃肠液都有较好的耐受性,其中突变菌株的耐受性略高于原始菌株,但并未呈现显著性差异,原始菌株及突变菌株的EPS同时也具备良好体外抗氧化活性,这为乳酸菌益生功能的进一步开发利用提供了理论依据,但是其体内益生活性及其抗氧化机理还有待进一步研究。
[1] XU Y,CUI Y,WANG X,et al.Purification, characterization and bioactivity of exopolysaccharides produced by Lactobacillus plantarum KX041[J].International Journal of Biological Macromolecules,2019,128:480-492.
[2] DILNA S V,SURYA H,ASWATHY R G,et al.Characterization of an exopolysaccharide with potential health-benefit properties from a probiotic Lactobacillus plantarum RJF4[J].LWT-Food Science and Technology,2015,64(2):1 179-1 186.
[3] QURASHI A W,SABRI A N.Bacterial exopolysaccharide and biofilm formation stimulate chickpea growth and soil aggregation under salt stress.[J].Brazilian Journal of Microbiology,2012,43(3):1 183-1 191.
[4] LYNCH K M,ZANNINI E,COFFEY A,et al.Lactic acid bacteria exopolysaccharides in foods and beverages: Isolation, properties, characterization, and health benefits[J].Annual Review of Food Science and Technology,2018,9(1):155-176.
[5] ZHU W,WANG Y,YAN F,et al.Physical and chemical properties, percutaneous absorption-promoting effects of exopolysaccharide produced by Bacillus atrophaeus WYZ strain[J].Carbohydrate Polymers,2018,192:52-60.
[6] MIN W,FANG X,WU T,et al.Characterization and antioxidant activity of an acidic exopolysaccharide from Lactobacillus plantarum JLAU103[J].Journal of Bioscience and Bioengineering,2019,127(6):758-766.
[7] RAJOKA M S,JIN M,HAOBIN Z,et al.Functional characterization and biotechnological potential of exopolysaccharide produced by Lactobacillus rhamnosus strains isolated from human breast milk[J].LWT-Food Science and Technology,2018,89:638-647.
[8] WANG J,WU T,FANG X,et al.Characterization and immunomodulatory activity of an exopolysaccharide produced by Lactobacillus plantarum JLK0142 isolated from fermented dairy tofu[J].International Journal of Biological Macromolecules,2018,115:985-993.
[9] LI S,HUANG R,SHAH N P,et al.Antioxidant and antibacterial activities of exopolysaccharides from Bifidobacterium bifidum WBIN03 and Lactobacillus plantarum R315[J].Journal of Dairy Science,2014,97(12):7 334-7 343.
[10] 李卫娜,赵波,柳陈坚,等.副干酪乳杆菌胞外多糖抗氧化活性分析[J].食品工业科技,2019,40(24):34-39.
[11] 白丽娟.马奶酒中产胞外多糖瑞士乳杆菌的筛选及多糖的结构和抗氧化活性研究[D].沈阳:沈阳农业大学,2017.
[12] 刘刚,梁琪,宋雪梅,等.复合诱变选育高产胞外多糖嗜热链球菌菌株[J].食品与发酵科技,2019,55(1):11-18.
[13] 王诗玮,纪琪,朱天辉.紫外线诱变莱氏绿僵菌对敌敌畏的耐药性[J].植物保护,2019,45(6):185-191.
[14] JEONG D,KIM D,KANG I,et al.Characterization and antibacterial activity of a novel exopolysaccharide produced by Lactobacillus kefiranofaciens DN1 isolated from kefir[J].Food Control,2017,78:436-442.
[15] 丁楠,何美珊,戈子龙,等.果蔬发酵制品的功效及应用研究进展[J].食品工业科技,2019,40(7):332-336.
[16] WANG X,SHAO C,LIU L,et al.Optimization, partial characterization and antioxidant activity of an exopolysaccharide from Lactobacillus plantarum KX041[J].Biological Macromolecules,2017,103:1 173-1 184.
[17] 黄燕燕,郭均,黎恒希,等.降胆固醇乳酸菌的体外筛选及其降胆固醇机理探讨[J].食品科学,2018,39(6):88-94.
[18] 李岩岩.鼠李糖乳杆菌与干酪乳杆菌纯种发酵豆乳产品贮藏稳定性及菌体肠道耐受性研究岩[D].保定:河北农业大学,2012.
[19] YE G,CHEN Y,WANG C,et al.Purification and characterization of exopolysaccharide produced by Weissella cibaria YB-1 from pickle Chinese cabbage[J].International Journal of Biological Macromolecules,2018,120(PartA):1 315-1 321.
[20] CHEN Y X,LIU X,XIAO Z,et al.Antioxidant activities of polysaccharides obtained from Chlorella pyrenoidosa via different ethanol concentrations[J].International Journal of Biological Macromolecules,2016,91:505-509.
[21] 黄云鹏,姜淑娟,钱方,等.高产胞外多糖嗜热链球菌的诱变育种研究[J].食品工业,2012,33(6):43-45.
[22] 王帅,贺羽,贺斌.自然发酵泡菜中高体外抗氧化活性乳酸菌的筛选及其对模拟胃肠道环境的耐受性[J].食品工业科技,2019,40(22):93-97.
[23] NWODO U U,GREEN E,OKOH A I.Bacterial exopolysaccharides: Functionality and prospects[J]. International Journal of Molecular Sciences,2012,13(11):14 002-14 015.
[24] FEDOROV M,NEMCOV
M,NEMCOV
![]() D,et al. Exopolysaccharides may increase gastrointestinal stress tolerance of Lactobacillus reuteri[J].Folia Veterinaria,2018,62(4):24-32.
D,et al. Exopolysaccharides may increase gastrointestinal stress tolerance of Lactobacillus reuteri[J].Folia Veterinaria,2018,62(4):24-32.
[25] RIBEIROA J S,SANTOS M J,SILVA L K,et al.Natural antioxidants used in meat products: A brief review[J].Meat Science,2019,148:181-188.
[26] ZHANG J,CAO Y,WANG J,et al.Physicochemical characteristics and bioactivities of the exopolysaccharide and its sulphated polymer from Streptococcus thermophilus GST-6[J].Carbohydrate Polymers,2016,146:368-375.
[27] CHEN Y,MAO W,TAO H,et al.Structural characterization and antioxidant properties of an exopolysaccharide produced by the mangrove endophytic fungus Aspergillus sp. Y16[J].Bioresource Technology,2011,102(17):8 179-8 184.
[28] 马文锦,李梅林,王博,等.胶红酵母 Rhodotorula mucilaginosa CICC 33013胞外多糖的分离纯化及抗氧化活性研究[J].食品与发酵工业,2019,45(11):65-69.
[29] LIU C F,TSENG K C,CHIANG S S,et al.Immunomodulatory and antioxidant potential of Lactobacillus exopolysaccharides[J]. International Journal of Molecular Sciences,2011,91(12):2 284-2 291.
[30] 刘煜珺,张雨晴,高原,等.乳杆菌胞外多糖抗氧化活性研究[J].中国食品学报,2019,19(6):21-35.
[31] 李卫娜,赵波,柳陈坚,等.副干酪乳杆菌胞外多糖抗氧化活性分析[J].食品工业科技,2019,40(24):34-39.