餐厨垃圾是指学校、公共食堂和餐饮业产生的食品废物[1],包括剩菜、剩饭、饮料、丢弃的水果、粮食及食物汤汁等人们日常餐饮活动中所产生的垃圾,俗称泔脚,是城市生活垃圾的重要组成部分[2]。随着我国经济的高速发展,人民生活水平日益提高,餐厨垃圾数量也在不断增加,一般可以达到生活垃圾总量的30%~50%,每年还在以8%~10%的速度增长[3]。近几年随着我国主要城市生活垃圾分类工作的推进,实现生活垃圾的减量化、资源化和无害化处理已经是城镇化过程必须面对和解决的难题[4]。如何简单高效的处理餐厨垃圾成为目前需要迫切解决的问题。从化学组成上看,餐厨垃圾成分包括淀粉、纤维素、蛋白质、脂肪和少量无机盐等几大常见类别[5]。餐厨垃圾凭借高有机物、高含水率、营养丰富等特点,成为宝贵的可再生资源,蕴含着很大的回收和再利用价值[6-8]。目前餐厨垃圾的资源化处理技术包括微生物饲料制作、堆肥制有机肥、厌氧消化、微生物制氢等[9-11];非资源化处理技术包括焚烧、填埋、粉碎直排等。餐厨垃圾处理优先顺序为源头减量、工业利用、堆肥、焚烧/填埋,目前主要发达国家倾向于采用堆肥制肥料或加工成饲料的资源化回收利用方式[12-14]。
餐厨垃圾好氧堆肥技术是利用好氧微生物的生命活动,将餐厨垃圾中有机物通过微生物的作用分解成腐殖质并形成稳定产品的过程[15],客观上减小了餐厨垃圾对环境的污染。该技术也因兼具固态发酵能耗低、方便实用,能够充分分解转化餐厨垃圾的特点,被逐渐推广开来,成为餐厨垃圾资源化利用的重要手段之一。在较高温度下进行的好氧堆肥也被称为高温好氧堆肥法。高温好氧堆肥相对于常温静态堆肥,具有减量化迅速,设备占地空间小等显著优点,同时堆肥过程中所产生的持续高温也有利于去除原料中所带来的病原微生物、虫卵和杂草种子等[16-17]。加快堆肥过程,获得优质的有机肥,微生物是关键,传统堆肥最常见的方式是自然通风静态堆肥,利用餐厨垃圾土著微生物自然生长繁殖分解有机质,这种堆肥方式成本较低,技术简单,但堆肥时间长,占地面积大。且物料堆内部通风不畅,氧气不易进入,会抑制微生物的生长,延长发酵周期,堆肥的产品质量也难保证[18]。已有研究表明接种特定功能微生物可以增加堆肥初期微生物的群体数,提高微生物群体活性,缩短到达高温期的时间,加快有机物的分解,明显缩短堆肥化周期[19]。国外对堆肥接种微生物菌剂的研究较为充分。20世纪40年代,美国通过接种细菌使堆肥时间缩短1~3 d;20世纪70年代,日本研制的 EM 菌剂加快了堆肥的效率,10~15 d 可使堆肥腐熟[20]。目前已经商业化的餐厨垃圾高温堆肥箱多使用从日本引进的EM菌剂。由于日本和中国在饮食方面的巨大差别,EM菌剂在实际使用过程中存在肥堆升温慢,减重少,腐熟度不够等各种问题。因此,筛选适合中国餐厨垃圾高温堆肥的功能微生物具有重要意义。
本研究从完全腐熟的餐厨垃圾有机肥料中,筛选出适合餐厨垃圾高温好氧堆肥的芽孢杆菌,并对其进行菌种鉴定和耐受性研究,以解决餐厨垃圾高温堆肥箱在堆肥过程中存在的各种问题。为开发适合国内餐厨垃圾堆肥的复合菌剂提供借鉴。
1 材料与方法
1.1 实验材料
1.1.1 实验样品
样品来源于学校食堂,经过预处理的餐厨垃圾分别堆放于不同土壤环境中至完全腐熟,采集堆肥样品于4 ℃冰箱保存备用。
1.1.2 培养基
(1) 牛肉膏-蛋白胨培养基(LB培养基)(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,琼脂20.0,pH 7.4~7.6。
(2) 富集培养基(g/L):可溶性淀粉3,蛋白胨10,酵母膏3,KH2PO4 1.5,K2HPO4 2,MgSO4 0.1,pH 7.4~7.6。
(3) 半固体琼脂培养基(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,琼脂4.0~5.0,pH 7.4~7.6。
(4) 产淀粉酶菌株筛选培养基(g/L):可溶性淀粉3.0,蛋白胨10.0,牛肉膏3.0~5.0,NaCl 5.0,琼脂15.0~20.0,pH 7.2~7.4。
(5) 刚果红纤维素培养基(g/L):酵母膏2.0,KH2PO4 1.0,MgSO4·7H2O 0.5,NaCl 0.5,CMC-Na 3.0,刚果红0.1,琼脂20.0,pH自然。
(6) 产蛋白酶菌株筛选培养基(g/L):脱脂奶粉15.0,蛋白胨10.0,牛肉膏5.0,NaCl 5.0,琼脂15.0,pH 7.3~7.5。脱脂奶粉用水溶解后单独灭菌,灭菌后再混合,倒平板。
(7) 产脂肪酶菌株筛选培养基(g/L):蛋白胨5.0, KH2PO4 1.2,K2HPO4 1.8,NH4Cl 4,MgSO4·7H2O 0.2,NaCl 0.1,FeSO4·7H2O 0.01,CH3CH2COONa 2.5,琼脂15.0,橄榄油乳化液50 mL,每100 mL培养基中加入0.2 mL 0.5%(体积分数)的维多利亚蓝B,pH 7.2~7.4。
(8) 橄榄油乳化液制备:将橄榄油与2.5%(体积分数)的Triton X-100以1∶4的体积比混合后,冰浴条件下,用超声破碎仪进行超声乳化。超声条件为功率50%(375 W),工作1 s停止3 s,工作4 min。
(9) 盐耐受性验证培养基:NaCl 4~8 g,牛肉膏0.3 g,葡萄糖0.1 g,蛋白胨1.0 g,溴甲酚紫指示剂适量,琼脂粉1.8 g,蒸馏水100 mL,pH 7.4。
1.2 实验方法
1.2.1 菌种的初筛与分离纯化
菌种富集:称取堆肥样品5 g,加入含有100 mL无菌牛肉膏-蛋白胨液体培养基的三角瓶中(内置玻璃珠),置于80 ℃恒温水浴锅中水浴15~20 min(热处理),放入200 r/min、45 ℃的摇床中培养24 h以上。
菌种初筛:将富集培养的菌液进行10倍梯度稀释,依次得到10-1~10-4的菌液。取10-2、10-3和10-4三个梯度的菌液各0.2 mL分别涂布于牛肉膏-蛋白胨琼脂培养基,45 ℃倒置培养12 h以上观察。
菌种分离纯化:挑取初筛平板上形态不同的菌落划线于牛肉膏-蛋白胨平板上,对菌落进行编号,多次划线直至分离出的单菌落形态稳定一致。
1.2.2 菌株形态学观察
平板菌落观察:菌落颜色、形状、边缘、大小、透明度及有无凸起。菌体形态及染色观察:油镜下菌体普通染色观察细胞形态、大小、排列;革兰氏染色;芽孢染色观察芽孢着生特点。
1.2.3 菌种产酶性能及耐受性
产酶性能:取分离纯化得到的菌株,以及来源于本实验室已鉴定的枯草芽孢杆菌YB6和解淀粉菌YB7分别点样于产淀粉酶筛选培养基、刚果红纤维素培养基、产蛋白酶筛选培养基和产脂肪酶筛选培养基平板上,置于45 ℃培养24 h观察菌落生长情况,有无透明圈,并测定透明圈与菌落直径的比值(D/d值),比较各菌株产酶性能。
菌种耐受性实验:耐温性,将获得的单菌落接种于牛肉膏-蛋白胨斜面培养基上,每个菌落做1个对照,分别置于4、20、50、55和60 ℃下培养,观察并记录菌体生长状况,极限环境下可多培养几天再观察。耐盐性,将各菌株接种在不同盐度(NaCl质量分数4%~8%)的LB培养基平板上,观察菌株是否生长及长势。
1.2.4 分子生物学鉴定
采用大连宝生物工程有限公司细菌16S rDNA提取与扩增专用试剂盒。扩增引物为细菌通用引物,正向引物5′-GAGCGGATAACAATTTCACACAGG-3′,反向引物5′-CGCCAGGGTTTTCCCAGTCACGAC-3′。PCR反应体系为50 μL反应体系:4 μL裂解上清液,25 μL PCR Premix Taq,正向引物与反向引物各0.5 μL,20 μL超纯水。PCR扩增条件为94 ℃预变性10 min,94 ℃变性0.5 min,55 ℃退火0.5 min,共30个循环,72 ℃延伸2 min。扩增产物送样上海生工生物工程有限公司测序。
获得序列经NCBI网站BLAST并利用DNAMAN4.0、MEGA5.1软件进行多重序列比较后构建系统发育树,Bootstrap值设定为1 000。
1.2.5 生长曲线的测定
正常生长环境下生长曲线用LB液体培养基接种入选菌株,放入200 r/min,37 ℃摇床培养,分别于0、2、4、6、8、12、16、20、24 h取培养液测定OD600值,绘制生长曲线。
非正常生长环境下生长曲线:用LB液体培养基(含体积分数6%的NaCl,5%的橄榄油乳化液)接种入选菌株,放入200 r/min,55 ℃摇床培养,分别于0、2、4、6、8、12、16、20、24、36、48、60、72、84、96、108 h取培养液测定OD600值,绘制生长曲线。
1.2.6 堆肥反应器及堆肥方法
堆肥反应器结构如图1所示,堆肥箱总容积约43.0 L,不锈钢材质,整个箱体由保温层覆盖,加盖,箱体装有通气泵,泵底具有一个排气孔,正常通气量标准为2.5 L/min,还可由连接的控制装置通过通断电来改变通气量。保温层内部连接有加热丝,配备控温系统,温度设定后可自动调节,搅拌速度可通过变频器及减速机调节,整套设备具有称重系统,可以检测堆肥过程中重量损失,能够较好地满足试验要求。
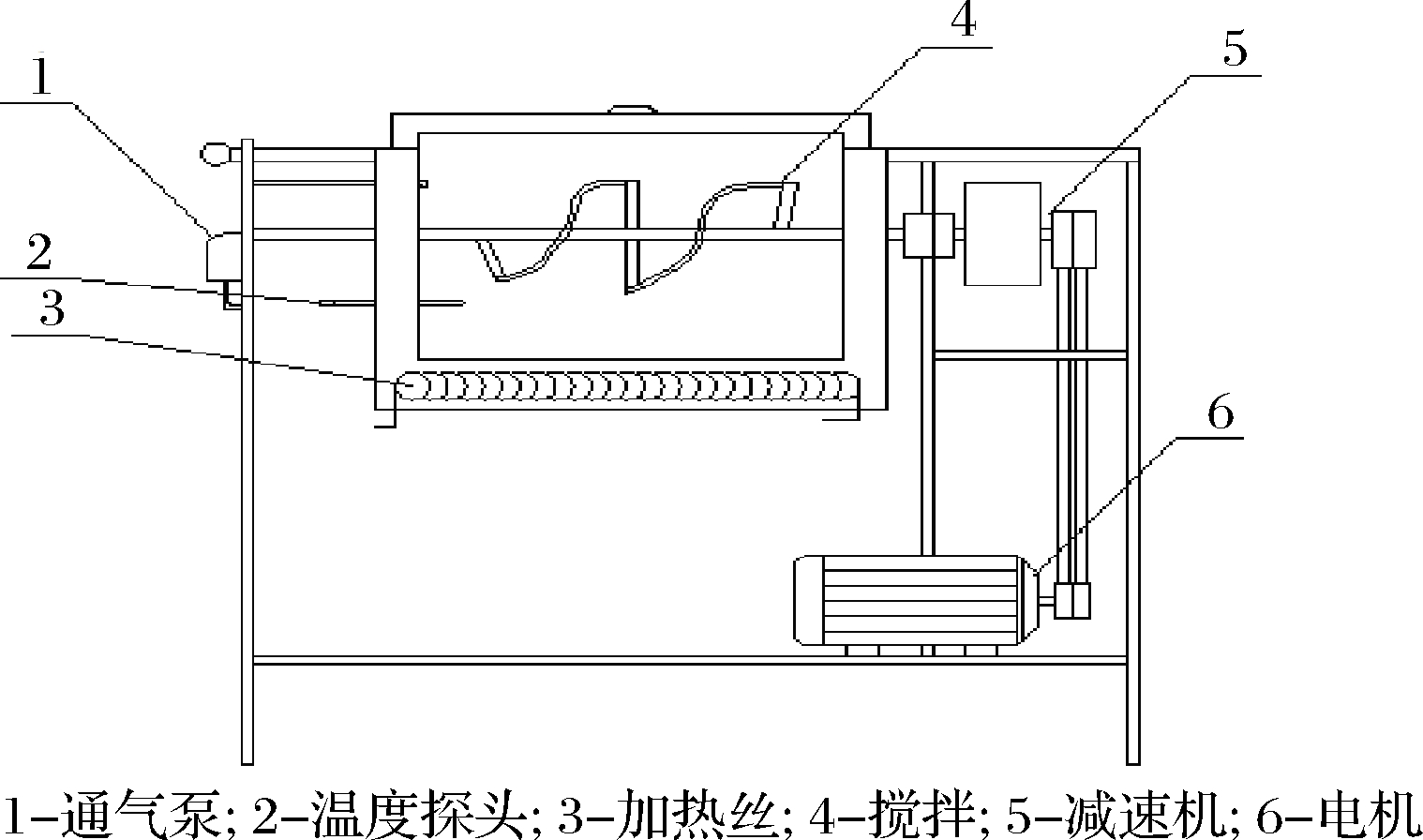
图1 试验堆肥反应器结构图
Fig.1 The composting reactor structure
堆肥方法采用高温好氧堆肥方式。堆肥试验开始时,将锯木屑与预处理的餐厨垃圾以一定比例加入反应箱体,总添加量约30 kg。调节含水率(质量分数)在50%~60%。调节主辅料添加比例使C/N在25∶1~30∶1,搅拌转速25 r/min,设定堆肥温度55 ℃,通气泵初始设定为开∶关=5 s∶5 s。
1.2.7 堆肥过程中水解酶活的测定
粗酶液制取:称取堆肥样品10 g,加入1%(质量分数)NaCl溶液50 mL,30 ℃恒温水浴1 h,每15 min摇晃1次,滤纸过滤,得粗酶液。
酶活力测定:淀粉酶酶活采用钝化法测定[21],根据实际情况略有改动;蛋白酶酶活采用福林酚法[22];纤维素酶酶活采用DNS法测定[23];脂肪酶酶活采用酸碱滴定法测定[24]。
2 结果与分析
2.1 菌种的分离和纯化
2.1.1 菌落形态特征
在不同环境中腐熟的餐厨垃圾有机肥中取得堆肥样品共计15份,通过热处理使目标微生物不断富集。经过LB培养基平板划线,共获得单菌落46株,通过菌落形态和细胞形态观察,排除相似及疑似菌株后共获得8株形态各异的菌株,分别编号为YB1、YB2、YB3-1、YB3-2、YB4-1、YB4-2、YB4-3和YB5。将8株菌在LB培养基平板上三区划线,待长出单菌落后,观察菌落形态。菌落形态如图2所示,其中正中间为8株菌在同一个平板上的照片。
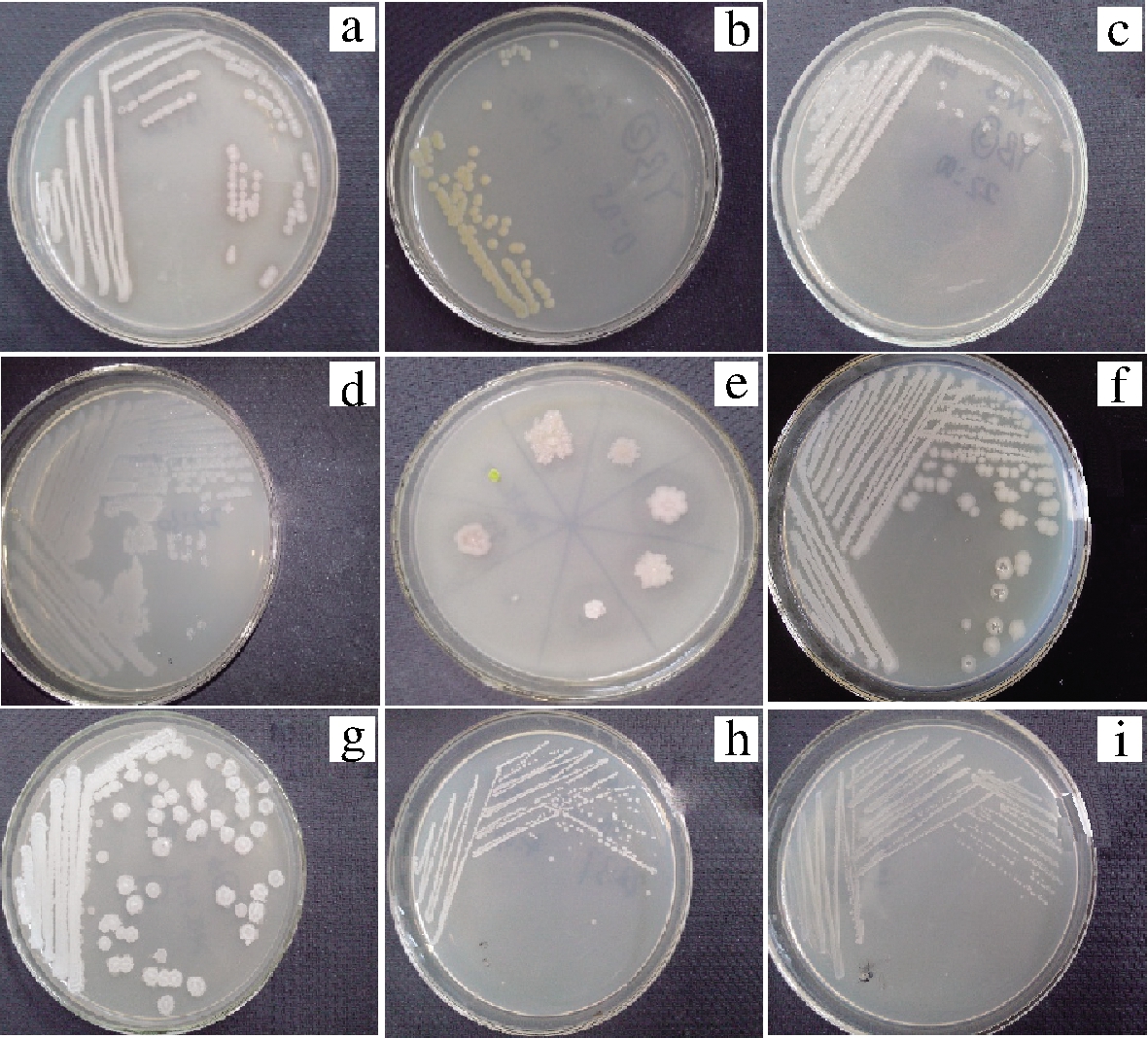
a-YB1;b-YB2;c-YB3-1;d-YB3-2;e-8株菌;f-YB4-1; g-YB4-2;h-YB4-3;i-YB5
图2 菌落形态
Fig.2 The colony morphology
2.1.2 菌落显微染色观察
将筛选到的8株菌进行细胞染色后,在光学显微镜(10×100倍)油镜下观察细胞形态特征及染色情况,菌株显微形态如图3所示。
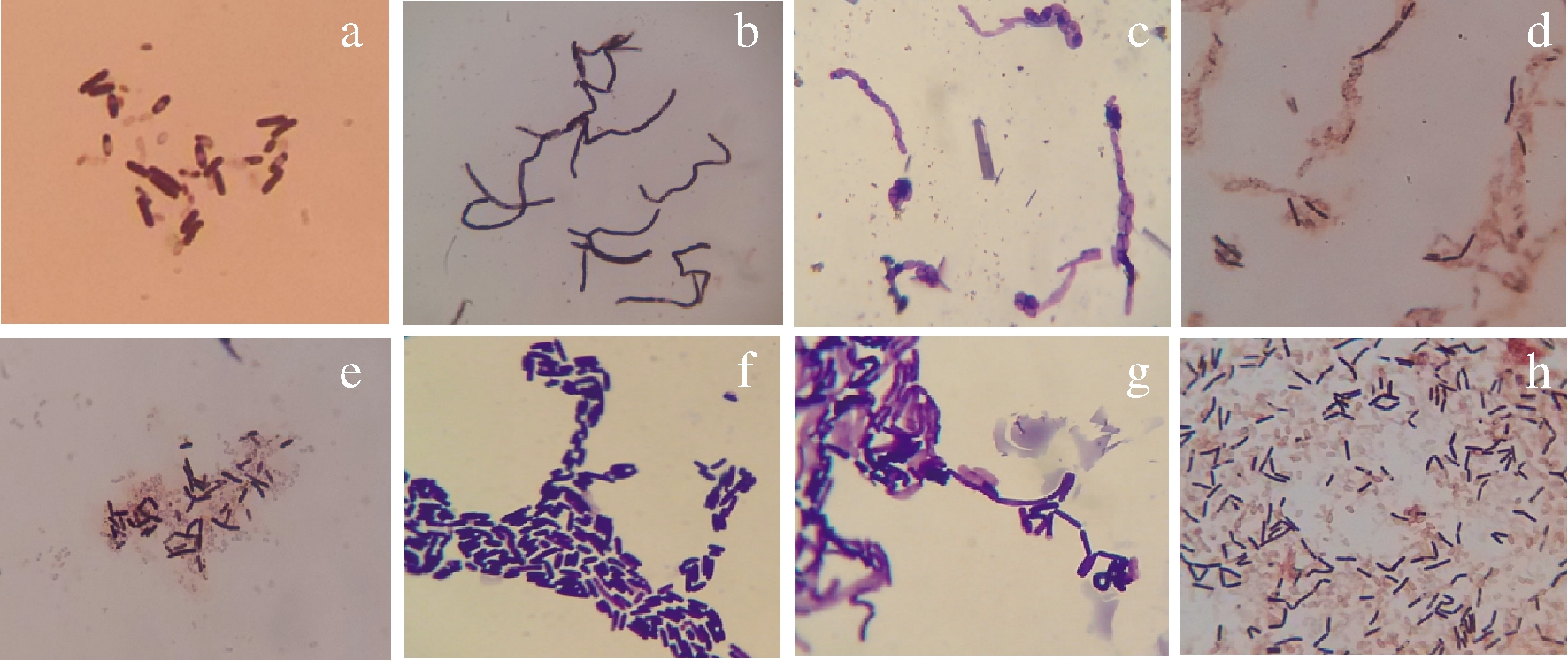
a-YB1;b-YB2;c-YB3-1;d-YB3-2;e-YB4-1;f-YB4-2; g-YB4-3;h-YB5
图3 菌株的显微形态
Fig.3 The microscopic morphology of the strains
2.2 菌种产酶性能测试
将筛选到的8株菌与对照菌(YB6和YB7,来源于本实验室前期筛选,已知可产淀粉酶和蛋白酶)分别点接到淀粉、纤维素、蛋白质和油脂筛选培养基平板上,置于45 ℃恒温培养24 h。向淀粉筛选培养基平板上的菌落周围滴加卢卡氏碘液,用游标卡尺测量透明圈直径,并以此判断待测菌株对淀粉的分解能力。纤维素、蛋白质及油脂降解能力则直接由透明圈反应来判断,记录各组实验的D/d值,分析比较大小。透明圈反应如图4所示,测定结果如表1所示。
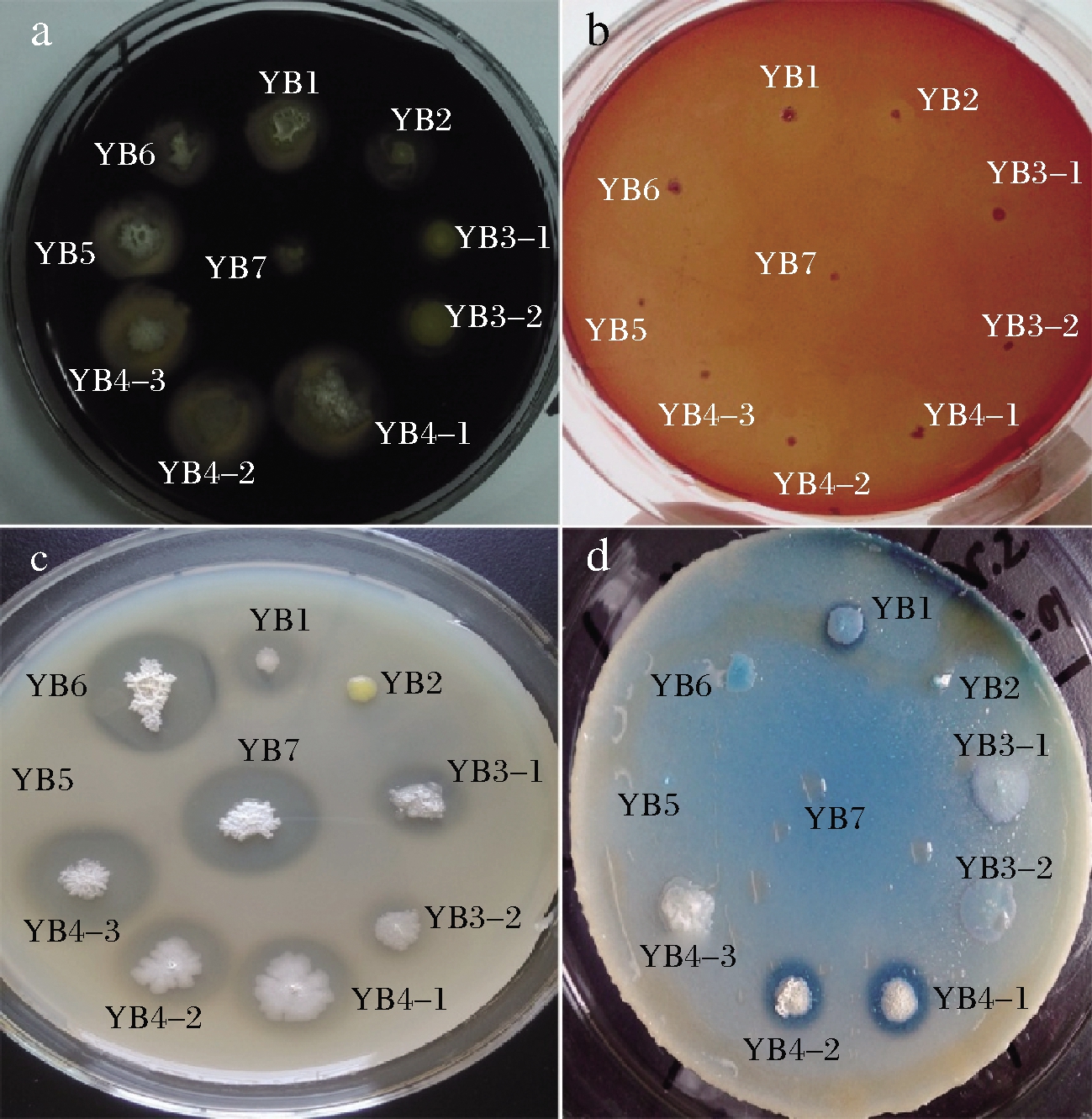
a-淀粉;b-纤维素;c-蛋白质;d-油脂
图4 菌株产酶透明圈反应
Fig.4 Transparent circle reaction of enzyme produced by the strains
实验结果表明,筛选的8株菌与对照菌均有分解淀粉的能力,其中YB1、YB2、YB4-1、YB4-2、YB4-3、YB5、YB6和YB7产淀粉酶能力较强;7株菌(除YB3-2外)与对照菌均有分解纤维素的能力,其中YB1、YB4-1、YB4-2、YB4-3、YB5和YB6产纤维素酶能力较强;6株菌(除YB2和YB5外)与对照菌均有分解蛋白质的能力,其中YB1、YB4-3、YB6和YB7产蛋白酶能力较强;只有3株菌具有分解油脂的能力,其中YB4-1和YB4-2产脂肪酶能力较强,YB1产脂肪酶能力一般,而对照菌YB7则不能在油脂环境下生长。综合分析上述各菌株的产酶性能,可以得出YB1、YB4-1和YB4-2对淀粉、纤维素、蛋白质及油脂具有更强的分解能力。
表1 产酶情况统计
Table 1 Statistics of enzyme production

分解物YB1YB2YB3-1YB3-2YB4-1YB4-2YB4-3YB5YB6YB7淀粉++++++++++++++++++纤维素++++-+++++++++++蛋白质++-++++++-++++油脂+---++++---N
注:+表明产生透明圈,+越多表明透明圈越大;-表明可以生长,但未见明显透明圈;N表示不生长
2.3 菌种耐受性能测试
堆肥采用高温好氧堆肥,肥堆温度会较长时间保持在50~60 ℃,在这种温度下一般的微生物很难生长。餐厨垃圾的高含盐率是中国餐厨垃圾区别于其他国家的主要特征,中国不同地区的饮食习惯也导致餐厨垃圾含盐率有很大差异[25-26]。盐对微生物具有Na+毒性,未经驯化的微生物在Na+质量浓度为500~2 000 mg/L时即受轻度抑制[27-28],随着Na+质量浓度升高,微生物酶活性降低,从而影响整个体系的堆肥反应,肥效降低。因此筛选具有高温耐受性和高盐耐受性的微生物十分重要。
2.3.1 温度耐受性
将筛选到的8株菌接种于LB培养基平板上,置于不同温度下培养,观察各菌株的生长状况,结果如表2所示。
表2 菌株温度耐受性
Table 2 Temperature tolerance of the strains
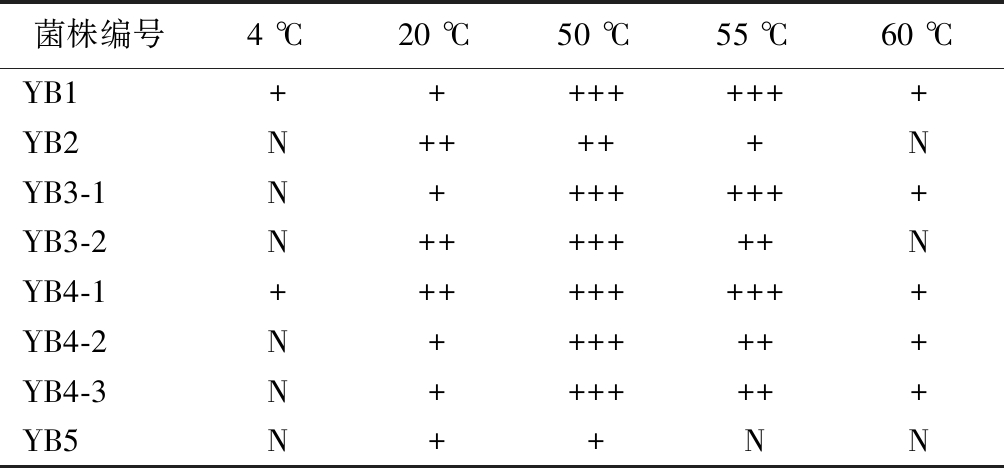
菌株编号4 ℃20 ℃50 ℃55 ℃60 ℃YB1+++++++++YB2N+++++NYB3-1N++++++++YB3-2N+++++++NYB4-1++++++++++YB4-2N+++++++YB4-3N+++++++YB5N++NN
注:+表示可以生长,+越多表示菌株生长越旺盛,N表示不生长(下同)
实验结果表明,有7株菌能在20~55 ℃下正常生长(YB5除外,在55 ℃下不能生长),其中YB1、YB3-1和YB4-1在55 ℃下生长比较旺盛;有5株菌可以耐受60 ℃高温而缓慢生长(除YB2、YB3-2和YB5外);有2株菌可以在4 ℃低温下缓慢生长,即YB1和YB4-1,其他6株菌则不生长。综上所述,除YB5外,其余菌株均能在55 ℃及以下快速生长,具有较高的温度耐受性。
2.3.2 盐度耐受性
将筛选的8株菌分别接种于添加了不同质量分数的NaCl的盐耐受性验证培养基平板上,置于45 ℃恒温培养24 h,观察菌落生长情况,结果如表3所示。
表3 菌株盐度耐受性
Table 3 Salinity tolerance of the strains

菌株编号盐度(NaCl质量分数)/%45678YB1++++++++NYB2+++++++NYB3-1+++++++++++NYB3-2+++++++++++NYB4-1+++++++++++NYB4-2++++++++NYB4-3++++++++NYB5+++++NN
实验结果表明,各菌株均具有较高的盐度耐受性,有7株菌(YB5除外,最高耐受6%的盐度)最高耐受7%的盐度,相比较而言,YB3-1、YB3-2和YB4-1在7%盐度下长势旺盛,YB1、YB2、YB4-2和YB4-3在7%盐度下能够正常生长;小于6%的盐度所有菌株都能正常生长。综上所述,筛选的8株菌都有较高的盐度耐受性。
2.4 分子生物学鉴定
综合考虑各菌株的产酶性能及对温度和盐度的耐受性,选择YB1、YB4-1和YB4-2作为潜力菌株,用于后续堆肥实验。使用试剂盒扩增3株菌的16S rDNA序列片段,送上海生工公司测序,得到16S rDNA基因碱基测序,将各菌株的碱基序列输入美国国立生物技术信息中心,应用BLAST程序,将所得序列与数据库中存在细菌的16S rDNA序列进行相似性比对,结果如表4所示。
表4 各菌株鉴定结果
Table 4 The identification results of the strains

菌株编号序列长度/bp相似菌株相似度/%YB11 104Bacillus subtilis99YB4-11 143Bacillus megaterium100YB4-21 077Bacillus licheniformis99
由表4可知,YB1、YB4-1和YB4-2的碱基序列长度分别为1 104、1 143和1 077 bp,通过比对,确定其分别为枯草芽孢杆菌(Bacillus subtilis)、巨大芽孢杆菌(Bacillus megaterium)和地衣芽孢杆菌(Bacillus licheniformis)。
2.5 筛选菌株生长曲线
取已经在LB液体培养基中培养8 h的YB1、YB4-1和YB4-2菌悬液各0.2 mL,分别接种于LB液体培养基(空白)和LB液体培养基(质量分数为6%的NaCl,5%的橄榄油乳化液)中培养,测定不同培养时间发酵液的OD值,绘制生长曲线,如图5所示。
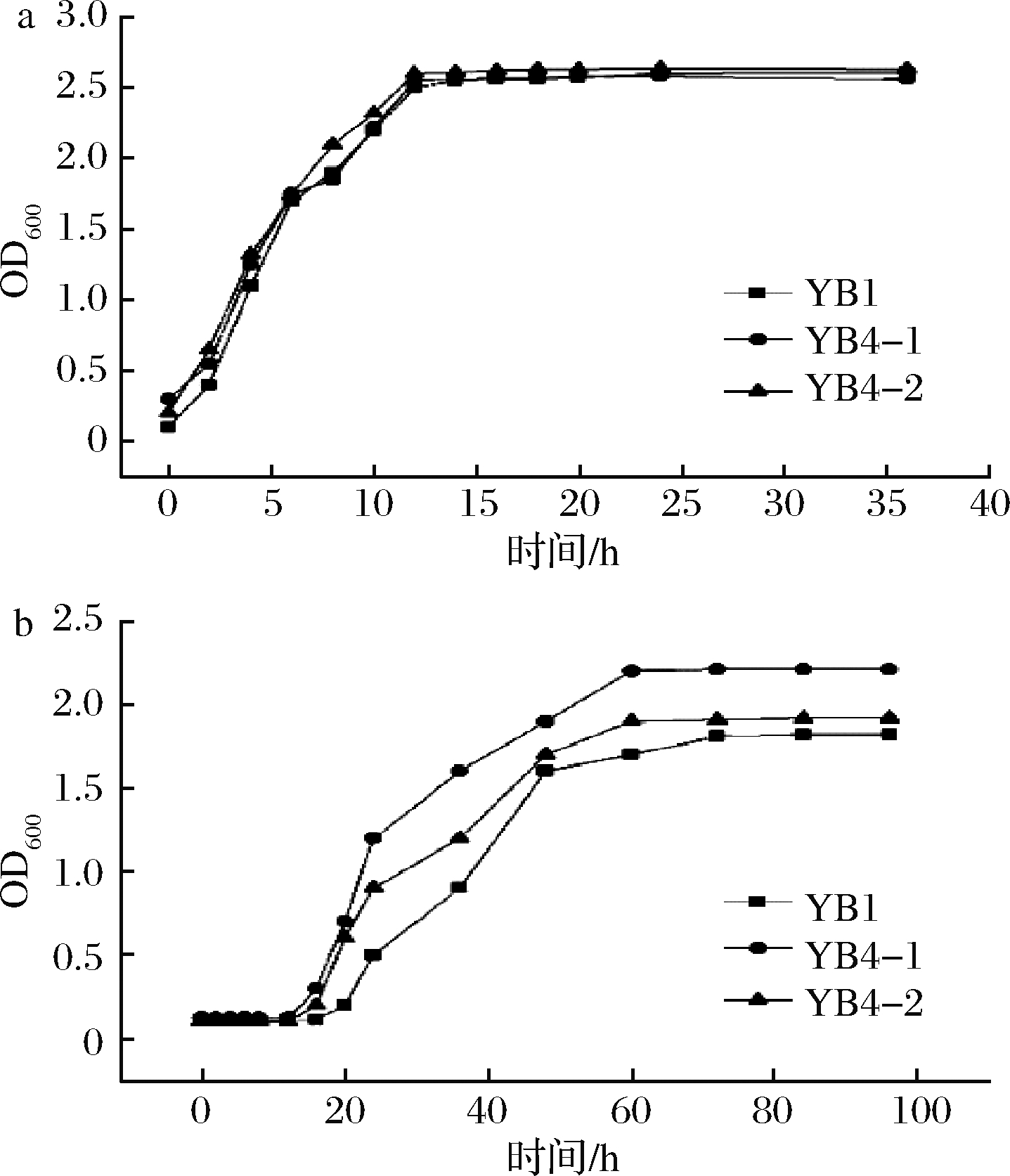
a-正常培养环境;b-非正常培养环境
图5 筛选菌株生长曲线
Fig.5 The growth curve of screened strains
微生物生长繁殖分为4个时期,分别为停滞期、对数期、稳定期、衰亡期。3种潜力菌株在正常LB液体培养基环境中生长情况如图5-a,可以看出活化后的菌种转接到新鲜培养液中时,看不到延滞期,12 h 时到达对数生长期末期,开始进入稳定期。当接种于非正常培养环境中(LB培养基含质量分数为6%NaCl,5%的橄榄油乳化液,培养温度55 ℃)时,如图5-b所示,3种菌株生长速度明显减慢,停滞期延长接近20 h,到60 h时才进入生长稳定期,此时菌体浓度YB4-1>YB4-2>YB1,均低于正常LB液体环境中的菌体浓度。
2.6 筛选菌株复合菌剂对餐厨垃圾降解率的影响
复合菌剂的制备:将YB1、YB4-1和YB4-2分别在LB液体培养基(含质量分数为6%的NaCl,5%的橄榄油乳化液,培养温度55 ℃)中培养60 h,将发酵液按体积比1∶1∶1混合制作成复合菌剂。
实验组和对照组:实验组接种投料质量1%的复合菌剂,对照组对应添加投料质量1%的空白培养基。实验按照1.2.6中堆肥方法进行高温好氧堆肥,通过称重系统记录整个堆肥过程中重量变化,结果如图6所示。
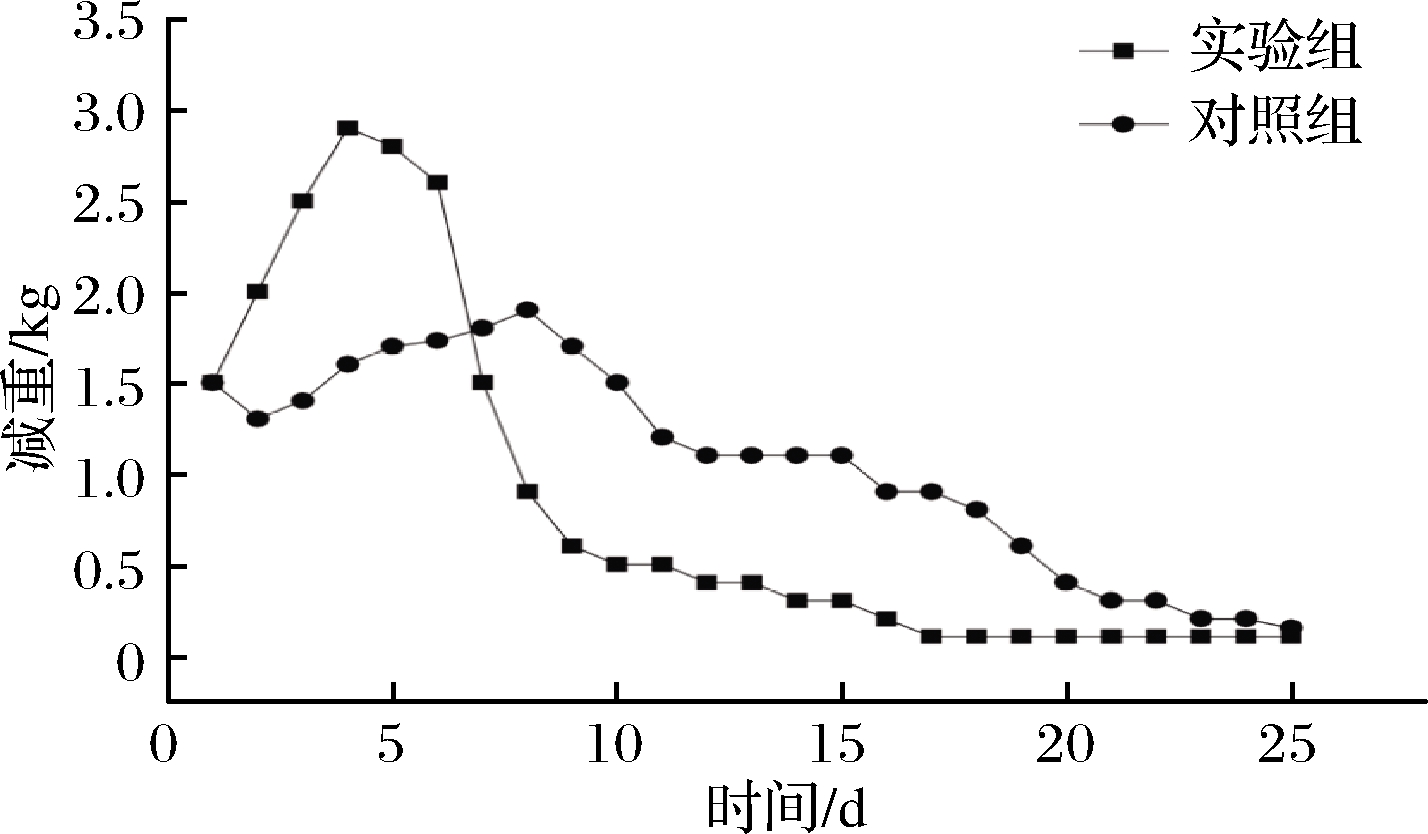
图6 堆肥过程中减重
Fig.6 Weight loss during composting
图6显示了复合菌剂在堆肥过程中对餐厨垃圾降解率的影响,开始出现的减重主要是因为水分蒸发的缘故,结果表明,实验组接种复合菌剂后第2天开始,餐厨垃圾减重明显升高,第4天达到最高值,单日减重2.8 kg,后期随着有机质的不断分解利用,减重逐渐降低,15 d后趋于稳定,总减重率可达到85%。对照组在第4天减重开始上升,第8天减重达到最大值,单日最高减重明显低于实验组,25 d后趋于稳定,总减重率接近65%。由此可知,该复合菌剂不仅能明显缩短堆肥周期(约40%),而且将餐厨垃圾降解率提高了31%,非常适合作为餐厨垃圾降解菌。
2.7 筛选菌株在高温好氧堆肥过程水解酶酶活
在2.6中实验组堆肥过程的第2、4、6、8、10、12天时分别取样测定餐厨垃圾高温好氧堆肥过程中的水解酶酶活,测定结果如图7所示。
测定结果表明,4种水解酶酶活力在堆肥开始的第2天都能检测到;淀粉酶和脂肪酶酶活在第4天均达到最大值,分别为130.0和5.2 U/mL;蛋白酶和纤维素酶酶活分别在第6天和第8天达到最大值,分别为13.0和2.5 U/mL,这可能与产酶微生物不同的生长状态有关。4种酶的酶活在达到最高值后均有减弱趋势,可能因为随着有机质的分解整个堆肥环境发生了变化,影响了酶的活力。
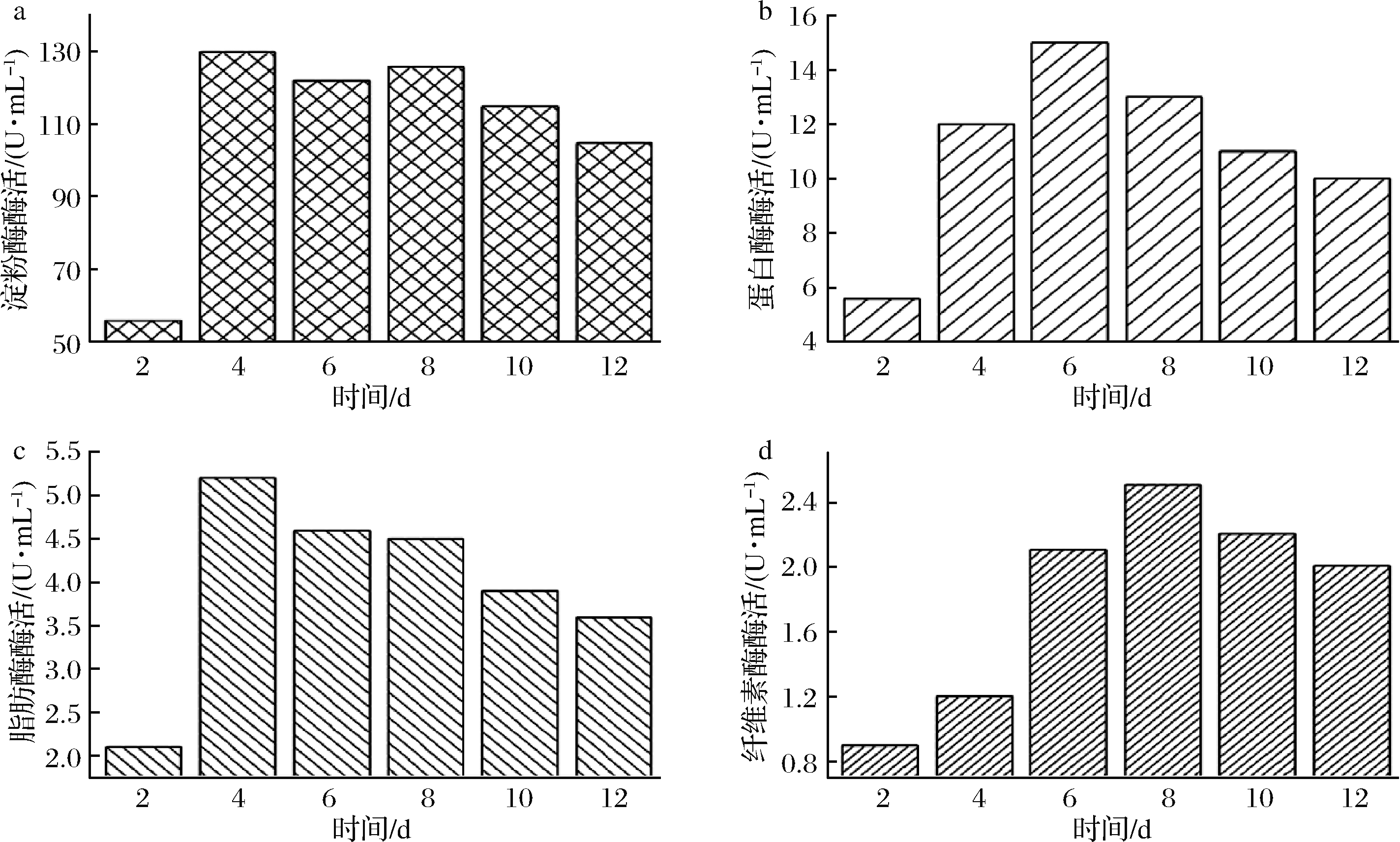
a-淀粉酶酶活;b-蛋白酶酶活;c-脂肪酶酶活;d-纤维素酶酶活
图7 堆肥过程中的酶活
Fig.7 Enzyme activity during composting
3 结论
本研究从不同环境中腐熟的餐厨垃圾有机肥样品中进行芽孢杆菌菌种筛选,通过富集、分离纯化获得了8株形态各异的目标菌株,分别编号为YB1、YB2、YB3-1、YB3-2、YB4-1、YB4-2、YB4-3和YB5,经菌落显微染色观察,所有菌株均为革兰氏阳性菌,且内部有芽孢。
通过平板透明圈法测定各菌株的产酶能力,结果显示8株菌均有分解淀粉的能力,7株菌(除YB3-2外)均有分解纤维素的能力,6株菌(除YB2和YB5外)均有分解蛋白质的能力,只有3株菌具有分解油脂的能力,其中YB1、YB4-1和YB4-2对淀粉、纤维素、蛋白质及油脂具有更强的分解能力。耐受性试验结果表明,除YB5外,其余菌株均能在55 ℃及7%的盐度下快速生长,具有较高的温度和盐度耐受性。综合考虑各菌株的产酶能力及对温度和盐度的耐受性,最终确定YB1、YB4-1和YB4-2为潜力菌株,用于后续堆肥实验。
经过分子生物学鉴定,确定YB1、YB4-1和YB4-2分别为枯草芽孢杆菌(Bacillus subtilis)、巨大芽孢杆菌(Bacillus megaterium)和地衣芽孢杆菌(Bacillus licheniformis)。
将3株菌株等比例制作成复合菌剂用于餐厨垃圾堆肥实验,结果表明从第2天开始,餐厨垃圾减重明显升高,第4天达到最高值,15 d后趋于稳定,总减重率可达到85%,该复合菌剂不仅能明显缩短堆肥周期(约40%),而且将餐厨垃圾降解率提高了31%,非常适合作为餐厨垃圾降解菌。
[1] 尹亚琳.餐厨垃圾的处理技术[J].资源节约与环保,2018(6):106.
[2] 朱慧.餐厨垃圾及组分对几种常见微生物生长的影响[D].南京:南京大学,2019.
[3] 周营.餐厨垃圾好氧堆肥微生物强化及复混肥制备的研究[D].广州:华南理工大学,2018.
[4] 黄林丽,谢斌,陈立,等.公共餐厨垃圾饲料化利用的混合菌发酵工艺[J].食品与发酵工业,2019,45(24):148-152.
[5] 冯磊,高媛,寇宏丽,等.餐厨垃圾干发酵水解酸化机制及产气动力学[J].环境污染与防治,2016,38(9):62-67.
[6] 刘敬武.城市餐厨垃圾资源化、无害化、减量化处理研究[J].环境与发展,2018,30(6):240-241.
[7] 王静,陆万祥.餐厨垃圾资源化专利技术综述[J].河南科技,2017(16):58-59.
[8] 施军营,薛方亮,何清玉,等.城市餐厨垃圾前处理的工艺优化[J].环境工程学报,2017,11(10):5 658-5 662.
[9] 饶玲华,李军.餐厨垃圾资源化处理方案对比分析[J].环境科学与技术,2016,39(S2):237-240.
[10] 何侃侃,曾武,黄燕冰,等.餐厨垃圾生物处理技术研究进展[J].广东化工, 2018, 45(24):25-26.
[11] 高常卉,黄振兴,赵明星,等.餐厨垃圾厌氧干发酵产氢特性及其调控[J].环境工程学报,2018,12(6):1 843-1 852.
[12] 程亚莉,毕桂灿,沃德芳,等.国内外餐厨垃圾现状及其处理措施[J].新能源进展,2017,5(4):266-271.
[13] 陈立春,卞月红.南京餐厨垃圾特征、危害与主要处理方法[J].农业工程技术,2018,38(29):38-39.
[14] 郝晓地,周鹏,曹达啓.餐厨垃圾处置方式及其碳排放分析[J].环境工程学报,2017,11(2):673-682.
[15] 周东兴,王广栋,邬欣慧,等.腐熟堆肥中维素降解菌筛选鉴定及酶学特性研究[J].东北农业大学学报,2018,49(5):60-68.
[16] 张达余,凌培杰,周森林,等.易腐厨余垃圾好氧高温堆肥制作技术[J].现代农业科技,2019(5):164-165.
[17] 文斌,郭小林,傅祥超,等.三种菌剂在兔粪菌渣高温堆肥中的应用效果研究[J].草业与畜牧,2016(2):43-51.
[18] 张琴.两种不同通风方式下堆肥接种剂的作用效果研究[D].北京:中国农业大学,2007.
[19] 赵斌,方正,柯晓静.促腐菌剂在农业有机废弃物腐解中的应用研究进展[J].河南农业科学,2014,43(1):7-10.
[20] 勾长龙,高云航,刘淑霞,等.微生物菌剂对堆肥发酵影响的研究进展[J].湖北农业科学,2013,52(6):1 244-1 247.
[21] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[22] QB/T 1803—1993,工业酶制剂通用试验方法[S].北京:中国轻工业出版社,1993.
[23] 方华.绍兴黄酒麦曲中微生物的初步研究[D].无锡:江南大学,2006.
[24] 江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007,24(8):72-75.
[25] BROWN I J,TZOULAKI I,CANDEIAS V,et al.Salt intakes around the world:Implications for public health[J].International journal of epidemiology,2009,38(3):791-813.
[26] LIU Nuo,WANG Quan,JIANG Jiangguo,et al.Effects of salt and oil concentrations on volatile fatty acid generation in food waste fermentation[J].Renewable Energy,2017,113:1 523-1 528.
[27] 王攀,李冰心,黄燕冰,等.含盐量对餐厨垃圾干式厌氧发酵的影响[J].环境污染与防治,2015,37(5):27-31.
[28] 任连海,黄燕冰,王攀.含盐量对餐厨垃圾堆肥理化特性变化规律的影响[J].重庆大学学报,2014,37(7):104-109.