油脂的体外消化受多种因素的影响,例如酶的浓度、脂肪的组成以及界面面积和粒径大小等[1-3],关于这些因素的研究早有报道,但对于加样量和乳液含油量对乳液中脂肪消化的影响报道甚少,人们的饮食习惯不同,有人食量大,有人喜欢吃油脂含量多的食物,有人喜吃动物类油脂,这些将直接影响到人们的体重。我国人民的体重情况不容乐观,据2015年中国居民营养与慢性病状况报告显示,18岁及以上成人肥胖率11.9%。肥胖是众多慢病如心脑血管疾病、糖尿病、癌症的重要诱因,肥胖超重更容易患动脉粥样硬化,是心血管疾病发病的主因[4]。另外大人和孩子,老人与年轻人体内酶浓度存在一定的差异[5]。因此,研究不同酶含量、加样量和乳液含油量及油脂类型对油脂体外消化的影响具有重要的现实意义。另外,包埋前后脂肪酸成分是否发生变化直接影响到包埋后脂肪的口感和味道,因此,需要对脂肪包埋前后的成分进行分析对比。使用不同的油制备的乳液由于组成(脂肪酸链长和不饱和度)不同,其消化率有一定的差异。乳剂通过模拟体外消化期间的粒度分布,颗粒电荷,微观结构和宏观外观也与油的类型相关[6]。
因此,本文研究了不同酶浓度、加样量、油含量及油类型对乳液油脂脂肪酸释放率的影响,并通过气相色谱测定了5种不同油类型包埋前后和消化后的脂肪酸组成。这项研究的结果可能有助于设计功能性食品,以控制甘油三酸酯的消化和吸收。这为以后不同油在乳液体系的应用研究奠定了基础,为减肥人士的饮食指导提供了理论依据。
1 材料与方法
1.1 材料与试剂
椰油、紫苏籽油、橄榄油、棕榈油、稻米油,益海嘉里食品营销有限公司;乳清分离蛋白(whey protein isolate,WPI) 丹尼斯克(中国)有限公司;羧甲基纤维素钠(carboxmethylcellulo sesodium,CMC)、黏液蛋白、胃蛋白酶、胰酶、胆汁盐,美国Sigma-Aldrich公司;浓HCl、NaOH、Na2HPO4、NaCl、KCl、CaCl2、MgCl2、KH2PO4,北京化工厂;试剂均为分析纯。
1.2 仪器与设备
电子天平(BS210S型),北京赛多利斯仪器系统有限公司;ULTRA-TURRAX 分散机(T25 基本型),德国IKA 公司;高压均质机(Homelab型),意大利FBF 公司;气相色谱仪(2010plus),岛津企业管理有限公司;自动电位滴定仪(907),瑞士万通中国有限公司;光学法微流变仪(Rheolaser Master),北京朗迪森科技有限公司。
1.3 实验方法
1.3.1 样品的制备
准确称取2 g的乳清分离蛋白溶于88 g去离子水中,高速搅拌使其充分溶解,将溶液以800 r/min的速度搅拌30 min以确保完全分散和溶解,配成蛋白溶液,备用;准确称取2 g的CMC溶于pH 3的醋酸盐缓冲液(88 g)中,搅拌过夜,配成纤维素溶液,备用。蛋白溶液高速剪切,剪切过程中缓慢加入20 g油形成粗乳液,纤维素溶液高速剪切,并缓慢加入粗乳液,再经高压均质机(一级均质压力25 MPa,二级均质压力5 MPa)均质2 次,制得5种不同的油乳液。
1.3.2 椰子油乳状液的微观流变学研究
采用Rheolaser Master光学法微流变仪对乳液的流变学特性进行分析。将准备好的透明石英样品瓶(乳液约20 mL)放入25 ℃的等温室中,经实时多次的激光光源(波长650 nm)扫描,得到乳液的强度去相关函数,接着得到粒子的均方位移(mean square displacement,MSD)。
1.3.3 体外消化过程
参考YUAN等[7]方法分别制备不同离子浓度的口腔消化液(simulated salva fluid,SSF)、胃消化液(simulated gastvic fluid,SGF)和小肠消化液(simulated intestinal fluid,SIF)备用。
口腔消化阶段:取30 mL(60、90 mL)乳状液于烧杯中,加入21 mL SSF(含黏蛋白0.9 g),用NaOH调pH=7,37 ℃恒温水浴振荡(150 r/min)10 min。
胃消化阶段:取30 mL(60,90 mL)口腔消化后的乳状液于烧杯中,加入21 mL SGF,加入胃蛋白酶3 mL(10.67 mg/mL),用HCl调pH=3,37 ℃恒温水浴振荡(150 r/min)40 min。
小肠消化阶段:取30 mL(60、90 mL)胃消化后乳状液于烧杯中,加入21 mL SIF(含胆汁盐0.281 25 g),加入胰脂肪酶3 mL (10 mg/mL),用NaOH调pH=7,使用激光粒度电位分析仪检测体系pH,并用0.2 mol/L NaOH溶液滴定以维持体系pH恒为7,37 ℃恒温水浴振荡(150 r/min)2 h。
1.3.4 不同油乳状液消化过程脂肪酸释放率测定
参考MINEKUS等[5]方法并进行修改。使用pH-stat方法,用0.2 mol/L NaOH溶液滴定消化液。口腔阶段维持pH=6.8消化10 min;胃阶段维持pH=2.8消化40 min;小肠阶段维持pH=6.8消化2 h。按照公式(1)计算释放的游离脂肪酸(free fatty acid,FFA)的百分比。
(1)
式中:VNaOH,滴定消耗NaOH体积,L;mNaOH,NaOH溶液浓度,mol/L;Mlipid,样品相对分子质量,g/mol;Wlipid,样品质量,g。
1.3.5 不同油乳状液消化过程脂肪组成测定
1.3.5.1 乳液及消化后小肠液中油的提取
参考BLIGH[8]和SINGH等[9]的方法并进行修改,其流程如下:

1.3.5.2 油的甲酯化
参考SINGH等[9]和O′FALLON等的方法[10]并进行修改,其流程如下:
1.3.5.3 气相色谱条件
色谱柱:2B-WAXPLUS 石英毛细柱(30 m×0.25 mm,0.25 μm);升温程序:130 ℃保持1 min,以6.5 ℃/min升至170 ℃,保持0 min,以2.75 ℃/min升至215 ℃,保持12 min,以4 ℃/min升至230 ℃,保持10 min,以1 ℃/min升至235 ℃,保持1 min;载气(N2)流速1 mL/min,压力104.2 kPa,进样量1 μL;分流比为50∶1。
1.3.5.4 不同油中脂肪组成比的计算
自动进样,吸取1 μL试样液注入气相色谱仪,记录色谱峰的保留时间和峰高。利用标准图谱确定每个色谱峰的性质(定性),利用软件自带的自动积分方法计算各脂肪酸组分的百分含量计算如公式(2)所示[11]:
(2)
式中:Xi,试样测定液中各脂肪酸甲酯的组成,%;Ai,试样测定液中各脂肪酸甲酯峰面积;Fi,各脂肪酸甘油三酯转换成脂肪酸的换算系数。
1.4 数据处理
每个实验重复4次,采用DPS 7.5软件对试验数据进行分析,并采用Origin 8.5软件进行作图。
2 结果与分析
2.1 不同酶浓度对模拟WPI-CMC椰油乳液体外消化过程中游离脂肪酸释放率的影响
图1表示不同酶浓度下椰油乳液在体外消化各阶段的脂肪酸释放率。在酶浓度为0.15~1.5 mg/mL时,口腔和胃阶段乳液的脂肪酸释放率整体偏低;在小肠阶段,随酶浓度的增加乳液脂肪酸释放率增加。胰酶浓度的增加使其水解乳液中脂肪的速率增加,会增进乳液液滴的溶胀,从而更快地释放出游离的脂肪酸,脂肪酸释放率增高。这与表1中K值相对应,K值表示单位时间内平衡体系中产生的游离脂肪酸所需的氢氧化钠的用量,可以看出,在浓度范围内,胰酶的浓度越高,K值越大,说明脂肪酸释放速率越快,而最终游离脂肪酸的释放率也越高。据报道[12]胰酶是对于胃肠道脂质酶促水解过程很重要。通过晶体结构分析表明,胰酶用量的增加有利于胰酶结合,这可能有助于将脂肪酶维持在活性构象中,有利于加快水解反应。
表1 椰油乳液在不同酶浓度下的K值及肠脂肪酸 释放率
Table 1 K value and fatty acid release rate in small intestine of coconut oil emulsion under different enzyme concentrations
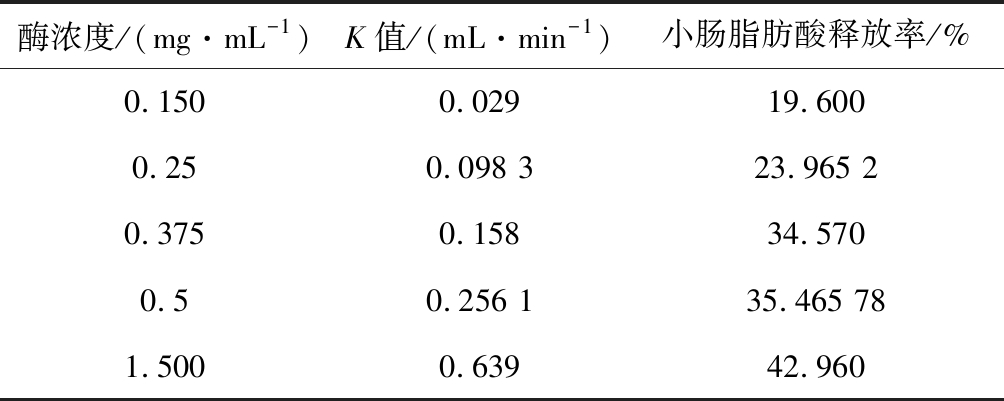
酶浓度/(mg·mL-1)K值/(mL·min-1)小肠脂肪酸释放率/%0.150 0.029 19.600 0.250.098 323.965 20.375 0.158 34.570 0.50.256 135.465 781.500 0.639 42.960
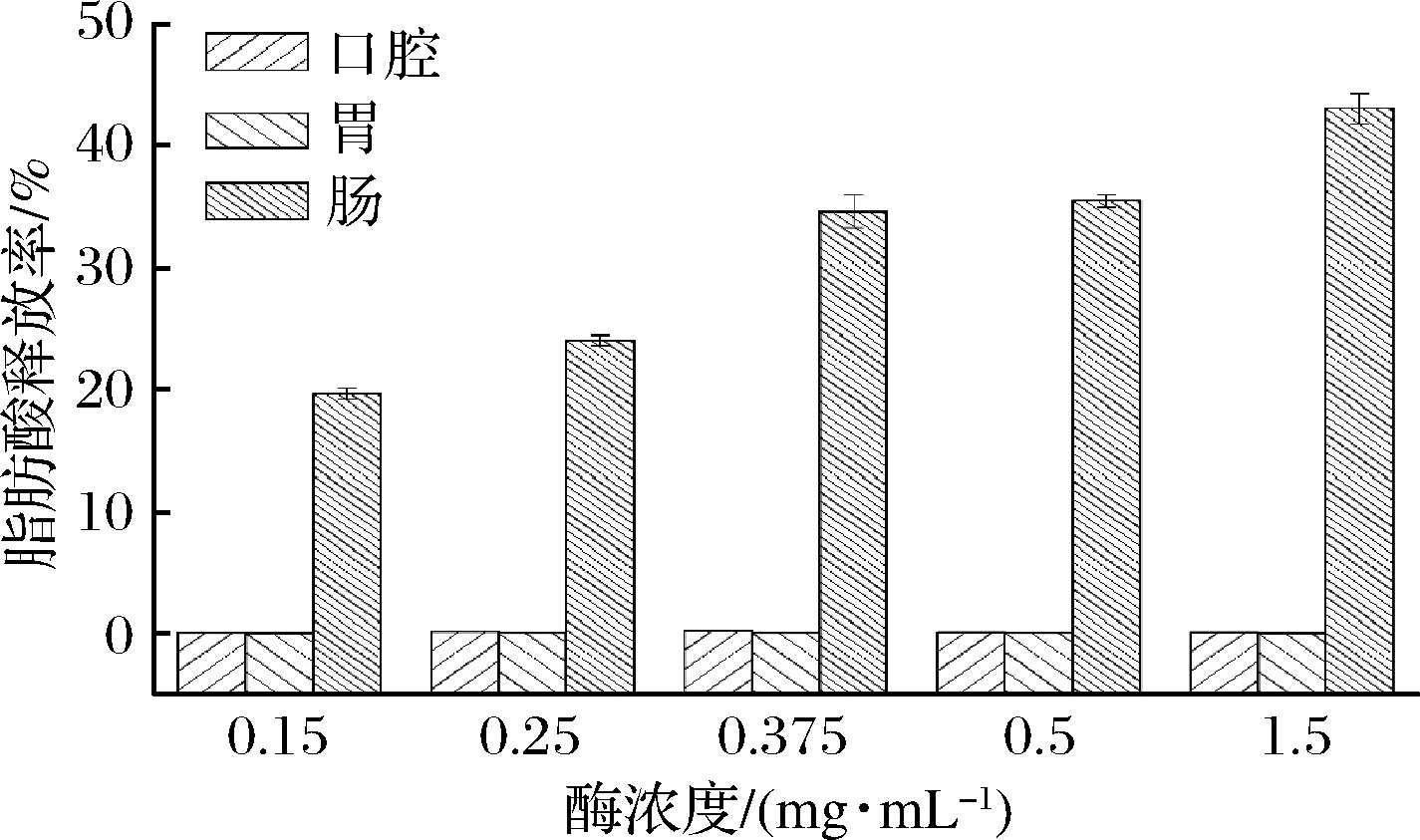
图1 不同酶浓度下椰油乳液的脂肪酸释放率
Fig.1 Fatty acid release rate of coconut oil emulsion under different enzyme concentrations
2.2 不同加样量对模拟WPI-CMC椰油乳液体外消化过程中游离脂肪酸释放率的影响
图2为不同加样量下椰油乳液在体外消化各阶段的脂肪酸释放率。在口腔和胃阶段,乳液脂肪酸释放率整体偏低。在小肠阶段,随加样量的增加乳状液的脂肪酸释放率反而减小。在实际测定中,即使在酶浓度足够高,也会出现随底物浓度增加酶促反应速度降低的现象,这可能是过量的底物聚集在酶分子上,生成无活性的中间产物,不能释放出酶分子,减少了乳液和酶的接触面积,从而抑制乳液中脂肪的消化,降低脂肪酸的释放率。INTERTHAL等[13]在研究酪氨酰DNA磷酸二酯酶(Tdp1)催化拓扑异构酶I-DNA共价复合物中发现Tdp1-DNA共价反应后有中间体的积累,产生一种新的蛋白质-DNA复合物,这可能会干扰人类细胞的转录和复制。
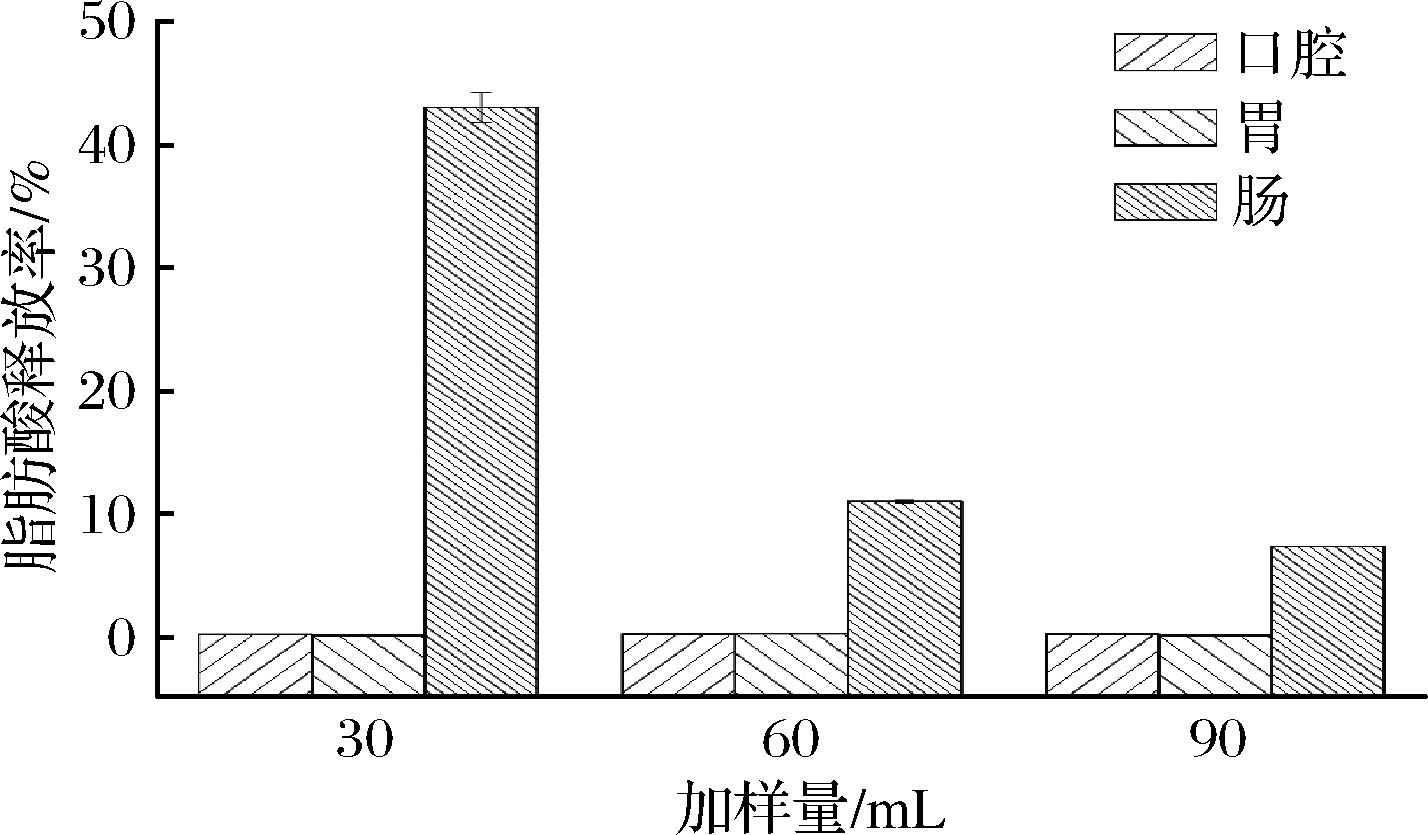
图2 不同加样量下椰油乳液的脂肪酸释放率
Fig.2 Fatty acid release rate of coconut oil emulsion under different loading amounts
2.3 不同含油量对模拟WPI-CMC椰油乳液体外消化过程中游离脂肪酸释放率的影响
2.3.1 不同含油量对模拟WPI-CMC乳液微流变特性的影响
XU等[14]发现壳聚糖的添加导致WPI-FG稳定的叶黄素乳液的宏观黏度和弹性指数增加,而且壳聚糖还增加了乳液中叶黄素的化学稳定性。KYUJEONG等[15]还使用动态光散射技术进行了微流变学测量用来表征纤维素纳米原纤维悬浮液的黏弹性,表明含有高浓度盐的纤维素纳米原纤维悬浮液显示更多类固体行为。为更好探究不同含油量对椰油乳液游离乳液脂肪酸释放率的影响,对比了不同油含量的乳液微流变特性。
MSD曲线表示样品中的颗粒在给定的去相关时间内运动的平均面积。图3中10%和30%椰油乳液体系的MSD曲线为线性曲线,所以10%和30%椰油乳液体系为纯黏性流体,在相同的去相关时间内,30%椰油乳液的MSD值较10%椰油乳液低,运动的距离较短,说明乳液随含油量增加,其黏弹性增大,流动性变差,而黏弹性增高能够更好地保护体系中的油脂不被体外消化中的酶破坏;40%和50%椰油乳液体系的 MSD曲线分为开始阶段、平台区、结束阶段,因为出现平台区,为黏弹性流体,40%椰油乳液的弹性平台区要高于50%椰油乳液,根据方程EI=1/(MSD)~G'plateau,平台区的高度越高,弹性越小,因此50%椰油乳液的弹性要高。且50%椰油乳液的平台区斜率要低于40%椰油乳液,平台区的斜率越低,样品表现出更多的固体特征,平台区的斜率越高,样品表现出更多的液体特征,因此50%的椰油乳液表现出更多的固体特征,流动性更小。因此,乳液的含油量越大,其黏弹性越好,流动性变差。

a-10%椰子油;b-30%椰子油;c-40%椰子油;d-50%椰子油
图3 不同含油量下椰油乳液的MSD曲线
Fig.3 MSD curves of coconut oil emulsions with different oil contents
2.3.2 不同含油量对模拟WPI-CMC乳液体外消化过程中游离脂肪酸释放率的影响
图4为不同加样量下椰油乳液在体外消化各阶段的脂肪酸释放率。在口腔和胃阶段,乳液脂肪酸释放率整体偏低。在小肠阶段,随油含量的增加乳液的脂肪酸释放率减少。可能的原因是油含量增加,蛋白损耗絮凝,乳化效果差,比表面积减小,不利于脂肪酸的释放。也可能与乳液的流变学特性相关,当乳液的含油量增加时,乳液的黏弹性增加,乳液的流动性减小,因此不利于胆汁盐会吸附至乳液液滴的表面,进而与乳液界面上的乳化剂发生竞争性吸附并部分取代乳化剂,不利于乳液界面上的乳化剂分子脱落,这就在一定程度上抑制了胰脂肪酶与乳液中油相的接触,从而抑制乳液中脂肪的消化,降低脂肪酸的释放率。
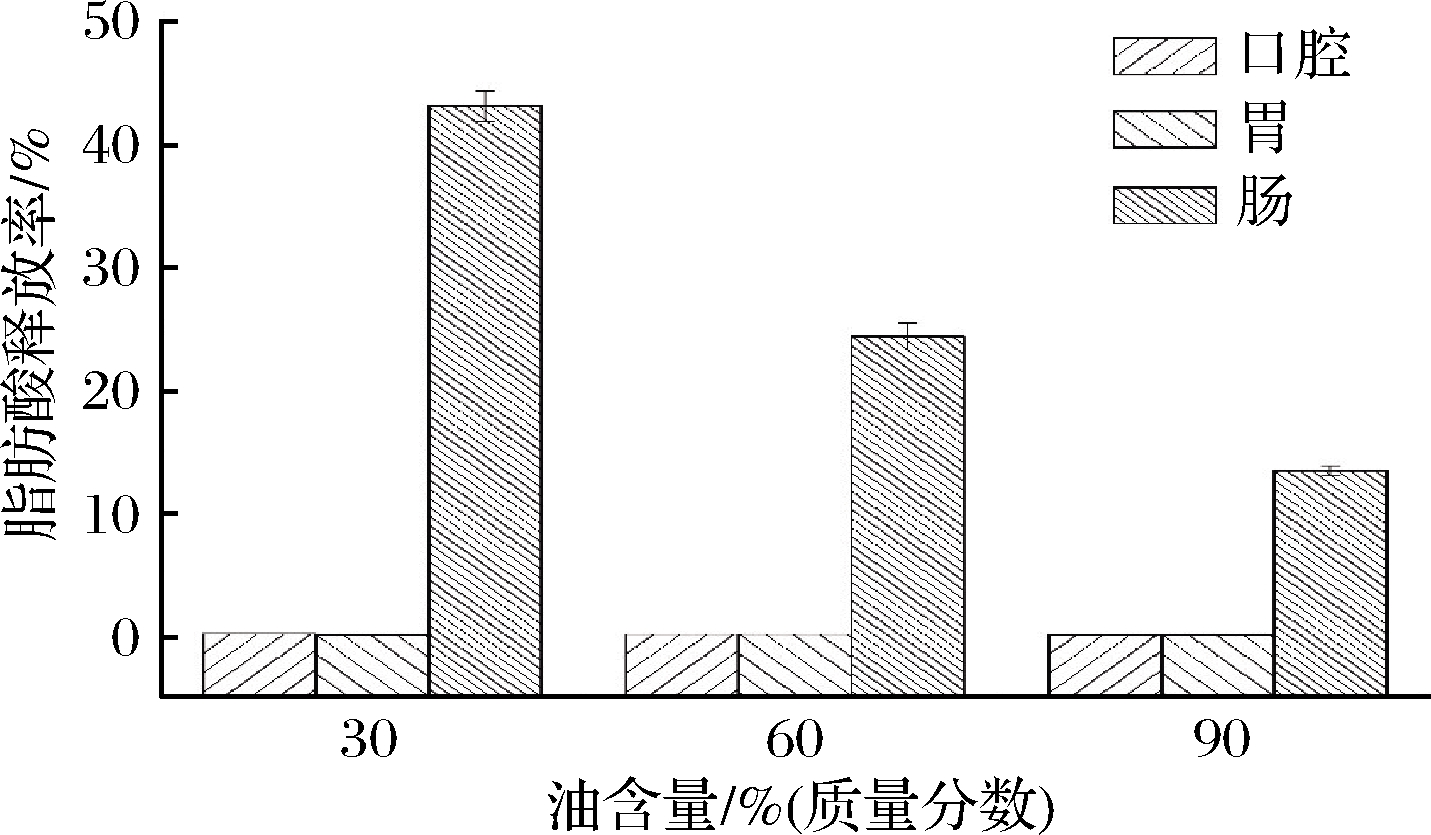
图4 不同含油量下椰油乳液的脂肪酸释放率
Fig.4 Fatty acid release rate of coconut oil emulsion under different oil content
2.4 不同油类型对乳液体外消化过程中游离脂肪酸释放率的影响
2.4.1 五种不同原油中脂肪酸的组成
表2为不同油脂的脂肪酸组成,各组成均符合国家标准。
表2 不同类型油乳液的脂肪酸组成
Table 2 Fatty acid composition of different types of oil emulsions
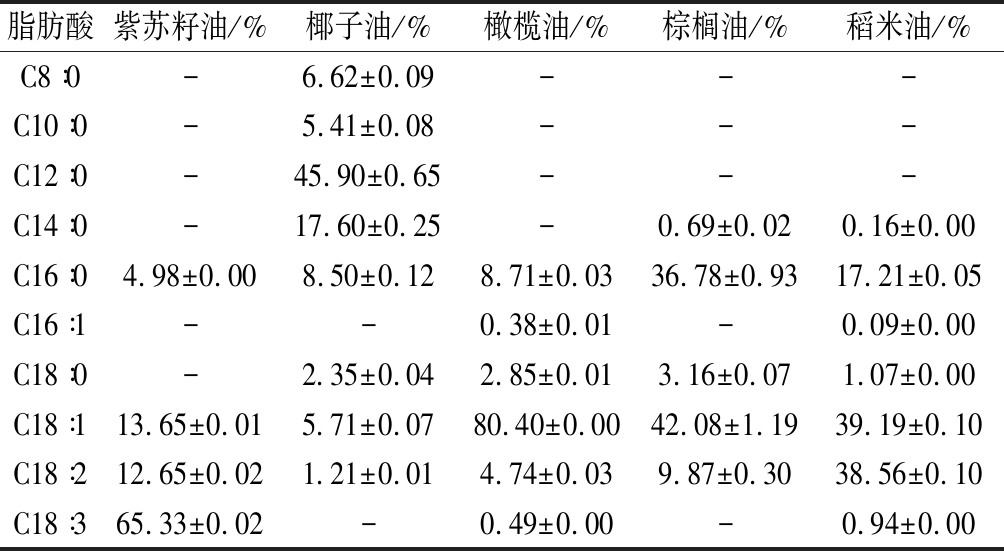
脂肪酸紫苏籽油/%椰子油/%橄榄油/%棕榈油/%稻米油/%C8∶0-6.62±0.09---C10∶0-5.41±0.08---C12∶0-45.90±0.65---C14∶0-17.60±0.25-0.69±0.020.16±0.00C16∶04.98±0.008.50±0.128.71±0.0336.78±0.9317.21±0.05C16∶1--0.38±0.01-0.09±0.00C18∶0-2.35±0.042.85±0.013.16±0.071.07±0.00C18∶113.65±0.015.71±0.0780.40±0.0042.08±1.1939.19±0.10C18∶212.65±0.021.21±0.014.74±0.039.87±0.3038.56±0.10C18∶365.33±0.02-0.49±0.00-0.94±0.00
注:上表表示平均值±方差,-表示未检出
紫苏籽油中脂肪酸排名前三的分别是C18∶3,C18∶2和C18∶1,占总脂肪酸的91.63%;椰油中含量最丰富的脂肪酸为C12∶0,C14∶0,占总脂肪酸的63.5%,橄榄油中绝大部分脂肪酸为C18∶1,占总脂肪酸的80.4%;棕榈油中含量丰富的脂肪酸分别为C16∶0,C18∶1,占总脂肪酸的78.86%;稻米油中含量最多的是C18∶2和C18∶1,占总脂肪酸的77.75%。结果表明,稻米油主要为长链单、多不饱和脂肪酸(油酸和亚油酸);紫苏籽油中长链多不饱和脂肪酸(亚麻酸)含量较高;橄榄油主要由长链单不饱和脂肪酸(油酸)组成;椰油中主要含中链饱和脂肪酸;棕榈油中主要含长链单不饱和脂肪酸(含油酸)和中链饱和脂肪酸。这表明不同膳食脂质的脂肪酸组成显示出极大的差异,这可能进一步导致它们在消化、吸收和营养方面的差异[16]。
2.4.2 不同油类型对模拟椰油乳液体外消化过程中游离脂肪酸释放率的影响
图5为不同油对乳液体外消化的脂肪酸最大释放水平的影响,脂肪酸最大释放水平依次降低,椰油>橄榄油>棕榈油=稻米油>紫苏籽油。脂质的类型和结构可能有助于脂质的消化过程[17-18],链长可能影响胰酶的活性和甘油三酸酯脂解的程度,并且长链甘油三酸酯的消化速率比短链和中链甘油三酸酯慢[19-20],原因可能有:长链甘油三酯的消化产物是长链FFA,倾向于在油-水界面积聚,从而限制了脂肪酶到液滴表面。但是,短链或中链甘油三酯(短链或中链FFA)的消化产物对水的亲和力较高,因此会迅速移入周围的水相,从而使脂质表面更容易聚集脂肪酶,并有利于脂质水解过程[21]。此外,饱和脂肪酸(C16∶0和C18∶0)也被报道为比不饱和脂肪酸(C18∶1,C18∶2n-6和C18∶3n-3)释放更快[17]。由表2可知,椰油中主要含中链饱和脂肪酸,因此乳液的脂肪酸释放水平也较高;长链多不饱和脂肪酸的消化速率比长链单不饱和脂肪酸慢[22-23]。紫苏籽油中长链多不饱和脂肪酸(亚麻酸)含量较高,因此该乳液的脂肪酸释放水平也最低;稻米油主要为长链单、多不饱和脂肪酸(油酸和亚油酸),其乳液的释放率比紫苏籽油要高;橄榄油主要由长链单不饱和脂肪酸(油酸)组成,其释放率比稻米油要高;棕榈油乳液的脂肪酸释放水平与稻米油相当,一方面棕榈油中的单不饱和脂肪酸(油酸)含量与稻米油相当,另一方面可能与棕榈油中脂肪酸(C16∶0)的位置有关[16],胰酶的水解作用主要是对与Sn-1键相连的脂肪酸,其次对Sn-3键,只有很少的三酰基甘油完全水解为游离甘油(2-单酰基甘油异构化为1-单酰基甘油可能导致三酰基甘油的完全水解)。脂肪酸组成和甘油三酸酯结构的多样性会影响脂质的消化效率。先前的研究表明,口腔和胃的消化不良可以促进实际生理条件下小肠中脂质的消化,口腔和胃消化阶段的水解产物(MAG或Sn-1,2 DAG)能够增加对甘油三酯,共脂肪酶的结合,以及通过脂肪酸刺激胃中胆囊收缩素的释放[23]。因此,使用体外模型可能会比实际生理条件下或存在胃和舌脂肪酶条件下更低。

图5 不同油类型对乳液脂肪酸释放率的影响
Fig.5 Effect of different oil types on fatty acid release rate of emulsion
注:图中不同小写字母表示有显著性差异(P<0.05)
2.5 体外消化过程中从不同油乳液中释放出的单个游离脂肪酸
2.5.1 椰油乳液消化前后的脂肪酸组成
由图6可以看出原液椰油中除辛酸甲酯外,其他脂肪酸组成与原油中脂肪酸组成无显著性差异,而辛酸甲酯只占到脂肪酸组成的6.62%,占比较小,说明包埋对椰油主体成分的脂肪酸组成无影响;消化后小肠液的椰油中除亚油酸外,其他脂肪酸比例均有下降,说明椰油中其他脂肪酸的释放率要高于多不饱和脂肪酸。而多不饱和脂肪酸可能更难从椰油中的甘油三酯水解。
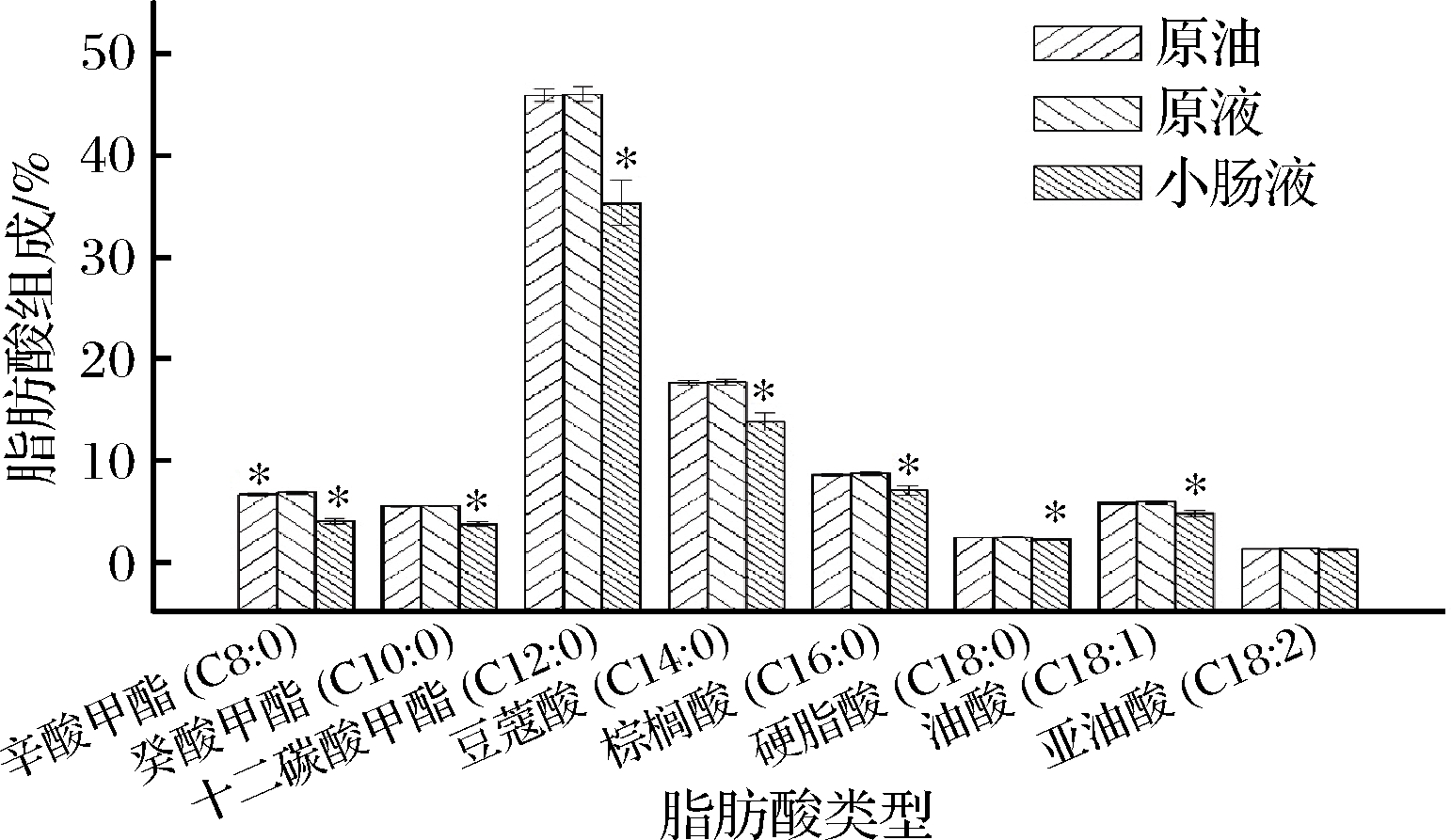
图6 椰子油及其乳液消化前后的脂肪酸组成
Fig.6 Fatty acid composition of coconut oil and its emulsion before and after digestion
注:*表示原油和小肠液中的不同脂肪酸与原液相比 有显著性差异(P<0.05)(下同)
2.5.2 紫苏籽油乳状液消化前后的脂肪酸组成
如图7所示,原液中紫苏籽油的棕榈酸、油酸、亚油酸和亚麻酸的组成与原油中脂肪酸组成无显著性差异,说明包埋对紫苏籽油的脂肪酸组成无影响;消化后的小肠液中棕榈酸、油酸和亚油酸的比例下降,亚麻酸的比例相对增加,说明包埋后紫苏籽油中的棕榈油、油酸和亚油酸的体外消化量较亚麻酸的多,其他脂肪酸的释放率要高于多不饱和脂肪酸。综合分析这可能表明多不饱和脂肪酸可能更难从紫苏籽油中的甘油三酯水解。
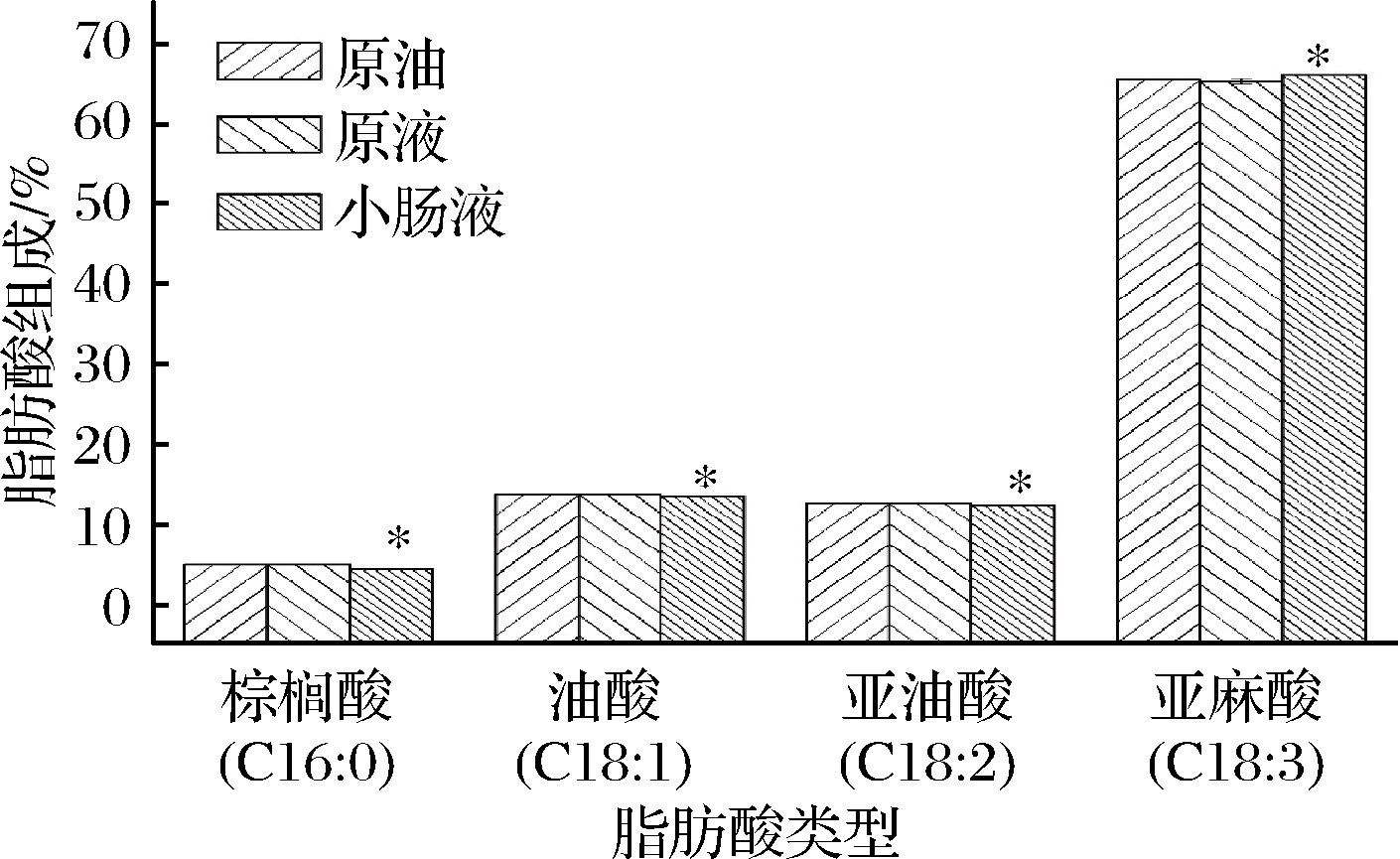
图7 紫苏籽油及其乳液消化前后的脂肪酸组成
Fig.7 Fatty acid composition of perilla seed oil and its emulsion before and after digestion
2.5.3 橄榄油乳液消化前后的脂肪酸组成
如图8所示,原液橄榄油中除棕榈酸和亚油酸外,其他脂肪酸组成与原油中脂肪酸组成无显著性差异,而这2种占总脂肪酸组成的13.45%,占比较小,说明包埋对橄榄油主体成分的脂肪酸组成无影响;消化后小肠液的橄榄油中硬脂酸和亚麻酸的组成比例略有上升,其他脂肪酸比例不变,说明包埋后橄榄油中的硬脂酸和亚麻酸的体外消化量较其他脂肪酸低,而橄榄油中硬脂酸比例较小,这说明其他主体脂肪酸的释放率要高于多不饱和脂肪酸。综合分析多不饱和脂肪酸可能更难从橄榄油中的甘油三酯水解。硬脂酸释放量低可能与橄榄油中甘油三酯的结构有关。

图8 橄榄油及其乳状液消化前后的脂肪酸组成
Fig.8 Fatty acid composition of olive oil and its emulsion before and after digestion
2.5.4 棕榈油乳液消化前后的脂肪酸组成
如图9所示,原液棕榈油中棕榈酸和油酸的脂肪酸组成与原油中脂肪酸组成相比有不同程度的下降,而这2种脂肪酸占总脂肪酸组成的78.86%,占比高,说明包埋使棕榈油主体成分的脂肪酸组成比例下降;消化后,小肠液的棕榈油中除豆蔻酸外,其他脂肪酸比例均有不同程度的下降,说明包埋后棕榈油中的脂肪酸均有一定的释放。

图9 棕榈油及其乳状液消化前后的脂肪酸组成
Fig.9 Fatty acid composition of palm oil and its emulsion before and after digestion
2.5.5 稻米油乳液消化前后的脂肪酸组成
如图10所示,原液稻米油中棕榈酸、油酸和亚油酸组成与原油中脂肪酸组成相比有不同程度的下降,说明包埋使稻米油主体成分的脂肪酸组成比例构成一定的破坏;消化后,小肠液的稻米油中豆蔻酸和硬脂酸的组成比例略有上升,其他脂肪酸比例不变,说明包埋后稻米油中的豆蔻酸和硬脂酸的体外消化率较其他脂肪酸低。这可能与稻米油中甘油三酯的结构有关[24-25]。
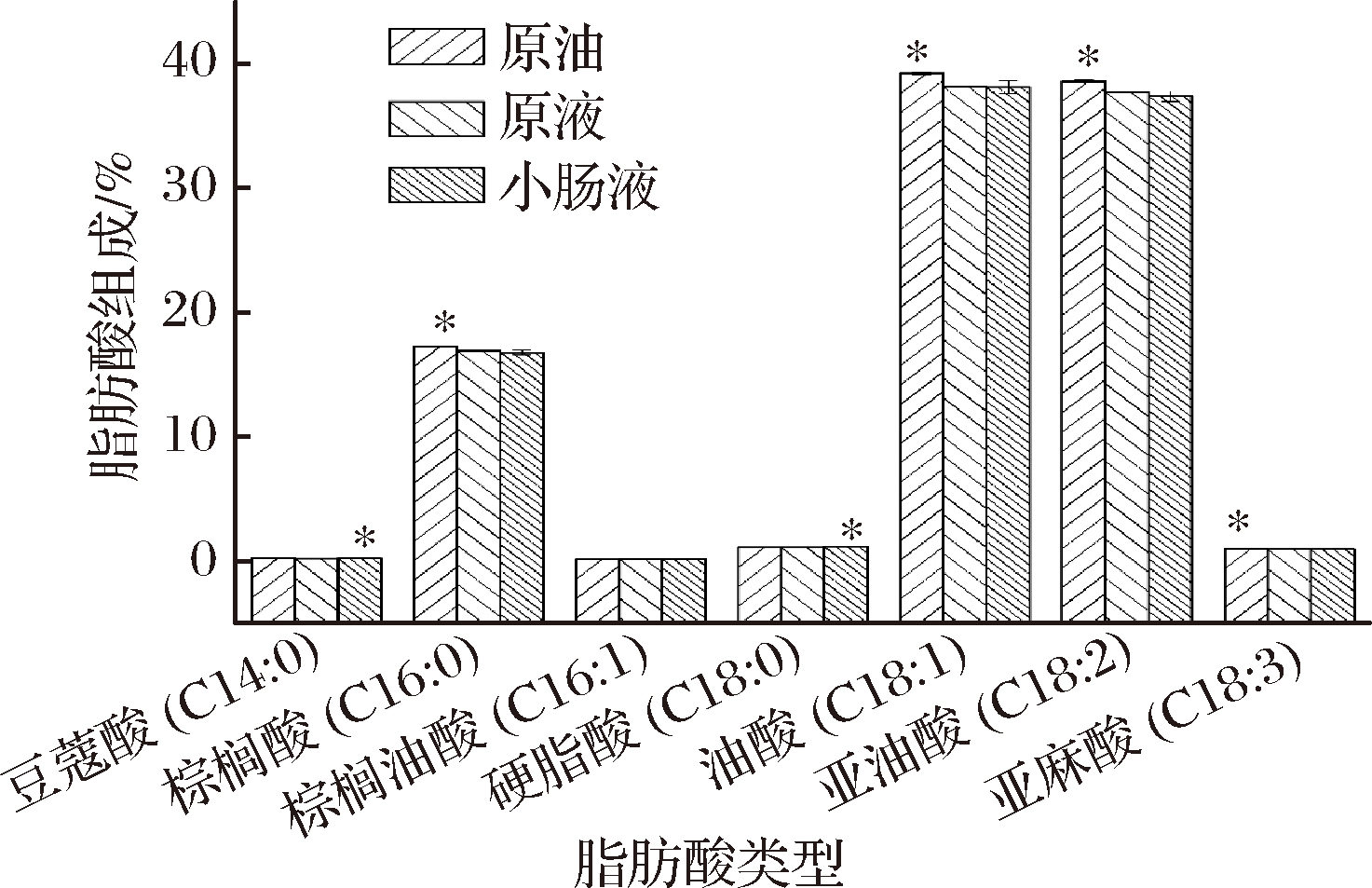
图10 稻米油及其乳状液消化前后的脂肪酸组成
Fig.10 Fatty acid composition of rice oil and its emulsion before and after digestion
3 结论
本实验的主要目的是探究不同酶浓度、加样量、含油量对椰油乳液体外消化过程中游离脂肪酸释放率的影响以及不同油类型对乳液体外消化过程中游离脂肪酸释放率及脂肪酸组成的影响。体外模拟消化结果表明,在口腔和胃阶段,WPI-CMC稳定的椰油乳液的脂肪酸释放率整体偏低,不随酶浓度(0.15~1.5 mg/mL)加样量和含油量的增加而变化;在小肠阶段,胰酶的浓度越高,乳液脂肪酸释放速率越快,而最终游离脂肪酸的释放率也越高;随加样量的增加乳状液的脂肪酸释放率反而减小,随油含量的增加乳液的黏弹性越好,流动性变差,脂肪酸释放率减少。乳液脂肪酸的最大释放水平顺序依次降低,椰油>橄榄油>棕榈油=稻米油>紫苏籽油;主要含长链甘油三酸酯的脂肪消化速率比中链甘油三酸酯慢,主要含长链多不饱和脂肪酸的脂肪消化速率比长链单不饱和脂肪酸慢;包埋对椰油、紫苏籽油和橄榄油主体成分的脂肪酸组成无影响,但使棕榈油主体成分的脂肪酸组成比例下降,对稻米油主体成分的脂肪酸组成比例构成一定的破坏;椰油、紫苏籽油和橄榄油中其他脂肪酸的释放速率要高于多不饱和脂肪酸。综上,本研究具有一定的现实意义,这为以后不同油在乳液体系的应用研究奠定了基础,为减肥人士的饮食指导提供了理论依据。
[1] HU M, LI Y, DECKER E A, et al. Role of calcium and calcium-binding agents on the lipase digestibility of emulsified lipids using an in vitro digestion model [J]. Food Hydrocolloids, 2010,24(8): 719-725.
[2] MALDONADO-VALDERRAMA J, WILDE P, MACIERZANKA A, et al. The role of bile salts in digestion [J]. Advances in Colloid & Interface Science, 2011,165(1): 36-46.
[3] MARZE S, ALGABA H, MARQUIS M. A microfluidic device to study the digestion of trapped lipid droplets [J]. Food & Function, 2014, 5(7): 1 481-1 488.
[4] HEBEBRAND J, HINNEY A. Obesity and overweight [J]. Zeitschrift für Kinder und Jugendpsychiatrie und Psychotherapie, 2009, 37(4): 237.
[5] MINEKUS M, ALMINGER M, ALVITO P, et al. A standardised staticin vitrodigestion method suitable for food-An international consensus [J]. Food Function, 2014, 5(6): 1 113-1 124.
[6] ZHANG R, ZHANG Z, ZHANG H, et al. Influence of lipid type on gastrointestinal fate of oil-in-water emulsions: In vitro digestion study [J]. Food Research International, 2015, 75:71-78.
[7] YUAN X, LIU X, MCCLEMENTS D J, et al. Enhancement of phytochemical bioaccessibility from plant-based foods using excipient emulsions: impact of lipid type on carotenoid solubilization from spinach [J]. Food & Function, 2018, 9(8): 4 352-4 365.
[8] BLIGH E G. A rapid method of total lipid extraction and purification [J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8):911-917.
[9] SINGH H, SARKAR A. Behaviour of protein-stabilised emulsions under various physiological conditions [J]. Advances in Colloid & Interface Science, 2011,165(1): 47-57.
[10] O′FALLON J V, BUSBOOM J R, NELSON M L, et al. A direct method for fatty acid methyl ester synthesis: Application to wet meat tissues, oils, and feedstuffs [J]. Journal of Animal Science, 2007, 85(6): 1 511-1 521.
[11] GB5009.168—2016 食品中脂肪酸的测定[S]. 北京:中国标准出版社,2016.
[12] BAUER E,王彦华. 脂质消化的生理规律[J]. 中国畜牧兽医, 2005,7:68.
[13] INTERTHAL H, CHEN H J, KEHL-FIE T E, et al. SCAN1 mutant Tdp1 accumulates the enzyme-DNA intermediate and causes camptothecin hypersensitivity[J]. EMBO (European Molecular Biology Organization) Journal, 2005, 24(12):2 224-2 233.
[14] XU D, AIHEMAITI Z, CAO Y, et al. Physicochemical stability, microrheological properties and microstructure of lutein emulsions stabilized by multilayer membranes consisting of whey protein isolate, flaxseed gum and chitosan[J]. Food Chemistry, 2016, 202:156-164.
[15] KYUJEONG S, JEGON L, HYEYOON L, et al.Flocculation behavior of cellulose nanofibrils under different salt conditions and its impact on network strength and dewatering ability [J]. Cellulose, 2015,22(6): 3 689-3 700.
[16] YE Z, LI R, CAO C, et al. Fatty acid profiles of typical dietary lipids after gastrointestinal digestion and absorbtion: A combination study between in-vitro and in-vivo[J]. Food Chemistry, 2019, 280:34-44.
[17] GUO Q, YE A, BELLISSIMO N, et al. Modulating fat digestion through food structure design [J]. Progress in Lipid Research, 2017, 68:109-118.
[18] SUN J H, JOO S T, LIM B O, et al. Impact of salt and lipid type on in vitro digestion of emulsified lipids [J]. Food Chemistry, 2011,126(4): 1 559-1 564.
[19] BENITO-GALLO P, WONG J C, MARLOW M, et al. Chain length affects pancreatic lipase activity and the extent and pH-time profile of triglyceride lipolysis [J]. European Journal of Pharmaceutics & BiopHarmaceutics, 2015, 93:353-362.
[20] ZHANG R J, ZHANG Z P, ZHANG H, et al. Influence of lipid type on gastrointestinal fate of oil-in-water emulsions: In vitro digestion study [J]. Food Research International, 2015,75:71-78.
[21] WILDE P J, CHU B S. Interfacial & colloidal aspects of lipid digestion [J]. Advances in Colloid & Interface Science, 2011,165(1): 14-22.
[22] CARLIER H, BERNARD A,CASELLI C. Digestion and absorption of polyunsaturated fatty acids [J]. Reprod Nutr Dev, 1991,31(5): 475-500.
[23] MU Huiling, CARL-ERIK H Y. The digestion of dietary triacylglycerols [J]. Progress in Lipid Research, 2004, 43(2): 105-133.
[24] YE A, CUI J, ZHU X, et al. Effect of calcium on the kinetics of free fatty acid release during in vitro lipid digestion in model emulsions [J]. Food Chemistry,2013, 139(1-4): 681-688.
[25] ZHU X, YE A, VERRIER T, et al. Free fatty acid profiles of emulsified lipids during in vitro digestion with pancreatic lipase [J]. Food Chemistry, 2013,139(1-4): 398-404.