丁二胺,又称腐胺,是原核和真核生物中常见的二元胺之一[1-2],具有重要的工业价值[3],被广泛用作生物塑料(如尼龙46)、药物、杀菌剂、表面活性剂等产品的原材料[4-7]。截止2006年,欧洲丁二胺的年产量约为10 000 t,市场价值超过1 600欧元/t[8-9],预计未来仍将高速增长[10]。目前,工业上丁二胺的合成主要依靠化学方法[10],虽然工艺成熟,但使用了不可再生的石油资源,不符合可持续发展的要求,且催化剂价格昂贵,反应条件相对苛刻。因此,丁二胺的生物合成得到了广泛关注[10-13]。
目的产物的定量测定是开展生物合成研究的基础。由于缺乏紫外吸收和荧光发色基团,直接利用高效液相色谱法(high performance liquid chromatography,HPLC)检测二胺类物质较为困难[14],因此需要衍生化试剂,如丹磺酰氯进行柱前衍生。然而,发酵液中除丁二胺外,还存在蛋白质、氨基酸、多肽以及小分子胺等多种含有氨基的物质,均能与丹磺酰氯发生反应(图1),从而对丁二胺的定量检测产生干扰。
本研究建立了一种基于校准曲线的检测方法,成功地对大肠杆菌发酵液中丁二胺的含量进行了定量测定,为后续生产菌株的性能评价及丁二胺的生物合成奠定了基础。
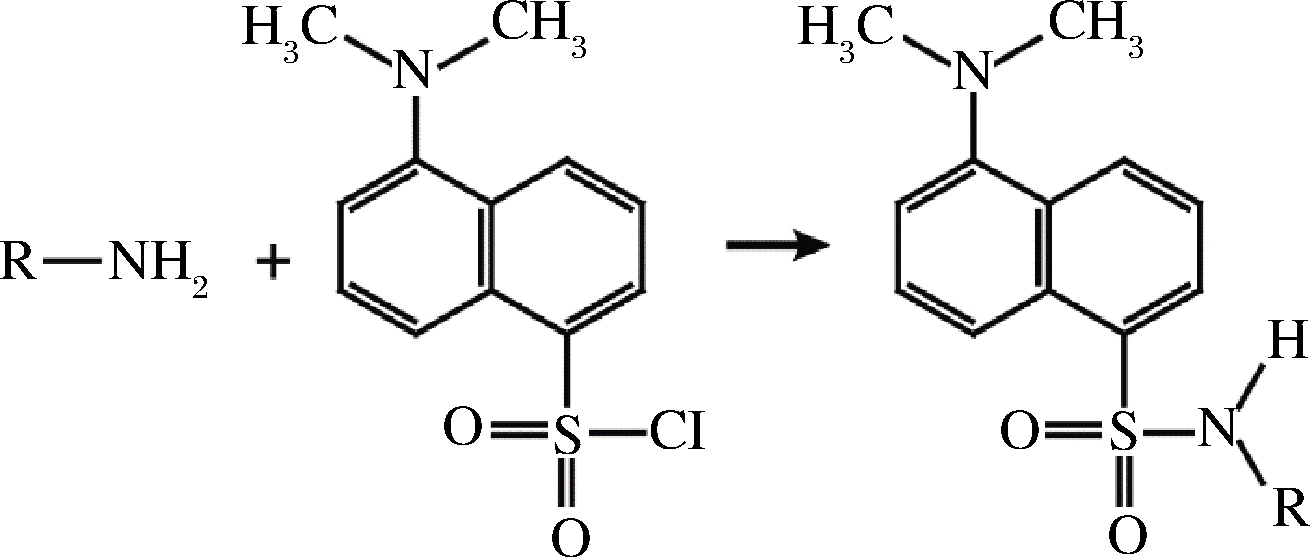
图1 丹磺酰氯与含氨基物质的衍生化反应过程
Fig.1 The reaction of dansyl chloride with substances containing amino-group
1 材料与方法
1.1 菌株与培养
大肠杆菌MG1655、大肠杆菌BL21(DE3),均为本实验室保藏。丁二胺生产菌的发酵实验在添加了4 g/L葡萄糖的肉汤(super optimal broth,SOB)培养基中进行。SOB培养基(g/L):酵母粉5.0,蛋白胨20.0,KCl 0.186,NaCl 0.5,MgCl2·7H2O 2.03。菌株在37 ℃,200 r/min条件下培养。
1.2 主要试剂
丁二胺盐酸盐(putrescine, PUT)标准品、1,7-庚二胺(1,7-diaminoheptane, HEP),Sigma Aldrich;内标物1,6-己二胺盐酸盐(1,6-diaminohexane, HEX)、高效液相色谱级乙腈,麦克林;衍生化试剂丹磺酰氯,阿拉丁。
1.3 仪器与设备
高效液相色谱体系采用安捷伦1260 Infinity Ⅱ,配备安捷伦1260 VWD检测器(G7114A)、安捷伦1260进样器(G7129A)以及安捷伦1260泵(G7111A)。样品使用安捷伦porpshell 120EC-C18柱(4.6 mm×150 mm,粒径4 μm)进行分离。
液相质谱分析采用Waters-MALDI-SYNAPT Q-TOF MS,联用Waters-Acquity-HPLC色谱仪和PDA检测器(200~500 nm)。样品在BEH C18柱(2.1 mm×150 mm,粒径1.7 μm)上于45 ℃条件下进行分离,流动相A和B分别为乙腈(体积分数为100%)和甲酸(体积分数为0.1%)。流速为0.3 mL/min,梯度洗脱程序等参数见参考文献[15]。
1.4 实验方法
1.4.1 二元胺标准品及发酵液的衍生化
二元胺标准品母液(PUT、HEX和HEP)质量浓度为10 g/L,使用时稀释。丹磺酰氯衍生二元胺的操作如下[16]:在500 μL的二元胺标准品或待测样品中加入等体积饱和NaHCO3溶液,使用饱和NaOH调节pH值至10,加入足量溶解于丙酮的衍生化试剂丹磺酰氯并混合均匀,60 ℃避光水浴30 min后使用2 mL无水乙醚萃取10 min,收集上层有机相,萃取操作重复2次。混合2次收集到的萃取物,N2吹干除去乙醚后将衍生物溶解于500 μL乙腈溶液中,0.22 μm滤膜过滤后HPLC检测。上述待测样品由发酵液样品12 000 r/min离心10 min后取500 μL上清液并添加5 μL HEX(10 g/L,终浓度为100 mg/L)和5 μL HEP(10 g/L,终浓度为100 mg/L)后得到。
1.4.2 二元胺衍生物的高效液相色谱分析
在C18柱上进行二元胺丹磺酰氯衍生物的高效液相色谱分离,温度为30 ℃,紫外检测波长为254 nm,进样量为10 μL,流动相A为超纯水,流动相B为高效液相色谱级乙腈,流动相均经0.22 μm滤膜过滤后使用。梯度洗脱程序设置为0~4 min,55%~70%B;4~6.7 min,70%B;6.7~12 min,70%~95%B;12~12.6 min,95%B;12.6~13.5 min,95%~55%B;13.5~16 min,55%B,总流速0.7 mL/min。
1.4.3 校准曲线的绘制
将SOB培养基中酵母粉的质量浓度分别设置为5、10、15、20、25、30、35、40 g/L,模拟不同时期发酵液中干扰物质含量的动态变化。在含5 g/L酵母粉的SOB培养基中,分别加入25、50、100、150、200 mg/L PUT与固定质量浓度的内标物HEP(100 mg/L)。经衍生化反应后,利用高效液相色谱法测定上述体系中PUT和HEP的峰面积。随后,将上述操作在含有10、15、20、25、30、35、40 g/L酵母粉的SOB培养基体系中重复进行。相似地,用HEX代替HEP作为内标,重复进行实验。
2 结果与分析
2.1 模拟发酵液体系中二元胺标准品的测定
由于缺乏紫外吸收和荧光发色基团,难以直接使用紫外或荧光检测器检测二元胺,因此本研究中选择丹磺酰氯[17-18]作为衍生化试剂进行实验。丁二胺衍生物和内标衍生物在超纯水体系中的分离效果如图2所示。结果表明,所有被测二元胺均能通过梯度洗脱程序完全分离。PUT(峰1)、HEX(峰2)和HEP(峰3)的保留时间分别为9.11、10.63和11.44 min。

峰1-200 mg/L丁二胺的丹磺酰氯衍生物;峰2-100 mg/L 1,7-庚二胺的丹磺酰氯衍生物;峰3-100 mg/L 1,6-己二胺的丹磺酰氯衍生物 A-溶解于超纯水中;B-溶解于含有5 g/L酵母粉的SOB培养基中;C-溶解于含有40 g/L酵母粉的SOB培养基中
图2 丹磺酰氯衍生化丁二胺、1,7-庚二胺、1,6-己二胺标准品的高效液相色谱图
Fig.2 The HPLC chromatogram of PUT, HEX, HEP standards with Dansyl chloride as derivative reagent
2.2 发酵液中丁二胺检测校准曲线的构建
将200 mg/L PUT分别溶于超纯水和含5 g/L酵母粉的SOB培养基中,同时加入100 mg/L HEX和HEP作为内标物,检测后发现, HEX和HEP的峰面积分别比超纯水中减小33%和11%(图2-B)。当酵母粉的质量浓度为40 g/L时,HEX和HEP的峰面积分别比超纯水中减小57%和46%(图2-C)。结果表明,当足量衍生化试剂存在时,酵母粉中可能含有某些与二元胺结构相似的物质,对二元胺的检测产生影响,且影响作用均随酵母粉浓度的增加而增强。因此,可以利用内标物受到的干扰,指示待测物质丁二胺所受影响,消除现有检测方法的偏差。
为了探究影响规律,在含有不同浓度酵母粉(0~40 g/L)的模拟发酵液体系中加入100 mg/L HEP(或HEX)和适量的PUT(50~200 mg/L)。经丹磺酰氯衍生化后,用高效液相色谱法测定PUT和HEP(或HEX)的峰面积。结果发现,当酵母粉浓度为定值时,单位浓度内标HEP峰面积与单位浓度PUT峰面积之间的比值为定值,随酵母粉浓度的升高,上述比值逐渐减小,定义该比值为转换系数Kput-hep,绘制HEP峰面积、酵母粉浓度、Kput-hep三者间关系曲线如图3-A和3-B所示。同样地,当酵母粉浓度为定值时,单位浓度内标HEX峰面积与单位浓度PUT峰面积的比值为定值,随着酵母粉浓度的增加,上述比值逐渐减小,定义该比值为转换系数Kput-hex,绘制HEX峰面积、酵母粉浓度、Kput-hex三者间关系曲线如图3-C和3-D所示。在检测微生物发酵液样品中的丁二胺含量时,只需在样品中加入100 mg/L HEP(或HEX)作为内标,根据HEP(或HEX)峰面积,从关系曲线A和B(或关系曲线C和D)中确定该体系下的转化系数Kput-hep(或Kput-hex),利用内标峰面积对丁二胺峰面积进行校准,即得到丁二胺的实际产量,从而消除体系对丁二胺检测的干扰。
2.3 校准方法的准确性及可行性评价
在含有5 g/L酵母粉的SOB培养基中,分别添加25、50、100、150、200 mg/L丁二胺的待测样品,经内标HEP校准计算后得到对应的丁二胺含量检测值为26.22、 50.63、 99.68、 147.48、 191.82 mg/L,误差分别为4.890%、 1.254%、-0.317%、-1.677%、-4.090%。经内标HEX校正后得到的丁二胺含量检测值分别为26.40、 51.91、 96.82、 145.93、 193.07 mg/L,误差分别为5.602%、 3.813%、-3.178%、-2.717%、-3.464%。此外,在含有10、 15、 20、 25、 30、 35、 40 g/L酵母粉的SOB培养基体系中,分别重复进行实验(图4)。总体来看,校准后的丁二胺检测值与实际值之间的误差为0.004%~7.959%,回收率为92.04%~107.73%。该方法的检出限为0.03 mg/L,定量限为0.11 mg/L,可以满足发酵液中丁二胺定量检测的要求。
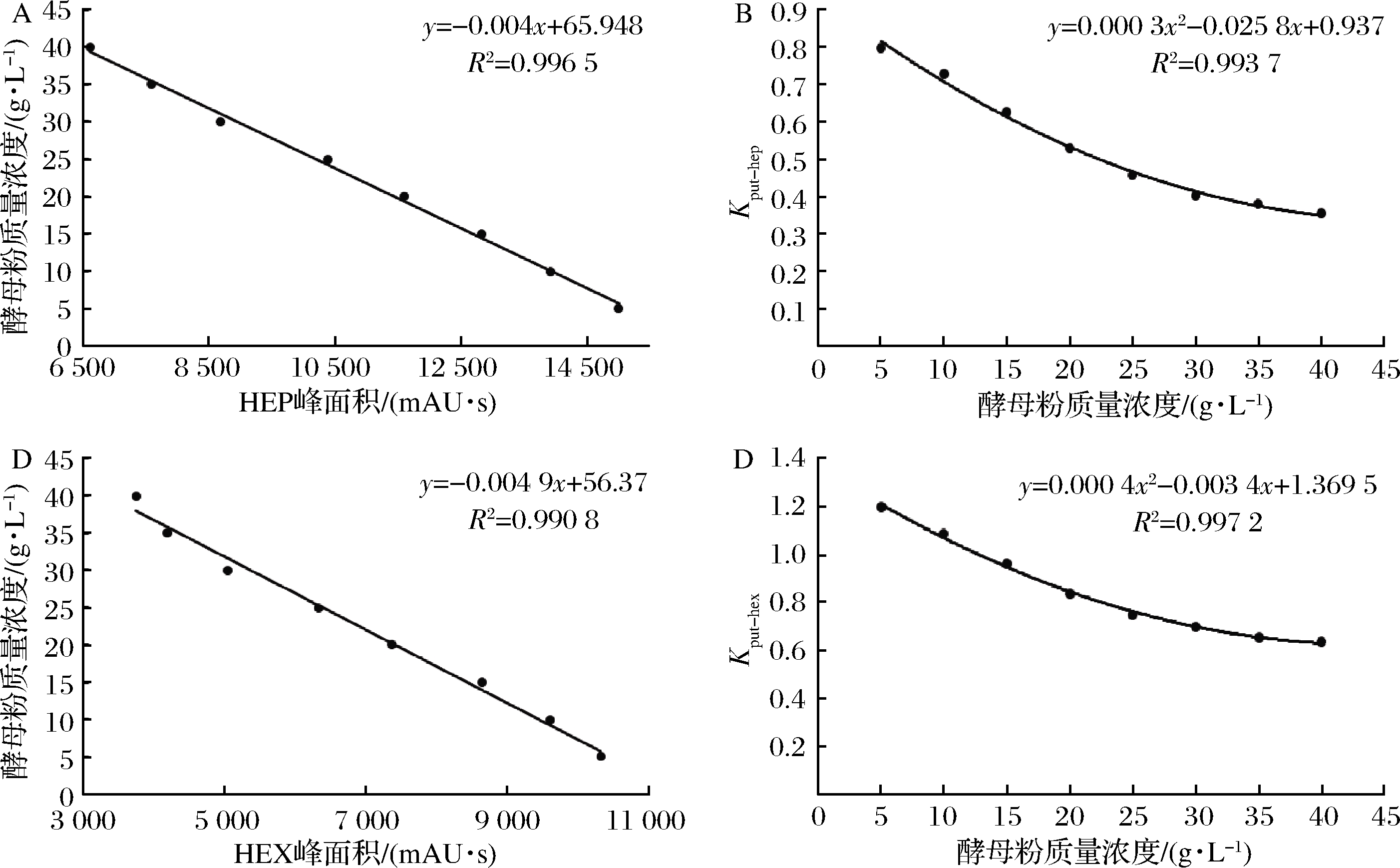
A-100 mg/L 1,7-庚二胺峰面积与酵母粉浓度的关系曲线;B-酵母粉浓度与转化系数Kput-hep的关系曲线; C-100 mg/L 1,6-己二胺峰面积与酵母粉浓度的关系曲线;D-酵母粉浓度与转化系数Kput-hex的关系曲线
图3 发酵液中丁二胺含量测定的校正关系曲线
Fig.3 The calibration cueve of the calculation method

图4 校准方法的准确性评价
Fig.4 The evaluation of the calculation method
随后,将该方法应用于生物合成丁二胺的实际检测中。选择大肠杆菌MG1655和大肠杆菌BL21(DE3)进行丁二胺发酵实验。大肠杆菌BL21(DE3)在SOB培养基中摇瓶发酵24 h可产生0.33 g/L丁二胺,而大肠杆菌MG1655在72 h内仅产生0.03 g/L丁二胺(图5),因此前者可作为出发菌株用于后续的研究。利用液质联用-四级杆-飞行时间质谱法(liquid chromatography mass spectrometry with quadrupole time-of-flight,LCMS-Q-TOF)进一步鉴定大肠杆菌BL21(DE3)的发酵液样品(图6),发现了丁二胺的2个特征碎片([M+H]+89.1和产物离子m/z 72.1)[19-20],证实大肠杆菌BL21(DE3)发酵积累的产物为丁二胺,表明上述方法成功鉴定了不同菌株的丁二胺生产能力,为进一步的研究奠定了基础。
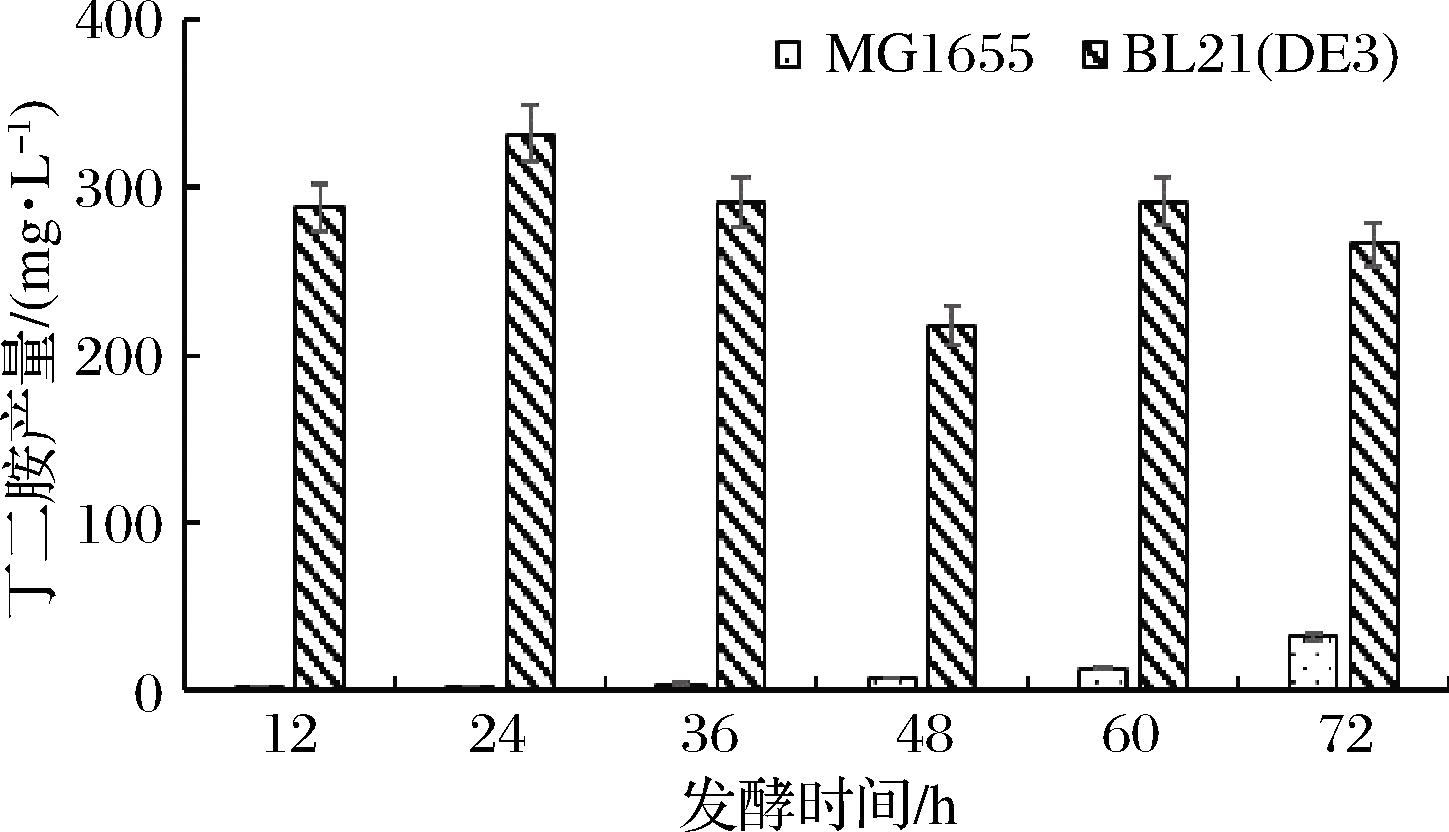
图5 大肠杆菌MG1655和BL21(DE3)在SOB培养基中 发酵产丁二胺情况
Fig.5 The production of putrescine by E. coli MG1655 and E. coli BL21(DE3) in SOB medium
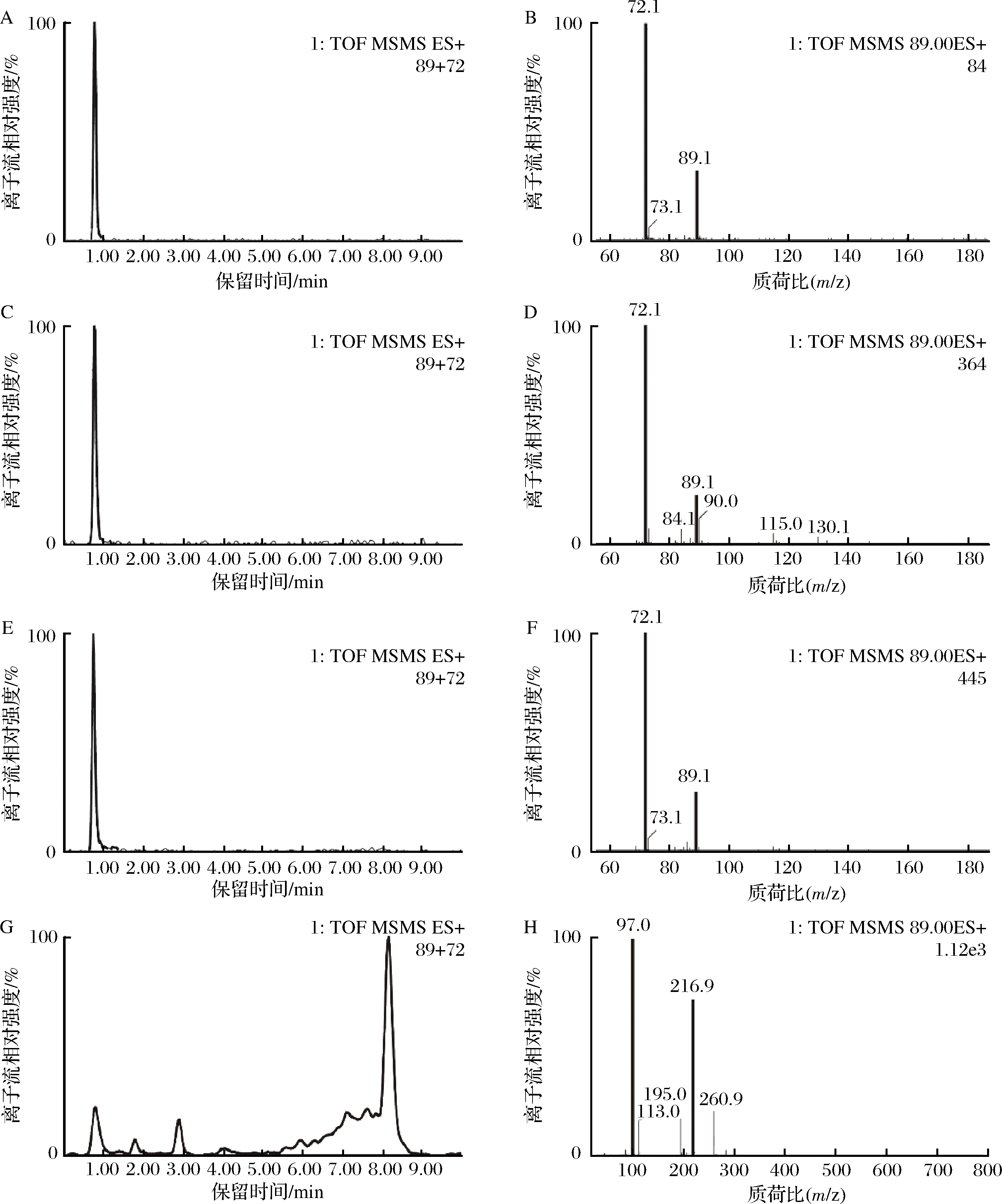
A-丁二胺溶于超纯水色谱图;B-丁二胺溶于超纯水质谱图;C-丁二胺溶于SOB培养基色谱图;D-丁二胺溶于SOB培养基质谱图; E-大肠杆菌BL21(DE3)在SOB培养基中产丁二胺色谱图;F-大肠杆菌BL21(DE3)在SOB培养基中产丁二胺质谱图; G-空白SOB培养基色谱图;H-空白SOB培养基质谱图
图6 丁二胺的LC-MS定性检测(前体离子[M+H]+89.1和产物离子m/z 72.1)
Fig.6 Qualitative determination of putrescine by LC-MS
3 结论
本研究提供了一种定量测定发酵液体系中丁二胺含量的方法,在传统丹磺酰氯柱前衍生HPLC检测丁二胺方法的基础上进行了改进,采用内标与校准曲线相结合,对高效液相色谱法检测出的丁二胺含量进行校准,消除了干扰成分的影响。该方法适用于丁二胺生物合成过程中产物的定量分析,可用于指导丁二胺生产菌株的筛选和构建。此外,该方法也可应用于复杂体系中多种二元胺的含量测定。
[1] HAMANA K, MATSUZAKI S. Polyamines as a chemotaxonomic marker in bacterial systematics[J]. Critical Reviews in Microbiology, 1992, 18(4): 261-283.
[2] TABOR C W, TABOR H. Polyamines in microorganisms[J]. Microbiological Reviews, 1985, 49(1): 81-99.
[3] SCHNEIDER J, WENDISCH V F. Biotechnological production of polyamines by bacteria: Recent achievements and future perspectives[J]. Applied Microbiology and Biotechnology, 2011, 91(1): 17-30.
[4] CHAE T U, AHN J H, KO Y S, et al. Metabolic engineering for the production of dicarboxylic acids and diamines[J]. Metabolic Engineering, 2020, 58(3):2-16.
[5] WENDISCH V F, MINDT M, PÉREZ-GARC A F. Biotechnological production of mono- and diamines using bacteria: Recent progress, applications, and perspectives[J]. Applied Microbiology and Biotechnology, 2018, 102(8): 3 583-3 594.
A F. Biotechnological production of mono- and diamines using bacteria: Recent progress, applications, and perspectives[J]. Applied Microbiology and Biotechnology, 2018, 102(8): 3 583-3 594.
[6] KUDO K, MOCHIZUKI M, KIRIYAMA S, et al. Studies on the structure and properties of nylon 46 fiber. I. Dimensional stability[J]. Journal of Applied Polymer Science, 1994, 52(7): 861-867.
[7] YAMANOBE T, KURIHARA Y, UEHARA H, et al. Structure and characterization of nylon 46[J]. Journal of Molecular Structure, 2007, 829(1): 80-87.
[8] LEE J W, KIM H U, CHOI S, et al. Microbial production of building block chemicals and polymers[J]. Current Opinion in Biotechnology, 2011, 22(6): 758-767.
[9] SCOTT E L, PETER F, SANDERS J. Biomass in the manufacture of industrial products—the use of proteins and amino acids[J]. Applied Microbiology and Biotechnology, 2007, 75(4): 751-762.
[10] QIAN Zhigang, XIA Xiaoxia, LEE Sangyang. Metabolic engineering of Escherichia coli for the production of putrescine: A four carbon diamine[J]. Biotechnology and Bioengineering, 2009, 104(4): 651-662.
[11] TSUGE Y, KAWAGUCHI H, SASAKI K, et al. Engineering cell factories for producing building block chemicals for bio-polymer synthesis[J]. Microbial Cell Factories, 2016, 15(1): 19-30.
[12] MEISWINKEL T M, RITTMANN D, LINDNER S N, et al. Crude glycerol-based production of amino acids and putrescine by Corynebacterium glutamicum[J]. Bioresource Technology, 2013, 145(4): 254-258.
[13] CHUNG H, YANG J E, HA J Y, et al. Bio-based production of monomers and polymers by metabolically engineered microorganisms[J]. Current Opinion in Biotechnology, 2015, 36(24): 73-84.
[14] ÖNAL A. A review: Current analytical methods for the determination of biogenic amines in foods[J]. Food Chemistry, 2007, 103(4): 1 475-1 486.
[15] ZHAO Mei, HUANG Dixuan, ZHANG Xiaojuan, et al. Metabolic engineering of Escherichia coli for producing adipic acid through the reverse adipate-degradation pathway[J]. Metabolic Engineering, 2018, 47(5): 254-262.
[16] WANG Xinna, LIANG Yawei, WANG Yaqi, et al. Simultaneous determination of 10 kinds of biogenic amines in rat plasma using high-performance liquid chromatography coupled with fluorescence detection[J]. Biomedical Chromatography, 2018, 32(2): e4 211.
[17] MOLINS L C, CAMPINS F P, SEVILLANO C A, et al. Urine polyamines determination using dansyl chloride derivatization in solid-phase extraction cartridges and HPLC[J]. Analyst, 1999, 124(4): 477-482.
[18] LOUKOU Z, ZOTOU A. Determination of biogenic amines as dansyl derivatives in alcoholic beverages by high-performance liquid chromatography with fluorimetric detection and characterization of the dansylated amines by liquid chromatography atmospheric pressure chemical ionization mass spectrometry[J]. Journal of Chromatography A, 2003, 996(1-2): 103-113.
![]() IVANOVA-PETROPULOS V, STEFOVA M. Ultra-performance liquid chromatography-triple quadruple mass spectrometry (UPLC-TQ/MS) for evaluation of biogenic amines in wine[J]. Food Analytical Methods, 2017, 10(12): 4 038-4 048.
IVANOVA-PETROPULOS V, STEFOVA M. Ultra-performance liquid chromatography-triple quadruple mass spectrometry (UPLC-TQ/MS) for evaluation of biogenic amines in wine[J]. Food Analytical Methods, 2017, 10(12): 4 038-4 048.
[20] SAGRATINI G, FERN NDEZ-FRANZ
NDEZ-FRANZ N M, DE BERARDINIS F, et al. Simultaneous determination of eight underivatised biogenic amines in fish by solid phase extraction and liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2012, 132(1): 537-543.
N M, DE BERARDINIS F, et al. Simultaneous determination of eight underivatised biogenic amines in fish by solid phase extraction and liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2012, 132(1): 537-543.