中国是世界第一大苹果生产国,种植广泛,品种丰富。将苹果进行深加工,既能提高苹果的附加值,也可以满足当代快节奏生活的需要。苹果加工制品包括苹果汁、干、醋、酱、罐头等,其中苹果汁是世界上第二大果汁产品,是苹果加工的主要方向。苹果汁可分为清汁与浊汁两大类,近年来,苹果浊汁因其新鲜天然、营养价值高、风味良好、方便安全而备受关注,市场占有率不断上升[1]。浊汁体系稳定性不佳是限制浊汁加工产业发展的关键因素,研究表明,果胶多酚、蛋白质是引起浊汁浑浊的主要成分,而引起浑浊的主要影响因素为酸度、离子强度与带电性质、温度及酶[2]。目前关于浊汁体系稳定性的研究主要集中在加工方式[3]、添加稳定剂[4]、探究大分子之间相互作用机理[5]等方面,鲜少有苹果自身内源因素影响稳定性的研究报道。
果胶是一种广泛存在于植物细胞壁的复杂多糖,由D-吡喃半乳糖通过α-1,4-糖苷键连接成长链,具有良好的增稠性及稳定性[6]。在浊汁体系中,果胶为相互作用的颗粒提供了保护涂层,从而保证了果汁中颗粒的稳定性[3]。苹果中富含有机酸,在新鲜果蔬直接榨汁过程中,有机酸作为一种内源因子,不可避免的会影响体系微环境(如pH、离子强度)或与体系内物质反应[7-8]。品种、成熟度、产地不同的苹果原料之间存在明显差异,会对苹果浊汁的酸度有较大影响[1]。而浊汁中有机酸的存在可能会对果胶结构产生影响,结构变化将进而影响黏度的变化[9],最终对体系的稳定性产生影响。
因此本研究模拟浊汁体系,选择苹果中含量较高的3种有机酸(苹果酸、柠檬酸、酒石酸)并根据在不同品种中的含量确定浓度梯度[10]。旨在探究有机酸作为内源因子对与苹果果胶组成的复合体系的结构、理化特性及稳定性的影响。研究结果将为改善苹果混浊果汁产品原料选取,提高产品稳定性提供理论依据。
1 材料与方法
1.1 材料与试剂
苹果果胶(APA系列103,酯化度65%,分子质量为160 kDa),烟台安得利果胶股份有限公司;苹果酸、酒石酸,上海源叶生物科技有限公司;柠檬酸,成都市科龙化工试剂厂;其他试剂均为分析纯。
1.2 仪器与设备
UV-2450紫外分光光度计,日本岛津公司;Spectrun100傅里叶红外光谱仪,美国PerkinElmer公司;ZEN3690马尔文激光粒度分析仪,英国马尔文仪器公司;MCR302流变仪,奥地利安东帕公司;SYNERGYH1MG全波长酶标仪,美国基因公司;Phenom Pro扫描电镜,荷兰Phenom Pro公司;TGA550热重分析仪,美国TA公司;LC-20A高效液相色谱仪,日本岛津公司。
1.3 试验方法
1.3.1 样品制备
将苹果果胶(pectin,PT)、苹果酸(malic acid,MA)、柠檬酸(citric acid,CA)、酒石酸(tartaric acid,TA)在环境温度下分别于超纯水中分散2 h后,将PT溶液分别与不同有机酸溶液混合再分散2 h。得到PT质量浓度为5 g/L,有机酸浓度依次为0.31、3.15、6.29、18.88、37.76 mmol/L的混合体系(混合体系按照浓度增加顺序以A~E依次编码)。5 g/L PT溶液作为对照。样品制备后部分存放于-40 ℃冰箱中,部分使用真空冷冻干燥为粉末保存,待用。
1.3.2 pH的测定
复合膜液pH采用85-2A pH计进行测量,每个样品平行测量3次,取平均值。
1.3.3 紫外光谱的测定
移取3 mL待测样品于石英比色皿中,以超纯水作为参比,于室温(25 ℃)检测样品在200~660 nm的紫外吸收光谱。
1.3.4 傅里叶变换红外光谱测定
精确称取6 mg冻干样品与300 mg KBr于玛瑙研钵中混合研磨,取研磨后样品3份(每份75 mg)置于45 ℃烘箱中烘干2 h后进行压片测量。以KBr为背景进行扫描,400~4 000 cm-1扫描范围,扫描分辨率4 cm-1,累计扫描32次。
1.3.5 单糖组成测定
最高浓度有机酸与PT复合体系在水中透析(8 kDa~14 kDa)8 h后冻干得到样品,参考王文俊[11]的方法并略有修改。
样品的酸水解:精确称取2 mg样品于安瓿瓶中,加入2 mL 4 mol/L三氟乙酸,酒精喷灯封管,110 ℃烘箱酸解3 h后冷却至室温,使用氮吹仪吹干。加少量水溶解,用0.1 mol/L NaOH调节pH至中性后定容至1 mL。
衍生物的制备:分别精确称取甘露糖(Man)、鼠李糖(Rha)、半乳糖醛酸(GalA)、半乳糖(Gal)、木糖(Xyl)、阿拉伯糖(Ara)、岩藻糖(Fuc),等摩尔混合得到浓度为2 mmol/L的7种标准单糖混合溶液。分别精确吸取1 mL上述水解待用样品及400 μL混标,加入50 μL 0.02 mol/L乳糖溶液作为内标,接着加入450 μL 0.3 mol/L NaOH及450 μL 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮溶液,漩涡振荡,充分混匀。70 ℃水浴反应30 min,冰水浴冷却10 min。再加入450 μL 0.3 mol/L HCL,1 mL氯仿进行萃取,涡旋5 min,离心(10 000 r/min,5 min)。反复萃取3次,最后一次水层过0.45 μm水系滤膜。
高效液相色谱分析条件:Thermo BDS-C18柱(250 mm×4.6 mm,5 μm),柱温40 ℃;二极管阵列检测器,检测波长250 nm。进样体积:20 μL。流动相:A相为15%(体积分数)乙腈+0.05 mol/L KH2PO4-NaOH缓冲溶液;B相为40%(体积分数)乙腈+0.05 mol/L KH2PO4-NaOH缓冲溶液;进行阶段连续梯度洗脱。洗脱时间阶段为0 min~10 min~40 min~50 min~57 min;洗脱液中B相对应时间梯度的浓度变化为0%~10%~30%~0%~0%;洗脱流速为0.7 mL/min。
1.3.6 扫描电子显微镜测定
冷冻干燥后的样品放置于粘台后进行喷金处理,在加速电压10 kV下观察样品的微观结构。
1.3.7 流变特性测定
采用药匙舀取样品,样品周围涂抹硅油以防止水分蒸发。选定锥板,型号为cp60-1(60 mm,1°);扫描温度25 ℃;流动曲线测量模式;剪切速率变化,0.1~100 s-1。测试完毕后对数据进行数学公式拟合,成功应用于Power Law方程:
σ=KPL γn
(1)
式中:σ为剪切应力,Pa;KPL为稠度系数,Pa·s;γ为剪切速率,s-1;n为非牛顿指数。
1.3.8 热稳定性测定
取3 mg冻干样品平铺于石英坩埚中,在氮气环境中进行热重分析,升温速率为10 ℃/min,温度范围为30~800 ℃。系统自动采集数据。
1.3.9 粒径测定
蒸馏水作为测量背景,取1 mL待测样品放入激光粒度仪的样品池中进行粒径及分布的检测。25 ℃,633 nm下进行测量。
1.3.10 浊度测定
将所有样品置于漩涡振荡器中混合振荡均匀,取200 μL于96孔板中,在650 nm处测量吸光值,吸光值即样品的浊度。
1.3.11 浊度保留率测定
将各样品分为离心、不离心2部分,离心部分经离心机以3 500 r/min 离心15 min。取离心前后样品上清液各200 μL加入96孔板中,记录650 nm处吸光值。离心前后样品吸光度值分别为A1、A2。按照公式(2)计算浊度保留率:
浊度保留率![]()
(2)
1.4 数据处理
所有实验均重复3次,每次测试均需更换样品。利用Origin 8.1软件作图。使用SPSS 19.0软件对数据进行ANOVA差异显著性分析与t检验。
2 结果与分析
2.1 复合体系pH值
果胶是一种酸性杂多糖,分子中含有65%以上的GalA,pH值一般在3~4(1%浓度条件下)[12]。本实验所用5 g/L PT水溶液的pH为3.39。随着体系内有机酸浓度的增大,有机酸-果胶复合体系pH值显著降低,其中TA-PT E体系下降最多,pH值由3.39下降至2.12。其次是PT-CA E体系下降至2.27,PT-MA E体系pH值为2.33。不同复合体系之间pH值的差异是由不同有机酸之间的酸性强弱所致。
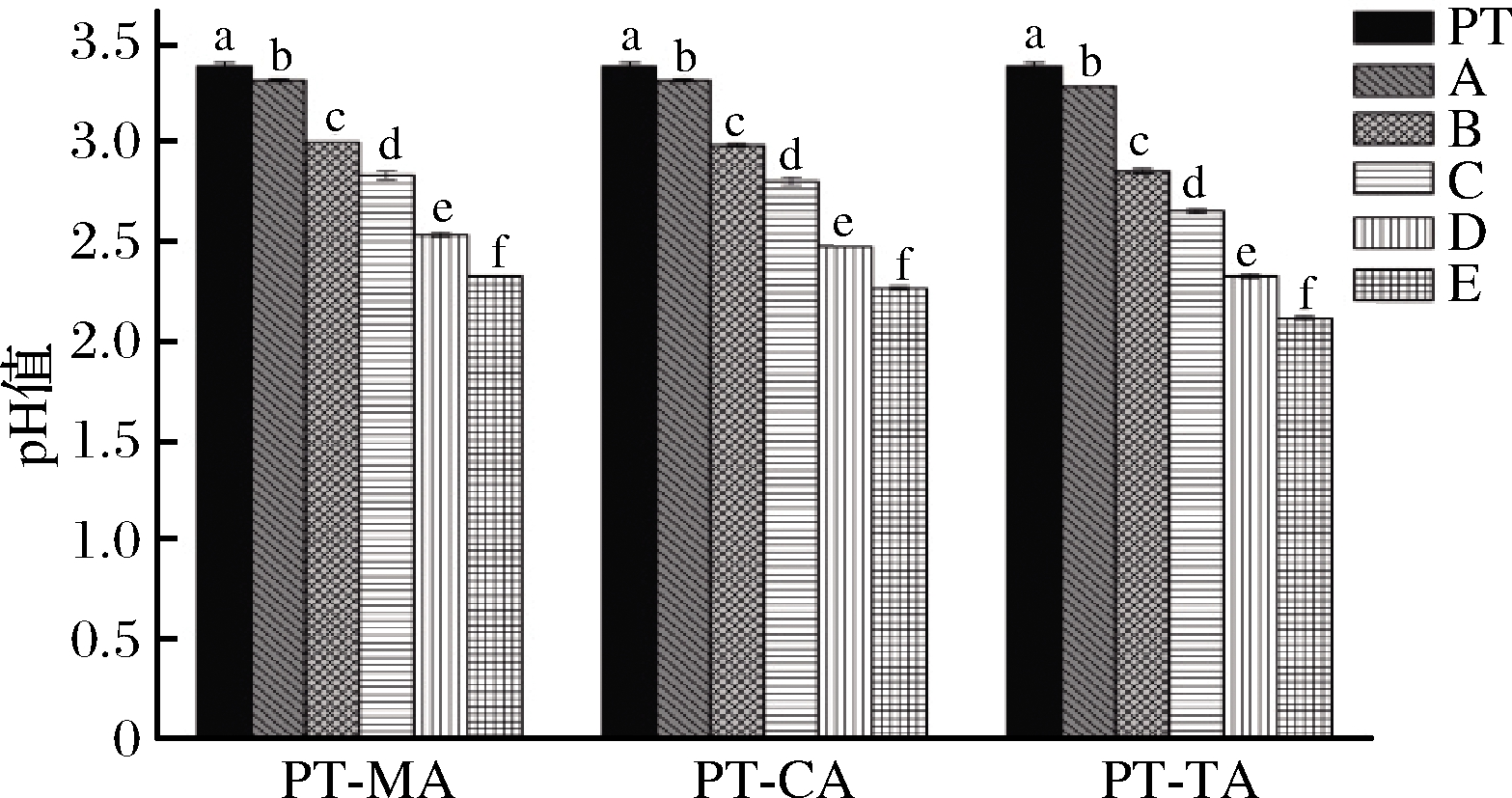
图1 不同浓度MA、CA、TA与PT复合体系pH值
Fig.1 The pH value of different concentrations of MA, CA, TA with PT composite systems
注:图中A~E表示有机酸浓度依次增加;不相同小写字母 表示差异显著(P<0.05)
2.2 紫外光谱分析
β-消除反应和酸水解是PT的2种非酶降解机理,其中β-消除反应会生成碳碳不饱和双键,在235 nm处出现吸收峰[13]。由图2可知,PT于203 nm处出现最大吸收峰,符合果胶多糖的特征吸收峰[14]。在270 nm处存在1个微小肩峰,可能是由于选取的商业PT纯度不高,存在微量杂质所致。PT特征峰吸收强度随着有机酸浓度的增加有规律地增强,对应波长处存在着不同程度的红移现象。随着MA浓度的增加,对应吸收峰从205 nm红移至215 nm;PT-CA复合体系由204 nm红移至213 nm;PT-TA复合体系则由204 nm迁移至215 nm处。这可能与体系内有机酸的引入有关。有机酸在210 nm附近处有较强吸收,且有机酸的引入会改变体系的极性,造成吸收峰的偏移[15]。图谱中并未出现新的吸收峰,表明有机酸与果胶复合过程中无不饱和键生成,果胶未发生β-消除反应。

a-PT-MA复合体系;b-PT-CA复合体系;c-PT-TA复合体系
图2 不同浓度MA、CA、TA与PT复合体系紫外光谱图
Fig.2 UV-vis spectrum of different concentrations of MA, CA, TA with PT composite systems
注:图中A~E表示有机酸浓度依次增加
2.3 红外光谱分析
傅里叶变换红外光谱常用于反映多糖的结构特征。如图3所示,样品于3 000~3 600 cm-1处出现的宽峰是由果胶分子间或分子内半乳糖醛酸O—H伸缩振动引起;2 933 cm-1处的吸收峰是果胶半乳糖醛酸甲酯或CH2基团上的C—H伸缩振动引起;1 145 cm-1处的吸收峰为C—O伸缩振动;这3处吸收峰符合多糖红外光谱图特征[16]。观察到出峰位置及吸收强度有所变化,进一步表明有机酸的加入破坏PT原有结构,影响了PT分子间或分子内的氢键作用力。1 747 cm-1处的吸收峰为酯化羧基C![]() O伸缩振动,1 622 cm-1处的吸收峰是PT未发生酯化的游离羧基的C
O伸缩振动,1 622 cm-1处的吸收峰是PT未发生酯化的游离羧基的C![]() O伸缩振动。有报道由此推导得出果胶酯化度[17]。图中样品1 747 cm-1处吸收峰明显高于1 622 cm-1处,表明各样品均为高酯果胶,符合本实验所用苹果果胶的基本性质。
O伸缩振动。有报道由此推导得出果胶酯化度[17]。图中样品1 747 cm-1处吸收峰明显高于1 622 cm-1处,表明各样品均为高酯果胶,符合本实验所用苹果果胶的基本性质。
在800~1 300 cm-1处为指纹区,反映出样品独有的特征。1 015~1 106 cm-1的吸收峰表明样品中含有呋喃糖和吡喃糖;961 cm-1处的吸收谱带表示半乳糖含量;921 cm-1处为D-吡喃葡萄糖基的吸收响应;833 cm-1是α-D-吡喃甘露糖的吸收[18]。不同有机酸作用下,对应的糖吸收峰发生了强度及位置的移动,表明有机酸使体系中的糖含量发生变化,可能是有机酸引起了PT降解,脱去了部分侧链上的中性糖[19]。由红外光谱可知,PT与MA、CA、TA均发生了相互作用,其中O—H、C—H、C![]() O、C—O等键发生变化,有机酸的引入并未改变复合体系中基团的类型,但是其含量可能发生了变化,果胶可能发生了酸水解。
O、C—O等键发生变化,有机酸的引入并未改变复合体系中基团的类型,但是其含量可能发生了变化,果胶可能发生了酸水解。
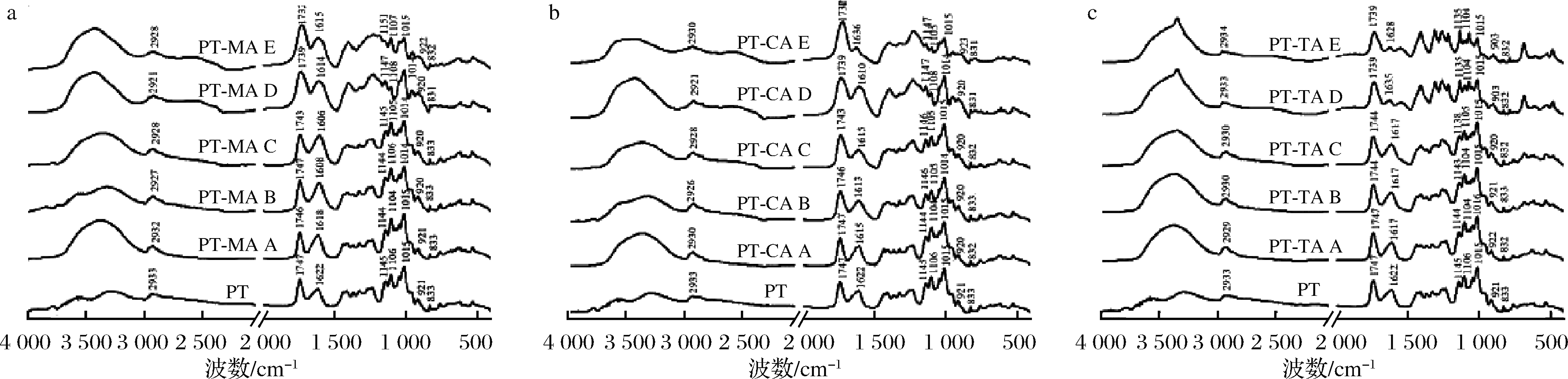
a-PT-MA复合体系;b-PT-CA复合体系;c-PT-TA复合体系
图3 不同浓度MA、CA、TA与PT复合体系红外光谱图
Fig.3 The Fourier transform infrared spectrum of different concentrations of MA, CA, TA with PT composite systems
注:图中A~E分别表示有机酸浓度依次增加
2.4 单糖组成分析
果胶主要由GalA的线性链组成,偶尔会被L-Rha打断,同时还含有其他中性糖侧链。果胶分子主要由半乳糖醛酸聚糖(HG),鼠李半乳糖醛酸聚糖I型(RG-I),鼠李半乳糖醛酸聚糖II型(RG-II)型,木糖半乳糖醛酸聚糖(XGA)4种结构域单元组成[20]。由红外光谱可知,有机酸对PT的单糖含量产生一定影响。选取本实验中各有机酸最高浓度复合体系进行单糖组成分析,结果如表1所示。
表1 MA、CA、TA对PT单糖组成的影响
Table 1 Effects of MA, CA, TA on the monosaccharide composition of PT
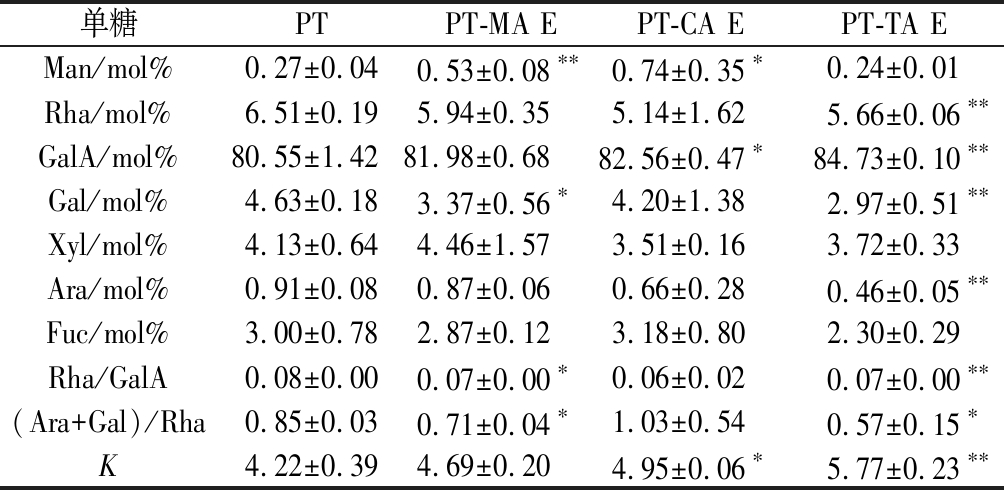
单糖PTPT-MA EPT-CA EPT-TA EMan/mol%0.27±0.040.53±0.08∗∗0.74±0.35∗0.24±0.01Rha/mol%6.51±0.195.94±0.355.14±1.625.66±0.06∗∗GalA/mol%80.55±1.4281.98±0.6882.56±0.47∗84.73±0.10∗∗Gal/mol%4.63±0.183.37±0.56∗4.20±1.382.97±0.51∗∗Xyl/mol%4.13±0.644.46±1.573.51±0.163.72±0.33Ara/mol%0.91±0.080.87±0.060.66±0.280.46±0.05∗∗Fuc/mol%3.00±0.782.87±0.123.18±0.802.30±0.29Rha/GalA0.08±0.000.07±0.00∗0.06±0.020.07±0.00∗∗(Ara+Gal)/Rha0.85±0.030.71±0.04∗1.03±0.540.57±0.15∗K4.22±0.394.69±0.204.95±0.06∗5.77±0.23∗∗
注:K=GalA/(Fuc+Rha+Ara+Gal+Xyl);表中E代表有机酸最高浓度;*代表与PT相比有显著性差异(P<0.05);**代表极显著差异(P<0.01)
由表1可知,PT中GalA的含量最高,主要含有Rha、Gal和Xyl。MA作用后,PT中Man含量显著增加,而Gal含量显著下降,表明Gal相应的支链减少。同等浓度CA作用后, PT中Man、GalA含量显著增加。TA作用后,GalA含量上升,Rha、Gal、Ara含量下降,TA可能破坏了对应单糖之间的糖苷键。综合3种有机酸处理得出,有机酸会使PT发生水解,其中Ara、Gal、Rha较易脱去。推测在酸性条件下,Ara、Gal、Rha较不稳定,而GalA及Man的比例有所上升,推测二者在酸性条件下稳定性较高。此推测与ROUND等[21]的研究结果相似。
Rha/GalA反映了果胶RG构型对整体果胶构型的贡献程度。当果胶的比值介于0.05~1时,其分子结构主要为RG-I型。而当比值低于0.05时,则主要为HG型和RG-Ⅱ型。样品检测均位于0.05~1,为RG-I型果胶。(Ara+Gal)/Rha值可粗略估计RG-I型果胶结构的分支程度,数值越大,表明中性糖连接到RG-I型主链上的侧链越长。GalA/(Fuc+Rha+Ara+Gal+Xyl)代表了果胶链的线性度,其值越大,果胶链的线性度越高。由上表可知,37.76 mmol/L TA处理后的PT线性度增加,支链长度降低,同浓度MA及CA处理后也呈现相同趋势。
2.5 扫描电镜分析
图4为不同浓度不同有机酸与PT复合体系的扫描电镜图,从左至右有机酸浓度依次增加。由图4可以看出,冻干PT整体呈现板状结构,表面粗糙多孔,且有似蜂窝状的结构穿插其中。3种有机酸的引入对PT网络结构的影响相似。随着有机酸的加入,复合体系均难以保持PT原有的板状结构,表面由粗糙变为光滑,孔状结构消失。不同的微观结构意味着有机酸的加入打乱了原有体系内PT分子之间形成的网络结构。在PT-MA体系中,低浓度时,PT呈现细丝状,排列松散无序。随着浓度的增加,体系逐渐由丝状变为小层片状,排列逐渐紧凑致密。这些貌特征与YANG等[22]的研究相似,这可能是由于果胶发生了降解或是解团聚引起的[23]。CA、TA与PT的复合体系具有相似影响。
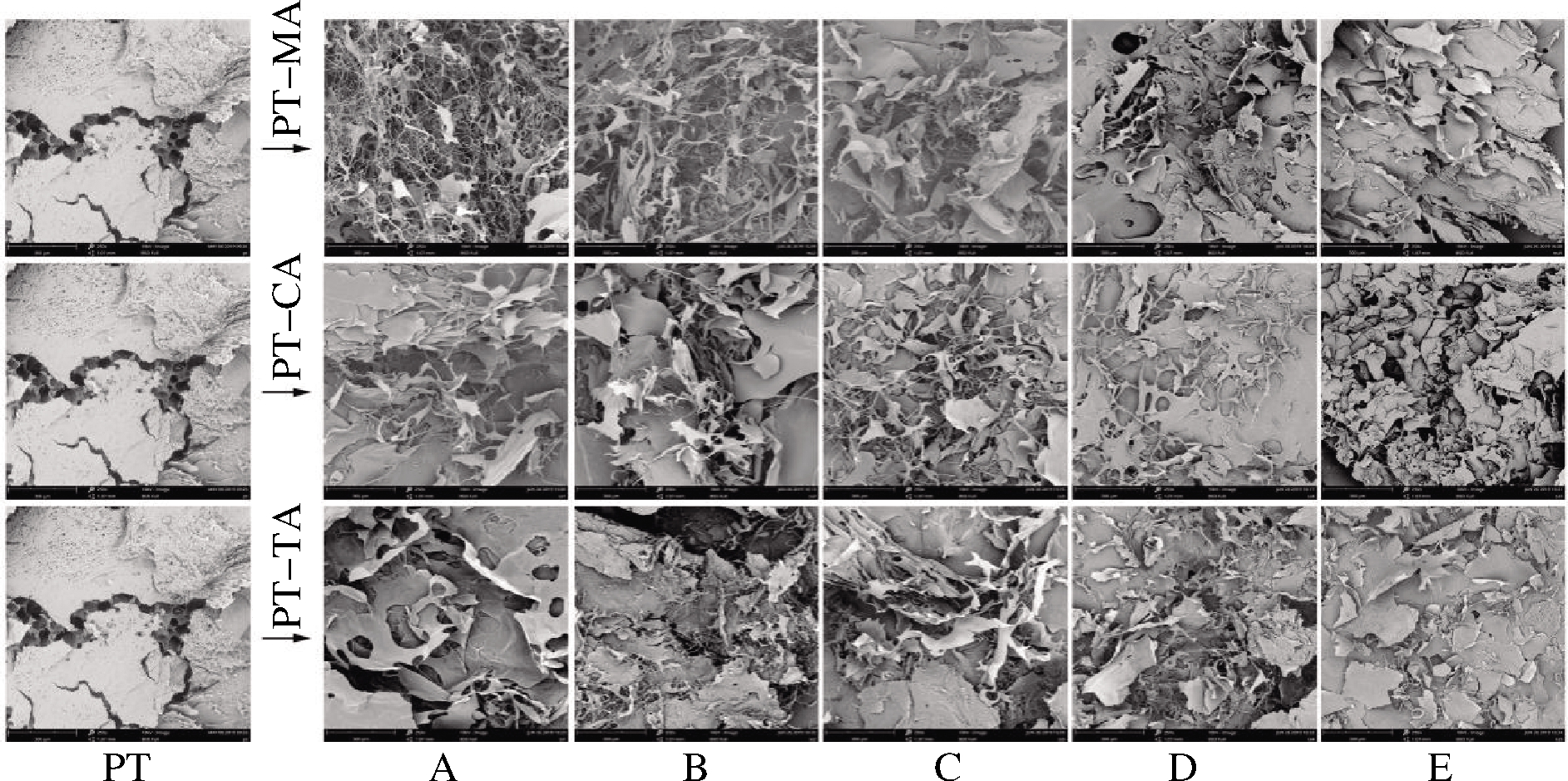
图4 不同浓度MA、CA、TA与PT复合体系的扫描电子 显微镜图
Fig.4 Scanning electron micrographs of different concentrations of MA, CA, TA with PT composite systems
注:图中A~E分别表示有机酸浓度依次增加,放大倍数250X
2.6 静态剪切分析
由图5可知,不同浓度有机酸与果胶的复合体系均表现出明显的剪切稀化现象,即随着剪切速率的增大,复合体系黏度下降。果胶是由链状分子构成的大分子聚合物,低剪切速率时,分子间互相缠结,黏度较大;当速率变大时,链状分子受到流层间剪切应力作用,分子构象破坏,发生滚动旋转收缩成团,黏度降低。在有机酸的存在下,复合体系整体黏度值均低于PT溶液,这一结果与吴剑夫[24]的研究结果相似。这可能是由于果胶水溶液自身为弱酸性,分子之间通过斥力等作用分散在水中,有机酸的加入引入H+,抑制果胶中半乳糖醛酸羧基的电离,减弱静电作用,果胶分子卷曲,黏度降低[25]。
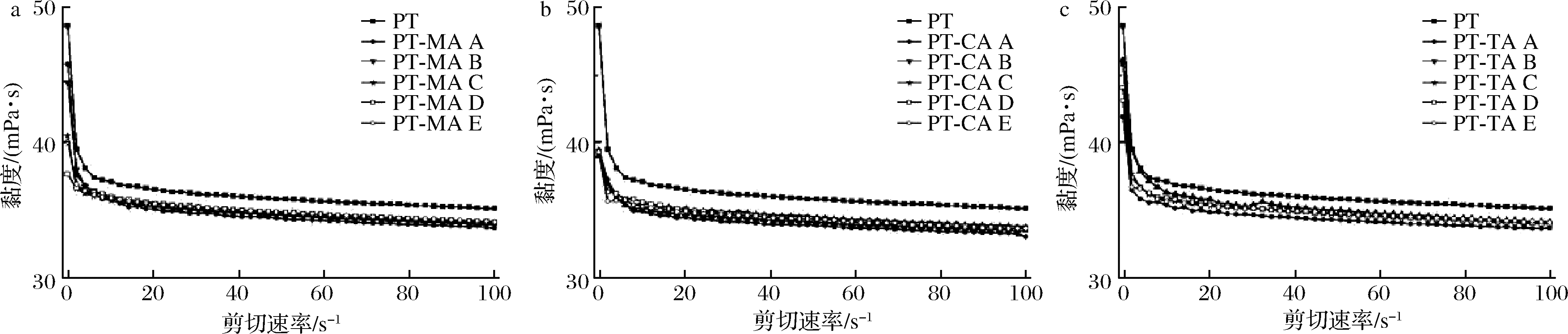
a-PT-MA复合体系;b-PT-CA复合体系;c-PT-TA复合体系
图5 不同浓度MA、CA、TA与PT复合体系表观黏度曲图
Fig.5 Apparent viscosity curve of different concentrations of MA, CA, TA with PT composite systems
注:图中A~E分别表示有机酸浓度依次增加
对各复合体系数据进行模型拟合,结果如表2所示。拟合数据的R2值均大于0.999,该模型数据拟合情况良好。其中n<1,表明所有复合体系均为假塑性流体;n值越接近1,体系越接近于牛顿流体。KPL为稠度系数,数值越高,表明体系黏度越高[26]。根据表2,随着体系内MA浓度的增大,PT-MA复合体系KPL持续下降,于18.88 mmol/L(PT-MA D)处时到达最低,n值呈现相反趋势,表明复合体系在此条件下黏度值最低,最接近于牛顿流体。随着MA浓度继续增加,其黏度有所回升但仍旧低于PT溶液,假塑性增强。PT-CA复合体系中,随着CA浓度的增大,KPL值逐渐降低,n值逐渐增大,当达到37.75 mmol/L(PT-CA E)时,体系黏度显著降低,更接近于牛顿流体。对于TA-PT复合体系,TA使得体系黏度显著降低,n值显著升高;但体系n值、KPL值与TA浓度不呈现明显的规律性。总体来说,有机酸的存在,会使得复合体系黏度降低,假塑性减弱。果胶中单糖组成的变化可能导致了黏度的下降[27],复合体系粒径下降,果胶卷曲,也会导致体系黏度降低。
2.7 热重分析
果胶的热稳定性影响着其应用范围,热重分析可反应样品的热力学特性。选取各有机酸最高浓度进行测试,结果如图6所示,其中图6-c~图6-f实线为样品的热重图像,反应物质质量随温度的变化,虚线为微分热重曲线,表明样品质量损失所经过的阶段。由图6可知,PT的质量损失可分为3个阶段。30~100 ℃为第一阶段,主要为自由水的散失,失重率为8.916%。100~200 ℃为第二阶段,主要为结合水、氢键、其他挥发性物质的损失,失重率为10.629%;主要质量损失为第三阶段,失重率为41.583%,主要是PT受热分解导致的质量快速损失,糖苷键被打断,GalA链大量热降解,然后发生二次降解,羧酸基团在糖环上发生脱羧反应,产生各种气体成分,形成固态焦物[28]。PT-MA E复合体系主要质量损失阶段失重率为49.888%。失重率较PT增加,最大失重温度下降。PT-CA E微分热重曲线表明该复合体系主要质量损失有2个阶段,第一阶段最大失重温度为184.91 ℃,失重率为39.158%,主要为CA及结合水引起[29],第二阶段,主要为PT糖苷键断裂,失重率为22.886%。PT-TA E体系主要质量损失阶段失重率为59.277%,最大失重温度为213.508 ℃。添加有机酸后,复合体系的失重率增大,热稳定性下降,可能是因有机酸加入后破坏PT网络结构,使得分子间相互作用力降低,体系网络结构疏松引起。
表2 不同浓度MA、CA、TA与PT混合体系Power Law 模型拟合参数表
Table 2 Power Law model parameters of different concentrations of MA,CA,TA with PT composite systems
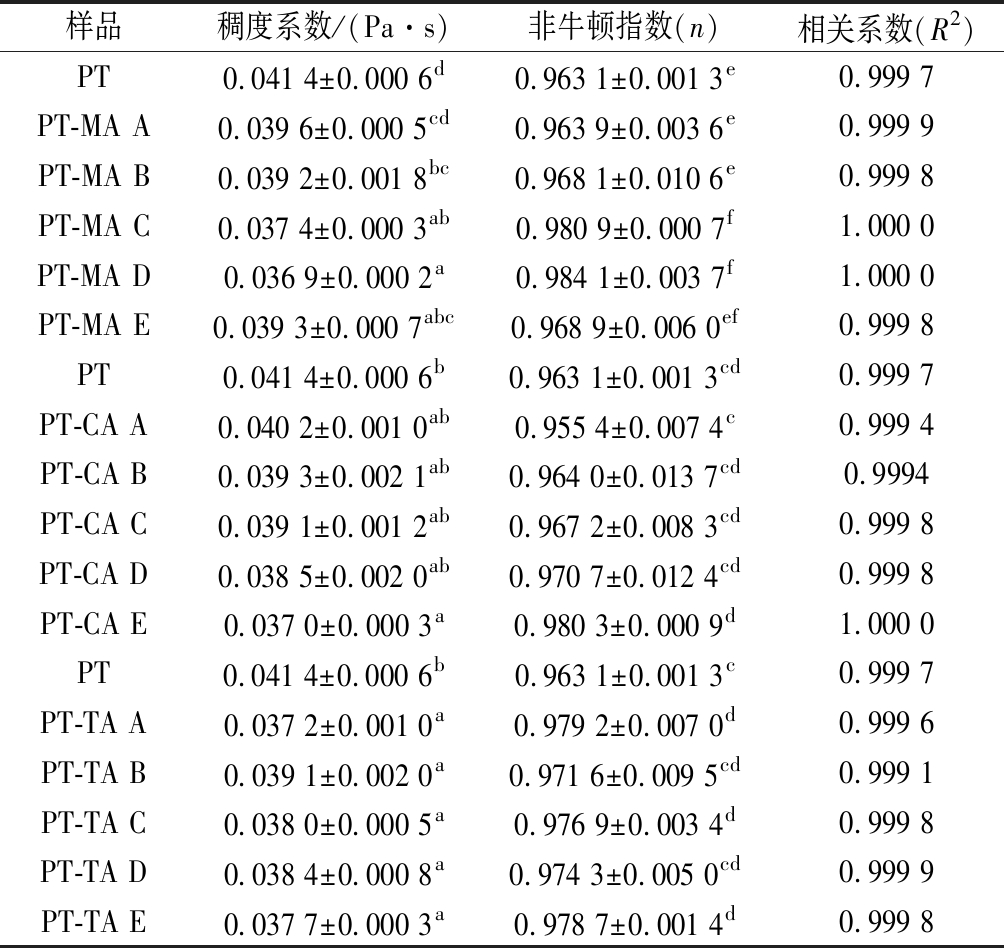
样品稠度系数/(Pa·s)非牛顿指数(n)相关系数(R2)PT0.041 4±0.000 6d0.963 1±0.001 3e0.999 7PT-MA A0.039 6±0.000 5cd0.963 9±0.003 6e0.999 9PT-MA B0.039 2±0.001 8bc0.968 1±0.010 6e0.999 8PT-MA C0.037 4±0.000 3ab0.980 9±0.000 7f1.000 0PT-MA D0.036 9±0.000 2a0.984 1±0.003 7f1.000 0PT-MA E0.039 3±0.000 7abc0.968 9±0.006 0ef0.999 8PT0.041 4±0.000 6b0.963 1±0.001 3cd0.999 7PT-CA A0.040 2±0.001 0ab0.955 4±0.007 4c0.999 4PT-CA B0.039 3±0.002 1ab0.964 0±0.013 7cd0.9994PT-CA C0.039 1±0.001 2ab0.967 2±0.008 3cd0.999 8PT-CA D0.038 5±0.002 0ab0.970 7±0.012 4cd0.999 8PT-CA E0.037 0±0.000 3a0.980 3±0.000 9d1.000 0PT0.041 4±0.000 6b0.963 1±0.001 3c0.999 7PT-TA A0.037 2±0.001 0a0.979 2±0.007 0d0.999 6PT-TA B0.039 1±0.002 0a0.971 6±0.009 5cd0.999 1PT-TA C0.038 0±0.000 5a0.976 9±0.003 4d0.999 8PT-TA D0.038 4±0.000 8a0.974 3±0.005 0cd0.999 9PT-TA E0.037 7±0.000 3a0.978 7±0.001 4d0.999 8
注:表中A~E分别表示有机酸浓度依次增加;不相同小写字母表示差异显著(P<0.05)
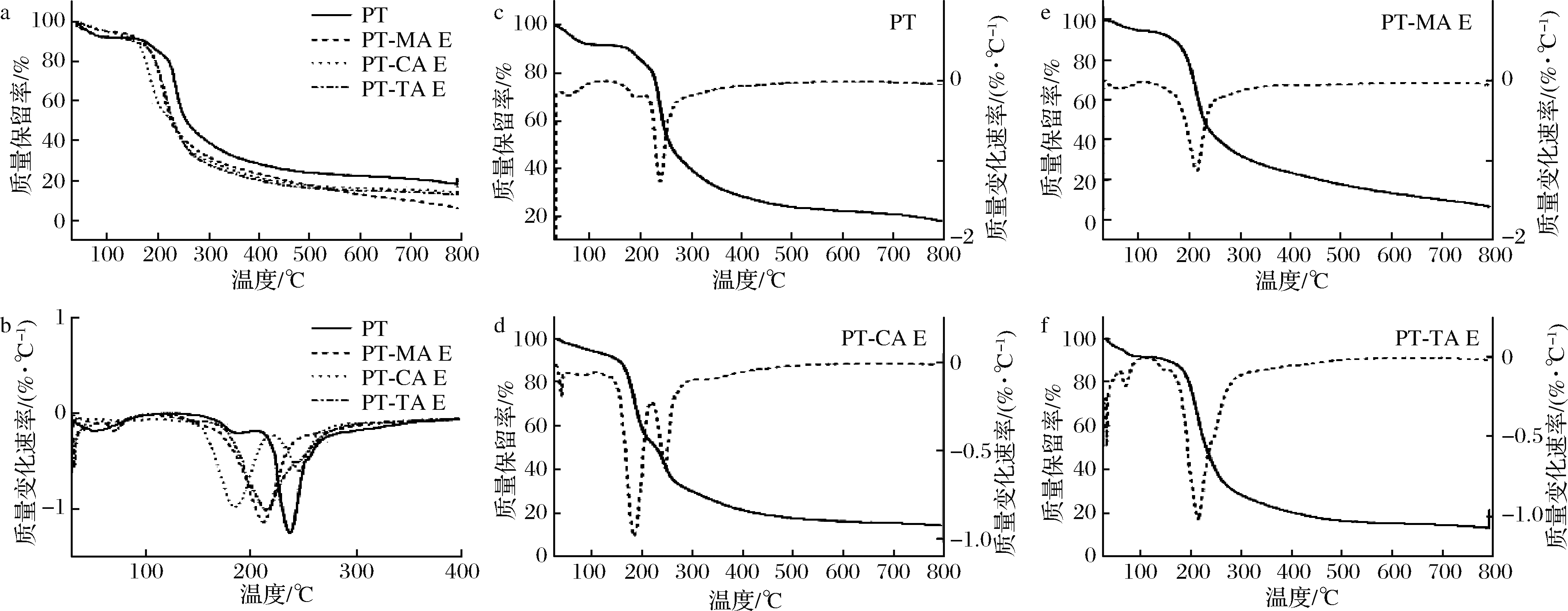
a-热重分析图;b-微分热重曲线;c~f-不同样品的热重(实线)及微分热重曲线(虚线)图
图6 MA、CA、TA与PT复合体系热重分析图
Fig.6 Thermogravimetric analysis of MA, CA, TA with PT composite systems
注:图中E代表有机酸最高浓度
2.8 粒径分析
平均粒径可以用于表示溶液中溶质颗粒的粒径大小情况,一定程度上反映聚合物在溶液中的聚集状态。苹果汁的云状颗粒稳定性通常遵循斯托克斯沉速公式,其中颗粒粒径与沉降速度成正比[30]。有机酸的加入能够明显降低体系内的粒径,且粒径随着有机酸浓度的增大而降低。可能是因为有机酸的加入引起了果胶的水解,果胶发生解团聚,或是静电作用减弱,果胶分子卷曲所致[25]。这一结果也可以解释表观黏度的降低及单糖组成的改变。
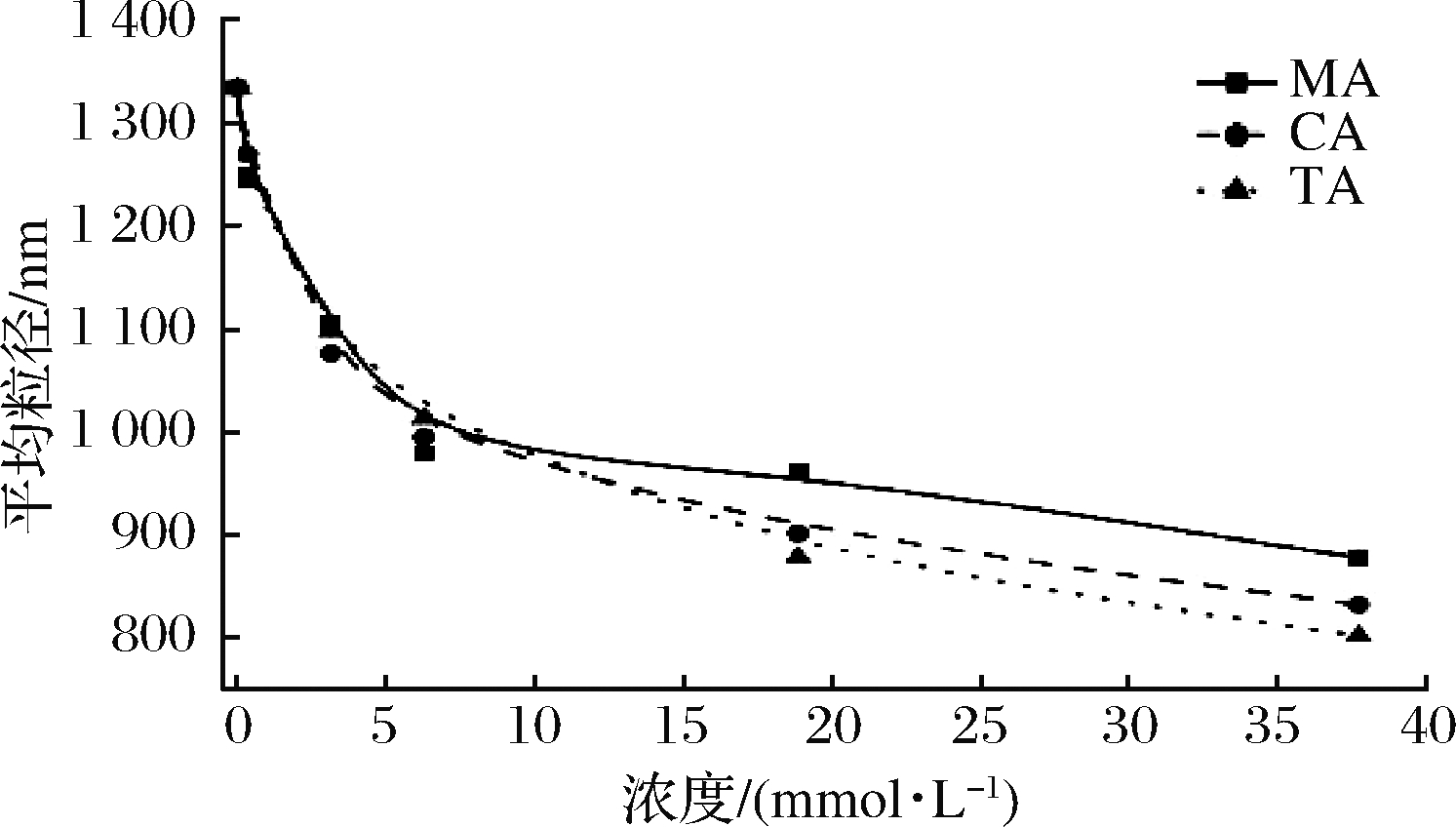
图7 不同浓度MA、CA、TA与PT复合体系粒径图
Fig.7 Particle size of different concentrations of MA, CA,TA with PT composite systems
2.9 浊度及浊度保留率分析
由2.2可知650 nm处果胶与有机酸均无吸收峰存在,因此选取650 nm为浊度测量波长。不同浓度MA、CA、TA与PT复合体系浊度及浊度保留率如表3所示。溶液的浊度可以在一定程度上反映溶液中溶质的聚集或分散情况。加入有机酸后,浊度的变化与有机酸浓度之间并不呈现规律变化。CA的加入对于体系浊度无显著影响。6.29 mmol/L MA及3.15 mmol/L TA会使得体系浑浊度增加,此时二者复合体系pH为2.84、2.86、6.29 mmol/L CA时体系pH为2.81,浊度为PT-CA体系最大值。因此推测体系浊度可能与体系pH有关,魏立威[3]的研究也得到相似结论。在pH为2.8左右时,复合体系浊度达到最大值。溶液的浑浊稳定性可简单的用溶液经离心力作用后其浊度保留率来衡量。保留率越大,表明溶液的浑浊稳定性越好。3种有机酸的加入均使得复合体系浊度保留率下降,有机酸的存在会降低PT溶液的浊度保留率,可能与体系黏度的下降有关。
表3 不同浓度MA、CA、TA与PT混合体系浊度及浊度保留率
Table 3 Turbidity and turbidity retention of different concentrations MA、CA、TA with PT composite systems
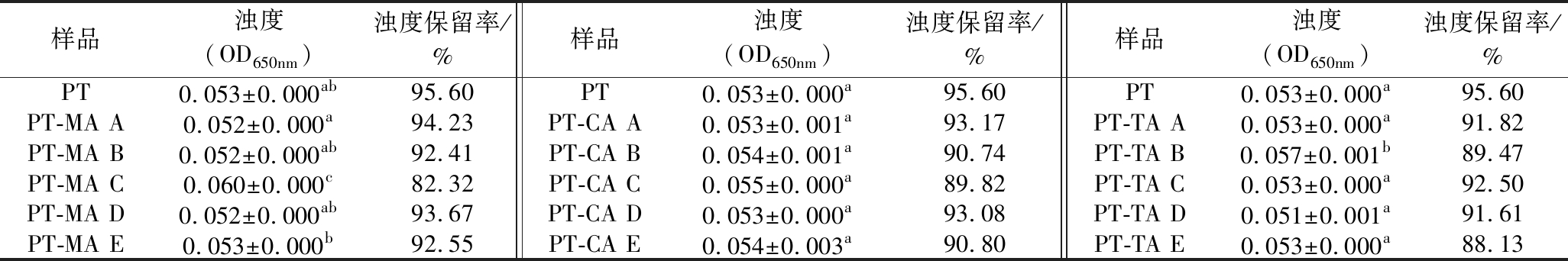
样品浊度(OD650nm)浊度保留率/%样品浊度(OD650nm)浊度保留率/%样品浊度(OD650nm)浊度保留率/%PT0.053±0.000ab95.60PT0.053±0.000a95.60PT0.053±0.000a95.60PT-MA A0.052±0.000a94.23PT-CA A0.053±0.001a93.17PT-TA A0.053±0.000a91.82PT-MA B0.052±0.000ab92.41PT-CA B0.054±0.001a90.74PT-TA B0.057±0.001b89.47PT-MA C0.060±0.000c82.32PT-CA C0.055±0.000a89.82PT-TA C0.053±0.000a92.50PT-MA D0.052±0.000ab93.67PT-CA D0.053±0.000a93.08PT-TA D0.051±0.001a91.61PT-MA E0.053±0.000b92.55PT-CA E0.054±0.003a90.80PT-TA E0.053±0.000a88.13
注:表中A~E分别表示有机酸浓度依次增加;不相同小写字母表示差异显著(P<0.05)
3 结论
通过紫外、红外光谱分析发现不同浓度3种有机酸对PT-有机酸复合体系结构均产生了一定影响,有机酸与PT相互作用并未生成新的不饱和键,PT未发生β-消除反应。在有机酸的作用下,PT发生部分水解,分子间、分子内氢键,C—H、C![]() O、C—O均参与反应。通过扫描电镜进一步发现有机酸的加入使得PT结构发生变化,由板状变为丝状或片状,表面由粗糙变为光滑,孔状结构消失。对体系黏度及稳定性研究表明,3种复合体系黏度、热稳定性、粒径、浊度保留率降低。综合对比3种有机酸,MA对于果胶的作用效果与浓度表现出一定的相关性,在低浓度时对稳定性呈现较强负效应,高浓度时负效应减弱。对于TA及CA而言,低浓度时对于体系稳定性较好。在后续研究中,可针对其他内源因子做更深入的研究,为浊汁的原料选择提供依据。
O、C—O均参与反应。通过扫描电镜进一步发现有机酸的加入使得PT结构发生变化,由板状变为丝状或片状,表面由粗糙变为光滑,孔状结构消失。对体系黏度及稳定性研究表明,3种复合体系黏度、热稳定性、粒径、浊度保留率降低。综合对比3种有机酸,MA对于果胶的作用效果与浓度表现出一定的相关性,在低浓度时对稳定性呈现较强负效应,高浓度时负效应减弱。对于TA及CA而言,低浓度时对于体系稳定性较好。在后续研究中,可针对其他内源因子做更深入的研究,为浊汁的原料选择提供依据。
[1] TIAN You, GOU Xiaoju, NIU Pengfei, et al. Multivariate data analysis of the physicochemical and phenolic properties of not from concentrate apple juices to explore the alternative cultivars in juice production[J]. Food Analytical Methods, 2018, 11(6): 1 735-1 747.
[2] 朱丹实, 任晓俊, 魏立威, 等. 苹果浊汁云状颗粒体系稳定机制研究进展[J]. 食品工业科技, 2019, 40(2): 306-311.
[3] 魏立威. 过滤及均质对苹果浊汁云状颗粒稳定性的影响[D]. 锦州: 渤海大学, 2019.
[4] 曹美霞. 红肉苹果浊汁加工贮藏研究及工艺设计[D]. 西安: 陕西师范大学, 2016.
[5] LARSEN L R, BUERSCHAPER J, SCHIEBER A, et al. Interactions of anthocyanins with pectin and pectin fragments in model solutions[J]. Journal of Agriculture and Food Chemistry, 2019, 67(33): 9 344-9 353.
[6] CHAN S Y, CHOO W S, YOUNG D J, et al. Pectin as a rheology modifier: Origin, structure, commercial production and rheology[J]. Carbohydrate Polymers, 2017, 161: 118-139.
[7] ELLERBEE L, WICKER L. Calcium and pH influence on orange juice cloud stability[J]. Journal of the Science of Food and Agriculture, 2011, 91(1): 171-177.
[8] HUANG Zhenyu, HU Huiyao, SHEN Fei, et al. Relatively high acidity is an important breeding objective for fresh juice-specific apple cultivars[J]. Scientia Horticulturae, 2018, 233: 29-37.
[9] REN Wenbo, ZHAO Shaojie, LIAN Yunhe, et al. Effects of hydrosoluble calcium ions and organic acids on citrus oil emulsions stabilized with citrus pectin[J]. Food Hydrocolloids, 2020, 100: 105 413.
[10] 郭爽, 刘璇, 毕金峰, 等. 基于品质指标的苹果浊汁品种与产地差异性分析[J]. 食品科学, 2018, 39(8): 115-122.
[11] 王文骏. 柑橘皮果胶超声辅助提取的作用机制研究[D]. 杭州: 浙江大学, 2018..
[12] 梁迪, 杨曦, 侯燕杰, 等. 苹果果胶-多酚复合膜液制备、流变特性及抗氧化性研究[J]. 食品与发酵工业, 2018, 44(8): 99-106.
[13] CHEN Jun, WU Shuangshuang, LIANG Ruihong, et al. The effect of high speed shearing on disaggregation and degradation of pectin from creeping
Fig seeds[J]. Food Chemistry, 2014, 165: 1-8.
[14] 王晓静. 火棘果中活性成分的分离及其抗油脂氧化酸败分析[D]. 吉首: 吉首大学, 2016.
[15] 黄慧敏, 张伟国. 反相高效液相色谱法测定苹果酸发酵液中的有机酸[J]. 食品与发酵工业, 2012, 38(5): 180-184.
[16] WANG Wenjun, MA Xiaobin, XU Yuting, et al. Ultrasound-assisted heating extraction of pectin from grapefruit peel: Optimization and comparison with the conventional method[J]. Food Chemistry, 2015, 178: 106-114.
[17] LIN Z, FISCHER J, WICKER L. Intermolecular binding of blueberry pectin-rich fractions and anthocyanin[J]. Food Chemistry, 2016, 194: 986-993.
[18] GAWKOWSKA D, CYBULSKA J, ZDUNEK A. Cross-linking of sodium carbonate-soluble pectins from apple by zinc ions[J]. Carbohydrate Polymers, 2018, 196: 1-7.
[19] 谢蔓莉, 叶发银, 雷琳, 等. 酸法提取条件对苹果果胶理化特性的影响及机制[J]. 食品与发酵工业, 2018, 44(4): 287-292.
[20] 易建勇, 毕金峰, 刘璇, 等. 果胶结构域精细结构研究进展[J]. 食品科学.
[21] ROUND A N, RIGBY N M, MACDOUGALL A J, et al. A new view of pectin structure revealed by acid hydrolysis and atomic force microscopy[J]. Carbohydrate Research, 2010, 345(4): 487-497.
[22] YANG Jinshu, MU Taihua, MA Mengmei. Extraction, structure, and emulsifying properties of pectin from potato pulp[J]. Food Chemistry, 2018, 244: 197-205.
[23] 俸思洁. 氨基酸修饰果胶的制备及性质研究[D]. 南昌: 南昌大学, 2016.
[24] 吴剑夫. 秋葵果胶提取工艺优化及理化特性比较研究[D]. 兰州: 甘肃农业大学, 2018.
[25] GILSENAN P M, RICHARDSON R K, MORRIS E R. Thermally reversible acid-induced gelation of low-methoxy pectin[J]. Carbohydrate Polymers, 2000, 41(4): 339-349.
[26] HOLST P S, KJ?NIKSEN A L, BU H, et al. Rheological properties of pH-induced association and gelation of pectin[J]. Polymer Bulletin, 2006, 56(2-3): 239-246.
[27] PENG Xiaoyan, MU Taihua, ZHANG Miao, et al. Effects of pH and high hydrostatic pressure on the structural and rheological properties of sugar beet pectin[J]. Food Hydrocolloids, 2016, 60: 161-169.
[28] ABURTO J, MORAN M, GALANO A, et al. Non-isothermal pyrolysis of pectin: A thermochemical and kinetic approach[J]. Journal of Analytical and Applied Pyrolysis, 2015, 112: 94-104.
[29] 崔文慧. 柠檬酸酰化改性壳聚糖及其产物结构和功能性质研究[D]. 北京: 中国农业科学院, 2016.
[30] GENOVESE D B, LOZANO J E. Effect of cloud particle characteristics on the viscosity of cloudy apple juice[J]. Journal of Food Science, 2000, 65(4): 641-645.