金鲳,学名卵形鲳鯵,是我国南方沿海重要的海产经济海水鱼之一。其体型扁圆,背部呈现金色且有坚硬的刺,并且含有多种人体所需的氨基酸和脂肪酸,营养价值较高,深受消费者喜爱。近年来金鲳养殖产量逐年增加,目前已突破15万t,曾在2013年出现严重压塘现象。其无肌间刺,是鱼糜加工的良好原材料,鱼糜和鱼糜制品的加工极大地解决了金鲳滞销、库存量较大的问题,同时缓解了鱼糜市场原材料匮乏的问题。
肌球蛋白作为肌肉中含量最高的蛋白质,也是肌肉中唯一可以单独加热就能形成凝胶的蛋白质,并且已有大量研究表明肌肉组织的凝胶性、持水性以及乳化性等均与肌球蛋白结构存在着密切的联系[1]。因此对肌球蛋白理化特性受不同加工条件影响的研究有助于指导具有良好凝胶性的鱼糜制品的加工[2]。肌球蛋白是以2个球状头部和1个棒状尾部为骨架构成的约160 nm的长型不对称结构的盐溶性蛋白[3]。单体肌球蛋白尾部主要由α-螺旋组成,加热使肌球蛋白变性分子结构展开并在蛋白质相互作用下聚合形成有序的凝胶网络结构。另外,漂洗和斩拌作为鱼糜加工的重要步骤,对蛋白质的变性、聚集也有一定的影响[4-5],并且直接影响着鱼糜凝胶性能的好坏。通常主要利用巯基、二硫键、表面疏水性以及浊度等指标来反映蛋白质在加工过程中的变性聚集情况,然而目前关于金鲳鱼糜的研究多集中在凝胶形成工艺以及冷冻鱼糜的保藏等方面[6-8]。
本研究以金鲳为原料,经过2次漂洗和斩拌,制得漂洗鱼糜和斩拌鱼糜,并分别提取鱼肉原料、漂洗鱼糜和斩拌鱼糜的肌球蛋白,同时将从斩拌鱼糜中提取的肌球蛋白分别在30、40、50、60、70以及90 ℃下加热30 min,然后测定肌球蛋白浊度、溶解度、巯基、二硫键、表面疏水性以及蛋白质结构等,来研究肌球蛋白在鱼糜加工过程中的变性聚集特性,为金鲳良好鱼糜凝胶的加工提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
大小相当的鲜活金鲳(Trachitus ovatus),于2019年5月购自于广州市海珠区华润万家超市,平均体重约300~400 g,本实验所用原料均在同一时间同一地点采购。
食盐、白砂糖(食品级),广州海珠区客村华润万家超市;乙二醇双(2-氨基乙基醚)四乙酸(EGTA)、三磷酸腺苷二钠(ATP-Na2)、5、5′-二硫代双(2-硝基苯甲酸)(DTNB)、乙二胺四乙酸(EDTA)、8-苯胺-1-萘磺酸(ANS)以及其余常见试剂均为分析纯,广州领驭生物科技有限公司;BeyoColorTM彩色预染蛋白,上海碧云天生物技术有限公司;三羟甲基氨基甲烷(Tris)(分析纯),美国Sigma公司;β-巯基乙醇、十二烷基硫酸钠(SDS)(电泳级),上海麦克林生化科技有限公司。
1.2 仪器与设备
IKA-T25组织匀浆机,德国IKA公司;HH-4快速恒温数显水浴箱,常州澳华仪器公司;Sunrise-basic吸光酶标仪,德国TECAN公司;Alpha1-4冷冻干燥机,德国Christ公司;IRAffinity-1红外光谱仪,日本岛津公司;3K30台式高速冷冻离心机,德国Sigma公司。
1.3 实验方法
1.3.1 原料制备
参考高翔等[9]制作鱼糜的方法处理原料,将购买的金鲳在0.5 h内运往实验室,并立即宰杀清洗并搅碎(鱼肉原料),然后漂洗[水洗1次、0.2%盐(质量分数)洗1次,每次4 min,肉液比1∶4,水温低于10 ℃],漂洗后挤压脱水,保持含水量为80%,得到漂洗鱼糜,然后在常压下斩拌[空斩5 min后加入食盐(质量分数1%)和白砂糖(质量分数1%)继续斩拌10 min,斩拌温度在4~10 ℃],制成斩拌鱼糜,然后分别提取原料、漂洗鱼糜、斩拌鱼糜肌球蛋白,并将斩拌鱼糜肌球蛋白调节至合适浓度,然后分别在30、40、50、60、70、90 ℃加热30 min用于后续研究。
1.3.2 肌球蛋白提取
根据PARK等[10]的方法,略作修改,整个提取过程均在10 ℃以下进行,将样品放置在4 ℃冰箱,3 d内使用。
1.3.3 浊度
参考CAO等[11],将肌球蛋白质量浓度调节至1 mg/mL,并在340 nm测定吸光值,以吸光值来表达肌球蛋白浊度大小。
1.3.4 溶解度
参考CHEN等[12],将肌球蛋白样品质量浓度调节至1 mg/mL,在4 ℃条件下,10 000×g离心10 min。蛋白质溶解度定义为上清液的蛋白质浓度除以原始肌球蛋白悬浮液的蛋白质浓度。蛋白质溶解度计算如公式(1)所示:
溶解度![]()
(1)
式中:C1,离心后蛋白质上清液质量浓度;C2,离心前(原始)肌球蛋白悬浮液的质量浓度,在本方法中,C2值为1 mg/mL。
1.3.5 总巯基和活性巯基的测定
参考WEI等[13],略作修改。
总巯基:移取0.5 mL 4 mg/mL的肌球蛋白溶液,加入4.5 mL 0.2 mol/L Tris-HCl(含8 mol/L尿素,2%SDS,10 mmol/L EDTA,pH 6.8)的缓冲液,振荡混匀,并加入0.5 mL 0.1%DTNB(0.1 g DTNB溶于100 mL 0.2 mol/L Tris-HCl,pH 8.0缓冲液)中,4 ℃避光反应1 h,于412 nm处测定吸光值。
活性巯基:移取0.5 mL 4 mg/mL的肌球蛋白溶液,加入4.5 mL 0.2 mol/L Tris-HCl不含尿素的缓冲液,振荡混匀,其余操作同上。巯基含量计算如公式(2)所示:
(2)
式中:A,412 nm处的吸光值;D,稀释倍数,本方法为11;ε,摩尔消光系数,为13 600 mol/(L·cm);C,蛋白溶液质量浓度,4 mg/mL。
1.3.6 二硫键的测定
参照文献[14],取0.5 mL 4 mg/mL的肌球蛋白溶液,向其中加入3.0 mL新配NTSB检测溶液(pH 9.5),混匀后于室温下,避光反应25 min,412 nm处测其吸光值。二硫键含量计算如公式(3)所示:
(3)
式中:A,412 nm处的吸光值;D,稀释倍数,此处为7;C,蛋白溶液质量浓度。
新配NTSB检测溶液的制备方法:用新配制的溶液(2 mol/L异硫氰酸胍,50 mmol/L甘氨酸,100 mmol/L Na2SO3,3 mmol/L EDTA,pH 9.5)以体积比1∶100稀释NTSB原液(100 mg DTNB溶于10 mL 1 mol/L的Na2SO3溶液中,调整pH为7.5,在38 ℃恒温条件下通O2反应,至溶液变为淡黄色终止反应)。
1.3.7 表面疏水性的测定
表面疏水性的测定参照CHENH等[15]方法,并略作改动,取2 mL 4 mg/mL肌球蛋白溶液并加入40 μL 1 mg/mL的溴酚蓝溶液,充分混合。空白组为2 mL肌球蛋白溶解液中直接加入40 μL 1 mg/mL溴酚蓝溶液。将样品置于室温条件下振荡10 min,然后在4 ℃条件下10 000×g离心10 min。上清液稀释10倍后在595 nm波长处测定吸光度。表面疏水性用溴酚蓝结合量来表示,表面疏水性计算如公式(4)所示:
(4)
式中:A0,表面疏水性;A1,空白组的吸光值;A2,样品组的吸光值。
1.3.8 红外光谱
参考林婉玲等[16]方法,将10 mg/mL的肌球蛋白溶液在-80 ℃冰箱中冻结4 h以上,然后置于真空冷冻干燥机中干燥得到肌球蛋白冻干样品。红外光谱的测定是将肌球蛋白冻干样品与提前干燥的无水KBr以质量比1∶100充分研磨混匀,然后压片。测定条件为分辨率4 cm-1,室温下重复扫描24次,扫描范围4 000~400 cm-1。扫描结果用Peak fit 4.12软件进行去卷积、二阶导、高斯拟合,分析蛋白质二级结构相对含量。
1.3.9 数据分析
所有数据均采用Origin 9.0和Excel 2010进行作图,实验数据用SPSS 22.0统计软件进行分析,结果用平均值±标准差表示,多组数据之间的差异用单因素ANOVA检验两两比较的Duncan’s比较模型,P<0.05表示差异显著。
2 结果与分析
2.1 不同处理条件对肌球蛋白浊度和溶解度的影响
溶解度是蛋白质变性的一个重要指标,较高的蛋白质溶解性在肉制品加工中极其重要,只有蛋白质处于高度溶解状态时肉制品才能表现出来良好的凝胶性、乳化性和保水性等功能性质[17],浊度可以反映蛋白质的聚集程度。不同处理条件对肌球蛋白浊度和溶解度的影响如图1所示。由图1可知,漂洗鱼糜相比于原料,肌球蛋白浊度显著下降,溶解度显著上升,这可能主要与漂洗造成蛋白质变性有关,而斩拌鱼糜肌球蛋白浊度从0.17增加到0.67,差异显著,表明斩拌过程中会造成更多活性巯基的暴露氧化形成二硫键,同时斩拌也会造成更多的蛋白质变性解旋,表面疏水性增加,最终在这些化学作用力的共同作用下肌球蛋白发生聚集、絮凝等变化[18],并且在斩拌过程中由于加入NaCl,有利于蛋白质的絮凝,从而溶液中悬浮颗粒直径增大,使光发生散射,浊度升高,并伴随着溶解度的显著下降。在30~90 ℃的加热过程中,肌球蛋白浊度分别为0.67、0.74、0.76、0.82、0.86和0.94,分别在40 ℃和90 ℃时,增加幅度较大,说明在这2个加热温度阶段,肌球蛋白聚集更为迅速,在40 ℃时肌球蛋白聚集能力强,形成乳胶体,而在90 ℃时,随着凝胶的形成,形成更大悬浮颗粒,导致体制浊度增大,但也有研究表明,随着温度升高,肌球蛋白浊度先增加,后由于更大悬浮颗粒的形成并在溶液中沉降,造成浊度减小[19],这可能与鱼种有关。溶解度的变化与浊度大致呈相反的趋势,冯雪平[20]研究加热温度对鲢鱼肌球蛋白理化特性的影响时也发现了类似的结果,总之温度对肌球蛋白的聚集行为影响较为复杂。

图1 肌球蛋白浊度和溶解度的变化
Fig.1 Changes in turbidity and solubility of myosin
注:同一指标不同小写字母表示差异显著(P<0.05)(下同)
2.2 不同处理条件对肌球蛋白总巯基和活性巯基的影响
巯基作为肌球蛋白中具有最高反应活性的基团,对肌球蛋白的功能特性发挥着很大的作用,是反映蛋白质变性的一个重要指标。如图2所示,在整个加工过程中,肌球蛋白总巯基含量呈持续下降趋势,总巯基含量的下降表明了活性巯基暴露氧化形成二硫键,新鲜鱼肉肌球蛋白总巯基含量在经过漂洗后从6.69 mol/100g下降到6.22 mol/100g,后经过斩拌,总巯基含量从6.22 mol/100g下降到5.69 mol/100g,2次分别减少7.0%和8.5%,无明显差异。相比斩拌鱼糜,30、40、50、60、70和90 ℃加热,总巯基含量分别下降28.21%、28.79%、30.22%、31.46%、32.86%和43.23%,总巯基含量下降程度显著大于漂洗和斩拌,表明了加热是二硫键形成的主要原因,而低于70 ℃加热时,总巯基含量下降程度显著小于90 ℃加热,这说明高温条件下,二硫键形成更多。活性巯基指暴露在蛋白分子表面的巯基,活性巯基的增加表明蛋白质结构的伸展[21]。漂洗鱼糜肌球蛋白活性巯基显著增大,表明漂洗会造成肌球蛋白变性伸展,斩拌则造成活性巯基含量下降,这证明斩拌过程中肌球蛋白有轻微聚集现象,而蛋白质聚合体的形成会掩盖活性巯基。在加热而过程中,活性巯基含量随着温度的升高先增加后减小,在50 ℃达到最大值,表明低温下,肌球蛋白趋于变性,而在更高温度下加热,肌球蛋白逐渐趋于聚集,从而活性巯基较少。由于二硫键的形成与活性巯基与总巯基含量的变化紧密相关,因此,为进一步研究在加工过程中肌球蛋白的性质,有必要对二硫键的形成进行研究。
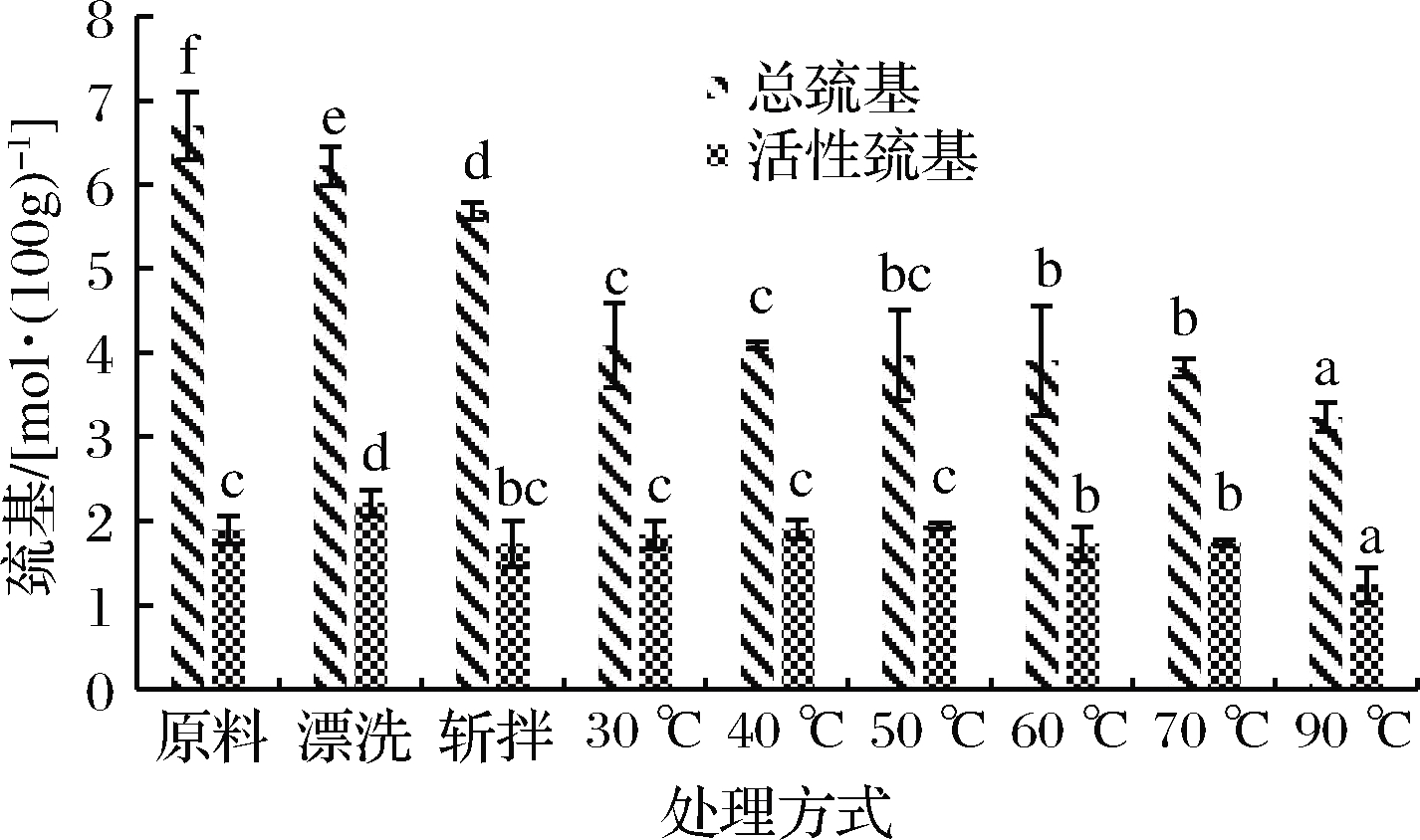
图2 肌球蛋白总巯基和活性巯基的变化
Fig.2 Changes in total and active sulfhydryl groups in myosin
2.3 不同处理条件对肌球蛋白二硫键的影响
分子间二硫键是通过相邻蛋白质肽链上具有反应活性巯基(—SH)基团的两个半胱氨酸分子的氧化形成,是蛋白质间电子共享形成的刚性化学键,一旦形成就不容易断裂,是热诱导蛋白质形成凝胶的主要化学键。二硫键的形成对蛋白质的折叠极其重要,其形成动力学直接影响着蛋白质折叠的速率和途径,并对稳定蛋白质的空间结构具有重要意义[22-23]。一般情况下,二硫键含量的变化在一定程度上反映了蛋白质结构的变化[24]。如图3所示,各种处理方式都会促进二硫键的形成,漂洗鱼糜肌球蛋白二硫键含量显著增多,这是由于含有巯基的半胱氨酸属于敏感性氨基酸,在漂洗过程中易被氧化从而使活性巯基氧化形成二硫键。李贤[25]研究表明,斩拌对蛋白质巯基含量影响较小,可能是由于暴露的巯基和包埋的巯基处于平衡状态,并且在鱼糜制作过程中,斩拌温度一般控制在10 ℃以下,不利于二硫键的形成。在本次研究中,斩拌过后,二硫键含量略有增加,这是因为在斩拌过程中空气中的氧也会造成巯基氧化形成二硫键。加热过程中,随温度升高二硫键含量增加,但高温加热是二硫键形成的主要原因。NIWA等[26]研究表明,40 ℃加热形成凝胶化鱼糜时,肌球蛋白头部巯基含量减少,形成二硫键,并对凝胶的形成有一定的作用,而WENCHING等[27]通过对罗非鱼肌肉中肌动球蛋白研究发现,在45~75 ℃,热处理产生的热诱导凝胶主要是肌球蛋白和非共价键(疏水键、非二硫共价键等)一起构成,而超过75 ℃时形成的热诱导凝胶主要归功于二硫键,这主要由于不同鱼种形成二硫键的最适温度也不同。在本实验中,70 ℃加热相比于斩拌鱼糜肌球蛋白,二硫键含量仅增加了5%,而90 ℃加热相比于斩拌鱼糜肌球蛋白,二硫键含量增加了20%,因此可以推测金鲳肌球蛋白二硫键在较高温度形成,与总巯基含量减少的趋势一致。由此可见,二硫键对肌球蛋白形成凝胶具有重要作用。
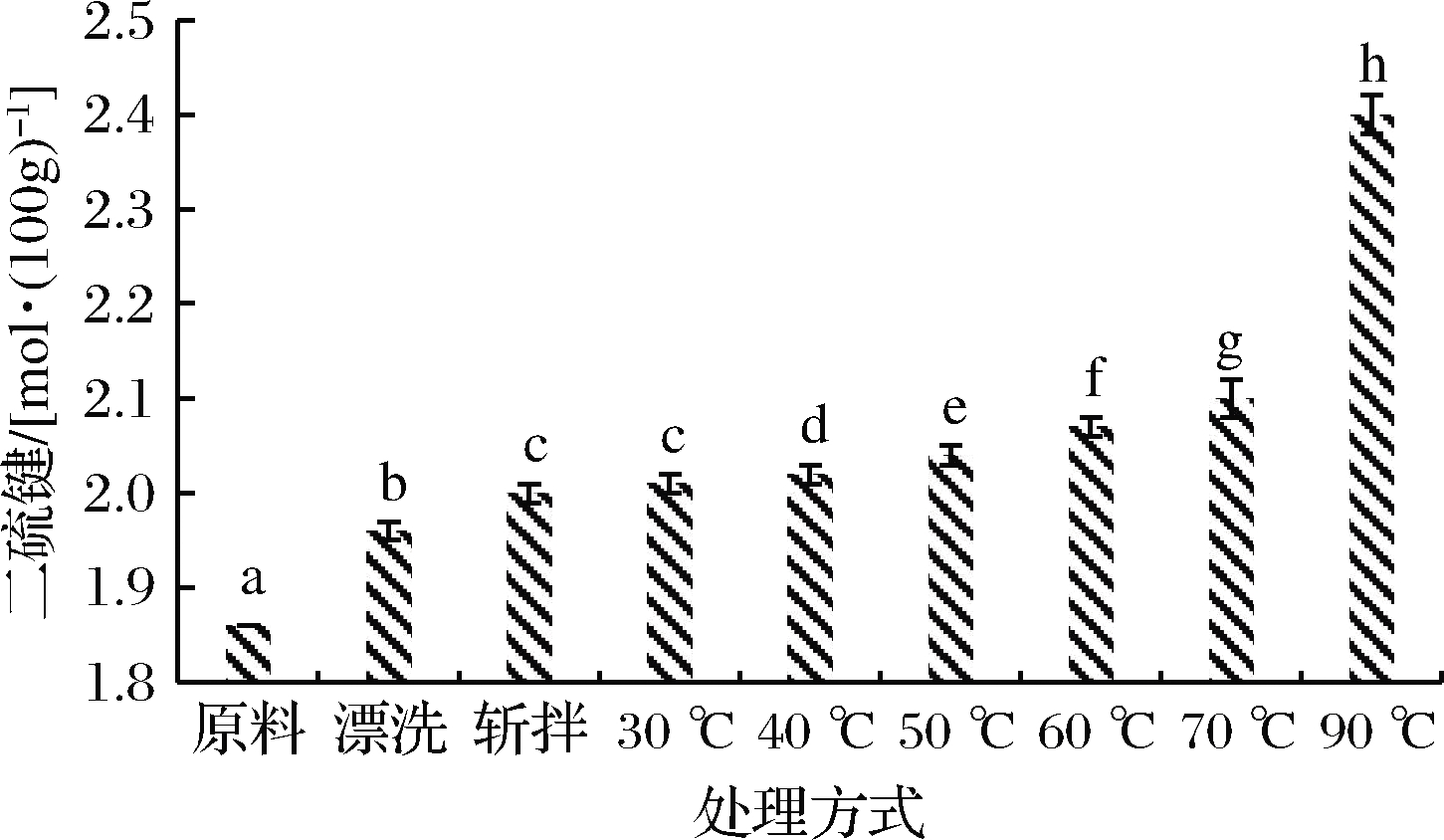
图3 肌球蛋白二硫键的变化
Fig.3 Changes in myosin disulfide bonds
2.4 不同处理条件对肌球蛋白表面疏水性的影响
蛋白质是具有复杂空间结构的生物大分子,在外界环境改变会造成空间构象的变化,从而影响表面氨基酸的分布,并进一步影响表面疏水性。表面疏水性可用来表征肌球蛋白疏水基团和极性环境的结合数目,而疏水基团与极性环境的结合数目可以用来衡量分子间相互作用的强弱[28]。如图4所示,漂洗鱼糜肌球蛋白表面疏水性显著增加(P<0.05),而经过斩拌后,鱼糜肌球蛋白表面疏水性从18.46 μg降低到14.36 μg,表明漂洗更容易造成肌球蛋白的变性,使疏水氨基酸暴露,而斩拌鱼糜肌球蛋白表面疏水性显著降低主要是由于斩拌过程中加入盐使蛋白质发生聚集。在加热过程中肌球蛋白表面疏水性先随着温度升高而缓慢增大,在60 ℃加热时急剧上升,而肌球蛋白溶解度在60 ℃急剧下降,浊度较大,可以推侧蛋白质聚集表明表面疏水性增加。而后随着温度的升高略有下降趋势,主要由于随着温度的升高,肌球蛋白疏水性侧链暴露出来,使蛋白由水溶环境转变成疏水性环境,蛋白聚合时又有少量疏水基团重新包埋于肌球蛋白内部而使表面疏水性下降。吕彤等[29]研究加热温度猪肉肌球蛋白表面疏水性的影响时,也有类似的发现,肌球蛋白表面疏水性在65 ℃左右达到最大值,然后随着温度的升高表面疏水性缓慢下降。而分布在蛋白质内部的疏水性氨基酸残基主要起稳定肌球蛋白尾部的双螺旋作用,疏水氨基酸残基的暴露会引起肌球蛋白分子的去折叠,因此为进一步研究加工过程中肌球蛋白的变性聚集规律,有必要对蛋白质结构进行研究。
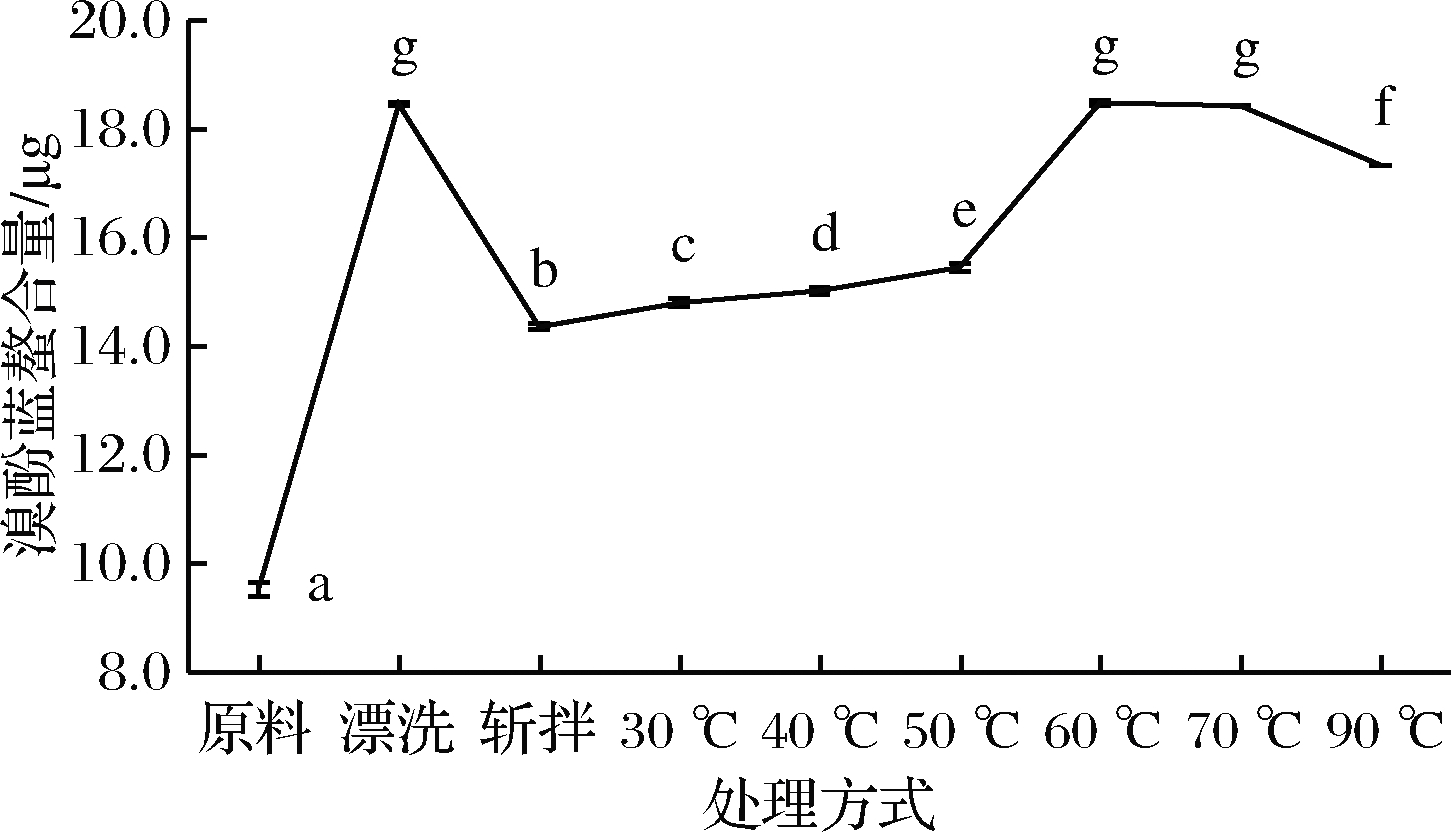
图4 肌球蛋白表面疏水性的变化
Fig.4 Changes in the surface hydrophobicity of myosin
2.5 不同处理条件肌球蛋白红外光谱测定
蛋白质在红外区有多个吸收带,不同处理条件下肌球蛋白的红外吸收峰如表1示。由表1可知,原料肌球蛋白酰胺A、酰胺B、酰胺 I、酰胺 Ⅱ和酰胺 III吸收峰的波数分别为3 304.06 cm-1、2 929.87 cm-1、1 664.57 cm-1、1 539.20 cm-1和1 247.94 cm-1,酰胺A区的吸收峰在3 440~3 400 cm-1处,主要指N—H的收缩振动,与氢键的形成有关,并且当含N—H基团的肽段参与氢键形成时,N—H基团的伸缩振动产生的吸收峰会降低100 cm-1左右,从而使吸收峰出现在3 340~3 300 cm-1[30],因此可以推测肌球蛋白在不同处理条件下均有氢键的存在。酰胺B区指C—H的伸缩振动,经过漂洗后发生蓝移,斩拌后发生红移,加热对酰胺B区无影响。酰胺Ⅰ、Ⅱ和Ⅲ带是反映蛋白质肽链骨架结构的最重要吸收峰[31],酰胺Ⅱ吸收峰出现在1 600~1 500 cm-1,主要指C—N伸缩振动和N—H变形振动,酰胺Ⅰ带吸收峰是由蛋白多肽骨架的伸缩振动而引起,主要指C![]() O伸缩振动,甘氨酸和脯氨酸残基的—CH2特征振动峰为酰胺Ⅲ,酰胺III带的波数为1 220~1 330 cm-1,酰胺Ⅰ带和酰胺Ⅲ带常被用来指认蛋白质的二级结构,但酰胺Ⅲ带吸收峰强度低,因此通常利用酰胺Ⅰ带分析蛋白质二级结构。酰胺Ⅰ带与蛋白肽链骨架的有序程度紧密相关,一般来说,酰胺Ⅰ带吸收峰波数越大,蛋白质结构有序度越高[32]。由表1可知,漂洗后波数增大,而斩拌后发生红移,波数较少,这可能是斩拌造成蛋白质α-螺旋解旋导致,随着加热温度的升高,酰胺Ⅰ带发生蓝移,波数增加,蛋白质结构越紧密,因此为进一步研究肌球蛋白在加工过程中二级结构的变化,本实验中通过二阶导、高斯拟合处理酰胺Ⅰ带研究肌球蛋白二级结构相对含量的变化。
O伸缩振动,甘氨酸和脯氨酸残基的—CH2特征振动峰为酰胺Ⅲ,酰胺III带的波数为1 220~1 330 cm-1,酰胺Ⅰ带和酰胺Ⅲ带常被用来指认蛋白质的二级结构,但酰胺Ⅲ带吸收峰强度低,因此通常利用酰胺Ⅰ带分析蛋白质二级结构。酰胺Ⅰ带与蛋白肽链骨架的有序程度紧密相关,一般来说,酰胺Ⅰ带吸收峰波数越大,蛋白质结构有序度越高[32]。由表1可知,漂洗后波数增大,而斩拌后发生红移,波数较少,这可能是斩拌造成蛋白质α-螺旋解旋导致,随着加热温度的升高,酰胺Ⅰ带发生蓝移,波数增加,蛋白质结构越紧密,因此为进一步研究肌球蛋白在加工过程中二级结构的变化,本实验中通过二阶导、高斯拟合处理酰胺Ⅰ带研究肌球蛋白二级结构相对含量的变化。
表1 肌球蛋白红外光谱特征吸收峰的波数
Table 1 Wave numbers of characteristic absorption peaks of myosin infrared spectrum
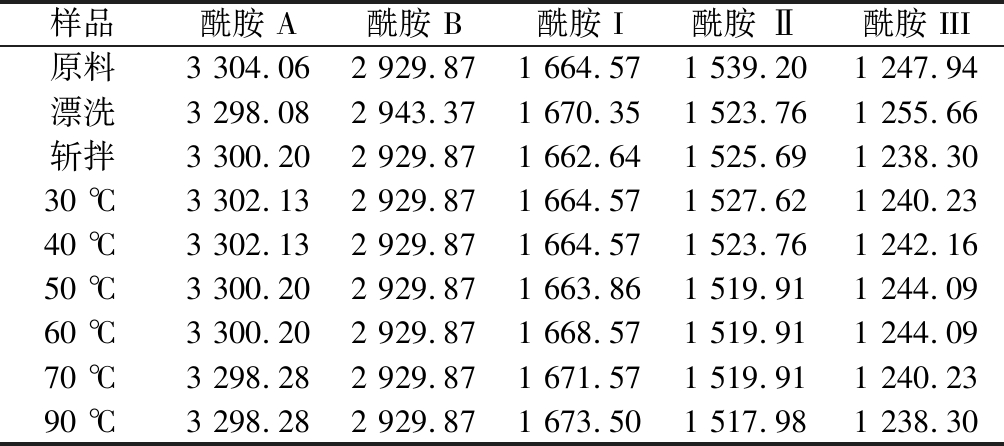
样品酰胺 A酰胺 B酰胺 I酰胺 Ⅱ酰胺 III原料3 304.062 929.871 664.571 539.201 247.94漂洗3 298.082 943.371 670.351 523.761 255.66斩拌3 300.202 929.871 662.641 525.691 238.3030 ℃3 302.132 929.871 664.571 527.621 240.2340 ℃3 302.132 929.871 664.571 523.761 242.1650 ℃3 300.202 929.871 663.861 519.911 244.0960 ℃3 300.202 929.871 668.571 519.911 244.0970 ℃3 298.282 929.871 671.571 519.911 240.2390 ℃3 298.282 929.871 673.501 517.981 238.30
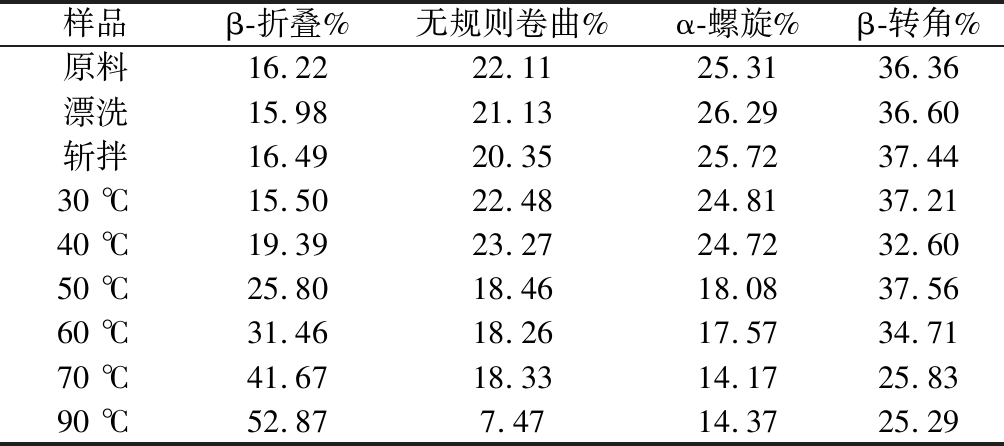
肌球蛋白在加工过程中二级结构相对含量的变化如表2所示,天然肌球蛋白的β-折叠、无规则卷曲、α-螺旋和β-转角含量分别为16.22%、22.11%、25.31%和36.36%,漂洗后β-折叠和无规则卷曲含量略微减少,α-螺旋略增加,β-转角无明显变化,这与袁凯等关于对白鲢鱼糜的二级结构研究结果类似[33]。斩拌鱼糜肌球蛋白无规则卷曲结构相对含量降低了4%,而β-折叠和β-转角分别增加3%和2%,而李贤[25]通过对鲢鱼肌球蛋白二级结构研究发现,随着斩拌或者擂溃的进行,α-螺旋解折叠展开转变为无规则卷曲,这可能与斩拌时间、斩拌温度以及鱼种等有一定的关系。在30~90 ℃,随着加热温度的升高,肌球蛋白二级结构中β-折叠含量逐渐升高,α-螺旋含量逐渐减少。无规则卷曲在低于40 ℃加热含量无明显变化,而在高于50 ℃加热时,无规则卷曲结构含量显著下降。β-转角在70 ℃以下加热,含量无明显变化,在70~90 ℃温度范围内,其含量明显下降。α-螺旋是紧密而无空腔的结构,结构过于稳定,不利于功能特性所需要的某种构象变化,β-结构和无规则卷曲也是紧密有序的稳定结构,但是相比α-螺旋结构他们的紧密程度和构象稳定性明显变差,但是蛋白质的柔韧条件明显改善,更加有利于发挥蛋白质的某种功能特性[34]。通常加热条件下α-螺旋含量降低代表蛋白质分子展开程度增加,而β-折叠含量增加代表蛋白质分子间聚集程度增加,β-结构的形成是凝胶形成的基础,两者含量的增高有利于良好凝胶结构的形成[35]。此可以推测在低温加热条件下,对蛋白质凝胶结构起稳定作用的主要是β-转角,而在高温条件下主要是β-折叠起稳定作用,贾丹[36]同样发现鲢鱼肌球蛋白二级结构中β-折叠在温度高于50 ℃才开始形成。由此可见,蛋白质二级结构中β-结构的变化是形成凝胶的前提。
表2 肌球蛋白二级结构相对含量变化
Table 2 Changes in the relative content of myosin secondary structure
样品β-折叠%无规则卷曲%α-螺旋%β-转角%原料16.2222.1125.3136.36漂洗15.9821.1326.2936.60斩拌16.4920.3525.7237.4430 ℃15.5022.4824.8137.2140 ℃19.3923.2724.7232.6050 ℃25.8018.4618.0837.5660 ℃31.4618.2617.5734.7170 ℃41.6718.3314.1725.8390 ℃52.877.4714.3725.29
3 结论
金鲳是制作鱼糜制品良好的原材料,但是其凝胶强度相对较低,因此为了为金鲳鱼糜的加工提供一定的参考,本次实验对金鲳肌球蛋白的理化性质进行了一定的研究。漂洗、斩拌以及不同温度加热对肌球蛋白理化特性均有一定的影响,漂洗过程中,肌球蛋白浊度减小,活性巯基与表面疏水性显著增大,更易造成蛋白变性;斩拌会使肌球蛋白浊度增大,表面疏水性减少,并且总巯基显著减少形成二硫键,造成蛋白质的轻微聚集形成微凝胶;不同加热温度对肌球蛋白变性聚集影响差异显著,本实验中,60 ℃是一个重要的加热温度,在低于60 ℃加热条件下,肌球蛋白在加热条件下是变性聚集的动态过程,而在更高温度加热条件下,变性聚集的蛋白逐渐聚合,形成稳定凝胶,伴随着肌球蛋白浊度、溶解度、表面疏水性以及二硫键等均达到最大值,活性巯基与总巯基含量降到最低,α-螺旋结构解旋形成更多的β-折叠,无规则卷曲和β-转角含量显著减少。
[1] HAYAKAWA T, YOSHIDA Y, YASUI M, et al. Heat-induced gelation of myosin in a low ionic strength solution containing L-histidine[J]. Meat Science, 2012, 90(1): 77-80.
[2] 汪媛,张立彦,吴利芬,等. 微波加热对肌球蛋白理化特性的影响[J].食品工业,2019, 40(3):191-196.
[3] LANIER T C, CARVAJAL P, YONGSAWATDIGUL J, et al.Surimi gelation chemistry[M].3rd ed.Boca Raton:CRC Press,2013,435-489.
[4] 王金余,刘承初,赵善贞,等. 白鲢鱼糜肌球蛋白交联反应和凝胶化最适条件的研究[J].食品科学,2008,29(11):223-227.
[5] DUCEPT F, DE BROUCKER T, SOULI J M, et al. Influence of the mixing process on surimi seafood paste properties and structure[J]. Journal of Food Engineering, 2012, 108(4): 557-562.
J M, et al. Influence of the mixing process on surimi seafood paste properties and structure[J]. Journal of Food Engineering, 2012, 108(4): 557-562.
[6] 裴志胜,文攀,王卉,等. 微胶囊化高良姜精油对冷藏金鲳鱼糜的保鲜效果及凝胶特性影响[J].食品科技,2018,43(2):167-170.
[7] 曹湛慧,黄和,陈良,等. 加工工艺对金鲳鱼糜制品凝胶强度的影响[J].食品工业,2015,36(7):37-40.
[8] 王娜. 加工工艺对金鲳鱼糜凝胶特性及鱼糜蛋白冷冻变性影响的研究[D].湛江:广东海洋大学,2015.
[9] 高翔, 王蕊, 刘后祥. 低值淡水鱼鱼糜制品凝胶强度的研究[J]. 食品与发酵工业, 2010, 36(6):53-56.
[10] PARK J, LANIER T. Scanning calorimetric behavior of tilapia myosin and actin due to processing of muscle and protein purification[J]. Journal of Food Science, 1989, 54(1): 49-51.
[11] CAO H, JIAO X, FAN D, et al. Microwave irradiation promotes aggregation behavior of myosin through conformation changes[J]. Food Hydrocolloids, 2019, 96: 11-19.
[12] CHEN X, XIONG Y L, XU X L. High-pressure homogenization combined with sulfhydryl blockage by hydrogen peroxide enhance the thermal stability of chicken breast myofibrillar protein aqueous solution[J].Food chemistry, 2019, 285: 31-38.
[13] WEI L, CAO L, XIONG S, et al. Effects of pH on self-assembly of silver carp myosin at low temperature[J]. Food Bioscience, 2019, 30: 100 420.
[14] 王仕钰. 微波对鸡胸肉糜凝胶特性的影响研究[D].广州:华南理工大学,2013.
[15] CHELH I, GATELLIER P, SANTE-LHOUTELLIER V. A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683.
[16] 林婉玲,杨贤庆,李来好,等. 浸渍冻结对调理草鱼冻藏过程中肌原纤维蛋白特性的影响[J].南方水产科学,2016,12(3):67-73.
[17] 周扬,陈雪珂,戴宏杰,等. 溶液体系中迷迭香酸与肌球蛋白的相互作用及其对蛋白理化特性的影响[J/OL].食品科学,http://kns.cnki.net/kcms/detail/11.2206.ts.20190918.0958.032.html.
[18] 王蕾,范大明,黄建联,等 .破碎方式对白鲢鱼糜凝胶结构的影响[J].食品与机械,2018,34(3):32-38.
[19] 袁丽,孙楚楚,石彤,等. 热诱导对鳙鱼肌球蛋白特性的影响[J].中国食品学报,2017,17(11):28-35.
[20] 冯雪平. 热处理温度对鲢肌球蛋白结构和凝胶水分影响的研究[D].镇江:江苏大学,2016.
[21] KO W C, YU C C, HSU K C. Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J]. LWT-Food Science and Technology, 2007, 40(8): 1 316-1 320.
[22] XU Y,XIA W,YANG F,et al. Physical and chemical changes of silver carp sausages during fermentation with Pediococcus pentosaceus[J]. Food Chemistry,2010,122(3): 633-637.
[23] 曹洪伟. 微波对鱼糜加工过程中肌球蛋白和关键酶结构的影响[D].无锡:江南大学,2019.
[24] 李向红,王发祥,张付兰,等. 冷藏过程中草鱼肌原纤维蛋白结构的变化[J].食品与发酵工业,2015,41(10):177-181.
[25] 李贤. 破碎方式对鱼糜凝胶特性的影响[D].武汉:华中农业大学,2014.
[26] NIWA E. Chemistry of Surimi Gelation[M]. New York: Marcel Dekker,1992:389.
[27] WENCHING K O, CHICHENG Y U, KUOCHIANG H S U. Changes in conformation and sulfhydryl groups of tilapia actomyosin by thermal treatment[J]. Lebensmittel-Wissenschaft und-Technologie, 2007,40(8): 1 316-1 320.
[28] 朱潘红,周春霞,付苇娅,等. 赖氨酸诱导低离子强度下罗非鱼肌球蛋白增溶及机制[J].食品科学,2018,39(3):97-103.
[29] 吕彤,林俊杰,周昌瑜,等. 热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J].农业工程学报,2016,32(8):285-291.
[30] LI H, LIU B L, GAO L Z, et al. Studies on bullfrog skin collagen[J]. Food Chemistry, 2004, 84(1): 65-69.
[31] 温慧芳,陈丽丽,白春清,等. 基于不同提取方法的鮰鱼皮胶原蛋白理化性质的比较研究[J].食品科学,2016,37(1):74-81.
[32] PAYNE K J, VEIS A. Fourier transform IR spectroscopy of collagen and gelatin solutions: Deconvolution of the amide Ⅰ band for conformational studies[J]. Biopolymers, 1988, 27(11): 1 749-1 760.
[33] 袁凯,张龙,谷东陈,等. 基于漂洗工艺探究白鲢鱼糜加工过程中蛋白质氧化规律[J].食品与发酵工业,2017,43(12):30-36.
[34] 穆利霞. 大豆蛋白一糖接枝改性及其结构与功能特性研究[D].广州: 华南理工大学,2010.
[35] KANG Z L, WANG P, XU X L, et al. Effect of beating processing, as a means of reducing salt content in frankfurters: A physico-chemical and Raman spectroscopic study[J]. Meat Science, 2014, 98(2):171-177.
[36] 贾丹. 青鱼肌肉蛋白质及其凝胶特性的研究[D].武汉:华中农业大学,2016.