动物宰后,血液所携带的氧气供应停止,氧化还原电位下降,细胞色素系统无法运转[1],机体丧失了通过电子传递链产生三磷酸腺苷(adenosine triphosphate,ATP)的能力。糖酵解成为唯一的能量代谢途径。这一过程与活体肌肉暂时性缺氧条件下发生的反应相似,但宰后这种变化一直延续到肌糖原耗尽或参与糖酵解的酶系失活。糖酵解过程产生的乳酸不会像活体动物那样被转运到肝脏中再合成肝糖原或通过血液循环被排除,而是在肌肉细胞内蓄积起来,导致肌肉pH值下降[2]。而pH值的变化速度与幅度会影响肌肉的色泽、嫩度、系水力、蒸煮损失等肉品质指标[3-4]。
腺苷一磷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)是一种重要的 “能量调节器”,由一个催化亚基(α)和2个调节亚基(β和γ亚基)组成的异源三聚体,属丝氨酸/苏氨酸蛋白激酶,它广泛存在于真核细胞生物中[5]。活化的AMPK通过关闭合成代谢途径以减少能量消耗,同时开启分解代谢途径增加能量产生以维持ATP水平[6-7]。AMPK活性调控信号通路如图1所示,其中一种激活途径是通过其上游的蛋白激酶发生磷酸化,进而直接启动AMPK α 亚单位的苏氨酸172位,激活细胞中AMPK活性[8]。目前发现2种AMPK上游激酶,即钙/钙调素依赖性蛋白激酶激酶β(calcium/calmodulin-dependent protein kinase kinase Beta,CaMKKβ)和肝脏激酶B1(liver kinase B1,LKB1)[9-10]。CaMKKβ对苏氨酸(Thr)172位的磷酸化不依赖于AMP浓度的升高,而是通过增高Ca2+浓度从而激活AMPK,其调节是通过细胞内Ca2+浓度的升高而启动[11-12]。低水平的胞内活性氧(reative oxygen species,ROS)现在被认为是维持细胞内稳态和正常生理功能的关键信号[13],有研究报道,活性氧升高后可通过激活钙释放激活钙通道 (Ca2+ release-activated Ca2+channel, CRAC)导致细胞内Ca2+离子增多并活化CaMKKβ[14]。
然而牦牛肉宰后成熟过程中,活性氧对CaMKKβ-AMPK信号通路,糖酵解以及肉品质影响的研究报道较少。因此,本文通过H2O2、活性氧清除剂N-乙酰基-L-半胱氨酸(N-acetyl-L-cysteine,NAC)以及H2O2+ Compound C(AMPK抑制剂)处理牦牛肉作为研究对象,测定牦牛肉成熟过程中AMPK级联反应相关指标、糖酵解关键酶活力、糖酵解产物等指标,初步探索活性氧对牦牛肉宰后成熟过程中AMPK的激活作用以及对宰后肌肉糖酵解及肉品质的影响。
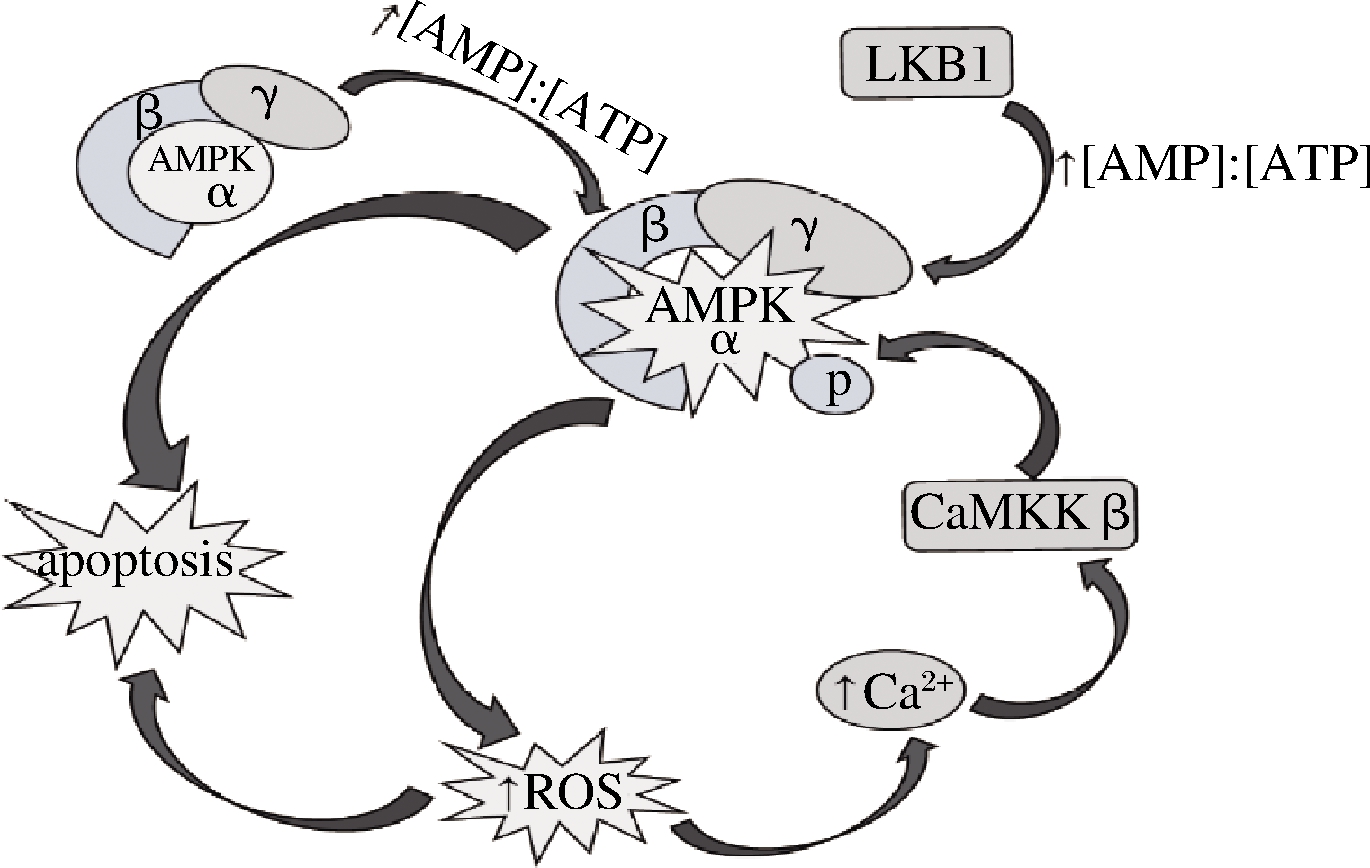
图1 AMPK活性调控信号通路
Fig.1 The signaling pathway of AMPK activity regulation
1 材料与方法
1.1 材料与试剂
在甘肃甘南牧区,随机选取健康无病,生长发育正常,平均年龄3~4岁,体质量(350 ± 20) kg的牦牛6头,公母各3头,宰前禁食16~18 h,禁水2 h。屠宰后立即取牦牛胴体中部背最长肌肉样,置于4 ℃条件下成熟。
牛磷酸化腺苷酸活化蛋白激酶酶联免疫分析试剂盒、牛钙调蛋白依赖性蛋白激酶激酶β酶联免疫分析试剂盒,上海远慕生物科技有限公司;丙酮酸激酶测定试剂盒、肌/肝糖原测定试剂盒、乳酸测试盒,南京建成生物工程研究所。Compound C(AMPK抑制剂)、D-甘露糖醇(D-mannitol)、Tris-base、乙二醇双(2-氨基乙基醚)四乙酸[ethylenebis(oxyethylenenitri)tetraacetic acid],美国Amresco公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),二硫苏糖醇(dithiothreitol,DTT), 2′,7′-二氯荧光黄双乙酸盐(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA),美国Sigma公司;H2O2、NAC、NaCl、浓H2SO4,国药集团化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
FA2004B 型电子天平,上海佑科仪器有限公司;TGL-16M 型离心机,长沙湘仪离心机仪器有限公司;TU-1810 型紫外可见分光光度计,北京普析通用仪器有限责任公司;LRH-250型生化培养箱,上海一恒科学仪器有限公司;XHF-DY型高速分散器,宁波新芝生物科技股份有限公司;HI99163型便携式pH计,意大利哈纳仪器公司;C-LM4 型数显式肌肉嫩度仪,上海精密科学仪器有限公司;RF 5301-PC荧光分光光度计,日本岛津公司。
1.3 实验方法
1.3.1 样品采集与处理
屠宰后立即取胴体中部背最长肌,剔除脂肪、筋腱及结缔组织后,分割为每块50 g的肉样,随机分为4组,第1组注射5 mmol/L H2O2溶液作为产生活性氧组,第2组注射20 mmol/L NAC溶液作为清除活性氧组,第3组注射0.9% NaCl溶液作为对照组,第4组注射5 mmol/L H2O2+ 40 μmol/L Compound C溶液作为抑制AMPK活性组,每组注射量均为肉质量的10%,采用真空包装,在4 ℃条件下进行宰后成熟。对于0 h的肉样立即用锡箔纸包裹后,放入液氮中冷冻待测。其余肉样在成熟时间点6、12、24、48、72、120 h分别进行取样,并测定AMPK活力等指标,对于不便立即测定的指标,用锡箔纸包裹,液氮迅速冷冻后置于-80 ℃冻藏待测。
1.3.2 ROS水平的测定
参照张玉林[15]和王琳琳[16]的方法并略作修改,将0.5 g肌肉组织放入4.5 mL的Tri-HCl缓冲液(10 mmol/L Tri-HCl,8 g/L NaCl,0.1 mmol/L EDTA-2Na,10 mmol/L 蔗糖,pH 7.4)中剪碎,冰浴匀浆1 min, 3 000×g冷冻离心15 min收集上清,并测定上清蛋白浓度。将上清液与反应缓冲液(10 mmol/L Tri-HCl,8 g/L NaCl,0.1 mmol/L EDTA-2Na,10 mmol/L 蔗糖,10 μmol/L DCFH-DA,pH 7.4)混合,快速放入水浴锅37 ℃孵育15 min(注意避光操作),最后用荧光分光光度计立即测定荧光强度值(激发波长488 nm,发射波长525 nm)。
1.3.3 胞浆中Ca2+水平的测定
参考辛国荣等[17]的方法并略作修改,取组织块于10 mL烧杯中,加入预冷的匀浆介质[pH 7.4, 0.1 mol/L Tris-HCl,1 mmol/L KCl,1 mmol/L EDTA-2Na,0.25 mol/L(蔗糖去离子水配制)],固液比为1∶9(g∶mL),使用高速分散器冰浴、10 000 r/min的条件下制成100 g/L的组织匀浆。
取100 g/L的组织匀浆,在4 ℃、2 000 r/min条件下离心10 min,弃沉淀,取上清液以4 ℃、18 000 r/min离心15 min,沉淀物为线粒体,分离线粒体后的上清液即为胞浆。
采用火焰原子吸收法,取1.5 mL待测液于加盖试管中加入浓HNO3 5 mL,置于阴暗处硝化1周,然后用烘箱加热使HNO3尽量分解蒸发,留存即为样品。加入10 g/L的氯化镧至10 mL,混匀待测。
1.3.4 AMPK、CaMKKβ活力的测定
参照杨雅媛等[18]的方法并作修改,取冷冻的组织肉样约0.5 g剁碎置于离心管中,加入预冷的匀浆液(pH 7.4,0.05 mol/L Tris-HCl,1 mmol/L EDTA,1 mmol/L EGTA,1 mmol/L DTT,50 mmol/L NaF,5 mmol/L焦磷酸钠,0.25 mol/L D-mannitol)冰浴匀浆(每15 s匀浆1次,间隙20 s,重复3次)。然后在4 ℃、10 000 r/min的条件下冷冻离心5 min,取上清液用于AMPK、CaMKKβ活力的测定。测定方法以及标准曲线制作参照酶联免疫试剂盒进行。
1.3.5 糖酵解指标的测定
肌糖原、乳酸、丙酮酸激酶等指标通过南京建成生物工程研究所的试剂盒进行测定,具体操作步骤和结果计算参照各试剂盒的说明书进行。
1.3.6 pH值的测定
将便携式pH计的探针插入肉样中,使pH计的电极与肌肉组织充分接触,读数稳定后记录,每个肉样重复测定3次,取平均值。
1.3.7 肉品质指标的测定
蒸煮损失:参考马秀丽等[19]的方法,将长×宽×高不少于 6 cm × 3 cm × 3 cm 的肉样,修整去除肉块表面的脂肪和结缔组织,称重记为Ma,80 ℃恒温水浴加热,用数显温度计记录加热过程中肉块的中心温度。当中心温度达到75 ℃时,恒温保持5 min后取出冷却至室温,再次称重记为Mb,蒸煮损失计算如公式(1)所示:
蒸煮损失![]()
(1)
剪切力:将测定完蒸煮损失的肉样沿肌纤维方向取3个直径为1.27 cm肉柱,用C-LM4 型数显式肌肉嫩度仪垂直肌纤维方向剪切肉柱,每组重复3次,取平均值。
1.4 统计分析
试验结果均采用平均值±标准差表示,数据平行测定3次,所有数据使用SPSS 19.0软件进行数据分析(多重比较分析采用 Duncan 法,P<0.05),使用Excel 2016软件制图。
2 结果与分析
2.1 ROS对宰后牦牛肉CaMKKβ-AMPK通路的影响
ROS和Ca2+是公认的细胞重要信使。如图2所示,宰后H2O2组活性氧水平呈上升趋势,对照组与NAC组ROS水平呈先下降后上升趋势,对照组在12 h达到最小值,NAC组在24 h到达最小值;H2O2组活性氧水平在宰后0~12 h显著高于其他2组,NAC组显著低于其他2组(P<0.05)。说明H2O2处理提高了宰后肉ROS水平,NAC能够抑制ROS的产生。3组Ca2+浓度均逐渐升高, H2O2组显著(P<0.05)高于NAC组,这说明清除活性氧能够降低胞浆中Ca2+浓度。王琳琳[16]研究的Ca2+介导宰后牦牛肉线粒体凋亡途径激活机制中也指出,宰后成熟过程中,确实存在Ca2+超载现象。在12 h时,H2O2组Ca2+浓度显著(P<0.05)高于对照组14.61%,对照组显著(P<0.05)高于NAC组11.81%,随后均呈现逐渐下降的趋势。综上所述,H2O2处理能够激活钙释放激活钙通道致使内质网中Ca2+大量释放至胞浆中。
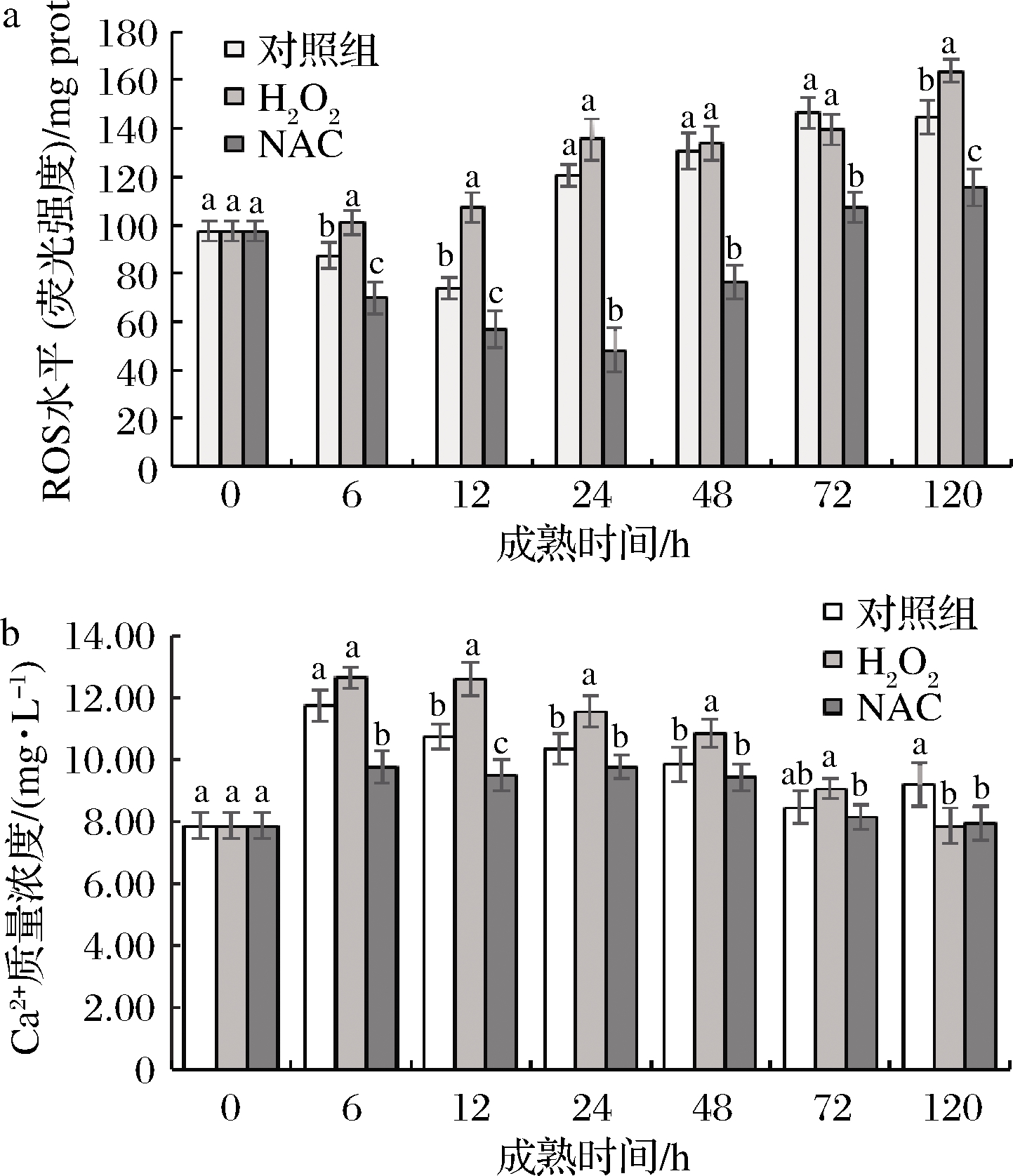
a-ROS水平;b-Ca2+质量浓度
图2 宰后背最长肌成熟过程中ROS水平 及胞浆Ca2+质量浓度的变化
Fig.2 Changes of ROS levels and Ca2+ concentrations in cytoplasm of longissimus dorsi muscle during postmortem aging
注:小写字母不同表示同一时间点不同处理方式间差异显著 (P<0.05),小写字母相同表示同一时间点不同处理方式间 差异不显著(P>0.05);不同时间点间差异显著性未标出(下同)
CaMKKβ作为唯一不依赖于AMP浓度的升高而激活AMPK的蛋白激酶,在AMPK级联反应中的地位举足轻重。如图3所示,在宰后牦牛肉成熟过程中CaMKKβ活力呈现先升高后降低的趋势,在6 h达到最大值,且3组间差异显著(P<0.05),其中,H2O2组为122.43 IU/L,对照组为112.15 IU/L,NAC组为84.39 IU/L。这可能是由于胞浆中Ca2+浓度的升高,从而起到了激活CaMKKβ的作用。廖海含[20]的研究也发现前体脂肪细胞胞内Ca2+激活CaMKKβ-AMPK信号通路以维持前体脂肪细胞因子-1。在成熟6~24 h,3组牦牛肉样CaMKKβ活力均呈现下降的趋势。这可能是由于肉成熟过程中细胞内环境变化导致酶空间结构破坏从而酶活力快速下降。综上,H2O2显著提高CaMKKβ酶活力,可能对宰后牦牛肉AMPK活性及糖酵解产生影响。
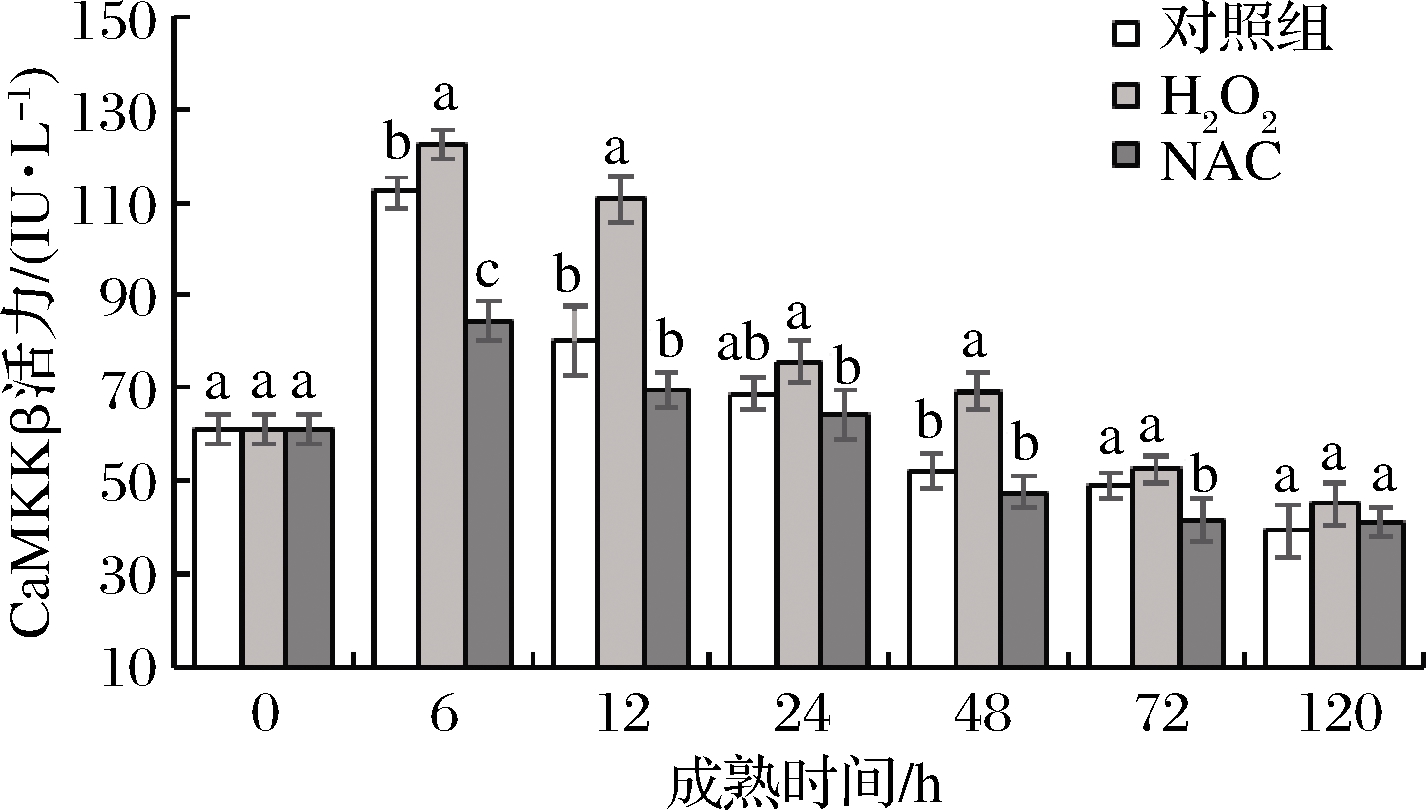
图3 宰后背最长肌成熟过程中CaMKKβ活力的变化
Fig.3 Changes of CaMKKβ activity of longissimus dorsi muscle during postmortem aging
AMPK是广泛存在于真核细胞内高度保守的蛋白激酶下游组件,作为细胞内能量稳态的关键感受器和调节器[21-22],与能量代谢有着密切关联。宰后牦牛肉成熟过程中AMPK活力变化如图4所示,成熟0~120 h,3组牦牛肉样AMPK活力整体呈现降低的趋势,H2O2组与对照组有所升高,且在12 h时达到最大值,其中,NAC组显著(P<0.05)低于对照组13.02%,显著(P<0.05)低于H2O2组16.73%。在12~48 h,处理组与对照组间均显著(P<0.05)高于NAC组。这说明宰后牦牛肉成熟过程中ROS诱导CaMKKβ的激活,对其下游激酶AMPK具有活化作用。廖海含[20]研究CaMKKβ在心肌纤维化的作用时也指出在小鼠心肌组织中,CaMKKβ缺失后AMPK磷酸化水平显著降低。H2O2组与对照组牦牛肉在12 h均达到成熟期间最大值,这与杨雅媛等[18]的研究结果相类似。SCHEFFLER等[23]的研究也表明,骨骼肌中AMPK被激活来维持细胞能量的供应。综上,宰后牦牛肉成熟过程中在活性氧诱导下,上游激酶CaMKKβ通过Ca2+的活化,从而激活下游蛋白激酶AMPK。

图4 宰后背最长肌成熟过程中AMPK活力的变化
Fig.4 Changes of AMPK activity of longissimus dorsi muscle during postmortem aging
2.2 ROS对宰后牦牛肉糖酵解的影响
糖酵解是葡萄糖被分解生成丙酮酸的过程,在缺氧的条件下丙酮酸进一步被还原为乳酸。丙酮酸激酶(pyruvate kinase, PK)是该过程的限速酶之一,宰后牦牛肉成熟过程中变化如图5所示。随着成熟时间的延长,4组牦牛肉样PK活力表现出下降趋势,在成熟12~48 h,H2O2处理组PK活力显著(P<0.05)高于其他3组,加入抑制剂Compound C组则显著(P<0.05)低于其他3组。这说明AMPK能够对PK起到激活作用,加入AMPK抑制剂组能够明显抑制PK活力。张一敏等[24]在研究不同部位肉中AMPK差异表达时也发现,AMPK能够通过磷酸化激活PK。DING等[25]在研究牦牛对海拔高度适应性时指出糖酵解酶活力与高海拔呈正比,这可能与低氧适应下牦牛肉中AMPK活力更强[18, 26]有关。

图5 宰后背最长肌成熟过程中丙酮酸激酶活性的变化
Fig.5 Changes of PK activity of longissimus dorsi muscle during postmortem aging

图6 宰后背最长肌成熟过程中肌糖原的变化
Fig.6 Changes of muscle glycogen of longissimus dorsi muscle during postmortem aging
肌糖原作为肌肉中重要的储能物质,在宰后牦牛肉成熟过程中,变化规律如图6所示,随着成熟地进行,肌糖原含量呈现逐渐下降的趋势,在成熟24~48 h,H2O2组显著(P<0.05)低于NAC组18.89%,34.46%;而清除了活性氧的NAC组和抑制AMPK活性的Compound C组则显著(P<0.05)高于对照组与H2O2组。这表明在宰后活化的AMPK可以通过加速肌糖原的分解来影响糖酵解,活性氧诱导的CaMKKβ-AMPK通路在这一过程中起到了重要作用。与此相似的是,李泽[27]在研究AMPK对羊肉能量代谢和肉质的影响及其机理时也指出,羊肉AMPK活力高的部位肌糖原代谢速率更快。
乳酸是无氧糖酵解的最终产物,其含量会直接影响到宰后肉的pH变化[28],继而对系水力、嫩度等品质产生影响。如图7所示,宰后0~72 h,4组牦牛肉样均呈现升高趋势,且在72 h达到最大值,但4组间差异不显著(P>0.05)。在6~48 h,H2O2组乳酸含量显著(P<0.05)高于AMPK抑制剂组。这说明成熟期间AMPK活力的升高,能够提高宰后牦牛肉糖酵解能力。杨雅媛等[18]的研究认为,当糖酵解底物充足时,糖原的分解不是影响乳酸含量进而改变肉质的关键因素,从而解释了不同肉品质差异。
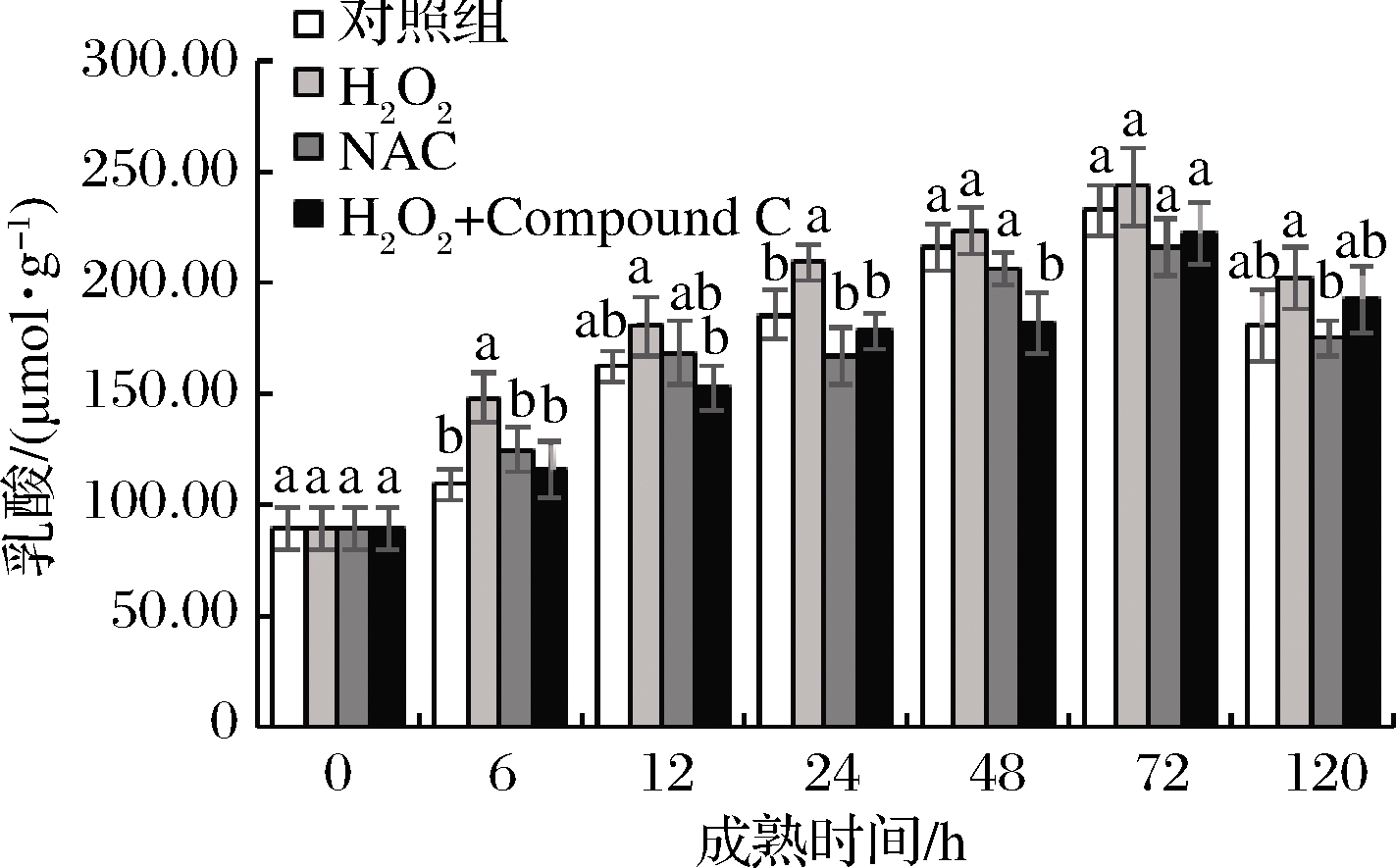
图7 宰后背最长肌成熟过程中乳酸的变化
Fig.7 Changes of lactic acid of longissimus dorsi muscle during postmortem aging
pH值是乳酸含量的直观反映,乳酸含量越高,pH值越低,如图8所示,宰后成熟期间,牦牛肉4组肉样pH值均表现出先降低后有所缓慢升高的现象,H2O2组与其他3组相比,在6~12 h下降更快且在第12 h显著(P<0.05)低于其他3组;在成熟6~48 h AMPK抑制剂组pH值高于其他3组但差异不显著(P>0.05)。

图8 宰后背最长肌成熟过程中pH值的变化
Fig.8 Changes of pH of longissimus dorsi muscle during postmortem aging
2.3 ROS对宰后牦牛肉品质的影响
剪切力能够直接反应肉的嫩度,剪切力越大,肌肉嫩度越小。如图9所示,4组肉样均呈现先升高后降低的趋势,H2O2组在第24 h达到最大值8.54 kgf随后显著(P<0.05)降低,而其他3组则在第72 h达到最大值。这表明活性氧加快了肌肉的成熟时间,显著提高了肉的嫩度。张玉林[15]在研究ROS对宰后鹅肉品质的影响时也指出活性氧能够改善肉的嫩度。张小涛[29]、WANG等[30]认为ROS通过诱导细胞凋亡来降解肌原纤维蛋白从而改善肌肉嫩度,而细胞凋亡途径中的Bcl-2蛋白家族是通过AMPK磷酸化激活的[22]。在48~120 h, AMPK抑制剂组剪切力显著(P<0.05)高于对照组,这表明AMPK活力高肉的剪切力越小。高永芳等[31]指出通过AMPK激活剂AICAR处理,显著改善了宰后牛肉的嫩度。
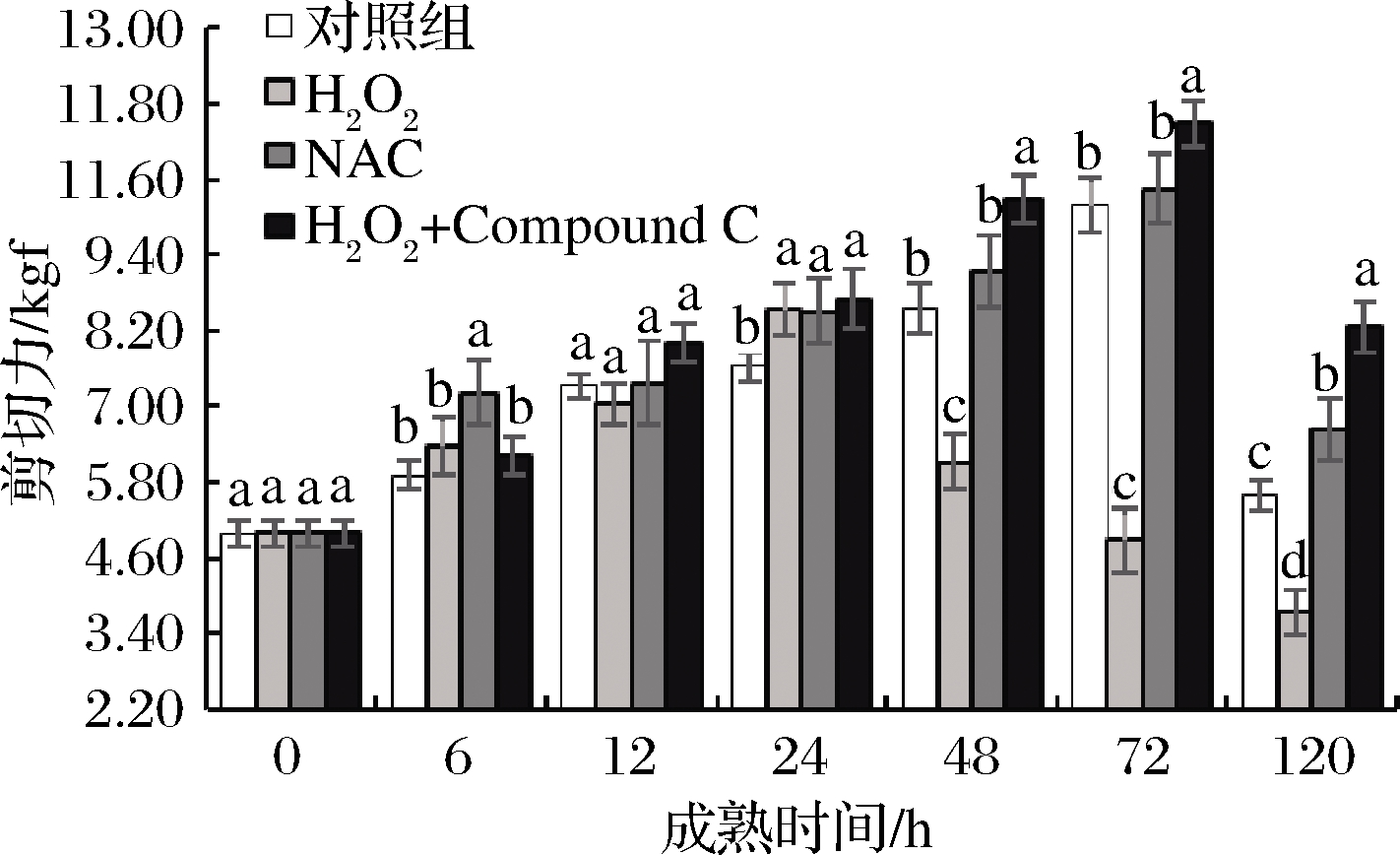
图9 宰后背最长肌成熟过程中剪切力的变化
Fig.9 Changes of shear force of longissimus dorsi muscle during postmortem aging
保水性与肉的嫩度,风味,营养等品质有着直接关系,其中蒸煮损失是衡量保水性的主要指标。宰后牦牛肉成熟过程中蒸煮损失的变化如图10所示,4组肉样均呈现先升高后降低的趋势,在第48 h达到最大值。其中清除活性氧的NAC组显著(P<0.05)低于其他3组,保水性最好。这与张玉林研究鹅肉品质的结果相一致,认为ROS能够通过改变肌原纤维蛋白二级结构来影响保水性[15]。在成熟6~24 h,AMPK抑制剂组则低于H2O2组,这可能是因为AMPK活性被抑制,糖酵解过程产生的乳酸含量低于H2O2组,pH值远离蛋白质等电点,保水性好。张一敏等[24]的研究也指出,AMPK能够通过调节糖酵解进程而影响牛肉的保水性等品质。
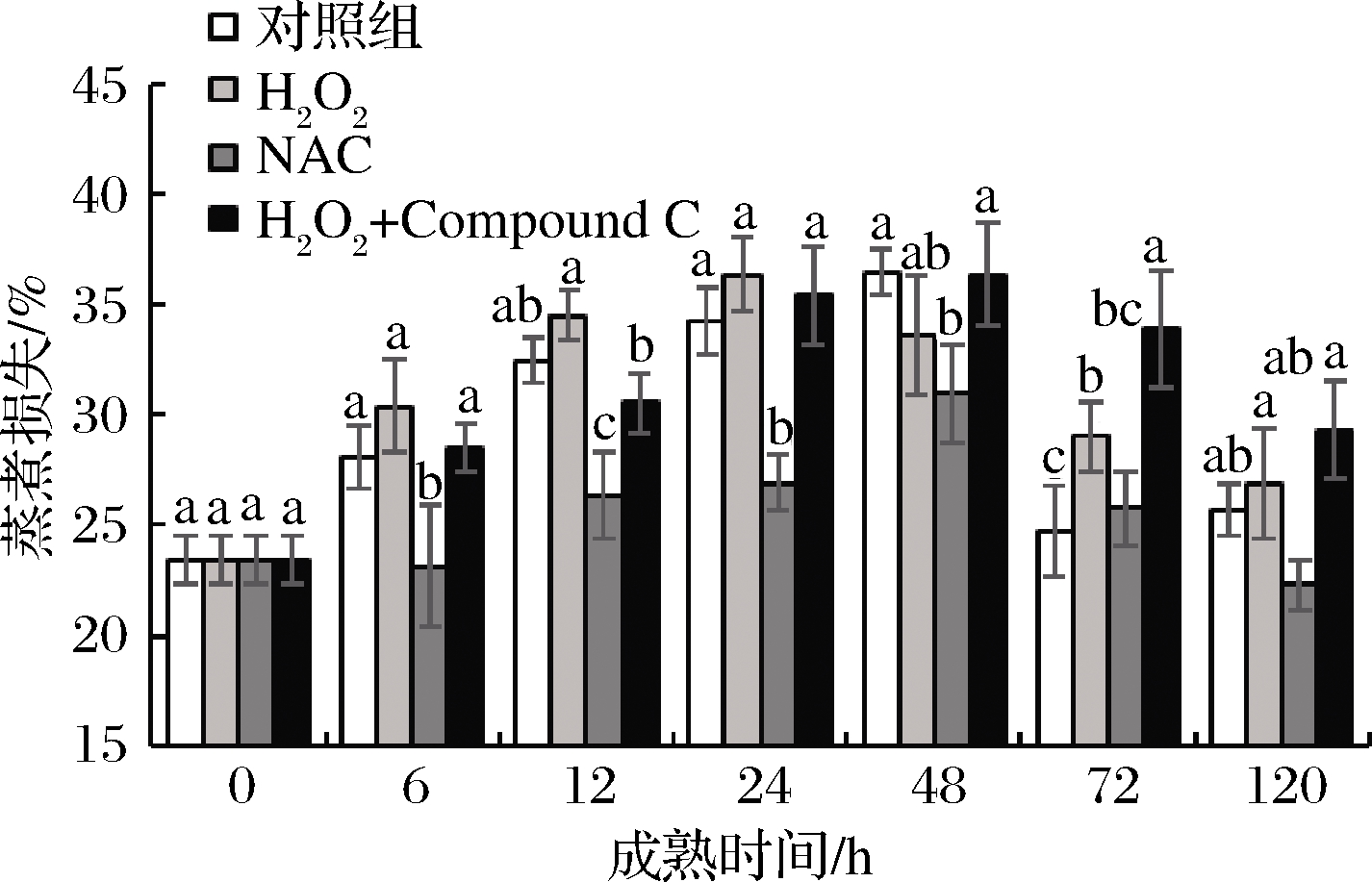
图10 宰后背最长肌成熟过程中蒸煮损失的变化
Fig.10 Changes of cooking loss of longissimus dorsi muscle during postmortem aging
3 结论
在宰后牦牛肉成熟过程中,通过H2O2处理,产生ROS诱导钙泵中Ca2+释放,导致胞浆中Ca2+浓度升高,从而激活了CaMKKβ-AMPK通路,致使活化的AMPK磷酸化糖酵解过程中的关键酶,如丙酮酸激酶,继而加速肌糖原降解,乳酸积累及pH值下降,促进宰后肌肉糖酵解代谢,同时,ROS能够通过AMPK途径提高肉的嫩度,清除活性氧能够显著(P<0.05)提高肉的保水性。AMPK活力高能够加速糖酵解过程致使肉的保水性下降。因此,宰后肉成熟过程中能够通过调控AMPK级联反应及糖酵解过程来改善肉的品质。
[1] LAWRIE R A, LEDWARD D A. Lawrie′s Meat Science[M]. 7th ed. England: Woodhead Publishing, 2006.
[2] 马晓冰, 苏琳, 林在琼, 等.不同品种肉羊肌肉的糖酵解潜力及其与肉品质的相关性[J].食品科学, 2015, 36(15): 1-4.
[3] 马秀利.CaCl2处理对不同品种牛肉成熟过程中品质及能量代谢的影响[D].兰州:甘肃农业大学, 2018: 24-26.
[4] 田甲春, 韩玲, 刘昕, 等.牦牛肉宰后成熟机理与肉用品质研究[J].农业机械学报, 2012, 43(12): 146-150.
[5] 李泽, 靳烨, 马霞.不同贮藏温度下宰后羊肉的肉质变化及其影响因素[J].农业工程学报, 2010, 26(Supp 1): 338-342.
[6] WANG H B, ZAN L S, ZHANG Y Y. Profiling of the yak skeletal muscle tissue gene expression and comparison with the domestic cattle by genome array[J]. Animal, 2014, 8(1): 28-35.
[7] CHAN A Y M, DYCK J R B. Activation of AMP-activated protein kinase (AMPK) inhibits protein synthesis: A potential strategy to prevent the development of cardiac hypertrophy[J].Canadian Journal of Physiology and Pharmacology, 2005, 83(1): 24-28.
[8] 张铭灏, 朱立贤, 张一敏, 等.腺苷酸活化蛋白激酶(AMPK) 活性对动物宰后糖酵解的影响[J].食品与发酵工业, 2016, 42(12): 234-239.
[9] WOODS A, JOHNSTONE S R, DICKERSON K, et al. LKB1 is the upstream kinase in the AMP-activated protein kinase cascade[J]. Current Biology, 2003, 13(22): 2 004-2 008.
[10] WOODS A, DICKERSON K, HEATH R, et al. Ca2+/ calmodulin-dependent protein kinase kinase-β acts upstream of AMP-activated protein kinase in mammalian cells[J].Cell Metabolism,2005,2(6): 21-33.
[11] GREEN M F, SCOTT J W, STEEL R, et al. Ca2+/Calmodulin-dependent protein kinase kinase beta is regulated by multisite phosphorylation[J]. Journal of Biological Chemistry, 2011, 286(32): 28 066-28 079.
[12] ONSELAER M B, OURY C, HUNTER R W, et al. The Ca2+/calmodulin-dependent kinase kinase β-AMP-activated protein kinase-α1 pathway regulates phosphorylation of cytoskeletal targets in thrombin-stimulated human platelets[J]. Journal of Thrombosis & Haemostasis, 2014, 12(6): 973-986.
[13] FORMAN H J, FUKUTO J M and TORRES M. Redox signaling: thiol chemistry defines which reactive oxygen and nitrogen species can act as second messengers[J]. American Journal of Physiology Cell Physiology,2004,287(2):C246-C256.
[14] MUNGAI P T, WAYPA G B, JAIRAMAN A, et al. Hypoxia triggers AMPK activation through reactive oxygen species-mediated activation of calcium release-activated calcium channels[J].Mol Cell Biol, 2011, 31(17): 3 531-3 545.
[15] 张玉林.宰后活性氧簇(ROS)的形成对鹅肉品质影响机制的研究[D].宁波:宁波大学, 2014: 31-32.
[16] 王琳琳.Cyt-c释放和介导宰后牦牛肉线粒体凋亡途径激活机制及对嫩度影响的研究[D].兰州:甘肃农业大学, 2018: 43-44.
[17] 辛国荣, 姜广林, 高艳华, 等.肝硬化门脉高压症中肝细胞线粒体钙、细胞色素C与细胞凋亡的关系[J].中国组织工程研究与临床康复, 2007, 11(47): 9 456-9 461.
[18] 杨雅媛, 宋仁德, 韩玲, 等.不同海拔高度牛宰后牛肉AMPK活性及能量代谢研究[J].农业机械学报, 2018, 49(10): 370-374; 380.
[19] 马秀丽,王琳琳,韩玲,等.不同浓度环孢菌素A处理对牛肉宰后成熟过程中品质及细胞凋亡因子的影响[J].食品与发酵工业, 2018, 44(4): 65-72.
[20] 廖海含.CaMKK2在心肌纤维化中的作用及其机制研究[D].武汉:武汉大学, 2017: 52-53.
[21] 王宇, 袁倩, 王柏辉, 等.AMPK活性及其级联效应对肉品质的研究进展[J].食品科学, 2018, 39(17): 298-304.
[22] 蔡帆, 苏金玲, 葛璞, 等.AMPK促凋亡机制研究进展[J].生命的化学,2015,35(1):26-30.
[23] SCHEFFLER T L, GERRARD D E. Mechanisms controlling pork quality development: The biochemistry controlling postmortem energy metabolism[J]. Meat Science, 2007, 77(1): 7-16.
[24] 张一敏, 朱立贤, 曹丽, 等.肉牛宰后初期一磷酸腺苷活化蛋白激酶活性在不同部位肉中的差异表达及与牛肉品质关系[J].食品与发酵工业, 2016, 42(6): 73-79.
[25] DING X, LIANG C, GUO X, et al. Physiological insight into the high-altitude adaptations in domesticated yaks (Bos grunniens) along the Qinghai-Tibetan Plateau altitudinal gradient[J]. Livestock Science, 2014, 162(1): 233-239.
[26] GAO Y, YANG Y, HAN L, et al. Study on the effect of CaMKKβ-mediated AMPK activation on the glycolysis and the quality of different altitude postmortem bovines longissimus muscle[J]. Journal of Food Biochemisty, 2019, 43(11): 13 023.
[27] 李泽. AMPK活性对宰后羊肉能量代谢和肉质的影响及其机理研究[D].呼和浩特:内蒙古农业大学, 2010: 61-62.
[28] 董笑含.AMPK活性调节对宰后不同温度处理及不同部位牛肉能量代谢的影响[D].泰安:山东农业大学, 2017: 35-36.
[29] 张小涛.鹅肉ROS形成对宰后caspase介导细胞骨架蛋白降解的影响[D].宁波:宁波大学,2013: 28-30.
[30] WANG L, HAN L, MA X, et al. Effect of mitochondrial apoptotic activation through themitochondrial membrane permeability transition pore on yak meat tenderness during postmortem aging[J]. Food Chemistry,2017,234:323-331.
[31] 高永芳, 宫玉霞, 杨雅媛, 等. AMPK活性对宰后牛肉糖酵解、肌肉内环境及品质的影响[J].食品科学, 2019, 40(17): 40-52.