每年全球生产超过1.05亿t甘薯,中国是甘薯主要的生产大国[1]。甘薯的主要采后病害是软腐病。软腐病病原体匍枝根霉(Rhizopus stolonifer)广泛分布在空气和土壤中,甘薯被其侵染后,由于快速发展的水渍病斑,块根很快就会完全腐烂,整个腐烂过程可以在几天内完成。目前学术界对甘薯软腐病的抑制研究多针对低温贮藏而非常温物流过程。常温物流的温湿度条件非常适宜匍枝根霉的生长繁殖,且物流环境空气中存在的匍枝根霉也极易浸染甘薯,而我国由于缺乏控温及密闭运输工具,导致软腐病的物流发病情况也比较严重,农贸市场上经常出现甘薯腐烂的情况。
生姜作为天然香料已有2 000年的历史[2],其块茎提取物中含有多酚化合物(6-姜酚及其衍生物)、挥发性精油、二苯基庚烷等,具有很高的抗氧化活性,抑菌功能强[3]。生姜提取物不仅对各种真菌病原体有抑制活性,如镰刀菌(Fusarium udum)[4]、画眉草弯孢菌(Curvularia eragrostidis)和可可球二孢菌(Botryodiplodia theobromae)[5]等,而且还能诱导增强果蔬免疫能力。目前有关生姜提取液用于抑制常温物流下甘薯软腐病的效果和机理还未见报道。本文通过使用体积分数为0%、25%、50%、100%生姜提取液对软腐病致病菌匍枝根霉同时进行体外和甘薯活体实验,从活体和体外2个角度探究不同浓度生姜提取液处理对甘薯软腐病的影响,并探讨其作用机制,为生姜提取液在抑制甘薯软腐病的实际应用中提供理论基础。
1 材料与方法
1.1 材料与试剂
从重庆市北碚天生农贸市场购得同批采收的新鲜甘薯,品种为“红心王”;新鲜生姜,表面完好无损,无发芽,购于重庆市北碚区永辉超市;匍枝根霉(Rhizopus stolonifer),中国工业微生物菌种保藏管理中心提供;塑料筐,外尺寸为388 mm×305 mm×111 mm,内尺寸为355 mm×275 mm×104 mm;PE塑料袋,尺寸为50 cm×60 cm,厚度为28 μm。
80%甘油(体积分数)、硼酸、Na2B4O7·5H2O、L-苯丙氨酸、EDTA、30%H2O2(体积分数)、邻苯二酚、L-苯丙氨酸、Na2HPO4·2H2O、NaH2PO4·H2O、二硫苏糖醇、蛋氨酸、乙二胺四乙酸二钠、磷酸钾、冰乙酸、无水乙酸钠,成都市科龙化工试剂厂;聚乙烯吡咯烷酮、聚乙二醇6000、TritonX-100、愈创木酚、重庆北碚化学试剂厂;β-巯基乙醇,AMRESCO公司;氯化硝基四氮唑蓝,上海如吉生物科技发展有限公司;马铃薯葡萄糖培养基,北京奥博星生物技术有限责任公司。其余试剂为实验室常用试剂,所有试剂等级为分析纯。
1.2 仪器与设备
HWS气候箱,宁波东南仪器;H1650R离心机,湖南湘仪;UV-2450PC紫外可见分光光度计,日本岛津;BXM-30R高压蒸汽灭菌锅,上海博讯实业;KQ3200DB超声波清洗器,昆山市超声仪器;VD-850洁净工作台,苏州净化设备。
1.3 样品处理
1.3.1 孢子悬浮液的制备
将Rhizopus stolonifer接种至PDA平板培养基上,于28 ℃恒温培养箱中培养7 d,待病原菌长出孢子,再用无菌水清洗菌丝,通过8层纱布过滤,滤液即是孢子悬浮液。用血球计数板计数,得到1×106 CFU/mL的孢子悬浮液备用。
1.3.2 生姜提取液的制备
取生姜100 g,洗净、切碎后研磨成匀浆,加入1 000 mL无菌蒸馏水搅拌均匀,于40 ℃下150 W、40 kHz超声波提取40 min,用已灭菌的双层纱布过滤,即得生姜提取液原液[6],置于4 ℃冰箱储藏备用。
1.3.3 匍枝根霉体外实验
用无菌水将生姜提取液原液按比例稀释为体积分数25%、50%、100%的生姜提取液并配置相应马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA),以不加入生姜提取液PDA培养基为对照处理(CK),121 ℃灭菌20 min,待PDA培养基冷却至45 ℃左右倒平板备用。
1.3.4 匍枝根霉甘薯活体实验
挑选大小一致,无发芽,破皮少,两端完整的甘薯,先用清水洗净再用质量分数为75%的酒精擦拭表面,晾干后备用。将甘薯随机分成4组,设置3个重复。采用体积分数0%(CK)、25%、50%、100%的生姜提取液浸泡甘薯5 min,处理结束后于室温下自然晾干。然后,用直径3 mm的无菌打孔器在果实赤道部位等距离打3个孔(深3 mm)。4 h后,再分别向每个孔中加入20 μL匍枝根霉孢子悬浮液(1×106 CFU/mL)。待菌液全部吸收后,将甘薯装入塑料筐中,筐外套上PE塑料袋,模拟常温物流环境,置于25 ℃、相对湿度(relative humidity,RH)85%~95%的环境中贮藏,每2 d测定1次指标,每组设置3个重复。
1.4 测定指标
1.4.1 匍枝根霉体外实验指标
1.4.1.1 匍枝根菌丝菌落直径
取1 μL匍枝根霉孢子悬浮液(1×106 CFU/mL)点在配置好的体积分数为25%、50%、100%的生姜提取液PDA平板中,以不含生姜提取液的PDA平板作为对照(CK),待菌液全部吸收后密封平板,置于28 ℃恒温培养箱中倒置培养,采用十字交叉法每隔24 h测定1次菌落直径,每组3个平板。
1.4.1.2 匍枝根霉孢子萌发率和芽管长度
采用凹玻片悬滴法[7]观察生姜提取液对匍枝根霉孢子萌发及芽管生长的影响。将体积分数为25%、50%、100%的生姜提取液分别与1×106 CFU/mL孢子悬浮液等体积混匀,以无菌水和1×106 CFU/mL孢子悬浮液等体积混匀为对照组(CK)。各处理组取40 μL滴加在凹玻片上,置于培养皿中于28 ℃下恒温保湿培养,在显微镜40倍物镜下每24 h观察孢子萌发情况,计算孢子萌发率,并进行显微拍照,同时记录芽管长度,单位为μm。每处理设3个重复,试验重复3次。孢子萌发率参照徐大勇等[8]的方法计算。
1.4.2 匍枝根霉甘薯活体实验(样品取果肉病斑处2 cm内健康组织样品测定)
1.4.2.1 多酚氧化酶(polyphenol oxidase,PPO)活性
参考DONG等[9]的方法,并稍作修改。称取1.0 g甘薯鲜样,加入5.0 mL提取缓冲液,在冰浴条件下将其研磨成匀浆,于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提取液。试管中加入4.0 mL 0.05 mol/L、pH 5.5的乙酸-乙酸钠缓冲液和1.0 mL 0.05 mmol/L邻苯二酚溶液,最后加入100 μL酶提取液。记录在410 nm处的吸光度值变化,测定3 min,重复3次。1个PPO酶活性单位定义为引起1 min吸光度变化0.01的量,用U表示。
1.4.2.2 超氧化物歧化酶(superoxide dismutase,SOD)活性
参考OBERLEY[10]的方法,并稍作修改。称取1.0 g甘薯鲜样,加入5.0 mL提取缓冲液,冰浴研磨成浆,于4 ℃、12 000 r/min离心30 min,收集上清液用于SOD活性测定。采用氮蓝四唑还原法测定SOD的活性,并将在560 nm处的1 min的反应体系产生氯化硝基四氮唑蓝(nitroblue tetrazolium,NBT)还原抑制为50%定义为1个SOD酶活单位(U)。
1.4.2.3 过氧化物酶(peroxidase,POD)活性
参考DONG等[9]方法,并稍作修改。称取1.0 g甘薯鲜样,置于预冷的研钵中,加入5.0 mL提取缓冲液,在冰浴条件下将其研磨成匀浆,于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提取液。往试管中加入3.0 mL 0.025 mol/L愈创木酚溶液和500 μL酶提取液,再加入200 μL 0.5 mol/L H2O2溶液,迅速混合反应。记录在470 nm处的吸光度值变化,测定3 min,重复3次。1个POD酶活性单位定义为引起1 min 吸光度变化0.01的量,用U表示。
1.4.2.4 过氧化氢酶(catalase,CAT)活性
参考曹健康等[11]的方法,并略作修改。称取1.0 g甘薯鲜样,加入5.0 mL提取缓冲液,冰浴研磨成浆,于4 ℃、12 000 r/min离心30 min,收集上清液用于CAT活性测定。往试管中加入100 μL酶液和2.9 mL 0.02 mol/L H2O2,以蒸馏水作参比,测定反应液在240 nm处的吸光度值。1个酶活性单位定义为1 g样品在240 nm波长处引起1 min吸光度变化0.01的量,用U表示。
1.4.2.5 抗环血酸过氧化物酶(ascorbate peroxidase,APX)活性
参考NAKANO等[12]的方法,并略作修改。称取3.0 g甘薯鲜样,加入5.0 mL提取缓冲液,冰浴研磨成浆,于4 ℃、12 000 r/min离心30 min,收集上清液用于APX活性测定。往试管中加入100 μL酶液和2.6 mL反应缓冲液,最后加入300 μL 2 mmol/L H2O2溶液启动酶促反应。测定290 nm处的吸光度值,以1 g样品APX酶促反应体系在波长290 nm处吸光度值降低0.01为一个酶活性单位,单位用U表示。
1.4.2.6 苯丙氨酸解氨酶(phenylalamine ammonia-lyase,PAL)活性
参照LISTER等[13]的方法并略有改进。称取1.0 g甘薯鲜样,置于预冷的研钵中,加入5.0 mL提取缓冲液,在冰浴条件下将其研磨成匀浆,于4 ℃、12 000 r/min离心20 min,收集上清液即为酶提取液,用于PAL活性测定。往试管中加入1 mL酶提取液和1 mL 0.02 mol/L的L-苯丙氨酸溶液,对照管不加底物,再加1 mL蒸馏水,置于37 ℃水浴保温60 min后,加入0.1 mL 6 mol/L HCl溶液以终止反应。再次12 000 r/min离心10 min去除变性蛋白,于290 nm处测定吸光度。以1 g甘薯样品组织1 h在290 nm处吸光度变化0.01为1个酶活单位,用U表示。
1.4.2.7 总酚含量
参照ZHOU等[14]方法,略有改动。取1.0 g甘薯鲜样,加入5 mL预冷的1%(体积分数)HCl-甲醇溶液,在研钵中冰浴研磨成匀浆,再于4 ℃、12 000 r/min条件下离心15 min,收集上清液待用。以1%HCl-甲醇溶液作为空白参比进行调零,于波长280 nm处测定溶液的吸光度值,重复3次。
1.4.2.8 类黄酮含量
参考ZHOU等[14]方法,稍有改动。称取1.0 g甘薯鲜样,加入5 mL预冷的1%HCl-甲醇溶液,在研钵中冰浴研磨成匀浆,再于4 ℃、12 000 r/min条件下离心15 min,收集上清液待用。以1%HCl-甲醇溶液作为空白参比进行调零,于325 nm处测定溶液的吸光度值,重复3次。
1.4.2.9 甘薯软腐病发病率
同一时间每组中已发病甘薯数量与每组甘薯总数的百分比即为该组甘薯该时间软腐病发病率,每组3个平行。
1.5 数据分析
采用Excel 2016进行数据整理,以SPSS 18采用单因素方差分析法进行显著性分析[15],显著水平为0.05,极显著水平0.01。采用Origin 8.6制图。
2 结果与分析
2.1 匍枝根霉体外实验结果分析
2.1.1 不同浓度生姜提取液对匍枝根霉菌丝菌落直径的影响
由图1-a可知,所有处理组匍枝根霉菌落直径的扩展均受到抑制,且随着浓度的增长抑制作用更好。处理组菌落直径显著小于CK组(P<0.05)。其中,100%组在前24 h并未生长。第72 h,各组菌落生长情况如图1-b所示,处理组菌落直径显著小于CK组(P<0.05)。第120 h,CK组匍枝根霉已几乎长满整个培养皿,此时25%、50%、100%(体积分数)处理组菌落直径分别为5.82、4.20、3.36 cm,显著小于CK组(P<0.05)。综上所述,100%生姜处理组对匍枝根霉的生长具有较好的抑制效果。
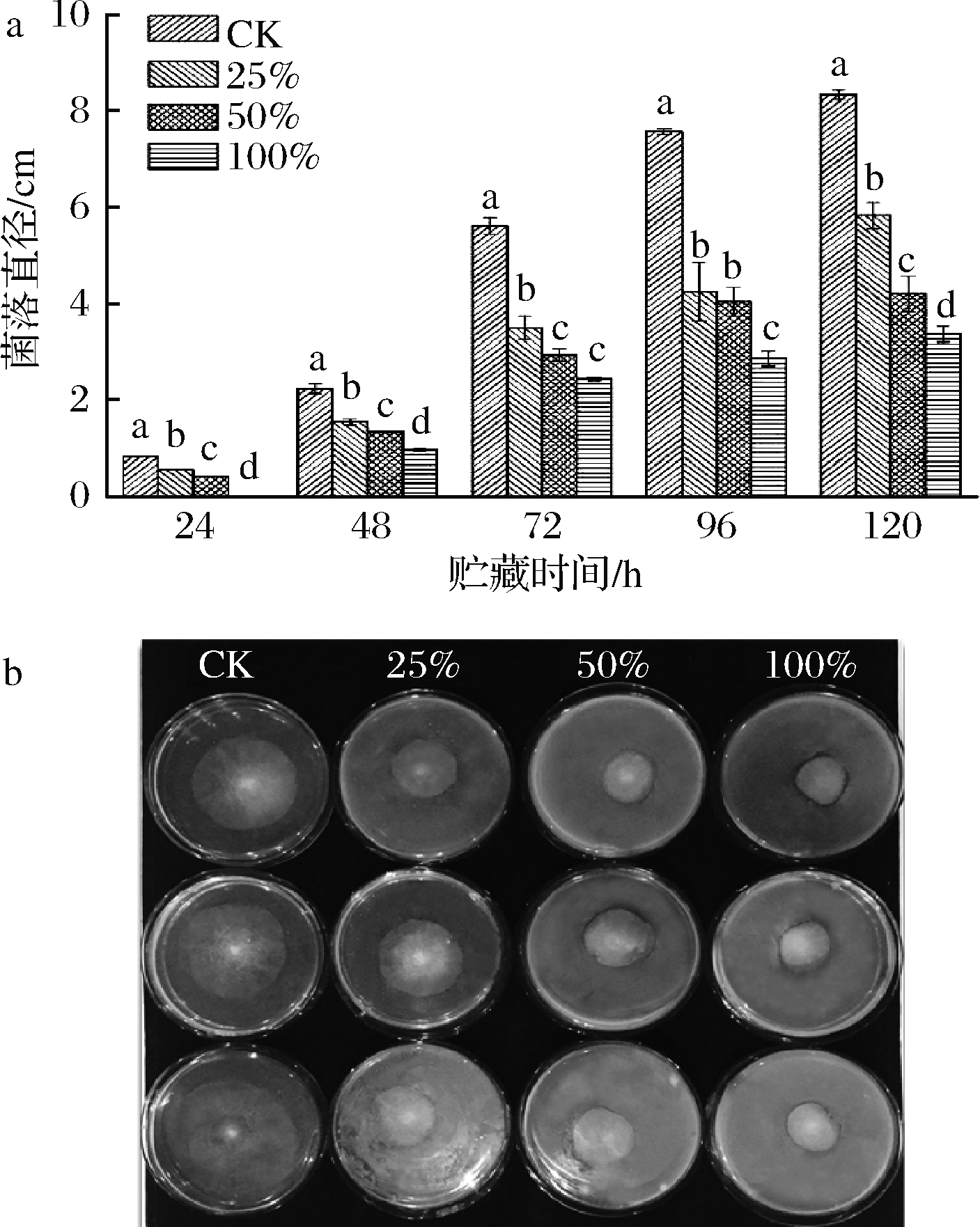
a-不同浓度生姜提取液对匍枝根霉菌落直径的影响;b-不同浓度 生姜提取液PDA平板培养匍枝根霉(72 h)
图1 不同浓度生姜提取液对匍枝根霉菌落生长的影响
Fig.1 Effects of different concentrations of ginger extract on the diameter of R.stolonifer colonies
2.1.2 不同浓度生姜提取液对匍枝根菌丝孢子萌发率的影响
匍枝根霉属于霉菌的一种,孢子是其重要的繁殖方式[16],抑制了孢子的萌发意味着抑制了匍枝根霉的繁衍。如图2所示,各组孢子萌发率随着培养时间的延长而上升,第24 h CK组孢子快速萌发,而处理组萌发率显著低于CK组(P<0.05),100%和50%(体积分数)组无显著差异(P>0.05)。整个培养过程中,CK组的孢子萌发率显著高于处理组(P<0.01),且各处理组之间差异达到极显著水平(P<0.01),100%组孢子萌发率最低。综上,生姜提取液可抑制匍枝根霉属孢子萌发,且100%的生姜提取液效果最好。
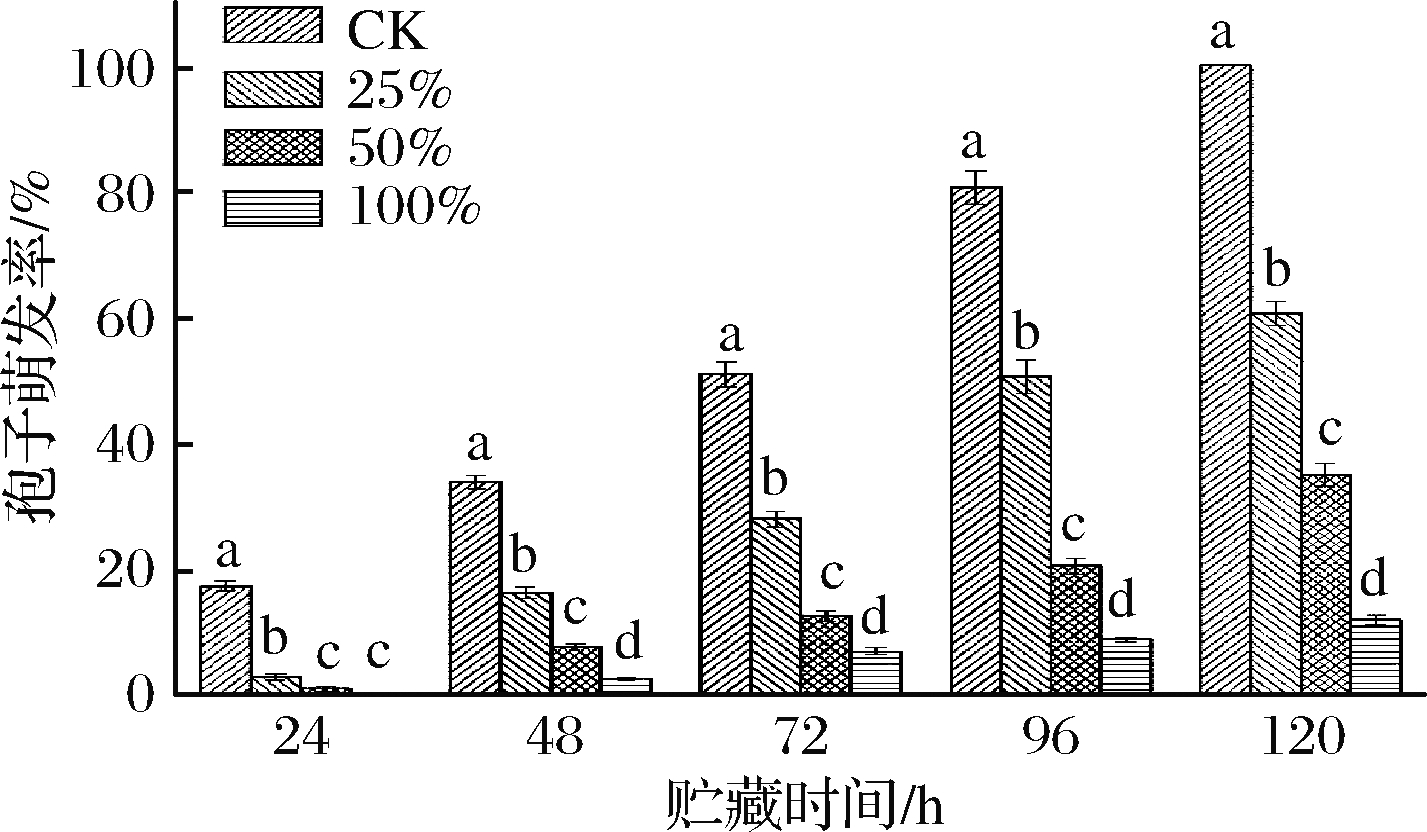
图2 不同浓度生姜提取液对匍枝根霉孢子萌发率的影响
Fig.2 Effects of different concentrations of ginger extract on the germination rate of R.stolonifer spores
2.1.3 不同浓度生姜提取液对匍枝根霉菌丝芽管长度的影响
芽管是指无性孢子萌发时产生的管状结构,是菌丝体的雏形,抑制芽管长度有利于抑制匍枝根霉的繁殖以及菌落的扩大。由图3-a可知,各组孢子芽管长度随着时间的延长不断增长。图3-b为显微镜下培养24 h时各组孢子萌发的情况,可以看出50%和100%(体积分数)组孢子还未萌发,而CK组和25%组芽管已开始生长。到48 h时,CK组芽管长度已达到96.92 μm,且生长速度较处理组快。第120 h时100%组芽管长度仅为32.91 μm,比CK组低4.09倍,与CK组差异极显著(P<0.01)。生姜处理组的芽管长度在整个培养过程中一直显著低于CK组(P<0.05)。综上,生姜提取液处理可以抑制R.stolonifer芽管的伸长,其中100%体积分数的抑制效果最好。
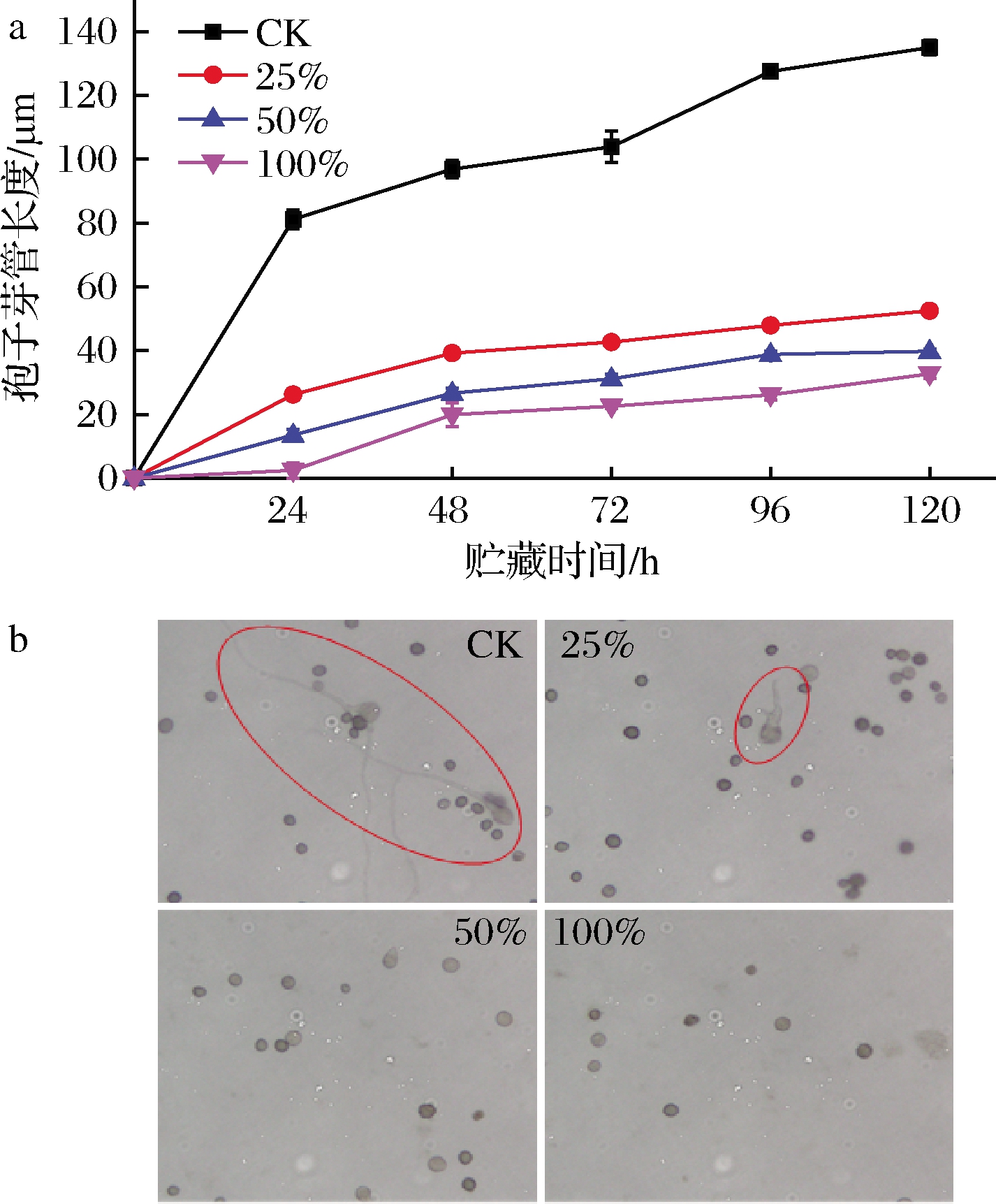
a-不同浓度生姜提取液对匍枝根霉芽管长度的影响; b-24 h不同浓度生姜提取液匍枝根霉芽管生长情况(比例尺50 μm)
图3 不同浓度生姜提取液对匍枝根霉孢子芽管长度的影响
Fig.3 Effects of different concentrations of ginger extract on the length of R.stolonifer mycelial tube
2.2 匍枝根霉甘薯活体实验结果分析
2.2.1 不同浓度生姜提取液处理对甘薯PPO活性的影响
在匍枝根霉侵入时,PPO酶不仅能催化多酚形成抗菌化合物醌类达到抗菌效果[17],还能在果蔬细胞中诱导木质素和木栓素的合成[18];木质素通过增强细胞壁,促进水分运输和防止细胞壁多糖降解来防御病原体的侵染。由图4可知,甘薯PPO活性总体呈上升趋势。0~2 d,各组PPO活性均急速上升,也许是为了抵抗匍枝根霉侵染,也可能是因为打孔时甘薯表皮受到损害。各处理组PPO活性上升速度快于CK组。第4天时,100%组PPO活性极显著高于50%组(P<0.01),而这2个处理组的PPO活性又极显著高于25%组和CK组(P<0.01)。在4~12 d,各组PPO活性都保持在较高水平,趋于稳定。整个物流期间,25%组与CK组之间的差异都不太明显,可能由于生姜提取液体积分数较低,活性物质在甘薯表皮附着少;而100%(体积分数)处理组与CK组之间一直保持着显著差异(P<0.05)。物流结束时,CK、25%、50%、100%组PPO活性分别是最初的2.09、2.27、2.36、3.0倍。总而言之,生姜提取液处理能够诱导甘薯PPO活性的升高。
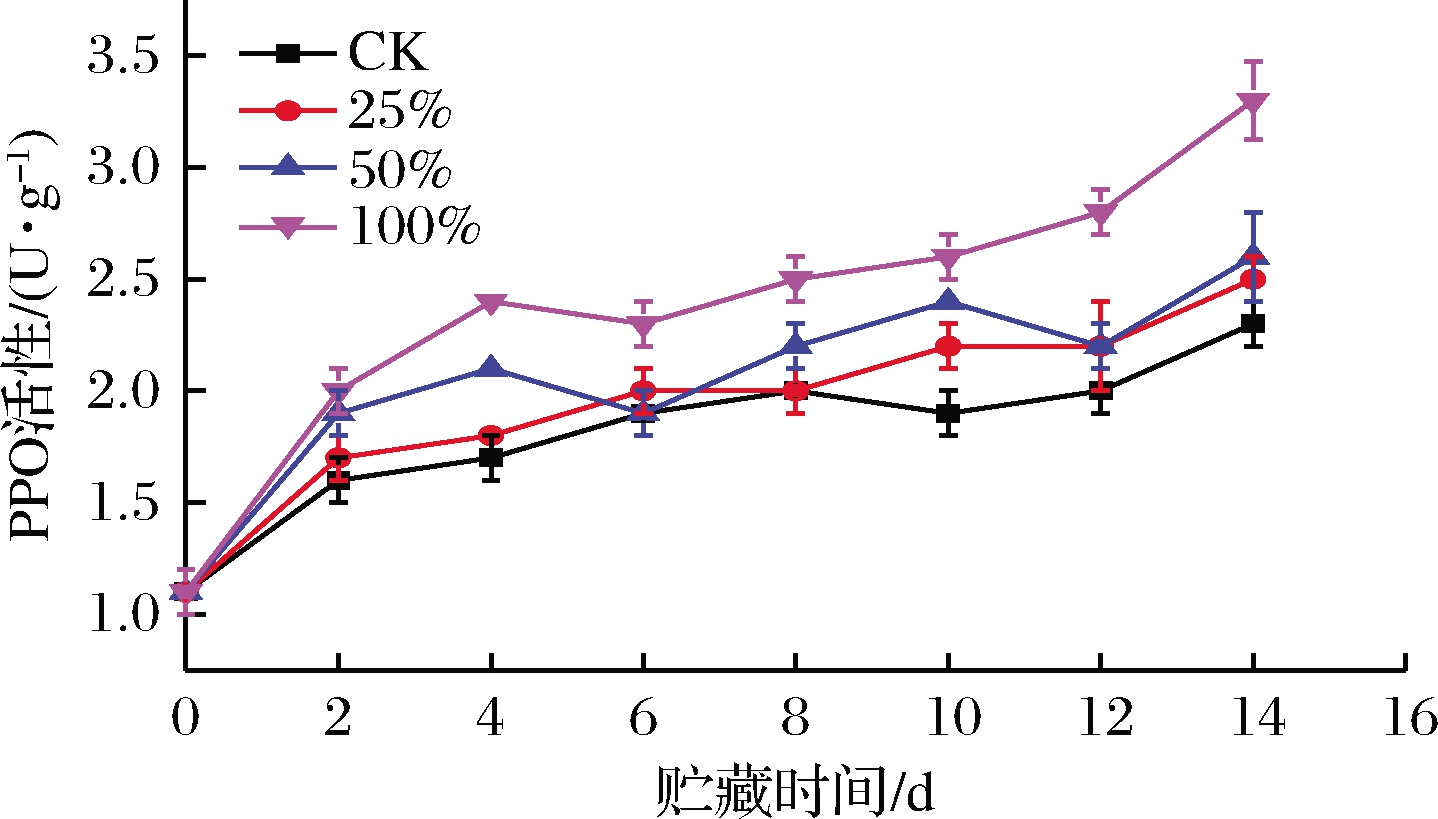
图4 不同浓度生姜提取液处理对甘薯PPO活性的影响
Fig.4 Effect of ginger extract treatment on PPO activity of sweet potato
2.2.2 不同浓度生姜提取液处理对甘薯SOD活性的影响
活化氧的产生可以作为信号,在果蔬-病原体相互作用的早期阶段引发随后的防御相关反应,然而在果蔬发病的后期,活化氧的积累可能导致细胞变性。SOD可以清除果蔬体内的活性氧和自由基,生成H2O2和![]() 从而保护细胞膜结构和功能、延缓腐病菌,包括匍枝根霉对细胞的感染。在甘薯受到匍枝根霉侵染时,SOD活性增强有利于增强甘薯的抗病性。
从而保护细胞膜结构和功能、延缓腐病菌,包括匍枝根霉对细胞的感染。在甘薯受到匍枝根霉侵染时,SOD活性增强有利于增强甘薯的抗病性。
由图5可知,各组甘薯SOD活性前期呈上升趋势,后期保持稳定。0~4 d,甘薯SOD活性升高急促,到第4天,CK、25%、50%、100%(体积分数)处理组SOD活性由最初的6.38 U/g增加至11.99、13.66、14.55、14.22 U/g,处理组显著高于CK组(P<0.05)。第4天后,各组SOD活性保持稳定。100%组和50%组SOD活性在8~12 d差异不大(P>0.05),不过这2组SOD活性都显著高于CK组和25%组(P<0.05)。
总体而言,生姜提取液可以加快甘薯SOD活性的提升,使甘薯更有力地抵抗匍枝根霉的侵染。
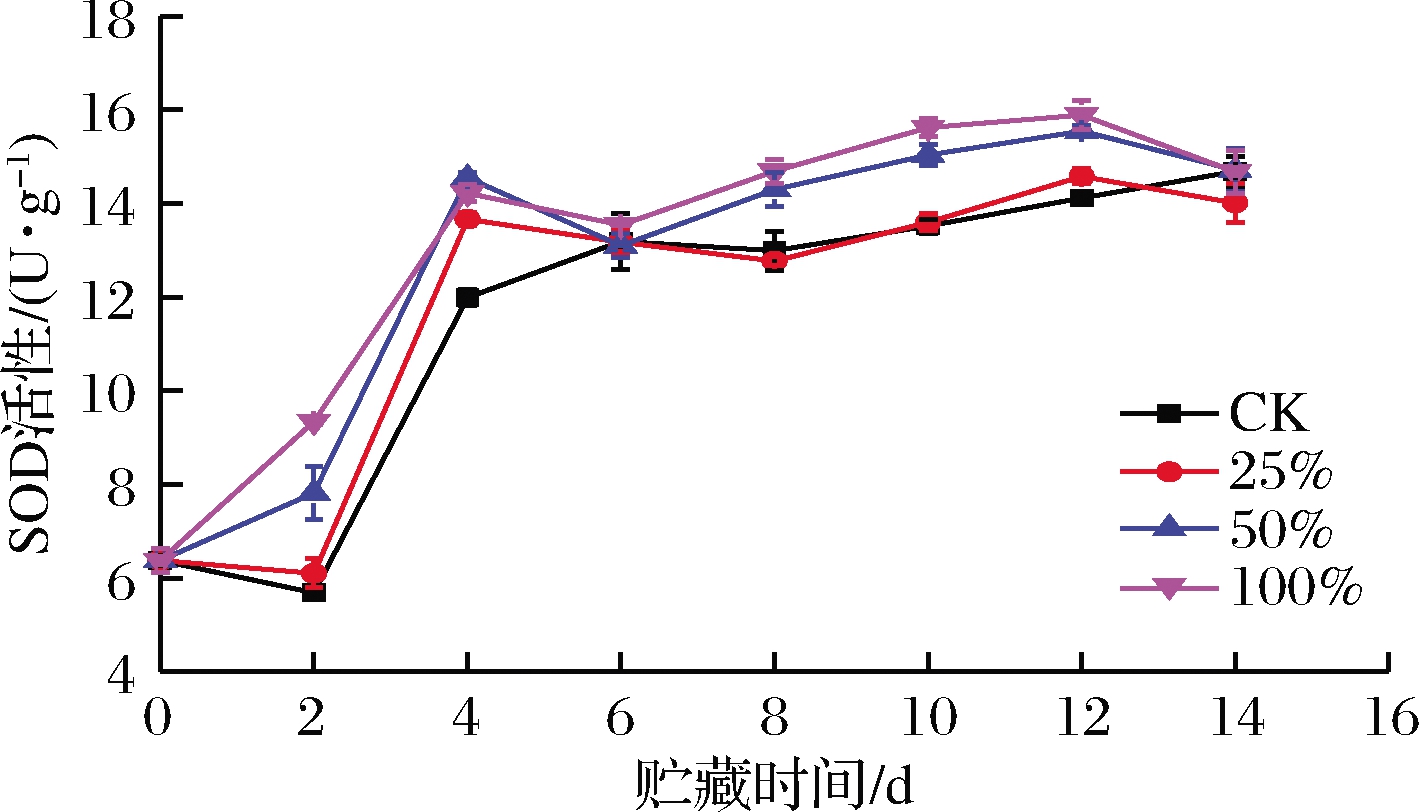
图5 不同浓度生姜提取液处理对甘薯SOD活性的影响
Fig.5 Effect of ginger extract treatment on SOD activity of sweet potato
2.2.3 不同浓度生姜提取液处理对甘薯POD活性的影响
POD涉及多种代谢过程,主要包括生长素分解代谢,逆境胁迫耐受性反应,细胞壁蛋白的交联,以及肉桂醇在木质素和木栓质形成聚合之前的氧化[20]。从细胞壁水平的单木质醇聚合到涉及自由基生成的机制,木质化形成过程的多个层次都有POD的参与。
如图6所示,各组甘薯POD活性都随着时间的延长表现出先上升后下降的趋势。0~6 d,各组POD活性大幅上升,可能是由于微生物侵染以及打孔时对甘薯表面造成了破坏,POD活性上升以形成木质化防御结构。各组在0~4 d 无显著差异(P>0.05),表明生姜提取液处理在物流前期对甘薯POD活性影响不大。各组POD活性在第6天到达峰值,100%组与50%组显著高于25%组和CK组(P<0.05)。第6天后,POD活性开始下降,100%组和50%组的POD活性在6~12 d显著高于CK组(P<0.05)。直到物流结束时,100%组还极显著高于其他3组(P<0.01)。由此,可知,在物流后期生姜提取液处理能够有效抑制甘薯POD活性的降低,其中100%组最佳。
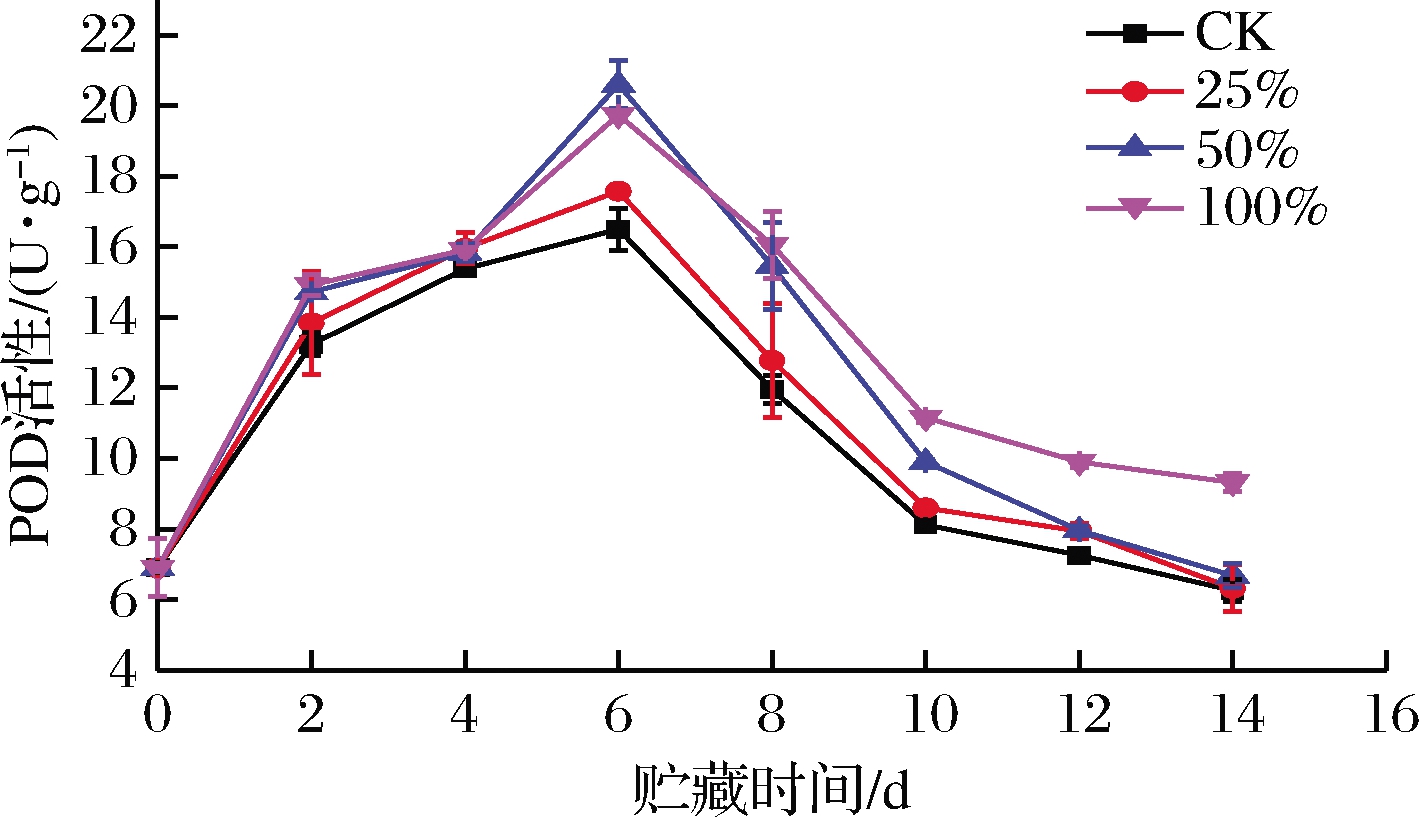
图6 不同浓度生姜提取液处理对甘薯POD活性的影响
Fig.6 Effect of ginger extract treatment on POD activity of sweet potato
2.2.4 不同浓度生姜提取液处理对甘薯CAT活性的影响
CAT和APX是负责在植物氧化胁迫期间清除H2O2的主要酶[21],CAT通过将果蔬体内的H2O2分解为水和分子氧来达到清除效果。如图7所示,甘薯CAT活性不断降低。第2天时, CK、25%、50%、100%(体积分数)处理组CAT活性较初始值分别下降了7.18%、15.30%、17.90%、23.42%。0~14 d,处理组CAT活性一直显著低于CK组(P<0.05),并且生姜提取液处理体积分数越高,CAT活性越低;其中,100%组CAT活性最低,显著低于其余3组(P<0.05),而25%组与50%组差别不大。CAT活性的降低有利于H2O2的累积,JIN等[22]研究表明MeJA降低了桃果实的CAT活性,提高了桃果实中H2O2水平,并猜测H2O2的累积可能是果实抗病机制的一部分,能够提高果实的抗病性。综上可知,生姜提取液处理能够降低甘薯CAT活性,且体积分数越高,活性越低。

图7 不同浓度生姜提取液处理对甘薯CAT活性的影响
Fig.7 Effect of ginger extract treatment on CAT activity of sweet potato
2.2.5 不同浓度生姜提取液处理对甘薯APX活性的影响
APX能催化抗坏血酸与H2O2发生氧化还原反应,使H2O2被分解清除[23]。如图8所示,甘薯APX活性波动下降。CK组APX活性在0~2 d 就上升了29.88%,而3个处理组则有小幅下降,这可能是由于没有经过任何处理的甘薯在匍枝根霉侵染时,在甘薯细胞间隙产生的H2O2首先扩散到胞质溶胶中,其中细胞溶质中的APX进行定位,然后才进入CAT范围内,并因为细胞溶质中的APX对H2O2的亲和力高于CAT,间接诱导了APX活性的提升。0~6 d,处理组APX活性显著低于CK组(P<0.05)。8~14 d,100%组显著低于CK组和25%组(P<0.05),50%组的APX活性除第10天外也显著低于CK组(P<0.05)。由上可知,甘薯接种匍枝根霉后,生姜提取液处理能够降低甘薯APX活性。KIM等[24]和LEE等[25]研究得出APX活性的降低有助于果蔬体内H2O2的增加,H2O2能够促进细胞壁的木质化,增强细胞壁结构,对病原菌侵染起到防御作用。
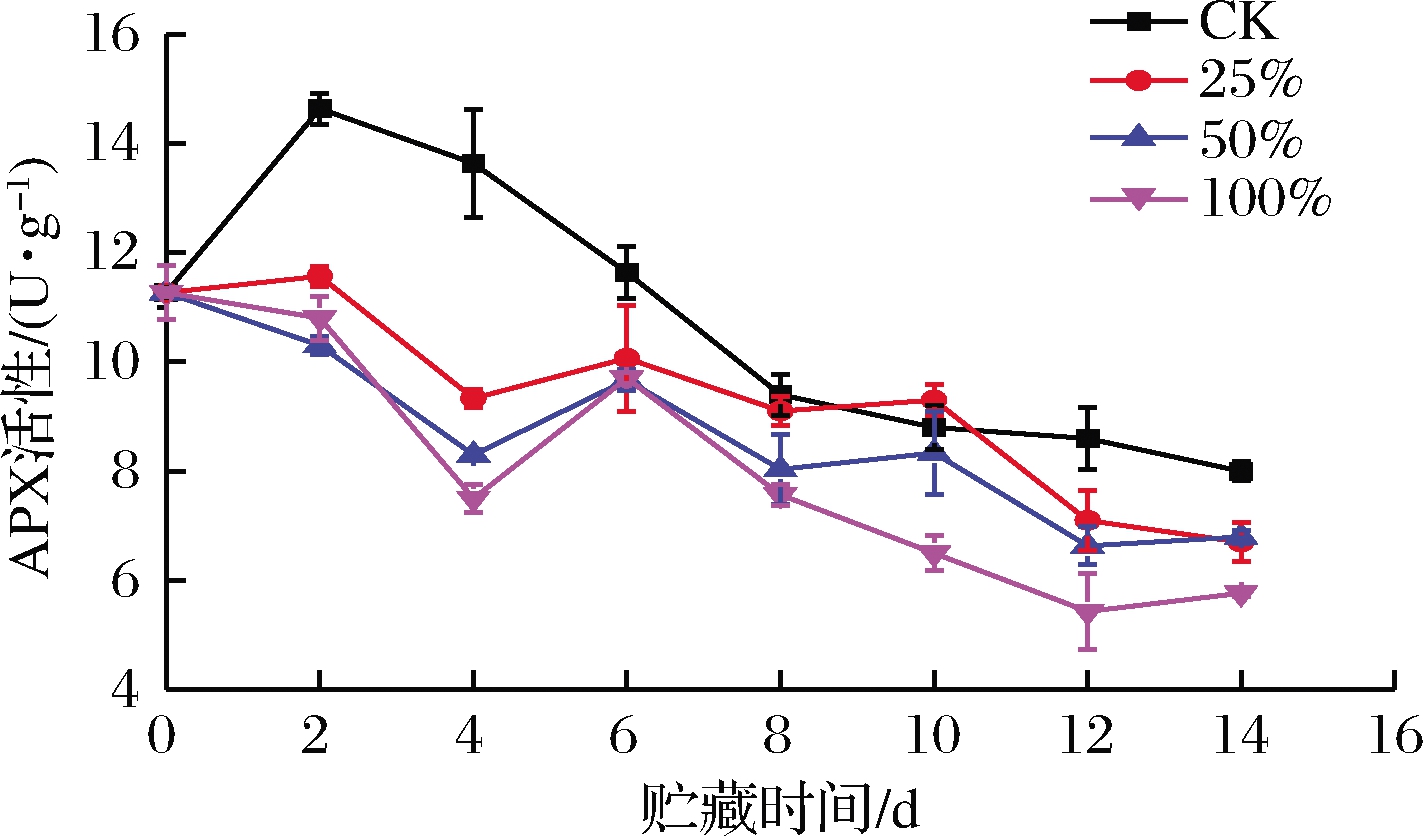
图8 不同浓度生姜提取液处理对甘薯APX活性的影响
Fig.8 Effect of ginger extract treatment on APX activity in sweet potato
2.2.6 不同浓度生姜提取液处理对甘薯PAL活性的影响
PAL酶催化L-苯丙氨酸并同时生成酚类物质[26]。有研究表明 PAL作为总酚、类黄酮等抗菌物质的合成途径,在匍枝根霉侵染时活性增强以保护甘薯免受病原菌的侵染[27]。由图9可知,各组甘薯PAL活性先上升后下降。0~4 d,各组PAL活性持续增加,处理组增长速度较CK组快,第4天时处理组PAL活性极显著高于CK组(P<0.01),表明生姜提取液处理能够提升甘薯PAL活性。6 d 后,PAL活性开始降低,但是100%组仍保持较高水平,100%组和50%组极显著高于CK组(P<0.01)。25%组与CK组在0~12 d 差异不显著(P>0.05),表明25%(体积分数)的生姜提取液处理对甘薯PAL活性影响不大。综上,50%和100%(体积分数)生姜提取液处理能够快速提升PAL活性,并延缓PAL活性的下降。这与生姜提取液在胡萝卜的防腐研究中的结果相似[28]。CHANDRA等[29]研究得出PAL的反应产物反式肉桂酸提供苯丙烷骨架,其用作木质素生物合成的构建亚单位,并表明PAL的激活是与果蔬抗病性相关的一般反应。
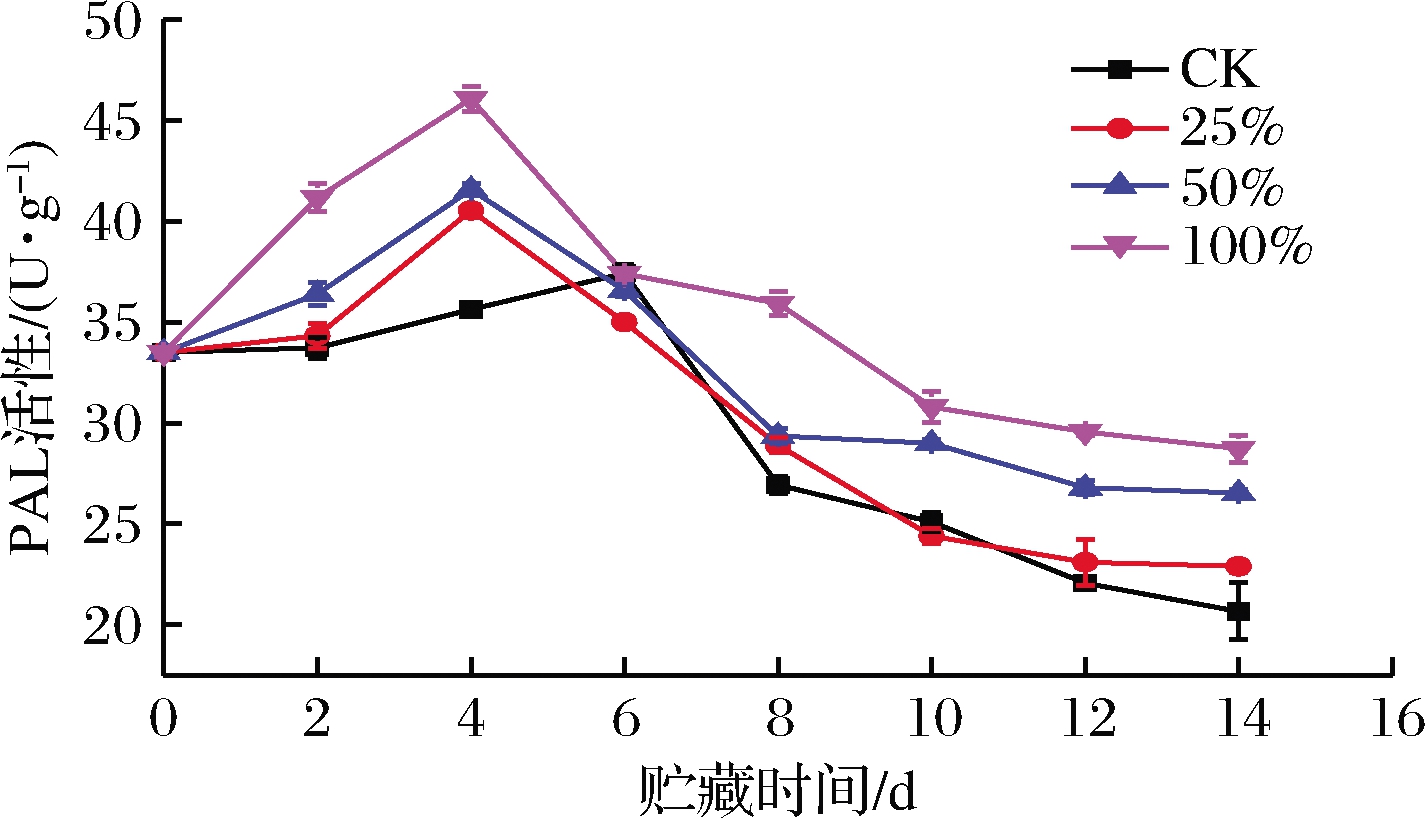
图9 不同浓度生姜提取液处理对甘薯PAL活性的影响
Fig.9 Effect of ginger extract treatment on PAL activity of sweet potato
2.2.7 不同浓度生姜提取液处理对甘薯总酚含量的影响
酚类物质能够抵御病原菌的侵害[30]。由图10可知,各组甘薯总酚含量总体呈先上升后下降的趋势。0~2 d,50%组和100%组总酚含量极显著高于CK组和25%组(P<0.01),这是因为生姜提取液中含有大量的酚类化合物[30],也有可能是在前2 d CK组和25%组的PAL活性受到抑制。4~6 d 各组总酚含量均上升,在第6天达到最大值,CK组、25%组、50%组和100%组分别从最初0.57 μg/g增加至1.39、1.45、1.49、1.62 μg/g,100%组显著高于CK组(P<0.05)。6 d后,总酚含量开始下降,可能是因为第6天后,各组PAL活性均迅速降低,而PPO酶活却保持上升趋势。8~14 d,100%组总酚含量最高,在10~14 d处理组显著高于CK组(P<0.05)。总而言之,相对于处理组而言,生姜提取液处理能够保持甘薯较高的总酚含量以抵御病原菌的侵入。
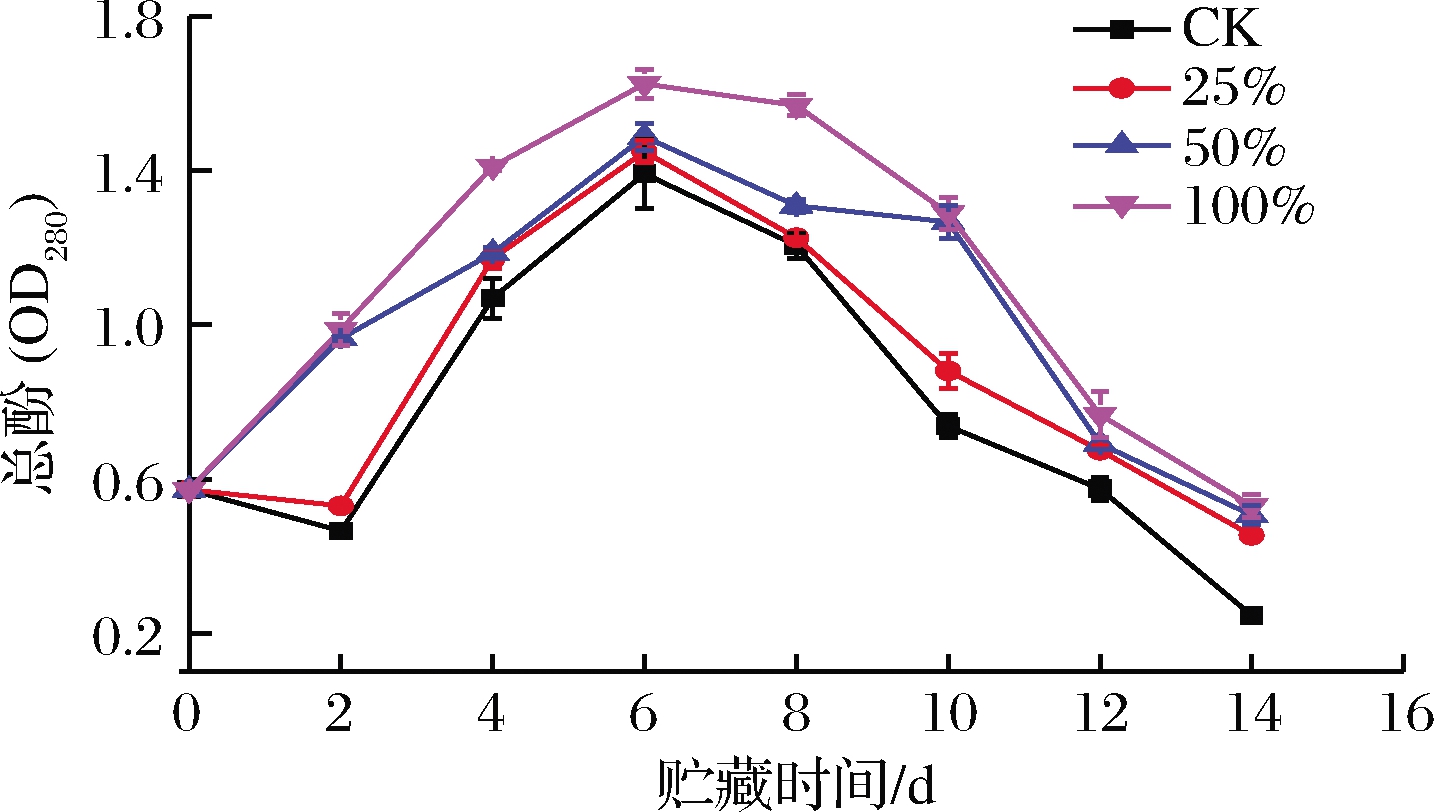
图10 不同浓度生姜提取液处理对甘薯总酚含量的影响
Fig.10 Effect of ginger extract treatment on total phenol content in sweet potato
2.2.8 不同浓度生姜提取液处理对甘薯类黄酮含量的影响
类黄酮是多酚化合物的亚组之一[32],具有抗氧化能力以及抗菌活性。如图11所示,各组类黄酮含量先上升后下降。0~2 d,各组类黄酮含量快速上升,且生姜提取液体积分数越高,上升速度越快。2~6 d CK组、25%组和50%组类黄酮含量变化不大,100%组显著上升,表明高浓度生姜提取液有益于类黄酮化合物的积累,原因可能是高浓度生姜提取液能在此期间显著提高PAL活性。第6天时,3个处理组之间差异极显著(P<0.01)。第6天过后,各组类黄酮含量开始下降。整个过程(除第12天),100%组类黄酮含量均显著高于其他3组(P<0.05),50%组次之,25%组效果较差。结果表明,生姜提取液处理能够快速提升甘薯类黄酮含量,且体积分数越高,效果越好。
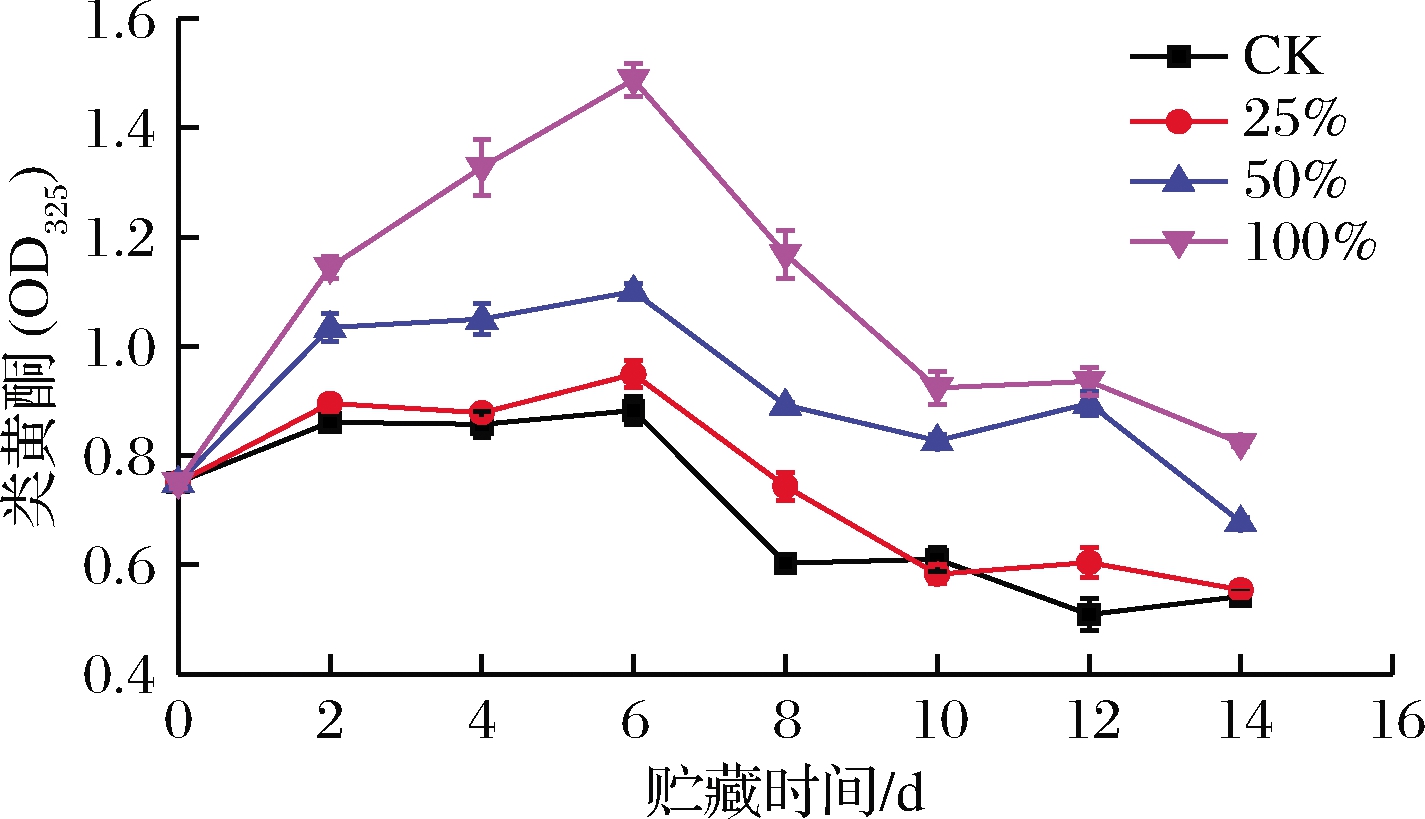
图11 生姜提取液处理对甘薯类黄酮含量的影响
Fig.11 Effect of ginger extract treatment on flavonoids content in sweet potato
2.2.9 不同浓度生姜提取液处理对甘薯类软腐病发病率的影响
由图12可知,CK组在第2天开始发病,此时处理组均未发病。第4天,25%组、50%组开始发病,100%组未见发病,处理组发病率均显著低于CK组(P<0.05)。100%组在第6天开始发病,发病率为3.33%,此时CK组发病率高达46.67%。第12天,CK组甘薯全部发病,25%组、50%组和100%组的发病率分别为60.00%、30.00%、13.33%,4个组之间存在极显著差异(P<0.01),表明生姜提取液能够延缓甘薯软腐病的发作,且延缓效果与生姜提取液的体积分数成正比。
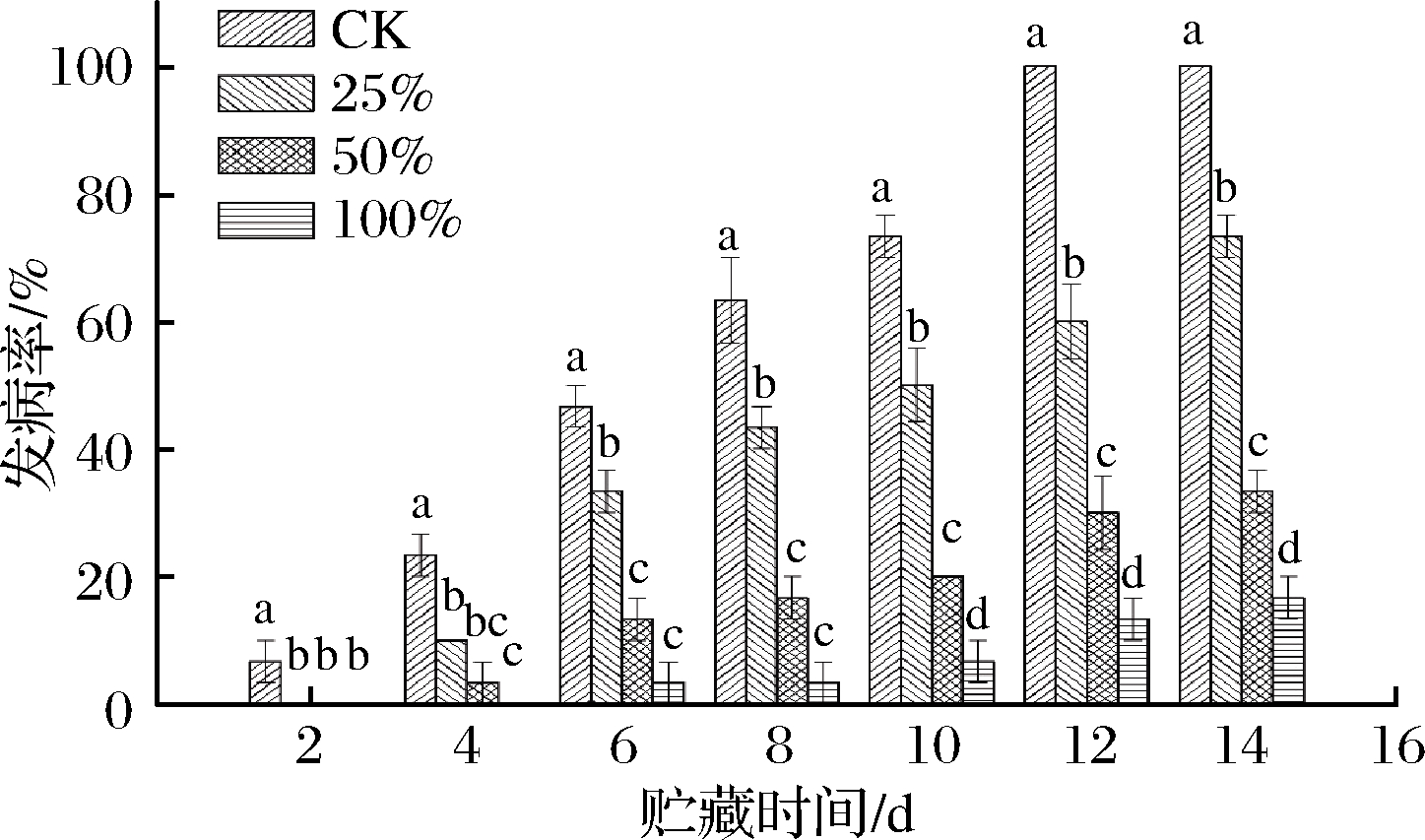
图12 不同浓度生姜提取液对甘薯软腐病发病率的影响
Fig.12 Effect of ginger extract on the incidence of sweet potato soft rot
3 结论
甘薯软腐病是由真菌病原体匍枝根霉引起的,是影响甘薯常温物流的重要病害之一。本文使用体积分数为0%、25%、50%、100%生姜提取液对匍枝根霉进行体外和甘薯活体实验。结果表明体外培养试验中生姜提取液处理对常温时匍枝根霉的菌丝生长、孢子的萌发以及孢子芽管的生长均有抑制作用,且效果与体积分数呈正比;活体实验中生姜提取液处理能够提高常温物流条件下甘薯SOD酶活同时抑制CAT、APX活性,有利于H2O2积累,阻止匍枝根霉的侵染,PPO、POD活性得到增强以促进细胞形成木质化屏障,较高的PAL活性则提高了总酚和类黄酮含量,从宏观上看生姜提取液能有效降低常温物流条件下甘薯软腐病发病率且没有异味残留。实验结果表明生姜提取液不仅可以直接抑制匍枝根霉生长,还能通过调节甘薯的生理变化抵御匍枝根霉侵染,且随着生姜提取液体积分数的提高,效果更佳。
[1] MUKHOPADHYAY S K, CHATTOPADHYAY A, CHAKRABORTY I, et al. Crops that feed the world 5. Sweetpotato. Sweetpotatoes for income and food security[J]. Food Security, 2011, 3(3):283-305.
[2] BARTLEY J P, JACOBS A L. Effects of drying on flavour compounds in Australian-grown ginger (Zingiber officinale)[J]. Journal of the Science of Food and Agriculture, 2000, 80(2): 209-215.
[3] 耿彤, 吴晓磊, 王志伟. 姜活性成分6-姜酚药代动力学研究进展[J]. 药学研究, 2017, 36(4):231-235.
[4] SINGH R, RAI B. Antifungal potential of some higher plants against Fusarium udum causing wilt disease of Cajanus cajan[J]. Microbios, 2000, 102(403):165-173.
[5] SAHI S T, HABIB A, GHAZANFAR M U, et al. In vitro evaluation of different fungicides and plant extracts against Botryodiplodia theobromae, the causal agent of quick decline of mango[J]. Pakistan Journal of Phytopathology, 2012, 24(2): 137-142.
[6] 唐彬. 麻辣鸡块冷链物流过程中品质变化及控制技术研究[D].重庆:西南大学,2018.
[7] 方中达. 植病研究方法[M]. 北京:农业出版社, 1979.
[8] 徐大勇, 李峰. 番茄灰霉病拮抗内生放线菌的筛选、鉴定及其活性评价[J]. 生态学杂志, 2012, 31(6):1 461-1 467.
[9] DONG H, CHENG L, TAN J, et al. Effects of chitosan coating on quality and shelf life of peeled litchi fruit[J]. Journal of Food Engineering, 2004, 64(3):355-358.
[10] OBERLEY L W. Nitroblue Tetrazolium[M]. Handbook of Methods for Oxygen Radical Research, 1985: 217-220.
[11] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 北京:中国轻工业出版社, 2007.
[12] NAKANO Y,ASADA K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach cholorplasts[J].Plant and cell Physiology,1981,22(5):867-880.
[13] LISTER C E, LANCASTER J E, WALKER J R L. Developmental changes in enzymes of flavonoid biosynthesis in the skins of red and green apple cultivars[J]. Journal of the Science of Food and Agriculture, 1996, 71(3):313-320.
[14] ZHOU Y, DENG L, ZENG K. Enhancement of biocontrol efficacy of Pichia membranaefaciens by hot water treatment in postharvest diseases of citrus fruit[J]. Crop Protection, 2014, 63:89-96.
[15] 谌小立, 黄先静, 杨旭芹, 等. 三种食用油对红酸汤烹调中全反式番茄红素含量影响研究[J]. 中国调味品, 2019, 44(3):97-100.
[16] 谭伟, 杜金华.二氧化氯在巨峰葡萄表面杀灭匍枝根霉效果的研究[J].现代食品科技,2006,22(2):64-66.
[17] LI B, DING Y, TANG X, et al. Effect of L-arginine on maintaining storage quality of the white button mushroom(Agaricus bisporus)[J]. Food and Bioprocess Technology, 2019, 12(4): 563-574.
[18] 蒋选利, 李振岐, 康振生. 过氧化物酶与植物抗病性研究进展[J]. 西北农林科技大学学报(自然科学版), 2001, 29(6):124-129.
[19] 程曦, 张敏, 傅阳,等. 减压贮藏对双孢菇保鲜品质的影响[J]. 食品与机械, 2016, 32(8):110-114.
[20] PASSARDI F, COSIO C, PENEL C, et al. Peroxidases have more functions than a Swiss army knife[J]. Plant Cell Reports, 2005, 24(5): 255-265.
[21] SHIGEOKA S, ISHIKAWA T, TAMOI M, et al. Regulation and function of ascorbate peroxidase isoenzymes[J]. Journal of Experimental Botany, 2002, 53(372): 1 305-1 319.
[22] JIN P, ZHENG Y, TANG S, et al. Enhancing disease resistance in peach fruit with methyl jasmonate[J]. Journal of the Science of Food and Agriculture, 2009, 89(5): 802-808.
[23] XANTHAKIS E, GOGOU E, TAOUKIS P, et al. Effect of microwave assisted blanching on the ascorbic acid oxidase inactivation and vitamin C degradation in frozen mangoes[J]. Innovative Food Science & Emerging Technologies, 2018, 48: 248-257.
[24] KIM Y H, KIM C Y, SONG W K, et al. Overexpression of sweetpotato swpa4 peroxidase results in increased hydrogen peroxide production and enhances stress tolerance in tobacco[J]. Planta, 2008, 227(4): 867-881.
[25] LEE D H, LEE C B. Chilling stress-induced changes of antioxidant enzymes in the leaves of cucumber: In gel enzyme activity assays[J]. Plant Science, 2000, 159(1): 75-85.
[26] BARBOSA CANOVAS G V, HENDRICKX M, KNORR D. Innovative food science and emerging technologies[J]. Innovative Food Science & Emerging Technologies, 2000, 1(1):1.
[27] 张洪翠,李云云,靳苗苗,等.乙醇熏蒸对双孢菇保险品质的影响[J].食品与发酵工业,2018,44(6):187-194.
[28] OJAGHIAN M R, WANG L, CUI Z Q, et al. Antifungal and SAR potential of crude extracts derived from neem and ginger against storage carrot rot caused by Sclerotinia sclerotiorum[J]. Industrial Crops and Products, 2014, 55: 130-139.
[29] CHANDRA A, SAXENA R, DUBEY A, et al. Change in phenylalanine ammonia lyase activity and isozyme patterns of polyphenol oxidase and peroxidase by salicylic acid leading to enhance resistance in cowpea against Rhizoctonia solani[J]. Acta Physiologiae Plantarum, 2007, 29(4):361-367.
[30] 赵梅. 梨果实对炭疽病和轮纹病抗性生理的研究[D].南京:南京农业大学,2013.
[31] STOILOVA I, KRASTANOV A, STOYANOVA A, et al. Antioxidant activity of a ginger extract (Zingiber officinale)[J]. Food Chemistry, 2007, 102(3):764-770.
[32] 李静,赵海峰. 多酚类化合物的主要食物来源[J]. 卫生研究, 2017, 46(1):169-173.