人口老龄化是20世纪以来全球社会经济发展面临的严峻挑战,我国人口老龄化速度是发达国家的2倍[1]。预计到2040年,我国平均每3个人中就有1位60岁以上老人,如此庞大的老年群体的健康不容忽视[2]。人到老年时期,脏器、消化腺、胃肠蠕动减弱[3],较高的蛋白质摄入有利于维持老年机体健康[4],各个国家都建议老年人每日膳食蛋白量应大于推荐量,且优质蛋白质比例应尽可能达到50%[5]。一般认为,动物蛋白利用率更高,营养价值更好[6]。牛肉蛋白因其蛋白含量高、脂肪含量低、易消化吸收,是适合老年人食用的健康蛋白食物。但高蛋白饮食对老年人肾脏、肝脏有毒副作用,并刺激老年人肠道产生应激反应[7],增加老年人机体负担。通过营养调控维持肠道免疫处于最佳水平是保证肠道健康、减少疾病、降低经济损失的重要手段[8-10]。全肠道病理切片能够连续性观察肠道不同位置的形态结构、黏膜形态变化,对比不同肠段之间的形态和病变差异,观察病理变化所在区域和大小,具有较好的对比性和可靠性。高蛋白饮食对全肠道组织结构及肠道中的蛋白酶活性有何影响还未见报道。
实验室前期研究发现桑叶粉与魔芋粉复配协同作用可促进肠道蠕动[11-13],调节肠道微生物菌群[14-15],增强机体免疫力[16]。同时,钟耕等[17]的研究也证实了该复配粉能够有效帮助消费者改善对重庆火锅等高蛋白、高脂饮食的消化性。因此,本研究从动物肠道内环境结构入手,采用全肠道切片观察技术,就复配粉对高牛肉蛋白饮食肠道健康的影响进行探索,为复配粉在改善肠道健康,尤其是老年肠道健康方面提供科学参考。
1 材料与方法
1.1 材料与试剂
桑叶粉,河南省卢氏县百瑞蚕茶有限公司,超细粉,100%过300目筛,水分质量分数≤5%,总膳食纤维质量分数52.9%,其中可溶性膳食纤维质量分数7.9%;魔芋粉(符合NY/T 494—2010中纯化魔芋微粉标准),重庆康佳客食品公司,葡甘聚糖质量分数>90%;按照实验室前期实验结果复配m(桑叶粉)∶m(魔芋粉)=1∶1;鲜牛里脊,重庆永辉超市沙坪坝店。
30只无特殊病原15月龄BALB/c小鼠,雌性,合格证号SCXK(渝)2018-0003。所有实验用鼠均购于重庆医科大学实验动物中心,于西南大学药学院实验动物中心SPF级屏障动物实验室饲养。
100 g/L中性甲醛固定液、中性树脂,国药集团化学试剂有限公司;PBS盐酸缓冲液,北京中杉金桥生物技术有限公司;二甲苯,天津致远化学试剂有限公司;苏木素,珠海贝索生物技术有限公司,以上试剂均为分析纯。小鼠胰蛋白酶ELISA酶检测试剂盒、小鼠肠肽酶ELISA检测试剂盒,上海扶生实业有限公司;其余为实验室常用化学试剂,均为分析纯。
1.2 仪器与设备
徕卡-2016转轮式切片机,德国徕卡集团有限公司; TSJ-Ⅱ型全自动封闭组织脱水机、BMJ-Ⅲ包埋机、PHY-Ⅲ病理组织漂烘仪,常州市中威电子仪器有限公司;BA400 Digital数码三目摄像显微镜,麦克奥迪实业集团有限公司;Image-Pro Plus 6.0图像软件分析仪,美国Media Cybernetics 公司; RT-6100酶标仪,美国Rayto公司。
1.3 试验方法
1.3.1 牛肉蛋白粉的制备
牛肉蛋白粉的制备参照SONG等[18]的方法,并略作修改。将新鲜牛里脊肉剔除可见结缔组织后切割成一定块状大小,于沸水中煮制脱脂,待牛肉全熟后沥水,50 ℃烘箱中干燥脱水,经粉碎过80目筛,收集筛下物,密封低温保存备用。水分质量分数1.02%,蛋白质质量分数93.50%。
1.3.2 饲料的配制
参照美国营养学会AIN-93M饲料配方,用牛肉蛋白粉替代部分玉米淀粉制备蛋白质质量分数为50%以上的高蛋白饲料,保持饲料能量一致,由南通特洛菲饲料科技有限公司特制。
1.3.3 动物分组及干预
小鼠适应性喂养1周后随机分为6组,每组5只,分别为阴性对照组(negative control group,NC),空白对照组(blank control group,BC)、阳性对照组(positive control group,PC)、高剂量组(high dose group, HD)、中剂量组(middle dose group, MD)和低剂量组(low dose group, LD)。NC组饲喂AIN-93M标准日粮,其他各组饲喂高牛肉蛋白日粮,全部自由进食,每日定时灌胃。其中,PC组灌胃江中消食片0.36 g/kg,HD组灌胃复配粉0.3 g/kg,MD组灌胃复配粉0.15 g/kg,LD组灌胃复配粉0.075 g/kg,NC组和BC组分别灌胃同等剂量的生理盐水。动物实验室温度为(23±1)℃,湿度为(53±2)%,每天光照12 h。饲养4周,期间定期更换垫料和水。实验期间定期对各鼠称重并记录体重,密切观察各鼠一般情况,每天观察大便性状。
1.3.4 样品收集
试验周期结束后,小鼠禁食过夜12~14 h,颈椎脱臼处死。完整收集小肠、大肠,用40 g/L多聚甲醛固定,用于肠道形态切片观察。完整收集各脏器,用于脏器指数测定。收集空肠内容物,用于酶活性的测定。
1.3.5 脏器指数计算
根据小鼠脏器质量和体重,按照公式(1)计算各脏器指数[19]。
脏器指数![]()
(1)
式中:脏器总质量,g;体重,g。
1.3.6 小肠、大肠切片观察
固定组织经全自动脱水机脱水、包埋、切片后按如下步骤操作:
切片脱蜡至水,苏木精染色10~20 min,自来水冲洗1~3 min,盐酸酒精分化5~10 s,自来水冲洗1~3 min,放入50 ℃的温水中返蓝,直到出现蓝色为止。自来水冲洗1~3 min,放入85%(体积分数)的酒精3~5 min,伊红染色3~5 min,水洗3~5 s,梯度酒精脱水,二甲苯透明,中性树胶封固,镜检。
以上标本均按病理检验标准作业程序(standard operation procedure,SOP)程序进行。采用三目摄像显微摄像系统对切片进行图像采集,每张切片于40倍下观察全部组织,选择要测量的区域并采集100倍图片待测。
1.3.7 酶活性的测定
肠道内容物酶活性的测定参照试剂盒方法。
1.3.8 数据统计与分析
实验结果以均值±标准偏差表示,用Excel 2010数据计算,用Statistix 9单因素方差分析。
2 结果与分析
2.1 对小鼠体重的影响
如表1所示,实验期间各组小鼠进食正常,毛皮色泽和活动情况未见异常。
表1 灌胃4周后各组小鼠体重变化情况 单位:g
Table 1 Weight changes of mice in each group after 4 weeks of gavage
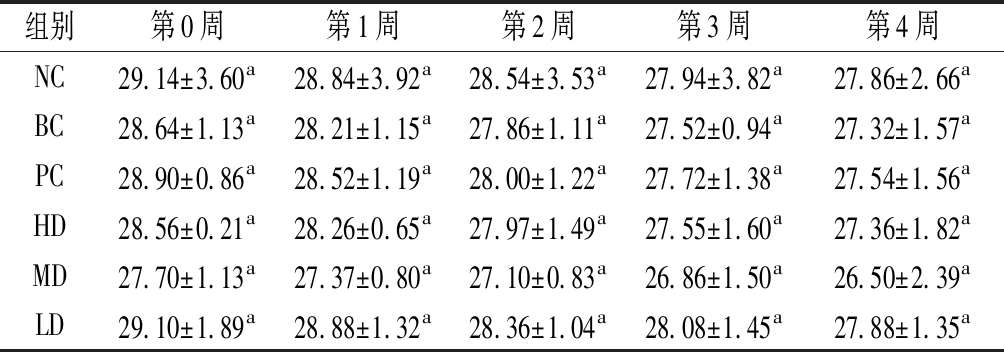
组别第0周第1周第2周第3周第4周NC29.14±3.60a28.84±3.92a28.54±3.53a27.94±3.82a27.86±2.66aBC28.64±1.13a28.21±1.15a27.86±1.11a27.52±0.94a27.32±1.57aPC28.90±0.86a28.52±1.19a28.00±1.22a27.72±1.38a27.54±1.56aHD28.56±0.21a28.26±0.65a27.97±1.49a27.55±1.60a27.36±1.82aMD27.70±1.13a27.37±0.80a27.10±0.83a26.86±1.50a26.50±2.39aLD29.10±1.89a28.88±1.32a28.36±1.04a28.08±1.45a27.88±1.35a
注:同一行中不同右上标小写字母表示存在显著性差异(P<0.05)(下同)
从小鼠体重测定结果可知,随着饲喂时间的延长,小鼠体重均呈下降趋势,可能是老年鼠处于生理衰退期,加之魔芋葡甘聚糖有一定的减重作用[20],但体重变化量无显著性差异。
2.2 对小鼠脏器指数的影响
心、肝、脾、肺、肾是动物体内重要的免疫中心和代谢器官,脏器指数是实验动物某脏器的质量与体重的比值,是衡量机体生长状况的重要指标,也是毒理实验中常用的指标,正常时脏器指数比较恒定[15]。本研究中,高蛋白膳食组小鼠与NC组各脏器指数无显著性差异,小鼠各脏器指数的质量变化不显著。表明各实验组饮食方式对实验动物机体没有毒副作用。
表2 高牛肉饲料对小鼠脏器指数的影响 单位:%
Table 2 Effect of high beef feed on organ index of mice
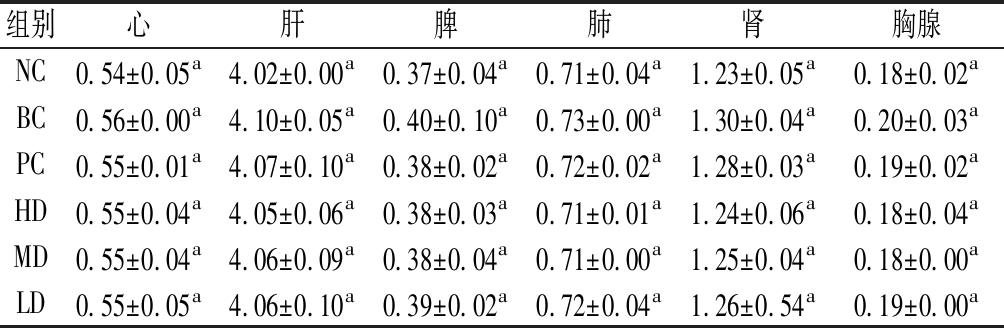
组别心肝脾肺肾胸腺NC0.54±0.05a4.02±0.00a0.37±0.04a0.71±0.04a1.23±0.05a0.18±0.02aBC0.56±0.00a4.10±0.05a0.40±0.10a0.73±0.00a1.30±0.04a0.20±0.03aPC0.55±0.01a4.07±0.10a0.38±0.02a0.72±0.02a1.28±0.03a0.19±0.02aHD0.55±0.04a4.05±0.06a0.38±0.03a0.71±0.01a1.24±0.06a0.18±0.04aMD0.55±0.04a4.06±0.09a0.38±0.04a0.71±0.00a1.25±0.04a0.18±0.00aLD0.55±0.05a4.06±0.10a0.39±0.02a0.72±0.04a1.26±0.54a0.19±0.00a
2.3 对小肠形态的影响
小肠是食物消化与吸收的主要场所,分十二指肠、空肠、回肠,肠绒毛是黏膜上皮中柱状细胞游离面的细微突起,皱襞、绒毛和微绒毛的存在,极大地扩大了小肠黏膜的面积[21]。
由图1可知,NC组小鼠十二指肠黏膜层肠绒毛结构完整,黏膜表面被覆单层柱状上皮,固有层内管状肠腺结构清晰,间质内未见明显炎细胞浸润及纤维增生。黏膜下层疏松结缔组织内可见血管和神经,肌层及外膜无炎细胞浸润,其他亦未见明显病理变化。BC组部分肠绒毛萎缩,上皮脱落,固有层内部分肠腺萎缩坏死,其他未见明显病理变化。PC组、HD组、MD组及LD组无病理变化,与NC组无差异。

a-NC组;b-BC组;c-PC组;d-HD组;e-MD组;f-LD组
图1 对老年鼠十二指肠组织形态的影响(200×)
Fig.1 Effect on duodenal tissue morphology of old mice
注:图b中↑表示上皮脱落(图2同)
由图2可知,NC组小鼠空肠黏膜层肠绒毛结构完整,杯状细胞数量正常,固有层内管状肠腺结构清晰,其他亦未见明显病理变化。BC组黏膜层、黏膜下层、肌层和浆膜层分层较清晰,少量黏膜上皮脱落,其他未见明显病理变化。PC组、HD组、MD组及LD组与NC组无显著性差异。
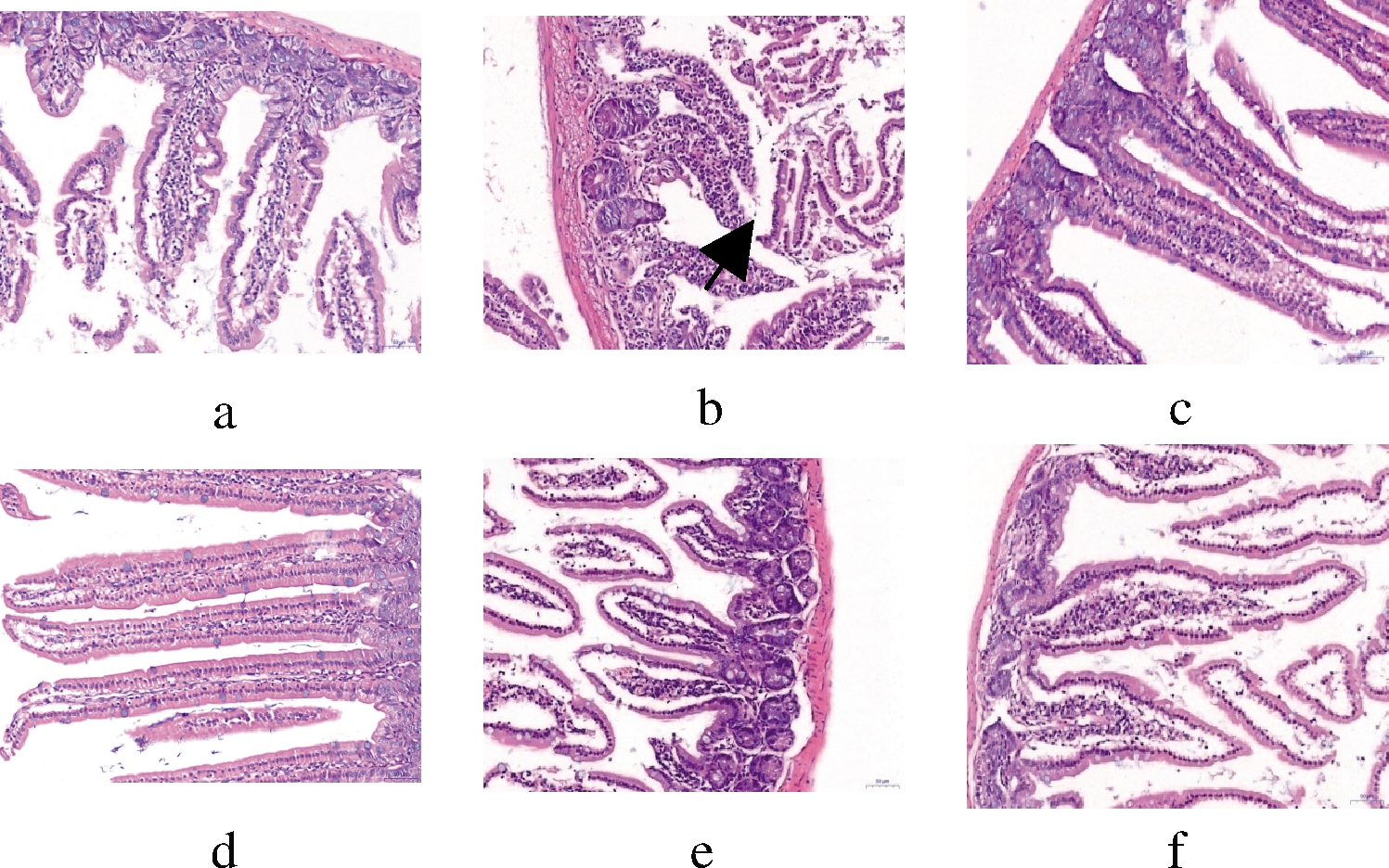
a-NC组;b-BC组;c-PC组;d-HD组;e-MD组;f-LD组
图2 对老年鼠空肠组织形态的影响
Fig.2 Effect on jejunal morphology of old mice
由图3可知,NC组回肠黏膜层肠绒毛结构、黏膜上皮完整,固有层内管状肠腺结构清晰,其他未见明显病理变化。BC组回肠绒毛黏膜层结构基本完整,少量肠绒毛断裂,黏膜上皮脱落,其他未见明显病理变化。PC组回肠黏膜层肠绒毛结构完整,偶见少量黏膜上皮细胞脱落,其他未见明显病理变化。HD组、MD组、LD组与NC组无显著性差异。
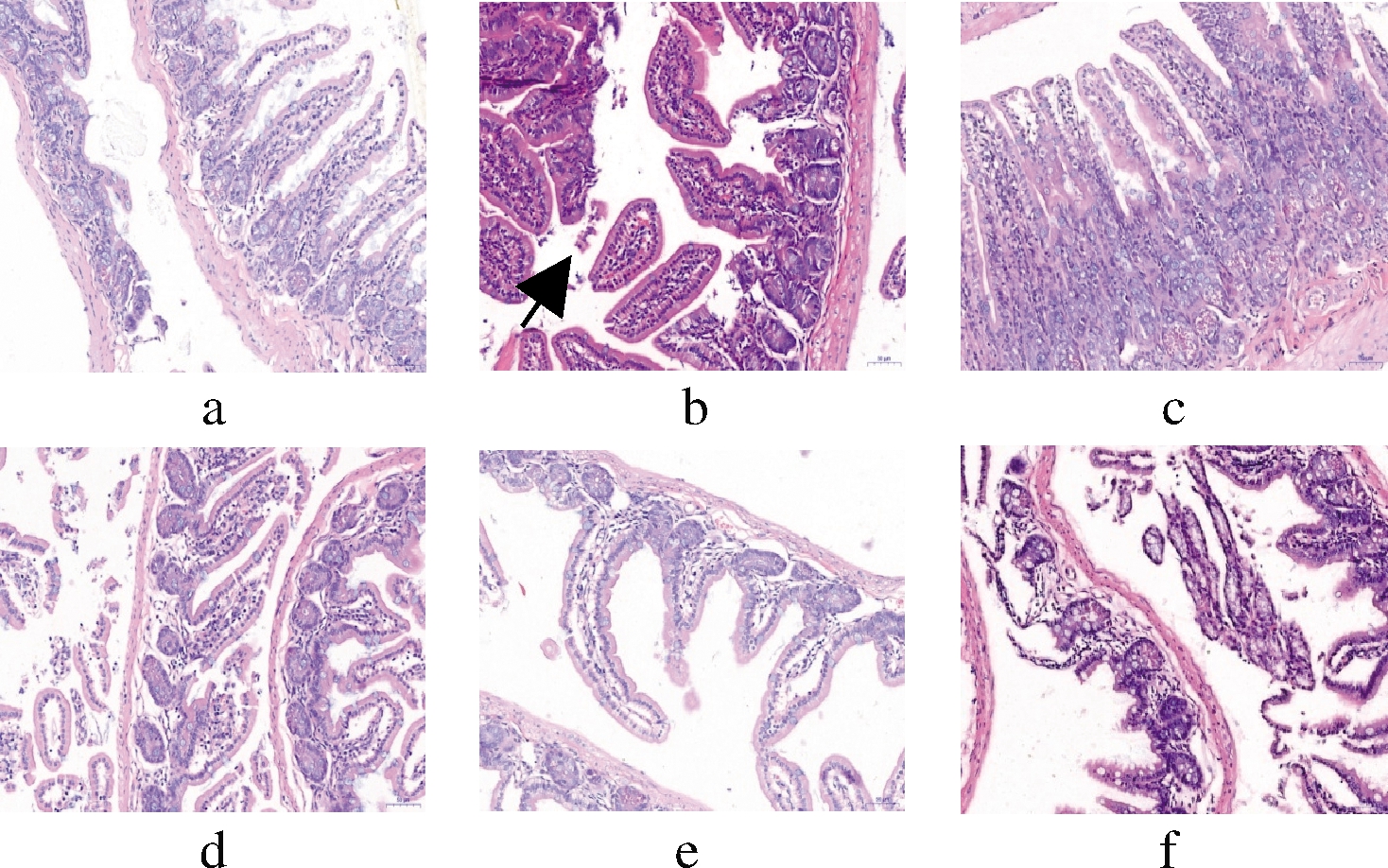
a-NC组;b-BC组;c-PC组;d-HD组;e-MD组;f-LD组
图3 对老年鼠回肠组织形态的影响
Fig.3 Effect on ileum morphology of old mice
注:图b中↑表示绒毛断裂
由老年鼠小肠(十二指肠、空肠、回肠)切片观察可知高牛肉蛋白饮食会导致肠绒毛断裂、萎缩、上皮脱落、固有层内部分肠腺萎缩坏死,而复配粉和消食片均能改善老年鼠高牛肉蛋白饮食对小肠造成的伤害,未见明显病理变化。
小肠表面积的大小直接反映小肠吸收功能,绒毛和隐窝的形态特征是反映上皮细胞的成熟及吸收功能最常用指标,绒毛越长、隐窝越浅,肠道消化吸收营养物质的能力越强[22]。绒毛高度(V)/隐窝深度(C)值是小肠功能状态的一种反应,V/C值与黏膜状态成正比[23]。由表3可知,灌胃复配粉组小肠组织各项指标较BC组显著较优(P<0.05),特别是HD组绒毛高度和肌层厚度显著性大于NC组(P<0.05),V/C值与NC组差异不显著。可能是因为牛肉蛋白中谷氨酸、精氨酸含量较高,谷氨酸含量达30 000 mg/kg,而谷氨酸能够显著改善小肠的吸收功能[24],精氨酸可提高小肠绒毛高度和空肠麦芽糖酶活性,降低隐窝深度,使小肠形态结构与吸收功能得到改善[22]。并且,复配粉中的魔芋粉可促进肠道蠕动[16],魔芋胶可对肠道壁形成保护膜,具有肠道益生性[14]。因此,复配粉能够提高小肠各项指标性能,维持肠道屏障的完整性,改善高牛肉蛋白饮食对老年鼠小肠造成的伤害,保护肠道结构,且呈量效关系。
表3 小肠组织测定结果
Table 3 The results of small intestine tissue
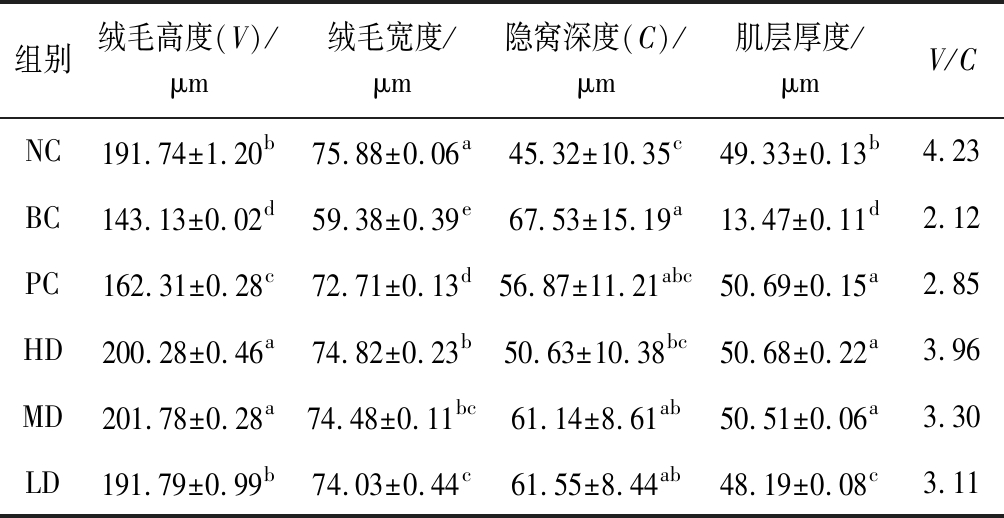
组别绒毛高度(V)/μm绒毛宽度/μm隐窝深度(C)/μm肌层厚度/μmV/CNC191.74±1.20b75.88±0.06a45.32±10.35c49.33±0.13b4.23BC143.13±0.02d59.38±0.39e67.53±15.19a13.47±0.11d2.12PC162.31±0.28c72.71±0.13d56.87±11.21abc50.69±0.15a2.85HD200.28±0.46a74.82±0.23b50.63±10.38bc50.68±0.22a3.96MD201.78±0.28a74.48±0.11bc61.14±8.61ab50.51±0.06a3.30LD191.79±0.99b74.03±0.44c61.55±8.44ab48.19±0.08c3.11
2.4 对老年鼠大肠组织形态的影响
大肠包括盲肠、结肠和直肠,主要功能是吸收水分、无机盐,并进行纤维素的发酵和分解。大肠黏膜包括黏膜上皮、黏膜下层、肌层、外膜[21]。
由图4可知,各组小鼠盲肠结构较完整,黏膜表面被覆柱状上皮且光滑无绒毛,固有层内大肠腺排列较为密集,肌层结构完整清晰,浆膜层完整,其他未见明显病理改变。
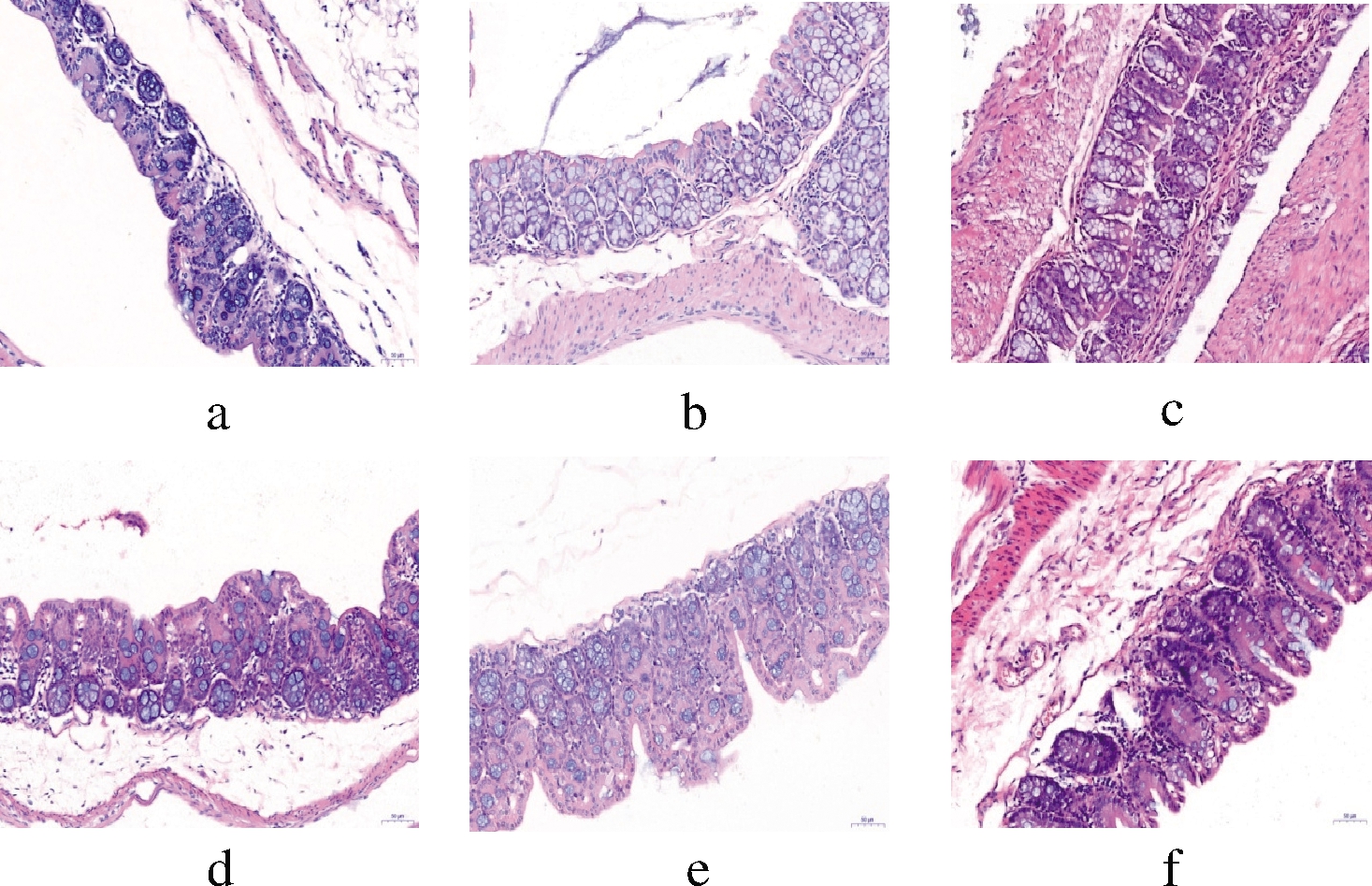
a-NC组;b-BC组;c-PC组;d-HD组;e-MD组;f-LD组
图4 对高牛肉蛋白饮食老年鼠盲肠组织形态的影响(200 ×)
Fig.4 Effect of high beef protein diet on the cecum morphology of old mice
由图5可知,NC组小鼠结肠黏膜层柱状上皮细胞形态正常,固有层内大肠腺排列较为密集,杯状细胞数量正常,肌层肌纤维结构完整清晰,浆膜层完整,其他未见明显病理改变。BC组黏膜层厚度不均一,部分黏膜上皮缺失,少量肠腺萎缩,局部固有层内炎细胞浸润,主要为淋巴细胞;其他未见明显病理变化。PC组、HD组、MD组及LD组与NC组无显著性差异。
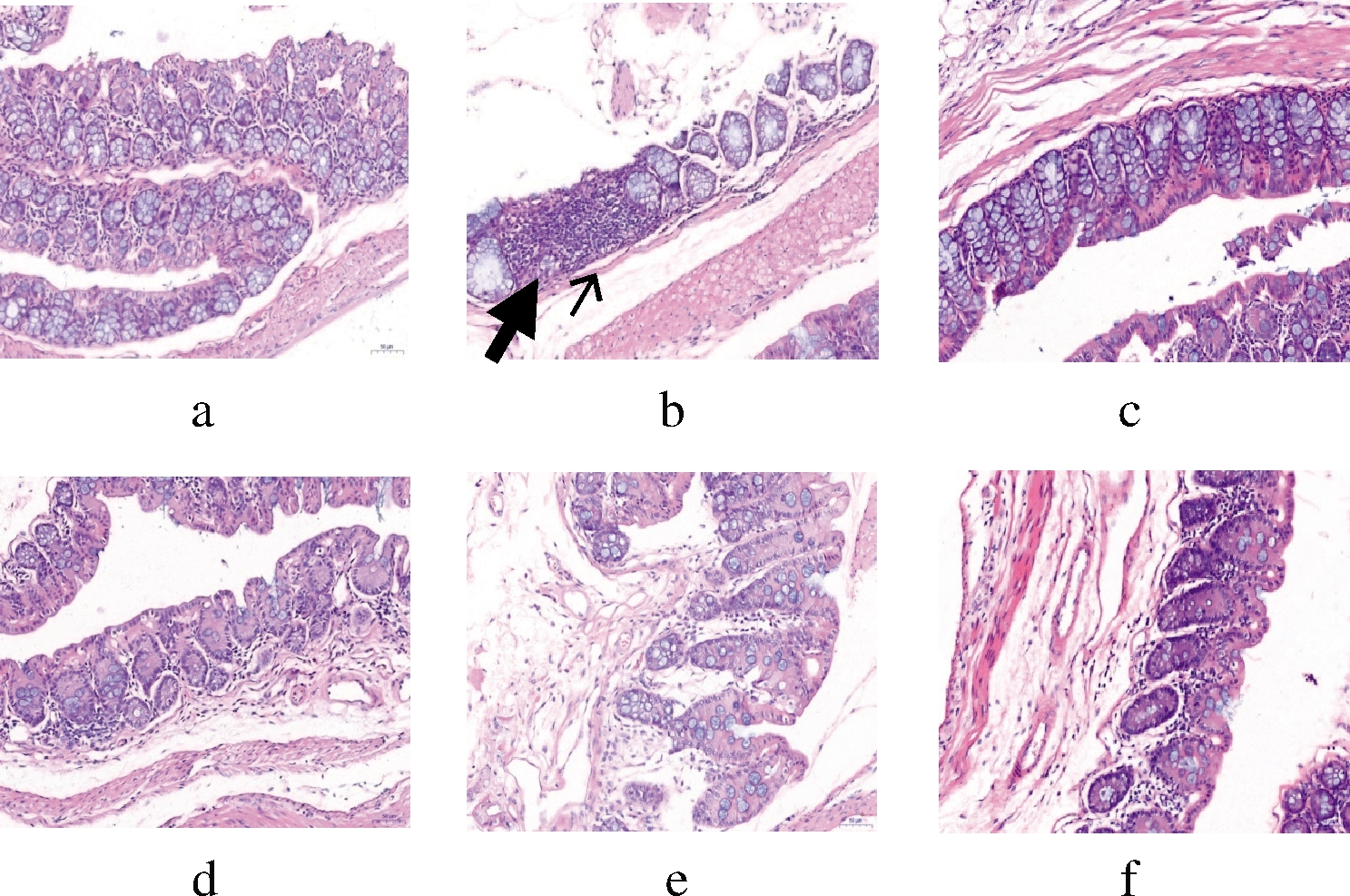
a-NC组;b-BC组;c-PC组;d-HD组;e-MD组;f-LD组
图5 对高牛肉蛋白饮食老年鼠结肠组织形态的影响(200×)
Fig.5 Effect of high beef protein diet on colonic morphology of old mice
注:图b中↑表示炎细胞浸润, 表示肠腺萎缩
表示肠腺萎缩
由图6可知,各组小鼠直肠结构较完整,固有层内大肠腺结构完整清晰,黏膜下层、肌层及浆膜层完整,其他未见明显病理改变。

a-NC组;b-BC组;c-PC组;d-HD组;e-MD组;f-LD组
图6 对高牛肉蛋白饮食老年鼠直肠组织形态的影响(200×)
Fig.6 Effect of high beef protein diet on the rectum morphology of old mice
高蛋白饮食降低肠道内短链脂肪酸的产生,提高氨、苯酚、硫化氢浓度,可引起结肠炎,也影响肠道神经系统和肠动力,继而引发感染和肿瘤的形成[22-23]。通过对老年鼠大肠(盲肠、结肠、回肠)切片观察说明高蛋白饮食对老年鼠结肠存在一定的伤害,这与前人的研究结果一致。复配粉能促进高蛋白饮食老年鼠大肠肠道健康,可能是因为蛋白质消化主要发生在小肠,而大肠参与部分蛋白质消化,且主要靠微生物发酵作用分解蛋白质[14, 25]。
2.5 对蛋白质消化酶活性的影响
小肠是蛋白质消化的主要部位[25-26],蛋白质在小肠内消化主要依赖胰腺分泌的各种蛋白酶,包括内肽酶(胰蛋白酶、糜蛋白酶和弹性蛋白酶)和外肽酶(氨基肽酶和羧基肽酶)[27]。本研究选取在蛋白质消化中起主要作用的胰蛋白酶、肠肽酶,其活性测定结果如表4所示。
表4 各组小鼠肠道酶活性 单位:U/g
Table 4 Intestinal enzyme activity of mice in each group
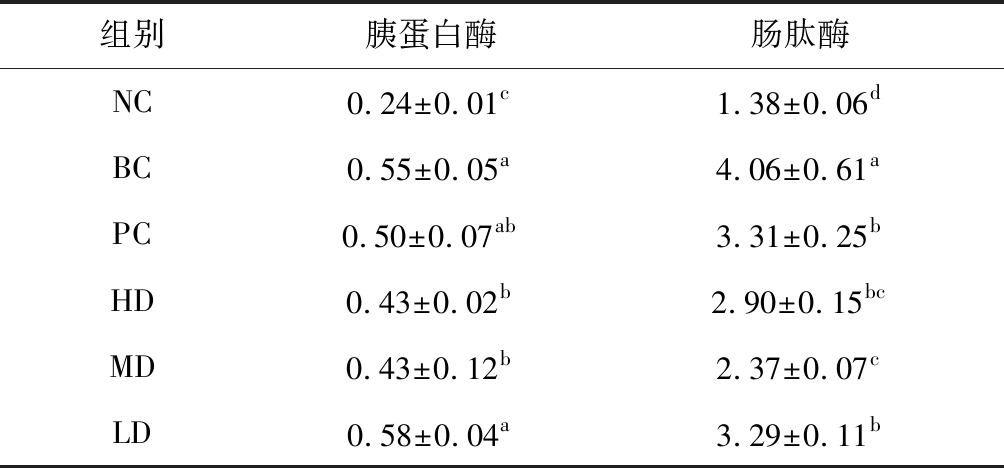
组别胰蛋白酶肠肽酶NC0.24±0.01c1.38±0.06dBC0.55±0.05a4.06±0.61aPC0.50±0.07ab3.31±0.25bHD0.43±0.02b2.90±0.15bcMD0.43±0.12b2.37±0.07cLD0.58±0.04a3.29±0.11b
消化酶活性的高低是反映机体消化机能的重要生理指标[28-29],在一定范围内,随着日粮蛋白质水平的提高,动物胃蛋白酶、肠道、肝脏胰蛋白酶活性均显著上升[30-31]。由表4可知,随着高蛋白饮食的摄入,胰蛋白酶和肠肽酶活性显著上升,是NC组的1倍以上,说明老年鼠摄入高蛋白,对消化酶活性具有一定的激活作用,这与前人的研究结果一致。虽然由2.3得出高蛋白饮食对小肠组织有一定的不利影响,但不影响肠道蛋白酶活性。而灌胃复配粉后,酶活性有降低趋势,特别是HD组和MD组,胰蛋白酶和肠肽酶活性显著降低,说明复配粉的灌胃对蛋白质消化有显著性影响,并呈现剂量关系。有研究表明,当蛋白质摄入量在一定范围内升高,动物能通过自身机体调节酶活性以适应消化相应的蛋白水平,当蛋白质含量超过消化器官承载负荷后,会对消化酶的分泌产生负反馈调节[30-31],并且由2.3得出,复配粉对高牛肉蛋白饮食老年鼠肠道形态变化有修复作用。因此,酶活性降低的原因可能是复配粉的灌胃使得肠道结构改善,消化吸收能力变强,也可能是复配粉的灌胃使得肠道微生物菌群发生变化,促进了蛋白质的消化吸收[32],使得食物中蛋白质的浓度降低,使机体诱导蛋白质消化酶的活性适应性降低。小肠蛋白酶活性变化可能与小肠所处的状态和食物的种类密切相关。
3 结论
复配粉对高牛肉蛋白饮食老年鼠肠道形态变化有修复作用,起到保护肠道结构的功能。其改善机理有待进一步研究。
高蛋白饮食能刺激老年鼠肠道内的蛋白质消化酶活性显著上升,而复配粉能够降低机体蛋白质消化酶的活性,其降低机理有待进一步研究。
[1] 向运华,王晓慧.国内老年健康的研究现状与反思——基于CNKI的文献计量分析[J].华中科技大学学报(社会科学版),2019,33(5):20-27.
[2] 陈铮,李小鹰,杨爱民,等.关于《老年医院建设和管理标准》的建议[J].中华老年医学杂志,2018,37(10):1 065-1 068.
[3] 陈宪泽,汪婷婷,黄靖,等.老年群体健康管理与长期照护一体化模式研究[J].锦州医科大学学报(社会科学版), 2019,17(4):14-17.
[4] BAUER J M,BIOLO G,CEDERHOLM T,et al.Evidence-based recommendations for optimal dietary protein intake in older people:A position paper from the PROT-AGE study group[J].Journal of the American Medical Directors Association,2013,14(8):542-559.
[5] 中华人民共和国国家卫生和计划生育委员会.WS/T 556-2017老年人膳食指导[S].北京:中国标准出版社,2017.
[6] PEREIRA P M D C,VICENTE A F D R.Meat nutritional composition and nutritive role in the human diet[J].Meat Science,2013,93(3):586-592.
[7] 徐畅,阮榕生,刘玉环.浅述高蛋白饮食对人体健康的影响[J].食品工业科技,2012,33(21):399-402.
[8] 解玉怀,王丽雪,杨维仁,等.植物提取物对畜禽肠道免疫的影响及其调控机制[J].草业科学,2018,35(10):2 500-2 511.
[9] TAKUYA S. Regulation of intestinal epithelial permeability by tight junctions[J]. Cellular and Molecular Life Sciences, 2013, 4(70): 631-659.
[10] 燕宇婷,段亚男,王琦.益生菌改善肝性脑病肠道菌群、肠粘膜屏障功能的研究进展[J].世界最新医学信息文摘,2018,18(98): 86-89.
[11] CHEN H,CHENG H,LIU Y,et al.Konjac acts as a natural laxative by increasing stool bulk and improving colonic ecology in healthy adults[J].Nutrition,2006,22(11):1 112-1 119.
[12] STAIANO A, SIMEONE D, DEL GIUDICE E,et al.Effect of the dietary fiber glucomannan on chronic constipation in neurologically impaired children[J].The Journal of Pediatrics,2000,136(1):41-45.
[13] WANYO P,SIRIAMORNPUN S,MEESO N.Improvement of quality and antioxidant properties of dried mulberry leaves with combined far-infrared radiation and air convection in Thai tea process[J].Food and Bioproducts Processing,2011,89(1):22-30.
[14] GOFFREDO M,MASS K,PARKS E J,et al.Role of gut microbiota and short chain fatty acids in modulating energy harvest and fat partitioning in youth[J]. The Journal of Clinical Endocrinology and Metabolism,2016,101(11):4 367-4 376.
[15] 黄艳.桑叶粉/魔芋葡甘聚糖复配增强骨密度功效及肠道益生性研究[D].重庆:西南大学,2017.
[16] CHEN H L,CHENG H C,WU W T,et al.Supplementation of konjac glucomannan into a low-fiber Chinese diet promoted bowel movement and improved colonic ecology in constipated adults:A placebo-controlled,diet-controlled trial[J].Journal of the American College of Nutrition,2008,27(1):102-108.
[17] 钟耕,钟典.一种用于消除因食用火锅导致身体不适的食品及制备方法:中国,ZL 2014 1 0394527.7[P].2018-06-15.
[18] SONG S X,HOOIVELD G J,LI M J,et al.Dietary soy and meat proteins induce distinct physiological and gene expression changes in rats[J].Scientific Reports,2016,6:20 036.
[19] HE W S,WANG M G,PAN X X,et al.Role of plant stanol derivatives in the modulation of cholesterol metabolism and liver gene expression in mice[J].Food Chemistry,2013,140(1): 9-16.
[20] 秦清娟,邓利,徐小青,等.魔芋葡甘聚糖及其衍生物肠道益生性的体外发酵评价[J].食品科学,2015,36(15):217-220.
[21] 杨倩.动物组织学与胚胎学[M].北京:中国农业大学出版社,2008.
[22] 刘凡,李艳芳.断奶仔猪胃肠道免疫及营养研究[J].河南畜牧兽医(综合版),2019,40(3):9-11.
[23] 岳晓敬,扶雄锋,胡栾莎,等.复合益生菌发酵豆粕对断奶仔猪肠道形态和消化酶活性的影响[J].中国畜牧杂志, 2016,52(11):49-54.
[24] 王喆,袁希平,王安奎,等.牛品种、性别对高档牛肉粗蛋白和氨基酸含量的影响[J].云南农业大学学报(自然科学版),2011,26(5):633-638.
[25] ITO K,MATSUURA K,MIHARA Y,et al.Delivery of pancreatic digestive enzymes into the gastrointestinal tract by pancreatic exocrine tissue transplant[J].Scientific Reports,2019,9(1):5 922.
[26] LIN P H,SHIH B L,HSU J C.Effects of different sources of dietary non-starch polysaccharides on the growth performance,development of digestive tract and activities of pancreatic enzymes in goslings[J].British Poultry Science,2010,51(2):270-277.
[27] YANG Jing,YANG Lin,WANG Yongchang,et al.Effects of dietary protein and energy levels on digestive enzyme activities and electrolyte composition in the small intestinal fluid of geese[J].Animal Science Journal,2017,88(2):294-299.
[28] BRZEK P,BRZEK P,CIMINARI M E,et al.Effect of age and diet composition on activity of pancreatic enzymes in birds[J].Journal of Comparative Physiology B,2013,183(5):685-697.
[29] ZHAO F, HOU S S, ZHANG H F,et al.Effects of dietary metabolizable energy and crude protein content on the activities of digestive enzymes in jejunal fluid of Peking ducks[J].Poultry Science,2007,86(8):1 690-1 695.
[30] BASHIARDES S,TUGANBAEV T,FEDERICI S,et al.The microbiome in anti-cancer therapy[J].Seminars in Immunology,2017,32:74-81.
[31] 李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996:163-164.
[32] 邵庆均,苏小凤,许梓荣.饲料蛋白水平对宝石鲈增重和胃肠道消化酶活性影响[J].浙江大学学报(农业与生命科学版),2004,30(5):553-566.