α-熊果苷(4-氢醌-α-D-吡喃葡萄糖苷)是一种天然糖苷,包含1个葡萄糖基和1个酚基,之间通过α-1,4糖苷键相连[1-2]。近年来,由于α-熊果苷有良好的对光辐射的耐褐变性和对酪氨酸酶的抑制活性,因此在化妆品工业中被广泛用作美白剂[3-4]。有文献报道,在大肠杆菌中过表达羟苯甲酸酯1-羟化酶和葡萄糖基转移酶,从头合成α-熊果苷,通过优化葡萄糖浓度,α-熊果苷的产量达到4.19 g/L [5]。LIU等[6]通过一系列突变方法,筛选了具有高α-端基选择性糖基化活性的突变型黄单胞菌(Xanthomonas maltophilia)BT-112,利用该突变菌株生产α-熊果苷的产量为30.6 g/L。目前,利用酶的转糖基化作用,以蔗糖为糖基供体、对苯二酚为糖基受体进行酶法催化是制备α-熊果苷的主要方法[7-8]。据文献报道,糖基转移酶[9]主要包括淀粉蔗糖酶(ASase,EC 2.4.1.4)[10-13]、蔗糖磷酸化酶(SPase,EC 2.4.1.7)[7, 14]和环糊精葡萄糖基转移酶(CGTase,EC 2.4.1.19)[15-16]。例如,在来自野油菜黄单胞菌(Xanthomonas campestris pv)的淀粉蔗糖酶的催化反应下,α-熊果苷的产量高达61.7 g/L,摩尔转化率为94.5%[17]。另外,由于蔗糖磷酸化酶的高转糖基能力[18],且作用底物是廉价且容易获得的蔗糖,因此常被选作生产α-熊果苷。来自肠膜明串珠菌(Leuconostoc mesenteroides)的蔗糖磷酸化酶,可以催化蔗糖的转糖基化反应生成α-熊果苷,摩尔转化率为65%[19]。
蔗糖磷酸化酶是一种同型二聚体的细胞内酶,属于糖基水解酶13家族[20-21]。蔗糖磷酸化酶可在一步反应中将蔗糖转化为相应的糖基化产物[22],即将蔗糖的糖基转移至对应受体上,形成相应的产物。KITAO等[23]研究表明,蔗糖磷酸化酶主要以蔗糖、1-磷酸-葡萄糖为糖基供体,多羟基的糖和糖醇、酚羟基、羧基等多类物质均可以作为该酶的糖基受体。蔗糖磷酸化酶由于其广泛的受体特异性,因而在高效生产α-熊果苷方面具有很大的潜力。迄今为止,在许多细菌中都发现了蔗糖磷酸化酶的存在,包括青春双歧杆菌(Bifidobacterium adolescentis)[24],变异链球菌(Streptococcus mutans)[25]和肠膜明串珠菌(Leuconostoc mesenteroides)[23]等,这些蔗糖磷酸化酶的基因已被克隆并异源表达。AERTS等[26]比较了6种不同来源的蔗糖磷酸化酶在体积分数25%二甲基亚砜溶剂中的稳定性,发现来自变异链球菌(Streptococcus mutans)和青春双歧杆菌(Bifidobacterium adolescentis)的酶最稳定。
本文选用来源于Streptococcus mutans UA159的蔗糖磷酸化酶(SmSP)在枯草芽孢杆菌中进行异源表达,采用更换表达载体、定点饱和突变和优化反应条件的方式,全细胞转化合成α-熊果苷。经过以上几种策略,我们获得催化效率较高的重组菌株B. subtilis WB600/pP43NMK-P43-SmSPI336L,α-熊果苷的产量达到了110.3 g/L,HQ摩尔转化率为88.7%,相比原始菌株(40.2 g/L),产量提高了2.74倍。
1 材料与方法
1.1 菌株-质粒与试剂
表达SmSP蛋白的gtfA基因(GeneBank登录号NC_004350.2)由天霖生物技术公司合成,并对其密码子进行了优化。克隆宿主大肠杆菌Escherichia coli JM109 (E. coli JM109)、异源表达宿主枯草芽孢杆菌Bacillus subtilis WB600(B. subtilis WB600,BSWB600)和表达载体pP43NMK、pHT01、pMA0911.1和pSTOP1622均由本实验室保藏。
α-熊果苷的标准样品购自Sigma-Aldrich,对苯二酚(hydroquinone, HQ)和相关化合物购自国药集团(中国上海),ClonExpress II一步克隆试剂盒购自诺维赞(中国南京),Bradford法蛋白浓度测定试剂盒、氨苄青霉素、卡那霉素、链霉素、氯霉素均购自上海生工。其他常用试剂均为分析纯。
1.2 重组质粒的构建
以pUC19-gtfA为模板PCR扩增经密码子优化的gtfA基因。通过酶切连接的方式构建重组质粒pHT01-Pgrac100-gtfA和pMA0911.1-PHpaII-gtfA,运用一步克隆的方式构建重组质粒pP43NMK-P43-gtfA和pSTOP1622-PxylA-gtfA。所用引物如表1所示。
表1 本文使用的引物
Table 1 Primers used in this study

注:a引物序列中,斜体字母代表酶切位点,下划线字母代表同源序列,加粗字母代表简并碱基
引物名称引物序列(5’-3’)agtfA-F (BamH I)AATTAAAGGAGGAAGGATCCATGCCAATCATTAACAAGACGATGCTTATTACgtfA-R (Sma I)ATTAGGCGGGCTGCCCCGGGTTATTCGAAAGATATGGTCTGATCATTCTCGGgtfA-F (Nde I)GGGAATTCCATATGATGCCAATCATTAACAAGACGATGCgtfA-R (BamH I)CGCGGATCCTTATTCGAAAGATATGGTCTGATCATTCTCGGgtfA-F1GGTAAGAGAGGAATGTACACATGCCAATCATTAACAAGACGATGCTTATTACTgtfA-R1ATTACGCCAAGCTTTCATCATTATTCGAAAGATATGGTCTGATCATTCTCGGTTp43NMK-F1TGATGAAAGCTTGGCGTAATCATGGTCATAp43NMK-R1GTGTACATTCCTCTCTTACCTATAATGGTACCGgtfA-F2GGAAATGTACAATGGTCCAAACTAGTATGCCAATCATTAACAAGACGATGCTTgtfA -R2GCCGGCATGCGGCCGGTACCGGATCCTTATTCGAAAGATATGGTCTGATCATTCTCGGpSTOP-F2GGATCCGGTACCGGCCGCATGCCGGCpSTOP-R2ACTAGTTTGGACCATTGTACATTTCCCCAA336-FTACCAAATCAACAGTACTTACTACAGCGCAA336-RTAAGTACTGTTGATTTGGTANNNGTCCAAGTTATTGTACTCTGCCGTAGAGp43-F(His)AACACCACCACCACCACCACTAATGATGAAAGCTTGGCGTAATCATGGTCATgtfA-R(His)TAGTGGTGGTGGTGGTGGTGTTCGAAAGATATGGTCTGATCATTCTCGG
1.3 异源表达和生物转化
将带有工程质粒的大肠杆菌E. coli JM109在Luria-Bertani(LB)培养基(10 g/L蛋白胨、5 g/L酵母提取物、10 g/L NaCl)中,37 ℃培养,并添加相应的抗生素。将测序正确的重组质粒转化至B.subtilis WB600感受态细胞中,单菌落在含有相应抗生素的20 mL LB培养基中37 ℃培养10 h。然后,将种子培养基以体积分数1%的接种量转接至Terrific-Broth(TB)发酵培养基(12 g/L蛋白胨、24 g/L酵母提取物、5.04 g/L甘油、17 mmol/L KH2PO4和72 mmol/L K2HPO4)中,37 ℃培养12 h。对于带有不同质粒的重组B. subtilis WB600,抗生素的终质量浓度为50 μg/mL卡那霉素、30 μg/mL链霉素、5 μg/mL氯霉素和100 μg/mL氨苄青霉素。
为了制备全细胞生物催化剂,离心收集发酵结束的菌体,用20 mmol/L磷酸钠缓冲液(PB缓冲液,pH 7.0)洗涤2次。在含有40 g/L HQ、372 g/L蔗糖、20 mmol/L PB缓冲液的反应混合物中进行生物催化转化。生物转化反应是在50 mL密闭容器中,30 ℃振荡反应20 h,用高效液相色谱检测上清液中的α-熊果苷浓度。
1.4 高效液相色谱(HPLC)分析产物
使用配备紫外检测器(281 nm)的Agilent SB-Aq色谱柱(4.6 mm×250 mm,5 μm)通过高效液相色谱法(HPLC,Agilent 1200)测量上清液中的α-熊果苷浓度。流动相为10 mmol/L的稀H3PO4和甲醇(体积比为8∶2),流速0.6 mL/min,柱温为35 ℃,进样量为10 μL。
1.5 定点饱和突变
我们根据预测的活性位点来选择SmSP的氨基酸残基,并对所选择的位点进行饱和突变,以提高SmSP的催化效率。以pP43NMK-P43-gtfA为模板,使用一步PCR法替换编码特定氨基酸的3个碱基,引物在表1中给出。扩增的样品用DpnI在37 ℃,2 h消化模板DNA,构建成功的重组质粒转化至B. subtilis WB600感受态细胞中进行表达和生物转化。
1.6 突变体活性与蛋白浓度的测定
以HQ作为底物,采用HPLC法测定α-熊果苷的浓度以测定酶活力。反应底物为182 mmol/L HQ和200 mmol/L蔗糖,溶剂为pH 7.0的PB缓冲液,将待测酶液与反应底物溶液均置于30 ℃预热5 min。取干净并于30 ℃预热过的1.5 mL离心管,加入800 μL反应底物溶液,再加入200 μL待测酶液,总反应体系为1 mL,于30 ℃水浴反应5 min,精确计时,100 ℃水浴加热10 min终止反应。利用HPLC法检测α-熊果苷的浓度。以失活后的酶液为反应空白对照。1个单位的蔗糖磷酸化酶酶活力定义为:在30 ℃,pH 7.0的条件下,1 h能转化1 μmol底物HQ为1 μmol产物α-熊果苷的酶量,即1 U=1 μmol/h。使用Bradford蛋白含量测定试剂盒测定酶液中的蛋白含量,以牛血清白蛋白为标准对蛋白质含量进行测定。
1.7 突变体的纯化
用一步PCR的方法,在酶蛋白C-端添加6-His标签,以便对蛋白进行亲和层析。一步PCR所用引物在表1中给出。收集成功表达酶蛋白的菌体细胞,用20 mmol/L的PB缓冲液(pH 7.0)洗涤细胞2次,并用该缓冲液重悬细胞,对细胞重悬液进行超声破碎,直至细胞重悬液呈现澄清的状态,以10 000 r/min低温高速离心30 min,弃除沉淀,所得上清液用孔径0.45 μm滤膜过滤,进一步去除杂质,制备蛋白的亲和层析。将过滤所得粗酶液通过镍柱(His GraviTrap柱),利用AKTA蛋白纯化仪进行纯化。上样后,用缓冲液A(20 mmol/L磷酸盐缓冲液、300 mmol/L NaCl、20 mmol/L咪唑,pH 7.0)平衡柱子,流速为1 mL/min。然后用缓冲液B(20 mmol/L磷酸盐缓冲液、300 mmol/L NaCl、500 mmol/L咪唑,pH 7.0)按照10%~100%进行梯度洗脱,流速为1 mL/min,纯化后的酶液保存在4 ℃条件下备用。纯化的蛋白用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)进行验证。
1.8 突变体酶学性质研究
为测定温度对突变体酶活性的影响,根据1.7中突变体酶活力的测定方法,测定在25~45 ℃温度下,突变体的酶活力,确定最适反应温度。为测定pH对突变体酶活力的影响,根据1.7中突变体酶活力的测定方法,选择pH 6.0~10.0的缓冲液测定突变体的最适反应pH。使用的缓冲液如下:磷酸钠缓冲液(pH 6.0~8.0),NaHCO3-NaOH缓冲液(pH 9.0~10),缓冲液浓度均为20 mmol/L。
以不同浓度的对苯二酚(浓度范围:0.9~136 mmol/L)为底物,测定突变体的动力学参数。根据公式(1)利用双倒数作图法进行作图,计算动力学参数:
(1)
式中:V,反应速率,μmol/(L·min);Km,米氏常数,mmol/L;[S],底物浓度,mmol/L;Vmax,最大反应速率,μmol/(L·min)。
1.9 全细胞转化条件的优化
为研究收集菌体的时间对转化效率的影响,根据1.3方法,分别离心收集发酵培养8、12、16、20、24 h的菌体,对发酵不同时间的菌体进行全细胞转化验证。
为研究菌体添加量对转化效率的影响,根据1.3方法,添加不同量的菌体使全细胞转化体系的OD600值分别为10、20、30、40、50、60、90和100。
为研究表面活性剂的添加对转化效率的影响,根据1.3方法,在全细胞转化体系中,分别添加体积分数为0.2%、2%、5%和8%的Tween-80,体积分数为0.5%、1%和2%的Triton X-100。
2 结果与讨论
2.1 SmSP的表达和表达载体的优化
为了在枯草芽孢杆菌中实现SmSP的异源表达,我们首先将gtfA基因PCR扩增并构建了重组表达质粒pHT01-Pgrac100-gtfA(图1-a)。通过SDS-PAGE分析以确认SmSP是否成功表达。如图1-b所示,在49 kDa处发现目标条带,这表明SmSP在枯草芽孢杆菌中已经成功表达。
为了提高SmSP的表达水平,我们又构建3个重组表达载体:pMA0911.1-PHpaII-gtfA、pSTOP1622-PxylA-gtfA和pP43NMK-P43-gtfA,如图1-a所示。本文所用的4种质粒分别含有不同的拷贝数,pP43NMK属于高拷贝质粒,pMA0911.1和pSTOP1622属于中拷贝质粒,而pHT01属于低拷贝数质粒。此外,这些质粒包含不同的启动子,包括组成型启动子(PHpaII,P43)和诱导型启动子(Pgrac100,PxylA)。P43是枯草芽孢杆菌中的强启动子,并且可以在不同的生长条件下都可以保持较高的启动子活性。我们通过SDS-PAGE分析SmSP在不同重组菌株中的表达情况,如图1-b所示,4个重组菌株的细胞破碎上清液中均能观察到清晰的目标蛋白条带。与pHT01-Pgrac100-gtfA相比,重组质粒pP43NMK-P43-gtfA产生的蛋白条带更粗,即SmSP的蛋白表达量更高,而含有pMA0911.1-PHpaII-gtfA和pSTOP1622-PxylA-gtfA的重组菌株所产生的条带粗细相似(图1-b)。接下来,我们使用构建的4株重组菌株进行了全细胞转化,用α-熊果苷的产量来验证不同载体表达SmSP的能力。结果如图1-c所示,含质粒pP43NMK-P43-gtfA的重组菌株产生的α-熊果苷的产量高于其他3种重组菌株。并且,这4株重组菌株均在全细胞转化20 h时达到最高的α-熊果苷产量,其中含有重组质粒pP43NMK-P43-gtfA的重组菌株在20 h时产量达到40.2 g/L。
众所周知,基因拷贝数是影响基因表达水平的重要参数[27]。基因拷贝数的高低,可直接影响到目的蛋白表达量的高低。另外,提高蛋白质产量的另一个高效策略之一是构建具有高活性和可控启动子的表达系统[28-29]。根据液相结果(图1-c),在所选择的4种质粒中,用包含有P43启动子的pP43NMK质粒来表达SmSP效果最好。综上所述,高拷贝数对于SmSP的表达是有益的,而启动子是直接影响蛋白质表达水平的重要调控元件。

a-4个重组表达载体的构建;b-重组菌株的细胞破碎后上清液的SDS-PAGE分析;M-Marker;1-5分别表示BSWB600/pP43NMK,BSWB600/pHT01-Pgrac100-gtfA,BSWB600/pMA0911.1-PHpaII-gtfA,BSWB600/pSTOP1622-PxylA-gtfA和BSWB600/pP43NMK-P43-gtfA;c-催化不同时间重组菌株BSWB600/pHT01-Pgrac100-gtfA,BSWB600/pMA0911.1-PHpaII-gtfA,BSWB600/pSTOP1622-PxylA-gtfA和BSWB600/pP43NMK-P43-gtfA产α-熊果苷的产量
图1 重组B. subtilis WB600中不同载体表达SmSP
Fig.1 The effect of different vectors on the production of SmSP by recombinant B. subtilis WB600
2.2 SmSP中loop A的定点饱和突变
根据SWISS-MODEL网站的预测,来自青春双歧杆菌B. adolescentis的蔗糖磷酸化酶BaSP(PDB ID:2gdv)与SmSP具有43.74%的氨基酸序列同一性,因此选择BaSP的晶体结构,对SmSP的三维结构进行建模。该结构由2个同源亚基组成,在结构上与BaSP类似,SmSP可以分为4个域:A、B、B′和C。结构域B由2个短的反平行β-折叠和2个短的α-螺旋组成,其结构域中还有1个控制受体底物结合的柔性环结构loop A(329AEYNNLDIY337)。结构域B′由一长一短2个α-螺旋组成,其中包含1个柔性环结构loop B(132YKRKD136)。结构域C是由SmSP的前56个残基形成的5个反平行β-折叠组成。有文献报道,BaSP中的受体结合位点由结构域B和B′决定[30],并且柔性环loop A和loop B对于受体结合的特异性至关重要,这2个柔性环覆盖了催化腔并随后协助特定底物结合与催化[31-33]。
因此,在本研究中,将受体亚位点Ile336选作突变位点。Ile336的定点饱和突变结果如图2所示,与野生型酶SmSP(WT)相比,突变体SmSPI336L(Ile336突变为Leu336)表现出更好的催化活性,α-熊果苷的产量为71.7 g/L。一些突变体突变体的α-熊果苷产量略低于原始菌株(49.8 g/L):SmSPI336N(47.7 g/L)、SmSPI336Q(46.3 g/L)和SmSPI336E(40.6 g/L)。还有一些突变体的催化能力很低,如突变体SmSPI336C和SmSPI336S几乎无产量。

图2 不同突变体的α-熊果苷的产量
Fig.2 α-Arbutin production in different mutants
为了进一步研究突变体SmSPI336L的催化能力比SmSP提高的原因,运用Discovery Studio 2017软件,将酶蛋白(SmSP和SmSPI336L)分别与受体底物HQ进行分子对接。然后使用DS软件将该对接结果绘制成三维图像,如图3-a所示。根据对接结果进行分析,图3-b和图3-c分别是SmSP和突变体SmSPI336L与底物HQ分子对接的结果。氨基酸残基Ile336均不直接和底物HQ结合,对于野生型SmSP来说(图3-b),HQ是通过4个极性键与loop B中的Asp136以及loop A中的Asn333相结合。与SmSP相比,SmSPI336L与HQ形成了2个新的极性键[Thr328 (loop A)/HQ; Tyr331 (loop A)/HQ](图3-c),这表明突变体SmSPI336L的活性位点对HQ的亲和力增强了[34]。此外,野生型酶SmSP中活性位点残基与HQ结合的平均键长为2.775 埃,而突变体SmSPI336L中的活性位点残基与HQ结合的平均键长缩短为2.475 埃。综合以上分子对接的结果表明,与野生型酶相比,突变体SmSPI336L与受体底物HQ之间的相互作用更加稳定,即更易于捕获到HQ,有利于转糖基反应的进行。
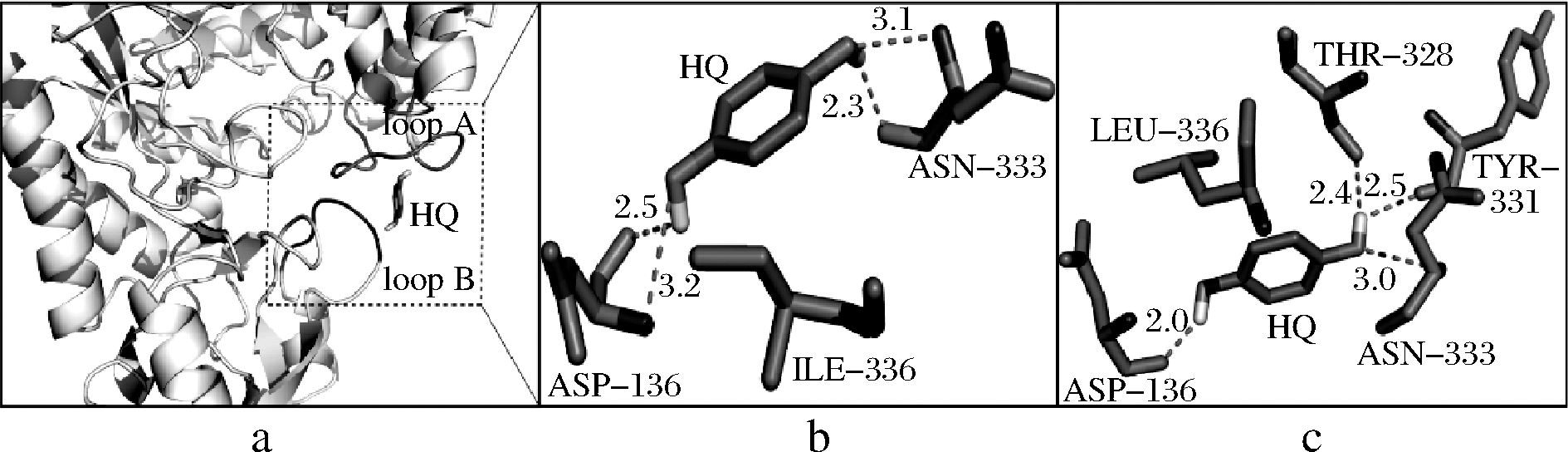
a-SmSP与HQ分子对接;b-SmSP与HQ分子对接结果;c-SmSPI336L与HQ分子对接结果
图3 SmSP与HQ分子对接结果
Fig.3 Docking results of SmSP and HQ
有报道,Arg135和Tyr344是BaSP受体结合位点中与特定底物结合的最重要的氨基酸残基[35]。位于Asp342和Tyr344之间的氨基酸对受体底物的结合也有着不可忽略的影响,因为其可以使柔性环形成一个特定的构象,从而促进酶与底物的结合[31]。对于BaSP,氨基酸残基Leu343是使相邻受体结合残基Tyr344正确定位所必需的[31]。当loop A在不同构象之间切换时,Leu343侧链的移动,导致Tyr344被推入催化活性位点并与受体底物相互作用。结合本文的研究结果,对于SmSP的第336位氨基酸也有使相应的氨基酸残基正确定位,并促使与底物结合的作用。明确了loop A是构成转糖基作用的另一个关键活性位点,也说明了SmSP中的第336位氨基酸残基的正确构象,对于与受体底物的结合和转糖基反应至关重要。
2.3 突变体的纯化及酶学性质研究
为了进一步研究SmSP的酶学性质,将SmSP和SmSPI336L进行了镍柱纯化。纯化前及纯化后的蛋白电泳如图4所示。条带1和2分别为SmSP和SmSPI336L的细胞破碎后的上清液,目的蛋白位于49 kDa位置处,条带清晰,但含有大量的杂蛋白。条带3和4分别为SmSP和突变体SmSPI336L经过镍柱纯化后的蛋白条带,在49 kDa位置处,目的蛋白条带更粗且无杂蛋白。

a-纯化前SDS-PAGE结果;b-纯化后SDS-PAGE结果
图4 蛋白纯化前后SDS-PAGE结果
Fig.4 SDS-PAGE analysis of the SmSP and its mutant
检测突变体的酶活力,由图5可知,突变体SmSPI336L(I336L)的最适温度和最适pH与对照(WT)相比,没有明显差异。最适温度均为30 ℃,最适pH值均为7.0。为了验证在相同条件下,突变体SmSPI336L对受体底物HQ的亲和力是否比对照强,本研究以HQ作为底物,对SmSP和SmSPI336L的动力学参数(Km和kcat)进行测定及分析。运用双倒数作图法,得出的拟合直线如图6所示。
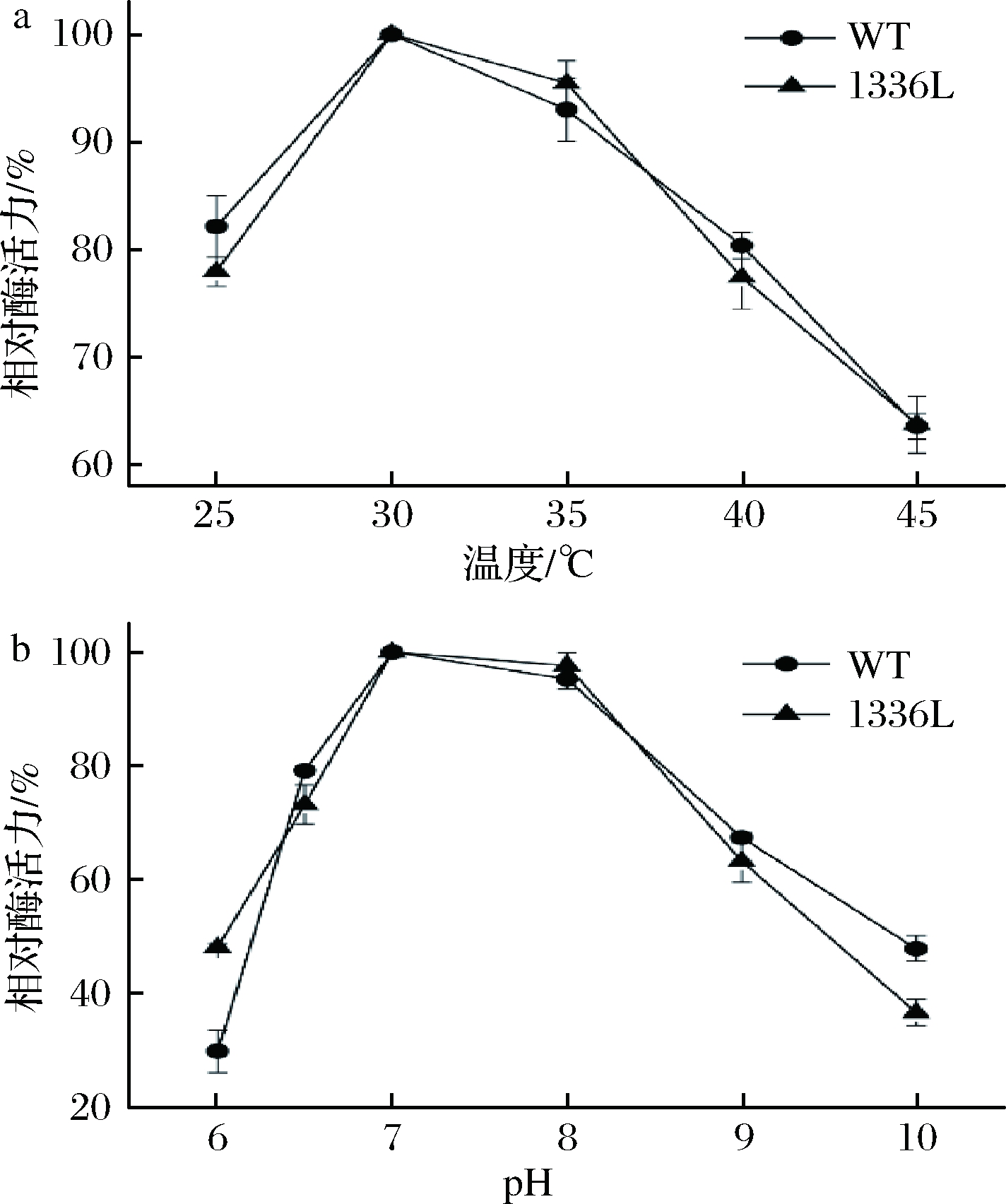
a-温度对酶活性影响;b-pH对酶活性影响
图5 温度和pH对酶活性的影响
Fig.5 The effects of temperature and pH on enzymes activity
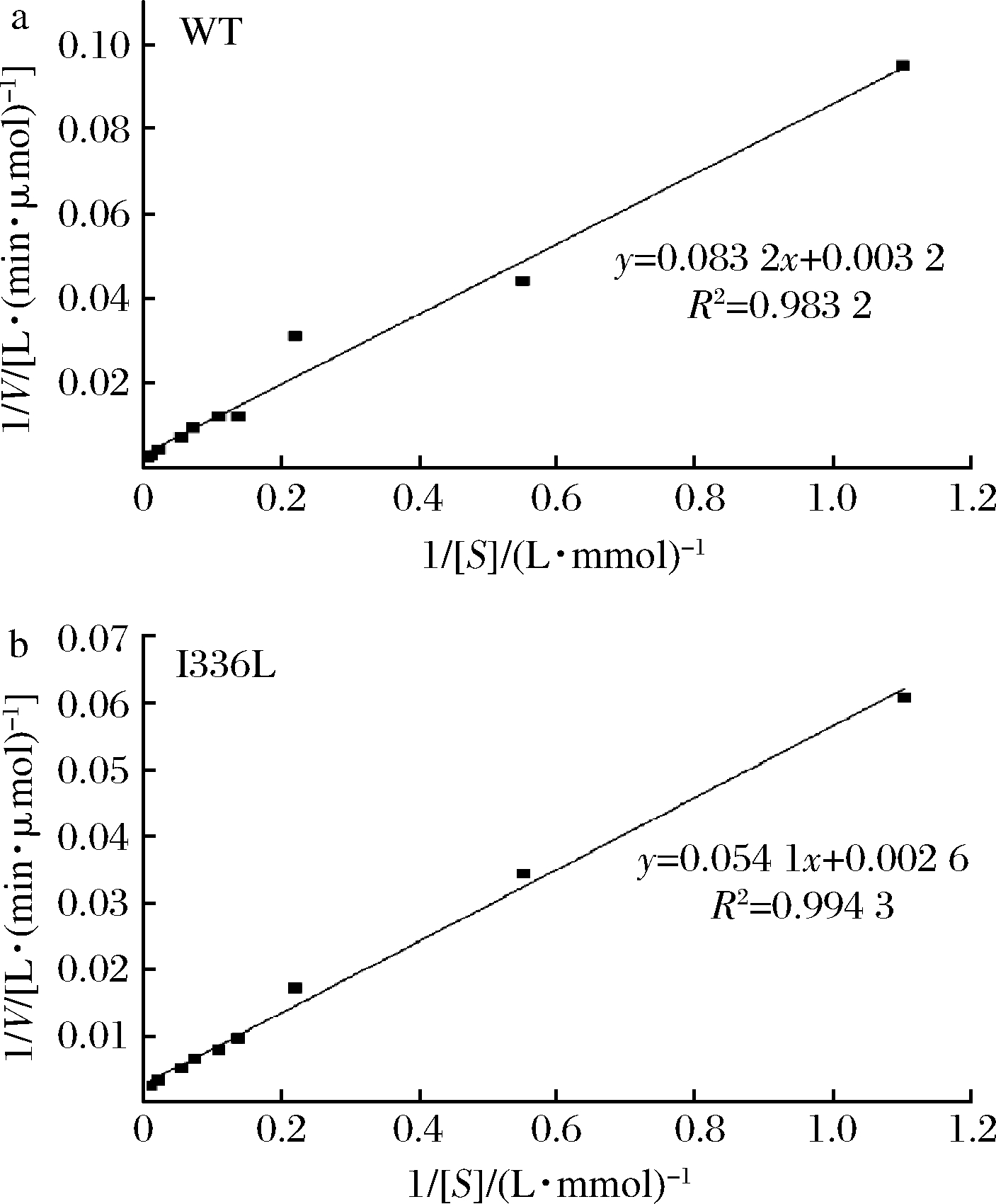
a-WT;b-I336L
图6 SmSP及其突变体的Lineweaver-Burk拟合直线
Fig.6 Kinetic parameters of SmSP and its mutant according to Lineweaver-Burk plot
根据拟合直线方程,对动力学参数的计算结果如表2所示。动力学参数测定结果显示,与对照相比,突变体SmSPI336L的Km值降低,说明突变体对底物HQ的亲和力增加;催化常数kcat升高,催化效率kcat/Km相比对照提高了1.54倍。
表2 突变体的动力学参数
Table 2 Kinetic parameters of SmSP and its mutant

酶Km/(mmol·L-1)kcat/(min-1)kcat/Km/(mmol·L-1·min-1)SmSP26.30±0.97316.06±11.2912.02SmSPI336L21.08±0.45389.74±8.8818.48
2.4 全细胞催化合成α-熊果苷反应条件的优化
2.4.1 收集发酵菌体的时间优化
为探究发酵时间对菌体全细胞转化生产α-熊果苷的影响,分别收集发酵8、12、16、20、24 h的重组菌B. subtilis WB600/pP43NMK-P43-SmSPI336L进行全细胞催化,用HPLC检测α-熊果苷的产量,如图7-a所示,收集发酵了12 h的菌体进行全细胞催化,所得到的α-熊果苷产量最高,为74.7 g/L。结合B. subtilis WB600/pP43NMK-P43-SmSPI336L的菌体生长曲线(图7-b)可知,发酵12 h左右的菌体处于稳定期,之后从15 h开始,便很快进入衰亡期。发酵12 h处于菌体生长对数后期,此时的菌体生物活性特征最好。因此收集发酵12 h的菌体进行全细胞催化实验,能够获得生长状态最好的菌体,从而获得较高的α-熊果苷产量。

a-α熊果苷产量;b-OD600
图7 收集发酵菌体的时间优化
Fig.7 Optimization of fermentation time
2.4.2 全细胞转化菌体添加量的优化
全细胞催化过程的实质是胞内酶的催化过程,而不同的菌体添加量(OD600)代表不同的添加酶量。合适的菌体添加量既能保证α-熊果苷有较高的产量,又不会对反应底物和过量菌体造成浪费。如图8所示,当菌体OD600为40时,全细胞催化反应生成的α-熊果苷产量最高,为95.2 g/L,相比之前OD600为20的对照组,产量提高了29.7%,此时HQ的摩尔转化率为76.6%。当菌体添加量再增加,α-熊果苷的产量降低,可能是菌体浓度过高,导致全细胞催化体系变得黏稠,不利于底物的接触和催化反应的进行。
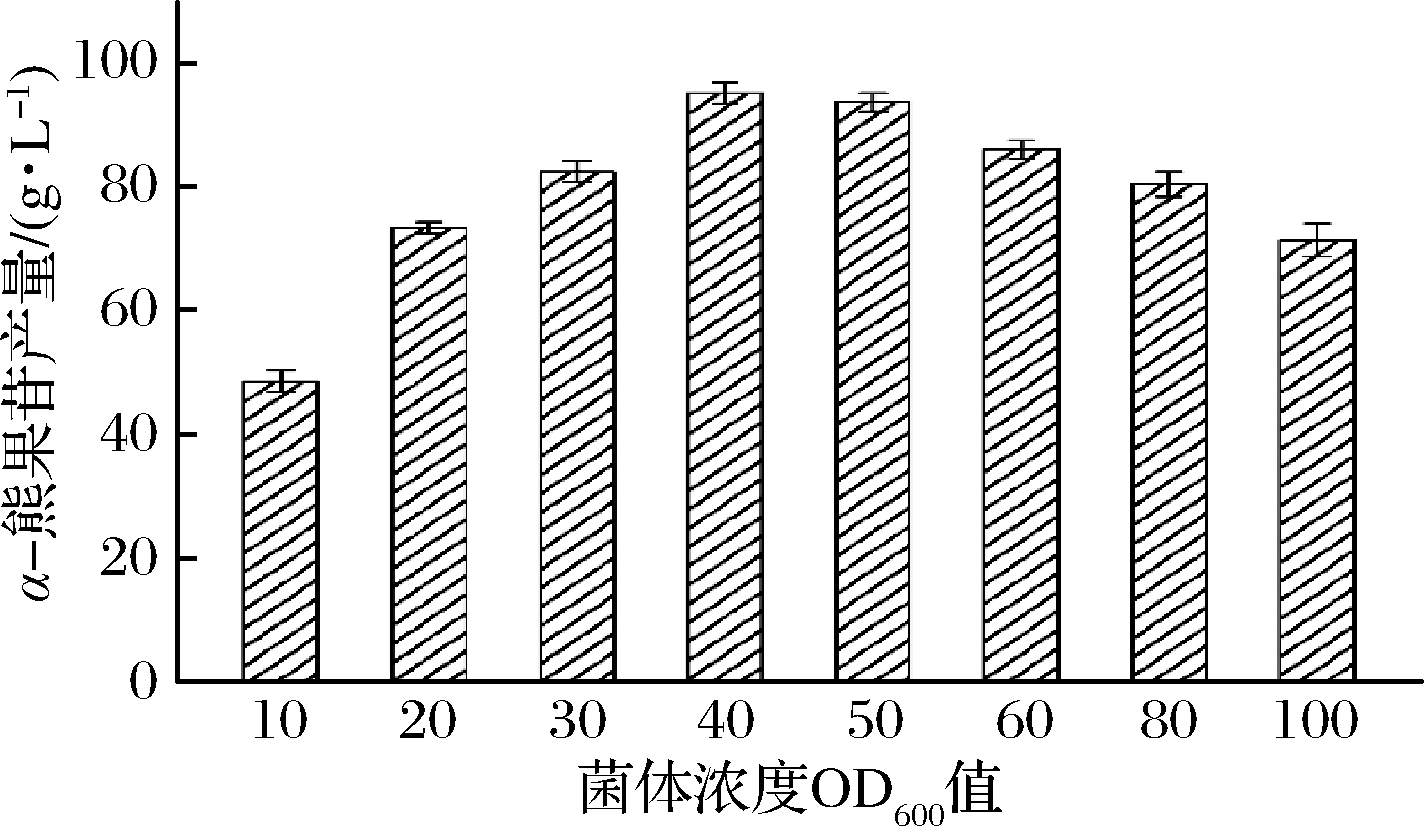
图8 全细胞转化菌体添加量的优化
Fig.8 Optimization of the OD600 of whole-cell transformation
2.4.3 全细胞转化体系中表面活性剂的优化
对于全细胞转化过程中的底物分子HQ和蔗糖,细胞膜对底物分子的渗透能力是影响物质进出细胞的重要因素。因此在全细胞转化体系中添加不同浓度的表面活性剂,利用HPLC检测α-熊果苷的产量。当添加的表面活性剂为Tween-80时,α-熊果苷的产量没有得到明显的提高,如图9-a所示,当添加的表面活性剂为Triton X-100时,如图9-b所示,添加体积分数为1% Triton X-100时,α-熊果苷的产量提高至110.3 g/L,相比对照提高了15.6%。Triton X-100属于非离子表面活性剂,能部分溶解细胞膜,相比于其他活性剂能更好地保证细胞膜的完整性,对细胞毒性小。
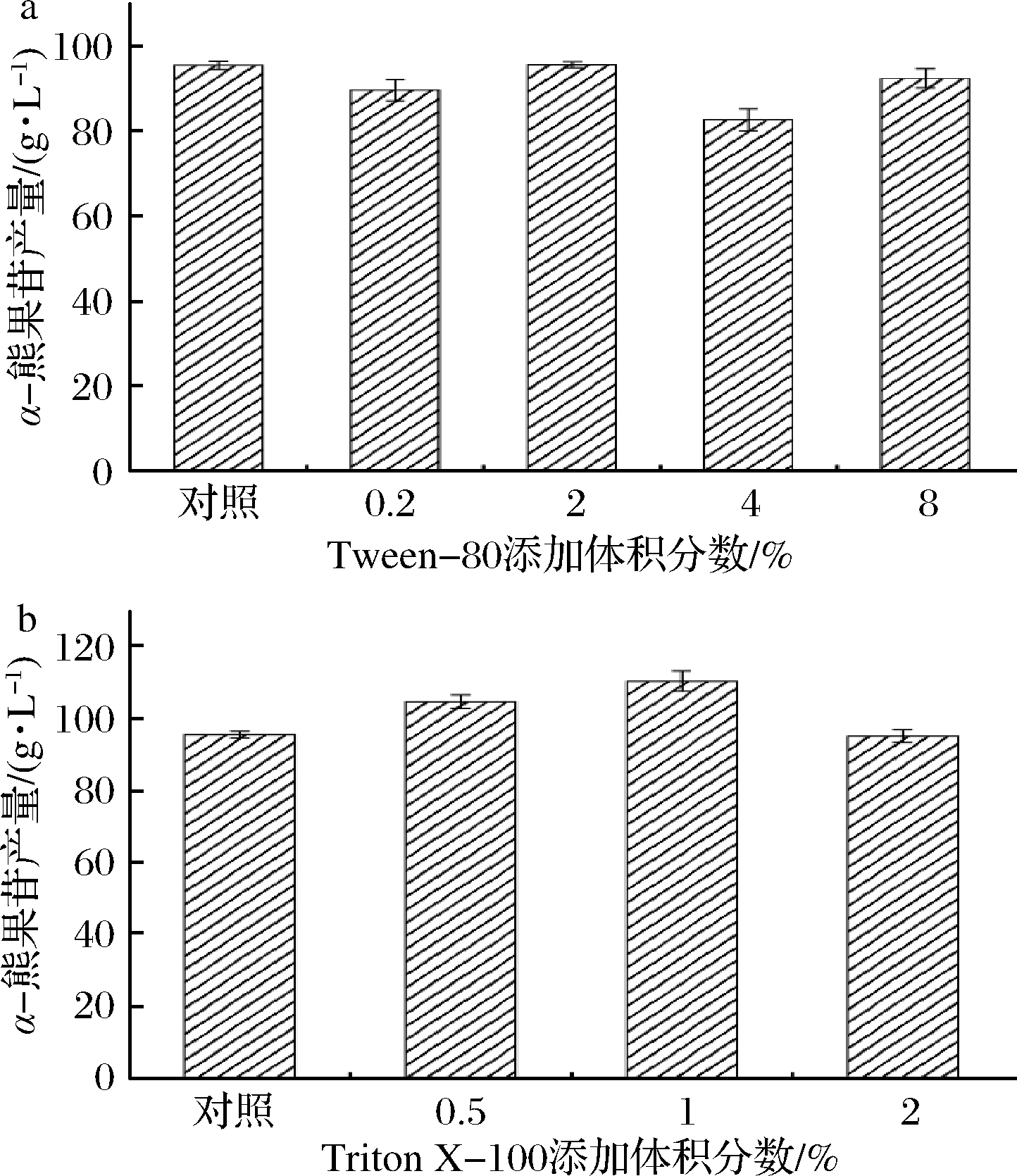
a-Tween-80添加体积分数对α-熊果苷的产量影响;b-Triton X-100添加体积分数对α-熊果苷的产量影响
图9 全细胞转化体系中表面活性剂的优化
Fig.9 Optimization of surfactants in whole-cell transformation systems
3 结论
将变异链球菌Streptococcus mutans UA159中克隆得到的蔗糖磷酸化酶(SmSP),在枯草芽孢杆菌Bacillus subtilis WB600中成功地异源表达。筛选出了表达SmSP的最佳载体pP43NMK-P43,通过定点饱和突变的方式,获得了转糖基效率较高的突变体SmSPI336L,并对获得的重组菌株B. subtilis WB600/ pP43NMK-P43-SmSPI336L全细胞转化合成α-熊果苷的条件进行优化,最终α-熊果苷的产量达到了110.3 g/L,HQ摩尔转化率为88.7%。与已报道的α-熊果苷生产方法相比,利用该法生产α-熊果苷的产量高,方法简单。对蔗糖磷酸化酶loop A区域的突变,为提高该酶与糖基受体底物的结合能力提供了新策略,也为利用蔗糖磷酸化酶高效生物转化合成α-熊果苷奠定了基础。
[1] SEO D H, JUNG J H, HA S J, et al. High-yield enzymatic bioconversion of hydroquinone to α-arbutin, a powerful skin lightening agent, by amylosucrase[J]. Applied Microbiology Biotechnology, 2012, 94(5): 1 189-1 197.
[2] NYCZ J E, MALECKI G, MORAG M, et al. Arbutin: Isolation, X-ray structure and computional studies[J]. Journal of Molecular Structure, 2010, 980(1-3): 13-17.
[3] LIU C, DENG L, ZHANG P, et al. Efficient production of α-arbutin by whole-cell biocatalysis using immobilized hydroquinone as a glucosyl acceptor[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 91: 1-7.
[4] ZHENG X, ZHANG B, ZENG M, et al. Inhibition of oxidative stress and autophagy by arbutin in lipopolysaccharide-induced myocardial injury[J]. Pharmacognosy Magazine, 2019, 15(63): 507.
[5] SHEN X, WANG J, WANG J, et al. High-level de novo biosynthesis of arbutin in engineered Escherichia coli[J]. Metabolic Engineering, 2017, 42: 52-58.
[6] LIU C Q, DENG L, ZHANG P, et al. Screening of high α-arbutin producing strains and production of α-arbutin by fermentation[J]. World Journal of Microbiology and Biotechnology, 2013, 29(8): 1 391-1 398.
[7] ZHU X, TIAN Y, ZHANG W, et al. Recent progress on biological production of α-arbutin[J]. Applied Microbiology Biotechnology, 2018, 102(19): 8 145-8 152.
[8] ZHOU H, ZHAO J, LI A, et al. Chemical and biocatalytic routes to arbutin[J]. Molecules, 2019, 24(18).
[9] WU P H, NAIR G R, CHU I M, et al. High cell density cultivation of Escherichia coli with surface anchored transglucosidase for use as whole-cell biocatalyst for α-arbutin synthesis[J]. Jouranl of Industrial Microbiology and Biotechnology, 2008, 35(2): 95-101.
[10] YU S, WANG Y, TIAN Y, et al. Highly efficient biosynthesis of α-arbutin from hydroquinone by an amylosucrase from Cellulomonas carboniz[J]. Process Biochemistry, 2018, 68: 93-99.
[11] YANG C, FAN W, ZHANG R, et al. Study on transglucosylation properties of amylosucrase from Xanthomonas campestris pv. campestris and its application in the production of α-arbutin[J]. Catalysts, 2018, 9(1): 5.
[12] ZHU L, XU M, LU C, et al. Optimization of whole-cell biotransformation for scale-up production of α-arbutin from hydroquinone by the use of recombinant Escherichia coli[J]. AMB Express, 2019, 9(1): 94.
[13] ZHU L, JIANG D, ZHOU Y, et al. Batch-feeding whole-cell catalytic synthesis of α-arbutin by amylosucrase from Xanthomonas campestris[J]. Journal of Industrial Microbiology and Biotechnology, 2019, 46(6): 759-767.
[14] GOEDL C, SCHWARZ A, MINANI A, et al. Recombinant sucrose phosphorylase from Leuconostoc mesenteroides: characterization, kinetic studies of transglucosylation, and application of immobilised enzyme for production of α-D-glucose 1-phosphate[J]. Journal of Biotechnology, 2007, 129(1): 77-86.
[15] MATHEW S, ADLERCREUTZ P. Regioselective glycosylation of hydroquinone to α-arbutin by cyclodextrin glucanotransferase from Thermoanaerobacter sp.[J]. Biochemical Engineering Journal, 2013, 79: 187-193.
[16] MCARTHUR J B, CHEN X. Glycosyltransferase engineering for carbohydrate synthesis[J]. Biochemical Society Transactions, 2016, 44(1): 129-142.
[17] LIU C, ZHANG P, ZHANG S, et al. Feeding strategies for the enhanced production of α-arbutin in the fed-batch fermentation of Xanthomonas maltophilia BT-112[J]. Bioprocess and Biosystems Engineering, 2014, 37(2): 325-329.
[18] GOEDL C, SAWANGWAN T, WILDBERGER P, et al. Sucrose phosphorylase: a powerful transglucosylation catalyst for synthesis of α-D-glucosides as industrial fine chemicals[J]. Biocatalysis and Biotransformation, 2009, 28(1): 10-21.
[19] KAZUHISA S, TAKAHISA N, KOJI N, et al. Syntheses of arbutin-aglycosides and a comparison of their inhibitory effects with those of α-arbutin and arbutin[J]. Chemical Pharmaceutical Bulletin, 2003, 51(7): 798-801.
[20] LEE J H, YOON S H, NAM S H, et al. Molecular cloning of a gene encoding the sucrose phosphorylase from Leuconostoc mesenteroides B-1149 and the expression in Escherichia coli[J]. Enzyme and Microbial Technology, 2006, 39(4): 612-620.
[21] ZHANG H, SUN X, LI W, et al. Expression and characterization of recombinant sucrose phosphorylase[J]. Protein Journal, 2018, 37(1): 93-100.
[22] GOEDL C, SCHWARZ A, MUELLER M, et al. Mechanistic differences among retaining disaccharide phosphorylases: insights from kinetic analysis of active site mutants of sucrose phosphorylase and α-trehalose phosphorylase[J]. Carbohydrate Research, 2008, 343(12): 2 032-2 040.
[23] KITAO S, SEKINE H. α-D-glucosyl transfer to phenolic compounds by sucrose phosphorylase from Leuconostoc mesenteroides and production of α-arbutin[J]. Bioscience Biotechnology and Biochemistry, 1994, 58(1): 38-42.
[24] VAN D B L A, VAN B E L, KIEVIT R P, et al. Physico-chemical and transglucosylation properties of recombinant sucrose phosphorylase from Bifidobacterium adolescentis DSM20083[J]. Applied Microbiology Biotechnology, 2004, 65(2): 219-227.
[25] SUGIMOTO K, NOMURA K, NISHIURA H, et al. Sucrose phosphorylases catalyze transglycosylation reactions on carboxylic acid compounds[J]. Biologia, 2008, 63(6): 1 015-1 019.
[26] AERTS D, VERHAEGHE T F, ROMAN B I, et al. Transglucosylation potential of six sucrose phosphorylases toward different classes of acceptors[J]. Carbohydrate Research, 2011, 346(13): 1 860-1 867.
[27] JIANG W, WANG Y. Improving catalytic efficiency and changing substrate spectrum for asymmetric biocatalytic reductive amination[J]. Journal of Microbiology and Biotechnology, 2020, 30(1): 146-154.
[28] LIU X, WANG H, WANG B, et al. High-level extracellular protein expression in Bacillus subtilis by optimizing strong promoters based on the transcriptome of Bacillus subtilis and Bacillus megaterium[J]. Protein Expression and Purification, 2018, 151: 72-77.
[29] LIU X, WANG H, WANG B, et al. Efficient production of extracellular pullulanase in Bacillus subtilis ATCC6051 using the host strain construction and promoter optimization expression system[J]. Microbial Cell Factories, 2018, 17(1): 163.
[30] KRAUS M, GRIMM C, SEIBEL J. Reversibility of a point mutation induced domain shift: expanding the conformational space of a sucrose phosphorylase[J]. Scientific Reports, 2018, 8(1): 10 490.
[31] VERHAEGHE T, DIRICKS M, AERTS D, et al. Mapping the acceptor site of sucrose phosphorylase from Bifidobacterium adolescentis by alanine scanning[J]. Journal of Molecular Catalysis B: Enzymatic, 2013, 96: 81-88.
[32] KRAUS M, GRIMM C, SEIBEL J. Redesign of the active site of sucrose phosphorylase through a clash-induced cascade of loop shifts[J]. Chembiochem, 2016, 17(1): 33-36.
[33] KRAUS M, GORL J, TIMM M, et al. Synthesis of the rare disaccharide nigerose by structure-based design of a phosphorylase mutant with altered regioselectivity[J]. Chemical Communnication, 2016, 52(25): 4 625-4 627.
[34] KRAUS M, GRIMM C, SEIBEL J. Switching enzyme specificity from phosphate to resveratrol glucosylation[J]. Chemical Communication, 2017, 53(90): 12 181-12 184.
[35] MUELLER M, NIDETZKY B. Dissecting differential binding of fructose and phosphate as leaving group/nucleophile of glucosyl transfer catalyzed by sucrose phosphorylase[J]. FEBS Letters, 2007, 581(20): 3 814-3 818.