香蕉在低温贮藏过程中,容易受低温胁迫的影响[1]。缓解香蕉冷害并延长保质期、提高香蕉冷藏品质的处理方法成为研究热点。香蕉在低温贮藏过程中色泽会变暗甚至失去光泽,并且在贮藏过程中硬度逐渐下降、感官品质降低[2]。此外,香蕉在低温贮藏过程中代谢组织中会产生活性氧离子(reactive oxygen species, ROS),而抗氧化系统能够清除活性氧离子,保持其含量处于较低水平。低含量的活性氧离子具有传递信号、加速代谢等作用,而高浓度的活性氧离子则会通过氧化作用对植物组织造成损伤,加速腐败进程,因此,维持较低水平活性氧含量对抑制果蔬衰老具有积极的作用[3-4]。H2S和NO作为信号分子,在果蔬采后代谢调控中发挥着重要的作用,早在20世纪中期研究人员发现大豆、黄瓜、棉花等植物体可以释放H2S[5]。随着研究的进一步深入,发现H2S和NO参与调节植物的一系列生理学反应,包括植物的生长发育、气孔运动、衰老等[6-10]。
近年来有研究表明,H2S和NO的交互作用对植物的生理过程具有调节作用,H2S和NO都对植物生理过程具有双重作用,即在高浓度时具有细胞毒性,而在低浓度时作为细胞信号分子发挥作用,并且存在多种途径对H2S的代谢平衡进行调节[11]。WANG等[12]发现外源H2S促进内源NO的积累[15],从而增强苜蓿的耐盐性,而NO清除剂c-PTIO可以抑制H2S的这种诱导作用,表明H2S可能是通过调控NO的代谢来进行胁迫响应。H2S对于NO代谢机制的影响尚未定论,H2S不管是促进还是抑制细胞中NO的积累都有相关报导[13-14]。通过外源H2S处理可以促进NO的累积从而缓解苜蓿遭受盐胁迫,发现H2S可以促进NO的积累[15],由此推测H2S是否在缓解低温对香蕉的胁迫方面也有相同的机制。本实验以巴西蕉为实验材料,研究H2S与NO的交互作用及c-PTIO对低温贮藏的香蕉果实品质、抗氧化水平的影响,旨在为H2S与NO交互作用对香蕉低温贮藏保鲜影响的研究提供进一步的理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
选用巴西香蕉,成熟度在7~8成,挑选果型端正无褐斑和机械伤、大小均匀的果实作为试验材料。
1.1.2 主要仪器设备
CR22D111高速冷冻离心机,日本日立公司;AR423CN电子分析天平,奥豪斯仪器(上海)有限公司产品;UV-6100紫外可见分光光度计,上海元仪仪器有限公司;IN612C恒温试验箱,日本雅马拓公司;雷磁DDB-303A电导率仪,上海仪电科学仪器股份有限公司;CR-400色差仪,日本岛津公司;HH-S6数显恒温浴锅,江苏金怡仪器科技有限公司;TA.XT Plus食品质构仪,英国Stable Micro Systems公司。
1.2 试验方法
1.2.1 样品处理方法
利用不同浓度的硝普钠(sodium nitroprusside, SNP)(0.1、0.5、1、2、5、8 mmol/L)和NaHS(0.5、1、1.5、2、3、8 mmol/L)进行香蕉低温贮藏预实验,根据预实验的结果,选取保鲜效果较好的2 mmol/L SNP、1 mmol/L NaHS,以及0.03 mmol/L NO抑制剂(c-PTIO)溶液分别装入不同的真空干燥器中。在气压为0.05 MPa条件下,抽真空处理香蕉果实5 min,设定蒸馏水抽真空5 min为对照组,每组6根香蕉果实。将4组经过抽真空处理后的香蕉放入0.04 mm厚度的聚乙烯薄膜袋内进行7 ℃低温贮藏15 d。
1.2.2 低温贮藏温度及时间
香蕉果实处理后置于7 ℃恒温箱中贮藏。在第0、3、6、9、12、15天分别从每个处理组的6根香蕉中随机取4根,选取香蕉赤道部位测定其果皮的各项指标。将取出的香蕉皮切成小块放入液氮中冷冻并置于-80 ℃冰箱中贮藏备测。
1.2.3 NO含量的测定
参照ZHANG等[10]的方法加以改动,NO在酸性条件下的代谢产物为磷酸盐和亚硝酸盐,通过格里斯试剂对这些稳定离子的量进行测定,可以间接计算得出NO的含量。取冷冻香蕉果皮2.0 g,加入5 mL pH 7.50 Na3PO4缓冲液(含1 mmol/L二流苏糖醇,1 mol/L MgCl2),冰浴研磨,于4 ℃下12 000×g离心20 min,取上清液用于NO含量的测定。
1.2.4 品质指标的测定
冷害指数的测定参照PONGPRASERT等[16]的方法。
硬度的测定参照LISJAK等[13]的方法。
色泽的测定参照EUM等[17]的方法。
1.2.5 相对电导率的测定和丙二醛的测定
相对电导率的测定采用陈发河等[18]的方法。
丙二醛(malondialdehyde, MDA)含量的测定采用范蓓等[19]的方法。
1.2.6 超氧阴离子自由基![]() 产生速率和H2O2含量的测定
产生速率和H2O2含量的测定
![]() 产生速率的测定采用XU等[20]的方法。
产生速率的测定采用XU等[20]的方法。
H2O2含量的测定采用王倩[21]的方法。
1.2.7 各种抗氧酶活性的测定
酶提取液参照GARC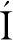 A-LIMONES等[22]的方法并加以改动,取香蕉果皮冻样2.0 g,加入8 mL pH 7.0浓度为50 mmol/L磷酸钠缓冲液(含0.1 mmol/L EDTA)。
A-LIMONES等[22]的方法并加以改动,取香蕉果皮冻样2.0 g,加入8 mL pH 7.0浓度为50 mmol/L磷酸钠缓冲液(含0.1 mmol/L EDTA)。
超氧化物歧化酶(superoxide dismutase,SOD)活性测定参照FU等[23]的方法并加以改动,测定采用南京建成总超氧化物歧化酶试剂盒。
抗坏血酸过氧化物酶(aseorbateperoxidase, APX)活性测定参照PONGPRASERT等[16]的方法并加以改动,活性测定时反应体系包括:0.1 mL酶提取液,0.1 mL 5 mmol/L抗坏血酸钠溶液, 1.7 mL 50 mmol/L Na3PO4缓冲液,0.1 mL 20 mmol/L H2O2(最后加入反应体系以启动反应)。
苯丙氨酸解氨酶(phenylalanineammo-nialyase, PAL)活性测定参照YINGSANGA等[24]的方法并加以改动,活性测定时反应体系包括:2 mL pH 7.8硼酸缓冲液,1.0 mL 20 mmol/L的苯丙氨酸缓冲液,0.2 mL的酶提取液。
过氧化氢酶(catalase, CAT)活性测定参考刘琦琦等[25]方法并加以改动,活性测定时反应体系包括:8 mL pH 7.0,浓度为 50 mmol/L Na3PO4缓冲液,0.1 mL酶提取液,0.2 mL 40 mmol/L 的H2O2(最后加入反应体系)。
过氧化物酶(peroxidase, POD)活性测定参考刘畅等[26]方法并加以改动,活性测定时反应体系包括:2 mL pH 7.0, 浓度为 50 mmol/L Na3PO4缓冲液(含40 mmol/L冻结愈创木酚),150 μL的提取液和0.08%的H2O2。
1.3 数据处理
各指标测定均重复3次,采用SPSS 10.0软件进行显著性分析,P<0.01表示差异极显著,用Origin软件对数据进行方差分析(ANOVA),P表示最小显著性差异(least-significant difference, LSD)在0.05水平的数值。
2 结果与分析
2.1 H2O、NO、H2S、c-PTIO处理对NO含量的影响
由图1可看出,香蕉果皮的NO含量在低温贮藏期间大体呈现逐渐下降的趋势,其中经NO处理的香蕉果皮的NO含量呈现先上升后下降的趋势,并且始终高于对照组NO含量的水平。在低温贮藏第3天时,经NO处理的香蕉果皮的NO含量达到最高值,为同期c-PTIO处理组香蕉果皮NO含量的2.23倍。

图1 外源NO、H2S、c-PTIO和H2O处理对香蕉果皮NO浓度的影响
Fig.1 Effects of exogenous NO, H2S, c-PTIO and H2O treatments on NO concentration in banana peel
2.2 H2O、NO、H2S、c-PTIO处理对香蕉果皮冷害指数的影响
香蕉冷害现象的直接表现为果实表面出现凹陷、变黑甚至腐烂,冷害指数是评价冷害程度的指标。从图2得出,低温贮藏至9 d时,经NO和H2S处理的香蕉冷害指数要小于对照组,而c-PTIO处理的香蕉则会产生相反的效果,冷害指数明显大于对照组。在低温贮藏第9天时,经NO处理的香蕉冷害指数仅为对照组的1/3。
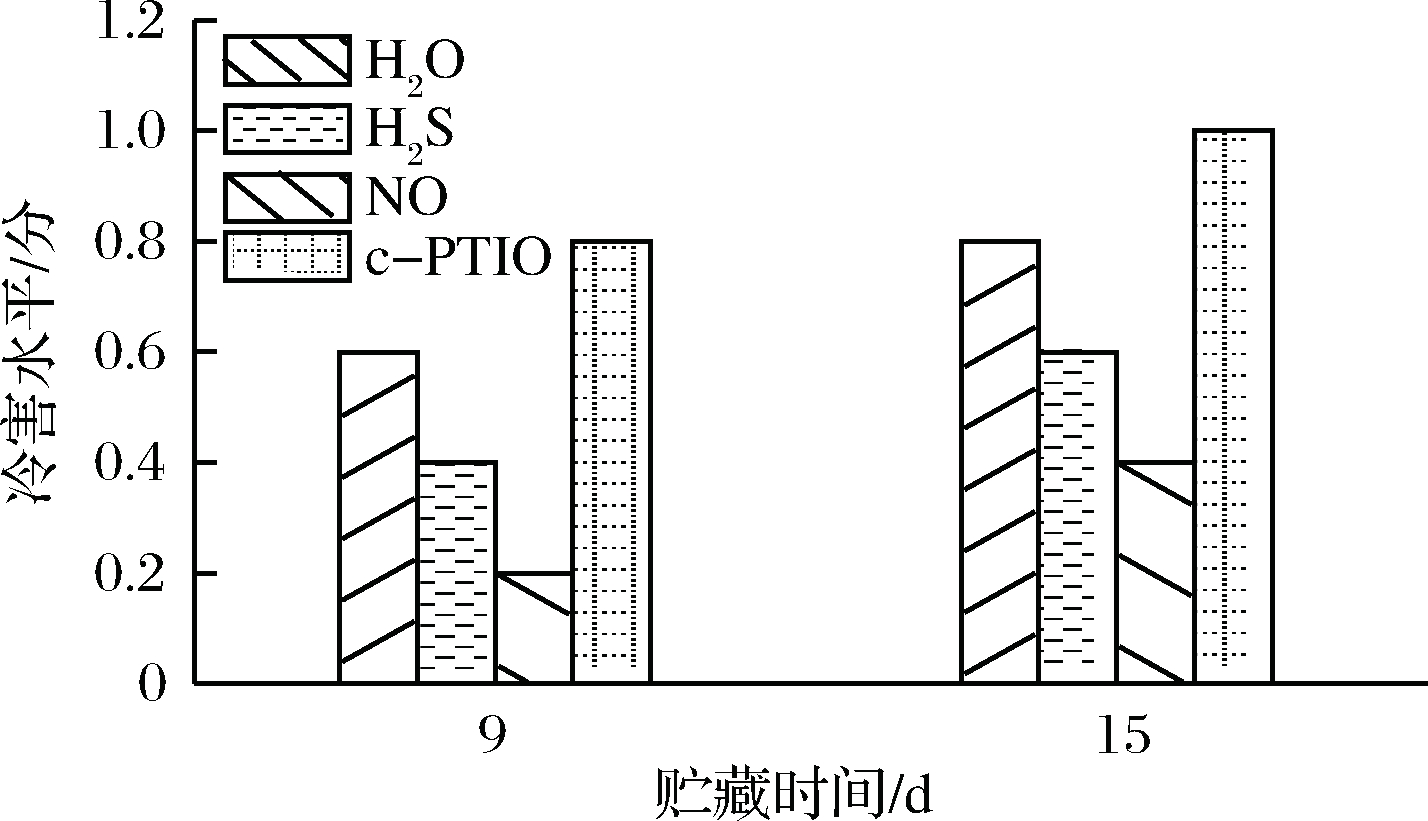
图2 外源NO、H2S、c-PTIO和H2O处理对香蕉果皮冷害指数的影响
Fig.2 Effects of exogenous NO, H2S, c-PTIO and H2O treatments on chilling index of banana peel
2.3 H2O、NO、H2S、c-PTIO处理对香蕉果皮低温贮藏期间硬度的影响
软化是果实成熟、衰老的重要标志。从图3可以看出,香蕉果皮硬度整体变化趋势为先上升后下降。其中对照组的果皮硬度在贮藏过程中波动较大。在低温贮藏第9天时,经NO处理的香蕉果皮硬度明显高于对照组,其差值为8.62%,而其他处理组的果皮硬度则要略低于对照组。
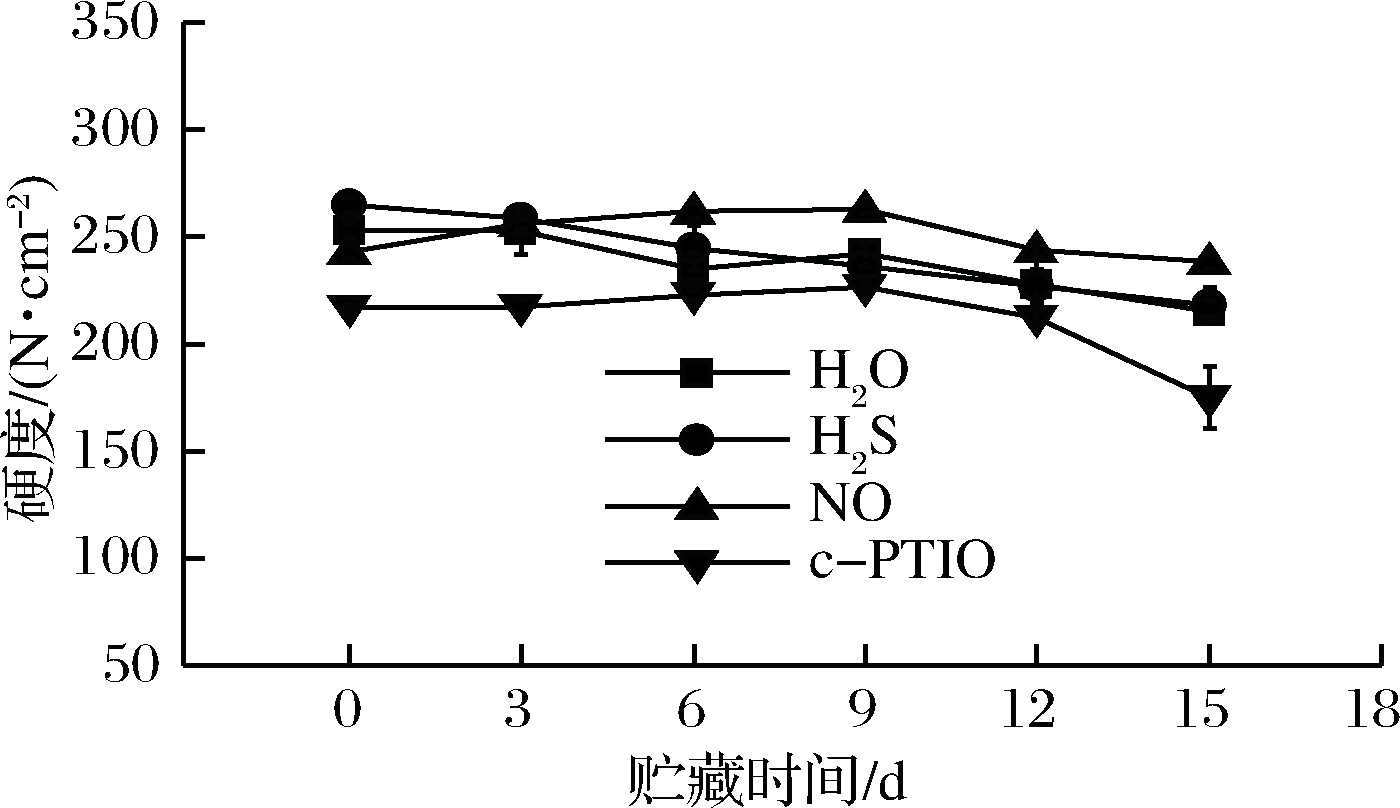
图3 外源NO、H2S、c-PTIO和H2O处理对香蕉果皮硬度的影响
Fig.3 Effects of exogenous NO, H2S, c-PTIO and H2O treatments on the hardness of banana peel
在低温贮藏第15天时,经NO处理的香蕉果皮硬度明显高于对照组,而经c-PTIO处理的香蕉果皮硬度则仅为对照组的76.90%,比硬度最高的处理组低36.30%。
2.4 H2O、NO、H2S、c-PTIO处理对低温贮藏期间香蕉果皮色泽的影响
香蕉在7~8成熟采收后颜色呈现绿色,随着贮藏时间的延长,香蕉逐渐变为黄色。但遭受冷害的香蕉不能正常后熟,香蕉表皮会变发生褐变,因此香蕉表观颜色是评价香蕉受冷害程度的重要指标。从表1可以看出,香蕉的亮度与色度角在低温贮藏过程中均成下降趋势,其中对照组的色度角在前期下降速度较快,而后期下降速度逐渐减慢。经c-PTIO处理的香蕉色度角在各个阶段均低于对照组,在6~15 d差异尤为明显,在第12天时,经c-PTIO处理的香蕉色度角比对照组低12.84%。
表1 外源NO、H2S、c-PTIO和H2O处理对香蕉果皮色泽的影响
Table 1 Effects of exogenous NO, H2S, c-PTIO and H2O treatment on the color of banana peel
注:不同小写字母表示同一行不同组间差异显著(P<0.05)
贮藏时间/d色度角亮度对照H2SNOc-PTIO对照H2SNOc-PTIO0117.23±0.76a117.52±0.5a116.94±0.86b116.94±1.59a58.82±1.15a57.07±0.94a58.1±0.1858.55±0.46a3116.62±1.24a115.45±2.09a116.95±0.88b115.64±1.12a57.00±1.04a57.99±2.46a57.85±2.3757.87±1.19c698.53±1.72c106.18±1.19c107.32±2.72a97.53±2.05a52.35±0.44c56.68±1.18c56.57±0.6a51.70±0.77a997.69±1.08d100.74±0.27d102.76±4.39c93.45±2.34c50.17±0.22c52.17±1.16c54.47±1.65c42.18±1.85a1294.74±2.94a98.92±0.32a97.54±2.33d83.82±4.94d45.22±1.79d49.83±1.22d52.76±0.58d38.90±1.65c1591.61±1.5a93.12±2.93a95.76±0.36a76.61±5.16a43.88±1.44a49.03±0.86d50.23±1.04a38.07±2.55a
2.5 H2O、NO、H2S、c-PTIO处理对低温贮藏期间香蕉果皮相对电导率和MDA含量的影响
植物在遭受寒冷胁迫时,自身活性氧会大量积累,从而诱发膜脂的过氧化作用。MDA是膜脂过氧化重要的产物之一,与相对电导率同为反应膜系统受损程度以及植物抗逆性的重要指标[27],如图4所示。
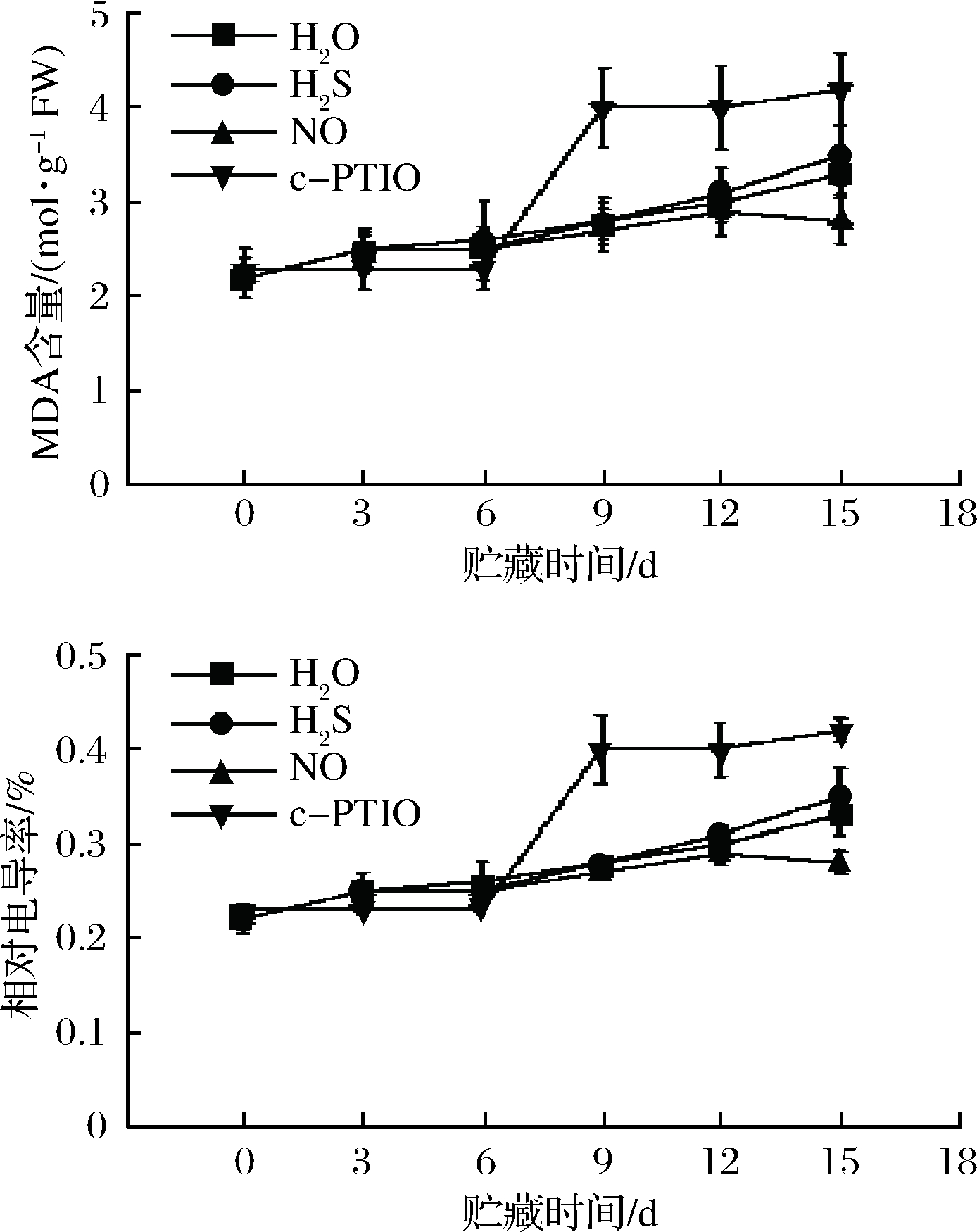
图4 外源NO、H2S、c-PTIO和H2O处理对香蕉果皮MDA含量和相对电导率的影响
Fig.4 Effects of exogenous NO, H2S,c-PTIO and H2O treatments on the relative conductivity of MDA content in banana peel
在6~15 d时,经c-PTIO处理的香蕉中MDA含量上升幅度要明显大于其他处理组及对照组。在第9天时,经c-PTIO处理的香蕉MDA含量比对照组高42.86%;并且相对电导率与对照组电导率的差异达到最大,为40.02%。随着贮藏时间的延长,差异逐渐减小,在第15天时,c-PTIO处理组比对照组低25.95%。
2.6 H2S、NO、H2O、c-PTIO处理对低温贮藏期间香蕉果皮H2O2含量和 产生速率的影响
产生速率的影响
H2O2和![]() 都是活性氧分子,产生和积累过量时都会对果蔬的细胞结构造成伤害。从图5可以看出,在6~15 d时,经c-PTIO处理的香蕉H2O2含量明显增加,增加幅度超过其他处理组及对照组,在第12天时差异达到最大,比对照组高29.07%。
都是活性氧分子,产生和积累过量时都会对果蔬的细胞结构造成伤害。从图5可以看出,在6~15 d时,经c-PTIO处理的香蕉H2O2含量明显增加,增加幅度超过其他处理组及对照组,在第12天时差异达到最大,比对照组高29.07%。
由图5可知,不同处理组及对照组香蕉![]() 产生速率在低温贮藏过程中呈现先上升后下降的趋势,c-PTIO处理组与对照组产生速率要明显大于其他处理组。
产生速率在低温贮藏过程中呈现先上升后下降的趋势,c-PTIO处理组与对照组产生速率要明显大于其他处理组。

图5 外源NO、H2S、c-PTIO和H2O处理对香蕉果皮H2O2含量和![]() 生成速率的影响
生成速率的影响
Fig.5 Effects of exogenous NO, H2S,c-PTIO and H2O treatments on H2O2 content and ![]() formation rate in banana peel
formation rate in banana peel
2.7 H2O、NO、H2S、c-PTIO处理对抗氧酶系统的影响
抗氧化系统在植物清除自由基中发挥着重要的作用,这个系统包括2大类,一类是由酚类物质,抗坏血酸(asobic acid, ASA)、谷胱甘肽(glutathione, GSH)等非酶抗氧化物质组成,另一类是APX、SOD、谷胱甘肽还原酶(glutathione reductase, GR)、POD等抗氧化酶,其中ASA-GSH循环系统在冷害防御体系中扮演着重要的角色[28]。
2.7.1 香蕉果皮SOD、POD及CAT酶活性的变化
从图6可以看出,SOD活性在低温贮藏过程中整体呈现逐渐下降的趋势,其中经c-PTIO处理的香蕉的SOD酶活性下降速度要明显快于其他处理组,与对照组下降速度相当。其中经H2S,NO处理的香蕉酶活性要明显高于对照组,其中H2S处理组最高,在第15天时,与对照组差异达到50.10%。在整个贮藏过程中,除经c-PTIO处理的香蕉外,其他处理组CAT酶活性均高于对照组。经NO处理的香蕉CAT酶活力为所有处理组中最高的,且在第9天时与对照组活性差异达到最大,较对照组高28.30%,为c-PTIO处理组活性的1.79倍。在3~12 d的贮藏过程中,H2S及NO处理组的POD酶活性都高于对照组及c-PTIO处理组。

图6 外源NO、H2S、c-PTIO和H2O处理对香蕉果皮SOD、POD及CAT酶活性的影响
Fig.6 Effects of exogenous NO, H2S, c-PTIO and H2O treatment on SOD, POD and CAT activities in banana peel
2.7.2 香蕉果皮APX和PAL活性的变化
从图7可知,APX酶活性在低温贮藏过程中均呈现逐渐上升的趋势。其中经H2S和NO处理的香蕉APX酶活性的上升幅度要明显大于其他处理组及对照组,且在第12天时与其他处理组及对照组的活性差异达到最大,H2S处理组酶活性比对照组高23.33%,NO处理组酶活性比对照组高26.28%。在0~12 d内c-PTIO处理组的PAL酶活性要明显低于其他处理组,且在第3天时,差值达到最大,经H2S处理的香蕉果实的PAL酶活性达到了对照组的1.6倍,是c-PTIO处理组的1.7倍,差异随贮藏时间延长逐渐缩小。

图7 外源NO、H2S、c-PTIO和H2O处理对香蕉果皮APX和PAL活性的影响
Fig. Effects of exogenous NO, H2S, c-PTIO and H2O treatments on APX and PAL activity of banana peel
3 结论与讨论
H2S和NO的交互作用可以延缓在冷藏期间香蕉果实硬度下降、保持较好的光泽度,而c-PTIO处理则呈现相反的效果。类似的结论也见于葡萄研究中,使用外源H2S及NO对低温贮藏下的果实进行处理,可以通过抑制其活性氧产物的积累,从而提高其抗氧化酶系统的活性,来减轻果实遭受冷害的程度[29]。在低温贮藏过程中香蕉颜色逐渐变暗、失去光泽度,通过H2S和NO处理可以减缓叶绿素的降解来保持采后果皮的光泽度和鲜亮的颜色,减少叶绿体脂质和蛋白质氧化的程度,此外还可以作用于叶绿体进而影响和调控一系列下游信号分子,该结果与前期研究结果相类似[30]。香蕉果皮的相对电导率在整个低温贮藏过程中的变化趋势与MDA含量大致相同,整体呈现上升趋势,这与HU等[31]和陈发河等[18]研究的结果相类似。
香蕉在采后低温冷藏过程中,![]() 生成速率呈逐渐上升的趋势,说明果实组织遭受氧化胁迫程度加深,从而引起MDA含量升高,而经过H2S和NO交互作用可以有效减缓氧化胁迫和脂膜氧化进程,此现象与前期研究结果相类似[20,32]。WU等[34]和LIU等[35]也研究发现,使用NO和H2S对果实进行处理能够有效降低低温贮藏期间H2O2的含量和
生成速率呈逐渐上升的趋势,说明果实组织遭受氧化胁迫程度加深,从而引起MDA含量升高,而经过H2S和NO交互作用可以有效减缓氧化胁迫和脂膜氧化进程,此现象与前期研究结果相类似[20,32]。WU等[34]和LIU等[35]也研究发现,使用NO和H2S对果实进行处理能够有效降低低温贮藏期间H2O2的含量和![]() 的累积,减少脂质过氧化现象的出现、阻碍蛋白质失活,从而保护细胞结构。
的累积,减少脂质过氧化现象的出现、阻碍蛋白质失活,从而保护细胞结构。
在植物受到逆境胁迫时,SOD、CAT及POD可以有效清除过高的活性氧,保持细胞内的活性氧处于一个较低水平从而减少对细胞造成的伤![]() 生成速率和SOD、CAT、POD活性在低温贮藏过程中呈现先降低后上升的趋势,表明低温可以暂时延缓氧化胁迫,但长时间的低温贮藏则会引起活性氧代谢失衡,过量的活性氧会破坏细胞膜的完整性,并进一步引起膜脂氧化作用,增强细胞膜的透性和MDA含量,同时活性氧的积累也可能提高抗氧化酶的活性,从而减缓氧化胁迫对组织的伤害,这与ZHANG等[10]的观点相似。此外也有研究得出,H2S和NO交互作用可以有效降低香蕉果实SOD、POD及CAT的活性,说明H2S和NO处理可以降低蛋白质分解的速度和膜脂氧化程度,从而达到保持果实冷藏品质的效果[36]。
生成速率和SOD、CAT、POD活性在低温贮藏过程中呈现先降低后上升的趋势,表明低温可以暂时延缓氧化胁迫,但长时间的低温贮藏则会引起活性氧代谢失衡,过量的活性氧会破坏细胞膜的完整性,并进一步引起膜脂氧化作用,增强细胞膜的透性和MDA含量,同时活性氧的积累也可能提高抗氧化酶的活性,从而减缓氧化胁迫对组织的伤害,这与ZHANG等[10]的观点相似。此外也有研究得出,H2S和NO交互作用可以有效降低香蕉果实SOD、POD及CAT的活性,说明H2S和NO处理可以降低蛋白质分解的速度和膜脂氧化程度,从而达到保持果实冷藏品质的效果[36]。
APX作为辅助抗氧化酶,其含量呈逐渐上升的趋势;PAL作为酚类合成过程中至关重要的酶之一,其含量呈先上升后逐渐下降的趋势。这可能是由于各种代谢加剧,活性氧含量增加,引发了抗氧化系统[30,37-38]。最近,有研究表明H2S处理可以降低脂氧合酶的活性(lipoxygenase, LOX),通过减少活性氧含量,进而可以维持抗坏血酸和谷胱甘肽处于一个较高的水平,同时增加APX、GR活性,进一步缓解许多植物的非生理胁迫[39-40]。在低温条件下,经NO和H2S处理后的果蔬PAL含量的增加可能与其自身的防御机制有关,同时也促进了多酚类物质的积累[41]。在番茄幼苗的研究中,NO和H2S处理可以通过提高其抗氧化酶活性来缓解盐胁迫和干旱胁迫对植物组织带来的伤害[42-43]。由此推断NO和H2S的交互作用来缓解低温胁迫对香蕉组织产生的影响。
综上,H2S和NO处理可以降低香蕉果实冷害程度,维持硬度,延缓果实相对电导率、MDA含量和![]() 产生速率,减缓细胞膜的破坏并且保持果实较高的抗氧化酶活性。这些都说明适当浓度H2S和NO的交互作用有助于维持被处理果实的抗氧化活性,并且能降低由于活性氧累积带来的氧化胁迫,从而较好地维持低温贮藏条件下果实的品质。但H2S对于NO代谢机制的影响尚未定论,H2S促进还是抑制细胞中NO的积累都有相关报导,本实验仅从生理生化角度对H2S和NO交互作用机制对缓解低温贮藏果蔬冷害进行研究,下一步将结合转录组测序分析技术,在全基因组水平上监测H2S和NO处理诱导香蕉基因表达水平的变化,系统总结H2S和NO信号分子在香蕉采后耐冷性形成过程中的作用机制,筛选鉴定未知的参与低温响应调控的信号分子和在香蕉耐冷性调控过程中起关键作用的代谢途径,构建H2S和NO的交互作用诱导耐冷性的信号转导通路,为H2S与NO信号分子的功能研究及其交互作用调控耐冷性的假说提供实验依据。
产生速率,减缓细胞膜的破坏并且保持果实较高的抗氧化酶活性。这些都说明适当浓度H2S和NO的交互作用有助于维持被处理果实的抗氧化活性,并且能降低由于活性氧累积带来的氧化胁迫,从而较好地维持低温贮藏条件下果实的品质。但H2S对于NO代谢机制的影响尚未定论,H2S促进还是抑制细胞中NO的积累都有相关报导,本实验仅从生理生化角度对H2S和NO交互作用机制对缓解低温贮藏果蔬冷害进行研究,下一步将结合转录组测序分析技术,在全基因组水平上监测H2S和NO处理诱导香蕉基因表达水平的变化,系统总结H2S和NO信号分子在香蕉采后耐冷性形成过程中的作用机制,筛选鉴定未知的参与低温响应调控的信号分子和在香蕉耐冷性调控过程中起关键作用的代谢途径,构建H2S和NO的交互作用诱导耐冷性的信号转导通路,为H2S与NO信号分子的功能研究及其交互作用调控耐冷性的假说提供实验依据。
[1] 罗自生,杜瑞雪,王延圣,等.硫氢化钠诱导采后香蕉耐冷性的研究[J].现代食品科技,2015,31(2):205-210.
[2] ZHANG T, CHE F, ZHANG H, et al. Effect of nitric oxide treatment on chilling injury, antioxidant enzymes and expression of the Cm CBF1 and Cm CBF3 genes in cold-stored Hami melon (Cucumis melo L.) fruit[J]. Postharvest Biology and Technology, 2017, 127: 88-98.
[3] FOYER C H, NOCTOR G. Oxidant and antioxidant signalling in plants a re-evaluation of the concept of oxidative stress in a physiological context [J]. Plant, Cell and Environment, 2005, 28(8): 1 056-1 071.
[4] FOYER C H, NOCTOR G. Ascorbate and glutathione: the heart of the redox hub [J]. Plant Physiology, 2011, 155(1): 2-18.
[5] WILSON L G, BRESSAN R A, FILNER P, et al. Light-dependent emission of hydrogen sulfide from plants[J]. Plant Physiology, 1978, 61(2):184-189.
[6] CARLOS GARC -MATA, LAMATTINA L, HYDROGEN SULPHIDE. Hydrogen sulphide, a novel gasotransmitter involved in guard cell signalling[J]. New Phytologist, 2010, 188(4):977-984.
-MATA, LAMATTINA L, HYDROGEN SULPHIDE. Hydrogen sulphide, a novel gasotransmitter involved in guard cell signalling[J]. New Phytologist, 2010, 188(4):977-984.
[7] SCUFFI D, ALVAREZ C, LASPINA N, et al. Hydrogen sulfide generated by L-cysteine desulfhydrase acts upstream of nitric oxide to modulate abscisic acid-dependent stomatal closure[J]. Plant Physiology, 2014, 166(4):2 065-2 076.
[8] SAMI F, FAIZAN M, FARAZ A, et al. Nitric oxide-mediated integrative alterations in plant metabolism to confer abiotic stress tolerance, NO crosstalk with phytohormones and NO-mediated post translational modifications in modulating diverse plant stress[J]. Nitric Oxide, 2018, 73:22-38.
[9] 郭芹, 吴斌,王吉德,等.NO处理对番木瓜采后贮藏性的影响[J]. 食品科学, 2011,32(4):227-231.
[10] ZHANG X, SHEN L, LI F, et al. Methyl salicylate-induced arginine catabolism is associated with up-regulation of polyamine and nitric oxide levels and improves chilling tolerance in cherry tomato fruit[J]. Journal of Agricultural and Food Chemistry, 2011, 59(17):9 351-9 357.
[11] YAMASAKI H, COHEN M F. Biological consilience of hydrogen sulfide and nitric oxide in plants: Gases of primordial earth linking plant, microbial and animal physiologies[J]. Nitric Oxide-Biology and Chemistry, 2016:55-56; 91-100.
[12] WANG Y Q, LI L, CUI W T, et al. Hydrogen sulfide enhances alfalfa (Medicago sativa) tolerance against salinity during seed germination by nitric oxide pathway[J]. Plant and Soil, 2012,351(1-2):107-119.
[13] LISJAK M, SRIVASTAVA N, TEKLIC T, et al. A novel hydrogen sulfide donor causes stomatal opening and reduces nitric oxide accumulation[J]. Plant Physiology and Biochemistry, 2010, 48(12): 931-935.
[14] HANCOCK J T, WHITEMAN M, et al. Hydrogen sulfide and cell signaling: Team player or referee?[J]. Plant Physiology and Biochemistry, 2014, 78:37-42.
[15] 周万海,师尚礼,寇江涛,等.一氧化氮对NaCl胁迫下苜蓿种子萌发的影响[J]. 核农学报,2012,26(4):710-716.
[16] PONGPRASERT N, SEKOZAWA Y, SUGAYA S, et al. A novel postharvest UV-C treatment to reduce chilling injury (membrane damage, browning and chlorophyll degradation) in banana peel[J]. Scientia Horticulturae, 2011, 130(1):73-77.
[17] EUM H L, HWANG D K, LEE S K, et al. Nitric oxide reduced chlorophyll degradation in broccoli (Brassica oleracea L. var. italica) florets during senescence[J]. Food Science and Technology International, 2009, 15(3):223-228.
[18] 陈发河,张美姿,吴光斌.NO处理延缓采后枇杷果实木质化劣变及其能量代谢的关系[J]. 中国农业科学,2014,47(2):2 425-2 434.
[19] 范蓓,杨杨,王锋,等.外源NO处理对采后芒果耐冷性的影响[J]. 核农学报,2013,27(6):800-804.
[20] XU M, DONG J, ZHANG M, et al. Cold-induced endogenous nitric oxide generation plays a role in chilling tolerance of loquat fruit during postharvest storage[J]. Postharvest Biology & Technology, 2011, 65:5-12.
[21] 王倩.H2S延长梨果实及甘薯块根采后贮藏期的抗氧化机制研究[D].合肥:合肥工业大学,2012.
[22] GARCI -LIMONES C, HERV
-LIMONES C, HERV S A, NAVAS-CORTÉS J A, et al. Induction of an antioxidant enzyme system and other oxidative stress markers associated with compatible and incompatible interactions between chickpea (Cicer arietinum L.) and Fusarium oxysporum f. sp.ciceris[J]. Physiological and Molecular Plant Pathology, 2002, 61(6):325-337.
S A, NAVAS-CORTÉS J A, et al. Induction of an antioxidant enzyme system and other oxidative stress markers associated with compatible and incompatible interactions between chickpea (Cicer arietinum L.) and Fusarium oxysporum f. sp.ciceris[J]. Physiological and Molecular Plant Pathology, 2002, 61(6):325-337.
[23] FU P, WANG W, HOU L, et al. Hydrogen sulfide is involved in the chilling stress response in Vitis vinifera L.[J]. Acta Societatis Botanicorum Poloniae, 2013, 82(4):295-302.
[24] YINGSANGA P, SRILAONG V, KANLAYANARAT S, et al. Relationship between browning and related enzymes (PAL, PPO and POD) in rambutan fruit (Nephelium lappaceum Linn.) cvs. Rongrien and See-Chompoo[J]. Postharvest Biology and Technology, 2008, 50(2-3):164-168.
[25] 刘琦琦,徐娟,王黎明,等.外源H2S对“尖脆”枣果实贮藏品质及抗氧化能力的影响[J].北方园艺,2018(22):135-142.
[26] 刘畅,徐玉娟,李升锋,等.龙眼果肉中多酚氧化酶和过氧化物酶性质研究[J].食品工业科技,2008,29(7):102-104.
[27] QIAN C L,HE Z P, ZHAO Y Y,et al. Maturity-dependent chilling tolerance regulated by the antioxidative capacity in postharvest cucumber (Cucumis sativus L.) fruit[J]. Journal of the Science of Food & Agriculture, 2013, 93(3):626-633.
[28] MITTLER R, VANDERAUWERA S, GOLLERY M, et al. Reactive oxygen gene network of plants[J]. Trends in Plant Science, 2004, 9(10):490-498.
[29] LUO Z, LI D, DU R, et al. Hydrogen sulfide alleviates chilling injury of banana fruit by enhanced antioxidant system and proline content[J]. Scientia Horticulturae, 2015, 183:144-151.
[30] LI D, LIMWACHIRANON J, LI L, et al. Involvement of energy metabolism to chilling tolerance induced by hydrogen sulfide in cold-stored banana fruit[J]. Food Chemistry, 2016, 208:272-278.
[31] HU L Y, HU S L, WU J, et al. Hydrogen sulfide prolongs postharvest shelf life of strawberry and plays an antioxidative role in fruits[J]. Journal of Agricultural and Food Chemistry, 2012, 60(35):8 684-8 693.
[32] XIA Y X, CHEN T, QIN G Z, et al. Synergistic action of antioxidative systems contributes to the alleviation of senescence in kiwifruit[J]. Postharvest Biology and Technology, 2016, 111:15-24.
[33] YANG S Y, SU X G, PRASAD K N, et al. Qxidation and peroxidation of postharvest banana fruit during softening [J].Pakistan Journal of Botany,2008,40(5):2 023-2 029.
[34] WU B, GUO Q, LI Q, et al. Impact of postharvest nitric oxide treatment on antioxidant enzymes and related genes in banana fruit in response to chilling tolerance[J]. Postharvest Biology and Technology, 2014, 92:157-163.
[35] LIU Y J, JIANG H F, ZHAO Z G, et al. Nitric oxide synthase like activity-dependent nitric oxide production protects against chilling-induced oxidative damage in Chorispora bungeana suspension cultured cells[J]. Plant Physiology & Biochemistry, 2010, 48(12):936-944.
[36] SHI H, YE T, CHAN Z, et al. Nitric oxide-activated hydrogen sulfide is essential for cadmium stress response in bermudagrass (Cynodon dactylon (L). Pers.)[J]. Plant Physiology and Biochemistry, 2014, 74:99-107.
[37] HE Y, HUANG B. Differential responses to heat stress in activities and isozymes of four antioxidant enzymes for two cultivars of Kentucky bluegrass contrasting in heat tolerance[J]. Journal of the American Society for Horticultural Science, 2010, 135(2):116-124.
[38] SONG L L, GAO H Y, CHEN H J, et al. Effect of short-term anoxic treatment on antioxidant ability and membrane integrity of postharvest kiwifruit during storage [J]. Food Chemistry, 2009, 114(4): 1 216-1 221.
[39] SHAN C J, ZHANG S L, LI D F, et al. Effects of exogenous hydrogen sulfide on the ascorbate and glutathione metabolism in wheat seedlings leaves under water stress[J]. Acta Physiologiae Plantarum, 2011, 33(6):2 533-2 540.
[40] SHAN C, DAI H, SUN Y. Hydrogen sulfide protects wheat seedlings against copper stress by regulating the ascorbate and glutathione metabolism in leaves[J]. Australian Journal of Crop Science, 2012, 6(2):248-254.
[41] HU K, WANG Q, HU L, et al. Hydrogen sulfide prolongs postharvest storage of fresh-cut pears (Pyrus pyrifolia) by alleviation of oxidative damage and inhibition of fungal growth[J]. PLoS ONE, 2014, 9(1):e85524.
[42] DIAO Q N, SONG Y J, SHI D M, et al. Nitric oxide induced by polyamines involves antioxidant systems against chilling stress in tomato (Lycopersicon esculentum Mill.) seedling[J]. Journal of Zhejiang University Science B, 2016, 17(12):916-930.
[43] LIANG Y, ZHENG P, LI S, et al. Nitrate reductase-dependent NO production is involved in H2S-induced nitrate stress tolerance in tomato via activation of antioxidant enzymes[J]. Entia Horticulturae, 2018, 229:207-214.