加热处理是大豆生产加工过程中的重要步骤,具有钝化抗营养因子和脂肪氧合酶,杀灭微生物,提高蛋白质消化率,去除生豆味等一系列作用。传统制浆一般采用蒸汽直喷加热,虽然传热效率高,不易结垢,但存在豆浆被稀释以及产品受污染等缺点。板式换热器传热系数高、换热面积大、占地面积小,在乳品、饮料生产线中被广泛应用。采用换热器加热不仅能很好地保持豆浆原有品质,还更安全、卫生。豆浆是由蛋白质、脂肪、碳水化合物和矿物质等组成的复杂流体。在加热过程中,豆浆的流变特性或豆浆组分的结构发生变化,从而在热表面上形成沉积物,导致换热器的传热效率下降,影响正常生产。
目前关于热表面沉积行为的研究主要集中在动物乳方面。牛乳杀菌时加热表面沉积物的量会随着时间而增加,并且总换热系数逐渐降低。温度是决定间接加热系统中沉积物成分的最重要因素[1]。FRYER与SLATER指出,在较高温度下形成的牛乳沉积物具有较低比例的蛋白质和较高比例的矿物质,并且增加热表面流体的流动速率可降低沉积速率[2-3]。牛乳在巴氏杀菌过程中形成沉积物被称为A型沉积物,含有蛋白质(50%~60%),矿物质(30%~35%)和脂肪(4%~8%)[4]。大多数β-乳球蛋白在受热表面或附近会发生变性,并且由于物理化学反应聚集而形成沉积物[5]。A型沉积物由靠近热交换器表面的富含矿物质的内层和富含蛋白质的外层组成[6-9]。当加热温度较高时(110 ℃以上),牛乳会形成以矿物质为主的B型沉积物,含有矿物质(主要是磷酸钙)(70%~80%)、蛋白质(15%~20%)和脂肪(4%~8%)[10-11]。
豆浆的理化特性与牛乳相比有很大差异,其矿物质含量也比较低。生豆浆中的大豆蛋白虽然是可溶的,但是加热后容易形成较大分子量的聚集体。此外,植酸含量较高,可以与钙、镁等二价金属离子形成不溶性复合物,这说明豆浆同样具有在加热表面沉积的可能性并且可能具有不同的沉积行为。研究表明,在某些条件下,豆浆沉积物积累的速度更快,并且其沉积物的特性不同于牛乳[12]。
根据BANSAL等[13]对影响牛乳沉积行为因素的描述,牛乳性质及操作温度能够影响牛乳的沉积行为。大豆蛋白在不同的pH下经过加热后具有不同的聚集程度,并且豆浆进料温度也可能影响沉积行为。本研究利用自制的小型板式换热器系统对豆浆进行加热,并对加热过程中发生的沉积现象进行探讨,通过记录系统的参数变化考察豆浆pH值与进料温度对沉积速率的影响,同时对沉积物的组成进行分析,为进一步开发大豆制浆及加工工艺提供支持。
1 材料与方法
1.1 材料与仪器
大豆,无锡市场;试验所用试剂除特殊交代外均为分析纯;AA-240型原子吸收分光光度计,美国瓦里安公司;FE28型pH计,上海梅特勒-托利多仪器有限公司;豆浆机,欧莱特电器有限公司;HH-S数显恒温水浴锅,江苏省金坛市医疗设备有限公司;BPG-9156A 精密鼓风干燥箱,上海一恒科学仪器有限公司。
1.2 试验设备
自制的板式换热器系统结构见图1,包括板式换热器、物料泵、物料罐、热水罐、热水泵、钎焊板片换热器以及预热罐等。控制部分包括进料流量计、进料流量调节阀、进料温度计、加热段出料温度传感器及压力表、冷却段出料温度计等。板式换热器加热部分由14块SUS304人型波纹换热板组成,形成13个通道,豆浆在2、4、6、8、10、12通道流动,在1、3、5、7、9、11、13通道中逆流通入热水。

图1 装置设计示意图
Fig.1 Diagram of designed apparatus
板式换热器加热部分的详细设计尺寸见表1。
表1 加热部分设计参数
Table 1 Detailed design of the heating section

项目参数项目参数板片材料不锈钢(AISI 304)豆浆通道间隙, bc/m0.002板片导热系数,lp/(W·mK-1)16.2热水通道间隙, bw/m0.002板片宽度,w/m0.096 5单通道流道截面积,fd/m20.000 15板片长度, Lch/m0.260 0波纹深度/m0.002板片厚度, a/m0.000 4总传热面积, AT/m20.220板片类型人形波纹板内部流动方式逆流
1.3 试验设计
1.3.1 运行条件及方法
设定不同的运行时间(0.5、1.5、3.0、5.0 h),研究沉积物的成分随时间的变化。约8 kg豆浆以75 L/h的流速注入板式换热器加热部分,pH为6.70,进料温度60 ℃,压力约0.22 MPa。热水流速与压力分别控制在200 L/h、0.35 MPa,热水入口温度约137 ℃。随后分别控制豆浆的pH值(6.3、6.5、6.7、6.9、7.1)和进料温度(30、50、70 ℃),其他条件相同,进行试验,运行时间5 h。
每次试验运行之前,用碱液彻底清洁整个系统,并用大量水冲洗以确保最大的换热效率,使用的蒸汽发生器能够提供相同的蒸汽量及压力。豆浆和反渗透纯(reverses osmosis, RO)水分别装在物料罐和热水罐中,首先将水送入测试区,然后将其他运行参数控制在设定条件,稳定后切换阀门通入豆浆。物料罐中的豆浆进入加热部分,加热到一定温度后进入冷却部分冷却,随后返回到预热段进行预热,最后返回至物料罐。测试部分的热水回到热水罐进行循环。所有实验运行的启动时间约为3 min,每30 s记录温度T1、T2、T3、T4。
在该试验中,豆浆被高流量的热水加热,并且热水的进料温度设计遵循工业惯例。所有实验运行中保持相同水平的温度驱动力,即处于清洁状态时,对数平均温差为17.6 ℃。该设备由食品行业常用的设备组成,并且流体通道内的雷诺数达到了与实际生产相似的要求。
1.3.2 沉积物的收集
每次试验完成后,拆卸板式换热器,取出加热部分的换热板,用清水轻微漂洗,去除板上残留的豆浆,将其放入约1.5 L的体积分数5%氨水中,于60 ℃下浸泡90 min,再将板上的沉积物转移至氨水中。然后再将换热板置于约1.5 L的体积分数5%乙酸溶液中,于60 ℃下浸泡90 min后,将剩余的沉积物从板上转移至乙酸溶液,将其浓缩干燥,除去乙酸。并将干燥后的样品水洗至浓缩后的氨水中,经冷冻干燥获得沉积物样品。
1.4 成分分析
1.4.1 豆浆及沉积物的基本成分测定
参考 GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》规定的方法测定蛋白质含量;参考 GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》规定的方法测定脂肪含量;参考GB 5009.4—2016 《食品安全国家标准 食品中灰分的测定》规定的方法测定灰分含量;参考GB 5009.92—2016 《食品安全国家标准 食品中钙的测定》规定的方法测定钙含量;参考GB 5009.241—2017 《食品安全国家标准 食品中镁的测定》规定的方法测定镁含量;参考GB 5009.87—2016 《食品安全国家标准 食品中磷的测定》规定的方法测定磷含量;参考GB 5009.91—2017 《食品安全国家标 准食品中钾、钠的测定》规定的方法测定钾、钠含量。
1.4.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis, SDS-PAGE)分析
沉积试验完成后,将取出的换热板于50℃烘干8 h,收集沉积物。取沉积物约200 mg,用10 mL 0.2 mol/L的HNO3处理1 h,在4 000 r/min下离心15 min,除去上清液,用蒸馏水洗涤沉淀3次,再用10 mL沉积物溶解液]8 mol / L尿素,0.2 mol/L 三羟甲基氨基甲烷(Tris),0.03 mol/L SDS和0.1 mol/L 乙二胺四乙酸(ethylene diamine tetraacetic acid, EDTA)]处理2 h后,在50 ℃下超声处理30 min,离心(4 000 r/min,15 min)后取上层清液。参照LAEMMLI[14]的方法进行SDS-PAGE,分离胶和浓缩胶的浓度分别为12.5%和5%。取1 mL清液加入适量二硫苏糖醇(终浓度控制在0.1 mol/L),并在沸水浴中加热5 min,最后取10 μL装入样品孔中。SDS-PAGE在15 mA下进行。凝胶使用考马斯亮蓝G-250染色,并用Image Lab/PC(4.0版)软件进行分析。
1.5 数据处理及分析
通过电子表格完成温度数据的统计,进行加热部分的热平衡和沉积速率分析。豆浆侧加热部分的入口和出口之间的温度差被视为时间的函数,并用于计算豆浆在任何时间获得的能量。在每次试验中,使用公式(1)计算豆浆获得的热量:
Qm=(m×Cp)m×(Tm,out-Tm,in)
(1)
式中:Qm,豆浆吸收热量,J;m,单位时间内处理豆浆质量,kg;Tm,out,豆浆出口温度,℃;Tm,in,豆浆进料温度,℃;Cp,豆浆比热容,J/(kg·℃)。
使用公式(2)计算对数平均温差:
(2)
式中:LMTD,对数平均温差,℃;Tw,out,热水出口温度,℃,Tw,in,豆浆进料温度,℃。
豆浆通道获得的能量等于从热水通道传递到豆浆通道热量。可按公式(3)计算总传热系数(U):
(3)
式中:U,系统总传热系数,W/(m2·K);A,总有效传热面积,m2。
通过公式(4)计算随时间变化的沉积因子Rf,可以反应沉积物对换热效率的影响:
(4)
式中:Rf,沉积因子,(m2·K)/W;Ut=0,初始传热系数,W/(m2·K)。
每组试验除特殊说明外均重复2~3次,部分结果以X±SD表示。使用SPSS 19.0分析、Origin 2017作图。
2 结果与讨论
2.1 豆浆的成分
大豆于20 ℃浸泡12 h后,加入RO水打浆,调节pH至6.5,使用螺杆式分离机除渣后,获得沉积试验所用的豆浆,通过稀释控制固形物质量分数为7.5%的豆浆。豆浆的主要成分包括水分、脂肪、蛋白质和其他非脂肪固体(纤维、灰分、碳水化合物等),具体含量见表2。室温(25 ℃)下豆浆为浅黄色胶体(pH约6.5)。豆浆的部分物理性质和热性能数值用水代替便于计算。
表2 豆浆成分
Table 2 Composition of soy milk

成分平均含量水/%92.50蛋白质/%3.50脂肪/%1.47矿物质/%0.41钙/[mg·(100 g)-1]27.40镁/[mg·(100 g)-1]29.95磷/[mg·(100 g)-1]54.15钾/[mg·(100 g)-1]81.65钠/[mg·(100 g)-1]14.53
2.2 传热系数的变化
通过热平衡和对流传热分析温度数据,获得总传热系数(U)随时间(t)的变化(图2)。对于所有的试验,总传热系数的测量误差≤3%。除个别特殊情况(pH 6.3),在5 h的试验过程中均能观察到一个阶段的沉积过程:总传热系数随运行时间增加渐进式降低。DELPLACE等[15]曾报道牛奶沉积存在一个初始诱导期(长达1 h)。豆浆沉积初期可能也存在一个非常短时间(几秒钟)的诱导期,但是由于测量系统的效率有限,没有被观察到。LALANDE等[16]和GOTHAM等[5]指出,在使用板式换热器加热的乳制品沉积中,也没有沉积后期。
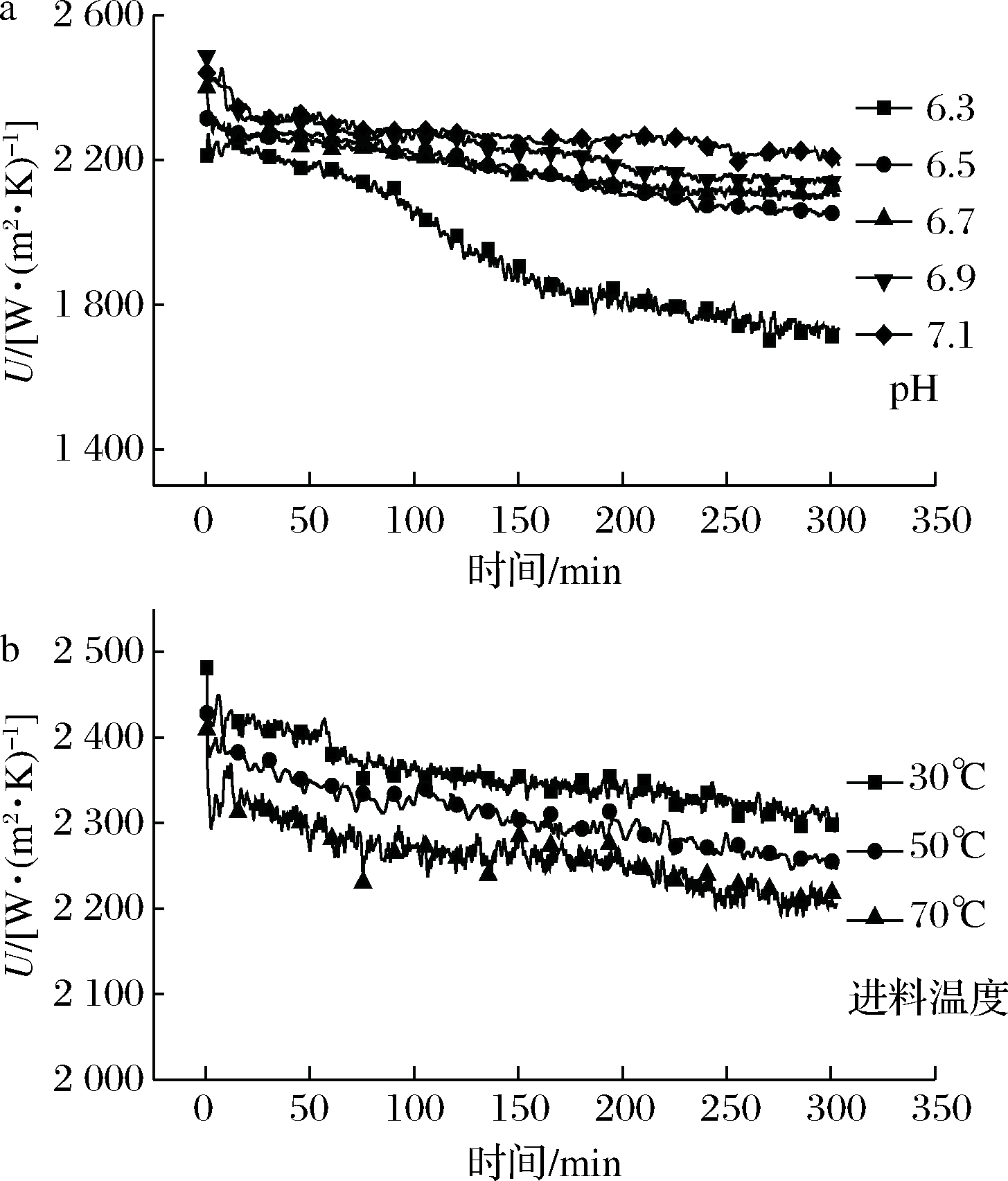
a-不同pH;b-不同进料温度
图2 总传热系数随时间的变化
Fig.2 Evolution of total heat transfer coefficient with time
在pH 6.3的试验中,观察到3个沉积阶段。第一阶段,蛋白质逐渐发生变性聚集,接触换热表面,夹带着其他组分逐渐形成沉积物,传热系数缓慢下降,持续约90 min;进入第二阶段,变性蛋白质聚集体体积增大,在pH 6.3下的溶解性低,通道内的流体运动的剪切作用不足,部分通道开始被聚集体堵塞,有效换热面积减少,总传热效率迅速下降,持续至150 min;第三阶段,在恒定的总流量的条件下,剩余通道内流速增加,较高的剪切力使聚集体无法继续堵塞通道,所以豆浆开始在剩余通道内缓慢沉积,传热系数缓慢下降。
2.3 沉积因子变化
2.3.1 pH对沉积因子的影响
如图3所示,提高豆浆的pH值至中性可以降低沉积因子的值(图3-a)。当pH值从6.5增加到6.7、6.9和7.1时,运行5 h后沉积因子减小,说明增加豆浆pH值可以缓解沉积的发生,这种现象可能与大豆蛋白的聚集有关。当pH为7.0时,大豆蛋白中的β伴球蛋白聚集反而会阻碍大豆球蛋白的聚集过程[17]。此外,大豆蛋白在中性pH值下具有更高的溶解性和稳定性,能够减少沉积物。
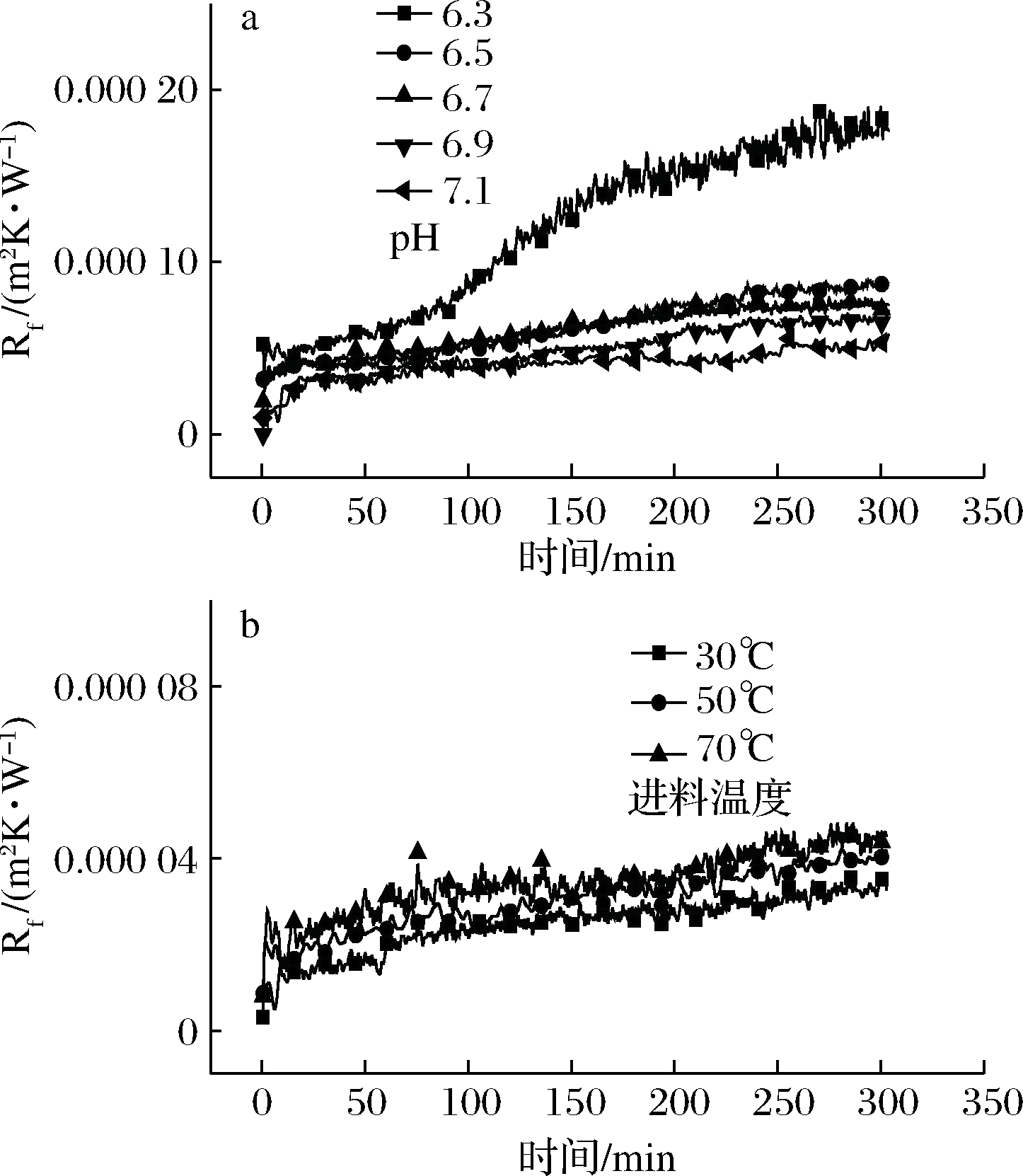
a-不同pH;b-不同进料温度
图3 沉积因子随时间的变化
Fig.3 Evolution of the fouling factor with time
当豆浆pH值降至6.3时,沉积因子显著增加。大豆蛋白在低的pH值(6.3)下稳定性较差,在加热时更容易发生变性并聚集,改变豆浆的理化性质,导致沉积物在换热器板上迅速增加。如前所述,低pH值下通道内发生了堵塞,沉积因子具有3个时期的变化。
2.3.2 进料温度对沉积因子的影响
如图3-b所示,随着豆浆进料温度的升高,沉积因子的值增加。该现象与牛奶的沉积行为有所不同,PRAKASH等[18]报道了在脱脂牛奶中,随着进料温度增加(65~95 ℃),沉积越少,整个系统能够运行的时间更长,并将原因归结于β乳球蛋白(β-lactoglobulin, β-Lg)在不同温度下的“黏性”变化。β-Lg大约在55 ℃便开始展开,65 ℃下β-Lg分子更多处于展开形式,具有更高的“黏性”,易附着在换热表面,而在高温下β-Lg分子发生变性后更倾向于在牛奶中聚集,不易附着在换热表面。不同的是,7S球蛋白和11S伴球蛋白的变性温度分别为70和90 ℃[19],在较低的温度下(30 ℃),大豆蛋白比较稳定,没有展开或者变性,不易附着在换热表面。提高进料温度至70 ℃时,部分蛋白开始展开、变性,豆浆的黏度开始增加,进入换热器后温度的进一步升高会导致黏度的急剧增加。同时,较高的进料温度会导致可沉积态(达到某一温度)豆浆组分在换热器中具有更长的保留时间,更易形成沉积物。此外,SRICHANTRA等[20]报道,进料温度越高,全脂牛奶在超高温灭菌过程中的沉积越多,该结果可能受均质化过程的影响,而豆浆与全脂牛奶均具有较高的脂肪含量,且豆浆制作过程中打浆的工艺流程有着和均质相同的作用。
2.4 沉积物成分随时间的变化
如图4所示,随着运行时间的增加,沉积物的总量逐渐增加,增速逐渐变小。30 min时,沉积物总量迅速增加至17.21 g/m2,其中蛋白质、脂肪的总占比达到57%,而灰分约占14%,说明沉积前期主要是蛋白质和脂肪的沉积造成了传热系数的降低。随着运行时间的增加,沉积物的总量不断增多,而其中蛋白质与脂肪的占比却逐渐降低,灰分占比提高,5 h沉积物中,蛋白质与脂肪的占比约为30%,灰分含量约为40%。
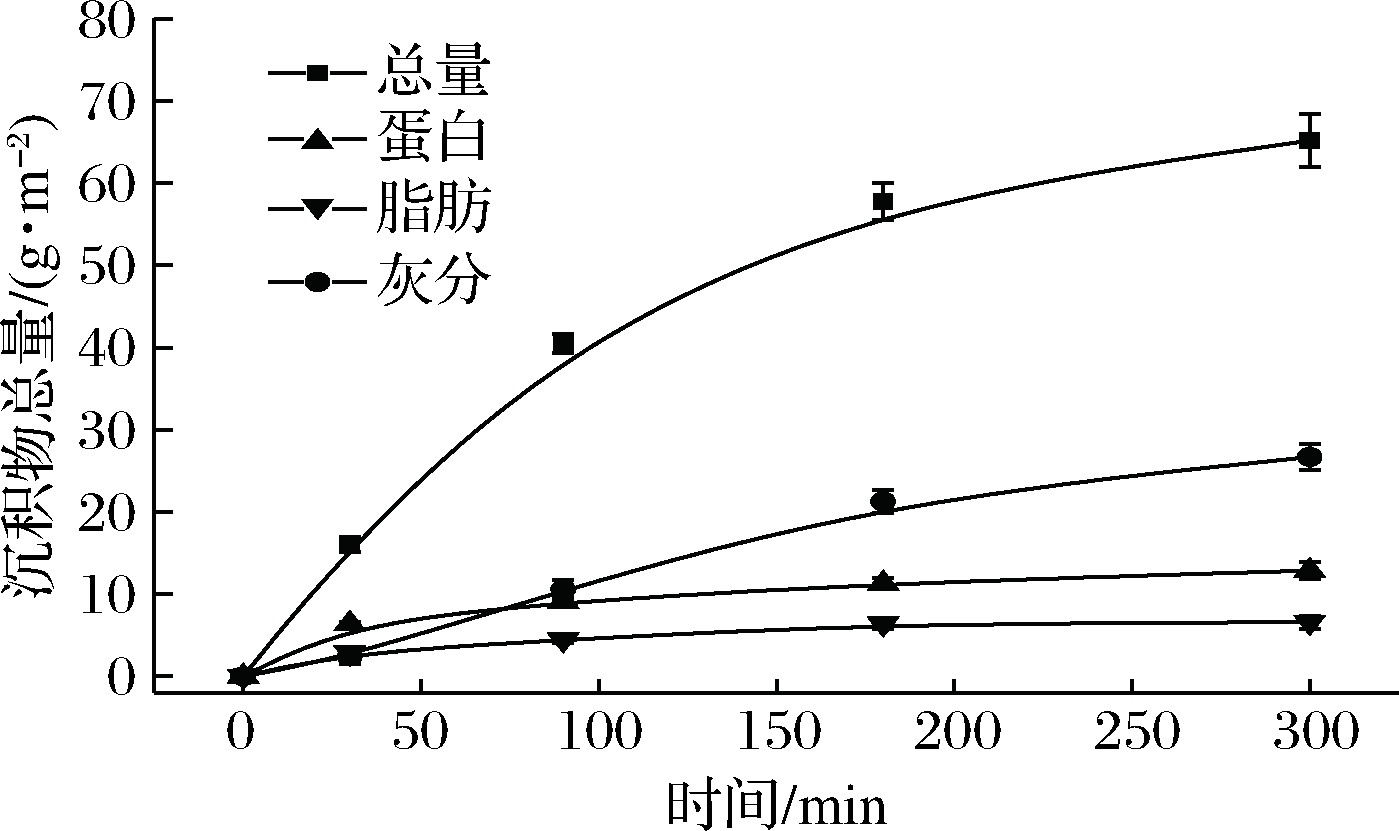
图4 沉积物中各成分的质量随时间的变化
Fig.4 Evolution of the mass value of each component in the sediment
结果说明,蛋白质与脂肪在运行前期对沉积物的形成贡献最大,但随着运行时间的增加,在总流量及压力保持不变的条件下,沉积物的生长进一步挤压了通道的空间,导致局部的湍流增加,延缓了后续变性聚集的蛋白质夹带脂肪进入沉积层。灰分在整个运行过程中,保持稳定增加的趋势。不同于大分子的蛋白质与脂肪,小分子矿物质盐在流体的推动作用下,更容易截留在沉积物中,并且蛋白质与脂肪沉积的夹带作用也在一定程度上促进了矿物质的沉积。
2.5 沉积物成分分析
2.5.1 蛋白质与脂肪含量的变化
沉积物的组成如表3所示,所有试验中沉积物的蛋白质与脂肪含量具有相同的变化趋势。虽然豆浆中蛋白质和脂肪的含量与牛奶接近,但是与B型牛奶沉积物中蛋白质(15%~20%)和脂肪(4%~8%)的含量相比,豆浆沉积物中蛋白质(18%~44%)、脂肪(4%~26%)含量均偏高。豆浆被加热至高温(105~120 ℃)的过程中,加热表面或附近的蛋白质发生变性,结构发生改变,倾向于聚集在换热板表面形成沉积物。此外,变性后的蛋白失去了吸附在分散的脂肪球界面上的性质,因此随着蛋白质的夹带,更多的脂肪被截留在豆浆沉积物中。这可能解释了豆浆与牛奶沉积物组成的差异性,然而目前还没有关于脂肪颗粒热稳定性的报道。BURTON[21]认为在牛奶间接加热系统中,脂肪对沉积物形成的作用可以忽略不计,所以在此阶段假设脂肪只依靠夹带作用参与沉积物的形成。
表3 豆浆沉积物的成分分析(干基)
Table 3 Composition analysis of the soy milk fouling deposit formation (dry basis)

成分pH值进料温度/℃6.306.506.706.907.10305070总质量/g48.61±0.9215.82±1.0514.34±0.4813.90±0.653.47±0.566.02±0.658.26±0.5210.50±0.53蛋白质/%44.27±0.2622.64±0.5019.53±0.1618.93±0.4312.32±0.4725.19±0.3020.42±0.4617.09±1.14脂肪/%25.61±0.5712.04±0.6110.03±0.189.91±0.481.12±0.0310.10±0.408.38±0.736.72±0.16灰分/%13.50±0.0839.59±0.6540.33±0.2943.13±0.4150.16±0.6931.41±0.4537.77±0.3946.47±1.20
结果表明,随着豆浆pH值的升高(6.3~7.1),豆浆沉积物的总量与蛋白质的含量减少(44.3%~12.5%)。ROSA等[22]报道β-乳球蛋白在pH 5.0时,沉积量最多。蛋白溶液的pH值越接近等电点,其溶解度越低,在加热过程中越容易发生沉积。大豆蛋白等电点约为4.5~5.0,其在低pH值下的稳定性和溶解度较低,蛋白质间的相互作用增强,加速了蛋白质的热变性和聚集,随后与换热表面接触形成沉积物。
随着豆浆进料温度的提高,沉积物总量增加,蛋白质与脂肪的占比下降,灰分占比上升。进料温度提高至70 ℃,蛋白质与脂肪的质量分别增加约0.28、0.09 g,而灰分增加约2.98 g,说明在沉积过程中进料温度的提高(30~70 ℃)对灰分的影响远大于蛋白质与脂肪。结合2.3.2中的分析,较高的进料温度仅仅提高了蛋白质的沉积速度,但在有限的换热面积上没有明显增加蛋白质的沉积,而是促进了灰分参与沉积物形成,造成了沉积物总量的增加。
2.5.2 蛋白质组分分析
沉积物蛋白质的SDS-PAGE结果如图5所示。在pH 6.3试验中,蛋白质堵塞通道后经过长时间的加热,发生了不可逆的变性,较难被还原成肽链进入电泳胶,条带较为暗淡,其他泳道蛋白质主要是7S(α′、α、β)11S(A、B)。使用Image Lab软件分析,7S和11S蛋白约占蛋白总量的32%和60%,与原豆浆中的大豆蛋白组分接近,说明豆浆中的蛋白质是均参与沉积的形成,没有某种特定的蛋白质能够优先沉积。乳清蛋白只占牛奶固形物的5%,但其在A型沉积物的占比超过了50%, B型沉积物中绝大多数蛋白质也是乳清蛋白。
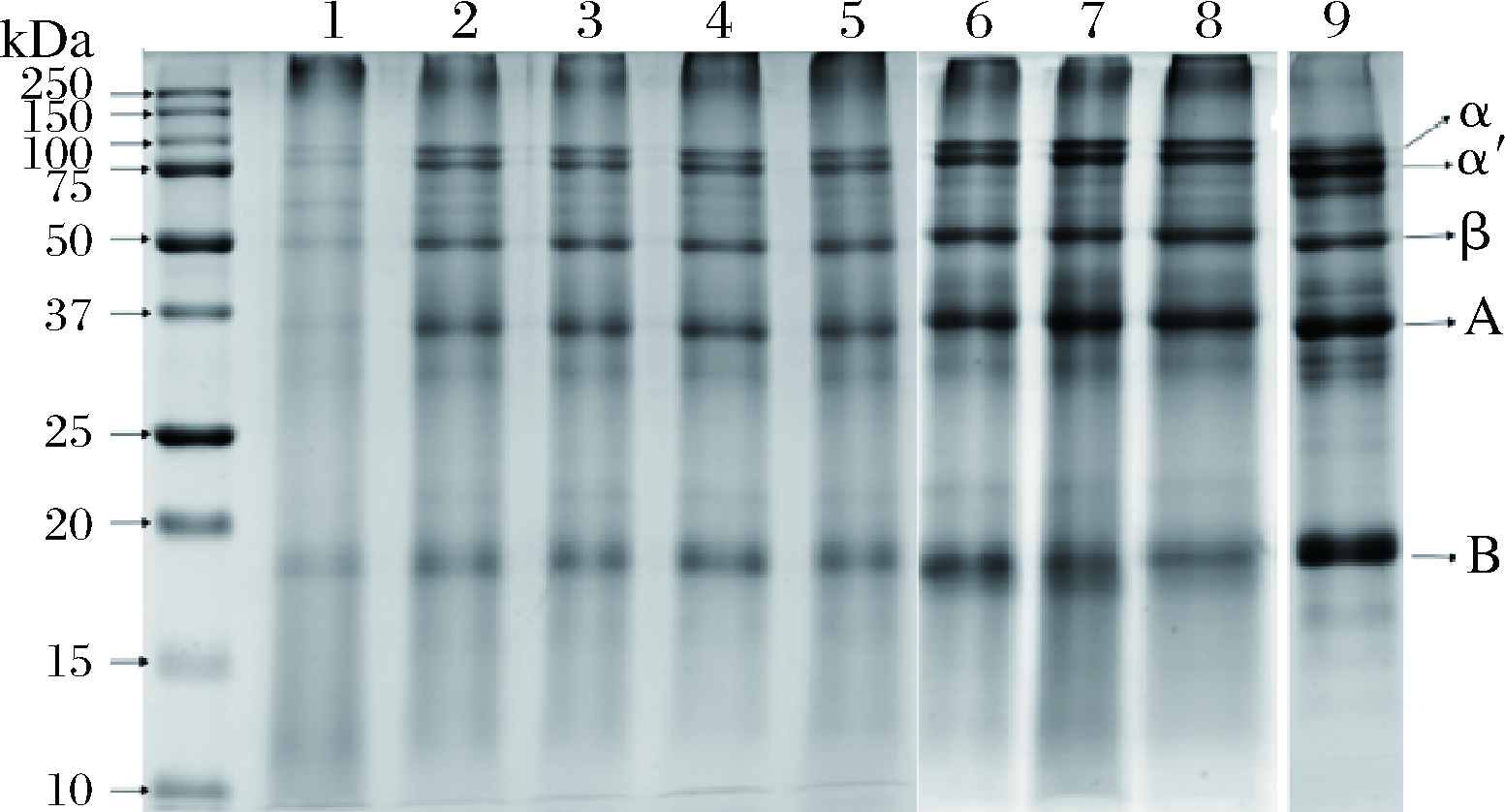
泳道1~5-豆浆pH(6.3、6.5、6.7、6.9、 7.1);泳道6~8-进料温度(30,50,70 ℃);泳道9-原豆浆。α′, α和β条带为β伴大豆球蛋白(7S); A和B条带为大豆球蛋白(11S)
图5 沉积物中蛋白质的凝胶电泳分析
Fig.5 SDS-PAGE pattern of the soy globulin
β-Lg和α-乳白蛋白 (α-lactalbumin, α-La)是2种主要的乳清蛋白,但加热引起沉积的蛋白质主要是β-Lg,其具有很高的热敏感性,因此在沉积的过程中占有重要地位[15, 23-25]。因此,豆浆沉积物中蛋白质的整体参与可以看作是豆浆沉积一个独特特征。
2.5.3 灰分成分分析
沉积物灰分中各离子的含量见表4,其中磷(21.64%~24.28%)含量最高,其次为钙(12.84%~13.78%)、镁(8.98%~10.77%)。VISSER等[26]综述了乳制品行业沉积物中钙、磷离子形成的是不溶性磷酸钙颗粒,蛋白质的变性和聚集以及磷酸钙颗粒的形成是遵循不同动力学的2个不同过程,沉积物中矿物质和蛋白质的沉积可以独立发生。
表4 沉积物灰分中矿物质离子的含量及沉积率 单位:%
Table 4 Mineral ion content in sediment ash
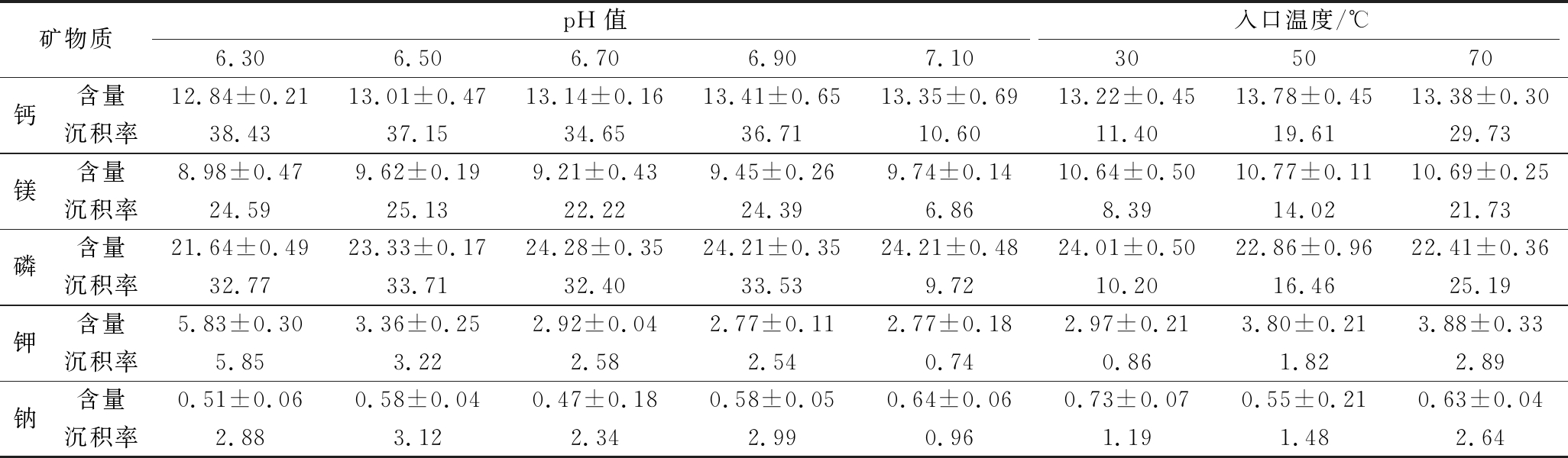
注:沉积率/%=沉积物中离子总量/原豆浆中该离子总量×100(以均值计算)
矿物质pH值入口温度/℃6.306.506.706.907.10305070钙含量12.84±0.2113.01±0.4713.14±0.1613.41±0.6513.35±0.6913.22±0.4513.78±0.4513.38±0.30沉积率38.4337.1534.6536.7110.6011.4019.6129.73镁含量8.98±0.479.62±0.199.21±0.439.45±0.269.74±0.1410.64±0.5010.77±0.1110.69±0.25沉积率24.5925.1322.2224.396.868.3914.0221.73磷含量21.64±0.4923.33±0.1724.28±0.3524.21±0.3524.21±0.4824.01±0.5022.86±0.9622.41±0.36沉积率32.7733.7132.4033.539.7210.2016.4625.19钾含量5.83±0.303.36±0.252.92±0.042.77±0.112.77±0.182.97±0.213.80±0.213.88±0.33沉积率5.853.222.582.540.740.861.822.89钠含量0.51±0.060.58±0.040.47±0.180.58±0.050.64±0.060.73±0.070.55±0.210.63±0.04沉积率2.883.122.342.990.961.191.482.64
在豆浆沉积中,矿物质参与沉积的原因可能是某些盐的溶解度与温度成反比,以及矿物质在蛋白质和脂肪基质中的滞留导致。与原豆浆中高含量的钾(81.65 mg/100 g)相比,含量更低的钙(27.40 mg/100 g)、镁(29.95 mg/100 g)、磷(54.15 mg/100 g)离子在发生沉积时具有更高的沉积率。大豆中80%磷主要存在植酸中,其具有很好的热稳定性。沉积物中矿物质离子可能是以植酸钙镁形式参与沉积,且在相似沉积条件及pH 6.3~6.9下,钙、镁、磷等矿物质离子进入沉积的参与率基本一致,说明其具有独立的沉积机制。提高进料温度,矿物质离子的沉积率随之增加。然而,目前关于生豆浆中植酸、蛋白质和矿物质的存在方式和相互作用的研究报道较少,无法进一步分析。
豆浆中矿物质的初始量尤为重要,其含量因品种、地理位置和成熟度的不同而不同。沉积物中矿物质离子的种类与总灰分的占比基本相同,所以矿物质沉积的机制是相同的。另外,灰分的占比具有与蛋白质和脂肪相反的变化趋势,说明蛋白质和脂肪的夹带并不是矿物质进入沉积物的主要驱动力。牛奶沉积物中矿物质主要分布在第一层(接触热表面) [27],因此,可以推测在沉积形成较少的情况,蛋白质和脂肪沉积的速度较慢,更多的是矿物质离子接触热表面形成沉积层,导致矿物质在沉积物中占比较高。不同pH值、进料温度的豆浆,通过影响矿物质盐的存在状态及蛋白质的沉积行为,引起沉积物中矿物质的变化,未来的研究需要探索沉积物中矿物质元素的垂直分布来证明这一推论。
3 结论
本研究采用一套自行搭建的设备以模拟生产中使用板式换热器的加热过程,探讨不同条件下豆浆沉积的影响因子,包括不同的豆浆pH值(6.3、6.5、6.7、6.9、7.1)、进料温度(30、50、70 ℃)和不同的运行时间(0.5、1.5、3.0、5.0 h)。结果表明,在相同的热驱动力下,提高豆浆pH值至中性、降低豆浆的入口温度能降低沉积速率,减少沉积量;对沉积物的组成与矿物质成分进行了分析,进一步阐明了各因素对沉积物形成的影响,推测100 ℃以上的豆浆沉积物属于同种类型,具有相同的沉积过程:大豆蛋白变性聚集夹带脂肪在前30 min接触换热表面迅速形成第一层沉积,随后在流体作用,主要是大量的矿物质盐截留及少量的蛋白质、脂肪附着造成沉积物的缓慢生长。对沉积物成分的分析进一步说明了蛋白质、脂肪及矿物质在沉积物形成过程中的贡献。控制豆浆pH在中性附近、不进行预热直接进入加热段是可行的减少沉积的工艺改进思路。
[1] SCHREIER, ROBERT P J. Monitoring and modelling of heat exchanger fouling[D]. Cambridge: University of Cambridge, 1995.
[2] FRYER P J, SLATER N K H. A direct simulation procedure for chemical reaction fouling in heat exchangers[J]. Chemical Engineering Journal, 1985, 31(2):97-107.
[3] FRYER P J, SLATER N K H. A novel fouling monitor[J]. Chemical Engineering Communications, 2007, 57(1):139-152.
[4] BURTON H, SECTION G. Deposits from whole milk in heat treatment plant—a review and discussion[J]. Journal of Dairy Research, 1968, 35(2):317.
[5] GOTHAM, MARTYN S. Mechanisms of protein fouling of heat exchangers[D]. Cambridge: University of Cambridge, 1990.
[6] TISSIER J P, LALANDE M. Experimental device and methods for studying milk deposit formation on heat exchange surfaces[J]. Biotechnology Progress, 1968,2(4):218-229.
[7] DAUFIN G, QUEMERAIS J P, QUEMERAIS A, et al.Fouling of a heat exchange surface by whey, milk and model fluids. An analytical study [J]. Lait, 1987, 67(3): 339-364.
[8] MICHEL B, MARGARET L, GREEN M B, et al. Deposit formation on heated surfaces: Effect of interface energetics[J]. Journal of Dairy Research, 1988, 55(4):551-562.
[9] FOSTER C L, BRITTEN M, GREEN M L. A model heat-exchange apparatus for the investigation of fouling of stainless steel surfaces by milk I. Deposit formation at 100 ℃ [J]. Journal of Dairy Research,1989, 56(2): 201-209.
[10] LUND D, BIXBY D. Fouling of heat exchanger surfaces by milk [J]. Process Biochem, 1975, 10:52-55.
[11] CHANGANI S D, BELMAR-BEINY M T, FRYER P J. Engineering and cleaning factors associated with fouling and cleaning in milk processing[J]. Experimental Thermal & Fluid Science, 1997, 14(4):392-406.
[12] WANG J, LI L, FU N, et al. A comparative study on fouling and cleaning characteristics of soy protein isolate (SPI)[J]. Nephron Clinical Practice, 2018, 14(4):550-557.
[13] BANSAL B, CHEN X D. A critical review of milk fouling in heat exchangers[J]. Comprehensive Reviews in Food Science & Food Safety, 2006,5(2):27-33.
[14] LAEMMLI B U K. Cleavage of structural proteins during assembly of head of bacteriophage-T4[J]. Nature, 1970, 227(5 259):680-685.
[15] DELPLACE F, LEULIET J C, TISSIER J P, et al. Fouling experiments of a plate heat exchanger by whey protein solutions [J]. Food and Bioproducts Processing: Transactions of the Institution of of Chemical Engineers, Part C,1994, 72:1-8.
[16] LALANDE M, TISSIER J P, CORRIEU G. Fouling of a plate heat exchanger used in ultra-high-temperature sterilization of milk[J]. Journal of Dairy Research, 1984, 51(4):557.
[17] GUO J, YANG X Q, HE X T, et al. Limited aggregation behavior of β-conglycinin and its terminating effect on glycinin aggregation during heating at pH 7.0[J]. Journal of Agricultural and Food Chemistry, 2012, 60(14):3 782-3 791.
[18] PRAKASH S, KRAVCHUK O, DEETH H. Influence of pre-heat temperature, pre-heat holding time and high-heat temperature on fouling of reconstituted skim milk during UHT processing[J]. Journal of Food Engineering, 2015, 153:45-52.
[19] ZHANG H, TAKENAKA M, ISOBE S. DSC and electrophoretic studies on soymilk protein denaturation[J]. Journal of Thermal Analysis and Calorimetry, 2004, 75(3):719-726.
[20] SRICHANTRA A, NEWSTEAD D F, MCCARTHY O J, et al. Effect of preheating on fouling of a pilot scale UHT sterilizing plant by recombined, reconstituted and fresh whole milks[J]. Food and Bioproducts Processing, 2006, 84(4):279-285.
[21] BURTON H. Seasonal variation in deposit formation from whole milk on a heated surface [J].Journal of Dairy Research, 1967, 34(2): 137-143.
[22] ROSA M T M G, GUIMAR ES, DANIELA H P, et al. Experimental measurements and simulation of the fouling phenomena of natural proteins[J]. International Journal of Heat and Mass Transfer, 2019, 129:1 075-1 085.
ES, DANIELA H P, et al. Experimental measurements and simulation of the fouling phenomena of natural proteins[J]. International Journal of Heat and Mass Transfer, 2019, 129:1 075-1 085.
[23] LYSTER R L J. The denaturation of α-lactalbumin and β-lactoglobulin in heated milk[J]. Journal of Dairy Research, 1970, 37(2):233-243.
[24] LALANDE M, JEANCCIERRE TISSIER. Fouling of heat transfer surfaces related to β-actoglobulin denaturation during heat processing of milk[J]. Biotechnology Progress, 1985, 1(2):131-139.
[25] GOTHAM S M, FRYER P J, PRITCHARD A M. β-Lactoglobulin denaturation and aggregation reactions and fouling deposit formation: A DSC study[J]. International Journal of Food Science & Technology, 2007, 27(3):313-327.
[26] VISSER J, JEURNINK T J M. Fouling of heat exchangers in the dairy industry[J]. Experimental Thermal & Fluid Science, 1997, 14(4):407-424.
[27] HAGSTEN C, ALTSK R A, GUSTAFSSON S, et al. Composition and structure of high temperature dairy fouling[J]. Food Structure, 2016, 7:13-20.
R A, GUSTAFSSON S, et al. Composition and structure of high temperature dairy fouling[J]. Food Structure, 2016, 7:13-20.