大黄鱼(Pseudosciaena crocea)是中国重要经济鱼类之一,主要分布于福建省沿海地区,因其味道鲜美且易于烹饪而广受消费者们喜爱[1]。据2019年中国渔业统计年鉴记载[2],我国海水养殖鱼类产量共计141.94万t,其中大黄鱼总产量为17.76万t,位居养殖海水鱼类产量第一。大黄鱼鱼卵是大黄鱼加工过程中的主要副产物,有研究发现[3]大黄鱼鱼卵中富含DHA和EPA型磷脂(large yellow croaker roe phospholipids, LYCRPLs),而DHA与EPA是人体不可缺少的重要营养素[4]。
已有研究表明,磷脂(phospholipids,PLs)具有良好的乳化能力,KOMAIKO等[5]发现,向日葵磷脂可以作为一种有效的天然乳化剂;DONSI等[6]使用大豆卵磷脂成功制备出稳定的乳状液。此外,MCCLEMENTS等[7]比较了不同天然乳化剂(大豆卵磷脂、乳清蛋白和阿拉伯胶)对制备玉米水包油乳液的影响。LYCRPLs富含DHA和EPA型磷脂,但目前关于LYCRPLs乳化效果的研究鲜见报道。
姜黄素是从姜黄(Curcuma longa Linn)植物的根系中提取所得[8],其具备多种生物活性,如抗氧化[9]、抗肿瘤[10]和抗炎[11]等。因此,姜黄素在食品添加剂和医学领域有着广阔的应用前景。然而,姜黄素是一种疏水性物质,低水溶性和光照不稳定性严重限制了其在食品和医药行业中的应用[12]。部分研究表明,水包油型乳液能够有效提升姜黄素的生物利用度[13-15]。
为进一步拓展水产品中磷脂用途,本研究以姜黄素为乳化对象,以乳液粒径和稳定性为指标,考察大黄鱼鱼卵磷脂的乳化功能。在单因素试验的基础上,采用响应面法优化乳液制备工艺,对乳液进行初步表征后,进一步考察大黄鱼鱼卵磷脂-姜黄素乳液的贮藏稳定性。研究结果有助于进一步拓展水产品加工副产物高值化利用。
1 材料与方法
1.1 材料与试剂
姜黄素(curcumin,纯度≥97%),河北天旭生物科技有限公司;新鲜大黄鱼鱼卵,福建宇辉食品实业有限公司;玉米油,益海嘉里金龙鱼粮油食品股份有限公司。95%乙醇、正己烷、丙酮,均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
LGJ-12S型真空冷冻干燥机,北京松源华兴生物技术有限公司;HN-3K型手持均质机,上海汗诺仪器有限公司;FB-110Q型超高压均质机,上海励途超高压设备有限公司;Nano-ZS90型马尔文激光粒度仪,英国Malvern 公司;LUMiFuge-111型全自动稳定性分析仪,德国LUM公司;HT770型透射电子显微镜,日本Hitachi公司;RO15型纯水机,上海康雷分析仪器有限公司。
1.3 试验方法
1.3.1 大黄鱼鱼卵磷脂的提取
称取一定量的冻干大黄鱼鱼卵[水分含量(1.0±0.005)%],加入体积分数为95%乙醇并在室温下搅拌2 h后抽滤,所得滤液加入适量的正己烷并2次提取,再次重复得到滤液后进行合并滤液,将滤液旋蒸得到总脂质溶解于冷丙酮中,放置过夜可得白色沉淀物,即为实验用磷脂样品,置于-20 ℃备用。
1.3.2 大黄鱼鱼卵磷脂-姜黄素乳液的制备
在室温条件下,将一定量的姜黄素溶解于玉米油中,磁力搅拌器搅拌2 h后使用0.45 μm的滤膜对玉米油溶液进行过滤,得到姜黄素油相;将LYCRPLs与去离子水按比例溶解(将4 g LYCRPLs溶于100 mL去离子水),使用磁力搅拌器搅拌2 h,得到水相。将姜黄素油相与水相按不同的比例[V(油相)∶V(水相)=15∶85]混合搅拌均匀(磁力搅拌1 h)后,使用手持均质机(20 000 r/min)均质5 min得到姜黄素粗乳液。最后将粗乳液加入到超高压均质机中均质,得到姜黄素乳液,置于4 ℃冰箱中备用。
1.3.3 乳液粒径测定
将制备好的大黄鱼鱼卵磷脂-姜黄素乳液使用去离子水稀释500倍后,取一定量装入比色皿中,采用激光粒度仪进行粒径尺寸的测定,重复3次。
1.3.4 乳液稳定性测定
使用全自动稳定性分析仪测定乳液的稳定性,测定结果以澄清指数表示,澄清指数数值越接近于0则表示乳液稳定性良好,反之则表示乳液稳定性较差。操作温度20 ℃,转速3 000 r/min,时间10 min。
1.3.5 单因素试验
在室温条件下,分别考察均质压力(10、25、40、60、80 MPa)、均质时间(20、60、80、100、140 s)、LYCRPLs添加量(质量分数为:2.0%、2.5%、3.0%、4.0%、5.0%)和油相比例(5%、10%、15%、20%、25%)4个因素对姜黄素乳液粒径和稳定性的影响。
1.3.6 响应面优化试验
在单因素试验的基础上,选取均质压力、均质时间、LYCRPLs添加量和油相比例4个因素,根据Box-Behnken中心组合试验设计原理,设计4因素5水平的响应面优化试验,对LYCRPLs乳化姜黄素工艺进行优化,各因素编码与水平如表1所示。
表1 响应面试验设计因素编码及水平表
Table 1 Coded and un-coded independent variables used in RSM design
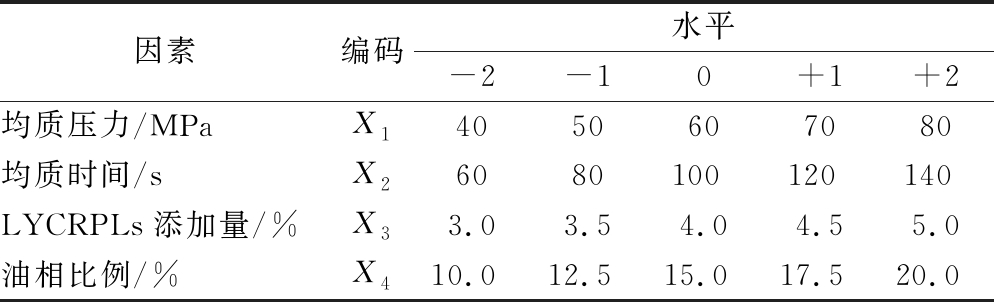
因素编码水平-2-10+1+2均质压力/MPaX14050607080均质时间/sX26080100120140LYCRPLs添加量/%X33.03.54.04.55.0油相比例/%X410.012.515.017.520.0
1.3.7 透射电镜观察
使用透射电子显微镜(transmission electron microscope, TEM)对最优制备工艺条件下的LYCRPLs-姜黄素乳液粒子形态进行观察。在进行透射电镜观察之前,用去离子水将乳液稀释到一定浓度,吸取适量的乳液,滴加到覆盖有碳膜的铜网上,等待1 min,使用滤纸吸干多余的液体。再使用10 g/L磷钨酸盐对铜网进行染色1 min,在室温下自然干燥,最后进行透射电镜观察。
1.3.8 乳液贮藏稳定性研究
根据响应面优化试验得出的最优工艺条件制备LYCRPLs-姜黄素乳液,分别在5、25和55 ℃下贮藏28 d,每7 d测定乳液的粒径并对样品外观进行拍照。
1.4 数据处理
所有试验均重复3次,结果取平均值。采用IBM SPSS Statistics 20软件进行统计分析,Origin 2017软件进行绘图,Design-Expert 10.0.7软件进行试验设计及方差分析。
2 结果与分析
2.1 单因素试验结果
2.1.1 均质压力对LYCRPLs-姜黄素乳液粒径和稳定性的影响
如图1所示,随着均质压力的增大,LYCRPLs-姜黄素乳液的粒径和澄清指数均呈现减小趋势(P<0.05)。这是由于均质压力越大,产生的剪切力和作用强度越大,其均质效果越好[16]。较低的粒径和澄清指数值代表乳液的品质较好,但在试验过程中,当均质压力超过60 MPa时,仪器内部温度随着压力的增大而升高,对乳液的品质造成不良影响。因此,选择均质压力60 MPa进行响应面优化试验。
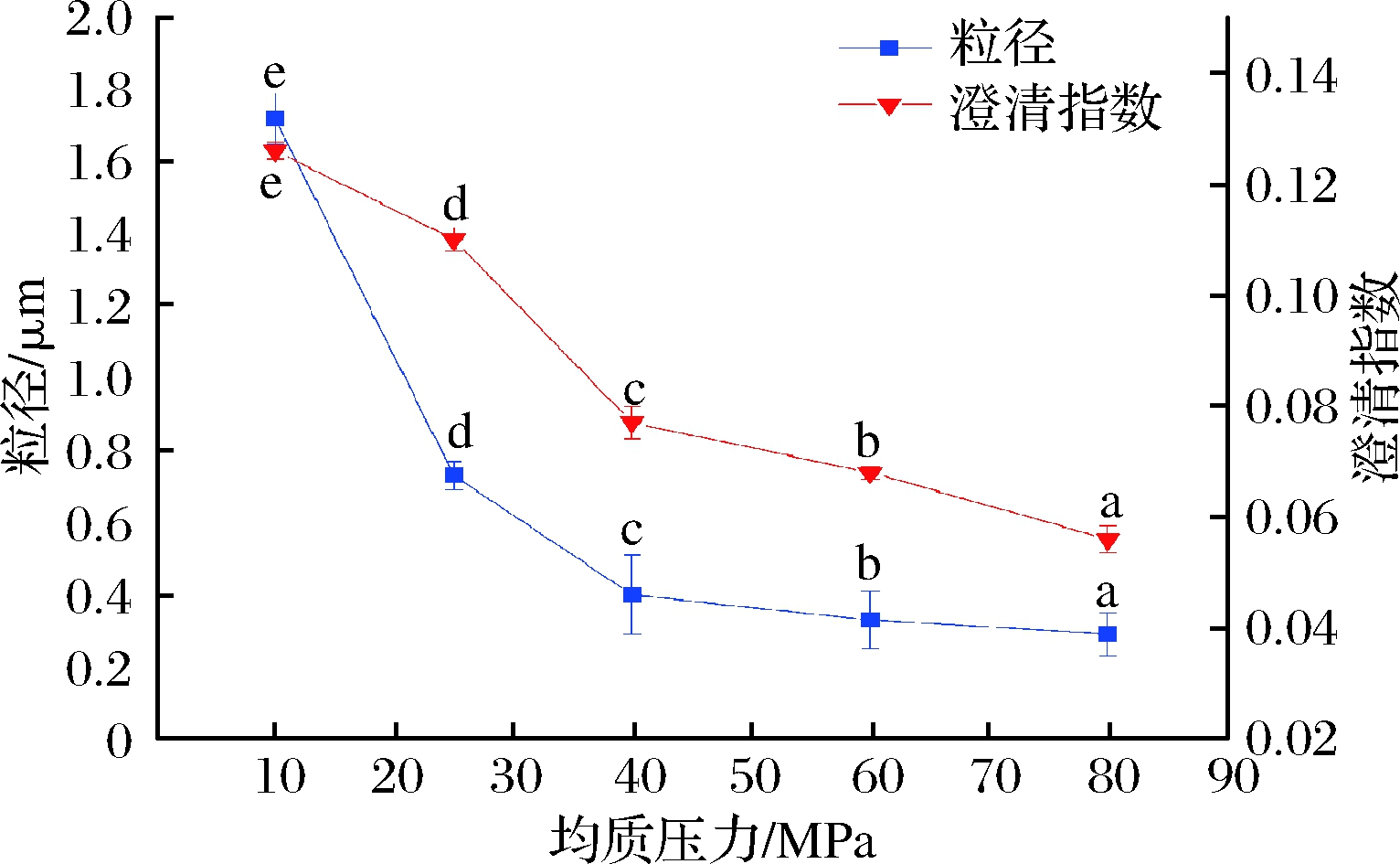
图1 均质压力对LYCRPLs-姜黄素乳液粒径和稳定性的影响
Fig.1 Effect of homogenization pressure on particle size and stability of LYCRPLs- curcumin emulsions
注:不同小写字母表示差异显著(P<0.05)(下同)
2.1.2 均质时间对LYCRPLs-姜黄素乳液粒径和稳定性的影响
如图2所示,均质时间对乳液粒径和稳定性的影响与均质压力基本一致,随着均质时间的增加,乳液的粒径与澄清指数值越低,显示出良好的稳定性。产生该现象的原因主要是均质机对乳液的均质作用能够随着时间的延长而更加充分,使水相与油相更好地结合,有效降低分散物尺度,提高乳液分布均匀性[17]。考虑到随着均质时间的延长,均质设备的处理温度随之增加,为了避免高温对乳液品质造成不良影响,因而选择均质时间为100 s进行响应面优化试验。
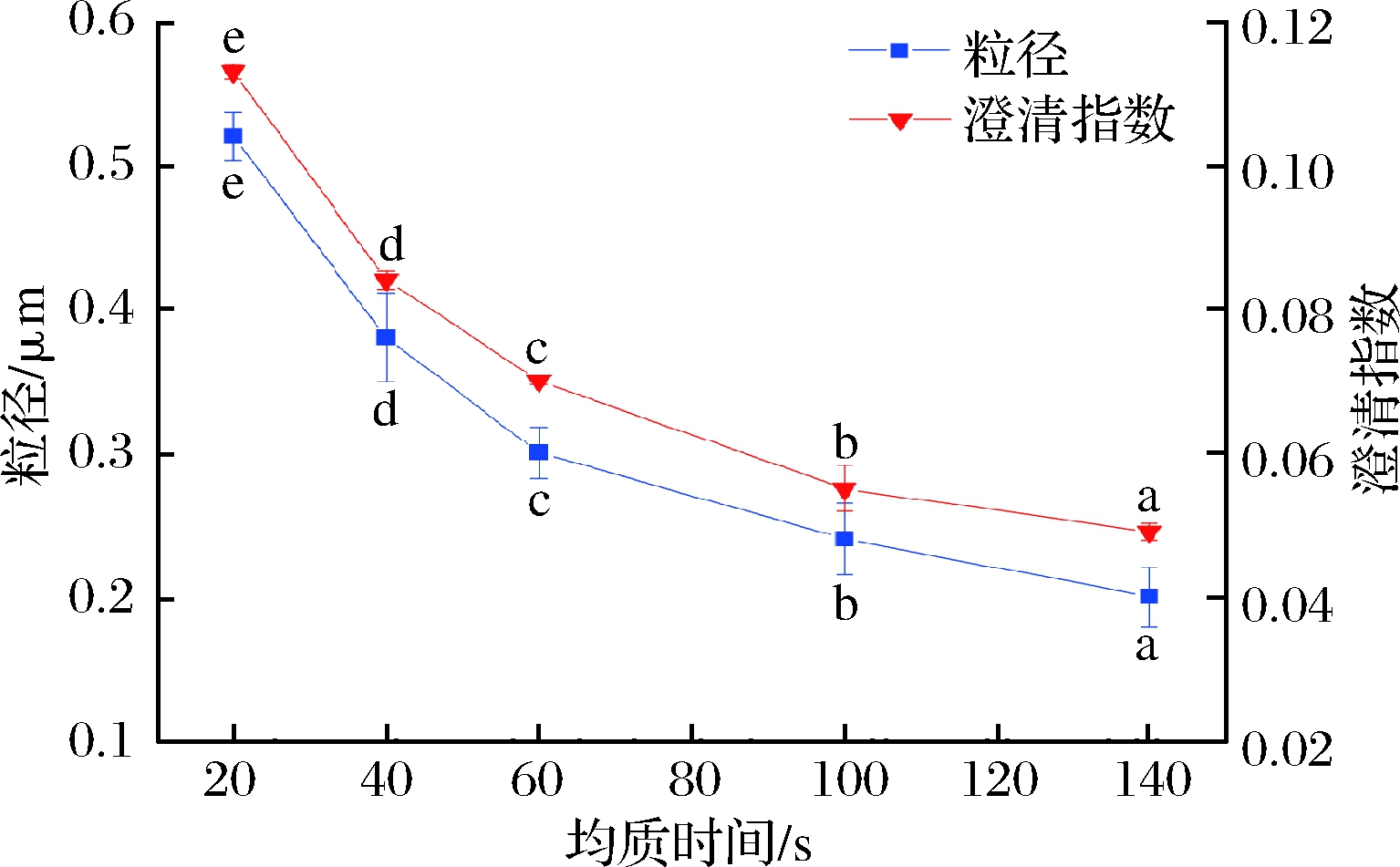
图2 均质时间对LYCRPLs-姜黄素乳液粒径和稳定性的影响
Fig.2 Effect of homogenization time on particle size and stability of LYCRPLs-curcumin emulsions
2.1.3 LYCRPLs添加量对姜黄素乳液粒径和稳定性的影响
由图3可知,在LYCRPLs添加量为2.0%~4.0%,乳液的粒径随LYCRPLs添加量的增加而减小,当LYCRPLs添加量为4.0%时达到最低,而后显著增加(P<0.05)。导致这一现象的原因可能是在一定范围内,乳化剂的添加量越多形成的胶束浓度越大,胶束中单体浓度降低,因此粒径减小。而过量添加乳化剂会使乳液中生成的粒子数过多,乳胶粒单位面积覆盖乳化剂不足而导致凝聚现象,从而导致粒径增大[18]。然而,乳液的澄清指数值随着LYCRPLs添加量的增加而逐渐减小,LYCRPLs添加量超过4.0%时,澄清指数无显著性变化(P<0.05)。这是因为乳化剂的加入降低了水-油界面的界面张力,赋予乳液良好的稳定性[19]。综合考虑LYCRPLs添加量对乳液粒径与稳定性的影响,选择LYCRPLs添加量为4.0%。
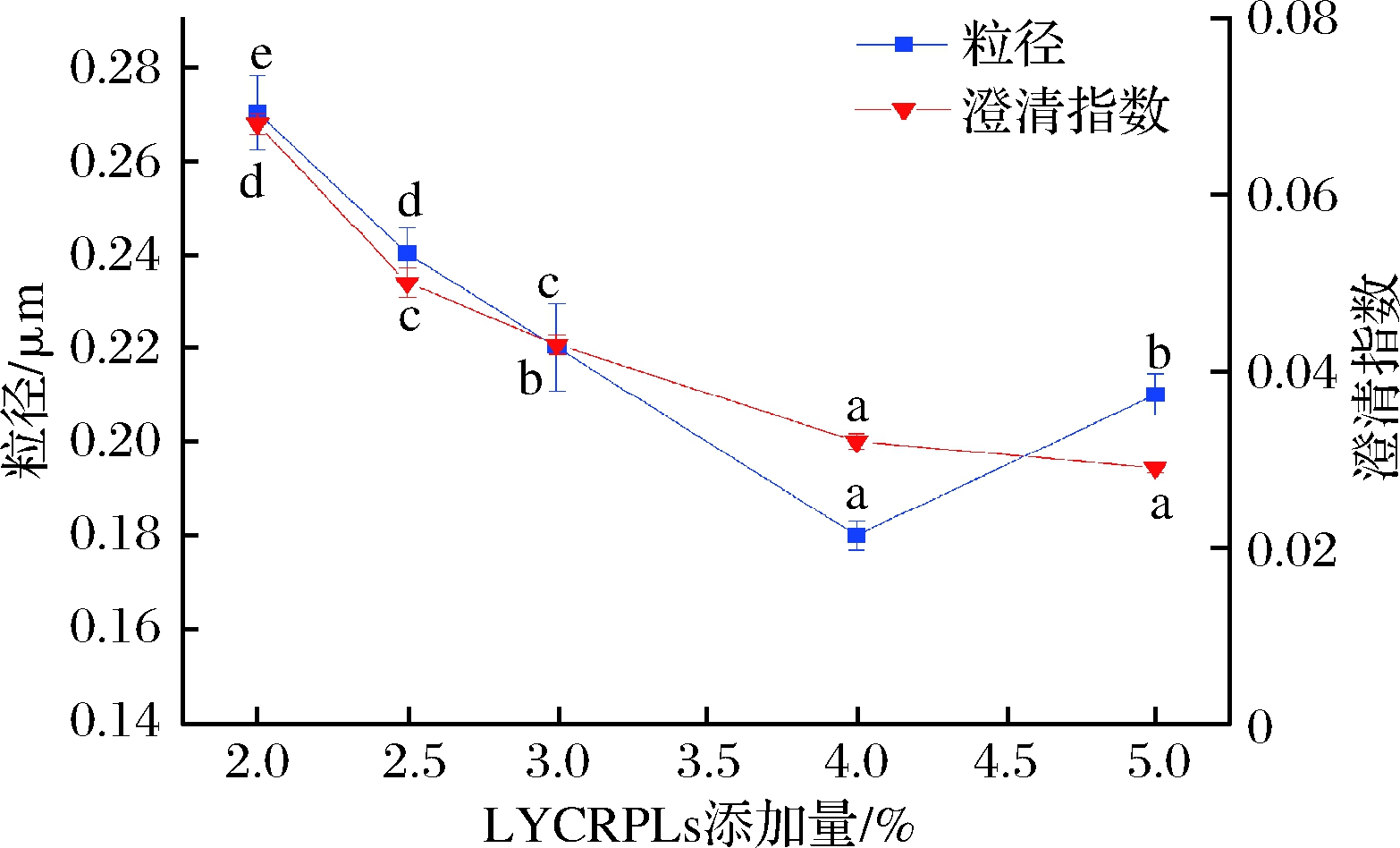
图3 LYCRPLs添加量对姜黄素乳液粒径和稳定性的影响
Fig.3 Effect of LYCRPLs added amount on particle size and stability of LYCRPLs-curcumin emulsions
2.1.4 油相比例对大黄鱼鱼卵磷脂-姜黄素乳液粒径和稳定性的影响
如图4所示,随着油相比例的逐渐增加,乳液粒径呈先减小后增大的趋势,而澄清指数值则不断减小,这是因为油浓度的增加降低了乳液的表面张力,增强了乳液的稳定性。乳化剂在乳液生产过程中,覆盖在油滴表面以形成均匀、稳定的粒子,油相浓度的升高导致所需的乳化剂浓度增加,因此当油相比例不断增加,固定的乳化剂浓度不足以覆盖油滴表面,最后导致乳液粒径的增大[20]。因此,选择油相比例为15%最佳。
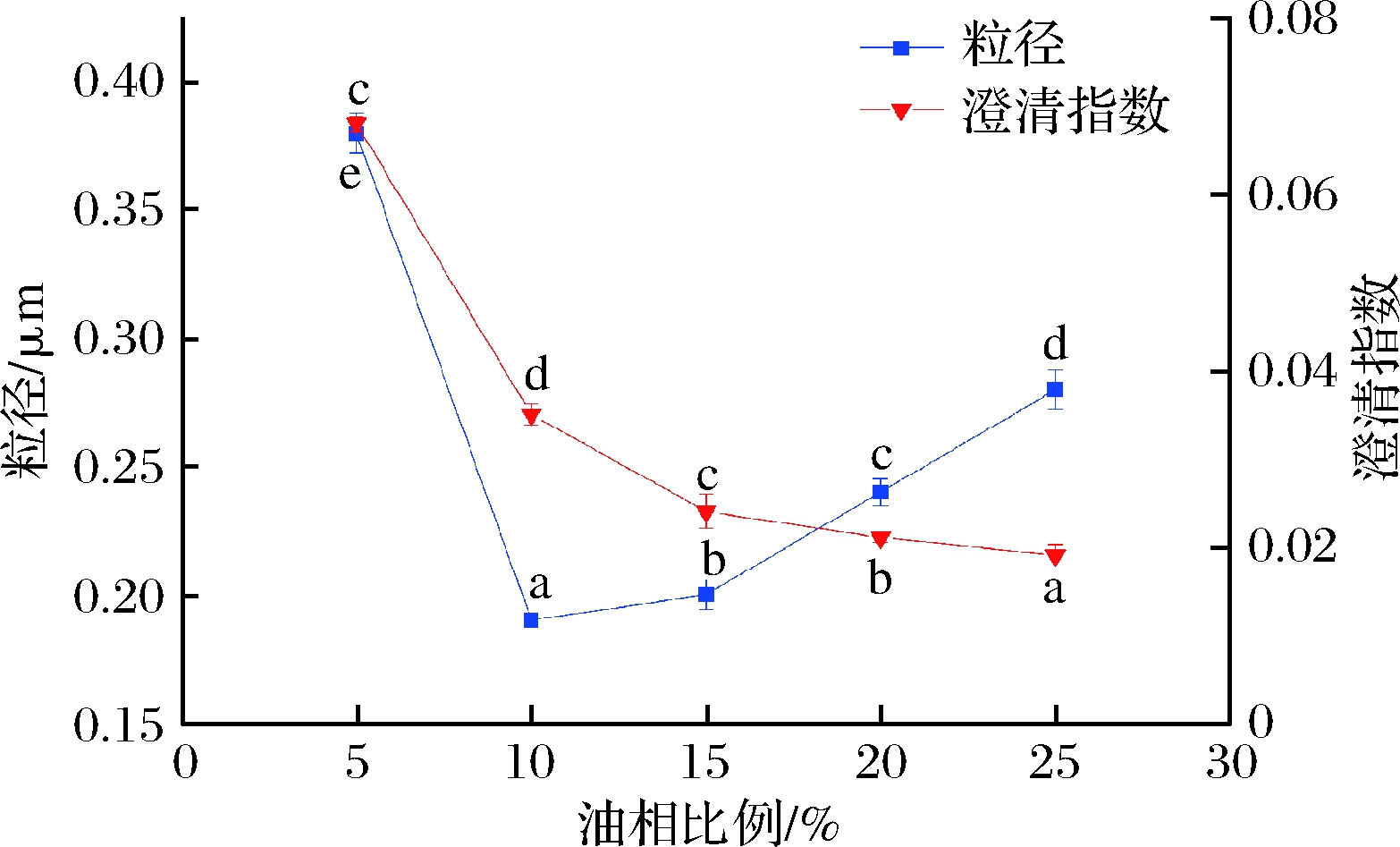
图4 油相比例对姜黄素乳液粒径和稳定性的影响
Fig.4 Effect of oil concentration on particle size and stability of LYCRPLs-curcumin emulsions
2.2 响应面优化试验
2.2.1 Box-Behnken 中心组合试验方案
在单因素试验的基础上,选取均质压力(A)、均质时间(B)、LYCRPLs添加量(C)和油相比例(D)4个因素为自变量,以LYCRPLs-姜黄素乳液的粒径(Y1)为响应值,设计4因素5水平的响应面优化试验。试验设计方案与结果如表2所示。
表2 响应面试验设计与结果
Table 2 Response surface methodology experimental design and results
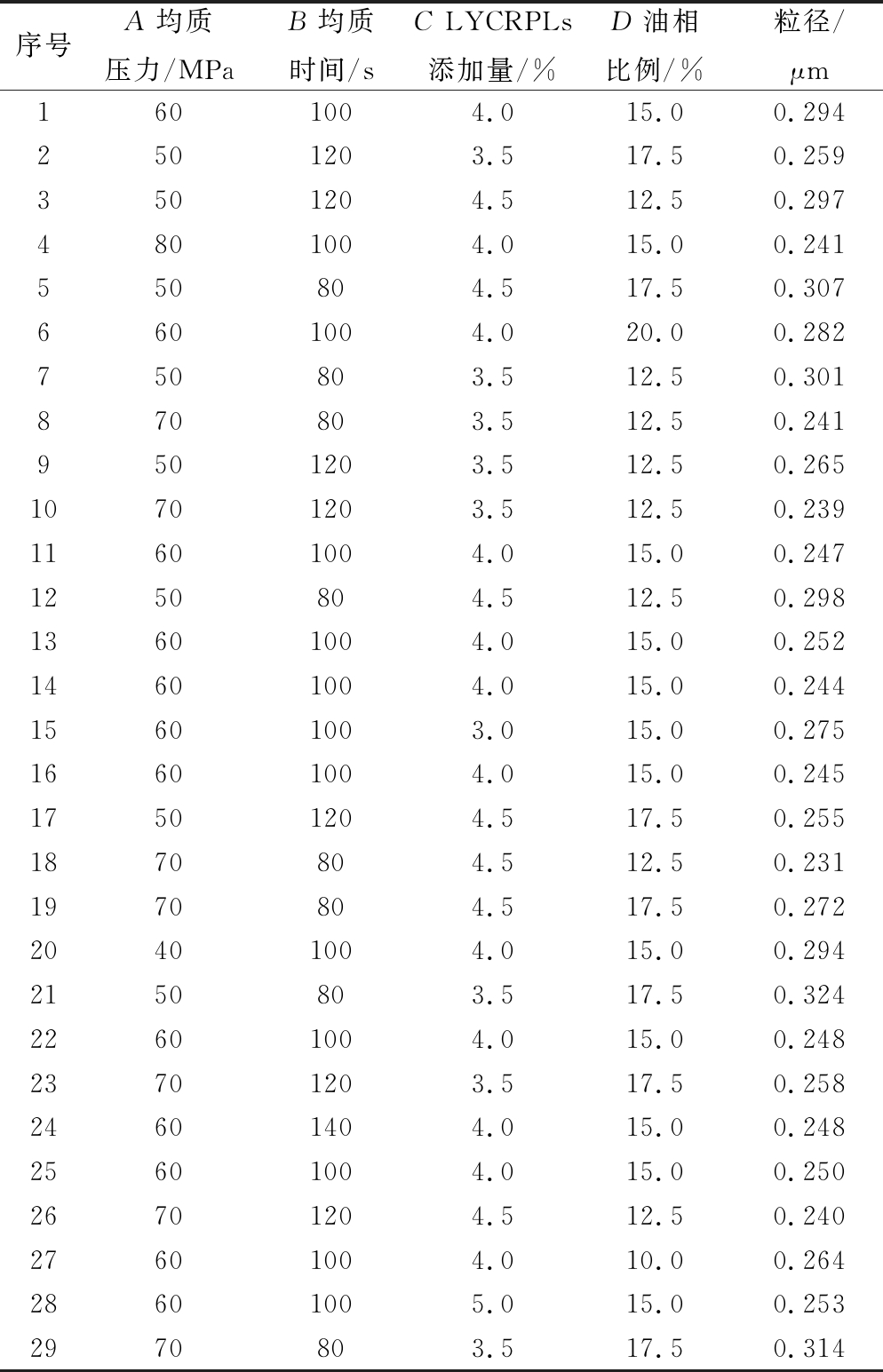
序号A均质压力/MPaB均质时间/sC LYCRPLs添加量/%D油相比例/%粒径/μm1601004.015.00.2942501203.517.50.2593501204.512.50.2974801004.015.00.241550804.517.50.3076601004.020.00.282750803.512.50.301870803.512.50.2419501203.512.50.26510701203.512.50.23911601004.015.00.2471250804.512.50.29813601004.015.00.25214601004.015.00.24415601003.015.00.27516601004.015.00.24517501204.517.50.2551870804.512.50.2311970804.517.50.27220401004.015.00.2942150803.517.50.32422601004.015.00.24823701203.517.50.25824601404.015.00.24825601004.015.00.25026701204.512.50.24027601004.010.00.26428601005.015.00.2532970803.517.50.314
2.2.2 响应面模型方程及方差分析
根据表2所得的试验数据,采用Design-Expert 10.0.7软件计算二次多项式方程的系数,并预测出大黄鱼鱼卵磷脂-姜黄素乳液的粒径。二次回归方程如下:Y1=+0.25-0.015A-0.013B-0.004C+0.007D+0.005AB-0.004AC+0.010AD+0.006BC-0.010BD-0.005CD+0.006A2+0.006B2+0.005C2+0.007D2。方程中各因素的系数绝对值表示影响程度。此外,对回归方程模型进行方差分析,结果如表3所示。
表3 回归模型方差分析
Table 3 Analysis of variances for the regression model
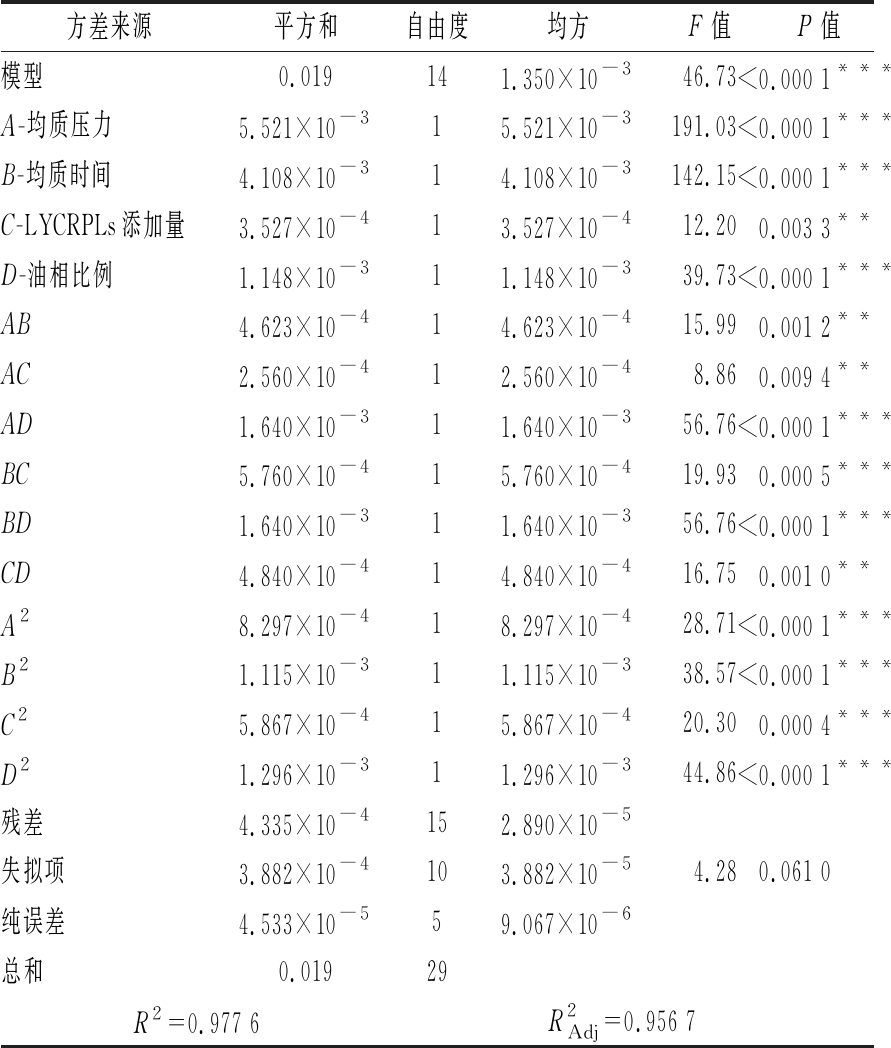
注:***表示差异极显著,P<0.001;**表示差异高度显著,P<0.01;*表示差异显著,P<0.05
方差来源平方和自由度均方F值P值模型0.019141.350×10-346.73<0.000 1***A-均质压力5.521×10-315.521×10-3191.03<0.000 1***B-均质时间4.108×10-314.108×10-3142.15<0.000 1***C-LYCRPLs添加量3.527×10-413.527×10-412.200.003 3**D-油相比例1.148×10-311.148×10-339.73<0.000 1***AB4.623×10-414.623×10-415.990.001 2**AC2.560×10-412.560×10-48.860.009 4**AD1.640×10-311.640×10-356.76<0.000 1***BC5.760×10-415.760×10-419.930.000 5***BD1.640×10-311.640×10-356.76<0.000 1***CD4.840×10-414.840×10-416.750.001 0**A28.297×10-418.297×10-428.71<0.000 1***B21.115×10-311.115×10-338.57<0.000 1***C25.867×10-415.867×10-420.300.000 4***D21.296×10-311.296×10-344.86<0.000 1***残差4.335×10-4152.890×10-5失拟项3.882×10-4103.882×10-54.280.061 0纯误差4.533×10-559.067×10-6总和0.01929R2=0.977 6R2Adj=0.956 7
由表3的方差分析结果可知,二次多项式模型与实验数据的拟合度良好,模型极显著(P<0.001),模型的回归系数与校正系数分别为0.977 6和0.956 7,且失拟项不显著(P>0.05),说明该试验模型在统计学上是准确可行的,通过响应面试验设计得到的二次多项模型可以描述所研究的自变量对响应变量的影响,可用于解释95.67%情况下关键因素对乳液粒径的影响,能够有效优化LYCRPLs-姜黄素乳液的制备工艺。此外,各因素及其交互作用对乳液粒径的影响显著性各不相同。其中,一次项A、B、D,交互项AD、BC、BD和二次项A2、B2、C2、D2对乳液粒径的影响极显著(P<0.001);一次项C,交互项AB、AC和CD对乳液粒径的影响高度显著(P<0.01)。通过比较各因素的F值可知影响程度依次为:均质压力>均质时间>油相比例>LYCRPLs添加量。
2.2.3 响应面交互作用分析
4个因素(均质压力、均质时间、LYCRPLs添加量和油相比例)对模型响应值的交互作用。通过这些三维响应面图能够直观地判断出各因素间的交互作用对乳液粒径的影响程度。从图5可知,均质压力、均质时间、LYCRPLs添加量和油相比例这4个因素间的两两交互作用对姜黄素乳液的粒径均有着显著影响,其中,油相比例和均质时间的交互作用最强(图5-E)。随着均质压力、均质时间与LYCRPLs添加量的增加,乳液粒径逐渐降低,这是因为均质剪切作用力不断增强导致的;而油相比例越高,乳液粒径反而增大[21]。这一现象与先前的单因素试验中所得的结果一致,同时也与表3中的方差分析结果吻合。
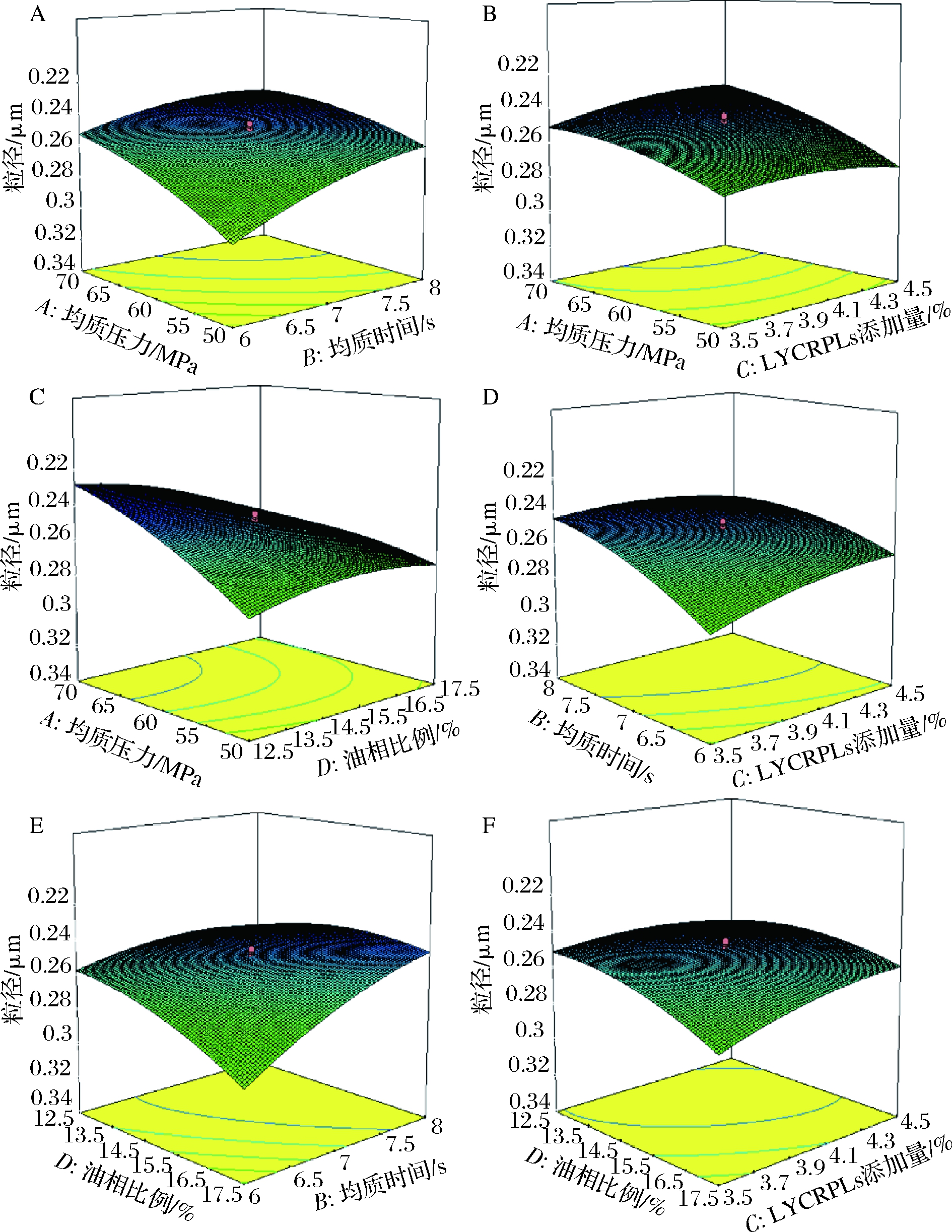
图5 各因素对姜黄素乳液粒径交互作用的响应面图
Fig.5 Response surface diagram of the interaction of various factors on the particle size of LYCRPLs-curcumin emulsions
2.2.4 最优工艺的确定及验证试验
LYCRPLs-姜黄素乳液最优制备工艺条件为:均质压力72.4105 MPa、均质时间101 s、LYCRPLs添加量4.275%、油相比例12.89%,该条件下的姜黄素乳液粒径为0.228 μm。由于仪器操作的可行性,修正试验条件为:均质压力72.4 MPa、均质时间101 s、LYCRPLs添加量4.275%、油相比例12.89%。在该条件下进行3次平行试验后测得乳液粒径为(0.216±0.005 9) μm,表明通过响应面法能够有效优化LYCRPLs-姜黄素乳液制备工艺。
2.3 大黄鱼鱼卵磷脂-姜黄素乳液表征
通过透射电镜对最优制备工艺条件下的LYCRPLs-姜黄素乳液颗粒形态进行表征,结果如图6所示。在30.0 k电镜条件下观察到乳液颗粒近似球形且无聚结等不良现象(图6-a),进一步在60.0 k电镜条件下观察颗粒结构,能够直观且清晰地看到搭载了姜黄素的油相被水相包封(图6-b),这与LI等[22]的研究报道一致。本结果表明LYCRPLs可覆盖于乳液油-水界面,使互不相溶的两相结合,制备出具有小粒径的水包油乳液。

a-×30 k;b-×60 k
图6 LYCRPLs-姜黄素乳液的透射电镜观察图
Fig.6 Transmission electron microscopic (TEM) observation of LYCRPLs-curcumin emulsions
2.4 乳液贮藏稳定性研究
实验进一步考察了LYCRPLs-大黄鱼鱼卵磷脂-姜黄素乳液的贮藏稳定性,图7呈现了LYCRPLs-大黄鱼鱼卵磷脂-姜黄素乳液的粒径变化和外观变化。
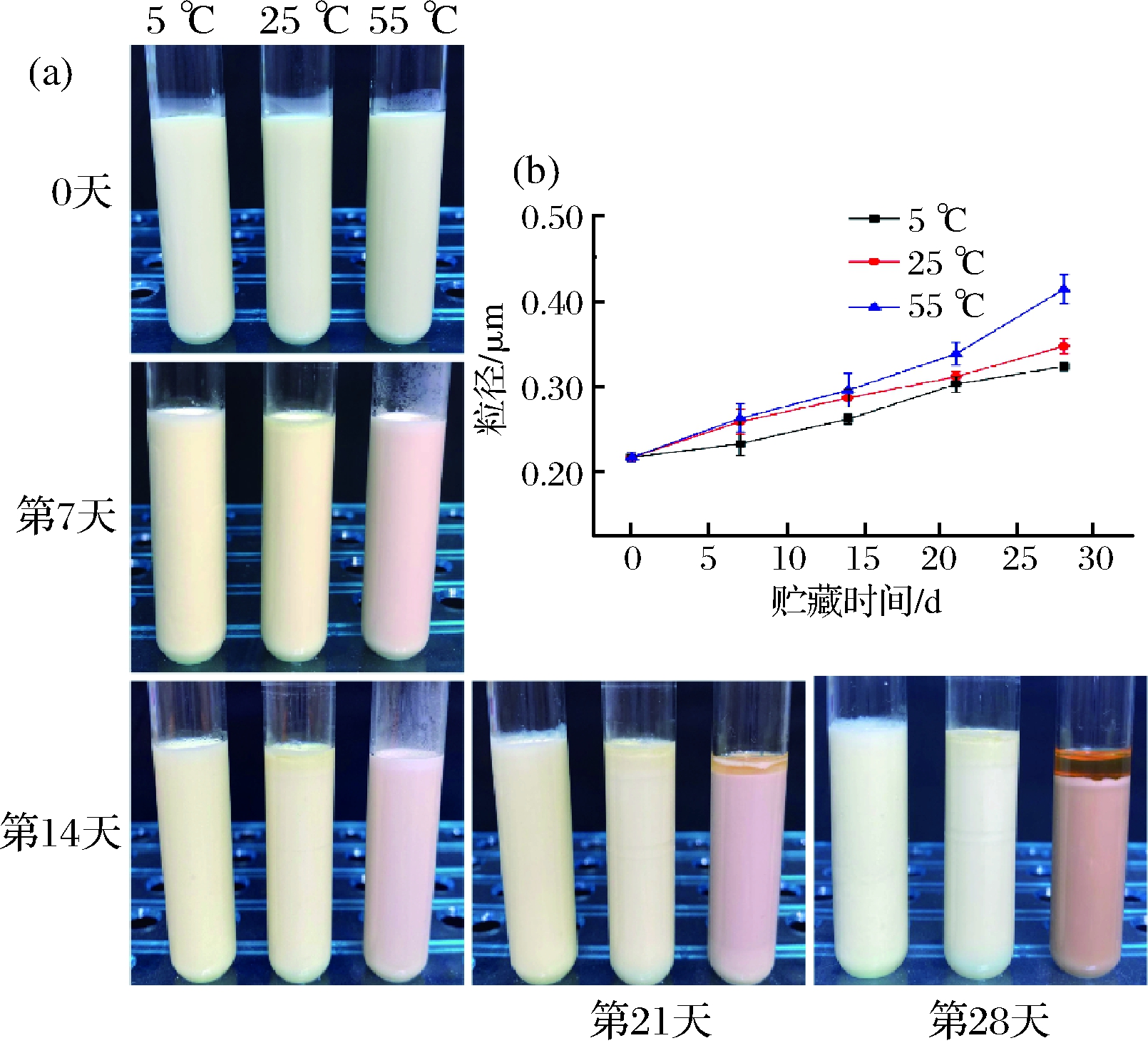
图7 LYCRPLs-姜黄素乳液在贮藏过程中的外观(a)和粒径(b)变化
Fig.7 Changes of appearance(a) and particle size(b) of LYCRPLs-curcumin emulsions during storage
由图7-a可知,第0天时的乳液分布均匀,但从第14天开始,55 ℃下的乳液开始褪色,可能是由于高温引起的姜黄素氧化反应[23],且55 ℃下的乳液从第21天开始出现油水分离现象,而5和25 ℃下贮藏的乳液仍保持稳定状态。此外,图7-b中显示了在3种不同温度贮藏过程中,乳液的粒径均呈增大趋势,认为该现象与奥斯特瓦尔德熟化作用有关,随着贮藏时间的延长,乳液品质发生变化,粒径不断增大[24]。以上结果表明,LYCRPLs-大黄鱼鱼卵磷脂-姜黄素乳液能够在5和25 ℃条件下保持较长时间的稳定性,而在高温条件下较不稳定。
3 结论
本研究以姜黄素为对象,考察了大黄鱼鱼卵磷脂对其乳化效果,在单因素试验的基础上,通过响应面法优化了大黄鱼鱼卵磷脂乳化姜黄素的工艺条件。研究结果表明,大黄鱼鱼卵磷脂具有较优的乳化能力,且贮藏稳定性良好。课题组下一步将着重开展大黄鱼鱼卵磷脂协同姜黄素的营养价值方面的研究,旨在推动大黄鱼产业的进一步发展。
[1] HUI G, LIU W, FENG H, et al. Effects of chitosan combined with nisin treatment on storage quality of large yellow croaker (Pseudosciaena crocea) [J]. Food Chemistry, 2016, 203: 276-282.
[2] 农业农村部渔业渔政管理局. 中国渔业统计年鉴 [M]. 北京:中国农业出版社, 2019.
[3] LIANG P, LI R, SUN H, et al. Phospholipids composition and molecular species of large yellow croaker (Pseudosciaena crocea) roe[J]. Food Chemistry, 2018, 245: 806-811.
[4] CANSELL M. Marine phospholipids as dietary carriers of long-chain polyunsaturated fatty acids[J]. Lipid Technology, 2010, 22(10): 223-226.
[5] KOMAIKO J, SASTROSUBROTO A, MCCLEMENTS D J. Encapsulation of ω-3 fatty acids in nanoemulsion-based delivery systems fabricated from natural emulsifiers: Sunflower phospholipids[J]. Food Chemistry, 2016, 203: 331-339.
[6] DONSI F, WANG Y, HUANG Q. Freeze-thaw stability of lecithin and modified starch-based nanoemulsions[J]. Food Hydrocolloids, 2011, 25(5): 1 327-1 336.
[7] MCCLEMENTS D J, GUMUS C E. Natural emulsifiers-biosurfactants, phospholipids, biopolymers, and colloidal particles: Molecular and physicochemical basis of functional performance[J]. Advances in Colloid and Interface Science, 2016,234:3-26.
[8] ANDREA A C, MAHMOOD A, ANWESHA S. Recent advances in emulsion-based delivery approaches for curcumin: From encapsulation to bioaccessibility[J]. Trends in Food Science & Technology, 2018, 71:155-169.
[9] CHUACHAROEN T, SABLIOV C M. Comparative effects of curcumin when delivered in a nanoemulsion or nanoparticle form for food applications: Study on stability and lipid oxidation inhibition[J]. LWT-Food Science and Technology, 2019, 113: 1-9.
[10] ZHANG W, CHEN C, SHI H, et al. Curcumin is a biologically active copper chelator with antitumor activity[J]. Phytomedicine International Journal of Phytotherapy & Phytopharmacology, 2016, 23(1): 1-8.
[11] EDWARDS R L, LUIS P B, VARUZZA P V, et al. The anti-inflammatory activity of curcumin is mediated by its oxidative metabolites[J]. Journal of Biological Chemistry, 2017, 292(52): 21 243-21 252.
[12] 牛静. 姜黄素纳米脂质体的制备及性质研究[D]. 南昌:南昌大学, 2015.
[13] GLADYS P, MONDRAGON C, ESPINOSA A. Developing curcumin nanoemulsions by high-intensity methods: Impact of ultrasonication and microfluidization parameters[J]. LWT-Food Science and Technology, 2019, 111: 291-300.
[14] ARTIGA-ARTIGAS M, LANJARI-PEREZ Y, MARTIN-BELLOSO O. Curcumin-loaded nanoemulsions stability as affected by the nature and concentration of surfactant[J]. Food Chemistry, 2018, 266: 466-474.
[15] SHEN P, ZHANG R, MCCLEMENTS D J, et al. Nanoemulsion-based delivery systems for testing nutraceutical efficacy using Caenorhabditis elegans: Demonstration of curcumin bioaccumulation and body-fat reduction[J]. Food Research International, 2019, 120: 157-166.
[16] FLOURY J, DESRUMAUX A, AXELOS M A V, et al. Effect of high pressure homogenisation on methylcellulose as food emulsifier[J]. Journal of Food Engineering, 2003, 58(3): 227-238.
[17] YUAN Y, GAO Y, MAO L, et al. Optimization of conditions for the preparation of β-carotene nanoemulsions using response surface methodology[J]. Food Chemistry, 2008, 107(3): 1 300-1 306.
[18] CICERO C P, ALLAN R F M, EBER A A M, et al. Development and optimization of pH-responsive PLGA-chitosan nanoparticles for triggered release of antimicrobials[J]. Food Chemistry, 2019, 295:671-679.
[19] MEHMOOD T. Optimization of the canola oil based vitamin E nanoemulsions stabilized by food grade mixed surfactants using response surface methodology[J]. Food Chemistry, 2015, 183: 1-7.
[20] CHA Y, SHI X, WU F, et al. Improving the stability of oil-in-water emulsions by using mussel myofibrillar proteins and lecithin as emulsifiers and high-pressure homogenization[J]. Journal of Food Engineering, 2019, 258: 1-8.
[21] YUAN Y, GAO Y, MAO L, et al. Optimization of conditions for the preparation of β-carotene nanoemulsions using response surface methodology[J]. Food Chemistry, 2008, 107(3): 1 300-1 306.
[22] LI X, WANG L, WANG B. Optimization of encapsulation efficiency and average particle size of Hohenbuehelia serotina polysaccharides nanoemulsions using response surface methodology[J]. Food Chemistry, 2017, 229: 479-486.
[23] LI P, LU W C. Effects of storage conditions on the physical stability of D-limonene nanoemulsion[J]. Food Hydrocolloids, 2016, 53: 218-224.
[24] STEPHEN Y, NITIN N. Thermal and oxidative stability of curcumin encapsulated in yeast microcarriers[J]. Food Chemistry, 2019, 275: 1-7.