菌落总数是指食品样品经过处理,在一定条件下培养后所得每克(或每毫升)样品中形成的微生物菌落数[1],是评价食品卫生情况的重要性指标。目前检测食品中菌落总数的方法有显色培养基法、测试纸片法、电阻抗技术法、ATP生物发光技术法、流式细胞术检测法和自动化仪器分析方法等。其中,显色培养基法实验步骤较传统方法简单[2-3],结果更易判读[4];测试纸片法方便快捷[4-5],但成本较传统培养法高[6];电阻抗法目前已被美国分析化学家协会 (Association of Official Analytical Chemists,AOAC)认证[6],但电阻抗仪对温度的稳定性要求较高[7-8],使用时需注意环境温度;ATP生物发光技术法操作快速简单、测定范围广[9],但菌落浓度一般需≥104 CFU/g[10];流式细胞术检测法大多应用在液体样品中,固体样品的应用还较少[11];自动化仪器检测法虽然仪器本身成本偏高,但操作简单,可以大大降低人工成本,适合大批量检测。
Microbio全自动菌落计数法是运用透镜像差多重聚焦技术对菌落进行3D分析,能够连续动态监测并有效区分杂质,快速完成菌落计数。为探究Microbio 全自动菌落计数法与平板菌落计数法在检测结果上是否有显著性差异,本文分别用上述2种方法检测模拟染菌的食品样品,从数据准确度、定量限和检出时间等方面进行分析比较。
1 材料与方法
1.1 仪器设备
微生物数码显微培养计数系统(MicroBio),BD;麦氏浊度仪(M007230),Biomerieux;培养箱(BD115),Binder;培养箱(IC160),Salvis。
1.2 菌种与样品
大肠埃希菌(Escherichia coli)ATCC11775,金黄色葡萄球菌(Staphylococcus aureus)22018,铜绿假单胞菌(Pseudomonas aeruginosa)ATCC27853,洋葱伯克霍尔德菌(Burkholderia cepacia)CICC10857,蜡样芽孢杆菌(Bacillus cereus)1410302,地衣芽孢杆菌(Bacillus licheniformis)22730,白色念珠菌(Monilia albican)ATCC90029,黑曲霉菌(Aspergillus niger)ATCC16404,领地伯克霍尔德氏菌(Burkholderia territorii)IQCC33107,污染伯克霍尔德氏菌(Burkholderia contaminans)CICC23882均为本实验室保存。食品样品(生鸡肉),购自北京超市,经高温灭菌后备用。
1.3 试剂与耗材
平板计数琼脂(plate count agar, PCA)、马铃薯葡萄糖琼脂,北京陆桥技术股份有限公司和BD公司;脑心浸液肉汤(brain heart infusion broth,BHI)、脑心浸液琼脂(brain heart infusion agar, BHIA),Oxoid公司;NaCl,国药集团化学试剂有限公司;马铃薯葡萄糖琼脂、比浊管,BD公司;2 mL离心管,AXYGEN公司;50 mL离心管,美国康宁公司。
1.4 方法
1.4.1 检测数据准确性及定量限比较
分别制备大肠埃希菌、金黄色葡萄球菌、洋葱伯克霍尔德菌、铜绿假单胞菌、地衣芽孢杆菌、蜡样芽孢杆菌、白色念球菌、黑曲霉的菌液。
用生理盐水将菌液调节到适当的浊度后加入到食品样品中,制成菌落终浓度为100、50、25、10、5 CFU/mL的食品样品模拟污染悬液,采用GB 4789.2—2016[1]、GB 4789.15—2016[12]中的方法进行检测。随后分别放入普通培养箱(PT组)和微生物数码显微培养计数系统(TD组)进行培养。每组5个重复。空白对照为未添加目标菌的食品样品。采用t检验进行统计,P<0.05认为差异具有统计学意义。
制备5份不同浓度:1、5、10、15、20、25 CFU/mL的食品样品模拟污染悬液,培养和检测方法同上。采用t检验进行统计,P<0.05认为差异具有统计学意义。
1.4.2 检出时间比较
分别制备领地伯克霍尔德氏菌、污染伯克霍尔德氏菌食品样品模拟污染悬液,污染浓度≤100 CFU/mL。培养方式及空白对照同1.4.1。采用t检验进行统计,P<0.05认为差异具有统计学意义。
1.4.3 不同操作人员比较
为探究人员操作对于计数结果的影响,以不同人员为单一变量,在其他条件不变的情况下,分别制备5、10、25、50、100 CFU/mL的食品样品模拟污染悬液(大肠埃希菌),实验由2人进行操作,各做5组,平行5次实验,具体操作及空白对照同1.4.1。
1.4.4 不同品牌培养基比较
用BD公司和北京陆桥公司的培养基进行金黄色葡萄球菌的培养操作,各做5组实验,前期处理和后续检测培养操作及空白对照同1.4.1。对计数结果进行单因素方差分析(α=0.05)。
1.5 数据处理方法
采用Excel及Minitab 17进行数据处理,对数据进行双样本t检验及单因素方差分析。
2 结果与分析
2.1 数据准确性及定量限比较
根据1.4.1步骤对8个菌种(大肠埃希菌、金黄色葡萄球菌、洋葱伯克霍尔德菌、铜绿假单胞菌、地衣芽孢杆菌、蜡样芽孢杆菌、白色念球菌、黑曲霉)进行数据准确性比较实验,空白对照无目标菌检出,回收率70%~105%,相对标准偏差(relative standard deviation, RSD) 0.04~0.35,说明数据准确度较好[13-14](表1)。5 CFU/mL时,RSD均≤0.35;10、25 CFU/mL时,RSD≤0.25;50、100 CFU/mL时,2个方法的RSD≤0.15。其中PT组RSD高于TD组RSD的比例为50%,这说明在数据稳定性上,TD组较PT组有微小的优势。在相对标准偏差方面,5、10 CFU/mL的RSD大多在0.20~0.35之间,这在一定程度上说明低浓度(5、10 CFU/mL)的平板计数误差较大。运用Minitab软件对数据进行方差分析(α=0.05),得到的P>0.05,说明2者在统计学上差异不显著,Microbio全自动菌落计数法可以替代平板计数法。
表1 两种培养方法下8株菌菌落计数的数据 准确性结果比较
Table 1 Comparison of the data accuracy of colony count of 8 strains under the two methods
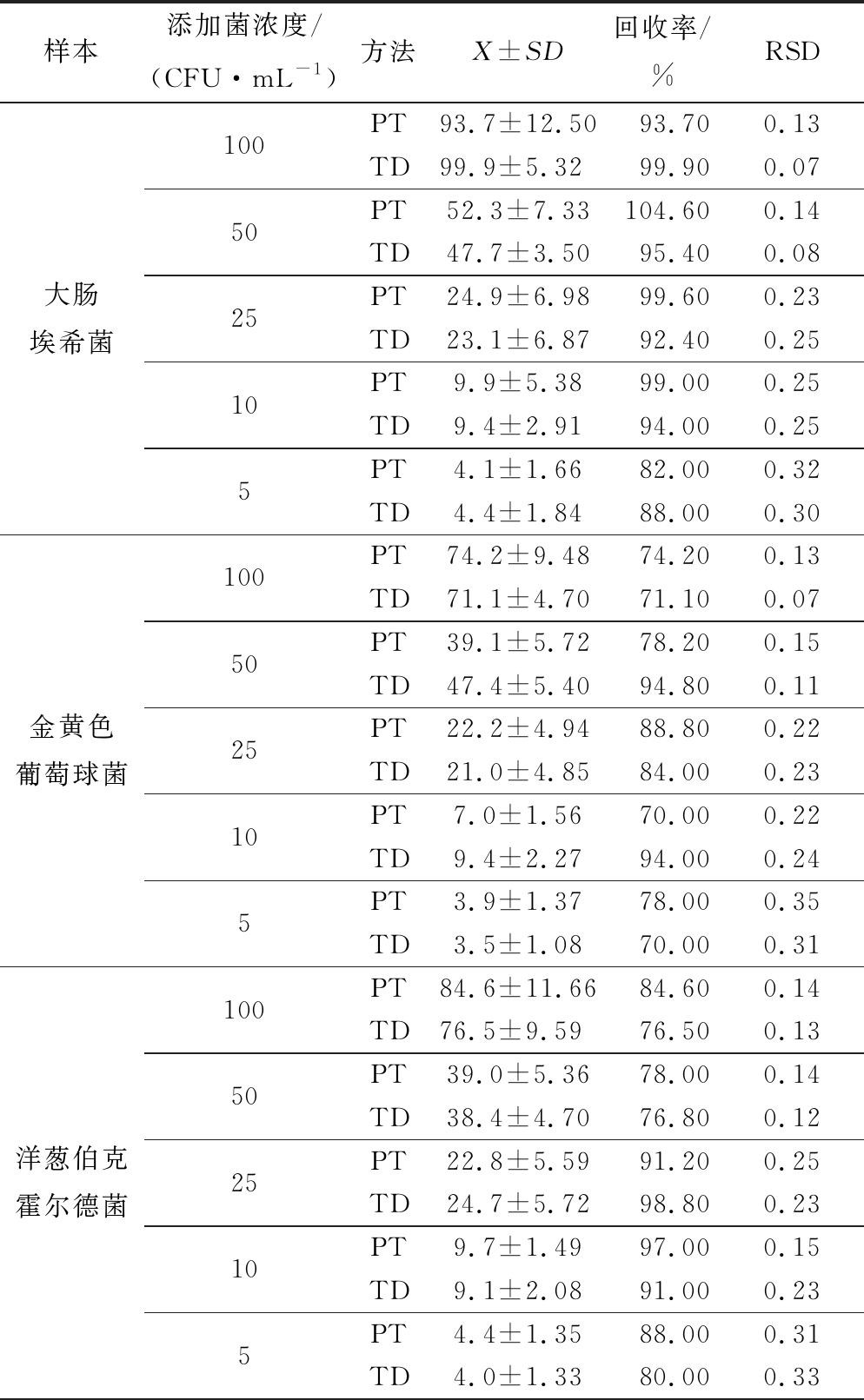
样本添加菌浓度/(CFU·mL-1)方法X±SD回收率/%RSD大肠埃希菌100PT93.7±12.5093.700.13TD99.9±5.3299.900.0750PT52.3±7.33104.600.14TD47.7±3.5095.400.0825PT24.9±6.9899.600.23TD23.1±6.8792.400.2510PT9.9±5.3899.000.25TD9.4±2.9194.000.255PT4.1±1.6682.000.32TD4.4±1.8488.000.30金黄色葡萄球菌100PT74.2±9.4874.200.13TD71.1±4.7071.100.0750PT39.1±5.7278.200.15TD47.4±5.4094.800.1125PT22.2±4.9488.800.22TD21.0±4.8584.000.2310PT7.0±1.5670.000.22TD9.4±2.2794.000.245PT3.9±1.3778.000.35TD3.5±1.0870.000.31洋葱伯克霍尔德菌100PT84.6±11.6684.600.14TD76.5±9.5976.500.1350PT39.0±5.3678.000.14TD38.4±4.7076.800.1225PT22.8±5.5991.200.25TD24.7±5.7298.800.2310PT9.7±1.4997.000.15TD9.1±2.0891.000.235PT4.4±1.3588.000.31TD4.0±1.3380.000.33
续表1
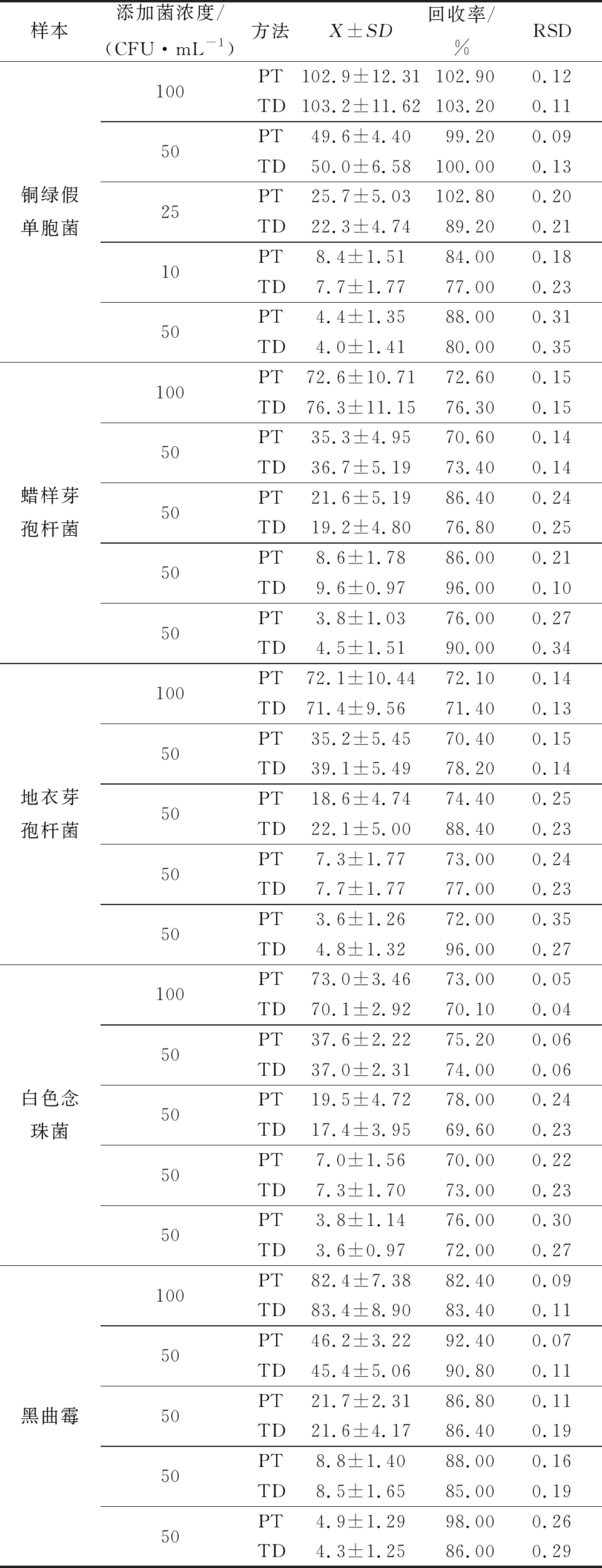
样本添加菌浓度/(CFU·mL-1)方法X±SD回收率/%RSD铜绿假单胞菌100PT102.9±12.31102.900.12TD103.2±11.62103.200.1150PT49.6±4.4099.200.09TD50.0±6.58100.000.1325PT25.7±5.03102.800.20TD22.3±4.7489.200.2110PT8.4±1.5184.000.18TD7.7±1.7777.000.2350PT4.4±1.3588.000.31TD4.0±1.4180.000.35蜡样芽孢杆菌100PT72.6±10.7172.600.15TD76.3±11.1576.300.1550PT35.3±4.9570.600.14TD36.7±5.1973.400.1450PT21.6±5.1986.400.24TD19.2±4.8076.800.2550PT8.6±1.7886.000.21TD9.6±0.9796.000.1050PT3.8±1.0376.000.27TD4.5±1.5190.000.34地衣芽孢杆菌100PT72.1±10.4472.100.14TD71.4±9.5671.400.1350PT35.2±5.4570.400.15TD39.1±5.4978.200.1450PT18.6±4.7474.400.25TD22.1±5.0088.400.2350PT7.3±1.7773.000.24TD7.7±1.7777.000.2350PT3.6±1.2672.000.35TD4.8±1.3296.000.27白色念珠菌100PT73.0±3.4673.000.05TD70.1±2.9270.100.0450PT37.6±2.2275.200.06TD37.0±2.3174.000.0650PT19.5±4.7278.000.24TD17.4±3.9569.600.2350PT7.0±1.5670.000.22TD7.3±1.7073.000.2350PT3.8±1.1476.000.30TD3.6±0.9772.000.27黑曲霉100PT82.4±7.3882.400.09TD83.4±8.9083.400.1150PT46.2±3.2292.400.07TD45.4±5.0690.800.1150PT21.7±2.3186.800.11TD21.6±4.1786.400.1950PT8.8±1.4088.000.16TD8.5±1.6585.000.1950PT4.9±1.2998.000.26TD4.3±1.2586.000.29
为确定TD组的检测结果是否可靠,对PT组和TD组的数据进行相关性分析。以PT组数值为横坐标,TD组数值为纵坐标,对数据进行线性回归,得到的相关系数在0.969 6~0.997 4之间,且都大于0.95,具有良好的相关性,表明Microbio 全自动菌落计数法的测定结果可靠。
为确定Microbio全自动菌落计数法和平板计数的定量限是否存在差异,选择6个较低检测浓度进行检测。空白对照无目标菌检出。当菌体浓度在1 CFU/mL时,2种方法的回收率都较低。5~25 CFU/mL时,回收较高,在72%~101%之间。对数据进行方差分析(α=0.05),P 值在0.107~1.000之间(≥0.05),表明2种方法差异不显著。定量限均可以达到 5 CFU/mL。
表2 两种培养方法下8株菌菌落计数的定量限结果比较
Table 2 Comparison of quantitative limit results of colony count of 8 strains under two culture methods
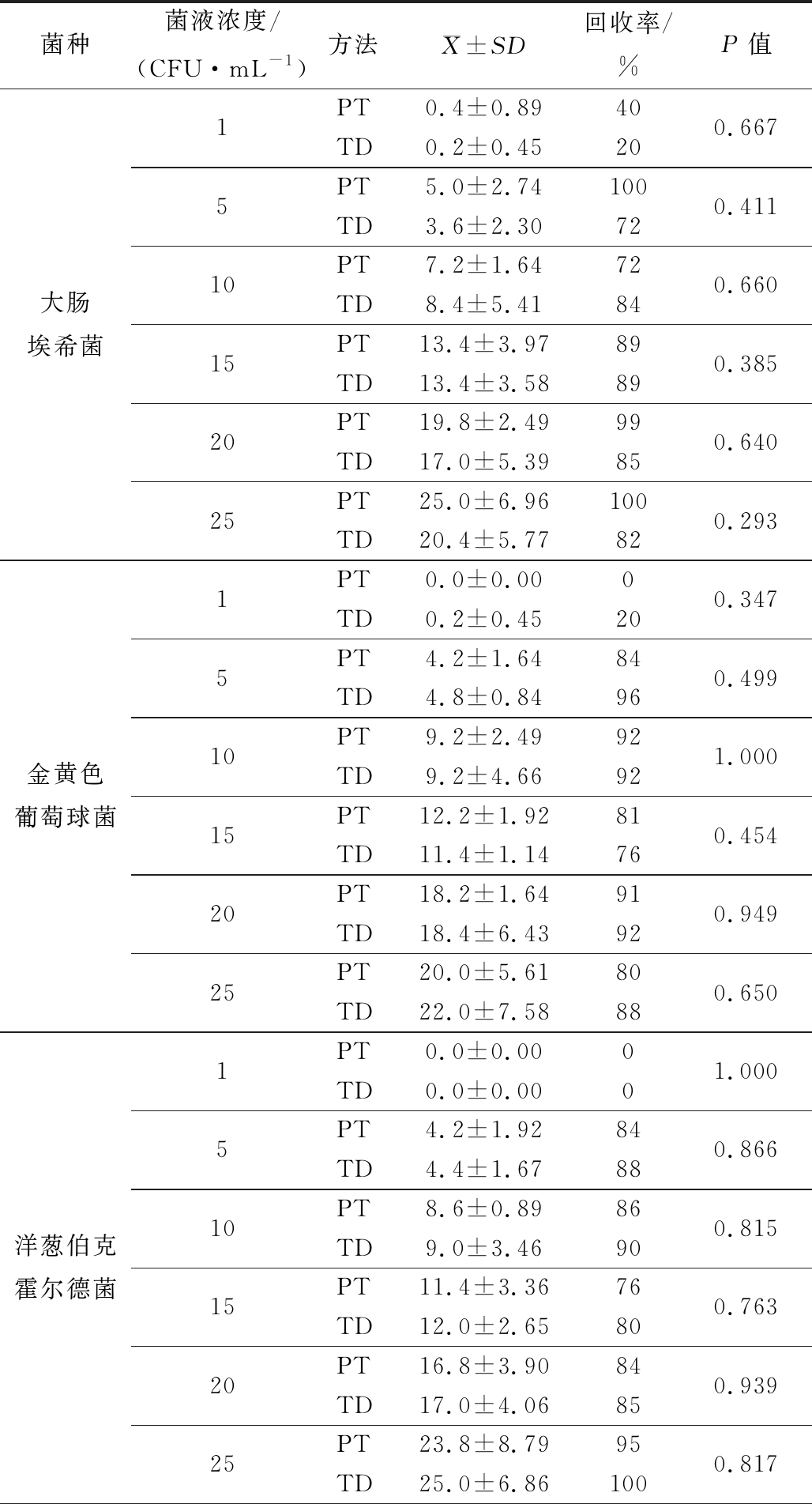
菌种菌液浓度/(CFU·mL-1)方法 X±SD回收率/%P值大肠埃希菌1PT0.4±0.8940TD0.2±0.45200.6675PT5.0±2.74100TD3.6±2.30720.41110PT7.2±1.6472TD8.4±5.41840.66015PT13.4±3.9789TD13.4±3.58890.38520PT19.8±2.4999TD17.0±5.39850.64025PT25.0±6.96100TD20.4±5.77820.293金黄色葡萄球菌1PT0.0±0.000TD0.2±0.45200.3475PT4.2±1.6484TD4.8±0.84960.49910PT9.2±2.4992TD9.2±4.66921.00015PT12.2±1.9281TD11.4±1.14760.45420PT18.2±1.6491TD18.4±6.43920.94925PT20.0±5.6180TD22.0±7.58880.650洋葱伯克霍尔德菌1PT0.0±0.000TD0.0±0.0001.0005PT4.2±1.9284TD4.4±1.67880.86610PT8.6±0.8986TD9.0±3.46900.81515PT11.4±3.3676TD12.0±2.65800.76320PT16.8±3.9084TD17.0±4.06850.93925PT23.8±8.7995TD25.0±6.861000.817
续表2
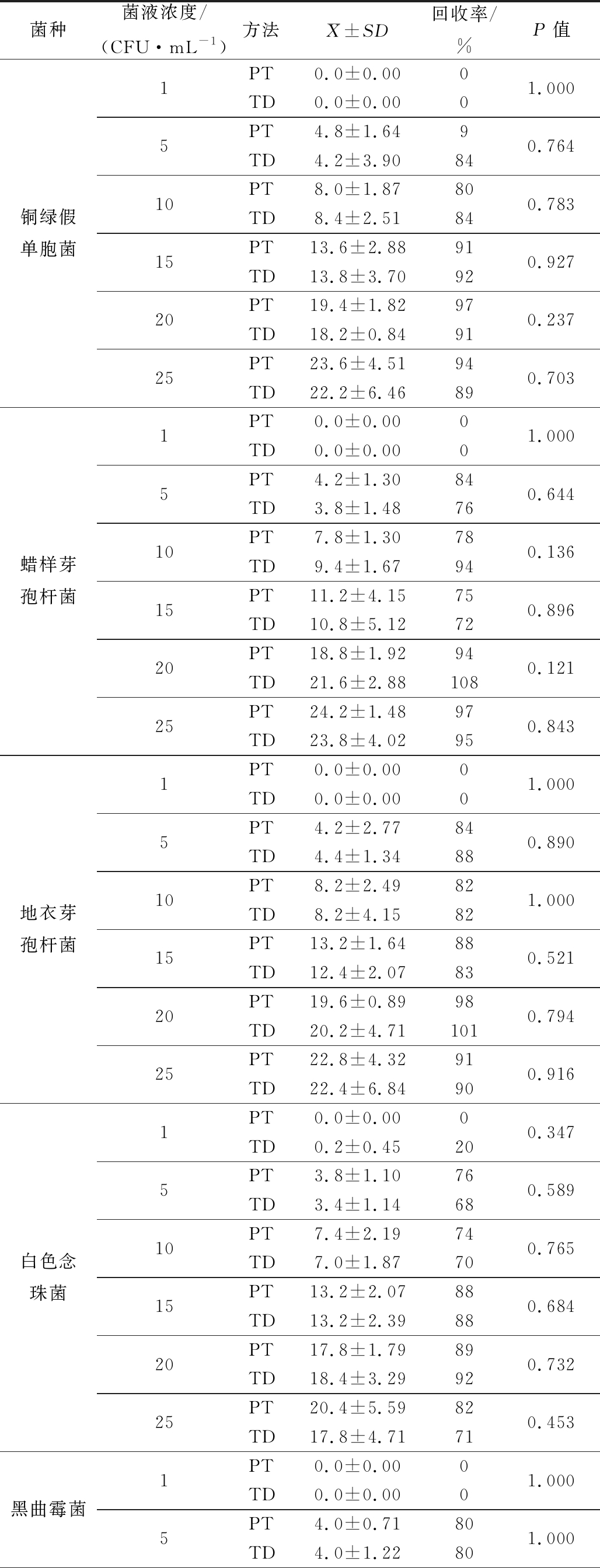
菌种菌液浓度/(CFU·mL-1)方法 X±SD回收率/%P值铜绿假单胞菌1PT0.0±0.000TD0.0±0.0001.0005PT4.8±1.649TD4.2±3.90840.76410PT8.0±1.8780TD8.4±2.51840.78315PT13.6±2.8891TD13.8±3.70920.92720PT19.4±1.8297TD18.2±0.84910.23725PT23.6±4.5194TD22.2±6.46890.703蜡样芽孢杆菌1PT0.0±0.000TD0.0±0.0001.0005PT4.2±1.3084TD3.8±1.48760.64410PT7.8±1.3078TD9.4±1.67940.13615PT11.2±4.1575TD10.8±5.12720.89620PT18.8±1.9294TD21.6±2.881080.12125PT24.2±1.4897TD23.8±4.02950.843地衣芽孢杆菌1PT0.0±0.000TD0.0±0.0001.0005PT4.2±2.7784TD4.4±1.34880.89010PT8.2±2.4982TD8.2±4.15821.00015PT13.2±1.6488TD12.4±2.07830.52120PT19.6±0.8998TD20.2±4.711010.79425PT22.8±4.3291TD22.4±6.84900.916白色念珠菌1PT0.0±0.000TD0.2±0.45200.3475PT3.8±1.1076TD3.4±1.14680.58910PT7.4±2.1974TD7.0±1.87700.76515PT13.2±2.0788TD13.2±2.39880.68420PT17.8±1.7989TD18.4±3.29920.73225PT20.4±5.5982TD17.8±4.71710.453黑曲霉菌1PT0.0±0.000TD0.0±0.0001.0005PT4.0±0.7180TD4.0±1.22801.000
续表2

菌种菌液浓度/(CFU·mL-1)方法 X±SD回收率/%P值黑曲霉菌10PT7.6±0.5576TD7.4±0.89740.68515PT13.4±1.1489TD13.6±3.51910.90920PT17.8±2.2889TD19.4±2.70970.34525PT20.0±1.8780TD18.2±0.8473%0.107
2.2 检出时间分析
污染伯克霍尔德氏菌[15]和领地伯克霍尔德氏菌生长缓慢[16],检测一般需要1~2 d。因此选用上述2株菌评价2种方法的最快检出时间。TD组的检出时间可以精确计时到0.5 h。空白对照无目标菌检出。污染伯克霍尔德菌16.0 h左右即可被 Microbio全自动菌落计数系统检出,20.0 h左右计数稳定(图1-a);领地伯克霍尔德菌15.5 h左右可被检出,19.0 h左右计数稳定(结果未显示);而平板计数法24 h左右才能检测到领地伯克霍尔德氏菌(结果未显示)和污染伯克霍尔德氏菌稳定计数结果(图1-b)。因此,从检测时间看,Microbio 全自动菌落计数法短于传统的平板计数法。
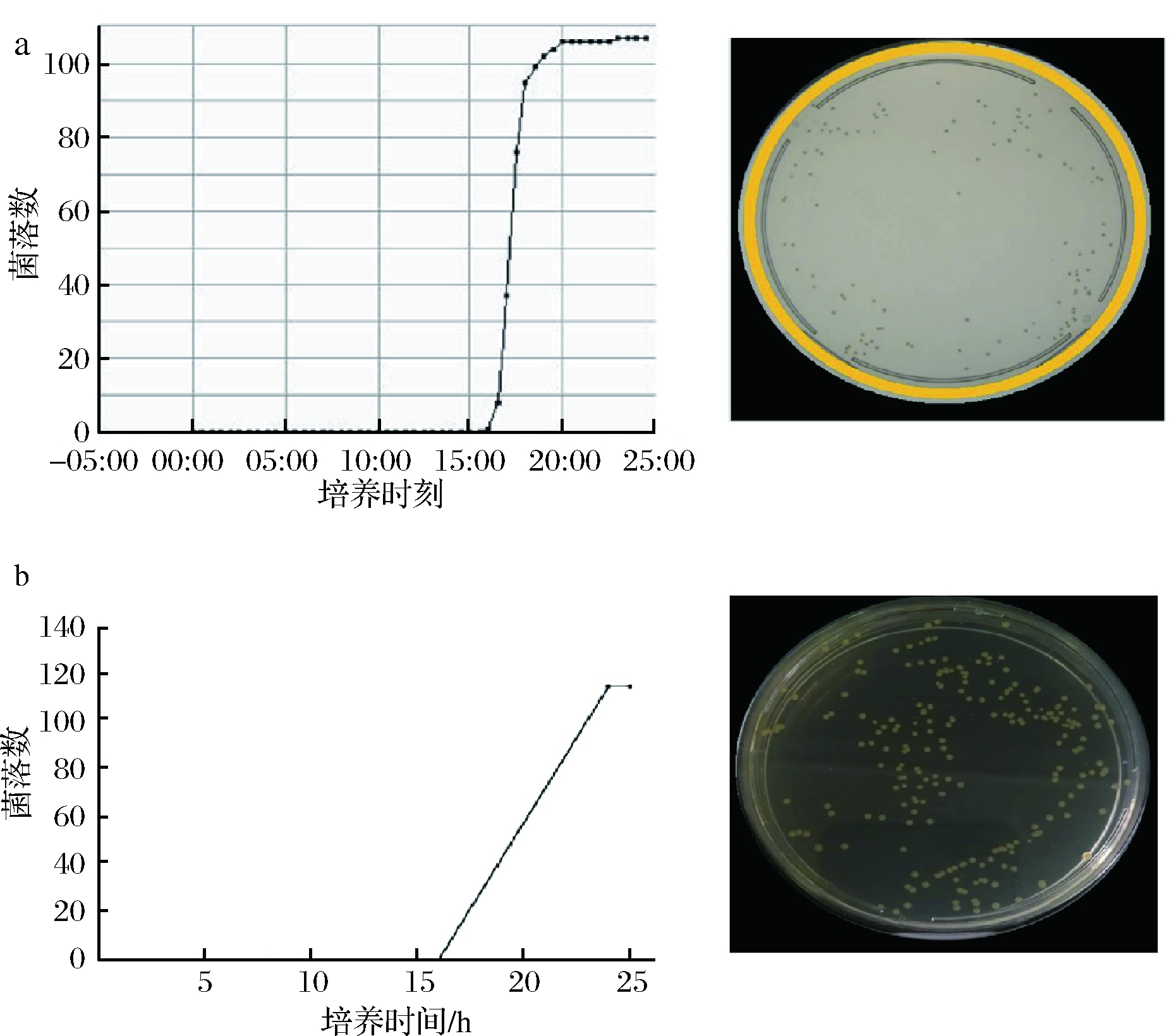
A-TD组;B-PT组
图1 污染伯克霍尔德氏菌检出时间结果
Fig.1 Check time result of Burkholderia contaminans
2.3 人员操作对于计数结果的影响
选用大肠埃希菌作为实验菌种,以操作人员(A、B)为单一变量,设计10组实验研究人员操作对于计数结果的影响。空白对照无目标菌检出,实验组10组数据的P值均>0.05(0.160~0.921之间)(表4),说明不同人员操作对计数结果影响不显著。
表4 不同人员对于计数影响的单因素方差分析(大肠埃希菌)
Table 4 Different people affected by the count of single factor analysis of variance(Escherichia coli)

添加菌浓度/(CFU·mL-1)方法人员 X±SDP值5PTAB4.6±1.953.6±1.340.913TDAB3.6±2.305.2±0.840.21110PTAB9.9±5.389.4±2.910.433TDAB10.6±2.708.2±2.860.52125PTAB25.0±6.9624.8±7.820.171TDAB25.4±7.9620.8±5.450.63250PTAB54.8±7.6049.8±6.910.599TDAB46.4±2.3049.0±4.240.160100PTAB91.0±12.1996.4±13.590.921TDAB100.6±3.7199.2±6.980.198
2.4 不同培养基对于计数结果的影响
图2是使用不同厂家培养基所得的计数结果图,a为TD组结果,b为PT组结果。1号为X厂家培养基,2号为Y厂家培养基,右下角为菌落计数结果,分别为73、98、95、115 CFU(空白对照无目标菌检出)。PT组和TD组分别有5个水平,每个水平的平行数为5,计数结果方差分析(α=0.05)显示,2种培养基在统计学上没有显著性差异。说明不同培养基对计数结果影响不大。
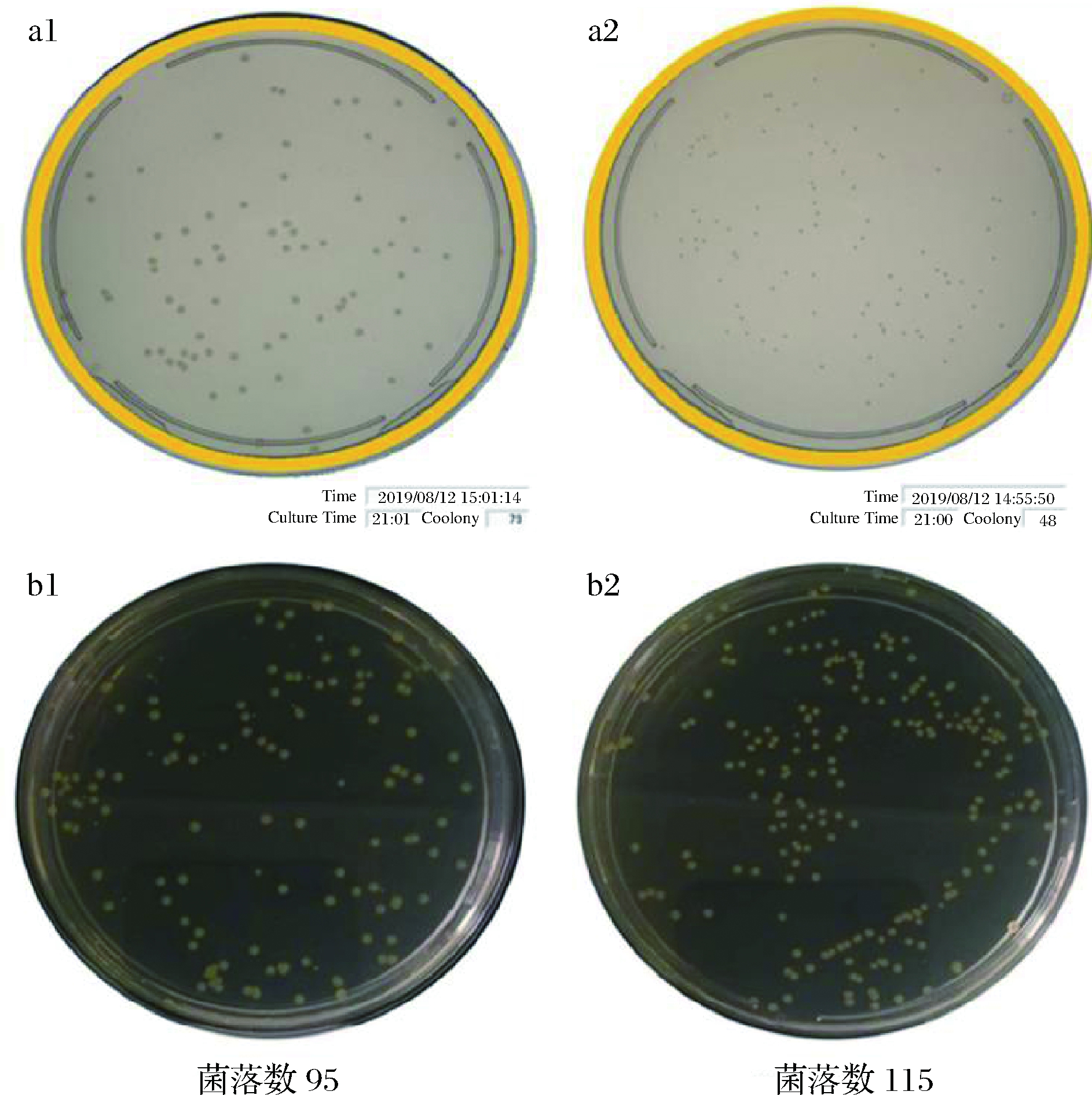
a-Microbio方法;b-平板计数法;1-X厂家培养基;2-Y厂家培养基
图2 不同厂家培养基、不同方法计数结果比较
Fig.2 Results from different manufacturers of culture media and different methods
3 讨论与结论
本研究共选用10种代表菌株,分别从计数数据准确性、定量限检测、检出时间、人员操作、不同培养基方面对Microbio全自动菌落计数法和平板计数法进行比较。实验结果表明,全自动菌落计数法在计数数据准确性、定量限检测、人员操作、不同培养基方面和平板计数法无统计学差异(α=0.05),最低检出限可达5 CFU/mL;检出时间方面,全自动菌落计数方法相较于平板计数法有一定的优势,节约4 h左右。
在菌种选择方面充分考虑了代表性,金黄色葡萄球菌和大肠埃希菌分别作为革兰氏阳性菌[17]和革兰氏阴性菌代表[17],蜡样芽孢杆菌和地衣芽孢杆菌是污染食品中常被检测到的芽孢杆菌[18],选取铜绿假单胞菌和洋葱伯克霍尔德菌来检测色素是否会影响机器的计数,选取黑曲霉和白色念球菌来评价机器真菌计数[19]的效果。
食品加工过程复杂多样,冷冻、盐渍、高温等加工方法可使部分菌株因细胞结构受损而死亡,但也存在一部分菌株能够抵御这些不良环境因素,而处于受损伤或亚致死状态,在这种情况下进行检测时,应合理地考虑培养基的使用效果。本研究发现,进口培养基和国产培养基在数量上没有显著性差异。从菌落的形态来看,X厂家培养基上生长的菌落较Y厂家培养基的稍大。因此在检测敏感性较高的菌种时,应根据菌种的长势选择合适的培养基[20]。
在检出时间方面,自动化的仪器设备要优于传统的检测方法。传统的检测方法,需要每间隔一定的时间就对菌落进行计数,并且受菌落大小及透明度的限制,十分耗费人力。而Microbio全自动菌落计数法可以实现实时检测,实时计数,操作更智能,还能将数据实时传输至工作者的邮箱,因此全自动菌落计数法在检出时间方面有一定的优势。
自动化检测是微生物快速检测的一个趋势,随着劳动力成本的上升和仪器成本的降低,越来越多的自动化检测技术应用于菌落计数中,如TSUTA等[21] 和RAYMOND等[11]分别用流式细胞术法来提高好氧平板计数法的预测精度及检测巧克力中乳酸菌的总数,LUCAS等[22]结合3D打印技术检测液滴中大肠杆菌的数量,JIANG等[23]采用电化学传感器的方法检测水中的菌落总数。利用全自动菌落计数法不仅可以节省劳动力,还可以降低实验员主观上对于菌落计数结果的影响,使结果更客观。目前关于Microbio 微生物数码显微培养计数系统的相关文献研究较少,但国内已有一些原理相似的仪器出现,如QXC-30(上海海恒机电)及讯数公司的一系列仪器,说明该方法在菌落计数方面有较大的潜能。
[1] GB 4789.2—2016. 食品安全国家标准 食品微生物学检验 菌落总数测定[S].北京:中国标准出版社,2017.
[2] 刘德,吴鑫,杨洁,等. 婴幼儿米粉中菌落总数检测方法的比较[J].食品安全质量检测学报, 2018, 9(23): 6 090-6 094.
[3] 谭静,平洋,朱海华. 金黄色葡萄球菌两种检测方法的比较研究[J].食品安全质量检测学报, 2016, 7(6): 2 277-2 280.
[4] 孙霞,蒋廉华,卢新. 3种方法检测食品中菌落总数的比较[J].中国卫生检验杂志, 2014, 24(9): 44-45; 48.
[5] 赵立冬,赵红阳,石业娇,等. 3MTM PetrifilmTM 快速菌落总数测试片法与食品中菌落总数检测国标方法(GB 4789.2—2010)的比较[J].中国微生态学杂志, 2018, 30(10): 1 203-1 210; 1 216.
[6] 谢雪钦. 两种方法测定菌落总数和大肠菌群的比较研究[J].食品工业, 2015, 36(10): 283-285.
[7] 谢翌冬. 生物阻抗法检测猪肉新鲜度及其模型预测研究[D].南京:南京农业大学, 2016.
[8] 杜寒春,叶开富,刘绍刚,等. 电阻抗法快速测定巴氏杀菌牛乳中菌落总数[J].中国乳品工业, 2017, 45(4): 56-58; 61.
[9] 侯玉柱,田雨,柯润辉,等.ATP生物发光法快速测定物体表面的菌落总数[J].食品与发酵工业,2015,41(2):217-220.
[10] BARI M L, KAWASAKI S. Encyclopedia of Food Microbiology[M]. Elsevier Inc, 2014: 269-279.
[11] RAYMOND Y, CHAMPAGNE C P. The use of flow cytometry to accurately ascertain total and viable counts of Lactobacillus rhamnosus in chocolate[J]. Food Microbiology, 2015, 46: 176-183.
[12] GB 4789.15—2016. 食品安全国家标准 食品微生物学检验 霉菌和酵母计数[S].北京:中国标准出版社,2017.
[13] SCHILLING M W. Chemical Analysis | Sampling and Statistical Requirements[M]. Encyclopedia of Meat Sciences, 2014, 1: 187-192.
[14] GB/T 32465—2015. 化学分析方法验证确认和内部质量控制要求[S].北京:中国标准出版社,2016.
[15] ROBSON C A, ADRIANO A S, VIVIANE P M, et al. Co-expression, purification and characterization of the lipase and foldase of Burkholderia contaminans LTEB11[J].International Journal of Biological Macromolecules, 2018, 116: 1 222-1 231.
[16] TAGELE S B, KIM S W, LEE H G, et al. Effectiveness of multitrait Burkholderia contaminans KNU17BI1 in growth promotion and management of banded leaf and sheath blight in maize seedling[J]. Microbiological Research, 2018, 214: 8-18.
[17] 梅仕良. 豆制品中菌落总数的流式细胞术检测研究[D].上海:上海师范大学, 2019.
[18] 张兰,徐红,翁文川,等. 流式细胞技术检测酸性饮料中菌落总数的研究[J].食品工业科技, 2018, 39(4): 235-239.
[19] 张浩. ATP生物荧光法快速检测化妆品中菌落总数的研究[J].工业微生物, 2017, 47(5):53-56.
[20] 于瑞莉,茆伟伟,龚丽芳.5种平板计数培养基质量分析[J].中国卫生检验杂志,2016,26(22):3 240-3 244.
[21] TSUTA M, SASAKI Y, TAKEUCHI I, et al. Use of multivariate analysis for the improvement in prediction accuracy of bacterial aerobic plate count by flow cytometry[J]. Elsevier Ltd, 2014, 55(2): 472-476.
[22] LUCAS C D, FEDERICO F,RIBEIRO LUIZ E B, et al. Label-free counting of Escherichia coli cells in nanoliter droplets using 3D printed microfluidic devices with integrated contactless conductivity detection[J].Analytica Chimica Acta., 2019, 1 071: 36-43.
[23] JIANG Xingxing,LIU Shuping,YANG Minghui, et al. Amperometric Genosensor for Culture Independent Bacterial Count[J]. Sensors and Actuators B: Chemical, 2019, 299: 126 944.