ε-聚赖氨酸(ε-poly-L-lysine, ε-PL)是一种由赖氨酸单体通过ε-氨基和α-羧基形成酰胺键聚合而成的天然同聚物。因其具有安全性高、抑菌谱广、水溶性和热稳定性好等优点,被日本、美国、韩国等多个国家用作食品防腐剂,2014年我国国家卫计委批准ε-PL及其盐酸盐作为食品防腐剂使用[1-3]。为了提高 ε-PL的产量,国内外学者在产生菌改造、营养条件优化和发酵过程调控等方面进行了研究。李双等[4]从不同ε-PL生产菌株出发,利用基因重排技术(Genome shuffling)使产量进一步提高。SHIMA等[5]研究了不同碳氮比对白色链霉菌发酵产生ε-PL的影响。KAHAR等[6]利用pH 双阶段调控策略,有效提高了ε-PL的生产效率。REN等[7]建立了一种酸性pH冲击策略,ε-PL产量有了很大提高。GUO等[8]研究发现不同浓度的酵母粉对ε-PL产量、生物量及关键酶活力有显著性差异(P<0.05)。WANG等[9]研究了金属离子对 S. diastatochromogenes CGMCC3145 产生ε-PL的影响, 当添加0.1 mmol/L Fe2+时,ε-PL 产量提高了 29.2%。此外,外源添加甘氨酸、赖氨酸[10-11]、ATP及生物素[12]均能提高 ε-PL 产量。
已有的ε-PL发酵过程中,氮源是随着碳源的流加进行补充的,往往只对碳源进行控制[13]。氮源的消耗主要体现在发酵液中氨氮![]() 浓度的变化,其中,无机氨氮发挥着重要的作用。产物合成与
浓度的变化,其中,无机氨氮发挥着重要的作用。产物合成与![]() 的消耗速率存在相关性,过高浓度的
的消耗速率存在相关性,过高浓度的![]() 会阻遏氯霉素、力复霉素、头孢菌素、白霉素和放线菌素的生物合成[14]。冯宁等[15]在研究氮源及其补料策略对L-缬氨酸发酵影响时,也发现(NH4)2SO4初始浓度高于225 mmol/L会对菌体生长产生抑制作用。在ε-PL合成代谢途径中,经三羧酸(tricarboxylic acid, TCA)循环得到的草酰乙酸与
会阻遏氯霉素、力复霉素、头孢菌素、白霉素和放线菌素的生物合成[14]。冯宁等[15]在研究氮源及其补料策略对L-缬氨酸发酵影响时,也发现(NH4)2SO4初始浓度高于225 mmol/L会对菌体生长产生抑制作用。在ε-PL合成代谢途径中,经三羧酸(tricarboxylic acid, TCA)循环得到的草酰乙酸与![]() 结合生产L-天冬氨酸,进而合成最终产物ε-PL[16]。前期以Streptomyces albulus IFO14147和Streptomyces noursei NRRL 5126生产ε-PL的研究中发现,
结合生产L-天冬氨酸,进而合成最终产物ε-PL[16]。前期以Streptomyces albulus IFO14147和Streptomyces noursei NRRL 5126生产ε-PL的研究中发现,![]() 可显著影响ε-PL 合成[17-18]。陈旭升等[19]采用Streptomyces sp.M-Z18菌株,在发酵过程中控制碳源浓度的同时将氨氮质量浓度控制在0.1~0.5 g/L,ε-PL产量提高29%,但氨氮
可显著影响ε-PL 合成[17-18]。陈旭升等[19]采用Streptomyces sp.M-Z18菌株,在发酵过程中控制碳源浓度的同时将氨氮质量浓度控制在0.1~0.5 g/L,ε-PL产量提高29%,但氨氮![]() 质量浓度对菌株Streptomyces diastatochromogenes 6#-7发酵生产ε-PL有何影响尚不清楚。因此,本研究尝试对ε-PL发酵过程中的
质量浓度对菌株Streptomyces diastatochromogenes 6#-7发酵生产ε-PL有何影响尚不清楚。因此,本研究尝试对ε-PL发酵过程中的![]() 进行定量控制,以确定氨氮对ε-PL合成的影响。
进行定量控制,以确定氨氮对ε-PL合成的影响。
淀粉酶产色链霉菌(Streptomyces diastatochromogenes 6#-7),天津科技大学生物反应工程研究室保藏。
种子和发酵培养基均为M3G培养基(g/L):葡萄糖50,(NH4)2SO4 10,酵母浸粉5,MgSO4·7H2O 0.5,K2HPO4·3H2O 0.8,KH2PO4 1.36,ZnSO4·7H2O 0.04,FeSO4·7H2O 0.03,用NH3·H2O调pH至7.2,121 ℃灭菌20 min。
通过调节培养基中(NH4)2SO4含量控制初始氨氮质量浓度。
1.2.1 摇瓶发酵
从斜面挑1环孢子接于含有100 mL M3G液体培养基的500 mL三角瓶中,30 ℃、200 r/min条件下振荡培养30 h得到种子液。
将种子液以6%接种量接于含有100 mL M3G液体培养基的500 mL三角瓶中,30 ℃、200 r/min条件下培养。定时取样,测定相关参数。
1.2.2 5 L分批发酵
采用5 L搅拌式发酵罐(B.Braun自控式发酵罐)。初始装液量2.7 L,接种量为10%。发酵过程中控制温度30 ℃,初始pH 6.8,自然降至pH 4.0时自动流加体积分数11%~13% NH3·H2O维持pH。通风量1~2 vvm,溶氧量(dissolved oxygen, DO) 30%,发酵液中残糖降至0 g/L时,发酵结束。
1.2.3 5 L补料分批发酵
采用5 L 搅拌式发酵罐(B.Braun自控式发酵罐)。初始装液量2.7 L,接种量为10%。采用严格的2阶段pH控制工艺进行发酵:初始pH 6.8,前期控制pH在6.0左右,当葡萄糖质量浓度降至10 g/L时,此时控制pH维持在4.0,温度30 ℃,通风量1~2 vvm,DO控制30 %(搅拌转速为300~1 000 r/min),通过流加葡萄糖控制残糖质量浓度并流加(NH4)2SO4控制![]() 质量浓度。
质量浓度。
残糖、生物量、pH参数的测定参照文献[20]。
ε-PL标准曲线和产量的测定参照文献[21]。
![]() 标准曲线和浓度的测定参照文献[22]。
标准曲线和浓度的测定参照文献[22]。
天冬氨酸激酶(aspartokinase, Ask)活性测定参照文献[23];聚赖氨酸合成酶(polylysine synthetase, Pls)活性测定参照文献[24-25]。
选择不同初始![]() 质量浓度作为实验组,以M3G培养基作为对照组
质量浓度作为实验组,以M3G培养基作为对照组![]() 质量浓度2.5 g/L),摇瓶发酵96 h,研究
质量浓度2.5 g/L),摇瓶发酵96 h,研究![]() 质量浓度对摇瓶发酵生产ε-PL的影响,结果如图1所示。
质量浓度对摇瓶发酵生产ε-PL的影响,结果如图1所示。
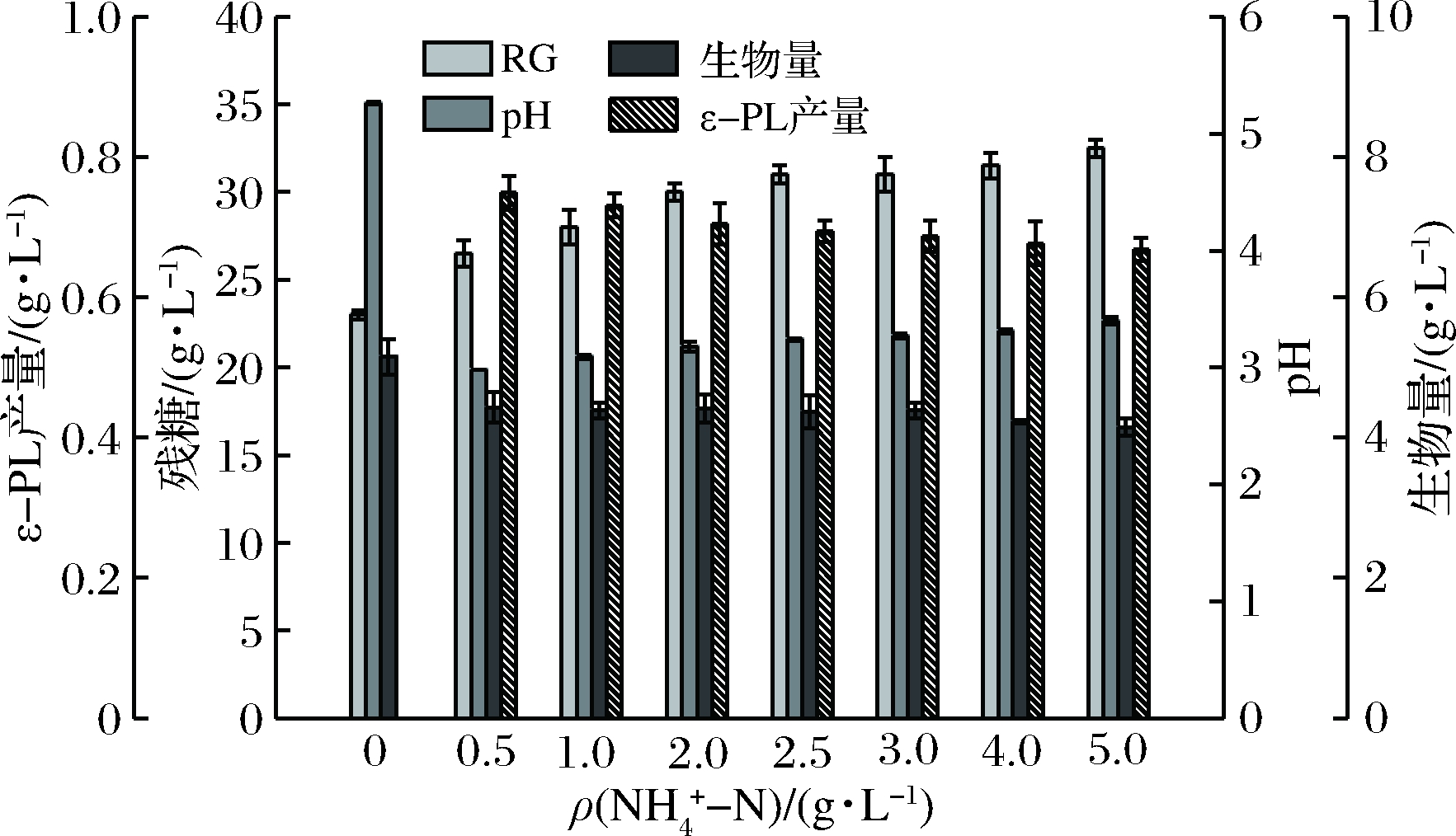
图![]() 质量浓度对摇瓶发酵生产ε-PL的影响
质量浓度对摇瓶发酵生产ε-PL的影响
Fig.1 Effect of ![]() concentration on ε-PL production in flask fermentation
concentration on ε-PL production in flask fermentation
由图1看出,除空白组(初始未添加![]() 外,其他实验组随着初始
外,其他实验组随着初始![]() 质量浓度的增加,残糖(RG)质量浓度逐渐提高,耗糖能力逐渐减弱,pH逐渐升高,ε-PL产量降低。空白组 pH保持较高水平,残糖较其他实验组低,生物量较高,但发酵液中未检测出ε-PL,这可能与
质量浓度的增加,残糖(RG)质量浓度逐渐提高,耗糖能力逐渐减弱,pH逐渐升高,ε-PL产量降低。空白组 pH保持较高水平,残糖较其他实验组低,生物量较高,但发酵液中未检测出ε-PL,这可能与![]() 参与氨基酸合成有关[26],菌体利用葡萄糖用于细胞生长,但由于缺少
参与氨基酸合成有关[26],菌体利用葡萄糖用于细胞生长,但由于缺少![]() 不能合成关键氨基酸,进而影响了ε-PL的合成[27]。初始
不能合成关键氨基酸,进而影响了ε-PL的合成[27]。初始![]() 质量浓度为0.5 g/L时,ε-PL产量达到0.75 g/L,与
质量浓度为0.5 g/L时,ε-PL产量达到0.75 g/L,与![]() 质量浓度2.5 g/L对照组ε-PL产量(0.69 g/L)相比提高了8.70%。
质量浓度2.5 g/L对照组ε-PL产量(0.69 g/L)相比提高了8.70%。
为了解释![]() 初始质量浓度对ε-PL生产影响的原因,对
初始质量浓度对ε-PL生产影响的原因,对![]() 初始质量浓度分别为0、0.5、2.5、5.0 g/L组取样并测定Ask和Pls的活力(图2)及测定ε-PL产量等参数(表1)。Ask是天冬氨酸途径的第一个酶,在ε-PL生物合成中起到决定性的调控作用[28]。Pls作为ε-PL合成途径中最后一个酶,控制ε-PL的合成,它的表达水平直接影响ε-PL的产量[29]。
初始质量浓度分别为0、0.5、2.5、5.0 g/L组取样并测定Ask和Pls的活力(图2)及测定ε-PL产量等参数(表1)。Ask是天冬氨酸途径的第一个酶,在ε-PL生物合成中起到决定性的调控作用[28]。Pls作为ε-PL合成途径中最后一个酶,控制ε-PL的合成,它的表达水平直接影响ε-PL的产量[29]。
从图2中看出,![]() 初始质量浓度0.5 g/L时,酶活力均高于其他组,24 h Ask酶活力达最高52.21 U,是对照组(23.63 U)的2.21倍,48、72 h分别达41.21、33.11 U,是对照组1.18、1.12倍,总体上保持较高的水平。Pls酶活力在发酵48h达到1 077.59 U,是对照组(967.72 U)的1.11倍;72 h Pls酶活力达到最高1 264.51 U,是对照组(958.18 U)的1.32倍;96 h酶活力下降,但仍高于对照组。根据表1可知,
初始质量浓度0.5 g/L时,酶活力均高于其他组,24 h Ask酶活力达最高52.21 U,是对照组(23.63 U)的2.21倍,48、72 h分别达41.21、33.11 U,是对照组1.18、1.12倍,总体上保持较高的水平。Pls酶活力在发酵48h达到1 077.59 U,是对照组(967.72 U)的1.11倍;72 h Pls酶活力达到最高1 264.51 U,是对照组(958.18 U)的1.32倍;96 h酶活力下降,但仍高于对照组。根据表1可知,![]() 初始质量浓度为0.5 g/L时,细胞活力高,ε-PL产量最高,糖酸转化率达到3.93%,高于对照组(3.69%),就摇瓶发酵而言,
初始质量浓度为0.5 g/L时,细胞活力高,ε-PL产量最高,糖酸转化率达到3.93%,高于对照组(3.69%),就摇瓶发酵而言,![]() 初始质量浓度为0.5 g/L更有利于生产ε-PL。
初始质量浓度为0.5 g/L更有利于生产ε-PL。
表1 摇瓶发酵96 h相关数据对比
Table 1 The comparison of data on shaker fermentation
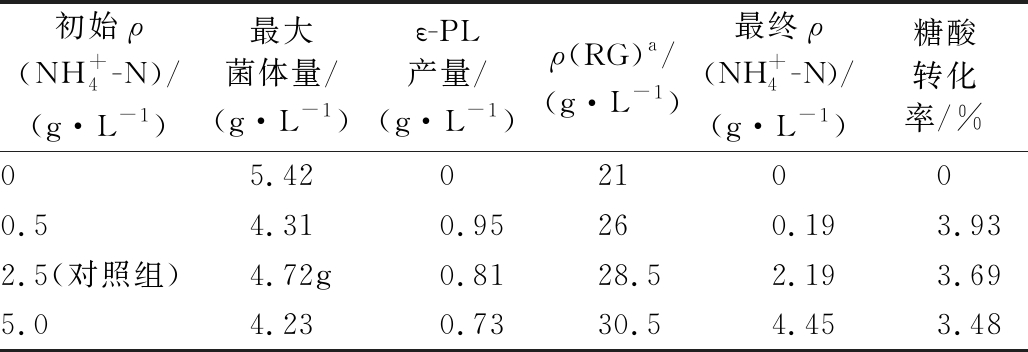
注:a残糖(residual sugar)
初始ρ(NH+4-N)/(g·L-1)最大菌体量/(g·L-1)ε-PL产量/(g·L-1)ρ(RG)a/(g·L-1)最终ρ(NH+4-N)/(g·L-1)糖酸转化率/%05.42021000.54.310.95260.193.932.5(对照组)4.72g0.8128.52.193.695.04.230.7330.54.453.48
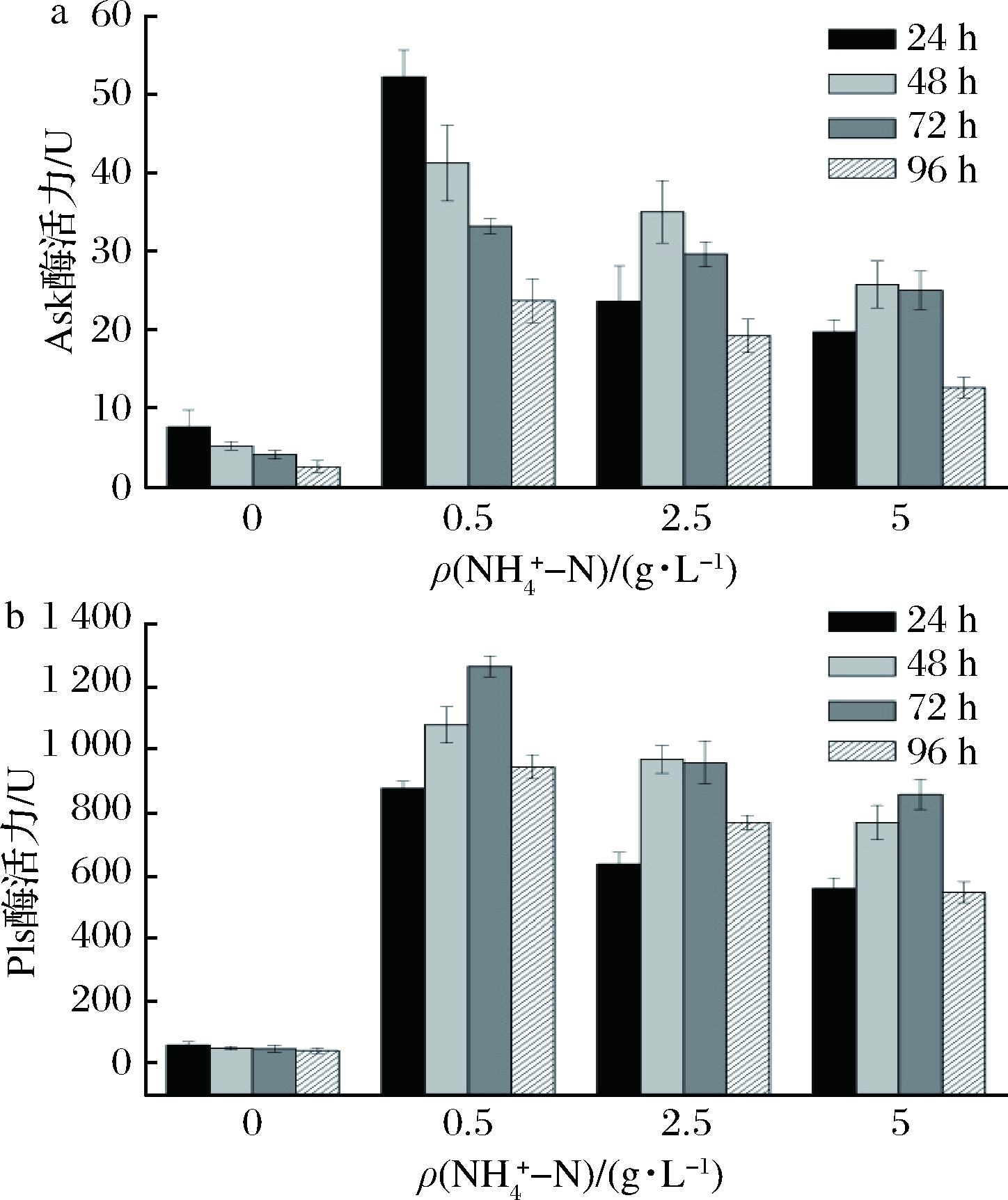
a-Ask酶活力;b-Pls酶活力
图![]() 质量浓度对摇瓶发酵Ask和Pls酶活力的影响
质量浓度对摇瓶发酵Ask和Pls酶活力的影响
Fig.2 Effect of ![]() concentration on the activities of Ask and Pls in flask fermentation
concentration on the activities of Ask and Pls in flask fermentation
在大多数细菌中,L-Lys 是通过天冬氨酸途径合成的[30],也有研究表明异源表达Ask可以提高L-Lys的产量[31],而L-Lys 是S.diastatochromogenes 合成 ε-PL 的前体物。![]() 初始质量浓度为0.5 g/L更有利于Ask和Pls的表达,进而增加了ε-PL的产量。
初始质量浓度为0.5 g/L更有利于Ask和Pls的表达,进而增加了ε-PL的产量。
为研究发酵罐水平下初始![]() 质量浓度对ε-PL产量的影响,以M3G培养基作为对照组,初始
质量浓度对ε-PL产量的影响,以M3G培养基作为对照组,初始![]() 质量浓度为0.5 g/L作为实验组进行分批发酵,结果如图3所示。
质量浓度为0.5 g/L作为实验组进行分批发酵,结果如图3所示。
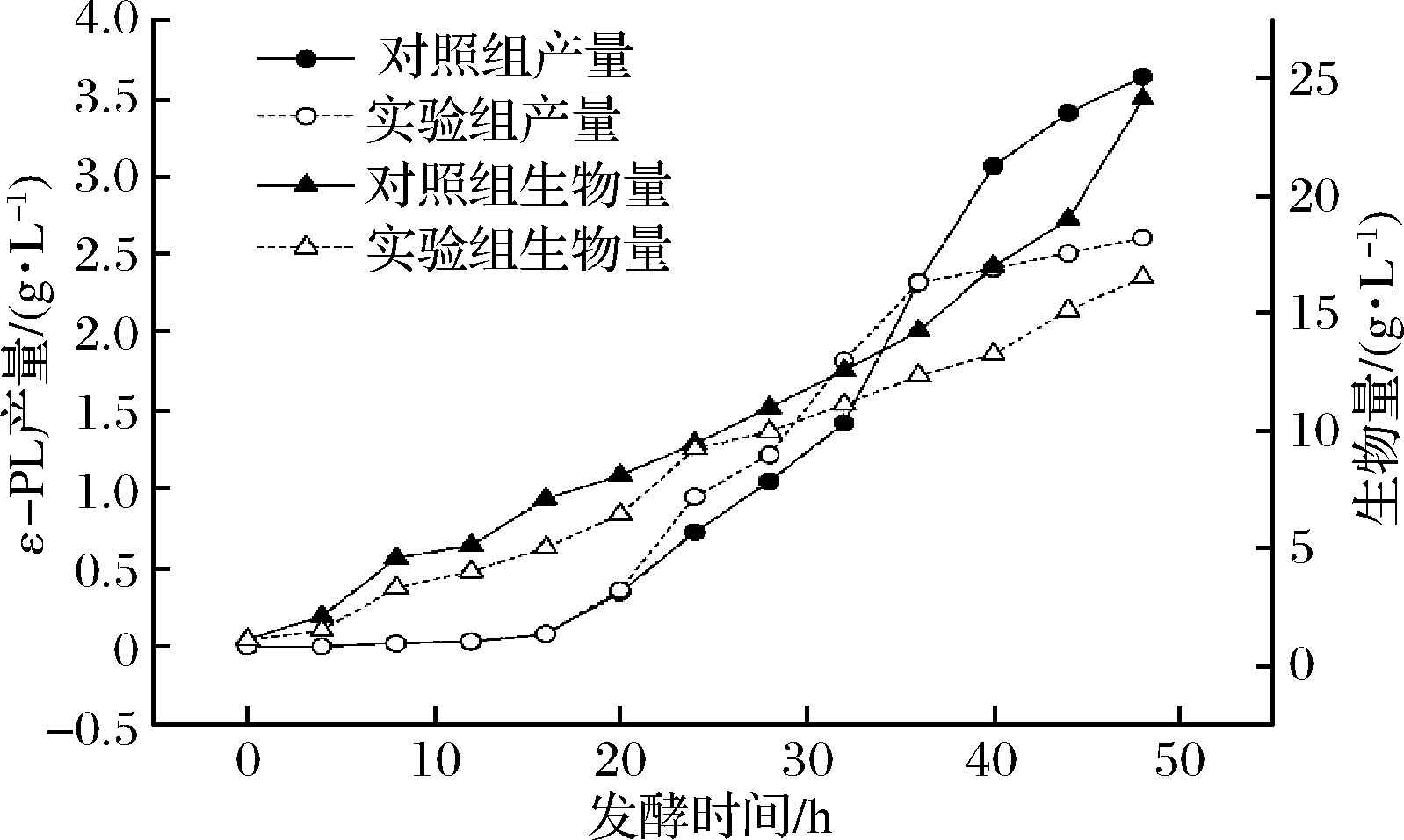
图![]() 质量浓度对5 L发酵罐分批发酵生产ε-PL的影响
质量浓度对5 L发酵罐分批发酵生产ε-PL的影响
Fig.3 Effect of ![]() concentration on the ε-PL production by batch culture in 5 L bioreactor
concentration on the ε-PL production by batch culture in 5 L bioreactor
由图3看出,在发酵开始阶段实验组生物量增长速率略高于对照组,32 h时生物量增长速率降低,最终生物量仅为16.52 g/L,低于对照组(24.12 g/L)31.51%,这与摇瓶发酵一致; ε-PL产量的变化趋势两者一致,随着生物量的增加,ε-PL产量也逐渐增加,发酵前期实验组ε-PL的增长速率要高于对照组,最终产量只有2.61 g/L,与对照组(3.63 g/L)相比降低了28.10%,分析原因可能是随着发酵的进行,![]() 质量浓度逐渐降低,虽然在发酵过程中用于维持pH的NH3·H2O可以补充一定质量浓度的
质量浓度逐渐降低,虽然在发酵过程中用于维持pH的NH3·H2O可以补充一定质量浓度的![]() 但对于高菌体量而言,发酵液中
但对于高菌体量而言,发酵液中![]() 的量不足以合成所需的前体物质,导致一部分细胞自溶,生物量较低,最终影响了ε-PL产量。
的量不足以合成所需的前体物质,导致一部分细胞自溶,生物量较低,最终影响了ε-PL产量。
5 L发酵罐分批发酵实验结果表明,由于发酵罐中菌体量高,0.5 g/L的![]() 不足以满足菌体生长和ε-PL生产的需要,因此在发酵过程中对
不足以满足菌体生长和ε-PL生产的需要,因此在发酵过程中对![]() 质量浓度进行定量控制能够在某种程度上提高ε-PL的产量。以传统方法即碳氮源以一定比例混合一起,通过碳源的添加量进行流加,不控制
质量浓度进行定量控制能够在某种程度上提高ε-PL的产量。以传统方法即碳氮源以一定比例混合一起,通过碳源的添加量进行流加,不控制![]() 质量浓度为对照,本文研究了2种
质量浓度为对照,本文研究了2种![]() 流加方式:实验组A,初始
流加方式:实验组A,初始![]() 质量浓度2.5 g/L,当发酵液中
质量浓度2.5 g/L,当发酵液中![]() 质量浓度降至0.5 g/L,通过流加(NH4)2SO4使
质量浓度降至0.5 g/L,通过流加(NH4)2SO4使![]() 质量浓度保持在0.5 g/L;实验组B,初始
质量浓度保持在0.5 g/L;实验组B,初始![]() 质量浓度0.5 g/L,发酵过程中控制
质量浓度0.5 g/L,发酵过程中控制![]() 质量浓度维持于0.5 g/L;分别进行流加发酵,结果如图4所示。
质量浓度维持于0.5 g/L;分别进行流加发酵,结果如图4所示。
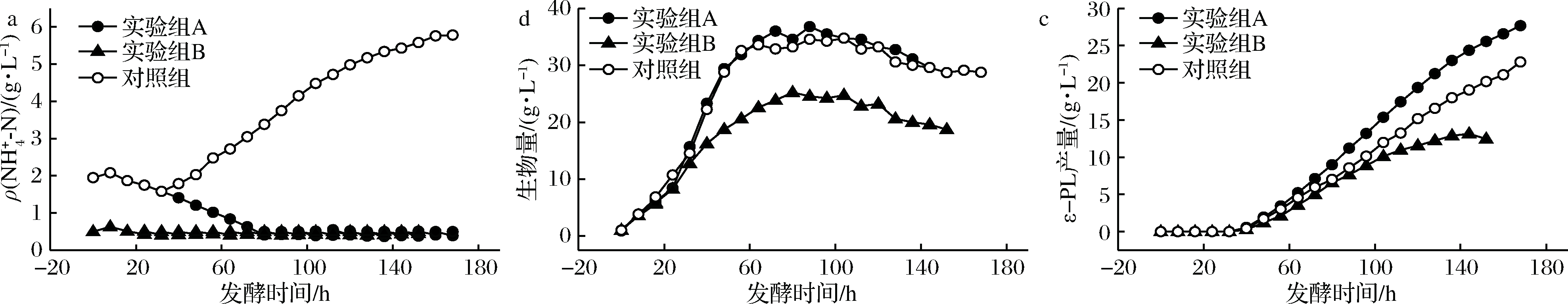
![]() 质量浓度;b-生物量;c-ε-PL产量
质量浓度;b-生物量;c-ε-PL产量
图![]() 流加方式对5 L发酵罐流加发酵生产ε-PL的影响
流加方式对5 L发酵罐流加发酵生产ε-PL的影响
Fig.4 Effect of ![]() Feeding Method on the ε-PL production by fed-batch culture in 5 L bioreactor
Feeding Method on the ε-PL production by fed-batch culture in 5 L bioreactor
由图4-a看出,实验组A发酵80 h时![]() 质量浓度降至0.5 g/L,实验组B发酵过程中控制
质量浓度降至0.5 g/L,实验组B发酵过程中控制![]() 质量浓度维持在0.5 g/L,而对照组由于碳氮源混合同时流加,80 h
质量浓度维持在0.5 g/L,而对照组由于碳氮源混合同时流加,80 h ![]() 质量浓度达到了3.38 g/L,并且随着发酵时间的延长,对照组的
质量浓度达到了3.38 g/L,并且随着发酵时间的延长,对照组的![]() 质量浓度逐渐升高,直至发酵结束
质量浓度逐渐升高,直至发酵结束![]() 质量浓度达到5.78 g/L,远高于实验组A和实验组B;从菌体生物量(图4-b)可以看出,实验组B的生物量与其他2组相比始终处于较低水平,这与分批发酵结果一致(图3),80 h生物量达到最大,为24.55 g/L,而实验组A和对照组生物量最大值分别为35.98和34.75 g/L,这可能是由于实验组B中
质量浓度达到5.78 g/L,远高于实验组A和实验组B;从菌体生物量(图4-b)可以看出,实验组B的生物量与其他2组相比始终处于较低水平,这与分批发酵结果一致(图3),80 h生物量达到最大,为24.55 g/L,而实验组A和对照组生物量最大值分别为35.98和34.75 g/L,这可能是由于实验组B中![]() 质量浓度一直维持在0.5 g/L,发酵前期
质量浓度一直维持在0.5 g/L,发酵前期![]() 含量过低使细胞的生长受到较大限制;由图4-c可看出,实验组A发酵168 h ε-PL产量最高,达到27.67 g/L,与对照组相比提高了17.72%,实验组B发酵152 h ε-PL产量最高,为12.46 g/L,远低于实验组A和对照组,这可能是由于实验组B的菌体量处于较低水平(图4-b),导致产量低于实验组A和对照组。
含量过低使细胞的生长受到较大限制;由图4-c可看出,实验组A发酵168 h ε-PL产量最高,达到27.67 g/L,与对照组相比提高了17.72%,实验组B发酵152 h ε-PL产量最高,为12.46 g/L,远低于实验组A和对照组,这可能是由于实验组B的菌体量处于较低水平(图4-b),导致产量低于实验组A和对照组。
对实验组A与对照组发酵过程中细胞比生长速率、产物比合成速率及生长强度进行对比,结果如图5所示。

a-细胞比生长速率;b-ε-PL比合成速率;c-生产强度
图![]() 流加方式对ε-PL合成效率的影响
流加方式对ε-PL合成效率的影响
Fig.5 Effect of ![]() feeding method on the ε-PL synthesis efficiency
feeding method on the ε-PL synthesis efficiency
由图5-a看出,实验组A和对照组的比生长速率曲线基本重合,可见改变了![]() 控制方式对整体细胞生长几乎没有影响,这与图4-b中细胞生物量的结果相符。图5-b是ε-PL比合成速率图,由图5-b中可以看出实验组A和对照组从40 h开始上升,大约在110 h达到最高,40 h后实验组A的ε-PL比合成速率始终高于对照组,这表明实验组A的菌体细胞合成产物能力较强。从图5-c可以看出,发酵40 h以后,实验组A的生产强度始终高于对照组,虽然二者的比生长速率相近(图5-a),但实验组A产物合成能力明显高于对照组,使得ε-PL产量与对照组相比提高17.72%。
控制方式对整体细胞生长几乎没有影响,这与图4-b中细胞生物量的结果相符。图5-b是ε-PL比合成速率图,由图5-b中可以看出实验组A和对照组从40 h开始上升,大约在110 h达到最高,40 h后实验组A的ε-PL比合成速率始终高于对照组,这表明实验组A的菌体细胞合成产物能力较强。从图5-c可以看出,发酵40 h以后,实验组A的生产强度始终高于对照组,虽然二者的比生长速率相近(图5-a),但实验组A产物合成能力明显高于对照组,使得ε-PL产量与对照组相比提高17.72%。
摇瓶发酵结果表明,初始![]() 质量浓度为0.5 g/L能够促进Ask和Pls的表达,进而提高ε-PL的产量,发酵96 h产量达到0.95 g/L,与对照组相比提高了15.13%。就5 L发酵罐水平而言,初始
质量浓度为0.5 g/L能够促进Ask和Pls的表达,进而提高ε-PL的产量,发酵96 h产量达到0.95 g/L,与对照组相比提高了15.13%。就5 L发酵罐水平而言,初始![]() 质量浓度为2.5 g/L,对发酵过程中碳、氮源分别流加,控制葡萄糖质量浓度维持在10
质量浓度为2.5 g/L,对发酵过程中碳、氮源分别流加,控制葡萄糖质量浓度维持在10 ![]() 质量浓度维持于0.5 g/L,保证了菌体正常生长,提高了细胞合成产物的能力,更有利于生产ε-PL。利用此工艺进行补料分批发酵,168 h ε-PL的产量达到26.67 g/L,与对照组相比提高了17.72%。发酵过程中控制
质量浓度维持于0.5 g/L,保证了菌体正常生长,提高了细胞合成产物的能力,更有利于生产ε-PL。利用此工艺进行补料分批发酵,168 h ε-PL的产量达到26.67 g/L,与对照组相比提高了17.72%。发酵过程中控制![]() 质量浓度可以提高ε-PL产量。
质量浓度可以提高ε-PL产量。
[1] 贾士儒.生物防腐剂[M].北京:中国工业出版社, 2009.
[2] 谭之磊,贾士儒,赵颖,等.淀粉酶产色链霉菌TUST2中ε-聚赖氨酸降解酶的纯化和性质[J]. 高等学校化学学报, 2009, 30(12): 2 404-2 408.
[3] 中华人民共和国国家卫生和计划生育委员会.关于批准ε-聚赖氨酸等4种食品添加剂新品种等的公告(2014年第5号)[J].中国食品添加剂,2014(3): 213-221.
[4] 李双,颜鹏,曾晨,等.Genome shuffling 筛选ε-聚赖氨酸高产菌及其对代谢流量分配的影响[J].微生物学通报,2016,43(12): 2 568-2 577.
[5] SHIMA S, SAKAI H. Poly-L-lysine produced by Streptomyces Part Ⅲ. Chenical studies[J]. Agricultural Biological Chemistry, 1981, 45(11): 2 503-2 508.
[6] KAHAR P, IWATA T, HIRAKL S, et al. Enhancement of ε-Poly-lysine production by Streptomyces albulus strain 410 using pH control [J]. Journal of Bioscience and Bioengineering, 2001, 91(2): 190-194.
[7] REN X, CHEN X, ZENG X, et al. Acidic pH shock induced overproduction of ε-poly-L-lysine in fed-batch fermentation by Streptomyces sp.M-Z18 from agro-industrial by-products[J].Bioprocess and Biosystems Engineering,2015, 38(6): 1 113-1 125.
[8] GUO F Z, ZHENG H R, ZHANG X, et al. Effect of yeast extract on production of ε-poly-L-lysine by Streptomyces diastatochromogenes[C].2016 International Conference on Applied Biotechology. Tianjin, 2016:235-244.
[9] WANG G,JIA S,WANG T, et al.Effect of ferrous ion on ε-poly-L-lysine biosynthesis by Streptomyces diastatochromogenes CGMCC3145 [J].Current Microbiology,2011,62(3): 1 062-1 067.
[10] 谭之磊,宋帅,王甜,等.甘氨酸对淀粉酶产色链霉菌Cbγ4 产ε-聚赖氨酸的影响[J].中国酿造,2012,31(9):27-29.
[11] 宋庆超,贾士儒,王国良,等.添加L-赖氨酸对淀粉酶产色链霉菌 CGMCC3145 生物合成 ε-聚赖氨酸的影响 [C].International Conference on Bio-Inspired Systems and Signal Processing.Xiamen,2010:226-229.
[12] 薛晓明,吴振强,吴清平,等.添加ATP和生物素优化ε-聚赖氨酸发酵的研究[J].中国酿造,2012,31(1):72-76.
[13] XU Z, BO F, XIA J, et al. Effects of oxygen-vectors on the synthesis of epsilon-poly-lysine and the metabolic characterization of Streptomyces albulus PD-1[J]. Biochemical Engineering Journal, 2015, 94: 58-64.
[14] 张肖静,李冬,梁瑜海,等.氨氮浓度对CANON工艺性能及微生物特性的影响[J]. 中国环境科学,2014,34(7):1 715-1 721.
[15] 冯宁,白亚磊,徐庆阳,等. 氮源及其补加策略对L-缬氨酸发酵的影响[J].食品与发酵工业, 2011, 37(4): 1-6.
[16] HAMANO Y, YOSHIDA T, KITO M, et al. Biological function of the pld gene product that degrades epsilon-poly-L-lysine in Streptomyces albulus[J]. Applied Microbiology & Biotechnology, 2006, 72 (1):173-181.
[17] Shih I L,Shen M H.Application of response surface methodology to optimize production of ε-poly-L-lysine by Streptomyces albulus IFO14147[J].Enzyme and Microbial Technology,2005,39(1):15-21.
[18] Bankar S B,Singhal R S.Optimization of poly-ε-lysine production by Streptomyces noursei NRRL 5126[J].Bioresource Technology,2010,101(21):8 370-8 375.
[19] 陈旭升,董难,毛忠贵. 碳源和氮源流加方式对ε-聚赖氨酸补料-分批发酵过程的影响[J].食品与发酵工业,2013,39(8): 47-52.
[20] SONG S, TAN Z L, GUO F Z, et al. Breeding of Streptomyces diastatochromogenes for mass-producing ε-poly-L-lysine by composite mutation[J]. Proceedings of the 2012 International Conference on Applied Biotechnology, Lecture Notes in Electrical Engineering, 2014(249):359-366.
[21] 曹伟锋,谭之磊,袁国栋,等.ε-聚赖氨酸测定方法的改进[J].天津科技大学学报,2007,22(2):9-11;32.
[22] 梁剑光,朱玲,徐正军.靛酚蓝-分光光度法测定发酵液中氨态氮含量研究[J].食品与发酵工业,2006,32(9):134-137.
[23] HAMANO Y, NICCHU I, SHIMIZU T, et al.Epsilon-poly-L-lysine producer, Streptomyces albulus, has feedback-inhibition resistant aspartokinase[J].Applied Microbiology and Biotechnology,2007,76(4):873-882.
[24] KITO N, MARUYAMA C, YAMANAKA K,et al.Mutational analysis of the three tandem domains of ε-poly-L-lysine synthetase catalyzing the l-lysine polymerization reaction[J].Journal of Bioscience and Bioengineering,2013,115(5):523-526.
[25] HAMANO Y, KITO N, KITA A,et al.Epsilon-poly-L-lysine peptide chain length regulated by the linkers connecting the transmembrane domains of epsilon-poly-L-lysine synthetase[J].Applied and Environmental Microbiology,2014,80(16):4 993-5 000.
[26] BRZONKALIK K, HERRLING T, SYLDATK C, et al.The influence of different nitrogen and carbon sources on mycotoxin production in Alternaria alternata[J].International Journal of Food Microbiology, 2011, 147(2): 120-126.
[27] SHIMA H, SAKAI H. Poly-L-lysine produced by Streptomyces partⅡ. Taxonomy and fermentation studies[J]. Agricultural and Biological Chemistry, 1981, 45(11): 2 497-2 502.
[28] FENG X, XU H, XU X, et al. Purification and some properties of ε-poly-L-lysine-degrading enzyme from Kitasatospora sp. CCTCC M205012[J]. Process Biochemistry, 2008, 43(6): 667-672.
[29] YAMANAKA K, MARUYAMA C, TAKAGI H, et al. ε-Poly-L-lysine dispersity is controlled by a highly unusual nonribosomal peptide synthetase[J]. Nature Chemical Biology, 2008, 4(12): 766-772.
[30] WITTMANN C, BECKE J. The L-lysine story: from metabolic pathways to industrial production[J].Microbiology Monographs,2007:39-70.
[31] 赵德周.基于代谢工程构建大肠杆菌L-赖氨酸高产菌[D].重庆:重庆大学,2017.