糖尿病是由胰腺分泌功能缺陷或胰岛素作用缺陷引起的,以血糖升高、糖代谢紊乱为特征的内分泌代谢性疾病,也是当前危害人类健康的常见病、多发病[1]。相关数据统计显示,糖尿病及其相关并发症已成为严重影响人类健康和生活质量的慢性非传染性疾病,2017年全球约有4.51亿糖尿病患者,其中我国糖尿病患者人数约占27%,预计到2045年将高达35%左右,位居全球首位[2]。近年来,除口服降糖药(磺酰脲类、双胍类和胰岛素促泌剂等)、胰岛素(普通胰岛素、基因工程胰岛素和中性可溶性人胰岛素等)以及中药类(玉泉丸、消渴丸和参芪降糖片等)等常用糖尿病治疗药物外,一些从天然食物中获取的活性物也被报道具有显著的降糖作用,且其降糖作用机制引起了研究者的广泛关注[3-4]。
辣椒(Capsicum annuum L.),茄科、辣椒属,是在全世界范围内被广泛消费的蔬菜和香料之一,其主要的辛辣成分是生物碱类物质,包括辣椒素 (46%~77%)、二氢辣椒素 (21%~40%),以及少量的降二氢辣椒素、高辣椒素、高二氢辣椒素等[5]。辣椒素(反式8-甲基-N-香草基-6-壬烯酰胺)又名辣素、辣椒碱,其分子式结构如图1所示,是一种斥水亲脂、无色无嗅的结晶或蜡状化合物,为辣椒属植物红辣椒的主要活性成分。现代研究表明,辣椒素及其衍生物具有广泛的生理活性,在治疗心血管疾病、镇痛止痒、降脂降糖和预防癌症等方面均有特殊的效果[6-7]。在美国和加拿大,辣椒素已被美国食品药品监督管理局(Food and Drug Administration, FDA)批准为非处方药(over-the-counter drug, OTC)。近年来,随着相关研究的深入,辣椒素的降糖机制在改善糖代谢、促进胰岛素分泌、介导瞬时受体电位香草酸亚型1(Transient receptor potential vanilloid 1, TRPV1)、调控内分泌及肠道菌群等方面均有体现,但目前未见系统报道。为综合评估辣椒素的降糖潜力,本文将其降糖效果及相关机制进行综述,以期为糖尿病研究提供参考。
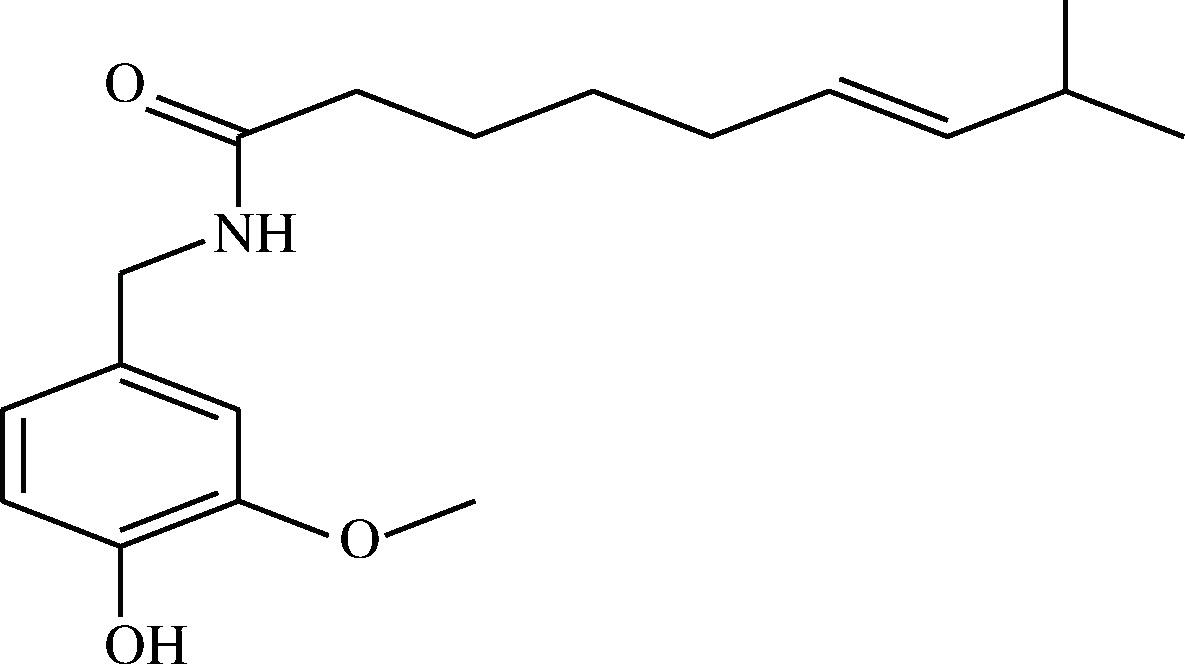
图1 辣椒素分子式结构图
Fig.1 The molecular structure of capsaicin
1 辣椒素抗糖尿病效果的研究
1.1 辣椒素的降糖实验研究
大量动物实验表明,辣椒素具有显著的抗糖尿病效果,其主要体现在辣椒素改善胰岛细胞、促进胰岛素分泌以及降低血糖水平等方面。TOLAN 等[8]以狗为实验模型,研究辣椒素对血糖、血浆胰岛素和胰岛素受体的影响,结果表明辣椒素能够促进胰岛素分泌,通过增加狗的血浆胰岛素含量来降低其血糖水平。OKUMURA等[9]研究发现,在膳食中添加一定量的辣椒素(0.004 2%)和咖啡因(0.031%)作用于KKAy型肥胖/糖尿病小鼠,饲喂28 d后发现,糖尿病小鼠的血糖水平相比对照组(糖尿病模型组)下降明显,且与咖啡因具有协同降糖作用。AKIBA等[10]研究表明辣椒素能够刺激大鼠胰岛β细胞,使其增加胰岛素的分泌而达到降糖的作用,辣椒素对食物摄入、能量消耗以及对胰腺内分泌均具有影响作用。KWON等[11]以切除90%胰腺的2型糖尿病大鼠为模型,研究辣椒素给药8周对糖尿病大鼠胰腺β细胞和胰岛素分泌的作用,实验结果表明,辣椒素对糖代谢紊乱和胰岛素抵抗具有改善作用。在ZHANG等[12]的研究中也验证了这一结果,并且发现无论是从辣椒中提取的天然辣椒素类物质[含辣椒素(66.5%)和二氢辣椒素(28.7%)]还是纯度≥95%的辣椒素单体物质,均能显著降低链脲佐菌素(streptozocin,STZ)诱导的糖尿病大鼠的血糖水平,且具有促进其胰岛素分泌、改善糖代谢紊乱以及抑制肠道对葡萄糖的吸收等作用。同时,相关研究表明辣椒素还能够通过增强脂联素及其受体的表达来改善肥胖以及糖尿病KKAy小鼠的代谢失调[13]。此外,LAGISETTY等[14]在实验中采用大鼠(正常和糖尿病)和家兔(糖尿病)为动物实验模型评估辣椒素对格列齐特活性的影响,结果表明辣椒素在糖尿病大鼠和家兔中均表现出显著的降血糖活性,具有改善胰岛素水平和β细胞功能的作用,同时又具有增强格列齐特药物降糖活性和改变格列齐特的药代动力学参数的作用,与单独使用格列齐特相比,二者联合使用降糖效果更为显著。
由于辣椒素特有的辛辣官能团,其辛辣特性会使其应用范围和使用剂量大大受限。有学者发现一种从日本甜椒 (CH-19) 中提取分离的且不含辛辣成分的辣椒素类似物(辣椒素酯),其生物活性以及分子结构(图2)与辣椒素类似,且动物试验表明它不但可以激活TRPV1,而且在降脂减肥、促进能量代谢以及胰岛素敏感性方面均有显著的效果[11],其细胞毒性比辣椒素低,且不含辛辣基团。相关研究也综合评估了辣椒素酯是否具有替代辣椒素的潜力。辣椒素酯和辣椒素作用于非肥胖的2型糖尿病大鼠的对比实验表明,同辣椒素相比,辣椒素酯通过提高胰岛素敏感性,能更好地改善葡萄糖代谢[11],但在STZ诱导的糖尿病大鼠中对比二者降糖效果,辣椒素酯在增加胰岛素分泌量及降糖效果方面明显劣于辣椒素,其降糖效果不显著[15]。
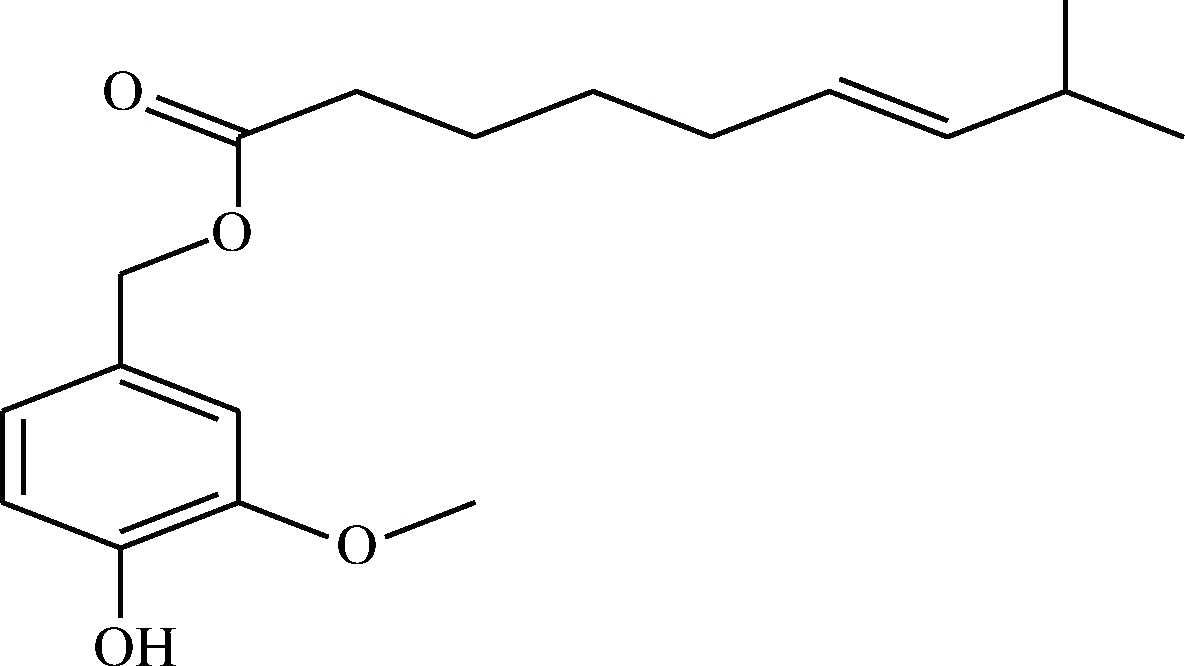
图2 辣椒素酯分子式结构图
Fig.2 The molecular structure of capsiate
上述研究结果表明,虽然辣椒素酯作为辣椒素的类似物也能改善糖尿病的一些症状,但其对TRPV1的上调效率以及不具备辛辣特性,或许是其降糖效果劣于辣椒素的主要原因。综上,辣椒素具有增加胰岛素分泌、改善糖代谢及胰岛素抵抗等作用,降糖效果显著,且能够增益格列齐特药物降糖活性,表明辣椒素具有成为降糖药物助剂的潜力。
1.2 辣椒素的降糖临床研究
随着对辣椒素研究的深入,与其相关的临床试验也陆续开展。较多学者关注于辣椒素对健康人群的胰岛素水平、胰高血糖素水平的潜在影响。如AHUJA等[16]研究了含有辣椒素的膳食对健康受试者(36名)血清胰岛素、C肽的影响,结果表明经常食用辣椒可以减轻餐后高胰岛素血症。CHAIYASIT等[6]也对12名健康的男性志愿者进行了临床试验,其口服葡萄糖耐量测试(oral glucose tolerance test, OGTT)结果显示,志愿者的血糖水平在30和45 min时显著低于安慰剂组(空白对照组),在60、75、105和120 min时,胰岛素水平显著升高,并表明5 g辣椒中所含辣椒素的量与等同胰岛素的降糖效果相当,更加明确了辣椒素具有促进胰岛素分泌以及显著地降血糖作用,并且摄入富含辣椒素的辣椒对妊娠期糖尿病患者的餐后高血糖、高胰岛素血症和空腹脂质紊乱均有改善,能够降低大孕期新生儿的发病率[17]。此外,2项中长期的研究也调查了定期摄入辣椒素对成年健康人群新陈代谢的影响:LEJEUNE等[18]报道了辣椒素(135 mg/d, 9周)具有促进脂肪氧化的作用,但摄入辣椒素与服用安慰剂的受试者之间的血清葡萄糖,胰岛素或能量消耗没有显著差异;BELZA等[19]报道了定期摄入辣椒素(0.6 μg/d, 1周)后人体能量消耗具有增加的趋势。YOSHIOKA等[20]的研究也部分验证了上述观点,其研究表明在健康受试人群摄入含辣椒素的餐食会降低总能量和大量营养素的摄入量,并且辣椒还会增加餐后能量消耗,促进女性的脂肪氧化和男性的碳水化合物氧化等。众所周知,肥胖会增加高血糖和高胰岛素血症的风险,减少能量输入和增加能量输出是减轻体重的2种方法,辣椒或其活性成分辣椒素已显示出增加能量消耗或脂肪氧化并降低血清脂质的作用,辣椒素对降血糖和降血脂均具有调控作用且二者关系密切,但对二者的具体调控机制以及二者是否具有互作关系尚未见报道。
此外,也有一些研究报道得出与其相悖的结果。如健康人群口服辣椒素(400 μg)后,其血浆葡萄糖(30~150 min)和胰高血糖素水平(90~180 min)会显著增加,血浆中胰岛素和C肽水平虽有一定程度增加,但与未摄入辣椒素人群相比无显著变化(90~165 min),并观察到辣椒素仅在葡萄糖吸收发生后才增加胰高血糖素水平,且血浆胰高血糖素水平比血浆胰岛素水平更高,二者释放时间无显著性差异。上述结果表明,低剂量的辣椒素能通过传导神经刺激健康受试者从胃肠道吸收葡萄糖并促进葡萄糖的吸收,得出辣椒素会导致健康受试人群口服葡萄糖餐后血糖和胰高血糖素浓度水平升高的结论[21],这与辣椒素具有降血糖作用的观点相悖。上述临床实验结果表明,辣椒素不增加健康受试者的胰岛素水平,但对患糖尿病以及相关并发症患者具有积极的改善、治疗作用,结合LAGISETTY等[14]的动物实验结果,表明辣椒素针对健康者和糖尿病患者可能会产生截然不同的影响,并且针对健康以及糖尿病人群可能存在选择性作用机制。该实验解释了上述研究中结论相悖的原因,但这一潜在的选择性机制是否确切存在,仍需更进一步的研究验证。
2 辣椒素的降糖机制
2.1 改善糖代谢
人体正常的血糖浓度需要神经系统、各种激素以及机体内各脏器(肝脏、胰腺和肠道等)的共同参与调控,一旦体内出现高血糖症状,就预示着糖代谢紊乱的发生,而糖代谢紊乱正是糖尿病发病的主要表现之一。现代医学研究表明,磷脂酰三磷酸肌醇(phosphatidylinositol 3-kinase, PI3K)/苏氨酸蛋白激酶(threonine protein kinase, AKT)、核因子-κB抑制蛋白激酶 (inhibitor of nuclear factor kappa-B kinase, IKK)/核因子-κB(nuclear factor kappa-B, NF-κB)、腺苷酸活化蛋白激酶(mitogen-activated protein kinases, AMPK)3条信号转导通路调控了整个葡萄糖代谢的全过程[23],相关研究表明,辣椒素对STZ诱导大鼠中肝脏、胰腺以及回肠中糖代谢的紊乱具有改善作用,并且对可能存在肝脏和胰腺中的糖代谢信号通路具有调控作用[11,15],因此探究与糖尿病糖代谢相关的信号通路,以及辣椒素对该通路及其信号因子的调控作用,对治疗糖尿病有着极其深远的意义。
KAMAGATE等[24]在肥胖诱导的2型糖尿病中发现PI3K/Akt 信号转导通路处于抑制状态,其原因是由于炎症因子(抵抗素和瘦素等)恶意掠夺性与胰岛素受体1(insulin receptor substrate 1, IRS1)或胰岛素受体2(insulin receptor substrate 2,IRS2)结合,并且IRS1的丝氨酸 (Ser)和酪氨酸(Thr)位点发生磷酸化,致使胰岛素对Tyr磷酸化的能力受到抑制。如辣椒素能够激活PI3K/Akt 信号相关通路,能够对改善2型糖尿病产生积极作用。KWON等[11]的研究结果恰好验证了上述这一推论,其研究表明辣椒素能够显著上调磷酸化蛋白激酶(phosphorylated protein kinase, pAkt)、IRS1和IRS2的蛋白水平,不仅可以通过激活pAMPK信号通路使pAkt→磷酸烯醇式丙酮酸羧激酶(phosphoenolpyruvate carboxykinase, PEPCK)和磷酸化腺苷酸活化蛋白激酶(phosphorylated adenylate activated protein kinase, pAMPK)信号传导增强,并且可以通过增强胰岛素/IGF-1信号传导而提高胰岛β细胞的质量(促进β细胞的增殖和减少β细胞的凋亡),从而降低肝脏葡萄糖的输出和增加糖原的储存。近期,几项最新研究也系统地探究了辣椒素在肝脏、胰腺以及肠道内所参与的糖代谢调控机制。研究表明辣椒素可显著上调肝X受体(liver X receptor, LXR)和胰腺-十二指肠同源异型盒-1(pancreatic duodenal homeobox-1, PDX-1)基因水平和蛋白表达,从而使LXR对其下游基因葡萄糖-6-磷酸酶(glucose-6-phosphatase, G6Pase)进行调控,PDX-1对下游基因葡萄糖激酶(glucoskinase, GK)、葡萄糖转运蛋白2(glucose transporter type 2, GLUT2)、IRS1或IRS2调控,从而达到抑制糖异生,刺激胰岛细胞分泌胰岛素的作用[11,15];并且辣椒素还可以通过下调钠-葡萄糖共转运载体1(sodium-glucose cotransporter 1, SGTL1),GLUT2和GLUT5的表达来抑制肠道对葡萄糖的吸收,最终达到改善糖尿病大鼠体内糖代谢紊乱、降低血糖水平的目的,并推断肝脏或胰腺中存在TRPV1-(PDX-1)-(GLUT2/GK)或TRPV1-(PDX-1)-(IRS1/2)信号通路[12,14]。
2.2 改善胰岛功能
胰岛功能与糖尿病息息相关,胰岛α细胞和β细胞分别分泌胰岛血糖素和胰岛素来共同维持人体血糖的动态平衡,一旦胰岛功能发生障碍,α细胞和β细胞分泌失衡就会导致糖尿病的发生,目前糖尿病主要分为1型糖尿病、2型糖尿病、其他特殊类型糖尿病及妊娠糖尿病,其中1型糖尿病(青少年糖尿病或胰岛素依赖型糖尿病)和2型糖尿病(成人发病型糖尿病)与胰岛功能尤为相关。1型糖尿病是由于血清中胰岛素的绝对缺乏而导致患者高血糖,从而导致一系列并发症的疾病。目前,胰岛素缓释泵技术、长效胰岛素的基因工程改造技术、胰岛移植和干细胞技术以及基因疗法等均能够针对1型糖尿病进行有效的治疗,而它们的主要靶器官均为胰岛β细胞,如何能够刺激患者体内残存的正常β细胞再生或者肝细胞分化为β细胞,成为治疗1型糖尿病病症的关键[25]。相关研究表明再生基因 (regenerating gene, Reg) 可以刺激胰岛β细胞再生,且能够被白细胞介素6 (interleukin-6, IL-6) 和糖皮质激素等炎症性因子激活,进而作用于Reg受体,达到β细胞增殖的作用[26]。辣椒素也被报道具有促进胰岛β细胞增殖以及减少β细胞凋亡的作用[11],且能够有效调控与胰岛β细胞发育、有丝分裂、增生以及凋亡的相关关键酶PDX-1、IRS1、IRS2、GK和GLUT2[27],ZHANG等[28]通过动物实验以及细胞实验部分验证了上述结论,1型糖尿病大鼠被饲喂辣椒素[6 mg/(kg·bw)]4周后,通过胰腺组织切片可观察到其损伤的胰腺组织得到明显的修复;并在细胞实验中发现适当浓度的辣椒素(50 μmol/L)能够显著促进小鼠瘤βTC-6细胞分泌胰岛素,但对其增殖没有任何促进作用,反而会随着辣椒素浓度(100~300 μmol/L)的增加,β细胞的生长会受到抑制直至凋亡。2型糖尿病其常见症状是胰岛β细胞功能障碍,因此如何修复胰岛β细胞功能障碍是治疗2型糖尿病的关键。相关研究表明磺脲类药物、选择性钾通道开放剂NN414和三磷酸腺苷敏感的K+通道开放剂均可以起到对胰岛β细胞功能保护的作用[29],而辣椒素能够改善2型糖尿病大鼠的胰岛素抵抗,提高胰岛素敏感性,并且能够增加胰岛细胞内Ca2+浓度,且在一定辣椒素浓度范围内(0~50 μmol/L)与胰岛素含量正相关[28],但是否与上述胰岛β细胞功能保护机制相关仍需要进一步研究。
2.3 介导TRPV1离子通道
TRPV1是一个配体门控非选择性阳离子通道,由于其可被外源或内源性介质敏化或激活,有望成为治疗各种疾病的潜在药物靶点,并且广泛参与抗炎镇痛、胰岛素分泌、改善胰腺功能(对β细胞功能具有增益作用)、调控PI3K/AKt信号通路等多项生理活动[30-31]。TRPV1参与PI3K/AKt信号通路,能够上调UCP2、Cx43、GLUT4的蛋白表达,具有改善肥胖小鼠的糖脂代谢紊乱及其防治后期并发症(动脉粥样病变)的效果,且TRPV1离子通道被激活后具有协同清胰汤缓解急性胰腺炎的作用[32]。此外,TRPV1能够通过降钙素基因相关肽和P物质的释放介导葡萄糖诱导的胰岛素分泌,其致敏对胰岛素分泌的调节被认为与慢性胰腺炎的发病机制有关[33],激活胰腺的感觉神经元TRPV1通道能控制胰岛炎症和胰岛素抵抗,说明TRPV1通道激活与1型糖尿病的发生有关。作为辣椒素受体,TRPV1离子通道被辣椒素激活后与糖尿病相关的机制也被众多研究者所关注:被辣椒素激活后的TRPV1离子通道可充当钙通道释放胰岛素,使胰岛β细胞分泌更多的胰岛素而达到降糖作用[10],并且辣椒素诱导的TRPV1感觉神经元能够通过化学神经支配在不改变雄性小鼠的胰岛β细胞的增殖和质量、全身性胰岛素敏感性、身体组成和能量消耗的情况下,改善其葡萄糖清除率以及增强由葡萄糖刺激引起的胰岛素分泌[34],并且TRPV1通道在调控糖代谢中的介导作用也被相关研究证实。此外,TRPV1被辣椒素激活能够显著改善糖尿病的相关并发症,如高血糖诱导的内皮功能紊乱、糖代谢紊乱等症状,并推断该作用机制可能与PKA信号通路的激活有关[35]。
然而,虽然大量的报道表明TRPV1离子通道与胰岛分泌相关,但TRPV1离子通道的激活是否为辣椒素降糖机制的必要条件却成为众多研究争论的焦点问题。研究表明,TRPV1通道的激活虽能改善胰岛素的敏感性以及胰岛素炎症,但并不会促进胰岛素的分泌[35-36],且在辣椒素与辣椒素酯降糖效果对比实验中,可发现虽然辣椒素酯[6 mg/(kg·bw]能够激活TRPV1通道,但其降糖作用却不明显[15],这是否表明辣椒素降糖作用机制另有途径,在不需要激活TRPV1通道的条件下,辣椒素仍能具有降糖作用呢? 据此,张世奇[28]通过使用TRPV1拮抗剂(辣椒卓平)阻断TRPV1离子通道后,动物及细胞实验证明,辣椒素对胰岛β细胞刺激作用不明显,胰岛素分泌增加不显著,辣椒素失去降糖作用。综合上述研究结论,辣椒素降糖机制的执行或许需要同时满足2个条件:(1) TRPV1离子通道的激活;(2) PDX-1mRNA和蛋白表达的显著上调。这样的推论或许可以部分解释辣椒素酯降糖作用不明显的现象(虽然能够激活TRPV1离子通道,但PDX-1在糖尿病大鼠胰腺和肝脏中表达不显著),但这一机制仍需诸多的技术手段进一步验证(如基因敲除技术、芯片技术及GST-Pull down 技术等)。
2.4 调控内分泌
内分泌系统是负责调控动物体内各种生理功能正常运作的两大控制系统之一,由分泌激素的无导管腺体所组成。内分泌腺和组织细胞能分泌一些生物活性物质(激素),直接释放进入血液或淋巴液,经血液循环运输到全身各处,作用于某些靶器官或靶细胞,从而达到调节生理活动的作用。众所周知,糖尿病是以糖代谢紊乱为主要表现的内分泌代谢性疾病,而与糖尿病相关的内分泌激素主要有肠促胰素、胰高血糖素、胰岛素和肾上腺素等。首先,肠促胰素由胰高血糖素样肽1(glucagon-like peptide 1, GLP-1)和糖依赖性胰岛素释放肽(glucose-dependent insulintropic polypeptide, GIP)组成,其中的GLP-1作为一个多功能的降血糖激素,具有调控糖代谢、促进胰岛素分泌、促进胰岛β细胞的再生和修复、改善胰岛素敏感性等作用[37]。研究表明辣椒素能增加细胞和组织中GLP-1的分泌,并且长期膳食辣椒素能改善野生型小鼠的糖耐量和增加胰岛素及血浆中GLP-1水平,最终达到降低血糖的目的[38]。其次,胰高血糖素是由胰岛α细胞分泌的一种激素,与胰岛素相反,其具有促进糖原分解和糖异生的作用,使血糖升高。目前,尚无研究表明辣椒素对胰高血糖素的影响作用,但辣椒素具有促进STZ诱导的1型糖尿病大鼠肝糖原和肌糖原的合成[28],这是否说明辣椒素对胰高血糖素具有抑制作用尚未可知。另有学者发现健康受试者摄入辣椒素(400 μg)后,反而会促进胃肠道对葡萄糖的吸收,引起餐后血糖和胰高血糖素浓度水平升高[21],此结果表明辣椒素具有促进糖原分解和糖异生的作用,与上述观点相悖(辣椒素能够促进1型糖尿病大鼠肝糖原和肌糖原合成),其原因或许与辣椒素在健康和患病机体内作用机制不同相关。目前,国内外大量报道均已证实辣椒素能够修复胰腺组织,刺激胰岛β细胞分泌胰岛素,此外,PDX-1可以将肝脏干细胞(WB-1细胞)诱导分化为胰岛素分泌细胞[39]。PDX-1是否能够诱导1型糖尿病大鼠肝脏干细胞分泌胰岛素需要进一步的论证。一些早期的研究,如WATANABE等[40]在氟烷麻醉的大鼠中研究了辣椒素对中枢神经系统的调控作用,其结果表明辣椒素可增强肾上腺交感神经活性并刺激肾上腺髓质分泌肾上腺素,食用单一辣椒粉后,血浆中肾上腺素和去甲肾上腺素水平均会增加,但在TRPV1基因敲除小鼠的模型中,辣椒素失去了对肾上腺素分泌的诱导作用[41],表明辣椒素通过TPRV1介导调控肾上腺素的分泌。但肾上腺素属于糖皮质激素,能够促进体内糖原分解从而升高血糖,这一结果与辣椒素具有降糖作用的结论也存在分歧,但这一分歧仍能用辣椒素在健康和患病人群中存在不同的作用机制进行解释。
2.5 调控肠道菌群
近年来,研究糖尿病患者肠道菌群的变化以及服用降糖药物后对其肠道菌群的影响为众多医学研究者所关注。研究主要集中于菌群组成、肠道环境和菌群多样性3个方面:首先,肠道黏膜的屏障完整性以及通透性变差均与肠道菌群组成失衡相关,不但使外界病毒和细菌更易入侵,而且更易致使天然T细胞向Th17细胞或Treg细胞分化[42],1型糖尿病患者胰腺淋巴结中,Th17和有缺陷的 Treg 所占比例相对于健康人群更高,说明肠道菌群可能参与1型糖尿病的发病机制;其次,长期肥胖会诱发肠道通透性以及屏障完整性变差,使革兰阴性菌群滋生导致脂多糖分泌增加,进而诱发全身性慢性炎症,使体内产生不利于胰岛β细胞生长的负面环境,促使2型糖尿病的发生[43];一项人体实验结果表明阿卡波糖能显著增加双歧杆菌数量,对肠道菌群失调具有改善作用,这进一步明确肠道菌群与糖尿病的发病机制关系密切[44]。据此,与辣椒素相关的研究也基于上述3个方面开展:首先,辣椒素能够改善病变的肠道菌群失衡,动物及临床实验表明糖尿病能够导致肠道菌群中厚壁门的细菌数量升高,拟杆菌门细菌数量降低,但使用辣椒素治疗后可明显观察到糖尿病患体肠道中厚壁门的细菌数量减少,拟杆菌门的细菌数量增加,肠道状态逐渐趋于健康[45];另有一项研究表明,在高脂饲料诱导肥胖模型小鼠盲肠中,存在一类具有降糖降脂功能的细菌(Akkermansia muciniphila),且发现该类细菌数量具有显著减少的趋势,而当辣椒素作用后发现该类细菌数量增加,但其增加原因是由于辣椒素对肠道环境的直接刺激作用还是间接刺激尚未明确[46];其次,辣椒素对肠道环境的影响也有颇多报道,如辣椒素调节饮食诱导肥胖小鼠肠道菌群,可显著影响肠道菌群多样性,肠道中产丁酸菌[毛螺旋菌科(Lachnospiraceae)和瘤胃球菌科(Ruminococcaceae)]的相对丰度明显增加,而革兰氏阴性菌(S24-7)明显减少,肠道通透性得到改善,血浆中革兰氏阴性菌细胞壁外壁成分脂多糖(lipopolysaccharide, LPS)浓度显著减少,表明辣椒素可以改善肥胖状态下的肠道菌群紊乱,缓解体内炎症水平[47];最后,长期食用辣椒素可显著降低高脂饮食肥胖小鼠的变形菌门(Proteobacteria)的丰度,显著增加拟杆菌属(Bacteroides)、粪球菌属(Coprococcus)、普氏菌属(Prevotella)和阿克曼氏菌属(Akkermansia)等的丰度,表明辣椒素能显著改善肠道菌群多样性,对人类健康具有促进作用[48]。但是,长期摄入辣椒素或许对肠道环境、菌群组成以及多样性产生不良影响,如持续灌胃STZ诱导的糖尿病大鼠低、中、高3种剂量[3.0、6.0、9.0 mg/(kg·d)]的辣椒素28 d,结果表明辣椒素能够降低短链脂肪酸(short-chain fatty acids, SCFA)含量、盲肠内容物中有益菌数量以及盲肠质量和盲肠壁表面积,升高总游离氨含量、pH值、水分含量和有害菌数量,暗示辣椒素的长期摄入对肠道健康具有一定的损害作用[49]。目前,辣椒素对肠道菌群的调控究竟有利还是有害仍然存在较大的分歧,其是否针对不同人群(健康、肥胖和糖尿病)的肠道菌群具有相应的独特调控机制目前也尚未可知。此外,愈来愈多的实验数据和临床研究支持肠道菌群在糖尿病疾病发展中的重要性,并且认为由于肥胖是2型糖尿病的主要触发因素之一,肠道菌群可以通过多种机制来调节宿主的能量平衡和肥胖状态(如增加饮食中的能量吸收,调节组织脂肪酸组成,调节胆汁酸和其他肠源性肽的分泌等)。在与肥胖相关的2型糖尿病疾病中,肠道菌群在糖和脂质代谢以及脂多糖诱导的低度炎症的发展中的作用已得到越来越多的认识。肠道菌群作为治疗代谢疾病和神经系统疾病的靶标,在调控糖尿病患者新陈代谢及其发病机理中起关键作用,虽然上述研究已经提出了几种解释肠道菌群与糖尿病之间联系的机制,但仍需要进一步的研究来阐明肠道菌群与肥胖的可能关系以及肥胖与2型糖尿病二者关联的机制。
辣椒素可以通过介导TRPV1离子通道,并基于糖代谢调控下对糖尿病患者肝脏、胰腺以及肠道功能具有改善作用,在宏观上表现为肝脏内肝糖原合成量增加,胰腺内受损的胰腺组织得到修复,胰岛素敏感性及分泌量增加,肠道内糖吸收受到抑制,肠道环境、菌群得到改善,血糖水平显著下降等;在微观上以TRPV1离子通道激活,辣椒素受体(TRPV1)上调和其下游糖代谢相关关键酶(PDX-1、GLUT2、GK和IRS1/2等)的显著受控表达的形式表现,综合其降糖机制路线如图3所示[15, 28]。但辣椒素降糖作用机制仍存在颇多疑惑:如辣椒素在不同摄入频率的情况下,对同一个体产生不同的影响,一次性大剂量降低胰腺和胰岛血流量,多次作用则会产生相反的效果[50];相同摄入剂量和频率的情况下在同一个体不同部位则产生不同的影响,如辣椒素可以显著上调糖尿病大鼠肝脏以及胰腺中GLUT2的表达,但在其回肠中则会显著抑制其表达[12]。相关动物模型和临床实验也表明,辣椒素作用于健康者和糖尿病患者,会产生截然不同的影响,甚至出现辣椒素增加口服葡萄糖餐后血糖和胰高血糖素浓度的现象[14,21]。说明辣椒素的降糖作用及其相关机制与辣椒素的摄入量、摄入频率、时间以及所针对人群的健康状态密切相关,并且针对健康及患糖尿病人群可能存在截然不同的作用机制,如何最大发挥其降糖功效仍需大量论证。
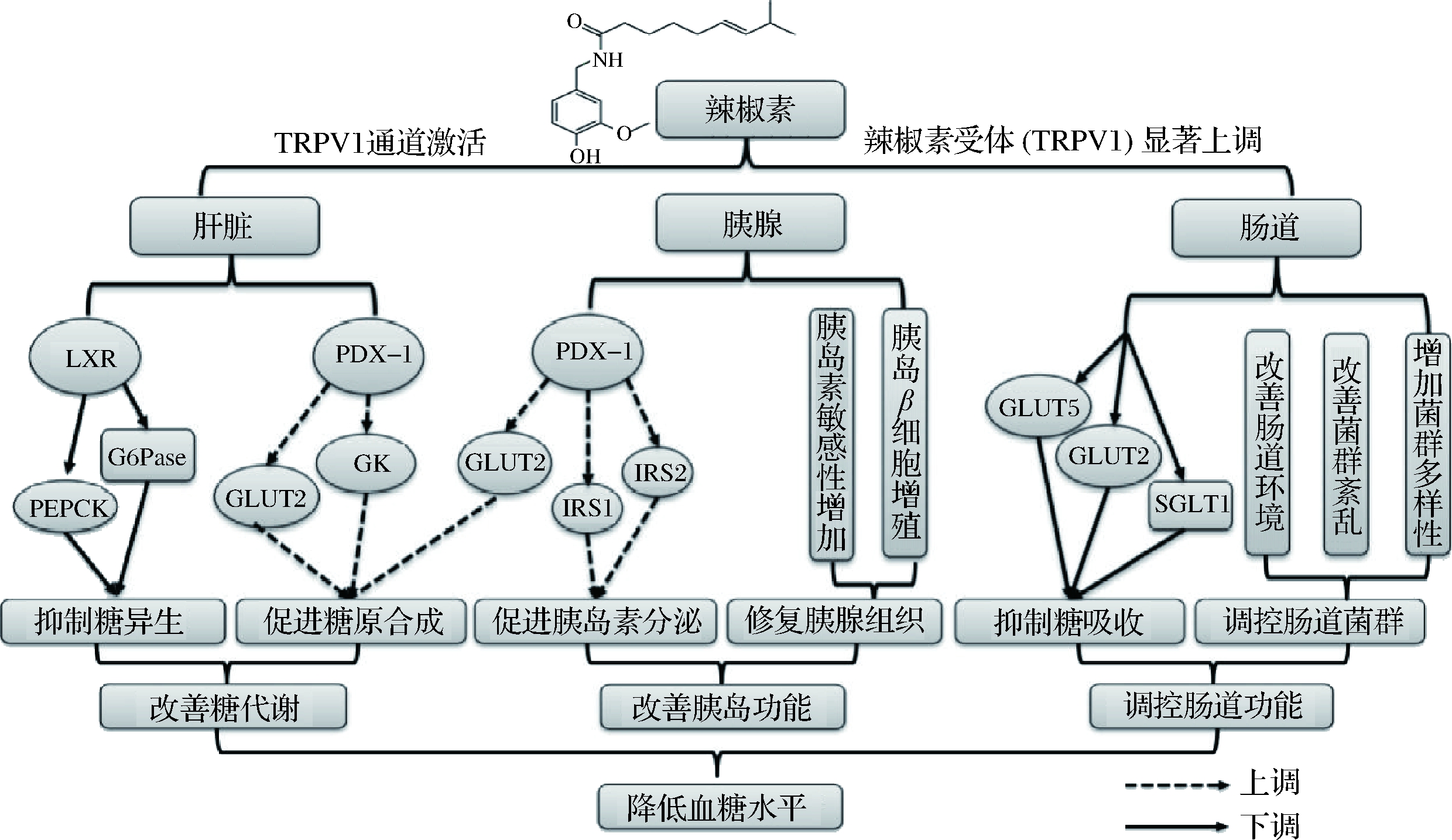
图3 辣椒素降糖机制路线图[15,28]
Fig.3 The hypoglycemic mechanism roadmap of capsaicin
3 结语
辣椒素具有显著的降糖效果,对糖尿病及其并发症均有一定的改善治疗作用,其作用机制具有多途径、多重性的特点,并且针对健康和患病人群或存在不同的针对性作用机制。大量动物实验及临床研究已明确辣椒素能够通过调控糖代谢、改善胰腺功能、介导TRPV1离子通道、调控内分泌系统以及肠道菌群等途径降糖,但各途径之间是否具有互作效应(协同增益或拮抗消减)尚缺乏相关研究数据支持。目前,随着辣椒素胶囊(降脂减肥和维护心血管健康)、辣椒素软膏(镇痛止痒和改善微血管循环)、辣椒素贴片(缓解糖尿病神经疼痛)等相关产品的陆续面市,愈发彰显辣椒素在抗糖尿病及其并发症中的防治潜力,但其辛辣特性局限了其应用剂量及应用范围。因此,寻找非辣味辣椒素类似物等效替代品以及应用低剂量辣椒素作为降糖药物的辅助制剂或为目前较可行的研究策略。
[1] GAVIN III J R, ALBERTI K, DAVIDSON M B, et al. Report of the expert committee on the diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 1997, 20(7): 1 183.
[2] CHO N H, SHAW J E, KARURANGA S, et al. IDF diabetes atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045[J]. Diabetes Research and Clinical Practice, 2018, 138: 271-281.
[3] BÜYÜKBALCI A, EL S N. Determination of in vitro antidiabetic effects, antioxidant activities and phenol contents of some herbal teas[J]. Plant Foods for Human Nutrition, 2008, 63(1): 27-33.
[4] SRINIVASAN K. Plant foods in the management of diabetes mellitus: spices as beneficial antidiabetic food adjuncts[J]. International Journal of Food Sciences and Nutrition, 2005, 56(6): 399-414.
[5] 张晶, 孙长波, 石磊岭, 等. RP-HPLC法测定辣椒中辣椒素、二氢辣椒素和降二氢辣椒素含量[J]. 药物分析杂志, 2011, 31(2): 244-246.
[6] CHAIYASIT K, KHOVIDHUNKIT W, WITTAYALERTPANYA S. Pharmacokinetic and the effect of capsaicin in Capsicum frutescens on decreasing plasma glucose level[J]. Chotmaihet Thangphaet, 2009, 92(1):108-113.
[7] KIM H S, KWON H J, KIM G E, et al. Attenuation of natural killer cell functions by capsaicin through a direct and TRPV1-independent mechanism[J]. Carcinogenesis, 2014, 35(7): 1 652-1 660.
[8] TOLAN I, RAGOOBIRSINGH D, MORRISON E Y S A. The effect of capsaicin on blood glucose, plasma insulin levels and insulin binding in dog models[J]. Phytotherapy Research, 2001, 15(5): 391-394.
[9] OKUMURA T, TSUKUI T, HOSOKAWA M, et al. Effect of caffeine and capsaicin on the blood glucose levels of obese/diabetic KK-Ay mice[J]. Journal of Oleo Science, 2012, 61(9): 515-523.
[10] AKIBA Y, KATO S, KATSUBE K, et al. Transient receptor potential vanilloid subfamily 1 expressed in pancreatic islet β cells modulates insulin secretion in rats[J]. Biochemical and Biophysical Research Communications, 2004, 321(1): 219-225.
[11] KWON D Y, KIM Y S, RYU S Y, et al. Capsiate improves glucose metabolism by improving insulin sensitivity better than capsaicin in diabetic rats[J]. The Journal of Nutritional Biochemistry, 2013, 24(6): 1 078-1 085.
[12] ZHANG S, YOU Y, LIU J, et al. Hypoglycaemic effect of capsaicinoids via elevation of insulin level and inhibition of glucose absorption in streptozotocin-induced diabetic rats[J]. Journal of Functional Foods, 2018, 51: 94-103.
[13] KANG J H, TSUYOSHI G, LE NGOC H, et al. Dietary capsaicin attenuates metabolic dysregulation in genetically obese diabetic mice[J]. Journal of Medicinal Food, 2011, 14(3): 310-315.
[14] LAGISETTY U, MOHAMMED H, RAMAIAH S. Effect of capsaicin on pharmacodynamic and pharmacokinetics of gliclazide in animal models with diabetes[J]. Pharmacognosy Research, 2018, 10(4): 437.
[15] ZHANG S, MA X, ZHANG L, et al. Capsaicin reduces blood glucose by increasing insulin levels and glycogen content better than capsiate in streptozotocin-induced diabetic rats[J]. Journal of Agricultural and Food Chemistry, 2017, 65(11): 2 323-2 330.
[16] AHUJA K D, ROBERTSON I K, GERAGHTY D P, et al. Effects of chili consumption on postprandial glucose, insulin, and energy metabolism[J]. The American Journal of Clinical Nutrition, 2006, 84(1): 63-69.
[17] YUAN L J, QIN Y, WANG L, et al. Capsaicin-containing chili improved postprandial hyperglycemia, hyperinsulinemia, and fasting lipid disorders in women with gestational diabetes mellitus and lowered the incidence of large-for-gestational-age newborns[J]. Clinical Nutrition, 2016, 35(2): 388-393.
[18] LEJEUNE M P G M, KOVACS E M R, WESTERTERP-PLANTENGA M S. Effect of capsaicin on substrate oxidation and weight maintenance after modest body-weight loss in human subjects[J]. British Journal of Nutrition, 2003, 90(3): 651-659.
[19] BELZA A,JESSEN A B. Bioactive food stimulants of sympathetic activity: effect on 24 h energy expenditure and fat oxidation[J]. European Journal of Clinical Nutrition, 2005, 59(6): 733-741.
[20] YOSHIOKA M, LIM K, KIKUZATO S, et al. Effects of red-pepper diet on the energy metabolism in men[J]. Journal of Nutritional Science and Vitaminology, 1995, 41(6): 647-656.
[21] DÖMÖTÖR A, SZOLCS NYI J, M
NYI J, M ZSIK G. Capsaicin and glucose absorption and utilization in healthy human subjects[J]. European Journal of Pharmacology, 2006, 534(1): 280-283.
ZSIK G. Capsaicin and glucose absorption and utilization in healthy human subjects[J]. European Journal of Pharmacology, 2006, 534(1): 280-283.
[22] 张世奇, 秦春青, 王倩倩, 等. 辣椒素对1型糖尿病大鼠糖代谢影响作用的研究[J]. 营养学报, 2017, 39(1): 76-80.
[23] JITRAPAKDEE S. Transcription factors and coactivators controlling nutrient and hormonal regulation of hepatic gluconeogenesis[J]. The International Journal of Biochemistry & Cell Biology, 2012, 44(1): 33-45.
[24] KAMAGATE A, DONG H H. FoxO1 integrates insulin signaling to VLDL production[J]. Cell Cycle, 2008, 7(20): 3 162-3 170.
[25] SHIMABUKURO M, HIGA M, ZHOU Y-T, et al. Lipoapoptosis in beta-cells of obese prediabeticfa/fa rats role of serine palmitoyltransferase overexpression[J]. Journal of Biological Chemistry, 1998, 273(49): 32 487-32 490.
[26] UNNO M, NATA K, NOGUCHI N, et al. Production and characterization of reg knockout mice: reduced proliferation of pancreatic β-cells in reg knockout mice[J]. Diabetes, 2002, 51(Suppl 3): S478-S483.
[27] ISLAM M S, LOOTS T DU. Experimental rodent models of type 2 diabetes: a review[J]. Methods and Findings in Experimental and Clinical Pharmacology, 2009, 31(4): 249-261.
[28] 张世奇. 辣椒素对I型糖尿病大鼠糖代谢的影响及其降糖机制的研究[D]. 重庆: 西南大学, 2017.
[29] OKAMOTO H, TAKASAWA S. Recent advances in the okamoto model: the CD38-cyclic ADP-ribose signal system and the regenerating gene protein (REG)-reg receptor system in β-cells[J]. Diabetes, 2002, 51(Suppl 3): S462-S473.
[30] BASSO L, ABOUSHOUSHA R, FAN C Y, et al. TRPV1 promotes opioid analgesia during inflammation[J]. Science Signaling, 2019, 12(575):1-14.
[31] DERBENEV A V, ZSOMBOK A. Potential therapeutic value of TRPV1 and TRPA1 in diabetes mellitus and obesity[J]. Seminars in Immunopathology, 2016, 38(3): 397-406.
[32] 王沛坚. 激活TRPV1上调UCP2防治糖脂代谢紊乱致动脉粥样病变的机制研究[D]. 重庆: 第三军医大学, 2013.
[33] ZHONG B, MA S, WANG D H. TRPV1 mediates glucose-induced insulin secretion through releasing neuropeptides[J]. In Vivo, 2019, 33(5): 1 431-1 437.
[34] KARAM J B, CAI W, MOHAMED R, et al. TRPV1 neurons regulate β-cell function in a sex-dependent manner[J]. Molecular Metabolism, 2018, 18: 60-67.
[35] SUN J, PU Y, WANG P, et al. TRPV1-mediated UCP2 upregulation ameliorates hyperglycemia-induced endothelial dysfunction[J]. Cardiovascular Diabetology, 2013, 12(1): 69.
[36] DIAZ-GARCIA C M, MORALES-L ZARO S L, S
ZARO S L, S NCHEZ-SOTO C, et al. Role for the TRPV1 channel in insulin secretion from pancreatic beta cells[J]. The Journal of Membrane Biology, 2014, 247(6): 479-491.
NCHEZ-SOTO C, et al. Role for the TRPV1 channel in insulin secretion from pancreatic beta cells[J]. The Journal of Membrane Biology, 2014, 247(6): 479-491.
[37] AHRÉN B. Sensory nerves contribute to insulin secretion by glucagon-like peptide-1 in mice [J].American Journal of Physiology-Regulatory, Integrative and Comparative Physiology,2004,286(2):R269-R272.
[38] WANG P, YAN Z, ZHONG J, et al. Transient receptor potential vanilloid 1 activation enhances gut glucagon-like peptide-1 secretion and improves glucose homeostasis[J]. Diabetes, 2012, 61(8): 2 155-2 165.
[39] GAUTHIER B R, BRUN T, SARRET E J, et al. Oligonucleotide microarray analysis reveals PDX1 as an essential regulator of mitochondrial metabolism in rat islets[J]. Journal of Biological Chemistry, 2004, 279(30): 31 121-31 130.
[40] WATANABE T, KAWADA T, KUROSAWA M, et al. Adrenal sympathetic efferent nerve and catecholamine secretion excitation caused by capsaicin in rats[J]. American Journal of Physiology-Endocrinology and Metabolism, 1988, 255(1): E23-E27.
[41] UCHIDA K, DEZAKI K, YONESHIRO T, et al. Involvement of thermosensitive TRP channels in energy metabolism[J]. The Journal of Physiological Sciences, 2017, 67(5): 549-560.
[42] FESTA ANDREAS, D’AGOSTINO RALPH, HOWARD GEORGE, et al. Chronic subclinical inflammation as part of the insulin resistance syndrome[J]. Circulation, 2000, 102(1): 42-47.
[43] MEHTA N N, MCGILLICUDDY F C, ANDERSON P D, et al. Experimental endotoxemia induces adipose inflammation and insulin resistance in humans[J]. Diabetes, 2010, 59(1): 172-181.
[44] 刘小翠, 胡郁刚, 陈伟忠. 阿卡波糖对糖尿病患者肠道菌群的影响[J]. 黑龙江医学, 2017, 41(6): 541-542.
[45] BABOOTA R K, MURTAZA N, JAGTAP S, et al. Capsaicin-induced transcriptional changes in hypothalamus and alterations in gut microbial count in high fat diet fed mice[J]. The Journal of Nutritional Biochemistry, 2014, 25(9): 893-902.
[46] EVERARD A, BELZER C, GEURTS L, et al. Cross-talk between akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J]. Proceedings of the National Academy of Sciences, 2013, 110(22): 9 066-9 071.
[47] 康超. 辣椒素通过调节肠道菌群发挥改善高脂膳食诱导小鼠肥胖体征//2017中国营养医学发展论坛暨全军营养医学大会论文汇编[C].呼和浩特: 中国营养学会, 2017: 28.
[48] 沈伟. 辣椒素对高脂饮食诱导肥胖小鼠肠道菌群的影响研究[D]. 重庆: 第三军医大学, 2017.
[49] 程亚娇, 王倩倩, 陆红佳, 等. 辣椒素对糖尿病大鼠肠道健康的影响[J]. 食品科学, 2015, 36(9): 154-159.
[50] CARLSSON P O, SANDLER S, JANSSON L. Influence of the neurotoxin capsaicin on rat pancreatic islets in culture, and on the pancreatic islet blood flow of rats[J]. European Journal of Pharmacology, 1996, 312(1): 75-81.