食品的品质一方面取决于食品组成,另一方面取决于食品组分在空间位置上的排列[1]。通过各种相互作用,种类及数量各异的组分形成晶体、胶束、泡沫、凝胶等结构,成为食品外观、质地、口感等品质的基础。泡沫是一类重要的食品结构,对啤酒、香槟酒、冰淇淋、掼奶油、充气糖果等食品的品质形成不可或缺,而对于界面主导食品如米糕、面包、蛋糕、华芙、馒头等,加工过程中气体的截留和稳定均匀的泡沫结构形成是赋予其品质(特别是外观及口感)的重要保证[2]。制作发泡食品或向食品中填充气体是降低食物能量密度的一种重要手段。当这类食品被摄取进入胃部后气体仍能持留于内,对形成饱腹感和减少热能摄入有益[3]。
食品中的泡沫包括水基泡沫(aqueous foams)和油基泡沫(oleofoams)2类[4-5]。传统上食品工业主要采用蛋白质或表面活性剂溶液进行发泡,但越来越多的证据表明,纳微米颗粒具有起泡和稳定泡沫能力[6]。SENÉE等[7]研究发现,起泡酒中内源性颗粒参与了泡沫的成长和稳定,这些颗粒因尺寸比滤孔小而在过滤操作中被保留在酒中。OBOROCEANU等[8]将乳清蛋白在酸性水溶液中80 ℃保温20 h,得到纤维状乳清蛋白,使其起泡能力大幅增加,甚至接近蛋清蛋白的水平。与传统发泡依赖添加小分子或人工合成的表面活性剂不同,作为起泡剂的颗粒是可食性食品材料。近年来以多糖[9]、蛋白质、脂质[10]、食品级碳酸钙[11]、微生物细胞等为材料制备的纳微米颗粒的泡沫特性研究不断见诸报道。这些颗粒在食品中作为起泡剂的潜在应用处于探索阶段,有关颗粒稳定的泡沫机制相关研究正在深入[12]。为推动纳微米颗粒在新型食品起泡剂及发泡食品中的应用,本文剖析食品颗粒起泡作用的条件和机制,探讨基于颗粒特性设计来改善泡沫特性的技术方法,并对其发展前景进行了展望。
1 颗粒制备和泡沫形成
1.1 颗粒具有起泡性的前提条件
当颗粒处于气-液间的界面膜时,意味着颗粒已不可逆地吸附在界面上,界面Gibbs自由能(G)为[13]:
G=γ1PA1P+γ2PA2P+γ12A12
(1)
式中:γ1P、γ2P和γ12分别为气相与颗粒、液相与颗粒、气相与液相之间的界面张力;A1P、A2P和A12分别为气相与被吸附颗粒之间的接触面积、液相与被吸附颗粒之间的接触面积、气相与液相之间的接触面积。
颗粒的可润湿性是影响其气-液界面行为的重要因素[14]。对于球形颗粒(图1),颗粒浸没深度h=R(1+cosθ)。式中:R为颗粒的半径,θ为三相接触角。根据杨氏方程,cosθ=(γ1P-γ2P) /γ12。颗粒与液相的接触面积A2P=2πR2(1+cosθ)。对于球形颗粒,公式(1)通常表达为颗粒从气-液界面脱附所需能量(-ΔE)[13]:
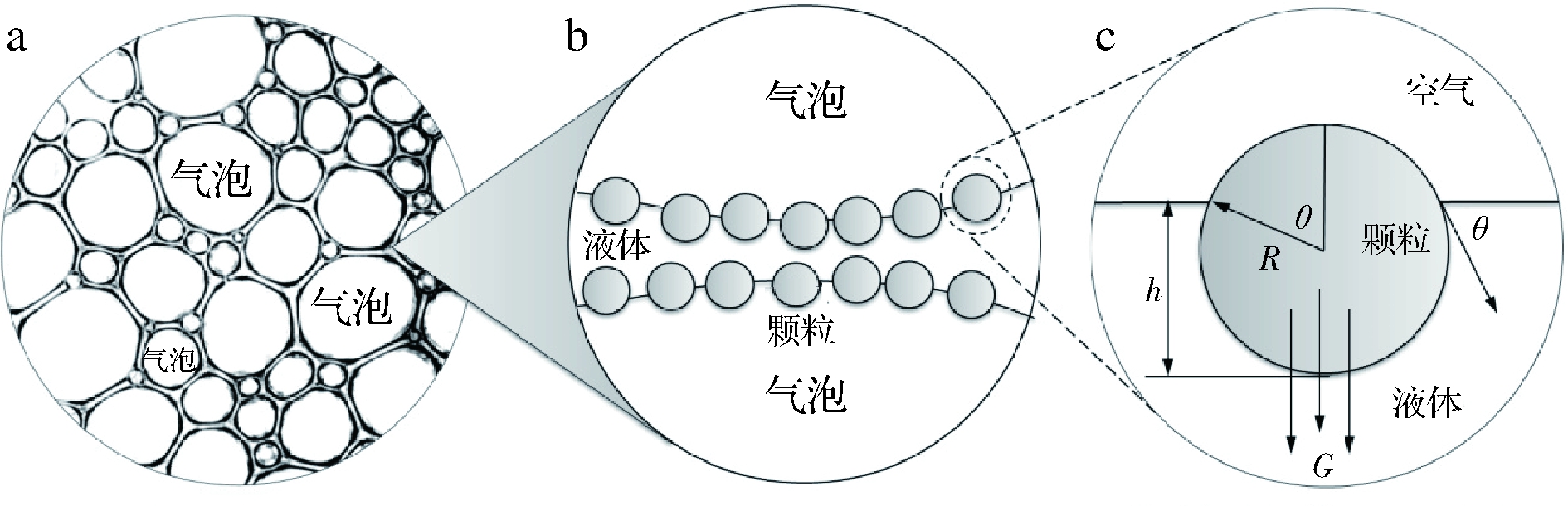
a-泡沫中的不同大小气泡分布(局部);b-颗粒在气泡-液体间的排列;c-颗粒在气-液界面的“浸没”状态
图1 泡沫中的颗粒在气-液界面的分布状况及其接触角(θ)
Fig.1 Distribution of the foam-stabilizing particles at an air-water interface and illustration of the contact angle (θ)
G =-ΔE=πR 2γ12(1-|cosθ|)2
(2)
式中:R,球形颗粒的半径;γ12,气/水界面张力;θ,三相接触角。
公式(2)表明,当R值恒定,θ越接近90°,颗粒离开界面的脱附能越大。当θ=90°,气相及液相对颗粒的“润湿”处于相当水平;当15°<θ<90°时,有利于水基泡沫形成,而90°<θ<165°时有利于油基泡沫形成[15]。
有研究建议对于圆盘形颗粒或杆状颗粒可分别采用公式(3)[16]和公式(4)[17]计算:
(3)
G=-ΔE=lqγ12(1-|cosθ|)
(4)
式中:Rdis,圆盘形颗粒的半径;l及q分别为杆状颗粒的长径和短径;γ12,气-液界面张力;θ,三相接触角。
由此可知,颗粒的起泡活性有赖于颗粒表面的可润湿性(可从θ来反映),但还包括其他因素:适宜的颗粒尺寸大小、形态以及表面电荷状况等。由公式(2)~(4)可知,将圆盘形颗粒及杆状颗粒从界面脱附所需能量较球形颗粒要多,因为前两者与1-|cosθ|线性相关,而后者与1-|cosθ|的平方线性相关。从颗粒稳定乳液的结果来看,非球形颗粒更适合作为乳化剂[16]。此外,颗粒表面电荷斥力不应造成颗粒间相互排斥以致在界面发生脱附。
1.2 具有起泡能力的颗粒的制备技术
1.2.1 机械破碎或化学剥蚀法
所谓机械破碎法,即通过研磨、高速剪切、高压均质等手段将大块物料破碎为纳/微米级颗粒。MATSUMIYA等[18]将大豆分离蛋白制作成大块凝胶(类似豆腐),经手持式打浆机破碎后,转移到榨汁机中制备成悬液,分别采用Ultraturrax T25高速均质机(24 000 r/min,5 min)或VC130超声均质机(振幅100,5 min),或射流均质机(压力24 MPa)均质悬液。结果表明,射流均质得到的颗粒粒度最小,3种均质方法制备颗粒的稳定泡沫的能力(半寿期)均高于大豆分离蛋白,原因可能在于均质颗粒通过Pickering效应增强了气-水界面膜的黏弹性。对于纤维状材料,高压均质通常是降低其粒度和提升起泡能力的有效手段[19-20]。
所谓化学剥蚀法,主要针对淀粉、几丁质、纤维素等多糖材料,通过强酸(通常为盐酸或硫酸)水解无定型区保留未被降解的结晶区,这些结晶区的尺寸通常在纳/微米级[21]。TZOUMAKI等[21]采用3 mol/L HCl处理(90 ℃,90 min)虾壳几丁质得到几丁质纳米晶体。即使不添加表面活性剂,几丁质纳米晶体水分散液具有稳定泡沫的能力,且随着其浓度增加这种能力随之增强。几丁质纳米晶体起泡和稳定泡沫遵循Pickering机制,即纳米晶体紧密排列在界面上,在界面液膜上形成类似凝胶的结构。
1.2.2 热诱导法
食品蛋白质在溶液中加热容易发生变性,进一步通过二硫键形成或疏水相互作用聚集纳米颗粒、微纤维或微凝胶等结构[22]。SCHMITT等[23]将乳清蛋白(4%)溶液于Soja板式热交换器(流量1 000 L/h)中于60 ℃预热后升温到85 ℃,保温15 min,冷却到4 ℃,逾85%的乳清蛋白转变为具有良好单分散性(PDI=0.113)的微凝胶(~200~220 nm)。将质量分数为5%的微凝胶溶液置于泡沫分析仪中可生成大小均匀的泡沫。OBOROCEANU等[8]研究发现,乳清蛋白热诱导(80 ℃保温20 h)变性聚集行为与溶液pH有关,当pH为7.0时形成球形颗粒,而在pH 2.0溶液中形成长约15 μm、轴径仅2~3 nm的纳米纤维。与球形颗粒相比,纳米纤维起泡性和稳定泡沫的能力更好,泡沫的品质与蛋清蛋白制得泡沫相当。LI等[24]将分散在20 mmol/L磷酸盐缓冲液(pH 7.0)中,质量分数为6.25%的蛋清蛋白质进行热诱导处理(90 ℃,30 min),制备蛋清蛋白凝胶,然后通过微射流设备均质处理(30 MPa)得到微凝胶颗粒,这些颗粒平均水力学半径约359 nm。在0.5%~3.0%质量分数范围内,尽管蛋清蛋白微凝胶颗粒的起泡性逊于未经热处理的蛋清蛋白,但前者可赋予泡沫更好的稳定性和机械强度。研究认为,蛋清蛋白微凝胶颗粒对泡沫的作用基于Pickering稳定原理。
1.2.3 反溶剂沉淀法
所谓反溶剂法,其操作为先将材料溶解在合适溶剂中,然后将其转移到不良溶剂(通常为水)中,或通过蒸馏移除共溶剂组分使剩余组分成为不良溶剂,析出形成颗粒。谷物醇溶蛋白质制备颗粒时常采用此法。PENG等[25]用70%乙醇溶解小麦醇溶蛋白,配制成2.5%的溶液,吸取1.2 mL溶液滴加到28.8 mL剧烈搅拌的去离子水中,即形成纳米颗粒(直径105.3 nm),采用纳米颗粒稳定的泡沫的直径为62.7 μm,与酪蛋白酸钠的相当(57.4 μm),比搅打相同质量浓度(1 mg/mL)卵清蛋白溶液生成的泡沫(455.7 μm)更加细腻,且泡沫的均匀性和稳定性较好。WOUTERS等[26]的研究展示了小麦醇溶蛋白纳米颗粒优异的起泡性能,但采用相同方法制备的玉米醇溶蛋白纳米颗粒的起泡性及稳定泡沫的能力并不理想。小麦醇溶蛋白纳米颗粒的粒度比玉米醇溶蛋白纳米颗粒更均匀(PDI=0.111)且尺寸较大(139.6 nm),并表现出更高的表面膨胀模量(surface dilatational modulus)。颗粒的柔性有利于在界面上适度变形和伸展,从而赋予其较强的稳定泡沫的能力。JIN等[27]配制1%的乙基纤维素丙酮溶液,向其中迅速加入等体积的去离子水,形成均匀细腻的悬浊液后蒸馏除去丙酮,即得到具有优异起泡能力的胶体颗粒(100~200 nm)。
1.2.4 通过自组装形成颗粒
自组装,通常指基本结构单元在基于非共价键的相互作用下,自发聚集形成稳定有序结构的过程或技术。甘草酸是一种天然三萜皂苷,因其具有两亲性结构,在水中溶解后能自组装形成直径约2.5 nm的纳米纤维[28]。研究表明[28],甘草酸纳米纤维可作为起泡剂制备稳定的泡沫材料。
1.2.5 通过构建复合物形成颗粒
在水相中,2种及以上的食品成分之间通过疏水相互作用、静电相互作用等次级键形成复合物。复合作用构建颗粒通常包括超分子包结、大分子络合、复凝聚作用等手段。RODR GUEZ等[29]研究表明,茶多酚与乳清蛋白质可通过相互作用生成纳米颗粒(30~90 nm),在较低茶多酚浓度下制备纳米颗粒能有效维持泡沫的高度。复凝聚作用通常指水相中的2种带不同电荷的聚电解质通过静电相互作用发生相分离而产生沉淀的一种现象,沉淀的尺寸可通过控制相分离条件进行调节[30]。蛋白质-多糖体系和多糖-多糖体系是最广泛采用的复凝聚体系。JARPA-PARRA等[31]将豆球蛋白样蛋白(10 mg/mL)与食品胶(瓜尔胶、果胶及黄原胶,1 mg/mL)的溶液混合,当水相pH为3.0时,豆球蛋白样蛋白(pI=4.6)带正电荷而食品胶带负电荷,2种聚电解质通过静电相互作用形成颗粒,搅打生成泡沫的稳定时间从51 min(豆球蛋白样蛋白)提升到126 min(添加瓜尔胶)、117 min(添加果胶)和275 min(添加黄原胶)。
GUEZ等[29]研究表明,茶多酚与乳清蛋白质可通过相互作用生成纳米颗粒(30~90 nm),在较低茶多酚浓度下制备纳米颗粒能有效维持泡沫的高度。复凝聚作用通常指水相中的2种带不同电荷的聚电解质通过静电相互作用发生相分离而产生沉淀的一种现象,沉淀的尺寸可通过控制相分离条件进行调节[30]。蛋白质-多糖体系和多糖-多糖体系是最广泛采用的复凝聚体系。JARPA-PARRA等[31]将豆球蛋白样蛋白(10 mg/mL)与食品胶(瓜尔胶、果胶及黄原胶,1 mg/mL)的溶液混合,当水相pH为3.0时,豆球蛋白样蛋白(pI=4.6)带正电荷而食品胶带负电荷,2种聚电解质通过静电相互作用形成颗粒,搅打生成泡沫的稳定时间从51 min(豆球蛋白样蛋白)提升到126 min(添加瓜尔胶)、117 min(添加果胶)和275 min(添加黄原胶)。
1.2.6 通过交联作用形成颗粒
交联作用是制备微凝胶颗粒的有效方式,微凝胶交联点数量、颗粒强度等特性容易通过控制反应来调节。KEAL等[32]研究表明,PNiPAM微凝胶软颗粒的稳定泡沫的能力与其交联密度有关,高交联密度的微凝胶软颗粒稳定的泡沫具有较大的界面膜排液速度,更容易出现气泡之间桥连。食品级颗粒制备时,交联作用主要通过酶法进行[33]。α-乳白蛋白在微生物转谷氨酰胺酶作用下形成致密的刚性结构的纳米颗粒(水力学半径Rh=100 nm;表观密度ρapp=21.6 kg/m3),在辣根过氧化物酶作用下则形成疏松结构的纳米颗粒(Rh=90 nm;表观密度ρapp=10.6 kg/m3),二者在起泡和稳定泡沫的能力方面存在差异。
1.2.7 脂质析晶法
在食用油脂加工中,通过控制温度能使油形成脂肪晶体,这些晶体甚至能在气-油界面处原位生长,从而在搅打过程中形成油基泡沫[34]。BINKS等[4]通过对4种食用油脂(椰子油、乳木果油、可可脂和棕榈仁硬脂)进行程序升温或熔融后再进行程序降温,均能得到具有高起泡能力的高熔点油脂晶体,这些晶体分散在低熔点的剩余油相中,经搅打即形成稳定的油基泡沫;上述油脂体系的固体脂肪含量接近30%时析出晶体具有较佳的起泡性能,这表明油基泡沫的稳定性与温度有关,当这些晶体熔化时油基泡沫随即破裂。
1.2.8 微生物细胞
发酵工业中经常能见到发酵产物甚至菌体本身生成泡沫的情况[35]。这些微生物菌体表面具有强烈的疏水性。HEARD等[36]从废水处理厂分离到3株丝状细菌(Gordonia amarae),这些细菌在指数生长期分泌生物表面活性剂到菌体表面,使菌体在整个生长周期内具有持久稳定泡沫的能力。在食品工业中,一些细菌和酵母菌的细胞具有优异的表面活性,它们通过Pickering机制稳定分散在水中的油滴和气泡[37-38]。FALCO等[39]观测到乳酸细菌的菌体表面可吸附β-酪蛋白或酪蛋白酸钠等成分,继而菌体在界面膜上排布成有序网络以稳定泡沫;当菌体浓度增加时,其起泡能力随之降低但生成的泡沫的稳定性却增加了。该研究结果对通过益生菌构建新型结构化乳品配料极具参考价值。
1.3 颗粒稳定的泡沫的形成
表1列出了各种方法制备的纳微米颗粒的形态特征和起泡特性。在研究中通常采用泡沫分析仪观测和分析泡沫形成过程以及生成泡沫的稳定性[40]。颗粒的起泡性常采用发泡率(泡沫体积与初始液体体积之比)表示。发泡能力(foaming capacity)还可通过Overrun值反映,Overrun值常用来衡量含泡食品或含泡体系中的气体占比[41],其计算公式为:
表1 各类颗粒的形态尺寸特征及起泡特性
Table 1 Morphology, size and foaming characteristics of various nano- and micro- particles

颗粒制备原料颗粒尺寸形态及特性起泡能力泡沫稳定性参考文献机械破碎法大豆分离蛋白尺寸与破碎方式有关,射流均质最小(d50=28.9 μm),ζ-电位<-30 mVN/A泡沫稳定性与颗粒浓度正相关。25 ℃时半寿期330 s(质量分数5%)[18]化学剥蚀法几丁质为纳米纤维,轴径20 nm;长240 nm颗粒质量分数从0.1%增至1%,发泡率由50%增至约75%。颗粒质量分数1%时,泡沫体积180 min内无变化,无排液;pH 7时稳定性最好[21]热诱导法乳清蛋白呈球形(~200~220 nm,PDI=0.113,pH 6.4);表面疏水度64 499(pH 6.8)起泡能力受颗粒浓度及pH影响(酸性条件有利,25 ℃,颗粒质量分数5%时,最大FC=1.18)颗粒浓度5%时,泡沫半寿期:261 s(pH 3.5)、461 s(pH 5.0)、285 s(pH 7.0)[23]乳清蛋白pH 7时形成纳米颗粒;pH 2对形成纳米纤维(长15 μm,轴径2~3 nm)颗粒质量分数2%发泡率最大(1 200%);纤维质量分数3%发泡率1 000%与蛋清蛋白起泡性相当纤维化乳清蛋白的发泡稳泡能力更优,1%~3%(质量分数)时仍有效发挥作用[8]蛋清蛋白纳米颗粒(水力学直径359 nm;PDI=0.4)0.5%~3.0%颗粒稳定泡沫尺寸分布比蛋清蛋白泡沫的窄;颗粒质量分数3.0%时最细腻贮藏时颗粒稳定泡沫的体积变化小,气泡残留量高于蛋清蛋白稳定泡沫[24]
续表1
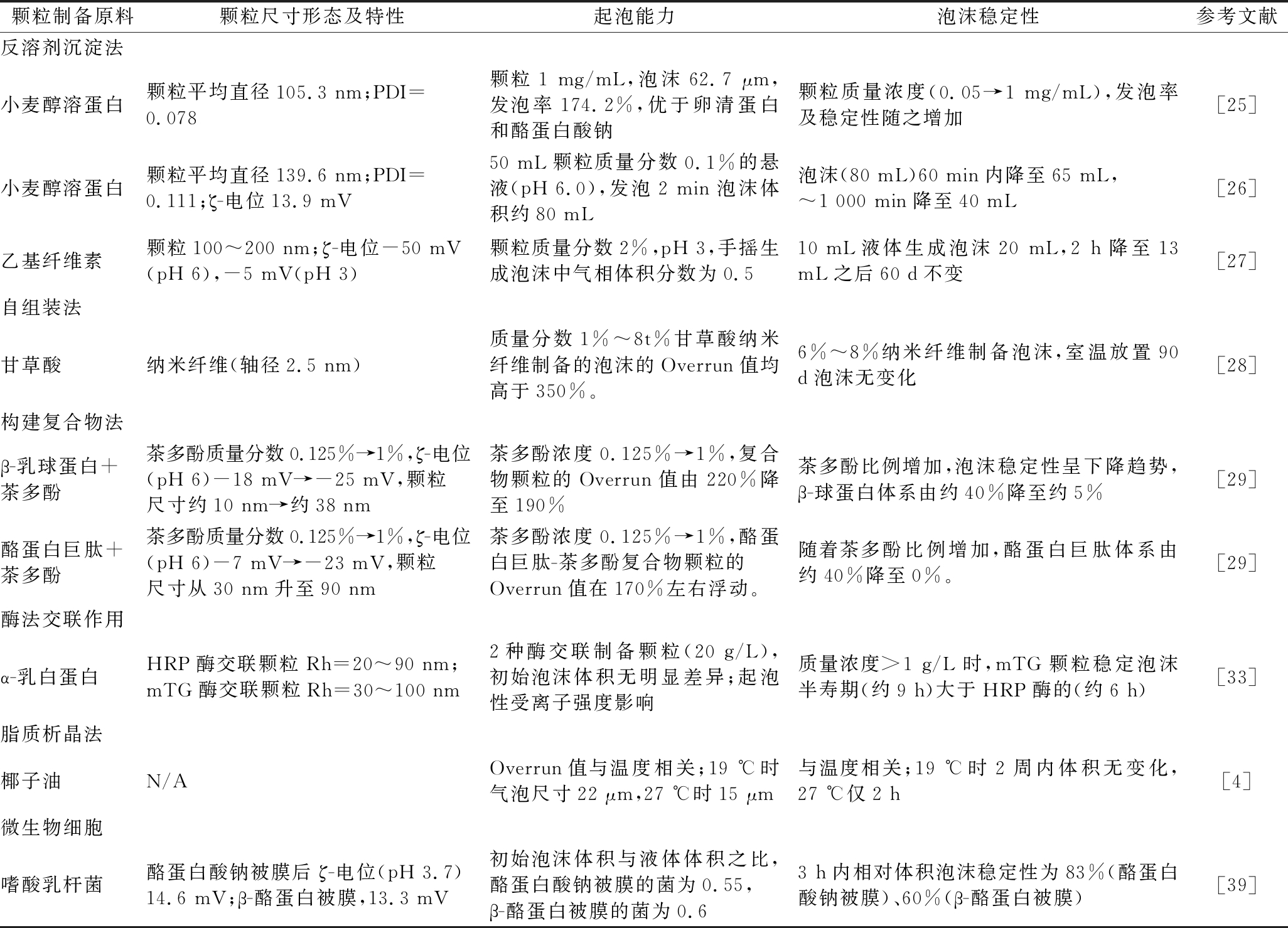
颗粒制备原料颗粒尺寸形态及特性起泡能力泡沫稳定性参考文献反溶剂沉淀法小麦醇溶蛋白颗粒平均直径105.3 nm;PDI=0.078颗粒1 mg/mL,泡沫62.7 μm,发泡率174.2%,优于卵清蛋白和酪蛋白酸钠颗粒质量浓度(0.05→1 mg/mL),发泡率及稳定性随之增加[25]小麦醇溶蛋白颗粒平均直径139.6 nm;PDI=0.111;ζ-电位13.9 mV50 mL颗粒质量分数0.1%的悬液(pH 6.0),发泡2 min泡沫体积约80 mL泡沫(80 mL)60 min内降至65 mL,~1 000 min降至40 mL[26]乙基纤维素颗粒100~200 nm;ζ-电位-50 mV(pH 6),-5 mV(pH 3)颗粒质量分数2%,pH 3,手摇生成泡沫中气相体积分数为0.510 mL液体生成泡沫20 mL,2 h降至13 mL之后60 d不变[27]自组装法甘草酸纳米纤维(轴径2.5 nm)质量分数1%~8t%甘草酸纳米纤维制备的泡沫的Overrun值均高于350%。6%~8%纳米纤维制备泡沫,室温放置90 d泡沫无变化[28]构建复合物法β-乳球蛋白+茶多酚茶多酚质量分数0.125%→1%,ζ-电位(pH 6)-18 mV→-25 mV,颗粒尺寸约10 nm→约38 nm茶多酚浓度0.125%→1%,复合物颗粒的Overrun值由220%降至190%茶多酚比例增加,泡沫稳定性呈下降趋势,β-球蛋白体系由约40%降至约5%[29]酪蛋白巨肽+茶多酚茶多酚质量分数0.125%→1%,ζ-电位(pH 6)-7 mV→-23 mV,颗粒尺寸从30 nm升至90 nm茶多酚浓度0.125%→1%,酪蛋白巨肽-茶多酚复合物颗粒的Overrun值在170%左右浮动。随着茶多酚比例增加,酪蛋白巨肽体系由约40%降至0%。[29]酶法交联作用α-乳白蛋白HRP酶交联颗粒 Rh=20~90 nm;mTG酶交联颗粒Rh=30~100 nm2种酶交联制备颗粒(20 g/L),初始泡沫体积无明显差异;起泡性受离子强度影响质量浓度>1 g/L时,mTG颗粒稳定泡沫半寿期(约9 h)大于HRP酶的(约6 h)[33]脂质析晶法椰子油N/AOverrun值与温度相关;19 ℃时气泡尺寸22 μm,27 ℃时15 μm与温度相关;19 ℃时2周内体积无变化,27 ℃仅2 h[4]微生物细胞嗜酸乳杆菌酪蛋白酸钠被膜后ζ-电位(pH 3.7)14.6 mV;β-酪蛋白被膜,13.3 mV初始泡沫体积与液体体积之比,酪蛋白酸钠被膜的菌为0.55,β-酪蛋白被膜的菌为0.63 h内相对体积泡沫稳定性为83%(酪蛋白酸钠被膜)、60%(β-酪蛋白被膜)[39]
(5)
式中:ml,给定体积(通常100 mL)发泡液体的质量,g;mf,给定体积(通常100 mL)泡沫的质量,g。
食品工业中制备泡沫主要通过2种方式:过饱和法和机械法[6]。过饱和法以啤酒泡沫为例,CO2在加压状态下溶解于液体中,压力解除时,CO2因过饱和向容器壁上的微小气囊扩散,微小气囊随之膨胀,长到足够大后脱离容器壁、上浮,最终在液体表面形成起泡的富集层即泡沫。所谓机械法,搅打空气到液体中形成气泡,持续搅打过程中较大的气泡切割成较小的气泡,水相中的表面活性物质不断吸附到这些气泡的气-液界面层,液膜足够牢固时即形成稳定泡沫,若气泡极易破裂则无法生成泡沫。CERVIN等[19]报道了水基泡沫的制备过程:取纳米纤维水凝胶(2%)加入辛胺溶液,用Ultra Turrax分散机以8 000 r/min处理10 min,因静电吸附作用辛胺吸附到纳米纤维上;13 500 r/min处理10 min使辛胺化纤维素纳米纤维在水相中均匀分散,将其转移到牛奶搅拌器中,搅打形成气泡,气泡表面旋即被纳米纤维覆盖,最终生成稳定泡沫。紧密排布在界面膜上的颗粒可有效阻止液体排出和气泡聚结[42-43],甚至在干燥过程中仍能保持泡沫形状[19]。GUNES等[34]展示了脂质结晶稳定的油基泡沫的制备过程:向脂质结晶中倒入植物油,可观察到脂质结晶定向吸附到气-油界面,搅打产生气泡,脂质结晶覆盖在气泡表面,形成细腻的泡沫。
2 颗粒稳定泡沫的性质
2.1 泡沫的稳定性
泡沫稳定性指泡沫结构持久稳定的能力。在研究中常借助各类显微技术对泡沫结构进行观测和记录。泡沫结构观测最常用的是光学显微镜[8, 34]。通过计算机技术捕捉图像后,采用图形软件(如ImageJ或Nano Measurer)处理,可得到气泡大小及尺寸分布等参数[8]。此外,激光共聚焦显微镜经常用于观测泡沫中的气泡形态[19],其优势在于借助选择性染色技术可以清晰观测颗粒在界面膜上的分布[44]。同时,冷冻电镜因其可原位观测泡沫的显微结构且放大倍率远高于光学镜而备受重视,无论是水基[27]还是油基[45]泡沫都适用。近年来小角中子散射(small angle neutron scattering, SANS)技术被用于解析泡沫的界面结构[46]。SANS技术优势在于可论证样品平方厘米范围的结构(不至于像扫描或投射电镜仅能获得样品的微区信息),且能观测纳米水平结构特征随分子间相互作用及时间、温度等环境条件变化的情况[30]。对泡沫而言,散射曲线上的低q值区域(q为散射矢量;q=(4π sin θ)/λ,其中2θ和λ分别为散射角和入射波长)可计算气泡平均尺寸,中q值区域可计算液膜厚度,高q值区域(1.22×10-2~1.08×10-1 Å-1)可反映Plateau边界内部结构信息[30]。
泡沫是热力学不稳定体系。泡沫失稳有3种可能的路径(图2):(1)排液。由于重力的作用,泡沫中的液体有从泡沫中排出的倾向。(2)由于气泡之间的液膜层因排液而破坏,引起气泡聚结。(3)气泡粗化。原因在于小气泡内的压力大于大气泡内的压力,而气体在水中具有一定溶解度,气体从小气泡向大气泡(甚至大气)发生扩散。这些现象通常会相互影响,导致泡沫远不及乳液稳定,当前研究尚无法区分上述因素各自对泡沫稳定性的影响。泡沫失稳时,表现为气泡长大、气泡破裂、液体析出、泡沫收缩等现象[47]。泡沫稳定性的评价方法主要包括对泡沫体积、液膜厚度、气泡尺寸、排液体积等指标的监测。其中最直观的是记录泡沫体积变化[48]。泡沫体积变为原始体积一半所需要的时间为半衰期(t1/2)可作为稳定性的定量评价依据[18]。
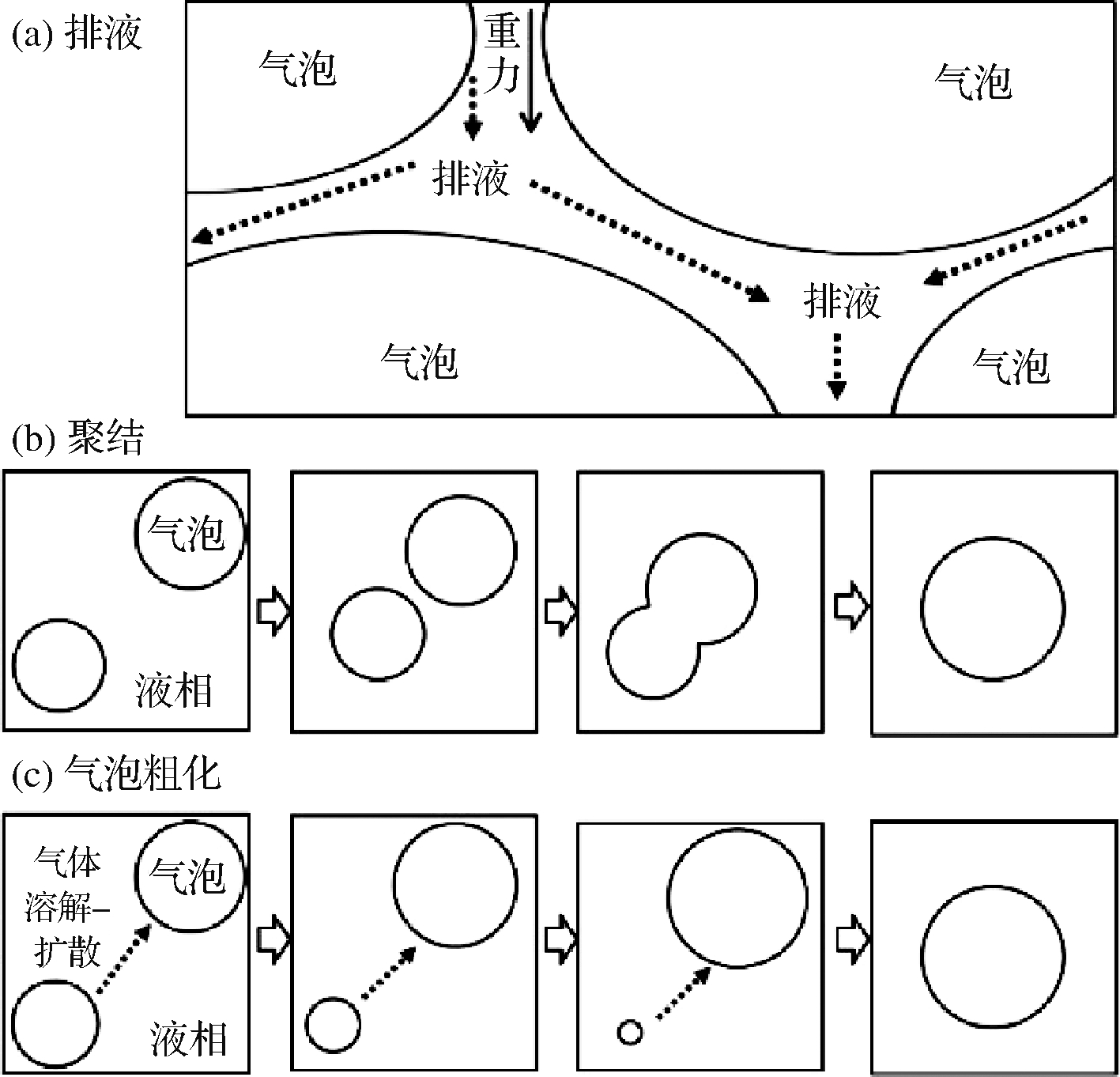
图2 泡沫失稳机制图示[47]
Fig.2 Scheme of the foam destabilization mechanism[47]
通过泡沫分析仪可以记录观察固定时间内泡沫中气泡聚结(和粗化)情况,以此用于稳定性评价[24]。泡沫分析仪还用来测量泡沫中液体析出情况,如泡沫开始排液时间(t0)或一定时间内排液体积[40]。JARPA等[31]提出采用τ即泡沫平均寿命作为评价泡沫稳定性的指标,τ值越大,泡沫稳定性越好。τ按照公式(6)~(8)计算:
H(t)=H(0)e-λt
(6)
ln[H(t)]=ln[H(0)]-λt
(7)
(8)
式中:H(0),t=0时刻泡沫高度;λ,泡沫衰减常数。公式(5)两边取自然对数得到公式(6),ln[H(t)]-t作图,斜率对应-λ,由公式(8)可求得τ。
2.2 泡沫的力学性质
颗粒稳定的泡沫往往具有一定的机械强度并呈现出一定的塑性[12, 19]。LEHOCKY等[49]采用LabStar实验室砂磨机将疏水性固体原料(5~300 μm)湿磨至亚微米级,在表面活性剂的辅助下分散成稳定的悬液。颗粒(而非表面活性剂)在湿磨过程中有稳定的泡沫形成。因泡沫具有较大机械强度,研磨后期泡沫黏度过大以致无法继续研磨。AR-G2流变仪表征泡沫的流变学性质发现,泡沫动态黏度在1~10 kPa·s且随湿磨时间增加而增大。湿磨时间超过60 min时,泡沫动态黏度还与添加的表面活性剂和固体物料质量之比有关,增加表面活性剂可使泡沫的动态黏度有所降低。
2.3 泡沫的加工特性
当具有足够机械强度时,颗粒稳定泡沫的加工特性便具有意义。比如在蛋糕制作中,鸡蛋清经搅打形成坚韧的泡沫对蛋糕品质形成是必需的。ALAVI等[50]将蛋清蛋白纳米纤维分散体(3%,40 mL)与100.0 g糖粉混合后搅打得到面糊,其塑性优于采用3%甚至10%蛋清蛋白(40 mL)与100.0 g糖粉搅打得到的面糊,静置时能较好地保持原来的形状。PENG等[51]发现小麦醇溶蛋白纳米颗粒稳定泡沫尽管气泡尺寸随着时间会增加,但气泡尺寸随时间变化的速度并未受到热处理(50、60、70 ℃)的影响。CERVIN等[19]研究发现辛胺化纤维素纳米纤维稳定的泡沫具有良好稳定性,将其转移到布氏漏斗中抽滤掉泡沫外的液体,并自然干燥(23 ℃,相对湿度29%)或60 ℃热风干燥可得到具有一定机械强度的干泡沫。
3 颗粒稳定泡沫的影响因素及调控措施
3.1 颗粒特性
3.1.1 颗粒特性与起泡能力的关联机制
为达到实际应用水平,颗粒不仅要有良好的起泡性,而且要具备优良的稳定泡沫的能力。颗粒在气-液界面形成牢固吸附层以稳定泡沫通常被称作Pickering效应[9, 11, 13, 52]。其特征在于,颗粒在气-水界面紧密排列分布,通过空间位阻作用阻止相邻气泡聚结[53],界面膜内的颗粒通过溶剂化(水合)或自聚集显著增加界面膜的黏弹性以抑制排液[48, 54]。除了三相接触角(θ),影响其泡沫特性的颗粒结构因素主要包括颗粒形状、尺寸[52]、表面粗糙度[48]、表面疏水性、颗粒的力学性质等方面。KARAKASHEV等[55]报道海泡石纤维的稳泡能力优于球形硅胶颗粒,两者的直径均为38 μm,接触角相近(66°和60°),但海泡石的纤维状结构使接触面积更大,在界面膜上通过缠结形成网络结构使泡沫更稳定。CHEN等[56] 通过超速离心得到不同大小酪蛋白胶束颗粒进行发泡试验考察了颗粒尺寸与泡沫稳定性的关系,结果表明,颗粒浓度3%,500 nm的颗粒生成的泡沫半寿期(25 h)远大于200 nm的颗粒生成泡沫的半寿期(230 min)。TUMARKIN等[57]发现一些颗粒可牢固地吸附在气泡上形成所谓的“装甲气泡”(armoured bubbles)。ELLIS等[40]发现琼脂凝胶颗粒的力学性质与泡沫稳定性存在关联,认为通过增加颗粒的弹性(elasticity)和颗粒间相互作用可增强琼脂凝胶颗粒的屈服应力,从而抵抗气泡上浮和因重力引起的排液,当屈服应力达到3~4 Pa时,排液几乎停止,此时泡沫的半衰期趋近最大值。
此外,颗粒的起泡能力与其浓度有关。因为颗粒浓度会影响颗粒在界面上的排列:当颗粒浓度较低时,颗粒全部吸附在气-水界面上,形成单层或双层紧密排列分布[27, 54, 58];当颗粒含量增大到一定浓度后,未吸附于界面的颗粒进入连续相(液相),颗粒之间通过自聚集形成类凝胶网络结构,减弱了液相流动性,阻止了液体排出,增强了泡沫稳定性[42]。
3.1.2 通过调整颗粒形态尺寸
颗粒的形态尺寸对其起泡和稳定泡沫的能力有重要影响[52]。MORALES等[59]研究发现,高能超声波处理使大豆分离蛋白颗粒粒度减小,颗粒的起泡能力得到显著提升;当高能超声波和热(70、80或85 ℃)协同处理时大豆分离蛋白颗粒,可进一步提升其起泡能力,原因在于协同处理过程大豆分离蛋白颗粒的粒度被进一步减小;有趣的是单独热处理(70、80或85 ℃)对颗粒起泡能力的增幅有限,因为尽管热处理减小了粒度但是由于颗粒粒度(水力学直径~150 nm)远大于超声处理的样品(水力学直径~75 nm)所致。MURRAY等[60]对Tencel纤维素采取不同方式处理制备得到一系列不同尺寸形状的材料,其中采用长时酸水解(55%硫酸,55 ℃处理6 h后冷却至室温继续水解7 d,随后升温到55 ℃再处理6 h)的样品呈杆状,长轴30~40 μm,短轴10 μm;而依次采用纤维素酶酶解、短时酸水解(55%硫酸,55 ℃、6 h)和冷冻研磨得到的样品,长轴7~15 μm,短轴2~5 μm。将它们各自与乙基纤维素作用形成复合物后测定起泡性能。前者起泡后起始泡沫相对高度0.5,泡沫破裂时间6 h;而后者起泡后初始泡沫相对高度0.8,但泡沫破裂时间减小到4 h。
3.1.3 通过调整颗粒界面特性
改变颗粒界面特性的方式主要包括对颗粒表面进行基团修饰、沉积被膜、化学与物理(如热处理)法组合等手段。基团修饰主要是向亲水性表面引入疏水性基团。JIANG等[37]研究发现嗜酸乳杆菌La5具有一定起泡能力,向菌体表面引入辛烯基琥珀酰基后,菌体疏水度增加,起泡能力从0.09增加到0.25(6%酰化试剂改性)和0.44(10%试剂改性),菌体改性使泡沫稳定性从10 min增加到3 h以上。沉积被膜法,即通过将可溶性组分沉积到颗粒表面,从而调整颗粒的性质。MURRAY等[60]通过向α-纤维素颗粒表面沉积乙基纤维素调整颗粒表面疏水度,α-纤维素颗粒稳定泡沫的能力得到改善;将沉积被膜颗粒继续与酪蛋白或乳清蛋白进行作用,可进一步抑制生成泡沫中气泡发生聚结。几丁质纳米晶体起泡性差,需要借助高能超声波和添加乙醇才能形成泡沫,且泡沫容易破裂[21];但是适量添加吐温20可促进几丁质纳米纤维向气-水界面不可逆吸附,提升起泡性,当纳米纤维浓度达到7.5 mg/mL时,生成的泡沫静置7 d仍稳定,无排液和气泡破裂现象[9]。GUAN等[61]报道蒙脱土纳米片经酪蛋白酸钠被膜后用于发泡,制作的泡沫细腻,气泡分布均匀,静置14 d泡沫体积无变化。ASGHARI等[41]研究发现辛烯基琥珀酰化大米淀粉与蛋清蛋白或豌豆分离蛋白混合后泡沫的稳定性提高且不损失起泡性,并指出这种提高作用受到淀粉尺寸和疏水性大小的协同影响。
3.2 起泡方式
泡沫中气泡大小及分布会影响泡沫稳定性,起泡方式不同会造成不同的气泡分布,因此起泡方式会影响到泡沫稳定性。JIN等[27]研究发现,对于乙基纤维素纳米颗粒悬液(2%),手摇(10 mL悬液加入到25 mL量筒中,封口后手摇2 min)或低速搅动(手持式电动搅打器或厨用搅拌机,搅打3 min)制作的泡沫的气泡较大,但厨用搅拌机制作的泡沫可达液体体积的2~11倍且泡沫机械强度好,10 cm高的泡沫经风干脱水后仍可直立1年以上;高速剪切2 min制成的泡沫的气泡尺寸随着剪切速率(Silverson搅拌机9 500 r/min; Ultra Turrax分散机13 500或21 500 r/min)的增加而减小,且气泡尺寸分布更均匀,非常稳定,呈细腻奶油状。研究认为低速搅打和高速分散过程中泡沫形成遵循不同的途径[27]:低速搅打时,能量输入强度低,有限的气体被截留,气泡尺寸较大,颗粒堆积在界面膜上,增加搅打速度可以将较大气泡剪切成较小的气泡。高速分散机狭缝中的流体具有极高的线速度,因水动力学压降(hydrodynamic pressure drop)产生水动力学空化作用,在高流速区域引起成核(nucleation)和气泡成长。这些不断长大的气泡被吸附其上的颗粒束缚而不至于破裂,在流体循环时,这些表面“粘附”了颗粒的气泡不断发生膨胀或收缩,从而使颗粒在其表面附着更紧,颗粒稳定的保护膜就更加致密,最终使稳定的泡沫得以形成。
3.3 环境因素
研究表明,泡沫的稳定性受到环境因素的影响,主要包括颗粒浓度[18]、pH[62]、离子强度[63]、共存成分以及温度[51]等因素。PENG等[51]将体系pH值从5.8降低至3.0(小麦醇溶蛋白pI=6.5),小麦醇溶蛋白纳米颗粒的粒径略有减小,ζ-电位从+16.3升高至+22.0 mV,研究发现pH降低使其发泡性和泡沫稳定性显著下降,原因在于颗粒在气-水界面的初始吸附速度减慢以及形成膜的黏弹性模量降低所致。
4 颗粒在食品中的应用
4.1 食品发泡剂
颗粒具有独特的起泡性和稳泡作用,相比于可溶解的起泡剂,颗粒稳定的泡沫在机械强度、可填充性等方面的特征是后者缺少的。作为食品发泡剂,颗粒可以用来制作稳定的油基泡沫,理论上既可以减少油脂的用量,又可以起到填充作用。SAREMNEJAD等[64]将单甘酯和双甘酯与葵花籽油于80 ℃彻底熔化,降温到8 ℃,慢慢升温到室温,对体系进行搅打(3 200 r/min)制备油基泡沫,泡沫中气泡平均尺寸可达20 μm,将其作为结构化配料制作充气香肠,其样品色泽等指标与市售全脂香肠无显著差异。ALAVI等[65]研究发现,采用蛋清蛋白制作的面糊稠度低,成型后不能保持形状,而采用热诱导法形成的纤维化蛋清蛋白制作的面糊稠度高,搅打性好,能较好地保持形状。流变学数据表明,后者制作的面糊具有更高的零剪切黏度、屈服应力、弹性模量和更大的剪切稀化行为,这是纤维化蛋清蛋白在面糊中发生链缠结所致。纤维化蛋清蛋白可以方便控制烘焙食品的质地,甚至作为调质类配料用于充气糖果生产。根据FALCO等[39]的研究结果,嗜酸乳杆菌的发泡性能使其具有作为在低热量发泡食品加工配料的潜力。
4.2 分离介质
泡沫分离法(foam fractionation)是一种将目标分离物质聚集在气泡表面并形成泡沫层以实现分离净化的分离技术[66]。HU等[67]采用疏水性二氧化硅纳米颗粒作为泡沫调节剂从甘薯淀粉废水中回收分离蛋白质。李子薇等[68]采用十二烷基二甲基甜菜碱改性疏水二氧化硅纳米颗粒作为稳泡剂,有效增强了乳制品废水中低浓度酪蛋白的泡沫性能,通过抑制泡沫排液和泡沫聚并,提高了分离效果,酪蛋白回收率可达94.2%,富集比达到12.3。WU等[69]研究了采用反式-白藜芦醇为模板制备的分子印迹二氧化硅纳米颗粒作为吸附分离材料从麝香葡萄果渣提取液中回收制备反式-白藜芦醇的工艺。
4.3 其他应用
颗粒稳定的泡沫具有良好的稳定性和机械强度,可用于制作多孔轻质材料。HUANG等[9]使用几丁质纳米纤维作为发泡剂制作泡沫,将湿泡沫风干除去水分得到超轻质多孔材料,其孔隙率99.4%,密度8.84 kg/m3,杨氏模量约290.2 kPa,与通过冷冻干燥方法制备的密度相当的多孔几丁质材料(杨氏模量约40.0 kPa)相比,机械性能得到显著改善。CERVIN等[19]研究发现辛胺化纤维素纳米纤维稳定的泡沫塑性优良,干燥时孔隙结构几乎不受影响,制得的多孔材料机械强度(杨氏模量437 kPa)远高于纤维素气凝胶(199 kPa)[70]。
5 结语
受自然界中存在的颗粒稳泡现象的启发,人们构建了一系列具有起泡活性的纳微米颗粒并探讨起泡及稳定泡沫的性能。这些颗粒以Pickering机理形成并稳定乳液的研究当前非常活跃[5],颗粒作为发泡剂或其他用途的研究正在兴起。但以下方面值得进一步研究:(1)基础研究方面。首先是界面结构特性可控的纳/微米颗粒制备方法有待开发,其次颗粒结构特性与起泡稳泡能力之间的关系有待阐明;(2)应用开发方面。需开发简便、低成本、规模化制造性能优良的纳微米颗粒发泡剂的工艺技术,在此基础上探索其在食品工业中的具体用途。
[1] HEERTJE I. Structure and function of food products: A review[J]. Food Structure, 2014, 1(1):3-23.
[2] SAHI S S, ALAVA J M. Functionality of emulsifiers in sponge cake production[J]. Journal of the Science of Food and Agriculture, 2003, 83(14):1 419-1 429.
[3] ARBOLEYA J C, GARC A-QUIROGA M, LASA D, et al. Effect of highly aerated food on expected satiety[J]. International Journal of Gastronomy and Food Science, 2014, 2(1): 14-21.
A-QUIROGA M, LASA D, et al. Effect of highly aerated food on expected satiety[J]. International Journal of Gastronomy and Food Science, 2014, 2(1): 14-21.
[4] BINKS B P, MARINOPOULOS I. Ultra-stable self-foaming oils[J]. Food Research International, 2017, 95:28-37.
[5] DICKINSON E. Advances in food emulsions and foams: reflections on research in the neo-Pickering era[J]. Current Opinion in Food Science, 2020,33:52-60.
[6] DRENCKHAN W, SAINT-JALMES A. The science of foaming[J]. Advances in Colloid and Interface Science, 2015, 222: 228-259.
[7] SENÉE J, VIAUX L, ROBILLARD B, et al. The endogenous particles of a sparkling wine and their influence on the foaming behaviour[J]. Food Hydrocolloids, 1998, 12(2): 217-226.
[8] OBOROCEANU D, WANG L, MAGNER E, et al. Fibrillization of whey proteins improves foaming capacity and foam stability at low protein concentrations[J]. Journal of Food Engineering, 2014, 121: 102-111.
[9] HUANG Y, YANG J, CHEN L, et al. Chitin nanofibrils to stabilize long-life Pickering foams and their application for lightweight porous materials[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(8): 10 552-10 561.
[10] TRUONG T, PRAKASH S, BHANDARI B. Effects of crystallisation of native phytosterols and monoacylglycerols on foaming properties of whipped oleogels[J]. Food Chemistry, 2019, 285: 86-93.
[11] BINKS B P, MUIJLWIJK K, KOMAN H, et al. Food-grade Pickering stabilisation of foams by in situ hydrophobisation of calcium carbonate particles[J]. Food Hydrocolloids, 2017, 63: 585-592.
[12] CHEN X W, YANG D X, ZOU Y, et al. Stabilization and functionalization of aqueous foams by Quillaja saponin-coated nanodroplets[J]. Food Research International, 2017, 99: 679-687.
[13] LAM S, VELIKOV K P, VELEV O D. Pickering stabilization of foams and emulsions with particles of biological origin[J]. Current Opinion in Colloid & Interface Science, 2014, 19(5): 490-500.
[14] HUNTER T N, PUGH R J, FRANKS G V, et al. The role of particles in stabilising foams and emulsions[J]. Advances in Colloid and Interface Science, 2008, 137(2): 57-81.
[15] RAYNER M, MARKU D, ERIKSSON M, et al. Biomass-based particles for the formulation of Pickering type emulsions in food and topical applications[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2014, 458: 48-62.
[16] VIS M, OPDAM J, VAN'T OOR I S J, et al. Water-in-water emulsions stabilized by nanoplates[J]. ACS Macro Letters, 2015, 4(9): 965-968.
[17] PEDDIREDDY K R, NICOLAI T, BENYAHIA L, et al. Stabilization of water-in-water emulsions by nanorods[J]. ACS Macro Letters, 2016, 5(3): 283-286.
[18] MATSUMIYA K, MURRAY B S. Soybean protein isolate gel particles as foaming and emulsifying agents[J]. Food Hydrocolloids, 2016, 60: 206-215.
[19] CERVIN N T, ANDERSSON L, NG J B S, et al. Lightweight and strong cellulose materials made from aqueous foams stabilized by nanofibrillated cellulose[J]. Biomacromolecules, 2013, 14(2): 503-511.
[20] CERVIN N T, JOHANSSON E, BENJAMINS J W, et al. Mechanisms behind the stabilizing action of cellulose nanofibrils in wet-stable cellulose foams[J]. Biomacromolecules, 2015, 16(3): 822-831.
[21] TZOUMAKI M V, KAREFYLLAKIS D, MOSCHAKIS T, et al. Aqueous foams stabilized by chitin nanocrystals[J]. Soft Matter, 2015, 11(31): 6 245-6 253.
[22] REN C, TANG L, ZHANG M, et al. Structural characterization of heat-induced protein particles in soy milk[J]. Journal of Agricultural and Food Chemistry, 2009, 57(5): 1 921-1 926.
[23] SCHMITT C, BOVAY C, ROUVET M. Bulk self-aggregation drives foam stabilization properties of whey protein microgels[J]. Food Hydrocolloids, 2014, 42: 139-148.
[24] LI X, MURRAY B S, YANG Y, et al. Egg white protein microgels as aqueous Pickering foam stabilizers: Bubble stability and interfacial properties[J]. Food Hydrocolloids, 2020, 98: 105 292.
[25] PENG D, JIN W, LI J, et al. Adsorption and distribution of edible gliadin nanoparticles at the air/water interface[J]. Journal of Agricultural and Food Chemistry, 2017, 65(11): 2 454-2 460.
[26] WOUTERS A G B, SCHAEFER S, JOYE I J, et al. Relating the structural, air-water interfacial and foaming properties of wheat (Triticum aestivum L.) gliadin and maize (Zea mays L.) zein based nanoparticle suspensions[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2019, 567: 249-259.
[27] JIN H, ZHOU W, CAO J, et al. Super stable foams stabilized by colloidal ethyl cellulose particles[J]. Soft Matter, 2012, 8(7): 2 194-2 205.
[28] 苏恩谊,马璐璐,李青,等.基于天然甘草酸纳米纤维的多维组装制备食品级的超稳态泡沫[J].现代食品科技,2020,36(3):205-210;79.
[29] RODR GUEZ S D, VON STASZEWSKI M, PILOSOF A M R. Green tea polyphenols-whey proteins nanoparticles: Bulk, interfacial and foaming behavior[J]. Food Hydrocolloids, 2015, 50: 108-115.
GUEZ S D, VON STASZEWSKI M, PILOSOF A M R. Green tea polyphenols-whey proteins nanoparticles: Bulk, interfacial and foaming behavior[J]. Food Hydrocolloids, 2015, 50: 108-115.
[30] SCHMIDT I, NOVALES B, BOUÉ F, et al. Foaming properties of protein/pectin electrostatic complexes and foam structure at nanoscale[J]. Journal of Colloid and Interface Science, 2010, 345(2): 316-324.
[31] JARPA-PARRA M, TIAN Z, TEMELLI F, et al. Understanding the stability mechanisms of lentil legumin-like protein and polysaccharide foams[J]. Food Hydrocolloids, 2016, 61: 903-913.
[32] KEAL L, LAPEYRE V, RAVAINE V, et al. Drainage dynamics of thin liquid foam films containing soft PNiPAM microgels: influence of the cross-linking density and concentration[J]. Soft Matter, 2017, 13(1): 170-180.
[33] DHAYAL S K, DELAHAIJE R J B M, DE VRIES R J, et al. Enzymatic cross-linking of α-lactalbumin to produce nanoparticles with increased foam stability[J]. Soft Matter, 2015, 11(40): 7 888-7 898.
[34] GUNES D Z, MURITH M, GODEFROID J, et al. Oleofoams: Properties of crystal-coated bubbles from whipped oleogels-evidence for Pickering stabilization[J]. Langmuir: the ACS Journal of Surfaces and Colloids,2017,33(6): 1 563-1 575.
[35] 宋阳, 姜成英, 王爱杰, 等. 城市污水处理厂活性污泥生物泡沫研究进展[J]. 微生物学通报, 2019, 46(8):1 954-1 970.
[36] HEARD J, HARVEY E, JOHNSON B B, et al. The effect of filamentous bacteria on foam production and stability[J]. Colloids and surfaces B: Biointerfaces, 2008, 63(1): 21-26.
[37] JIANG X, FALCO C Y, DALBY K N, et al. Surface engineered bacteria as Pickering stabilizers for foams and emulsions[J]. Food Hydrocolloids, 2019, 89: 224-233.
[38] FIROOZMAND H, ROUSSEAU D. Microbial cells as colloidal particles: Pickering oil-in-water emulsions stabilized by bacteria and yeast[J]. Food Research International, 2016, 81: 66-73.
[39] FALCO C Y, GENG X, C RDENAS M, et al. Edible foam based on Pickering effect of probiotic bacteria and milk proteins[J]. Food Hydrocolloids, 2017, 70: 211-218.
RDENAS M, et al. Edible foam based on Pickering effect of probiotic bacteria and milk proteins[J]. Food Hydrocolloids, 2017, 70: 211-218.
[40] ELLIS A L, MILLS T B, NORTON I T, et al. The effect of sugars on agar fluid gels and the stabilisation of their foams[J]. Food Hydrocolloids, 2019, 87: 371-381.
[41] ASGHARI A K, NORTON I, MILLS T, et al. Interfacial and foaming characterisation of mixed protein-starch particle systems for food-foam applications[J]. Food Hydrocolloids, 2016, 53: 311-319.
[42] DICKINSON E. Food emulsions and foams: Stabilization by particles[J]. Current Opinion in Colloid & Interface Science, 2010, 15(1-2): 40-49.
[43] WEGE H A, KIM S, PAUNOV V N, et al. Long-term stabilization of foams and emulsions with in-situ formed microparticles from hydrophobic cellulose[J]. Langmuir, 2008, 24(17): 9 245-9 253.
[44] LI X, YANG Y, MURRAY B S, et al. Combination of egg white protein and microgels to stabilize foams: Impact of processing treatments[J]. Journal of Food Engineering, 2020, 275: 109 860.
[45] BINKS B P, ROCHER A, KIRKLAND M. Oil foams stabilised solely by particles[J]. Soft Matter, 2011, 7(5): 1 800-1 808.
[46] AXELOS M A V, BOUÉ F. Foams as viewed by small-angle neutron scattering[J]. Langmuir, 2003, 19(17): 6 598-6 604.
[47] FAMEAU A L, SALONEN A. Effect of particles and aggregated structures on the foam stability and aging[J]. Comptes Rendus Physique, 2014, 15(8-9): 748-760.
[48] CHEN X, CHEN Y, ZOU L, et al. Plant-based nanoparticles prepared from proteins and phospholipids consisting of a core-multilayer-shell structure: Fabrication, stability, and foamability[J]. Journal of Agricultural and Food chemistry, 2019, 67(23): 6 574-6 584.
[49] LEHOCKY R, ![]() I, et al. Occurrence and prevention of Pickering foams in pharmaceutical nano-milling[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2019, 143: 91-97.
I, et al. Occurrence and prevention of Pickering foams in pharmaceutical nano-milling[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2019, 143: 91-97.
[50] ALAVI F, EMAM-DJOMEH Z, MOHAMMADIAN M, et al. Physico-chemical and foaming properties of nanofibrillated egg white protein and its functionality in meringue batter[J]. Food Hydrocolloids, 2020, 101: 105 554.
[51] PENG D, JIN W, TANG C, et al. Foaming and surface properties of gliadin nanoparticles: Influence of pH and heating temperature[J]. Food Hydrocolloids, 2018, 77: 107-116.
[52] GUEVARA J S, MEJIA A F, SHUAI M, et al. Stabilization of Pickering foams by high-aspect-ratio nano-sheets[J]. Soft Matter, 2013, 9(4): 1 327-1 336.
[53] HOROZOV T S. Foams and foam films stabilised by solid particles[J]. Current Opinion in Colloid & Interface Science, 2008, 13(3): 134-140.
[54] MURRAY B S, ETTELAIE R. Foam stability: proteins and nanoparticles[J]. Current Opinion in Colloid & Interface Science, 2004, 9(5): 314-320.
[55] KARAKASHEV S I, OZDEMIR O, HAMPTON M A, et al. Formation and stability of foams stabilized by fine particles with similar size, contact angle and different shapes[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2011, 382(1-3): 132-138.
[56] CHEN M, BLEEKER R, SALA G, et al. Particle size determines foam stability of casein micelle dispersions[J]. International Dairy Journal, 2016, 56: 151-158.
[57] TUMARKIN E, PARK J I, NIE Z, et al. Temperature mediated generation of armoured bubbles[J]. Chemical Communications, 2011, 47(47): 12 712-12 714.
[58] BINKS B P. Particles as surfactants—similarities and differences[J]. Current Opinion in Colloid & Interface Science, 2002, 7(1-2): 21-41.
[59] MORALES R, MART NEZ K D, RUIZ-HENESTROSA V M P, et al. Modification of foaming properties of soy protein isolate by high ultrasound intensity: Particle size effect[J]. Ultrasonics Sonochemistry, 2015, 26: 48-55.
NEZ K D, RUIZ-HENESTROSA V M P, et al. Modification of foaming properties of soy protein isolate by high ultrasound intensity: Particle size effect[J]. Ultrasonics Sonochemistry, 2015, 26: 48-55.
[60] MURRAY B S, DURGA K, DE GROOT P W N, et al. Preparation and characterization of the foam-stabilizing properties of cellulose-ethyl cellulose complexes for use in foods[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 13 277-13 288.
[61] GUAN Y, ZHONG Q. Stable aqueous foams created with intercalated montmorillonite nanoclay coated by sodium caseinate [J]. Journal of Food Engineering, 2019, 248: 36-45.
[62] MIQUELIM J N, LANNES S C S, MEZZENGA R. pH Influence on the stability of foams with protein-polysaccharide complexes at their interfaces[J]. Food Hydrocolloids, 2010, 24(4): 398-405.
[63] SCHMITT C, BOVAY C, ROUVET M, et al. Whey protein soluble aggregates from heating with NaCl: physicochemical, interfacial, and foaming properties[J]. Langmuir, 2007, 23(8): 4 155-4 166.
[64] SAREMNEJAD F, MOHEBBI M, KOOCHEKI A. Practical application of nonaqueous foam in the preparation of a novel aerated reduced-fat sauce[J]. Food and Bioproducts Processing, 2020, 119: 216-225.
[65] ALAVI F, EMAM-DJOMEH Z, MOHAMMADIAN M, et al. Physico-chemical and foaming properties of nanofibrillated egg white protein and its functionality in meringue batter[J]. Food Hydrocolloids, 2020, 101: 105 554.
[66] BURGHOFF B. Foam fractionation applications[J]. Journal of Biotechnology, 2012, 161(2): 126-137.
[67] HU N, WU Z, JIN L, et al. Nanoparticle as a novel foam controller for enhanced protein separation from sweet potato starch wastewater[J]. Separation and Purification Technology, 2019, 209: 392-400.
[68] 李子薇, 胡楠, 杨松琴, 等. 纳米颗粒作为稳泡剂泡沫分离酪蛋白的工艺[J]. 化工进展,2020,39(3):851-857.
[69] WU Z, LI N, ZHANG X, et al. Effective recovery of trans-resveratrol from the leaching solution of muscat grape pomace by developing a novel technology of foam fractionation[J]. Journal of Food Engineering, 2019, 241: 41-50.
[70] SEHAQUI H, ZHOU Q, BERGLUND L A. High-porosity aerogels of high specific surface area prepared from nanofibrillated cellulose (NFC)[J]. Composites Science and Technology, 2011, 71(13): 1 593-1 599.