益生菌(probiotics)是一类通过改善宿主体内的微生态平衡而发挥有益作用的活性微生物总称。它们可粘附于宿主肠黏膜表面,通过影响外源菌及病原体定殖的方式来改善肠道菌群结构、促进肠道有益菌增殖、抑制有害菌的生长、提高机体免疫力、降低胆固醇、调节血脂等重要生理功效,同时在肠道免疫失调引发的一系列肠道慢性感染性疾病以及肠应激综合征等疾病的预防和治疗上也有着广泛的应用[1]。一般认为,益生菌被服用后只有保持较高活性才能发挥有效作用,但由于服用后要经受胃酸、胆盐等环境后才能最终到达活性位点,因此胆盐耐受性是选择益生菌的重要标准之一[2]。胆汁酸(bile acid, BA)是在肝脏中由胆固醇合成的两亲性分子,它们储存在胆囊并在机体摄食后释放到小肠中,可促进脂质的乳化和增溶。近年来,已有研究表明BA是信号传导分子,其通过法尼醇X受体(farnesoid X receptor, FXR)和G蛋白偶联膜受体5(TGR5)介导信号激活宿主体内与胆汁酸、脂质、碳水化合物代谢及能量消耗和炎症相关基因的表达,在调节宿主新陈代谢、生理、营养和免疫功能中发挥重要作用[3]。而胆盐是胆汁酸在碱性胆汁中的主要存在形式,在脊椎动物的脂质消化中起重要作用,负责胆汁参与脂肪的消化和吸收。大量研究表明,益生菌不但可通过胆盐水解酶来提高自身的胆盐胁迫抗性,从而增加其在肠道中的存活几率和稳定性[4],而且还能通过胆盐水解酶直接参与胆汁酸调控而实现其部分功能特性[5],因而益生菌胆盐水解酶一直是研究的热点。
1 胆盐水解酶
1.1 胆盐水解酶的特点
胆盐水解酶(bile salt hydrolase,BSH),属于甘氨酸水解酶家族的N-端水解酶成员。不同来源的BSH在氨基酸数量、最适pH和温度、分子质量、底物偏好及酶催化效率方面均存在较大差异[6]。BSHs主要由314~338个氨基酸编码组成,BSH单体分子质量在34~42 kDa。最适pH范围为3.8~7.0,在30~55 ℃时,BSHs活性最佳。
大多数BSHs以同型四聚体的形式存在,而来自脆弱芽孢杆菌ATCC 25285的LaCRL1098_BSH、BlBB536_BSH和BSH,分别以同源二聚体、同源六聚体及同源八聚体形式存在[7]。约翰逊乳杆菌100-100中的4种BSH以同源或异源三聚体形式存在[8]。此外,在其他菌株中也观察到多种形式BSH的出现,如唾液乳杆菌LGM14476中的 BSHs为同源二聚体[9]。
前人研究表明, BSH存在6个活性位点,分别为Cys2、Arg18、Asp21、Asn82、Asn175和Arg228[10]。在蛋白自身酶解过程中,初始的甲硫氨酸(Met)被去除后Cys2便成为催化中心,这是Ntn水解酶超家族的共同点。因此,Cys2的巯基(SH)对BSH催化至关重要。LIANG等[11]研究表明,Asn82与BSH的活性密切相关。
BSH具有底物特异性。BSH可能会识别胆盐中的类固醇核或氨基酸侧链(图1)。相关动力学数据表明,BSH底物的识别部位为氨基酸侧链,且大多数BSH倾向水解甘氨结合胆盐,这主要由牛磺结合胆盐中硫原子引起的位阻所致[12]。还有研究表明,类固醇核及氨基酸侧链的修饰也会影响BSH的底物偏好[13]。最近,通过对胆盐进行分子对接和比较结构分析,表明BSH可以通过与疏水性类固醇的疏水性相互作用来识别底物[14-15]。
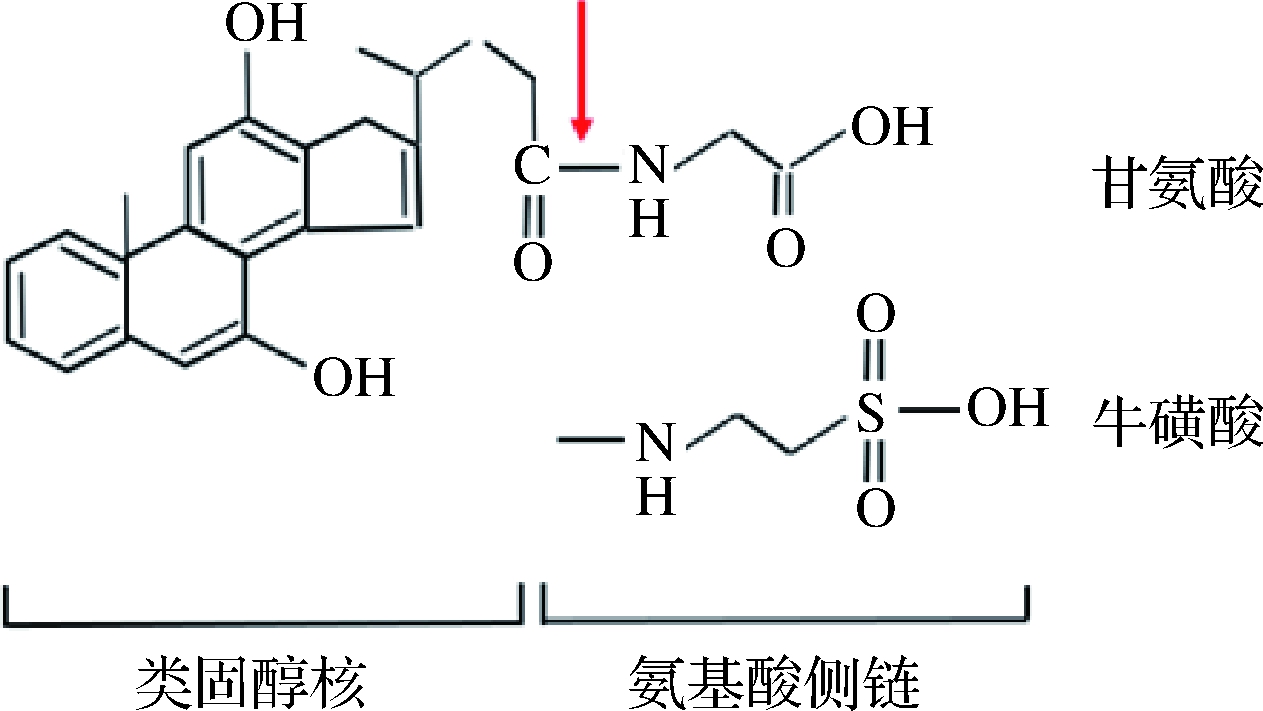
图1 胆盐的化学结构
Fig.1 The chemical structure of bile salts
1.2 胆盐水解酶在益生菌中的分布
在检索了公共数据库美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)中的蛋白数据库后发现,BSH主要分布于乳酸菌和双歧杆菌中。同时,乳酸菌和双歧杆菌通常用作益生菌菌株,也是胃肠道菌群的重要组成部分。
与文献[6]报道一致,检索过程中发现有许多菌株存在多个BSH基因。筛选出主要产bsh的乳酸菌菌种整理成表1。如植物乳杆菌WCFS1有4个bsh基因(bsh1、bsh 2、bsh3、bsh4),约氏乳杆菌DPC 6026有3个bsh 基因(氨基酸序列分别为AEB93337.1、AEB93154.1、AEB92403.1),嗜酸乳杆菌LA4和LA11均有2个bsh基因(bshA和bshB)(数据来源于NCBI)。
表1 部分益生菌中的胆盐水解酶分布情况
Table 1 Distribution of bile salt hydrolase in partial probiotics

菌株基因名称(核苷酸序列号)蛋白序列号氨基酸数量/个Lactobacillus plantarum WCFS1bsh1,lp_3536(3154175-3154411)CCC80500.1324pva1,lp_0067(64823-65839)CCC77632.1338pva2,lp_3362(2987554-2988540)CCC80350.1328pva3,lp_2572 (2290117-22910707)CCC79725.1317Lactobacillus johnsonii NCC 533LJ_1412(1286673-1287653)AAS09178.1326LJ_1147(1065946-1066923)AAS08969.1325LJ_0056(77465-78415)AAS08038.1316Lactobacillus agilis DSM 20509FC14_GL001514(39634-40608)KRM65161.1324Lactobacillus parabuchneri DSM 5707FC51_GL000838(39417-40409)KRM45487.1330Lactobacillus buchneri DSM 20057FC79_GL000689(14210-15126)KRK68247.1308Lactobacillus amylovorus DSM 20531LA20531_09935(1987830-1988807)ATO53887.1325Lactobacillus acidophilus La-14LA14_1092(1058274-1059251)AGK94261.1325LA14_0914(869313-870290)AGK94084.1325Lactobacillus fermentum NCDO 394bsh(1-978)AEZ06356.1325Lactobacillus reuteri JCM 1112LAR_0701(808477-809454)BAG25217.1325Lactobacillus salivarius LMG14476bsh2(1-978)ACL98205.1325Lactobacillus gasseri ATCC 33323KY674913.1(1-978)ARB50240.1325Lactobacillus crispatus EM-LC1Lc367_0832(27967..28944)EST03469.1325Lactobacillus pentosus DSM 20314FD24_GL001245(29140-30126)KRK23105.1328FD24_GL001794(584-1543)KRK22048.1319Lactobacillus ruminis S23P869_05035(3460-4401)KLA48229.1313P869_08915(404-1378)KLA46842.1324Lactobacillus sakei subsp. sakei LS25LS25_0234(103528-104520)EOR85780.1330Lactobacillus gasseri ATCC 33323Bifidobacterium breve DSMZ 20213CP000413.1(102-1496)ABJ59469.1316CP000413.1(102-1496)ABJ60345.1325DQ309031.1(1-951)ABC26911.1316Bifidobacterium adolescentisbsh(163-1113)AAX86039.1316Bifidobacterium longumbsh(255-1208)AAF67801.1317Bifidobacterium animalis subsp. lactis Bl-04CP001515.1ACS46225.1314Bifidobacterium longum subsp. infantis ATCC 15697JQ696818.1(1-484)AFK13058.1161Bifidobacterium pseudolongum subsp. pseudolongum LMG 11571BPSP_0514(571935-572879)KFI79764.1314Bifidobacterium ruminantium DSM 6489JX880239.1(1-484)AGA16583.1161Bifidobacterium choerinum LMG 10510BCHO_1099(102731-103675)KFI57613.1314Bifidobacterium animalis subsp. lactis NRRL B-41405JQ696813.1(1-481)AFK13053.1160Bifidobacterium animalis subsp. animalis NRRL B-41406JQ696812.1(1-481)AFK13052.1160Bifidobacterium thermacidophilum subsp. porcinum LMG 21689BPORC_1117(1361683-1362633)KFJ00339.1316
目前关于不同乳酸菌胆盐水解酶的活性已有较为系统的研究,但在BSH多重同源物上的研究仍需进一步完善。LAMBERT等[16]对植物乳杆菌WCFS1的BSH研究表明,4个bsh基因的表达量会显著影响胆盐水解酶活性、底物偏好、胆盐耐受性等性质,这为其他菌种bsh基因的研究奠定了基础。LIANG等[11]通过建立乳杆菌科的BSH序列的本地数据库(BSH-SDL),根据亲缘关系将bsh基因分为5个亚型,系统地阐明了乳杆菌中BSH的分子基础,有利于高BSH活性菌株的筛选。同时,对携带多个bsh基因的菌株进行分析,发现不同种属间菌株bsh基因表达存在显著差异,而同一种属间菌株bsh基因表达差异并不显著,这也为研究BSH蛋白序列在进化关系和活性位点方面的特征以及对胆盐代谢的具体影响上开辟了新途径。
1.3 胆盐水解酶抑制剂
结合胆盐因有两亲性,具有更高效的脂肪溶解能力,而益生菌产生的 BSH可解结合胆盐不利于动物脂肪的积累[17]。因此,在畜牧业抑制BSH活性已被确定为一个潜在的既保持益生菌用作动物饲料补充剂,又调节动物体内脂质和能量平衡,以确保体质量增加的方法[6]。据报道,一些抗生素类生长促进剂(antibiotic growth promoter, AGPs)如四环素和罗沙酮,研究发现,这类抗生素可直接抑制肠道中的BSH酶活性[18]。但APGs在动物中长期使用易产生抗药性,停止使用AGPs是保护公众健康的全球趋势,因此需要发掘AGPs的有效替代品。SHELTON等[19]和LIU等[20]研究表明,铜离子(CuCl2)和锌离子(ZnSO4)是有效的BSH抑制剂,当使用高浓度的铜离子和锌离子时,可有效改善猪等家禽的生长性能和饲料效率,然而,长期使用高剂量的铜离子或锌离子容易导致铜/锌中毒及环境污染。近年,SMITH等[21]通过高通量筛选系统(high throughput screening, HTS)筛选出核黄素、咖啡酸苯乙酯等有希望的BSH抑制剂。ADHIKARI等[22]开发出一种新型BSH抑制剂的筛选系统,并鉴定出一种铅化合物GR-7,可有效抑制小鼠体内外胆盐的水解,且不会显著影响肠道细菌的生存能力。本研究为开发安全、高效率的BSH抑制剂提供了新方向。另外,加强BSH底物抑制剂的合理开发,对于膳食补充益生菌来提高动物饲料效率和生长性能具有重要意义。
2 胆盐水解酶的生理功能
2.1 营养作用
BSH水解结合胆盐可产生游离胆汁酸和氨基酸,其中,甘氨酸可代谢成氨和CO2,牛磺酸可代谢成氨、CO2和硫酸盐,可被用作碳源和氮源,具有BSH活性的菌株在生长时便可获得营养优势。HUIJGHEBAERT等[23]研究发现产BSH的梭状杆菌可利用牛磺酸作为电子受体,且在牛磺结合胆盐存在的情况下生长速度明显加快。在长双歧杆菌中也观察到,bsh基因伴随编码腺苷酰转移酶的基因glnE共转录[24]。其中,glnE基因负责参与氮元素调节的级联反应。因此,BSH的去结合胆盐作用很可能为益生菌在肠道的存活提供了营养保障。
2.2 膜特性的改变
溶菌酶、磷脂酶以及抗菌肽(例如防御素)是肠道天然免疫的重要组成部分。细菌细胞膜的组成、流动性、渗透性、疏水性和净电荷都与宿主的防御功能息息相关[25]。研究表明,BSH可促进胆固醇或胆汁酸进入细胞膜,引起膜的修饰,如增加不饱和脂肪酸的含量、改变膜的流动性,从而提高膜的柔韧性和强度[25-26]。据文献[27]报道,高浓度的胆盐会溶解磷脂并破坏细胞膜的脂质双分子层结构,BSH的存在可降低胆盐的活性,从而防止细胞膜裂解。因此,具有BSH活性的益生菌可修饰细胞膜的结构和保护细胞膜的完整性,从而增强宿主体内的免疫能力,这对抵抗病原菌引起的长期感染很重要。
2.3 胆盐解毒
结合胆盐对菌体具有较高的毒性。体外研究表明,牛磺结合胆盐通常在任何pH下对细菌细胞仅产生轻微影响,而甘氨结合胆盐在酸性pH下对细胞具有极高的毒性[28]。BSH降低结合胆盐毒性的机理主要包括:(1)将毒性较高的结合胆盐水解为毒性较弱的次级胆盐,从而降低对细菌的毒性;(2)改善结合胆盐引起的细胞内酸化。结合胆盐进入细胞后,使细胞内酸化呈现毒性,而 BSH作用产生的游离胆汁酸可转化为较弱的解离物,通过重新捕获共转运质子来防止ATP过度消耗,从而维持细胞内pH稳态[29];(3)维持胆汁酸临界胶束浓度。胆汁酸在生理条件下以离子(类固醇骨架)形式存在,当高于临界胶束浓度时会形成胶束,随着临界胶束浓度的降低,类固醇骨架的潜在膜毒性即增加[30]。而BSH可通过水解结合胆盐产生胆汁酸来维持临界胶束浓度,使菌株免于类固醇骨架诱发的细胞膜毒性。
2.4 胃肠道存活率
BSH具有解除结合胆盐毒性的能力,可提高菌株在胃肠道中的存活率。研究表明,BSH酶有助于李斯特菌和布鲁氏菌在胃肠道中的定殖[31-32]。在布鲁氏菌中,敲除bsh基因使其对胆盐更加敏感,并影响了其在肠道内的黏附性和内在化活性。最近,YANG等[4]研究发现,过表达bsh基因的植物乳杆菌,与正常植物乳杆菌相比,在小鼠胃肠道中的存活时间显著增长。微生物对宿主表面的黏附能力是影响其在胃肠道存活的一个重要指标。与敲除bsh基因的植物乳杆菌相比,BSH过表达菌株和正常菌株对Caco-2肠道细胞的粘附数量均显著增加[4]。因此,证实了BSH对于乳酸菌的存活及肠道粘附的重要性。
3 胆盐水解酶在益生菌发挥益生功能中的作用
3.1 降胆固醇
血清胆固醇升高是诱发冠心病、动脉粥样硬化等心血管疾病的主要因素[33]。可使用药物进行治疗,如他汀类及胆汁酸螯合剂等。但药物价格通常昂贵,还可能产生不良副作用,如胃肠不适等。因此,膳食补充具有调节高脂血症的益生菌是一种安全有效的替代方法,能够维持宿主的脂质水平而无不良副作用[34]。
大量研究表明,益生菌降低胆固醇的能力与BSH活性相关。MALPELIET等[35]研究表明,膳食补充低剂量罗伊氏CRL 1098发酵的酸奶(125 g, 106 CFU/d),可有效降低高胆固醇血症受试者的总胆固醇(total cholesterol, TC)和低密度胆固醇(low-density lipoprotein cholesterol, LDL-C)水平,而高密度胆固醇(high-density lipoprotein cholesterol, HDL-C)和甘油三酯(triglyceride, TG)水平没有变化。WANG等[36]研究发现,植物乳杆菌AR113和干酪乳杆菌 pWQH01可显著降低高脂小鼠血清中的TC和LDL-C水平及动脉粥样硬化指数(atherosclerosis index, AI)。并且,还能调节与胆固醇代谢相关基因的表达来降低胆固醇水平,包括抑制肝FXR和小异二聚体伴侣(small heterodimer partner, SHP)基因的表达来抑制胆固醇的合成吸收,促进CYP7A1、肝X受体(liver X receptor, LXR)和低密度脂蛋白受体(low-density lipoprotein receptor, LDLR)基因的表达来增加肠道胆固醇排泄。GUO等[37]通过建立高血脂模型,得出了与WANG等[36]相似的结论,即发现植物乳杆菌KLDS 1.0344能够显著改善脂质在血清和肝脏中分布,并增加大鼠粪便TC和总胆汁酸水平。但在调节胆固醇代谢相关基因的表达方面又有了新的发现,即KLDS 1.0344菌株可抑制肝HMGCR和肠NPC1L1基因的表达,促进肠LXRα、ABCG5、ABCG8和ABCA1基因的表达[37]。
其他研究指出,胆盐水解生成的游离胆汁酸重吸收效率较低,可随粪便大量排出体外[38]。同时,次级胆盐在肠道中对脂质的溶解和吸收效率较低,需要消耗更多胆固醇来从头增加胆汁酸的合成,从而降低了血清中胆固醇的水平[39]。此外,游离胆汁酸与胆固醇在肠道形成复合物共沉淀,随粪便排出体外也是降低胆固醇含量的途径之一[40](图2)。
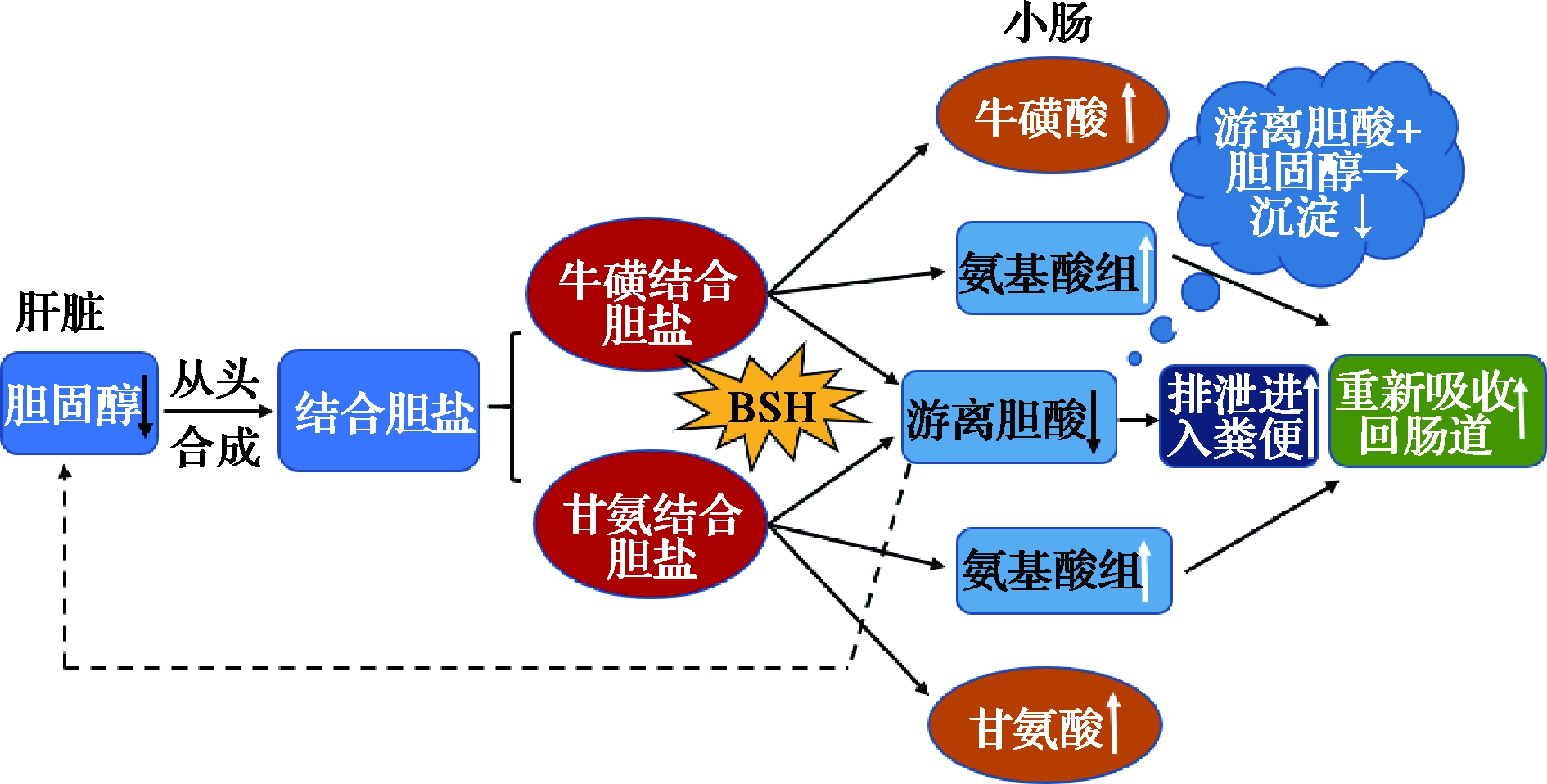
图2 胆盐水解酶降胆固醇的作用途径
Fig.2 The pathways of lowering cholesterol by bile salt hydrolase
上述研究表明了BSH在调节胆固醇代谢途径中的具体机制,证实了BSH在降胆固醇水平上中发挥的作用和效果。因此,筛选高BSH活性的益生菌对降胆固醇的临床应用具有重要意义。
3.2 益生菌定殖
BSH可提高益生菌在胃肠道的定殖能力,作用分为以下2个方面:
一方面,BSH有助于益生菌在胃肠道长期定殖。YANG等[4]将植物乳杆菌进行编辑,构建了BSH过表达型菌株和BSH缺失型菌株,探究了3株菌对Caco-2细胞的黏附能力,证实了BSH活性强弱与菌株对肠细胞的吸附数量呈正相关。这也印证了BSH对菌株在肠道的定殖具有十分重要的作用。另一方面,BSH可通过介导对胆汁酸的抗性而促进益生菌对胃肠道的定殖。JONES[41]将bsh基因在李斯特菌中表达,与正常菌株相比,表达BSH的李斯特菌在胆汁酸环境中的存活率显著增加(约1.5个lg CFU),证实了BSH在体外介导胆汁酸耐受性。进一步评估菌株在小鼠肠道中的存活能力,表达BSH的李斯特菌与正常李斯特菌相比存活率呈现了一定程度的增加。虽然增幅很小,但可能在新宿主肠道的定殖过程中产生重大影响。因此,BSH可提高益生菌菌株的胆盐抗性及黏附特性,有助于益生菌在肠道的定殖,这对于功能性菌株的开发挖掘具有推动作用。
3.3 缓解炎症性肠病
溃疡性结肠炎和克罗恩病是2种主要的炎症性肠病(inflammatory bowel disease,IBD),以胃肠道的慢性和复发性炎症为特征[42]。IBD患者的典型症状包括腹痛、腹泻、便血、食欲不振、疲劳及体重减轻等[43]。IBD的确切原因尚未清楚,现有的IBD治疗方法包括外科手术治疗和药物治疗,治疗药物包括氨基糖皮质激素药物、水杨酸、生物制剂和免疫抑制剂等。然而,这些药物治疗具有强烈的副作用并不适合长期治疗[44]。近年来,益生菌被认为是治疗IBD的有效且安全的辅助疗法[45]。
相关报道显示,IBD中肠道微生物失衡或“营养不良”,可对宿主的新陈代谢产生影响[46]。DUBOC等[47]研究发现,IBD患者中微生物酶活性受损可导致胆汁酸代谢受损,特征为胆盐无法水解、转化和脱硫。而肠腔内胆盐代谢异常会增强肠道上皮炎症反应,从而使IBD恶化(图3)。此外,肠腔中结合胆盐浓度过高,还易诱发艰难梭菌等病原菌的产生[48]。
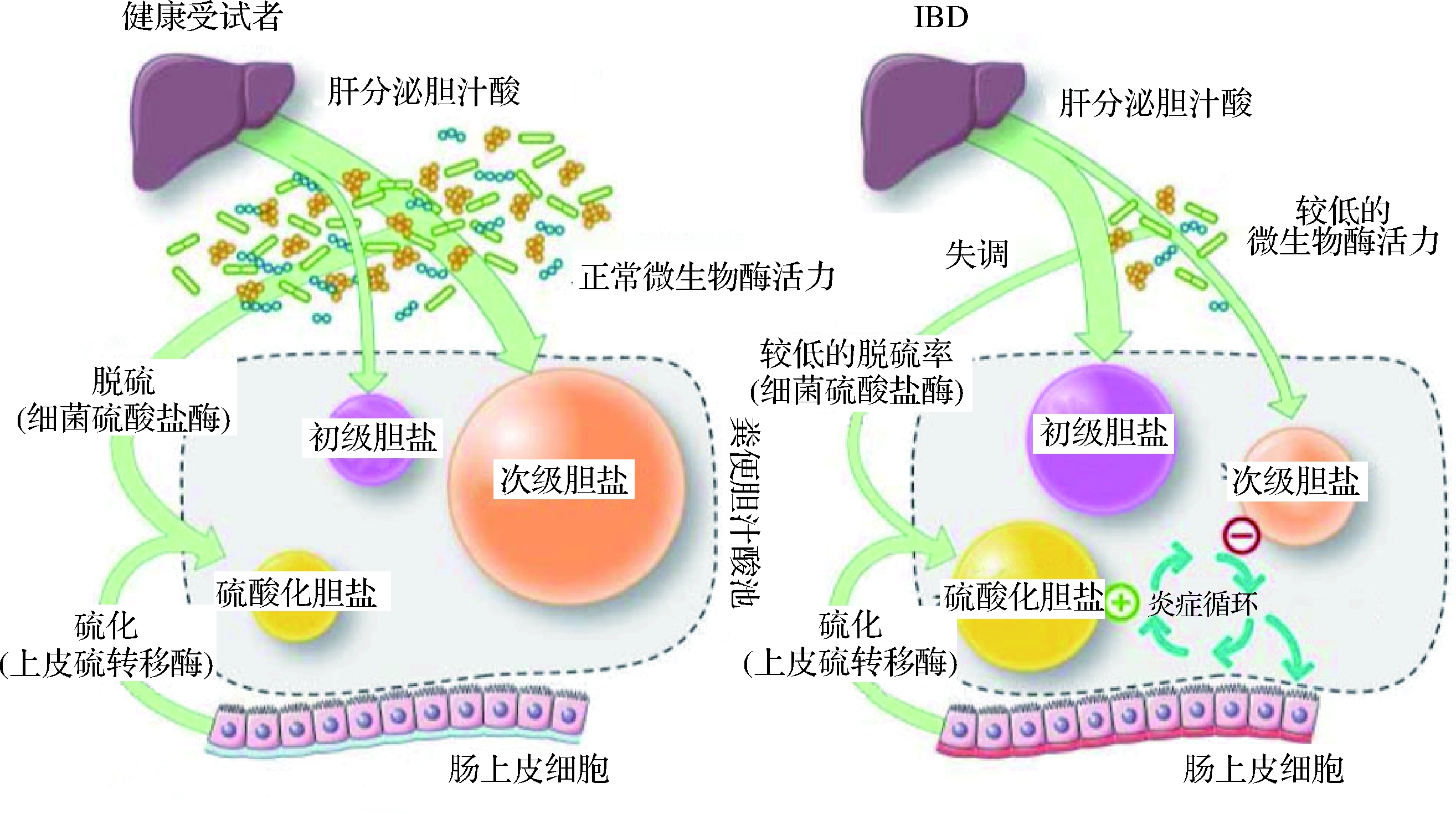
图3 炎症性肠病中胆汁酸代谢异常的生理病理模型
Fig.3 Physiological and pathological model of abnormal bile acid metabolism in inflammatory bowel disease
目前,已有研究表明,植物乳杆菌AR113可有效缓解葡聚糖硫酸钠引起的结肠损伤,包括调节肠道免疫反应维持上皮屏障的完整性,改善肠道菌群失调,抑制TLR4/MyD88/NF-κB通路的表达,并降低促炎因子(TNF-α、IL-1β和IL-6)的表达量[49]。对植物乳杆菌AR113进行基因组测序,分析表明其具有4个bsh基因(bsh1、bsh2、bsh3和bsh4)。据此推测,胆盐水解酶负责胆盐代谢途径的第1步,可催化介导胆汁酸的生成,摄入具有BSH活性的益生菌能够促进肠道内胆盐的生物转化,进而缓解肠道内高剂量胆盐引起的炎症反应,这对于缓解IBD等相关疾病具有指导意义。
4 展望
目前已对BSH的结构、活性位点及底物偏好作了较为系统的研究,对BSH的生理特性及分布的了解也越来越全面。BSH可赋予益生菌胆盐抗性,利于其在顺利到达胃肠道后发挥更广泛的益生作用。并且大量研究表明,BSH参与益生菌和宿主代谢途径的复杂调控机制,如介导胆汁酸代谢、调控胆固醇合成途径和维持肠道菌群稳态等,将宿主代谢与人类的各种生理病理状况联系在一起,从而在改善人类健康中发挥重要作用。进一步表明了具有BSH活性的益生菌可通过介导胆汁酸代谢将宿主肠道和肝脏之间联系起来,为治疗相关疾病提供了可能性。
为了更好地了解BSH的功能,未来需要对益生菌中多个BSH基因、BSH蛋白结构和遗传调控方面进行解析,进一步确定胆盐水解酶在益生菌中所发挥的具体作用,为具有BSH活性的益生菌在食品及功能保健品中的应用提供理论基础。此外,还需研究利用基因编辑技术和蛋白组学技术,更简单、快速地找到或构建高BSH活性的益生菌株,通过干预饮食的方法来控制胆固醇、高血脂、糖尿病、肥胖症,缓解炎症性肠病等症状,这对于全面解决和理解BSH作为临床工具具有深远意义。
[1] GEORGE KERRY R, PATRA J K, GOUDA S, et al. Benefaction of probiotics for human health: A review [J]. J Food Drug Anal, 2018, 26(3): 927-939.
[2] 吴蜀豫, 陆冉. FAO/WHO《食品益生菌评价指南》[J]. 中国食品卫生杂志, 2003, 15(4): 377-379.
[3] RAM REZ-PÉREZ O, CRUZ-RAM
REZ-PÉREZ O, CRUZ-RAM N V, CHINCHILLA-L
N V, CHINCHILLA-L PEZ P, et al. The role of the gut microbiota in bile acid metabolism [J]. Annals of Hepatology, 2017, 16: 15-20.
PEZ P, et al. The role of the gut microbiota in bile acid metabolism [J]. Annals of Hepatology, 2017, 16: 15-20.
[4] YANG Y, LIU Y, ZHOU S, et al. Bile salt hydrolase can improve Lactobacillus plantarum survival in gastrointestinal tract by enhancing their adhesion ability [J]. Fems Microbiology Letters, 2019, 366(8): 1-8.
[5] ADEBOLA O O, CORCORAN O, MORGAN W A. Prebiotics may alter bile salt hydrolase activity: Possible implications for cholesterol metabolism [J]. Pharma Nutrition, 2020: 12.DOI:10.1016/j.phanu.2020.10018.2.
[6] DONG Z, LEE B H. Bile salt hydrolases: Structure and function, substrate preference, and inhibitor development [J]. Protein Science, 2018, 10: 1 742-1 754.
[7] STELLWAG E J, HYLEMON P B. Purification and characterization of bile salt hydrolase from Bacteroides fragilis subsp [J]. Biochimica Et Biophysica Acta, 1976, 452(1): 165-176.
[8] ELKINS C A, MOSER S A, SAVAGE D C. Genes encoding bile salt hydrolases and conjugated bile salt transporters in Lactobacillus johnsonii 100-100 and other Lactobacillus species [J]. Microbiology, 2001, 147(12): 3 403.
[9] BI J, FANG F, LU S, et al. New insight into the catalytic properties of bile salt hydrolase [J]. Journal of Molecular Catalysis B Enzymatic, 2013, 96: 46-51.
[10] SURESH C G, PUNDLE A V, SIVARAMAN H, et al. Penicillin V acylase crystal structure reveals new Ntn-hydrolase family members [J]. Nat Struct Biol, 1999, 6(5): 414-416.
[11] LIANG L, YI Y, LV Y, et al. A comprehensive genome survey provides novel insights into bile salt hydrolase (BSH) in Lactobacillaceae [J]. Molecules, 2008, 23(5):1 157.
[12] CHAND D, AVINASH V S, YADAV Y, et al. Molecular features of bile salt hydrolases and relevance in human health [J]. Biochimica Et Biophysica Acta General Subjects, 2016, 1861(1): 2 981-2 991.
[13] MCAULIFFE O, CANO R J, KLAENHAMMER T R. Genetic analysis of two bile salt hydrolase activities in Lactobacillus acidophilus NCFM [J]. Applied and Environmental Microbiology, 2005, 71(8): 4 925-4 929.
[14] OZTURK M, ONAL C, BA N M. Critical F129 and L138 in loop III of bile salt hydrolase (BSH) in Lactobacillus plantarum B14 are essential for the catalytic activity and substrate specificity [J]. Food Biotechnology, 2019, 33(4): 325-337.
[15] XIONG Z Q, WANG Q H, KONG L H, et al. Short communication: Improving the activity of bile salt hydrolases in Lactobacillus casei based on in silico molecular docking and heterologous expression [J]. J Dairy Sci, 2017, 100(2): 975-980.
[16] LAMBERT J M, BONGERS R S, DE VOS W M, et al. Functional analysis of four bile salt hydrolase and penicillin acylase family members in Lactobacillus plantarum WCFS1 [J]. Appl Environ Microbiol, 2008, 74(15): 4 719-4 726.
[17] 王政, 张大伟. 某些抗生素类生长促进剂和胆盐水解酶抑制剂作用机制 [J]. 中国畜牧杂志, 2016, 52(10): 38-42.
[18] LIN J. Antibiotic growth promoters enhance animal production by targeting intestinal bile salt hydrolase and its producers [J]. Front Microbiol, 2014, 5: 33.
[19] SHELTON N W, TOKACH M D, NELSSEN J L, et al. Effects of copper sulfate, tri-basic copper chloride, and zinc oxide on weanling pig performance [J]. J Anim Sci, 2011, 89(8): 2 440-2 451.
[20] LIU Z H, LU L, LI S F, et al. Effects of supplemental zinc source and level on growth performance, carcass traits, and meat quality of broilers [J]. Poult Sci, 2011, 90(8): 1 782-1 790.
[21] SMITH K, ZENG X, LIN J. Discovery of bile salt hydrolase inhibitors using an efficient high-throughput screening system [J]. PLoS One, 2014, 9(1): e85344.
[22] ADHIKARI A A, SEEGAR T C M, FICARRO S B, et al. Development of a covalent inhibitor of gut bacterial bile salt hydrolases [J]. Nature Chemical Biology, 2020: 318-326.DOI:10.1038/s41589-o20-0467-3.
[23] HUIJGHEBAERT S M, MERTENS J A, EYSSEN H J. Isolation of a bile salt sulfatase-producing Clostridium strain from rat intestinal microflora [J]. Appl Environ Microbiol, 1982, 43(1): 185-192.
[24] VAN E J, CELIS P, DE P G, et al. Tauroconjugation of cholic acid stimulates 7 alpha-dehydroxylation by fecal bacteria [J]. Appl Environ Microbiol, 1996, 62(2): 656-661.
[25] BEGLEY M, HILL C, GAHAN C G. Bile salt hydrolase activity in probiotics [J]. Appl Environ Microbiol, 2006, 72(3): 1 729-1 738.
[26] AXMANN M, STROBL W M, PLOCHBERGER B, et al. Cholesterol transfer at the plasma membrane [J]. Atherosclerosis, 2019, 290: 111-117.
[27] BUSTOS A Y, FONT DE VALDEZ G, FADDA S, et al. New insights into bacterial bile resistance mechanisms: the role of bile salt hydrolase and its impact on human health [J]. Food Research International, 2018, 112: 250-262.
[28] BEGLEY M, SLEATOR R D, GAHAN C G, et al. Contribution of three bile-associated loci, bsh, pva, and btlB, to gastrointestinal persistence and bile tolerance of Listeria monocytogenes [J]. Infect Immun, 2005, 73(2): 894-904.
[29] BUSTOS A Y, SAAVEDRA L, VALDEZ G F D, et al. Relationship between bile salt hydrolase activity, changes in the internal pH and tolerance to bile acids in lactic acid bacteria [J]. Biotechnology Letters, 2012, 8: 1 511-1 518.
[30] GARIDEL P H A, KNAUF K, ET AL. Membranolytic activity of bile salts influence of biological membrane properties and composition [J]. Molecules, 2007, 12(10): 2 292-2 326.
[31] DUSSURGET O, CABANES D, DEHOUX P, et al. Listeria monocytogenes bile salt hydrolase is a PrfA-regulated virulence factor involved in the intestinal and hepatic phases of listeriosis [J]. Mol Microbiol, 2002, 45(4): 1 095-1 106.
[32] DELPINO M V, MARCHESINI M I, ESTEIN S M, et al. A bile salt hydrolase of Brucella abortus contributes to the establishment of a successful infection through the oral route in mice [J]. Infection and Immunity, 2007.DOI:10.1128/IAI.00952-06.
[33] CHIEN Y L, WU L Y, LEE T C, et al. Cholesterol-lowering effect of phytosterol-containing Lactic-fermented milk powder in hamsters [J]. Food Chemistry, 2010, 3: 1 121-1 126.
[34] KHARE A, GAUR S. Cholesterol-lowering effects of Lactobacillus species [J]. Current Microbiology, 2020, 4: 638-644.
[35] MALPELIET A, TARANTO2 M P, CRAVERO3 R C, et al. Effect of daily consumption of Lactobacillus reuteri CRL 1098 on cholesterol reduction in hypercholesterolemic subjects [J]. Food and Nutrition Sciences, 2015,17: 1 583-1 590.
[36] WANG G, HUANG W, XIA Y, et al. Cholesterol-lowering potentials of Lactobacillus strain overexpression of bile salt hydrolase on high cholesterol diet-induced hypercholesterolemic mice [J]. Food and Function, 2019, 10(3): 1 684-1 695.
[37] GUO L, WANG L, LIU F, et al. Effect of bile salt hydrolase-active Lactobacillus plantarum KLDS 1.0344 on cholesterol metabolism in rats fed a high-cholesterol diet [J]. Journal of Functional Foods, 2019:61.DOI:10.1016/jff.2019.103497.
[38] LIANG X, LV Y, ZHANG Z, et al. Study on intestinal survival and cholesterol metabolism of probiotics [J]. LWT, 2020: 124.DOI:10.1016/j.lwt.2020.109132.
[39] TSAI C C, LIN P P, HSIEH Y M, et al. Cholesterol-lowering potentials of lactic acid bacteria based on bile-salt hydrolase activity and effect of potent strains on cholesterol metabolism in vitro and in vivo [J]. Scientific World Journal, 2014, 2014: 690 752.
[40] LE B, YANG S H. Identification of a novel potential probiotic Lactobacillus plantarum FB003 isolated from salted-fermented shrimp and its effect on cholesterol absorption by regulation of NPC1L1 and PPARalpha [J]. Probiotics Antimicrob Proteins, 2019, 11(3): 785-793.
[41] JONES B V, BEGLEY M, HILL C, et al. Functional and comparative metagenomic analysis of bile salt hydrolase activity in the human gut microbiome [J]. Proc Natl Acad Sci USA, 2008, 105(36): 13 580-13 585.
[42] BERNSTEIN C N, ELIAKIM A, FEDAIL S, et al. World gastroenterology organisation global guidelines inflammatory bowel disease [J]. J Clin Gastroenterol, 2016, 50(10): 803-818.
[43] PALUMBO V D, ROMEO M, MARINO GAMMAZZA A, et al. The long-term effects of probiotics in the therapy of ulcerative colitis: A clinical study [J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2016, 160(3): 372-377.
[44] YOUNGE L. An overview of inflammatory bowel disease [J]. Nurs Stand, 2019, 34(1): 75-82.
[45] CURRO D, IANIRO G, PECERE S, et al. Probiotics, fibre and herbal medicinal products for functional and inflammatory bowel disorders [J]. Br J Pharmacol, 2017, 174(11): 1 426-1 449.
[46] ABRAHAM B P, QUIGLEY E M M. Probiotics in inflammatory bowel disease [J]. Gastroenterol Clin North Am, 2017, 46(4): 769-782.
[47] DUBOC H, RAJCA S, RAINTEAU D, et al. Connecting dysbiosis, bile-acid dysmetabolism and gut inflammation in inflammatory bowel diseases [J]. Gut, 2013, 62(4): 531-539.
[48] THANISSERY R, WINSTON J A, THERIOT C M. Inhibition of spore germination, growth, and toxin activity of clinically relevant C. difficile strains by gut microbiota derived secondary bile acids [J]. Anaerobe, 2017: 86-100.DOI:10.1016/j.jff.2020.103854.
[49] XIA Y J, CHEN Y, YANG J, et al. Lactobacillus plantarum AR113 alleviates DSS-induced colitis by regulating TLR4/MyD88/NF-κB pathway and gut microbiota composition [J]. Journal of Functional Foods, 2019,10(5):543-553.