丁酸梭菌最初由日本千叶县医学院卫生系Ichiro Ichiji博士于1933年从粪便中分离出来。因此,它也被称为宫乳菌[1]。在1877年首次记载和描述了丁酸梭菌。在以前的研究中,不同学者对这些物种进行了不同的描述和命名。直到1980年,它们才正式被命名为丁酸梭菌(Clostridium butyricum)[2],又名丁酸梭状芽孢杆菌(Clostridium butyricum)或丁酸菌(butyric acid bacteria)。主要存在于人类和动物肠道、天然酸奶、粪便和奶酪中,是一种益生菌,在医药、兽药和饲料工业领域得到广泛的应用。
随着抗生素的大量使用,其弊端也逐渐显露出来,比如导致动物胃肠道的正常菌群失调,产生耐药性和药物残留等副作用,尤其是奶、肉、蛋产品中残留的大量抗生素会大大地降低畜产品的质量,而残留的药物随着食物链进入人体,进而严重影响人类的健康[3-4]。因此,寻找一种能够替代抗生素的产品用于养殖业已成为目前研究的热点。微生态制剂作为一种潜在的新型绿色环保制剂,具有无毒副作用、无药物残留、无耐药性等特点,逐渐引起了国内外学者的兴趣和重视。本文通过对丁酸梭菌的相关生理功能及代谢特征进行阐述,并对其在食品生产中的应用进行分析和展望。
1 丁酸梭菌的生物学性状及其生理功能
1.1 丁酸梭菌的生物学性状
丁酸梭菌是一种梭状革兰氏阳性细菌,严格厌氧,在生长过程中产生酸和气体,并形成内生孢子[5];大小为(2.4~7.6) μm×(0.5~1.7) μm,两端钝,中间部分稍微肿胀;可单独或成对存在,呈直杆状或稍弯曲形态;菌体通常会形成椭圆形或圆形孢子,偏心或次端生,形成芽孢后菌体的末端膨大呈梭形[6],其菌落在显微镜和平板的形态如图1所示。丁酸梭菌在厌氧培养过程中产酸产气,最初的培养液稍微浑浊,稍后形成更多的沉淀。37 ℃下在固体培养基上划线培养24 h后,能够观察到直径为1.2~3 mm的菌落,菌落通常呈圆形、边缘整齐、表面潮湿光滑、不透明、略带酸味[7]。丁酸梭菌在生长过程中,可以利用碳水化合物,如纤维二糖、葡萄糖、蔗糖和乳糖,但不能利用半乳糖醇山梨糖和半乳糖醇。它还可以产生多种酶,如淀粉酶、脂肪酶、糖苷酶、蛋白酶等,最显著的是淀粉酶。丁酸梭菌通过发酵水解各种碳水化合物的最终代谢产物主要是丁酸和乳酸,还检测到少量的乙酸、乙醇、丁醇、氢等产物[8]。

a-显微镜下经革兰氏染色的丁酸梭菌;b-平板划线的丁酸梭菌
图1 丁酸梭菌在显微镜和RCM培养基上的菌落形态
Fig.1 Olony morphology of C. butyricum on microscope and RCM medium
1.2 丁酸梭菌的代谢机制
作为严格厌氧菌,在厌氧条件下,丁酸梭菌将大量的大分子有机物水解并产生许多复杂的生化反应,综合有关丁酸梭菌发酵代谢的研究,其主要生化反应途径见图2。

1-己糖激酶;2-6磷酸果糖激酶-1;3-醛缩酶;4-烯醇化酶;5-丙酮酸激酶;6-丙酮酸脱氢酶;7-氢化酶;8-铁氧还原蛋白氧化还原酶;9-硫解酶;10-三羟丁酰-CoA脱氢酶;11-巴豆酶;12-丁酸磷酸转移酶;13-丁酸激酶;14-乙醛脱氢酶;15-乙醇脱氢酶;16-乙酰磷酸转移酶;17-乙酸激酶;18-丙酮酸脱氢酶;19-柠檬酸缩合酶;20-顺乌头酸酶;21-异柠檬酸脱氢酶;22-磷酸烯醇式丙酮酸羧化酶;23-琥珀酰-COA合成酶;24-谷氨酸=脱羧酶;25-γ-氨基丁酸转氨酶;26-甘油脱氢酶;27-二羟丙酮激酶;28-甘油脱水酶;29-1,3-丙二醇脱氢酶
图2 丁酸梭菌生化反应中的主要代谢途径[9-13]
Fig.2 Main metabolic pathways in biochemical reaction of C. butyricum[9-13]
主要代谢途径:
(1)EMP途径。糖酵解途径是所有微生物利用葡萄糖代谢所共同经历的阶段,丁酸梭菌通过转移酶系统将葡萄糖由胞外转移进胞内,再通过磷酸化形成6-磷酸葡萄糖,然后被分解生成磷酸烯醇式丙酮酸(phosphoenolpyruvate, PEP)和丙酮酸并产生ATP。
(2)不完全三羧酸循环(tricarboxylic acid cycle, TCA)。在厌氧条件下,丁酸梭菌通过EMP产生的PEP与CO2经磷酸烯醇式丙酮酸羧化激酶催化形成草酰乙酸进入TCA循环的氧化支路和还原支路,生成α-酮戊二酸和琥珀酸,但由于丁酸梭菌缺少琥珀酸脱氢酶和琥珀酰-CoA,故使反应中断,形成了不完全的TCA循环[9]。
(3)脂肪酸代谢。丁酸梭菌发酵过程中会产生大量短链脂肪酸(short chain fatty acids, SCFA)和部分长链脂肪酸, 这些短链脂肪酸主要是丁酸梭菌在厌氧条件下通过其产生的胞外酶将低聚糖、多糖等不易被结肠消化的碳水化合物水解成单糖,这些小分子单糖进入细胞的胞浆,通过酶的作用进行糖酵解途径,从而转化成短链脂肪酸。在糖酵解途径中丙酮酸产生阶段,少部分的丙酮酸在乳酸脱氢酶的作用下氧化NADH并产生乳酸。产生丙酮酸的同时会生成铁氧还原蛋白氧化还原酶,该酶能催化丙酮酸产生乙酰-CoA和CO2,该酶对O2敏感,故厌氧程度是决定丁酸梭菌发酵的关键因素。一部分乙酰-CoA经乙酰磷酸转移酶催化生成乙酰磷酸,再通过乙酸激酶催化生成乙酸和ATP,同时合成了少量甲酸,还有一部分乙酰-CoA经硫解酶、3-羟丁酰辅酶脱氢酶、丁酸磷酸转移酶和丁酸激酶的催化,形成丁酸。长链脂肪酸与甘油均可被用于合成脂类物质。
(4)醇代谢。在丙酮酸转化为乙酰-CoA阶段,少部分乙酰-CoA会生成乙醇并伴随着NADH向NAD+转化。当甘油作为唯一碳源时,丁酸梭菌利用甘油脱氢酶将甘油转化为二羟丙酮,再形成丙酮酸进入糖酵解途径,从而获取能量以供其生长,另一方面甘油被以VB12为辅酶的甘油脱水酶还原为1,3-丙二醇,此部分所需的NADH由糖酵解途径提供。若在有氧情况下,丁酸梭菌会消耗大量NADH,使得甘油还原为1,3-丙二醇的过程更加难以获取NADH,从而会使1,3-丙二醇产量降低,所以目前大多采用厌氧发酵方式利用丁酸梭菌生产1,3-丙二醇。
(5)氢代谢。丁酸梭菌在产生丙酮酸阶段,此处过剩的NADH会被氢化酶利用,催化FdH2生成Fd和电子,同时H+接受电子产生H2。有研究表明,在氢化酶处理大量H+的过程中,丁酸梭菌为了防止细胞质的酸化,也会利用部分H+通过固氮酶将N2转化为氨态氮,这一过程也会产生副产物H2[10]。
(6)氨基酸代谢。有研究表明,在主成分分析(principal component analysis, PCA)中,检测到大量潜在物质,其中除一些脂肪酸外,还存在4-羟基丁酸、L-焦谷氨酸、L-丙氨酸等,它们在1,3-丙二醇的生成和NAD+/NADH的合成中发挥了平衡作用[11]。
2 丁酸梭菌代谢产物在食品加工中的应用
丁酸梭菌不光有强大的生理功能,它的代谢产物对我们的肠道也具有显著的健康疗效,这些益生代谢产物给食品生产和加工带来了新的契机。
2.1 食品风味添加剂
2.1.1 丁酸用于强化食品风味
丁酸梭菌最典型的代谢产物就是短链脂肪酸,主要有丁酸、乙酸、乳酸,还有少量的甲酸和丙酸等[14]。丁酸梭菌产生的丁酸通过给消化道黏膜上皮细胞供能而促进其增殖,还可以修复损伤的肠道并促进其上皮组织的再生[15-16]。丁酸虽然气味难闻,但仍作为重要的风味成分在食品生产中被广泛应用[17]。同时丁酸也是食品工业中重要的风味物质,被用作强化食品中的黄油味[18],丁酸酯也被用作增强水果香味的添加剂和生产香水的芳香化合物[19-20],如丁酸丁酯可用以配制苹果香型和奶油香型等香精[21],具有梨的香味,存在于香蕉、梨、可可豆中。丁酸乙酯在自然界中存在于许多植物的果实中,用于配制菠萝、葡萄、草莓等水果香型的食用香精,其中橘子中所含丁酸乙酯相对较高。香叶醇与丁酸结合形成的丁酸香叶酯是应用较频繁的萜类香料,用于玫瑰、香叶、薰衣草等香精的调和香料[22]。在传统的中国香型白酒生产中,丁酸菌在窖泥中发酵产生的丁酸转化为丁酸乙酯,是中国香型白酒的重要香味成分[23]。
2.1.2 1,3-丙二醇(1,3-PDO)用作增甜剂和保湿剂
1,3-丙二醇(1,3-propanediol)是丁酸梭菌通过甘油代谢途径产生的一种副产物,作为一种重要的化工中间体,被广泛应用于食品、化妆、医药等领域[24],它可以作为一种调味剂、表面活性剂,为调味化合物提供一定溶解度。其他用途还包括加工助剂和保湿剂。它被批准用于不同的食品,如调味料和香料、糖果、酒精饮料和冷冻乳制品。丙二醇可为食品减苦增甜,替代石油基载体和添加剂,降低水分活度,并具有保湿功能[25]。1,3-PDO可采用传统的对丙烯醛水合酶转化,也可采用甘油的酶转化[26]。一些微生物可利用甘油作为原料产1,3-PDO,如克雷伯氏肺炎杆菌、丁酸梭菌等,其发酵条件温和,环境污染小,不失为一种具有潜力的生产1,3-PDO的方法。同时利用分子生物学的手段,如基因工程等可大大提高1,3-PDO的生产效率及产量。杨苗苗[27]采用等离子体(atmospheric and room temperature plasma, ARTP)和亚硝基胍(1-methyl-3-nitro-1-nitrosoguanidine, NTG)结合诱变获得了对1,3-PDO具有高耐受性的菌株,通过优化甘油发酵的条件,与原始菌株相比,诱变后的菌株耐受性提高了30.8%,产量、产率、生产强度分别提高了29.48%、18%和29%。HORNG等[28]将肺炎克雷伯菌甘油脱氢酶和二羟丙酮激酶基因分别进行同源重组后利用工程菌进行发酵,结果与原菌株相比,工程菌中乳酸、2,3-PDO以及乙醇的积累现象得到了消除,此外,甘油脱氢酶和1,3-PDO脱氢酶的表达使得1,3-PDO产量提高。另外通过构建微生物菌群,混菌发酵生产1,3-PDO也是一种具有潜力的生产方法。
2.2 食品防腐
2.2.1 丁酸用于肉类防腐
丁酸梭菌可调节肠道菌群并促进肠道微生态平衡。肠内有大量的微生物,在正常情况下各种微生物之间保持平衡状态。一旦肠道菌群失衡就会出现各种疾病。丁酸梭菌是肠道中正常存在的微生物,可以在服用后维持或纠正肠道菌群失衡,减少肠毒素产生并促进肠道微生态平衡,它能够产生丁酸、乙酸、乳酸等短链脂肪酸,能抑制巴氏杆菌、大肠杆菌等肠道有害菌生长,促进肠道其他益生菌的生长,如双歧杆菌和乳酸菌[29]。DHAKAL等[30]探究了NaHSO4、乳酸、H3PO4、有机酸与NaHSO4组合对鸡脂肪和水中沙门氏菌的影响。结果表明,NaHSO4与有机酸复合使用时,沙门氏菌在较低的NaHSO4浓度下得到了抑制,说明这些化学物质可能具有协同作用。结果表明,添加5 g/L的NaHSO4和乳酸组合或NaHSO4与有机酸单独或联合使用,可以减少在储存和运输过程中残留水污染的鸡肉脂肪中的沙门氏菌。
2.2.2 细菌素用于食品防腐
丁酸梭菌还会产生细菌素,细菌素是由核糖体合成的具有抗菌和抗癌作用的小分子多肽。因此,细菌素具有良好的抑制多种病原微生物和食品腐败菌生长的作用[31-32]。丁酸梭菌作为一种益生菌也具有一定的抑菌特性,有实验证明丁酸梭菌的抑菌活性不仅仅来源于它产生的酸,其中也有多肽类物质。CLARKE等[33]很早就从丁酸梭菌中提取到了细菌素(7423),对巴氏杆菌有杀伤作用,通过蛋白酶处理后巴氏杆菌的活性仍然不可逆转。利用放射性标记法标记了巴氏杆菌的DNA,发现加入丁酸菌素后,巴氏杆菌DNA复制停止。贾丽楠[34]对丁酸梭菌的益生性能进行了体外实验,结果表明,丁酸梭菌发酵上清液中发挥抑菌作用的物质并非有机酸和H2O2,其中含有能被胰蛋白酶、蛋白酶K水解的多肽链,说明丁酸梭菌能产生抑制大肠杆菌、金黄色葡萄球菌等革兰氏阴性菌的多肽类物质。王腾浩等[35]筛选到丁酸梭菌并进行了体外抑菌试验,通过酸排,以及H2O2酶和蛋白酶(胰蛋白酶、蛋白酶K)处理后,发现发酵上清液经蛋白酶处理后抑菌圈消失,说明起抑菌作用的是蛋白质类。细菌素差别于抗生素,其可通过多种方式抑菌和杀菌。这些作用机制大致分为2类:一类是细菌素通过细胞膜进入胞内,影响DNA、RNA或蛋白质等物质的复制与表达;另一类是细菌素破坏细胞膜的完整性来抑菌和杀菌。近年来细菌素因其稳定、无残留、低毒,在食品领域具有广泛的应用潜力。细菌素在食品防腐方面的应用主要包括2种形式:一种方式是添加纯化的细菌素,另一种方式是直接在食品中添加产细菌素的益生菌[36]。
2.3 食品抗氧化
除了产生短链脂肪酸外,丁酸梭菌与乳酸菌等益生菌类似,也会产生胞外多糖(exopoly sacch arides, EPS),胞外多糖大多是由半乳糖、甘露糖、葡萄糖组成的植物脂多糖,目前研究较多的是乳酸菌属,胞外多糖具有重要的流变特性,可赋予某些食品特殊的质构[37]。胞外多糖具有生物免疫活性、抗肿瘤、抗氧化等作用[38]。刘逸凡等[39]通过优化丁酸梭菌的培养基,筛选出了1株高产胞外多糖的丁酸梭菌RO-07, 对其EPS的抗氧化特性进行研究,发现终质量浓度为0.33 mg/mL的EPS对·OH的清除率达到75.2%,对![]() 清除率达到95%,具有很强的抗氧化性。这充分说明了丁酸梭菌产生的胞外多糖具有很强的抗氧化性,可作为食品的抗氧化剂。向蓉等[40]利用龙眼多糖发酵丁酸梭菌,生物量有了显著提高,发酵后丁酸梭菌的活菌数能保持在13×106 CFU/mL以上,比不添加龙眼多糖的活菌量增长了2.8倍,且发酵液中多糖含量由1 439.21 mg/mL上升到了1 903.86 mg/mL,也有了显著的增加。通过分析发现,多糖含量的增加是由于丁酸梭菌发酵龙眼多糖,通过生物转化合成了更多的胞外多糖,这也证实了胞外多糖具有强抗氧化性,且能增强益生菌的生长以及抗应激能力。
清除率达到95%,具有很强的抗氧化性。这充分说明了丁酸梭菌产生的胞外多糖具有很强的抗氧化性,可作为食品的抗氧化剂。向蓉等[40]利用龙眼多糖发酵丁酸梭菌,生物量有了显著提高,发酵后丁酸梭菌的活菌数能保持在13×106 CFU/mL以上,比不添加龙眼多糖的活菌量增长了2.8倍,且发酵液中多糖含量由1 439.21 mg/mL上升到了1 903.86 mg/mL,也有了显著的增加。通过分析发现,多糖含量的增加是由于丁酸梭菌发酵龙眼多糖,通过生物转化合成了更多的胞外多糖,这也证实了胞外多糖具有强抗氧化性,且能增强益生菌的生长以及抗应激能力。
微生物产生的胞外多糖在工业中的应用是一个热点话题,目前乳酸菌胞外多糖已广泛应用于乳制品行业,在改善乳制品的增稠性和乳化的同时,减少了协同作用。也起到了增加食品黏度的功能[42],目前有关丁酸梭菌产胞外多糖的研究较少,以上的文献资料均未说明丁酸梭菌产生的胞外多糖组成成分及其结构,有待进一步研究。
2.4 维生素强化产品
丁酸梭菌能产生丰富的维生素,有研究表明,丁酸梭菌产品中VB2、VB6、VB12、叶酸和VC的含量高于空白,这些维生素的含量与健康人血液中的含量相当[43]。VB6缺乏会导致癫痫、贫血、抑郁、湿疹、消化系统紊乱、思维混乱和视觉障碍,同时会导致一些遗传代谢紊乱。LI等[44]筛选出胞外产VB12的乳杆菌菌株并对其环境胁迫、胃酸和胆盐的耐受性进行研究。植物乳杆菌LZ95和CY2的胞外VB12产量较高,分别为(98±15)g/L和(60±9) g/L。在胃酸和胆盐的胁迫下,表现出良好的耐受性。
农业废弃物的木质纤维素生物质中含有大量的VB化合物,但这些水溶性维生素在木质纤维素预处理或脱毒过程中容易进入废水排放。HAN等[45]证明了秸秆酸预处理和生物解毒工艺可以保留大量的VB,从而显著提高了乳酸发酵效率。在玉米秸秆水解液中添加VB3和VB5,可进一步提高纤维素乳酸的产量和发酵速率。
3 展望
目前在动物医学方面对丁酸梭菌已经有了广泛的研究,但是在食品工业生产中仍然处于起步阶段,其代谢产物的相关研究依然面临如下挑战:
(1)丁酸目前几乎全部采用丙烯化学合成法生产,因丙烯价格低廉,易得,目前已广泛应用于丁酸的商业化生产。其原理是利用金属催化剂,使丙烯的双键与O2和CO反应合成丁酸。随着人们生活水平的提高,且丁酸在食品生产中的应用广泛,微生物发酵生产丁酸必然是一个极具潜力的方法。如利用丁酸梭菌进行工业发酵产丁酸,在丁酸梭菌代谢过程中产乙酸途径会产生4 mol ATP,丁酸代谢途径会产生3 mol ATP,由于丁酸梭菌生长前期需要消耗大量ATP,所以前期会有大量乙酸产生[46],这使得丁酸产量大大降低。如何通过工业控制,降低丁酸梭菌产乙酸是工业生产面临的一大困难,基因工程与代谢工程作为新的技术,有望克服这一困难。
(2)有氧情况下,丁酸梭菌会消耗大量NADH,使得1,3-丙二醇产量降低,所以目前大多采用厌氧发酵方式利用丁酸梭菌生产1,3-丙二醇。厌氧的控制对生产丙二醇至关重要,传统方式有煮沸除氧、通N2除氧、覆盖石蜡。但这些步骤在实际工业生产中操作复杂,并不能很好地实现。利用液体深层发酵虽然可使菌体生长达到厌氧,但是发酵方式的局限性使得菌体生长缓慢,且产量大大降低。探索新的除氧方式,如何提升厌氧菌工业发酵效率是接下来面临的挑战之一。
(3)B族维生素是人体必需但又不能自身合成的维生素,目前工业上采用化学合成法来生产,但安全性需要关注。微生物发酵法作为一种新型的生物合成手段,利用食品级微生物发酵VB,其成本低、安全性高,逐渐被人们接受。丁酸梭菌主要存在于人类肠道中,同时丁酸梭菌自身会产生许多酶系分解碳水化合物,作为一种新型益生菌,可以利用一些农业废弃物,例如糟粕类物质,通过丁酸梭菌发酵,使其作为一种维生素D或B生产的工程菌,这样既可以节省大量的成本,又能获得大量维生素。但是目前有关丁酸梭菌产维生素的研究很少,其生产工艺及产量依然有待研究。
(4)丁酸梭菌是否会产生细菌素还有待研究,目前相关研究较少。作为一种肠道益生菌,如果能通过实验建立起抑菌谱,包括其细菌素的结构或多肽分子质量以及其对胃肠道的耐受性,那么这种细菌素不但可以作为产品来保护人体肠道,促进肠道优势菌群的生长,同时还可应用于食品的防腐等。
总之,丁酸梭菌及其益生代谢产物的研究还有很多地方值得探索。随着生物技术的发展,代谢组学作为一门新兴科学将在丁酸梭菌日后的研究中发挥重大作用,结合代谢组学,可更加完整地掌握丁酸梭菌的未知代谢产物,从而可结合基因组学、蛋白组学及转录组学等方式了解其对应益生代谢产物的代谢途径,通过代谢途径的调控,提升工业生产的效率和收益。
[1] FUJITA I, MAEDA A, TAKASHIK. Studies on the anti-diarrheal activity of Clostridium butyricm Miyairi Ⅱ 588[J]. Jpn Pharmacol Ther, 1986, 14: 6 073-6 080.
[2] 李雄彪,马庆英,崔云龙.酪酸梭菌——肠道健康的卫士[M].上海:复旦大学出版社, 2008.
[3] 王云鹏,马越.养殖业抗生素的使用及其潜在危害[J].中国抗生素杂志, 2008, 33(9): 519-523.
[4] 杜银峰.几种饲用抗生素替代产品对肉鸡生长、消化和免疫性能的影响[D].扬州:扬州大学, 2013.
[5] 冉雪松, 王振华, 潘康成.丁酸梭状芽孢杆菌的研究进展[J]. 安徽农学通报, 2007,(4): 37-39.
[6] 赵建新,张灏,田丰伟.丁酸菌的分离、鉴定及筛选[J]. 无锡轻工大学学报, 2002, 21(6): 597-601; 612.
[7] TANASUPAWAT S, PRASIRTSAK B, PAKDEETO A, et al. Characterization and fermentation products of Clostridium butyricum strains isolated from Thai soils[J]. Journal of Applied Pharmaceutical Science,2014, 4(4): 20-23.
[8] BUCHANAN R E, GIBBONS N E.伯杰细菌鉴定手册[M]. 8版. 北京:科学出版社, 1984.
[9] 刘颖. 丁酸梭状芽孢杆菌补料发酵的优化[D].武汉:湖北工业大学,2018.
[10] CALUSINSKA M, HAMILTON C, MONSIEURS P, et al. Genome-wide transcriptional analysis suggests hydrogenase- and nitrogenase-mediated hydrogen production in Clostridium butyricum CWBI 1009[J]. Biotechnology for Biofuels, 2015, 8(1):27.
[11] ZHANG A H, LIU H L, HUANG S Y, et al. Metabolic profiles analysis of 1,3-propanediol production process by Clostridium butyricum, through repeated batch fermentation coupled with activated carbon adsorption[J]. Biotechnology & Bioengineering, 2018,115(3):684-693.
[12] PARK JEONG-HOON, KIM DO-HYUNG, KIM HAN-SHIN, et al. Granular activated carbon supplementation alters the metabolic flux of Clostridium butyricum for enhanced biohydrogen production. [J]. Bioresource technology,2019,281:318-325.
[13] KUBIAK P, LEJA K, MYSZKA K, et al. Physiological predisposition of various Clostridium species to synthetize 1,3-propanediol from glycerol[J]. Process Biochemistry, 2012, 47(9):1 308-1 319.
[14] LVY R A, WIEDMAN M. CLOSTRIDIUM Clostridium tyrobutyricum[M]. Encyclopedia of Food Microbiology. 2nd ed. Oxford: Academic Press, 2014: 468-473.
[15] YANG C M, CAO G T, FERKET P R, et al. Effects of probiotic Clostridium butyricum on growth performance, immune function and cecal microflora in broiler chickens[J]. Poult Sci, 2012, 91(9): 2 121-2 129.
[16] 李劲亭, 刘力,戴欣.人和动物胃肠道微生物丁酸合成途径相关酶基因的研究进展[J].微生物学报, 2012,52(10): 1 181-1 186.
[17] HAMER H M, JONKERS D, VENEMA K, et al. Review article: The role of butyrate on colonic function[J]. Alimentary Pharmacology & Therapeutics, 2008, 27(2):104-119.
[18] ARMSTRONG D W, YAMAZAKI H. Natural flavours production: a biotechnological approach[J]. Trends in Biotechnology, 1986, 4(10):264-268.
[19] DU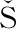 AN VAND
AN VAND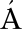 K, JANA ZIGOV
K, JANA ZIGOV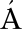 , ERNEST
, ERNEST 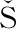 TURD
TURD K, et al. Evaluation of solvent and pH for extractive fermentation of butyric acid[J]. Process Biochemistry, 1997, 32(3):245-251.
K, et al. Evaluation of solvent and pH for extractive fermentation of butyric acid[J]. Process Biochemistry, 1997, 32(3):245-251.
[20] JANA ZIGOV , TURDK E, DUAN VAND
, TURDK E, DUAN VAND K, et al. Butyric acid production by Clostridium butyricum with integrated extraction and pertraction[J]. Process Biochemistry, 1999, 34(8):835-843.
K, et al. Butyric acid production by Clostridium butyricum with integrated extraction and pertraction[J]. Process Biochemistry, 1999, 34(8):835-843.
[21] 韩晓祥, 武晓丹, 周凌霄, 等. 酸性离子液体催化合成食用香料丁酸丁酯[J]. 中国食品学报, 2011, 11(3):68-76.
[22] 杨毅,曾建强.气相色谱法分析丁酸橙花酯和丁酸香叶酯[J].广西师范大学学报(自然科学版),1997,25(2): 69-71.
[23] LI C R, WANG Y S, XIE G P, et al. Complete genome sequence of Clostridium butyricum JKY6D1 isolated from the pit mud of a Chinese flavor liquor-making factory[J]. Journal of Biotechnology, 2016, 220:23-24.
[24] GERV SIO P D S, MACK M, CONTIERO J. Glycerol: A promising and abundant carbon source for industrial microbiology[J]. Biotechnology Advances, 2009, 27(1):30-39.
SIO P D S, MACK M, CONTIERO J. Glycerol: A promising and abundant carbon source for industrial microbiology[J]. Biotechnology Advances, 2009, 27(1):30-39.
[25] DuPont Tate & Lyle Bio Products. (2018). Zemea? USP-FCC Propanediol for Food and Flavors. https://duponttateandlyle.com/food-flavors/
[26] PAGLIARO M, CIRIMINNA R, KIMURA H, et al. From Glycerol to value-added products[J]. Cheminform, 2007, 46(24):4 434-4 440.
[27] 杨苗苗. 酪酸梭菌的诱变育种及其1,3-丙二醇的发酵与耐受机制的研究[D].南京,江苏大学,2019.
[28] HORNG Y T, CHANG K C, CHOU T C, et al. Inactivation of dhaD and dhaK abolishes by-product accumulation during 1,3-propanediol production in Klebsiella pneumoniae[J]. Journal of Industrial Microbiology, 2010, 37(7):707-716.
[29] 曹广添,刘婷婷,周琳, 等. 丁酸梭菌对致病菌和有益菌的体外作用效果研究[J].中国饲料, 2012,(4): 16-19.
[30] DHAKAL J, ALDRICH C G, KNUE VEN C. Assessing the efficacy of sodium bisulfate and organic acid treatments for control of salmonella typhimurium in rendered chicken fat applied to pet foods[J]. Journal of Food Protection,2019,82(11): 1 864-1 869.
[31] SKALICKOVA S, HEGER Z, KREJCOVA L, et al. Perspective of use of antiviral peptides against influenza virus [J]. Viruses, 2015, 7(10): 5 428-5 442.
[32] WANG J J, DOU X J, SONG J, et al. Antimicrobial peptides: Promising alternatives in the postfeeding antibiotic era [J]. Medicinal Research Reviews, 2019,39(3): 831-859.
[33] CLARKE D J, MORRIS J G. Butyricin 7423: a Bacteriocin Produced by Clostridium butyricum NCIB7423[J]. Journal of General Microbiology, 1976, 95(1):67-77.
[34] 贾丽楠. 丁酸梭菌抗逆性能及其对肉仔鸡益生性能的体外研究[D].保定:河北农业大学,2018.
[35] 王腾浩,宗鑫,宋德广,等.产抑菌蛋白的丁酸梭菌的筛选和鉴定及体外益生功能研究[J].中国畜牧杂志,2015,51(13):75-81.
[36] 李红红. 产细菌素枯草芽孢杆菌的生物学特性研究[D].济南:山东大学,2019.
[37] DUBOC P, MOLLET B. Applications of exopolysaccharides in the dairy industry. Int Dairy J,2001, 11(9):759-768
[38] LIU C F, TSENG K C, CHIANG S S, et al. Immunomodulatory and antioxidant potential of Lactobacillus exopolysaccharides[J]. J Sci Food Agric,2011, 91(12): 2 284-2 291.
[39] 刘逸凡,蔡国林,李晓敏, 等.丁酸梭菌的筛选及其胞外多糖抗氧化性的研究[J]. 食品与发酵工业, 2019, 45(5):25-33.
[40] 向蓉,梁伟杰,袁明贵,等.丁酸梭菌发酵龙眼多糖的工艺优化及多糖含量变化[J].中国畜牧杂志,2020,56(2):141-145.
[41] ZISU B, SHAH N P. Textural and functional changes in low-fat Mozzarella cheeses in relation to proteolysis and microstructure as influenced by the use of fat replacers, pre-acidification and EPS starter[J]. Int Dairy J,2005, 15(6):957-972.
[42] RUSSO P, DE C M, CAPOZZI V, et al. Lactobacillus plantarum strains for multifunctional oat-based foods[J]. LWT Food Sci Technol,2016, 68:288-294.
[43] ARAKI Y, ANDOH A, FUJIYAMA Y, et al. Oral administration of a product derived from Clostridium butyricum in rats[J]. International Journal of Molecular Medicine, 2002, 9(1):53-57.
[44] LI P, GU Q, YANG L, et al. Characterization of extracellular vitamin B 12 producing Lactobacillus plantarum strains and assessment of the probiotic potentials[J]. Food Chemistry, 2017, 234:494.
[45] HAN X, LI L, WEI C, et al. Facilitation of l-lactic acid fermentation by lignocellulose biomass rich in vitamin B compounds[J]. Journal of Agricultural and Food Chemistry, 2019, 67(25):7 082-7 086.
[46] ZIGOV J,
J,  TURD
TURD K E. Advances in biotechnological production of butyric acid[J]. Journal of Industrial Microbiology & Biotechnology, 2000, 24(3):153-160.
K E. Advances in biotechnological production of butyric acid[J]. Journal of Industrial Microbiology & Biotechnology, 2000, 24(3):153-160.