谷氨酰胺因其在人体血浆和肌肉中含量都较高,并且在人体的生理生化过程中起到重要的作用,一直是一种重要的氨基酸产品。但谷氨酰胺在使用、保存等方面存在着种种问题,因此需要寻找替代品来发挥它的功效。二肽是最简单的含酰胺键的组分,存在许多特殊而有趣的生物学活性[1]。丙谷二肽作为重要的二肽之一,具有溶解性好,热稳定性高以及进入人体可以快速降解成谷氨酰胺等优点[2-4],在许多功能性食品、保健品和药品中被广泛使用[5-7]。丙谷二肽的生产主要有化学合成与生物酶法2种[8]。人们对化学合成丙谷二肽研究较早,有氨基保护法、羧基内酸酐法等[9-10],但存在着生产步骤较多,有毒害物质参与生产过程等缺点。采用生物酶法生产丙谷二肽,具有生产过程中无毒无害,反应速率较快,专一性较强,副产物少等优点,被广泛研究[11-12]。2005年,YOKOZEKI 等[13]首先发现了一种可以用作生产二肽的L-氨基酸连接酶。但α-酯酰基转移酶比L-氨基酸连接酶具有更好的底物选择性和更快的生产丙谷二肽速率[14]。本实验前期通过采用氨基酸突变与密码子优化等策略分别实现了α-酯酰基转移酶在大肠杆菌和毕赤酵母中的表达,完成了丙谷二肽的高效合成[15-16]。
高密度发酵策略是一种可以显著提高微生物产率的方法,被广泛应用到原核微生物、真核微生物以及藻类发酵过程的优化中[17-19]。在微生物高密度发酵过程优化中,影响因素主要有培养基构成、补料方式、溶氧、pH、代谢产物、外源蛋白的诱导方式等[20]。
为进一步降低培养过程成本,本文以实验室构建的表达α-酯酰基转移酶的重组大肠杆菌为出发菌株[15],研究其高密度培养策略。实现了该菌株的高密度发酵,并且在高密度培养下的重组菌株表达的酯酰基转移酶具有较好的活性,为采用生物法制备丙谷二肽的产业化奠定了基础。
1 实验材料和方法
1.1 材料
本实验中,发酵使用试剂均为分析纯或以上水平,实验所用的液相色谱相关试剂均为色谱纯级别。高密度发酵过程中使用的葡萄糖为工业纯。O2,纯度99%。
实验菌株为本实验室构建的E. coli BL21-pET29a-SsAET 菌株。
分析仪器主要包括S6000高效液相色谱仪,华谱公司;Muitigo酶标仪,Thermo公司;Bio-3L发酵罐,上海百仑公司。
1.2 实验流程
本实验流程如图1所示。以生物量和丙谷二肽产率作为优化主要参考因素,通过摇瓶条件和发酵罐条件对菌株培养方法进行选择,最终确定该菌株高密度、高酶活力的发酵方式。

图1 实验流程图
Fig.1 Experimental flow chart
1.3 培养基成分优化
重组菌株在活化之后,以1%体积分数的接种量接入到含有50 μg/mL卡那霉素的培养基中,在37 ℃, 200 r/min的条件培养6~8 h后,加入0.05 mol/L的 IPTG,在18 ℃,180 r/min 的条件下培养过夜。之后对菌体进行收集,通过底物转化率以及菌体生物量筛选最佳培养基。
首先选取LB 培养基、TB 培养基、M9 培养基作为基础培养基,之后在选定培养基的基础上对其碳源、氮源以及无机盐的种类进行优化。其中碳源包括甘油、葡萄糖、乳糖、果糖、半乳糖。氮源包括酵母浸粉、胰蛋白胨、玉米浆、牛肉膏、酵母浸粉与胰蛋白胨混合物。
确定碳源、氮源种类后,以培养基中的碳源、氮源以及无机盐含量作为主要因素,以最终菌体的OD620 值和丙谷二肽生成率作为响应值,利用Box-Behnken Design 方法建立响应面模型[22-23],从而模拟出最佳的培养基组成。响应面设计情况如表1所示。
表1 响应面设计
Table 1 Response surface methodology

水平因素-101碳源/(g·L-1)1.010.019.0氮源/(g·L-1)9.024.039.0无机盐/(g·L-1)7.530.052.5
1.4 高密度条件优化
以优化后的培养基为基础培养基,在3 L发酵罐中对于高密度发酵中的影响因素进行研究。发酵参数为温度37 ℃,pH 7.1,搅拌转速200 r/min,溶氧通过O2和空气混合气通气来调节[24]。菌体培养过程结束后向发酵罐中加入0.05 mol/L的 IPTG,在18 ℃,180 r/min 的条件下诱导外源蛋白表达。诱导结束后收集菌体,检测底物转化率。
首先研究pH对于发酵罐培养的影响,通过使用体积分数为50%的NH3·H2O调节pH值为7,另一组不调节pH。之后比较了补料种类对于发酵的影响,一组使用600 g/L的葡萄糖作为补料培养基,另外一组使用含有600 g/L的葡萄糖为碳源,48 g/L 的m(酵母浸粉)∶m(胰蛋白胨)=2∶1的混合氮源作为补料培养基。发酵5 h左右开始进行补料处理,补料速率为10 mL/h。实验中除变量外其他发酵条件相同,检测发酵过程中生物量与残糖量。
补料方式对于高密度发酵有着很大的影响。发酵后5 h左右开始进行补料处理,分别使用2种方式:溶氧控制的补料,当溶氧>20%时开始补料,通过溶氧反馈级联调节方式进行[25-26];pH反馈控制补料,当pH>7.1时开始补料,通过pH反馈级联调节方式进行[26-28]。其他发酵条件相同,检测发酵过程中生物量与残糖量。
1.5 丙谷二肽合成
取培养好的重组大肠杆菌,离心细胞,去上清液后重悬细胞,根据之前测出的OD620值稀释,使得反应液中生物量相同,在7~10之间。在反应罐内加入1.46 g谷氨酰胺和2.79 g丙氨酸甲酯盐酸盐,加入90 mL 硼酸-硼砂缓冲液。在25 ℃下使用6 mol/L的NaOH溶液调节pH至8.5,加入10 mL 的重悬菌液开始反应。反应5 min 后取样,离心取上清液,于4 ℃保存进行下一步检测。
1.6 分析方法
产物有丙谷二肽、2种底物是丙氨酸甲酯盐酸盐、谷氨酰胺。首先对3种物质进行衍生化处理,之后进行高效液相色谱分析。通过紫外检测器配C18色谱柱检测。流动相A:V(乙酸钠溶液)∶V(乙腈溶液)=93∶7,流动相B:纯乙腈溶液,采用梯度洗脱的方式检测丙谷二肽。流速1 mL/min,检测器温度40 ℃,检测时间40 min,检测波长254 nm。采用外标法测定样品中丙谷二肽和谷氨酰胺的浓度,从而计算出丙谷二肽的浓度和底物的转化率。
发酵过程中溶液的溶氧以及pH通过发酵罐自带溶氧电极和pH电极进行检测。每次使用前对电极进行校准。发酵过程中的残糖量通过二硝基水杨酸法检测。
菌株的生物量通过酶标仪进行检测,检测波长620 nm。
2 结果与讨论
2.1 培养基成分优化
2.1.1 基础培养基的筛选
基础培养基为常用于培养大肠杆菌的LB培养基、TB培养基和M9培养基。3种培养基对于菌体生物量和底物转化率的影响如图2所示。在相同培养条件下,TB培养基的生物量>其他2种培养基的生物量,并且其底物转化率也是最高的。因此选取TB 培养基为基础,对培养基进行进一步的优化。
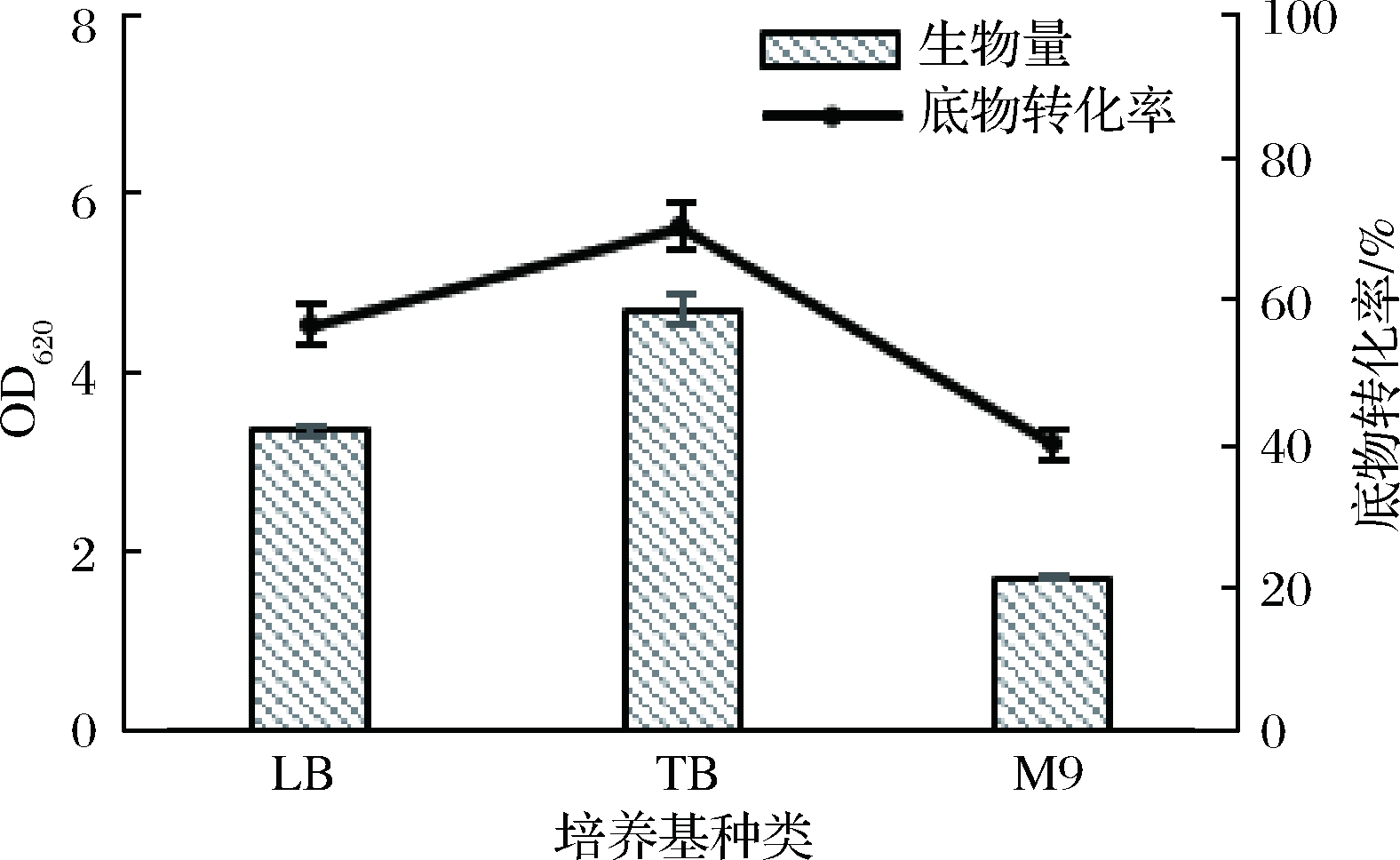
图2 不同培养基下菌体的生物量和底物转化率
Fig.2 Biomass and substrate conversion rates of bacteria in different medium
2.1.2 TB培养基中碳源和氮源优化
在选定的TB培养基基础上,仅改变培养基碳源种类,对菌体生物量和底物转化率的影响结果见图3。不同碳源对相同培养条件下菌体生物量与底物转化率存在着一定影响。葡萄糖与果糖作为培养基碳源是较优的选择。通过经济性比较,最终选择葡萄糖作为最终的培养基碳源。
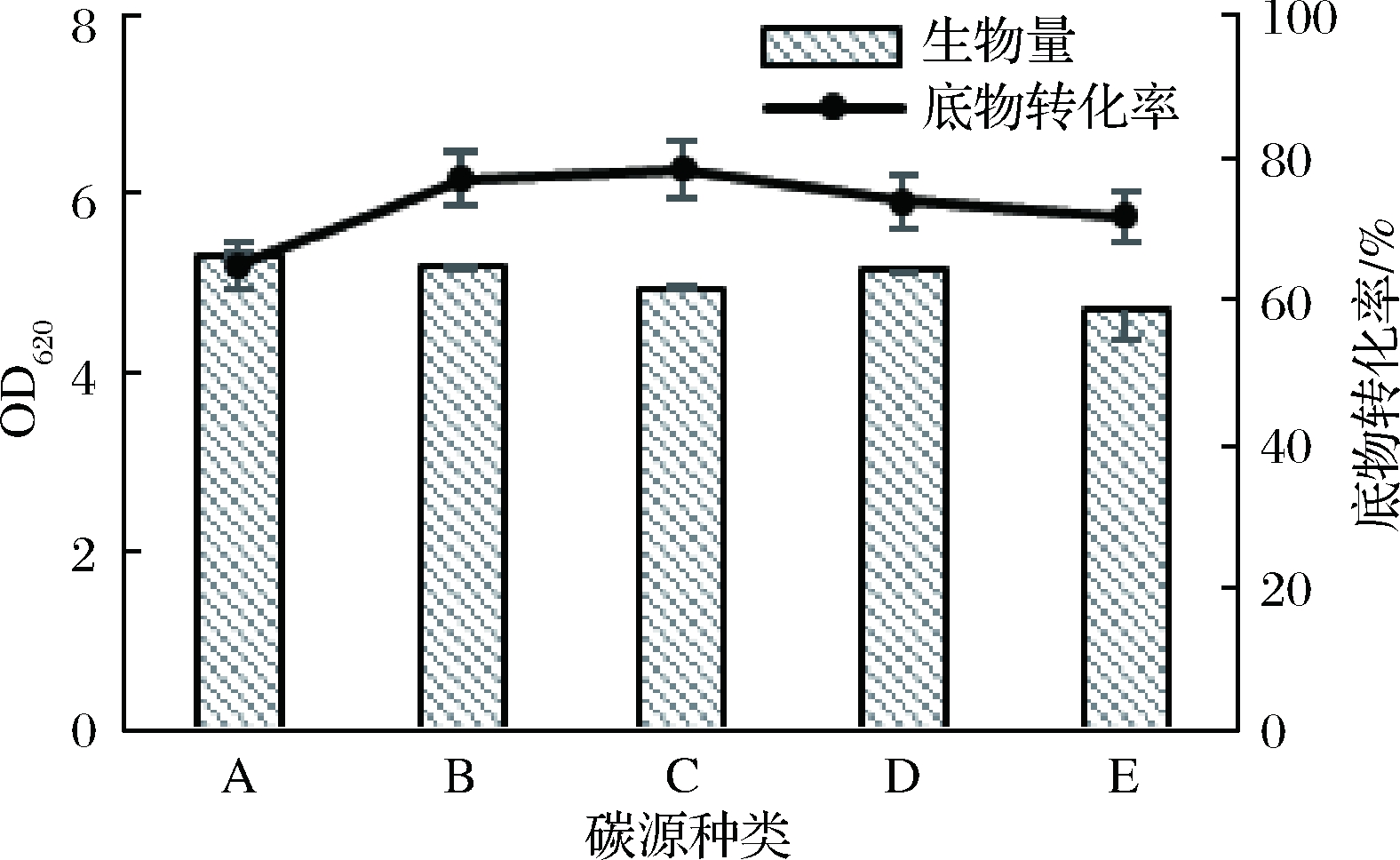
A-乳糖;B-果糖;C-葡萄糖;D-甘油;E-半乳糖
图3 不同碳源下菌体的生物量和底物转化率
Fig.3 Biomass and substrate conversion rates of bacteria in different carbon source
保持其他培养基成分不变,仅改变氮源种类、菌体生物量和底物转化率的变化见图4。如图4-a所示,不同氮源对相同培养条件下菌体生物量与底物转化率存在着影响。单纯使用酵母浸粉时,菌体生物量积累最明显,但是底物转化率较低;玉米浆作为氮源时,底物转化率较高,但是生物量只有其他组的50%左右。综合考虑,最终选择同时具有较好的菌体生物量与底物转化率的酵母浸粉与蛋白胨混合使用的氮源作为培养基氮源。图4-b显示混合氮源中2种物质的配比情况,发现m(酵母浸粉)∶m(胰蛋白胨)=2∶1时效果最好。
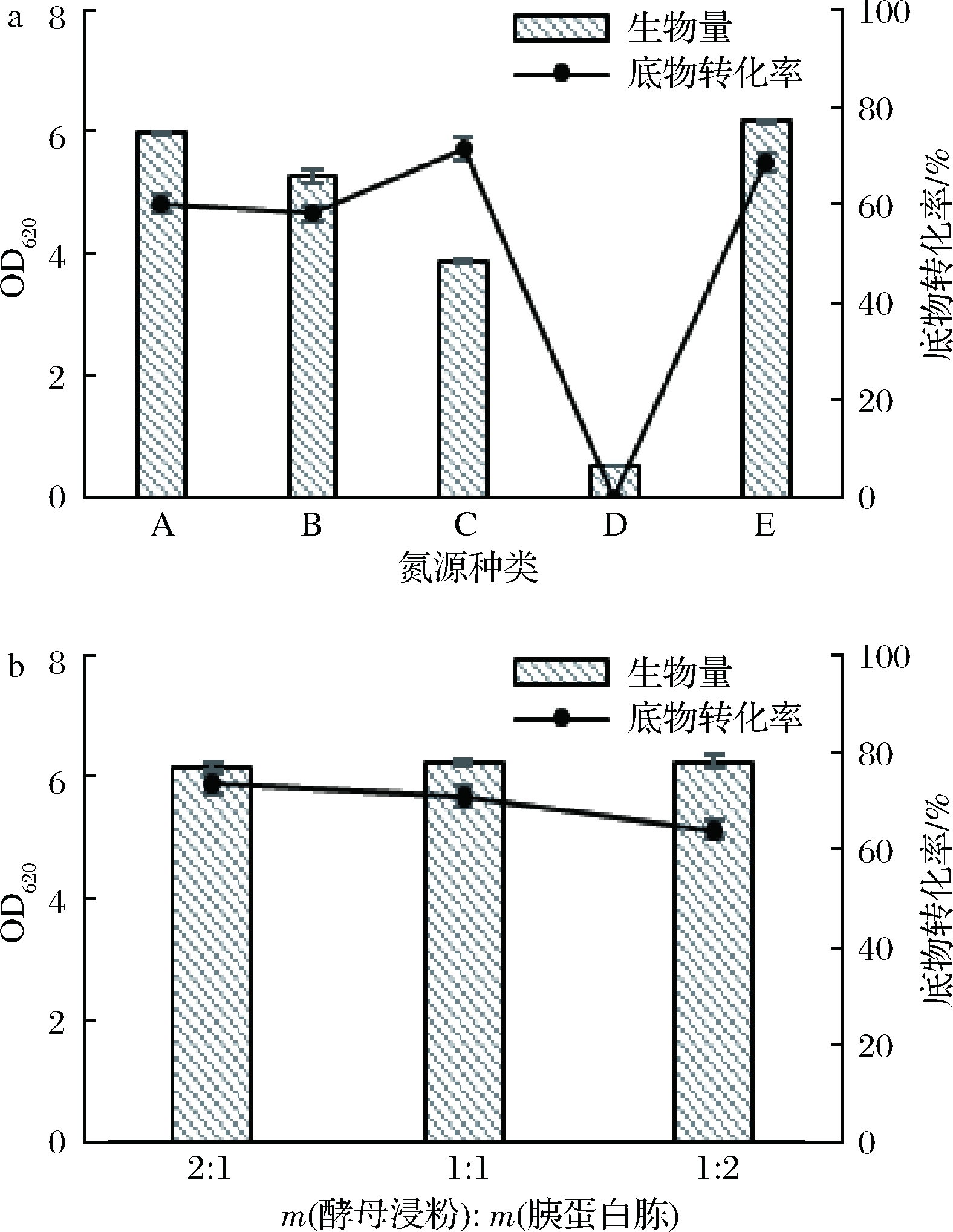
a-氮源对菌体的影响;b-混合氮源比例对菌体的影响
图4 不同氮源下菌体的生物量和底物转化率
Fig.4 Biomass and substrate conversion rates of bacteria in different nitrogen source
2.1.3 响应面分析法优化培养基配方
响应面分析根据表1设计的因素与水平进行实验。最终实验拟合模型如图5所示。总模型方差显著(P<0.05),模型拟合相关度为95.26%,方差失拟项F值不显著(P=0.131 4>0.05)。该模型与实际实验拟合较好,可以用来模拟不同培养基配方对于菌体的生物量与底物转化率的影响。
如图5所示,任意2个因素之间均存在明显的交互作用, 并且最优值落点均在试验考察的区域范围之内。最终确定基础培养基的成分为:葡萄糖质量浓度为10 g/L,混合氮源[m(酵母浸粉)∶m(胰蛋白胨)=2∶1]质量浓度为24 g/L,无机盐质量浓度为4.62 g/L KH2PO4和25.08 g/L K2HPO4。
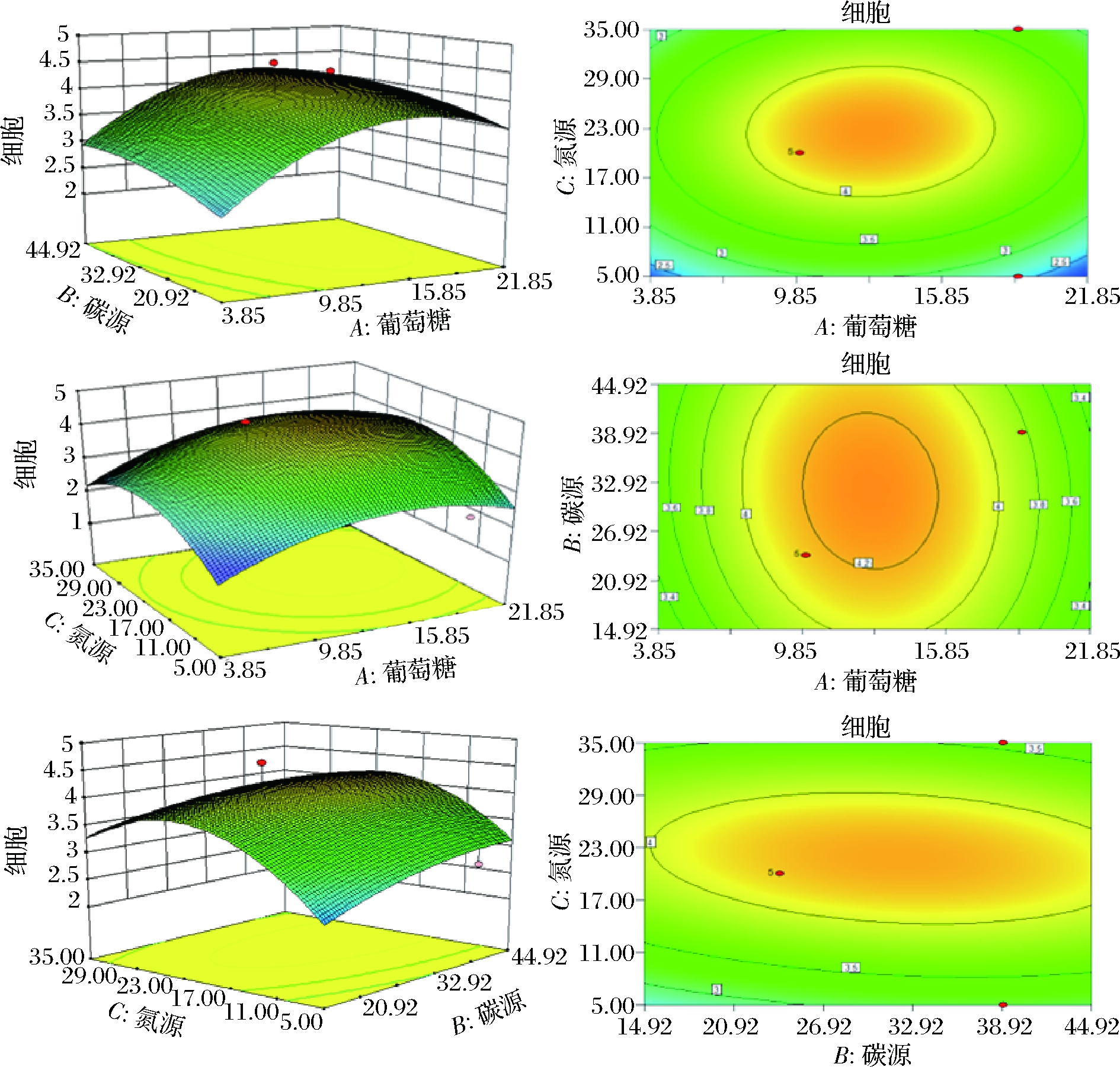
图5 响应面实验各组三维图与等高线图
Fig.5 3D diagram and contour diagram of response surface analysis experimental
2.2 高密度培养条件优化
2.2.1 pH的影响
摇瓶实验中无法及时调控pH,而在发酵罐发酵过程中,pH调节是重要的一步[29]。pH调节实验结果如图6所示。控制发酵罐中pH在7左右,菌体在发酵至5 h左右可以消耗完原始培养基中的葡萄糖,此时生物量也可以快速地达到较高水平,OD620最高可以达到6.3左右,菌体彻底烘干后的质量为5.34 g/L;未调节pH一组,菌体生长较缓慢,生物量也相对较差,最高OD620值仅为4.7,菌体彻底烘干后的质量为4.42 g/L。收集诱导后的细胞进行酶活性测试,没有控制pH的重组细胞酶活性较低。pH对于菌体的生长速率和整体活性都具有重要的影响。因此在后续实验中,都使用体积分数为50%的NH3·H2O调节pH至7。
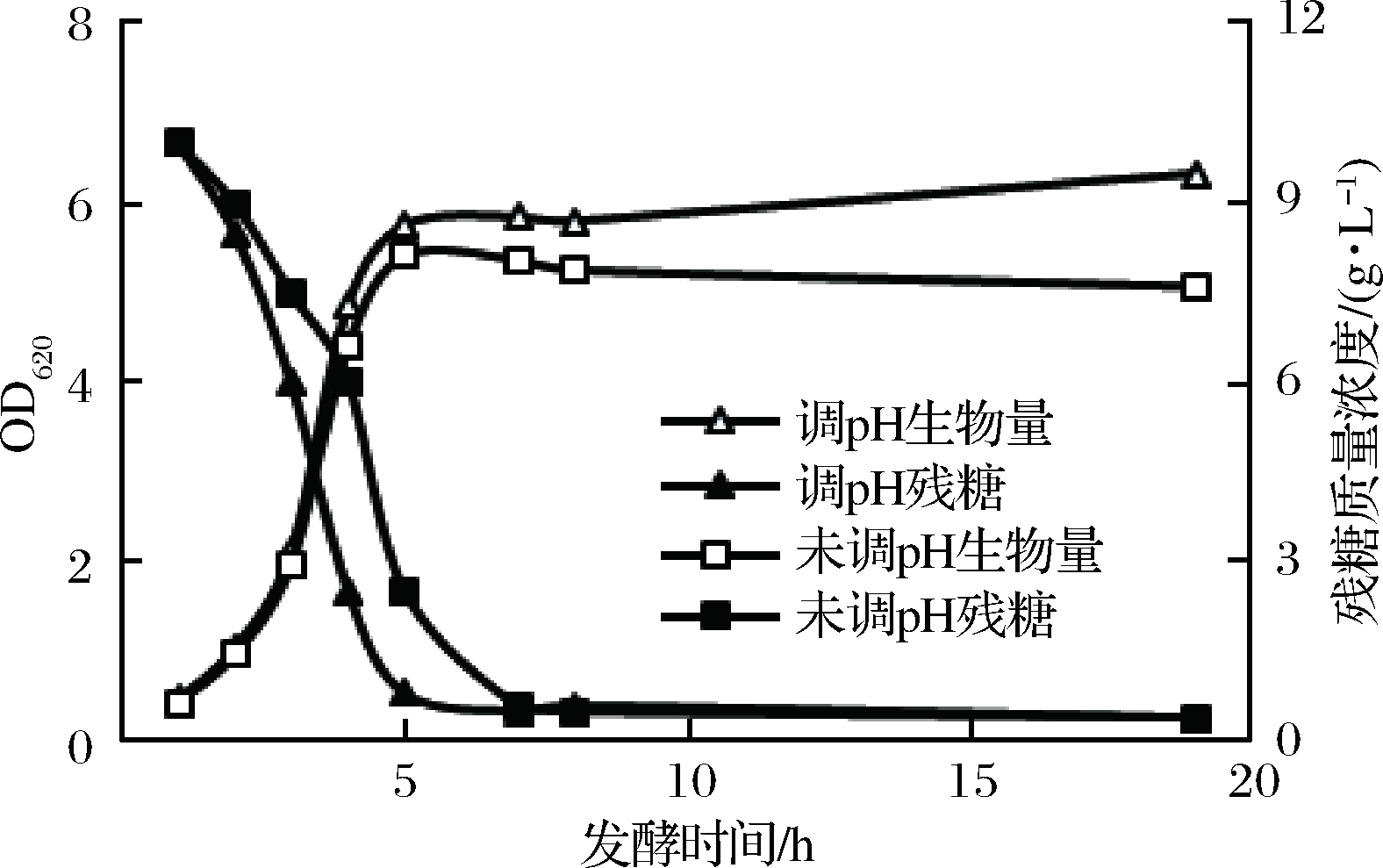
图6 pH对于菌体生物量与残糖的影响
Fig.6 Effects of pH regulation on bacterial biomass and residual sugars
2.2.2 补料种类的影响
为进一步提高菌体密度,需要在培养过程中补料培养。由图6可知,初始葡萄糖在发酵开始5 h左右几乎完全消耗,因此选择5 h左右开始进行补料。补料分为只补碳源和按比例补充碳源和氮源2种情况,实验结果如图7所示。可以看出,补料培养基为碳源或者碳源-氮源混合物对于生物量的影响不是很明显。但补加碳源-氮源混合液可以促使菌体耗糖速率增加,推测补加氮源可以促进生物体合成一些物质,并且加快微生物对碳源的吸收[30]。通过重组菌的酶活力测定,也证明了我们的假设。因此补料培养基为碳源-氮源混合液更有利于菌体实现高密度水平以及表达蛋白。

图7 补料方式对于菌体生物量与残糖的影响
Fig.7 Effects of feeding types on bacterial biomass and residual sugars
2.2.3 反馈补料方式的优化
发酵过程中基质浓度的变化对发酵过程存在重要影响。因为菌体的生长处于动态变化中,匀速补料的方式很难满足需求。我们采用了溶氧反馈补料和pH反馈补料2种动态补料的方式来进行补料方式的优化,实验结果如图8所示。从实验结果来看,采用2种不同反馈方式补料时,发酵过程中葡萄糖量一直处在较低水平,而菌体持续生长。对比恒溶氧反馈补料和恒pH反馈补料,可以看出恒溶氧反馈补料,碳源的利用速度更快,而生物量生长更多。接种后培养了27 h,恒溶氧反馈补料的生物量OD620达到58左右,而pH反馈补料的OD620值为43左右。在此基础上加入IPTG进行外源蛋白的诱导表达。采用溶氧反馈补料时,诱导之后,菌体的生物量继续增长,诱导3 h后,OD620值达到了67。而采用pH反馈补料时,添加诱导剂之后继续培养3 h,菌体量基本维持不变,甚至出现了下降。因此,控制溶氧在20%的恒溶氧反馈补料更适于表达α-酯酰基转移酶的重组大肠杆菌高密度培养。

图8 反馈补料对于菌体生物量与残糖的影响
Fig.8 Effects of feedback on bacterial biomass and residual sugars
2.3 高密度培养的重组菌用于丙谷二肽的生产
在大肠杆菌高密度发酵过程中,通过采取溶氧反馈补料的方式可以达到较高密度生物量。对高密度培养出的重组菌催化活性进行了测定。由表达转酯酶的重组菌催化的反应如图9所示。
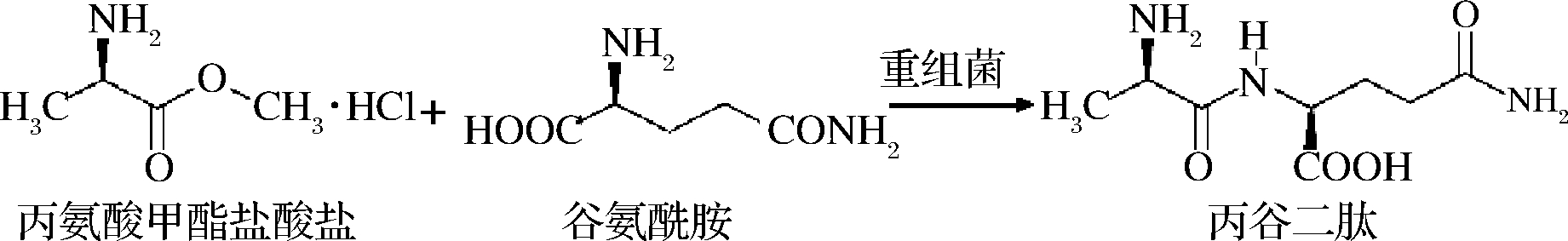
图9 丙谷二肽合成反应式
Fig.9 Synthetic reaction equations of Ala-Gln
用溶氧反馈补料培养后的菌体作为全细胞催化剂,进行丙谷二肽的酶催化合成。2种底物丙氨酸甲酯盐酸盐和谷氨酰胺,浓度分别为400与300 mmol/L,在重组菌体浓度OD620为0.7时,反应5 min,丙谷二肽的生成率达到34.56 g/L,生产效率约为7 g/(L·min),说明高密度条件下的重组大肠杆菌仍然保持了高活性,可保障该重组大肠杆菌在丙谷二肽的工业化生产中的应用,且能大幅度降低生产成本。为生物发酵法进行丙谷二肽制备的产业化提供了技术支持。
3 结论
国外市场上,丙谷二肽常被加入到保健品、饮品中,应用广泛,而目前国内丙谷二肽的产品则较为单一。随着中国对医疗卫生行业的重视程度加大以及老龄化现状的加剧,近些年人们对于丙谷二肽产品兴趣增大,如何实现微生物酶法生产丙谷二肽的工业化生产成了急需解决的问题。有关高密度培养重组菌生产丙谷二肽的方法尚未见报道。本实验先对摇瓶培养过程中培养基的种类、碳源、氮源进行筛选,最终通过响应面水平优化,确定了表达α-酯酰基转移酶的重组大肠杆菌的基础培养基。在此基础上,在3 L发酵罐中考察对于发酵中的补料类型、补料方式等,建立了溶氧反馈补料培养工艺。最终高密度条件下培养的重组菌株,其细胞密度达到摇瓶水平的14倍;同时,高密度条件下培养的重组菌株,丙谷二肽的质量浓度达到34.56 g/L,生产效率为7 g/(L·min),为目前文献报道最高水平。本研究为进一步工艺放大,实现丙谷二肽工业化生产奠定了基础。
[1] WANG T, ZHANG Y R, LIU X H, et al. Strategy for the biosynthesis of short oligopeptides: green and sustainable chemistry [J]. Biomolecules, 2019, 9(11):733.
[2] NOVA M V, NOTHNAGEL L, THURN M, et al. Development study of pectin/Surelease (R) solid microparticles for the delivery of L-alanyl-L-glutamine dipeptide [J]. Food Hydrocolloids, 2019, 89:921-932.
[3] ODA S, MULLANEY T, BOWLES A J, et al. Safety studies of L-alanyl-L-glutamine (L-AG) [J]. Regulatory Toxicology and Pharmacology, 2008, 50(2):226-238.
[4] YAGASAKI M, HASHIMOTO S. Synthesis and application of dipeptides; current status and perspectives [J]. Applied Microbiology and Biotechnology, 2008, 81(1):13-22.
[5] WANG Z E, WU D, ZHENG L W, et al. Effects of glutamine on intestinal mucus barrier after burn injury [J]. American Journal of Translational Research, 2018, 10(11):3 833-3 846.
[6] WANG J, LI Y, QI Y. Effect of glutamine-enriched nutritional support on intestinal mucosal barrier function, MMP-2, MMP-9 and immune function in patients with advanced gastric cancer during perioperative chemotherapy [J]. Oncology Letters, 2017, 14(3):3 606-3 610.
[7] ANDREWS F J, GRIFFITHS R D. Glutamine: essential for immune nutrition in the critically ill [J]. British Journal of Nutrition, 2002, 87(S1):S3-S8.
[8] 范晓光, 洪翔, 朱新雅, 等. 二肽的生物合成及应用研究进展[J].发酵科技通讯, 2016, 45(4):199-203.
[9] 唐果. N(2)-L-丙氨酰-L-谷氨酰胺二肽的合成与反应研究[D]. 厦门: 厦门大学, 2004.
[10] 杨晓勇. L-丙氨酰-L-谷氨酰胺的合成及工艺研究[D]. 杭州: 浙江大学, 2015.
[11] 郭明, 胡昌华.生物转化—从全细胞催化到代谢工程[J]. 中国生物工程杂志,2010,30(4):110-115.
[12] RIBEIRO L F, AMARELLE V, ALVES L F, et al. Genetically engineered proteins to improve biomass conversion: new advances and challenges for tailoring biocatalysts [J]. Molecules, 2019, 24(16):2 879.
[13] YOKOZEKI K, HARA S. A novel and efficient enzymatic method for the production of peptides from unprotected starting materials [J]. Journal of Biotechnology, 2005, 115(2):211-220.
[14] HIRAO Y, MIHARA Y, KIRA I, et al. Enzymatic production of L-Alanyl-L-glutamine by recombinant E. coli expressing alpha-amino acid ester acyltransferase from Sphingobacterium siyangensis [J]. Bioscience Biotechnology and Biochemistry, 2013, 77(3):618-623.
[15] LI Y M, YUAN W J, GAO J Q, et al. Production of L-alanyl-L-glutamine by recycling E. coli expressing alpha-amino acid ester acyltransferase [J]. Bioresource Technology, 2017, 245(PtB):1 603-1 609.
[16] LI Y M, GAO J Q, PEI X Z, et al. Production of L-alanyl-L-glutamine by immobilized Pichia pastoris GS115 expressing-amino acid ester acyltransferase [J]. Microbial Cell Factories, 2019, 18.DOI:10.1186/S12934-019-1077-1.
[17] CHANG H N, JUNG K, CHOI J, et al. Multi-stage continuous high cell density culture systems: A review [J]. Biotechnology Advances, 2014, 32(2):514-525.
[18] 徐冰冰, 雷庆子, 曾伟主, 等. 高密度发酵产酪氨酸酚裂解酶及催化合成L-DOPA[J]. 食品与发酵工业, 2019, 45(12):7-14.
[19] WESTMAN J O, FRANZEN C J. Current progress in high cell density yeast bioprocesses for bioethanol production [J]. Biotechnology Journal, 2015, 10(8):1 185-1 195.
[20] 荣辉, 吴兵兵, 杨贤庆, 等. 海洋微藻高密度异养发酵的研究进展[J]. 食品工业科技, 2018, 39(5):325-330.
[21] SUBRAMANIAM R, THIRUMAL V, CHISTOSERDOV A, et al. High-density cultivation in the production of microbial products [J]. Chemical and Biochemical Engineering Quarterly, 2018, 32(4):451-464.
[22] 李伟娜, 尚子方, 段志广, 等. 毕赤酵母高密度发酵产Ⅲ型类人胶原蛋白及其胃粘膜修复功能[J]. 生物工程学报, 2017, 33(4): 672-682.
[23] WANG T, LU Y, YAN H, et al. Fermentation optimization and kinetic model for high cell density culture of a probiotic microorganism: Lactobacillus rhamnosus LS-8 [J]. Bioprocess and Biosystems Engineering, 2020, 43(3):515-528.
[24] ACHARYA B, DUTTA A, BASU P. Ethanol production by syngas fermentation in a continuous stirred tank bioreactor using Clostridium ljungdahlii[J]. Biofuels, 2019, 10(2):221-237.
[25] 徐富增, 王柯, 李善元, 等. 拟指数—DO-stat两阶段补料策略在糖蜜酵母高密度培养中的应用[J]. 食品与发酵工业,2019, 45(7): 15-21.
[26] 王维卓. 重组大肠杆菌高密度发酵生产类人胶原蛋白Ⅱ发酵过程优化[D]. 西安: 西北大学, 2010.
[27] LI X, HUANG C, XU C Q, et al. High cell density culture of baker's yeast FX-2 based on pH-stat coupling with respiratory quotient [J]. Biotechnology and Applied Biochemistry, 2019, 66(3):389-397.
[28] HU Z C, ZHENG Y G, SHEN Y C. Dissolved-oxygen-stat fed-batch fermentation of 1,3-dihydroxyacetone from glycerol by Gluconobacter oxydans ZJB09112 [J]. Biotechnology and Bioprocess Engineering, 2010, 15(4):651-656.
[29] ZHAN X B, ZHU L, WU J R, et al. Production of polysialic acid from fed-batch fermentation with pH control [J]. Biochemical Engineering Journal, 2002, 11(2):201-204.
[30] 杨晓勇. 甘油培养基中有机氮源对大肠杆菌生长和外源蛋白表达影响的研究[D]. 上海: 华东理工大学, 2013.