豆豉是一类历史悠久的发酵豆制品,拥有独特的风味和较高的食用、药用价值[1],深受消费者喜爱。豆豉以大豆或黑豆为主要原料,在多种微生物的共同作用下发酵,产生活性肽、大豆低聚糖、大豆异黄酮、类黑精等一系列活性物质[2-3],使豆豉具有抗癌、抗氧化及促进免疫调节等生理活性[4-6]。
氧化应激被认为是造成许多慢性疾病如心血管疾病、糖尿病等的重要因素[7],而食物中的抗氧化成分可以减少氧化应激对机体的损伤,从而防止由自由基损伤导致的相关疾病[8]。大豆含有多种天然抗氧化成分如多酚、VC、异黄酮等[9-10],表现出良好的抗氧化活性。其中,大豆异黄酮是人们研究最多的物质,目前已发现的大豆异黄酮共有12种,大豆及普通大豆食品中的异黄酮主要是以糖苷形式存在(占97%~98%)。在发酵过程中,微生物产生的β-葡萄糖苷酶使豆豉中大豆异黄酮构成发生转变,生成大豆异黄酮苷元[11]。研究发现,A环上的酚羟基越多,其抗氧化作用越强,因此苷元型异黄酮较糖苷型具有更强的抗氧化活性[12]。XU等[5]研究表明大豆制品在发酵期间,大豆中糖苷型异黄酮有向苷元型转换的趋势,且豆豉经过发酵后,抗氧化活性增加[13]。
豆豉的分类方法有多种,按照加工原料可分为黄豆和黑豆豆豉;根据腌制口味可分为淡豆豉、咸豆豉和酒豆豉3种;豆豉还可以根据发酵微生物的不同分为毛霉型、曲霉型、根霉型和细菌型[14]。由于不同优势微生物菌群发酵的豆豉产酶能力的差异,豆豉在发酵过程中大豆异黄酮由糖苷型向苷元型转化程度也不同[15],最终导致其抗氧化活性出现差异。此外豆豉发酵的原料、工艺、环境等均会对其抗氧化活性造成影响[16-18]。为了解不同类型豆豉在抗氧化活性方面的差异以及影响因素,通过比较10种不同品牌豆豉(2种细菌型、5种曲霉型以及3种毛霉型豆豉)的总抗氧化能力、羟基自由基(·OH)清除率以评价抗氧化能力的差异,并通过测定总多酚、大豆异黄酮及各组分探究导致各豆豉抗氧化能力差异的原因。
1 材料与方法
1.1 材料与试剂
福林酚, 合肥博美生物科技有限责任公司;没食子酸、大豆苷、大豆黄苷、染料木苷、大豆素、大豆黄素、染料木素标准品(纯度≥98%),成都曼思特生物科技有限公司;乙腈、二甲基亚砜,色谱纯;其余试剂均为分析纯;总抗氧化试剂盒(T-AOC),南京建成生物工程研究所。
1.2 仪器与设备
AUY220微量分析天平,岛津公司;Agilent 1100 series高效液相色谱仪,安捷伦;LGJ-10真空冷冻干燥机,北京松源华兴科技发展有限公司;Thermo Scientific Multiskan FC全波长酶标仪,上海旦鼎国际贸易有限公司;H-2050R高速冷冻离心机,美国贝克曼公司;KQ3200E超声波振荡器,上海五相仪器仪表有限公司;KHW-S-4电热恒温水浴锅,天津市泰斯特仪器有限公司。
1.3 试验方法
1.3.1 样品来源
样品豆豉均为发酵成熟适当脱水后的纯豆豉样品,其中细菌型2种、曲霉型5种、毛霉型3种,因为根霉型主要是印尼的丹贝所以没有采购到相应样品。各样品经真空冷冻干燥后粉碎,过80目筛,置于-80 ℃保存备用。
表1 豆豉样品清单
Table 1 Details of Douchi samples

编号名称地域原料类型B-Y大山美味纳豆日本 北海道大豆B-H滨梨纳豆日本 北海道大豆细菌型A-YLY永利园豆豉福建 安南黑大豆A-TPQ太平桥豆豉湖南 浏阳泥豆A-DXY稻香元豆豉江西 南昌黑豆A-LFR辣夫人豆豉岳阳 平江县东北大豆A-YHF叶丰华豆豉广东 阳江黑豆曲霉型M-YC永川豆豉重庆 永川黑豆M-YJJ杨晋记豆豉广西 贺州黑豆M-HY黄姚豆豉广西 昭平县黑豆毛霉型
1.3.2 pH值
按照GB 5009.239—2016《食品安全国家标准 食品酸度的测定》进行测定。
1.3.3 总氨基酸含量
样品处理:以m(豆豉物料)∶m(蒸馏水)=1∶10的比例超声30 min,8 000 r/min,离心15 min,取上清液备用。提取液按照国标GB 5009.124—2016《食品中氨基酸的测定》进行测定。根据水溶性蛋白含量等于水解氨基酸含量之和,计算出水溶性蛋白含量。
1.3.4 水解度
样品中的氨基酸态氮含量测定采用GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》;总氮含量按照GB/T 6432—2018《饲料中粗蛋白的测定 凯氏定氮法》。按照公式(1)计算水解度:
水解度![]()
(1)
1.3.5 总多酚的测定
样品处理:以m(豆豉物料)∶m(体积分数为70%乙醇溶液)=1∶10的比例超声30 min,8 000 r/min,离心15 min,取上清液备用。
采用Folin-酚比色法进行测定。标准曲线绘制:称取没食子酸25 mg溶解于100 mL蒸馏水中。分别取0.1、0.2、0.3、0.4、0.5 mL于5支比色管中,分别加入体积分数为10%的Folin-酚试剂2.5 mL和7.5 g/mL Na2CO3溶液2 mL,加水定容至10 mL。在45 ℃水浴中反应15 min,波长765nm处测定其吸光度。样品测定:取提取液1 mL,按上述步骤操作,试验重复3次,取平均值。没食子酸标准曲线方程为:y=4.172x+0.103 8, R2=0.995 4。
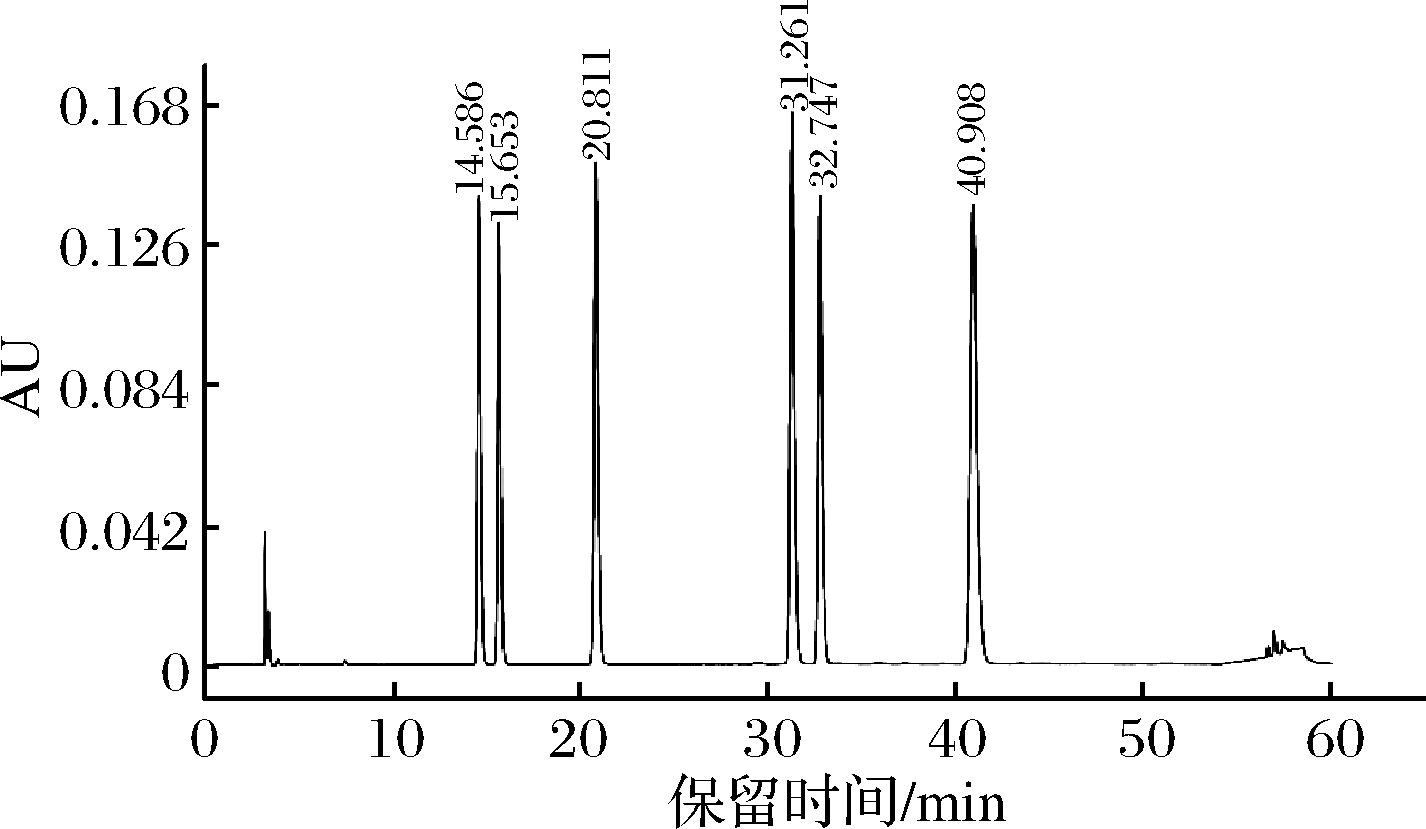
图1 标准样品色谱图
Fig.1 Chromatogram of standard sample
1.3.6 大豆异黄酮的测定
1.3.6.1 样品处理
分别称取10种豆豉样品粉末0.4~0.5 g,分别加入体积分数80%甲醇溶液溶解后超声20 min,定容至50 mL。摇匀后于8 000 r/min离心15 min。取上层清液过0.45 μm针孔式滤膜备用。
1.3.6.2 色谱条件
Agilent C18色谱柱 250 mm×4.6 mm×5 μm;流动相A乙腈与流动相B磷酸水溶液(pH 3.0)梯度洗脱详情见表2;流速1.0 mL/min;波长260 nm;进样量10 μL;柱温30 ℃。
表2 梯度洗脱参数
Table 2 Parameter of gradient elution
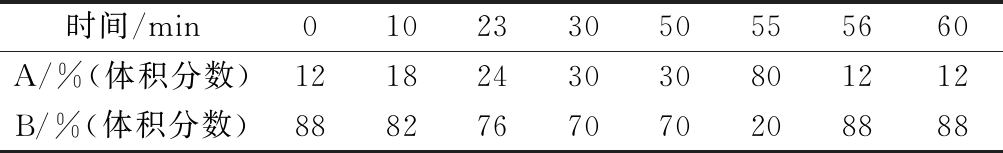
时间/min010233050555660A/%(体积分数)1218243030801212B/%(体积分数)8882767070208888
1.3.6.3 标准曲线的绘制
配制6种400 mg/L单标准品溶液,分别配制成8.0、16.0、24.032.0、40.0 mg/mL五种不同质量浓度的混合标准溶液。以下是各标品的出峰时间以及标准曲线:大豆苷(14.586 min)标准曲线y=39 269x-10 463,R2=0.999 7;大豆黄苷(15.653 min)标准曲线y=37 741x-10 470,R2=0.999 5;染料木苷(20.811 min)标准曲线y=54 862x-31 384,R2=0.999;大豆素(31.261 min)标准曲线y=62 736x-33 920,R2=0.998 3;大豆黄素(32.747 min)y=50 738x-26 673,R2=0.999;染料木素(40.908 min)y=83 819x-87 887,R2=0.996 6。
1.3.7 羟自由基(·OH)清除率的测定
测试管吸光度(A1):5 mol/L的邻苯二氮菲溶液1.5 mL,加入pH 7.4的磷酸盐缓冲液2.0 mL,混匀后,加入7.5 mol/L的FeSO4溶液1.0 mL,混匀后再加入1.0 mL/L的H2O2 1.0 mL,以蒸馏水补充至10 mL, 37 ℃水浴保温1 h,在波长510 nm处测定吸光度。对照管吸光度(A0)与上述方法差别在于不加H2O2和提取物。试样溶液管吸光度(A2):在测试管测完后分别加入各豆豉提取液1 mL。试验重复3次,取平均值。按公式(2)计算清除率:
·OH清除率![]()
(2)
1.3.8 总抗氧化能力测定
按照T-AOC试剂盒说明制作标准曲线和测定豆豉提取液的总抗氧化能力,依据数据计算出总抗氧化能力值相当于其数值倍的Trolox。
1.3.9 数据分析
试验平行测定3次,采用Excel 2003、Origin 9.0、SPSS软件进行数理统计分析、相关性分析和聚类分析。
2 结果与讨论
2.1 基础指标测定
由表3可知,不同优势菌群发酵豆豉的pH、水溶性蛋白含量及水解度均具有明显差异。其中pH高低顺序为:细菌型纳豆>毛霉型豆豉>曲霉型豆豉。2种细菌型豆豉B-Y和B-H的pH明显高于其他豆豉样品,其中以B-Y的pH最高(7.1±0.01),毛霉型豆豉的pH均大于5.20,较曲霉型豆豉稍高。这与邵良伟等[19]认为传统霉型豆豉是在酸性环境下制曲的结论相符。
表3 不同类型豆豉的pH、水溶性蛋白含量及水解度
Table 3 pH, degree of hydrolysis and water-soluble protein content of different Douchi
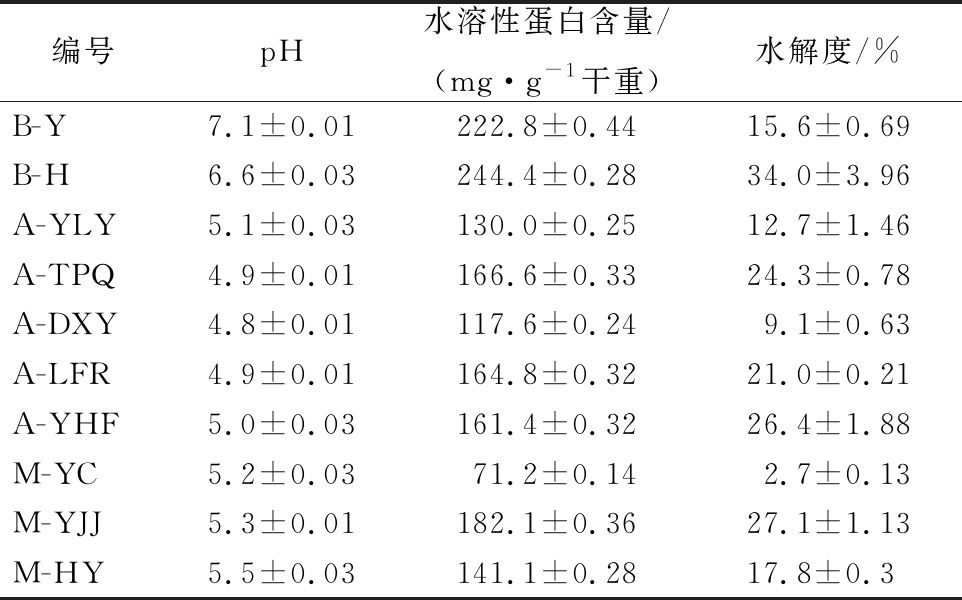
编号pH水溶性蛋白含量/(mg·g-1 干重)水解度/%B-Y7.1±0.01222.8±0.4415.6±0.69B-H6.6±0.03244.4±0.2834.0±3.96A-YLY5.1±0.03130.0±0.2512.7±1.46A-TPQ4.9±0.01166.6±0.3324.3±0.78A-DXY4.8±0.01117.6±0.249.1±0.63A-LFR4.9±0.01164.8±0.3221.0±0.21A-YHF5.0±0.03161.4±0.3226.4±1.88M-YC5.2±0.0371.2±0.142.7±0.13M-YJJ5.3±0.01182.1±0.3627.1±1.13M-HY5.5±0.03141.1±0.2817.8±0.3
豆豉的水溶性蛋白含量与水解度均可反映蛋白质的水解程度,可作为判断豆豉成熟的标准。细菌型B-Y和B-H的水溶性蛋白含量明显高于其他类型豆豉,且均大于20%。曲霉型豆豉中A-TPQ、A-LFR、L-YHF的水溶性蛋白质含量均为165 mg/g左右,而其他2种A-YLY、A-DXY相对较低。毛霉型豆豉的水溶性蛋白含量差异较大,其中以M-YC最低,为(71.2±0.14)mg/g。所有豆豉中以细菌型纳豆B-H的水解度最高,为(34±3.96)%,毛霉型豆豉M-YC则为水解度最低样品,水解度为(2.7±0.13)%,其变化趋势与水溶性蛋白含量一致。
纳豆发酵过程中,纳豆芽孢杆菌菌体增殖速度快,能够迅速产生大量蛋白酶引起蛋白质的降解[20],这可能是导致纳豆的水溶性蛋白质含量及水解度较高的原因;同时,霉菌型豆豉发酵工艺中的洗霉工序会引起水溶性蛋白流失,导致水溶性蛋白含量偏低。此外,由于不同厂家的豆豉生产工艺上存在差异,如洗霉、晒制、蒸煮程度、添加辅料种类以及发酵时间都会影响水溶性蛋白质含量及pH的变化[21-22]。
2.2 豆豉的总酚和大豆异黄酮含量
2.2.1 总多酚含量
由图2可知,B-Y、B-H两种细菌型纳豆总多酚含量明显低于其他类型豆豉(除M-YC外),这可能与纳豆以黄豆作为原料,而其他豆豉多以富含花色苷及总酚的黑大豆为原料[23]有关。曲霉型豆豉的5种样品中A-TPQ、A-DXY、A-LFR的总酚含量接近,其中以A-TPQ含量最高,为(57.2±0.03) mg/100 g,而A-YLY、A-YHF的总酚含量较同类型豆豉稍低。毛霉型豆豉中除M-YC的多酚含量最低为(21.8±0.05) mg/100 g外,M-YJJ(71.9±0.91) mg/100 g及M-HY(67.5±1.52) mg/100 g的多酚含量均在所有豆豉中较高。
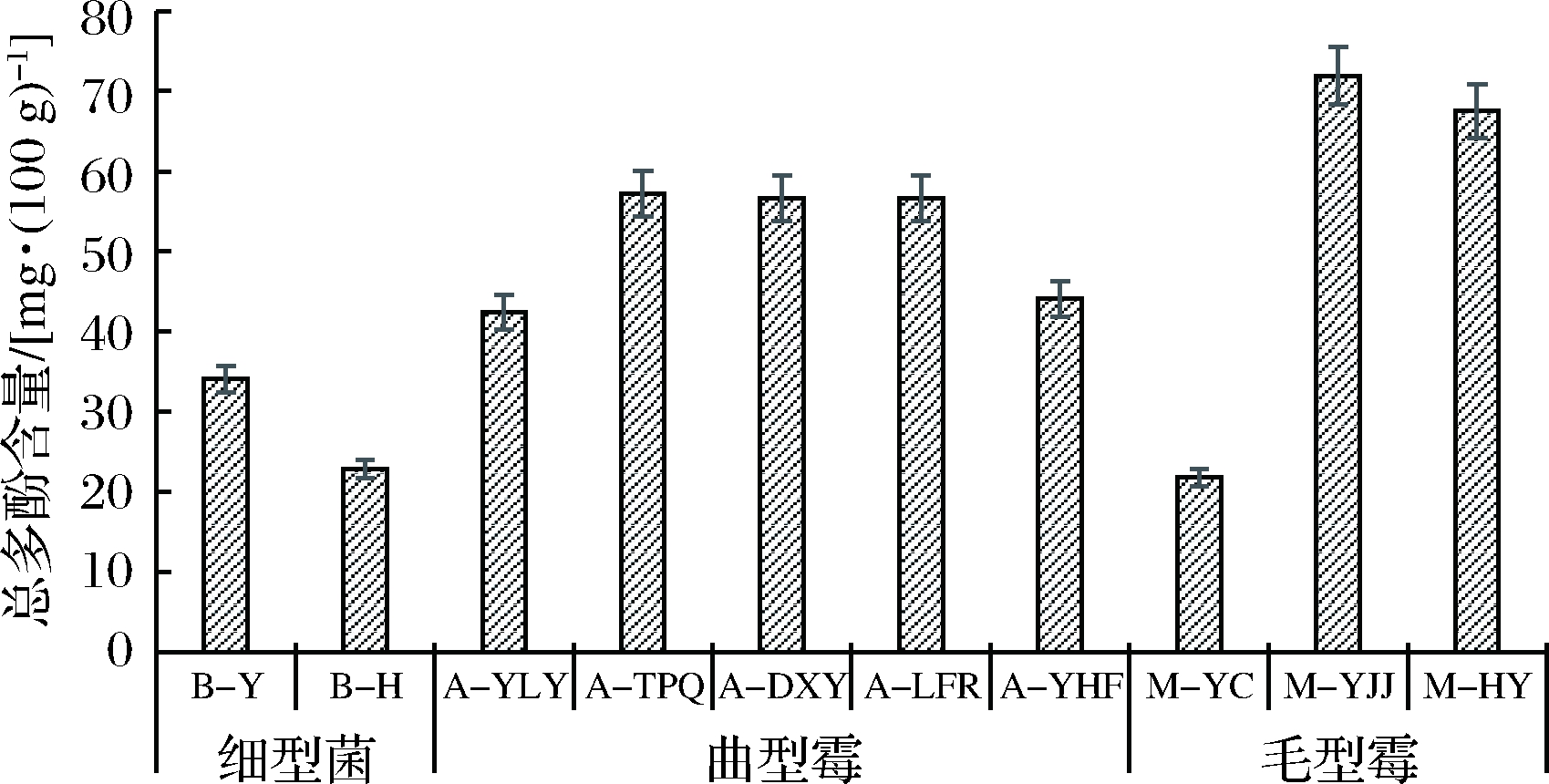
图2 不同类型豆豉的总多酚含量
Fig.2 Polyphenol content of different Douchi
2.2.2 大豆异黄酮含量
未发酵大豆中的大豆异黄酮主要为糖苷型的大豆苷、大豆黄苷、染料木苷,在发酵过程中,由于微生物能够分泌β-葡萄糖苷酶,将异黄酮糖苷水解为具有更强抗氧化活性的异黄酮苷元[15]。但由于不同类型豆豉中主要微生物不同,转化程度有所差异,详见图3、表4。
表4 不同豆豉的大豆异黄酮含量 单位:mg/kg
Table 4 Soy isoflavone content of different Douchi
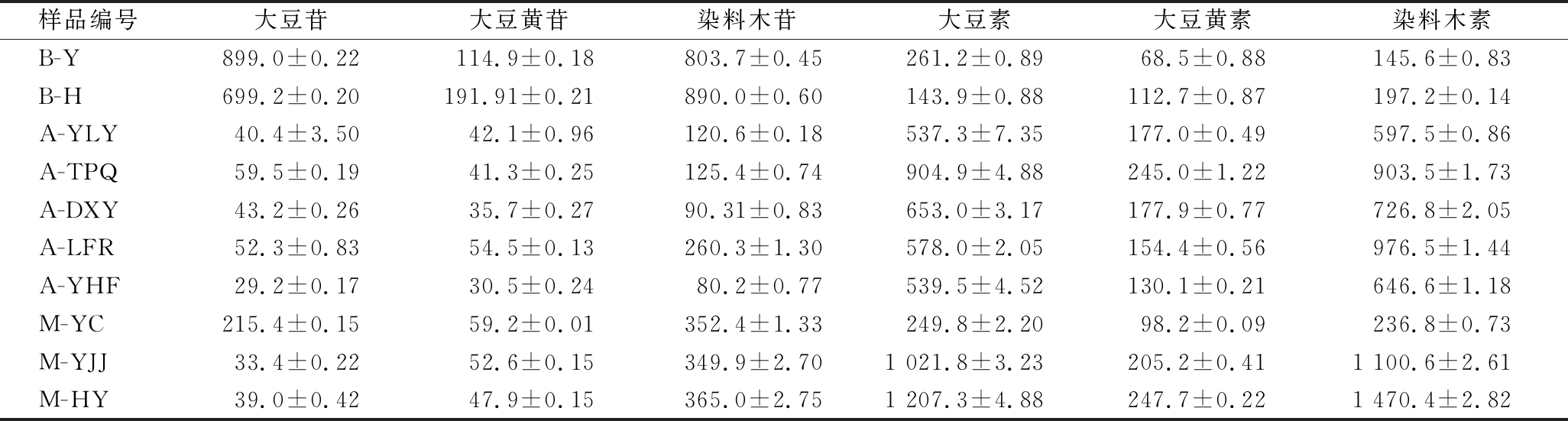
样品编号大豆苷大豆黄苷染料木苷大豆素大豆黄素染料木素B-Y899.0±0.22114.9±0.18803.7±0.45261.2±0.8968.5±0.88145.6±0.83B-H699.2±0.20191.91±0.21890.0±0.60143.9±0.88112.7±0.87197.2±0.14A-YLY40.4±3.5042.1±0.96120.6±0.18537.3±7.35177.0±0.49597.5±0.86A-TPQ59.5±0.1941.3±0.25125.4±0.74904.9±4.88245.0±1.22903.5±1.73A-DXY43.2±0.2635.7±0.2790.31±0.83653.0±3.17177.9±0.77726.8±2.05A-LFR52.3±0.8354.5±0.13260.3±1.30578.0±2.05154.4±0.56976.5±1.44A-YHF29.2±0.1730.5±0.2480.2±0.77539.5±4.52130.1±0.21646.6±1.18M-YC215.4±0.1559.2±0.01352.4±1.33249.8±2.2098.2±0.09236.8±0.73M-YJJ33.4±0.2252.6±0.15349.9±2.701 021.8±3.23205.2±0.411 100.6±2.61M-HY39.0±0.4247.9±0.15365.0±2.751 207.3±4.88247.7±0.221 470.4±2.82
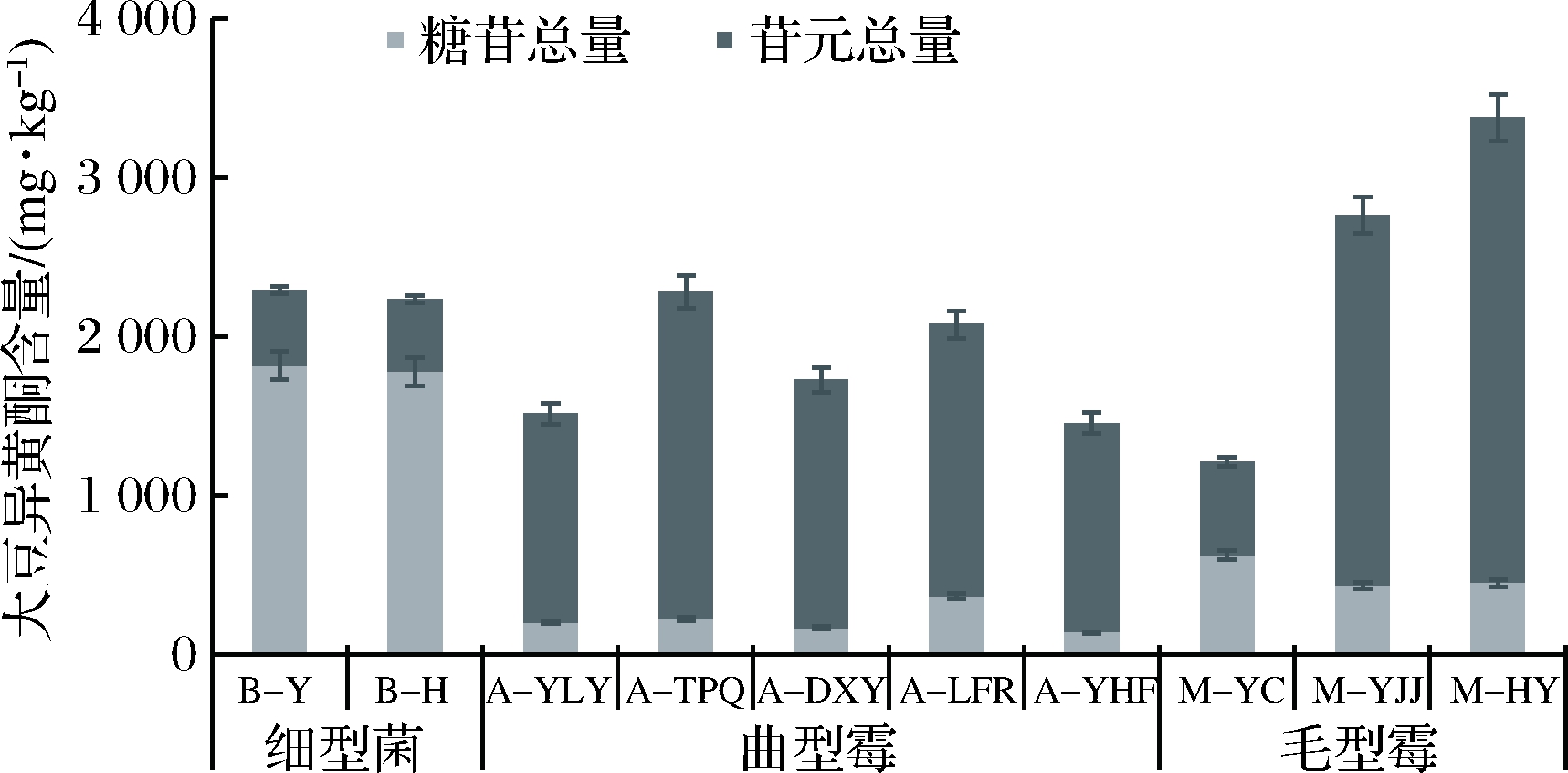
图3 不同豆豉中糖苷型和苷元型大豆异黄酮总含量
Fig.3 Changes in total contents of glucosides and aglycone in different Douchi
由图3可知,在所有豆豉样品中,M-YC的大豆异黄酮总含量最低,为(1 214.4±9.32) mg/kg,M-HY最高,为(3 377.3±20.6) mg/kg,其次为同类型豆豉M-YJJ。细菌型豆豉(B-Y、B-H)虽然大豆异黄酮总量不低,但两者的苷元型异黄酮仅占总量的20.73%和20.30%,其中B-H的苷元型异黄酮含量在所有样品中最低,为(453.7±0.81) mg/kg。5种曲霉型豆豉的苷元型大豆异黄酮占比均>82%,其中A-TPQ、A-DXY、A-YHF的占比超90%。毛霉型豆豉中M-HY的苷元型异黄酮含量在所有样品中最高,为(32 925.4±12.33) mg/kg,其占比达到86.62%。
2.3 豆豉的总酚和大豆异黄酮含量
由表5可知,细菌型纳豆B-Y和B-H的抗氧化活性接近,且明显弱于毛霉型和曲霉型豆豉,以B-H的总抗氧化能力(0.1±0.04) mmol/L和·OH清除率(5.4±0.04)%最低。在霉型豆豉中,M-HY的总抗氧化能力最高,为(0.6±0.08) mmol/L,A-DXY的·OH清除率最大,为(65.3±0.62)%,而A-YHF的·OH清除率与总抗氧化能力均为霉型豆豉中最低。
表5 不同豆豉的总抗氧化能力和·OH清除率
Table 5 Antioxidant capacity and ·OH clearance of different Douchi
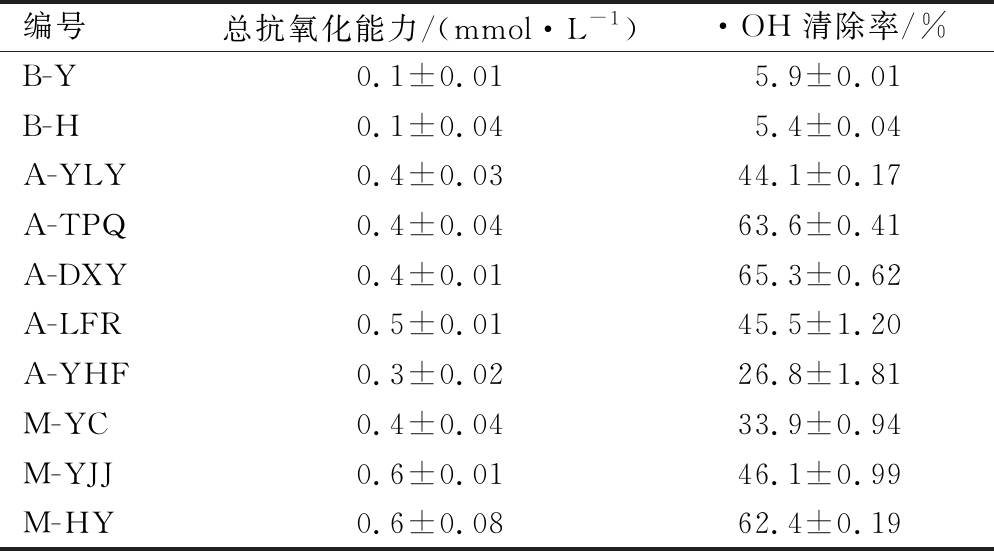
编号总抗氧化能力/(mmol·L-1)·OH清除率/%B-Y0.1±0.015.9±0.01B-H0.1±0.045.4±0.04A-YLY0.4±0.0344.1±0.17A-TPQ0.4±0.0463.6±0.41A-DXY0.4±0.0165.3±0.62A-LFR0.5±0.0145.5±1.20A-YHF0.3±0.0226.8±1.81M-YC0.4±0.0433.9±0.94M-YJJ0.6±0.0146.1±0.99M-HY0.6±0.0862.4±0.19
纳豆抗氧化活性显著弱于霉型豆豉,可能是因为纳豆是在黄豆中接种纳豆芽孢杆菌进行纯种发酵,而中国传统豆豉(曲霉型以及毛霉型豆豉)均属于混菌发酵。吴兰芳等[24]研究自然发酵豆豉与纯种发酵豆豉的抗氧化活性,结果表明,自然发酵豆豉抗氧化性>纯种发酵豆豉。此外,不同类型豆豉的抗氧化能力(表5)与多酚及大豆异黄酮含量(图2,表4)变化趋势较为一致,说明抗氧化活性物质(多酚及大豆异黄酮)含量的差异也可能是导致豆豉抗氧化活性差异的重要因素。为进一步论证豆豉抗氧化能力的影响因素,对不同类型豆豉的抗氧化能力及多酚含量、异黄酮含量进行了相关性分析。
2.4 抗氧化活性与多酚、大豆异黄酮的相关性分析
表6中采用Pearson’s相关性系数分析了10种不同来源的豆豉中抗氧化活性与总多酚、大豆异黄酮总含量以及大豆异黄酮苷元含量等的相关性。
表6 ·OH清除率、总抗氧化能力与总多酚和苷元型大豆异黄酮含量的相关性分析
Table 6 Correlation of coefficients between ·OH clearance, total antioxidant and the total phenols, aglycones of soybean isoflavone

注:“*”表示在0.05水平(双侧)上显著相关;“**”表示在0.01水平(双侧)上极显著相关,“-”表示未检出
指标总多酚含量苷元型含量·OH清除率总抗氧化能力pH总异黄酮含量总多酚含量1-0.753**0.792**--苷元型含量-10.803**0.853**--·OH清除率0.753**0.803**10.794**-0.782**0.213总抗氧化能力0.792**0.853**0.794**1-0.729*0.31pH---0.782**-0.729*1 - 总异黄酮含量--0.2130.31 - 1
结果表明,·OH清除率、总抗氧化能力与总多酚、大豆异黄酮苷元含量极显著(P<0.01)相关,但与大豆异黄酮总量相关性较低,说明总多酚、苷元型大豆异黄酮含量的变化是导致不同类型豆豉抗氧化能力差异的重要原因。其中,大豆异黄酮苷元含量与·OH清除率、总抗氧化能力的相关性较总多酚更强,分别为0.803和0.853,说明苷元含量对豆豉抗氧化活性的影响更大。CHUNG等[13]也认为豆豉发酵过程中苷元型异黄酮以及总多酚的含量增加是导致其抗氧化能力增强的主要原因。同时,总多酚、苷元含量与总抗氧化能力的相关性较·OH清除率更大,说明多酚和苷元含量对总抗氧化能力影响更大。此外,pH与·OH清除率及总抗氧化能力呈负显著相关(P<0.05),其中与·OH清除率的相关性为-0.782,表明pH对豆豉的·OH清除活性的抑制更大。朱新鹏等[25]对黑蒜提取物做抗氧化研究亦发现pH>7以上的环境中,抗氧化活性下降快。除了上述原因外,抗氧化能力也受到其他因素的影响,如曲霉型和毛霉型豆豉发酵过程中产生的类黑精也会有助于豆豉的抗氧化能力提升[26],而乙醇、食盐的添加会降低豆豉的抗氧化活性等[17-18]。
3 结论与分析
本研究探索了不同类型豆豉的抗氧化活性及其影响因素,研究发现:细菌型pH在7左右,明显高于霉型豆豉;细菌型水溶性蛋白含量明显高于霉型豆豉,水解度亦有类似趋势,说明细菌型豆豉的蛋白质水解程度较霉型豆豉深。此外,霉型豆豉的抗氧化活性普遍高于细菌型纳豆,其中以M-HY的总抗氧化能力最高,为(0.6±0.08) mmol/L,A-DXY的·OH清除率最大,为(65.3±0.62)%,细菌型豆豉的苷元型大豆异黄酮和总多酚含量均低于其他豆豉,其中B-H最低(453.7±0.81)、(22.9±0.89) mg/100 g。进一步的相关性分析结果表明,试验样品豆豉的总多酚、大豆异黄酮苷元含量分别与·OH清除率、总抗氧化能力的4个相关值均为极显著相关,pH与·OH清除率呈负显著相关,说明豆豉中总多酚、大豆异黄酮苷元含量的增加有助于其·OH清除活性和总抗氧化能力的增加,而pH增加会影响豆豉的抗氧化能力。
[1] HE B, LI H, HU Z, et al. Difference in microbial community and taste compounds between Mucor-type and Aspergillus-type Douchi during koji-making[J]. Food Research International, 2019, 121(4):136-143.
[2] CHA Y S, YANG J A, BACK H I,et al. Visceral fat and body weight are reduced in overweight adults by the supplementation of Doenjang, a fermented soybean paste[J]. Nutrition Research & Practice, 2012, 6(6):520-526.
[3] AMAROWICZ R, SHAHIDI F. Antioxidant activity of broad bean seed extract and its phenolic composition[J]. Journal of Functional Foods, 2017,38(1):656-662.
[4] JAYACHANDRAN M, XU B J. An insight into the health benefits of fermented soy products[J]. Food Chemistry,2019, 271(15):368-371.
[5] XU Lu, DU Bin, XU Baojun. A systematic, comparative study on the beneficial health components and antioxidant activities of commercially fermented soy products marketed in China[J]. Food Chemistry,2015(2):174-179.
[6] XIA X D, LING W H, MA J, et al An anthocyanin-rich extract from black rice enhances atherosclerotic plaque stabilization in apolipoprotein E-deficient mice[J]. Journal of Nutrition, 2006, 136(8): 2 220-2 225.
[7] WEI W, LIU Q, TAN Y, et al. Oxidative stress, diabetes, and diabetic complications[J]. Hemoglobin, 2009, 33(5):8-9.
[8] IWAI K, NAKAYA N, KAWASAKI Y. et al. Inhibitory effect of natto, a kind of fermented soybeans, on LDL oxidation in vitro[J]. Journal of Agricultural and Food Chemistry, 2002, 50(12): 3 592-3 596.
[9] LEE M J, CHUNG I M, KIM H, et al. High resolution LC- ESI-TOF-mass spectrometry method for fast separation, identification,and quantification of 12 isoflavones in soybeans and soybean products[J]. Food Chemistry, 2015, 176(6): 254-262.
[10] BROUNS F. Soya isoflavones: a new and promising ingredient for the health foods sector[J]. Food Research International, 2002, 35(2): 187-193.
[11] SUN Junming, SUN Baoli, HAN Fenxia, et al. Rapid HPLC method for determination of 12 isoflavone components in soybean seeds[J]. Agricultural Sciences in China, 2011, 10(1):1-77.
[12] DEJAN Z ![]() et al. Antioxidant activity relationship of phenolic compounds in Hypericum perforatum L[J]. Chemistry Central Journal, 2011, 5(1):34-40.
et al. Antioxidant activity relationship of phenolic compounds in Hypericum perforatum L[J]. Chemistry Central Journal, 2011, 5(1):34-40.
[13] CHUNG S K, MEE S L, SANG C P. Higher antioxidant properties of Chungkookjang, a fermented soybean paste, may be due to increased aglycone and malonylglycoside isoflavone during fermentation[J]. Nutrition Research, 2007, 27(11):719-727.
[14] 蔡尤林, 杜冰, 余飞, 等. 豆豉营养成分及研究进展[J]. 中国调味品, 2015,40(6):119-123.
[15] ZHI Shuaichang, LAN Hui, BAO Yali, et al. Progress of β-glucosidase from microorganisms[J]. Advances in Microbiology, 2018, 7(2): 79-86.
[16] 邹磊,汪立君,呼晴,等.后发酵过程中乙醇对豆豉抗氧化能力的影响[J].食品与发酵工业,2006,32(12):28-32.
[17] 万俊,程伟伟,沈小璐,等.加盐量对人工发酵豆豉后发酵中理化特性及抗氧化活性的影响[J].食品与机械,2018,34(8):29-32.
[18] WANG Lijun, YIN Lijun, LI Dong, et al. Influences of processing and NaCl supplementation on isoflavone contents and composition during Douchi manufacturing[J]. Food Chemistry,2006,101(3):1 247-1 253.
[19] 邵良伟,邹强,张琼,等.潼川豆豉制曲过程中理化指标变化规律[J].中国调味品,2019,44(10):14-17;25
[20] 刘彦敏,沈璐,王康,等.传统大豆发酵食品中纳豆芽孢杆菌的分离及纳豆发酵[J].食品科学,2020,41(2):208-214.
[21] 韩佳冬. 永川豆豉蛋白水解产物与黑色素形成机理的研究[D]. 重庆:西南大学, 2013.
[22] 张雨浩, 马良, 周梦柔,等. 永川豆豉发酵过程中蛋白水解作用与黑色素形成关系[J]. 食品科学, 2013,(19)14-17;25.
[23] 侯竹美,王凤舞.黄豆豉和黑豆豉在发酵过程中的抗氧化性[J].青岛农业大学学报(自然科学版),2016,33(1):45-48.
[24] 吴兰芳,蒋爱民,曲直,等.霉菌型黑豆豆豉的主要成分及其抗氧化活性研究[J].现代食品科技,2013,29(1):51-54.
[25] 朱新鹏,王英美.5种大蒜制备黑蒜的品质比较[J].中国调味品,2019,44(1):117-119;124.
[26] 何健,黄占旺,吴进菊,等.曲霉型豆豉类黑精的抗氧化活性研究[J].江西农业大学学报,2006(5):776-779.