大豆低聚肽是以大豆蛋白为原料,经生物技术酶处理获得的小分子肽[1],具有抗氧化、抗血管紧张素转化酶(angiotensin converting enzyme,ACE)[2]、增强免疫、延迟衰老[3]等功效,同时由于其溶解性高且易于被人体吸收,常被用作优良的食品保健原料。目前大豆肽的制备多采用单酶水解[2],即利用碱性蛋白酶[3]对大豆蛋白进行水解,但该法制备的大豆肽仍含有一些大分子多肽,不利于人体吸收,且具有一定的苦味,造成口感较差。目前有采用双酶水解的方法制备大豆低聚肽,以进一步降低分子质量,减少多肽的苦味。何东平等[4]采用碱性蛋白酶和中性蛋白酶复配,得到的大豆多肽分子质量均低于1 kDa。SCHMIDT等[5]分别用碱性蛋白酶、中性蛋白酶和木瓜蛋白酶水解大豆分离蛋白后,再利用风味蛋白酶进一步水解,获得了具有低致敏性和低苦味的大豆多肽,表明双酶法能更好地改善大豆多肽的功能。
有研究显示,大豆多肽苦味的主要物质是2~10肽等疏水性小肽,富含疏水性残基[6]。ZHU等[7]从酱油中制备纯化苦味疏水性肽,发现分子质量越小,对口感的影响越大,并且从苦味成分中分离了多个3肽,均显示苦味和涩味。因此,采用内肽酶结合外肽酶共同水解大豆蛋白是降低大豆多肽分子质量、苦味及改善多肽功能的有效方法。课题组前期研究获得了一种新型的外肽酶——三肽酶[8],能够有效地切割三肽等小分子多肽,尤其对酪氨酸、丙氨酸、脯氨酸等疏水性残基特异性较强。本研究采用碱性蛋白酶和三肽酶双酶法制备低苦味大豆低聚肽,并对其溶解性、苦味鲜味、抗氧化和抗ACE等功能方面进行研究,探究三肽酶在大豆低聚肽制备中的潜在能力,为大豆蛋白深加工提供依据。
1 材料与方法
1.1 实验材料
1.1.1 主要实验材料
大豆分离蛋白由江苏全盈生物技术有限公司提供;三氯乙酸、Na2HPO4和葡萄糖等化学试剂均为国产分析纯;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、碱性蛋白酶(200 000 U/g),北京索莱宝科技有限公司;马尿酸组胺酰亮氨酸(hippurate histamine leucine, HHL)、血管紧张素转化酶(angiotensin converting enzyme, ACE),Sigma公司。
1.1.2 主要实验设备
DKZ-2型电热恒温振荡水槽,上海精宏实验设备有限公司;UV 2000型分光光度计,美国尤尼柯公司;TG16-WS型台式高速离心机,湖南湘仪离心机仪器有限公司;F-7000 荧光分光光度计,日立高新技术公司;Waters-1525液相色谱仪,美国沃特公司;TS-5000Z味觉分析系统(电子舌),日本INSENT公司。
1.2 实验方法
1.2.1 三肽酶和大豆低聚肽的制备
三肽酶的制备:利用本实验室构建的1株三肽酶重组枯草芽孢杆菌WB600表达菌株[8],将其在TB培养基中发酵表达,在37 ℃、200 r/min条件下培养发酵20~24 h。发酵液通过盐析,Ni柱纯化后得到三肽酶。
对大豆分离蛋白进行酶解处理,先用碱性蛋白酶酶解,酶解时间1 h;酶解温度50 ℃;底物质量浓度70 mg/mL;酶底物比[E/S] 4∶100(质量比),然后于95 ℃水浴灭酶,冷却至室温后,样品冻干得到大豆多肽ASPI。相同碱性蛋白酶酶解条件,再加入三肽酶进行2次酶解,酶解时间1 h;酶解温度40 ℃;酶底物比[E/S] 4∶100得到的样品冻干后保存,得到大豆低聚肽。
工艺流程:碱性蛋白酶酶解→三肽酶酶解→冷冻干燥→大豆低聚肽
1.2.2 大豆肽分子质量测定
采用Waters 1525高效液相色谱仪测定,参考文献[9]。
色谱条件:色谱柱为UltrahydrogelTM Linear 300 mm×7.8 mm×2 μm。
流动相:0.1 mol/L NaNO3;流速:0.9 mL/min;柱温:45 ℃。
1.2.3 溶解性和水解度(degree of hydrolysis, DH)测定
溶解性:准确称取1 g蛋白样品,100 mL容量瓶定容,pH 7.0,混合振荡2 h,转速3 000×g离心15 min,取上清液[10]。
溶解性![]()
(1)
水解度是指蛋白裂解的肽键数与总肽键的比例,使用邻苯二甲醛o-phthalaldehyde,OPA)法[11]。按公式(2)计算:
(2)
式中:SerNH2,1 g大豆分离蛋白的氨基当量,mmol;α,常数,0.97;β,常数,0.34;htot,常数,7.80。
1.2.4 大豆低聚肽电子舌分析与感官评价
采用电子舌[12]测定大豆多肽的苦味、鲜味,将各样品溶液倒入电子舌的专用烧杯中,蒸馏水用作清洁溶剂。采样时间约为180 s,测量后清洁2~3 min。每1 s收集1次样品数据,并将测量值的平均值用作每个样品1次测量的数据。为了减小测量误差,将每个平行测量重复4次,去除第1数据,并且将测量3次的每个传感器的平均值作为1个样本数据,用于随后的数据分析。
采用排序检验法[13]对样品的苦味、鲜味进行排序,将样品按照苦味鲜味最强到最弱排序。感官评定小组由9位20~30岁的小组成员组成(4男5女),这些小组成员都对苦味和鲜味有很好的辨别能力。感官评定温度控制在室温(25±2)℃,不同样品间用清水漱口以恢复原感觉能力[14]。
1.2.5 DPPH自由基清除能力测定
取2 mL质量浓度为2 mg/mL的样品加入2 mL质量浓度为0.04 mg/mL的DPPH 无水乙醇溶液,混合均匀避光反应30 min,测其在波长517 nm处的吸光值(Ai)[15-16]; 空白对照是用2 mL无水乙醇溶液代替DPPH溶液,操作同上,测得吸光度值为Aj; 用2 mL无水乙醇代替样品作为参比,操作同上,测得吸光度值A0。根据公式(3)计算样品的DPPH自由基清除率:
DPPH自由基清除率![]()
(3)
1.2.6 羟基自由基(·OH)清除能力测定
取2 mL质量浓度为2 mg/mL的样品,加2 mL浓度为6 mmol/L的FeSO4和2 mL浓度为6 mmol/L的H2O2,混匀静置10 min,然后再加2 mL浓度为6 mmol/L的水杨酸,混匀静置30 min,在波长510 nm处测定吸光值为Ai[17];将去离子水代替水杨酸测定的吸光值定为Aj;将去离子水代替样品测定的吸光值定为A0。根据公式(4)计算样品的羟基自由基清除率:
羟基自由基清除率![]()
(4)
1.2.7 超氧阴离子自由基![]() 清除能力测定
清除能力测定
将1 mL的 2 mg/mL的样品和5 mL的Tris-HCl溶液(50 mmol/L,pH 8.0)混合液在25 ℃的水浴锅中温育20 min,然后加入50 μL的3 mmol/L的焦性没食子酸溶液,在25 ℃的水浴锅中反应4 min,在波长325 nm处测定吸光值Ai[18];将去离子水代替焦性没食子酸测定的吸光值定为Aj;将去离子水代替样品测定的吸光值定为A0。根据公式(5)计算样品的![]() 清除率:
清除率:
![]() 清除率
清除率![]()
(5)
1.2.8 还原力测定
取2 mg/mL样品溶液、0.2 mol/L的磷酸缓冲溶液(pH 6.6)和质量分数1%的铁氰化钾溶液各2 mL充分混合,于50 ℃水浴锅中反应,然后加入质量分数1% 的三氯乙酸终止反应。转速3 000×g离心10 min,取2 mL上清液,去离子水作对照组,分别加入2 mL的质量分数0.1%的FeCl3溶液,充分混合,在50 ℃水浴下保温10 min。在波长700 nm处测定吸光度,以吸光度表征还原力。
1.2.9 ACE抑制活性测定
取25 μL样品,加入125 μL的马尿酸组胺酰亮氨酸溶液(5 mmol/L),在37 ℃水浴锅中孵育5 min,加入20 μL的ACE(0.1 U/mL),在37 ℃孵育1 h,然后加入350 μL的HCl溶液(1 mol/L)以终止反应。然后加入1.7 mL乙酸乙酯萃取产生的马尿酸,振荡30 s,在3 000×g的条件下离心5 min,然后取上层液1 mL 在120 ℃烘箱内烘干,冷却后加入1 mL去离子水溶解,超声5 min,在波长228 nm处测吸光值,去离子水作为空白[19]。根据公式(6)计算样品的ACE抑制率:
ACE抑制率![]()
(6)
式中:A,空白组(用缓冲液替代样品)的吸光度;B,样品的吸光度;C,失活组(先加入HCl,后加入ACE)的吸光度。
1.2.10 游离氨基酸测定
采用氨基酸专用高效液相色谱仪测定,参考文献[20]。
1.2.11 统计分析方法
对感官排序样品进行统计分析,使用Friedman检验[21]计算出统计量F来分析样品之间的显著性差异,同时利用Kramer检定法[21]对样品进行分组。根据公式(7)计算样品的统计量F:
(7)
式中:j,评价员数;p,样品数量;R1、R2、…、Rp,各样品的秩和。
2 结果与分析
2.1 大豆低聚肽的溶解性和水解度
大豆蛋白的溶解性是对其加工利用的重要性能之一,可能还会对后续加工处理产生影响,所以溶解性也是其品质的一种体现[22]。水解度可以从侧面反映小分子肽含量及其功能活性的变化,如图1所示。
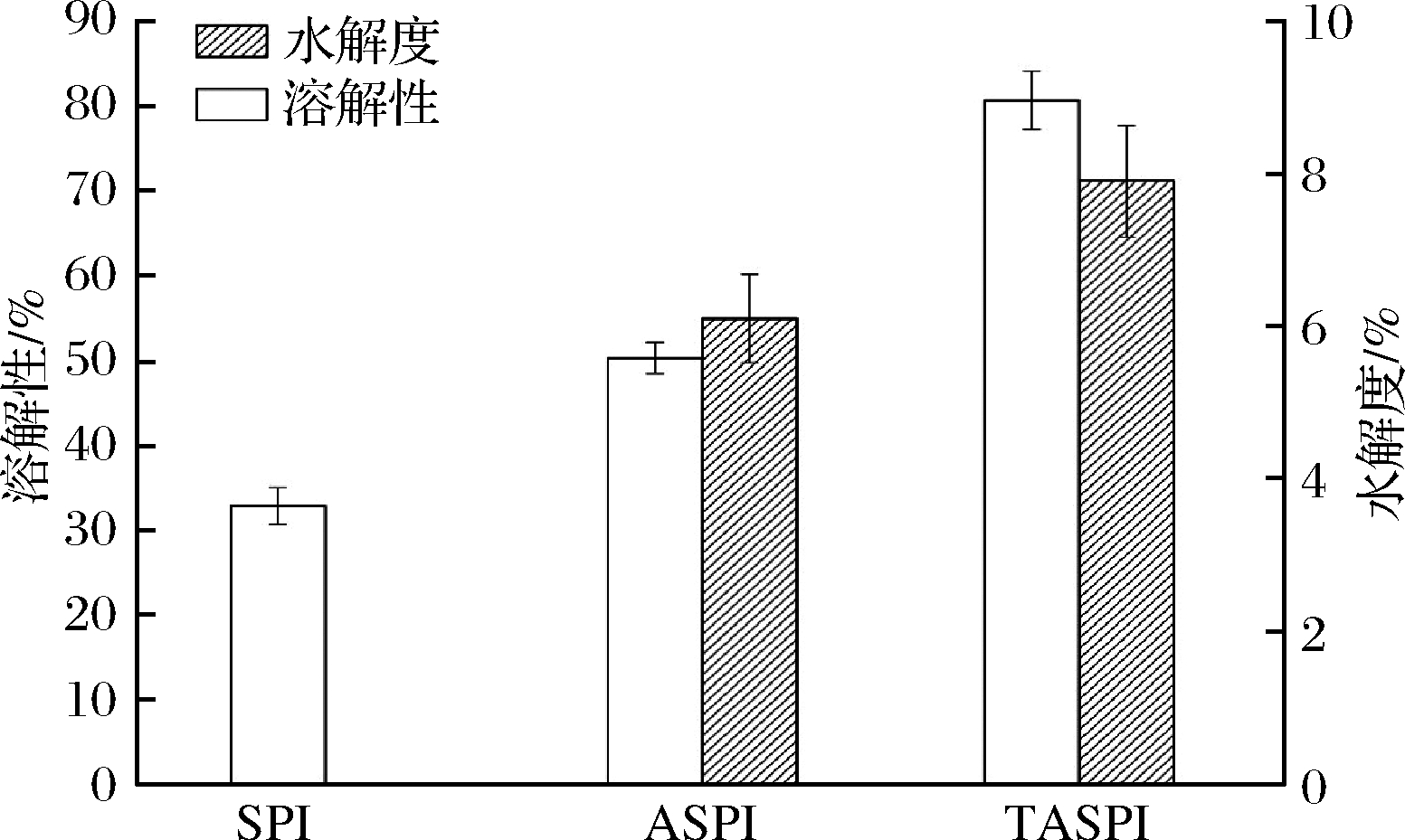
图1 SPI、ASPI和TASPI的溶解性和水解度分析
Fig.1 Solubility and degree of hydrolysis analysis of SPI, ASPI and TASPI
大豆分离蛋白(soy protein isolates, SPI)的溶解度为32.9%,碱性蛋白酶水解制备得到的大豆多肽(soybean peptides,ASPI)溶解度为50.3%,水解度为6.1%;碱性蛋白酶复配三肽酶水解得到的大豆低聚肽(soybean oligopeptide,TASPI)溶解度为80.6%,水解度为7.9%,与单酶水解相比,分别提高了60.4%和29.5%。这是由于三肽酶可以将碱性蛋白酶水解获得的部分多肽进一步水解,得到分子质量更小的肽,从而水解度提高,而且这些小分子肽更易溶解,溶解性亦相应提高[23]。以上结果表明,碱性蛋白酶和三肽酶复配水解大豆蛋白可以有效地提高其溶解性和水解度,有利于其在溶液中发挥它的功能性质。
2.2 大豆低聚肽分子质量分布及游离氨基酸组成分析
大豆蛋白分子质量是评价大豆蛋白产品的关键指标,小分子的物质易被人体吸收。如图2所示,SPI中95%均是>5 kDa的组分,小分子质量的组分很低。TASPI中<1 kDa的组分占81.8%,与ASPI(58.1%)相比提高了23.7%,表明三肽酶双酶法制备小分子多肽优于单酶法。低聚肽的主要分子质量区间是0.2~1 kDa,TASPI中此组分含量占69.3%,与ASPI的48.5%相比,提高了20.8%;<0.2 kDa的部分主要是游离氨基酸,ASPI占比是9.6%,TASPI占比是12.4%,提高了2.8%,这与三肽酶的性质相关,作为外切酶会释放游离氨基酸。综上所述,结合三肽酶双酶法较单酶法可以更好地提高小分子肽含量,会使更多的大分子蛋白水解成小分子物质,含有更多的低聚肽能够更易被人体吸收,有利于大豆多肽发挥功能。
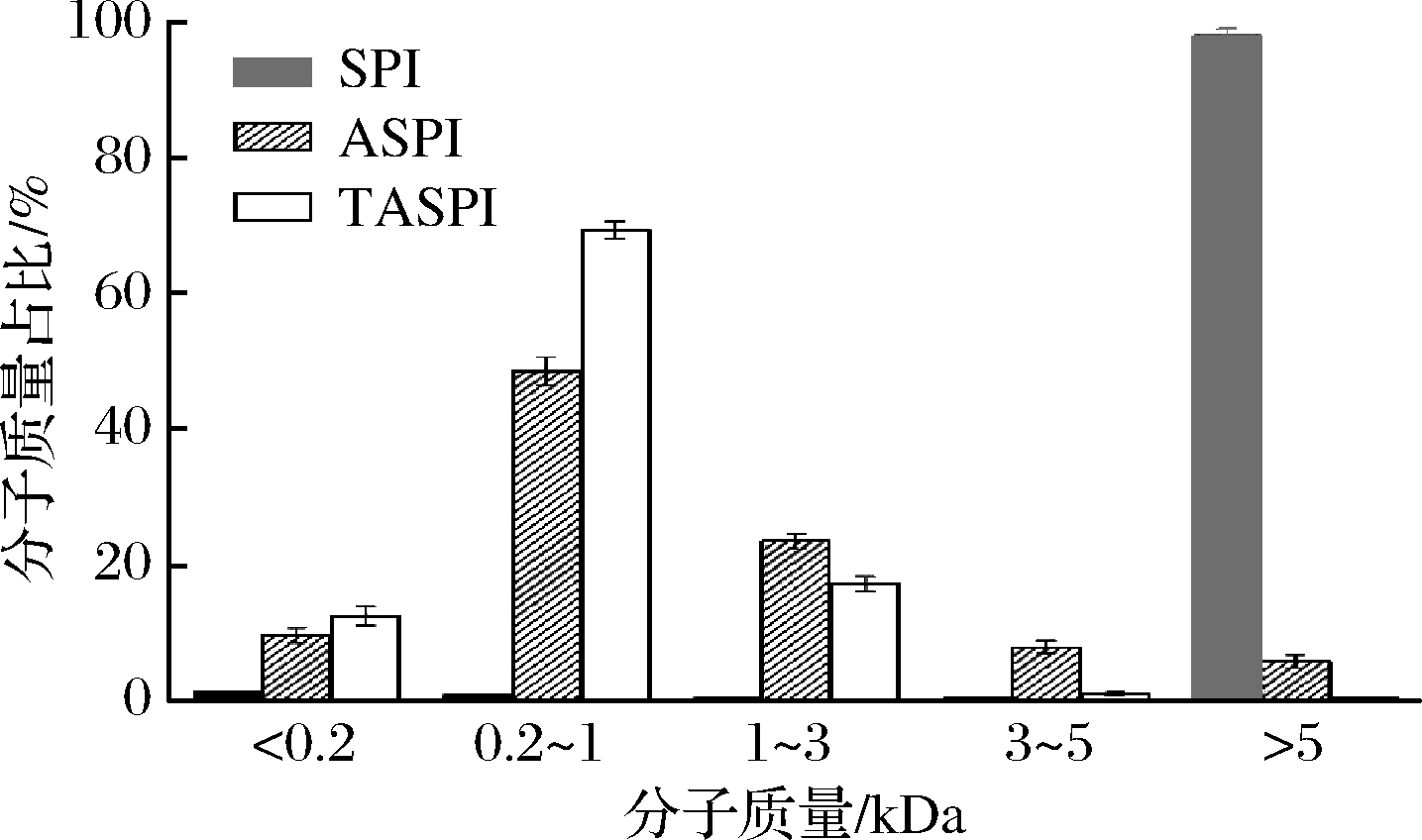
图2 SPI、ASPI和TASPI的分子质量分布
Fig.2 Molecular weight distributions of SPI,ASPI and TASPI
由表1可以看出,TASPI中游离氨基酸含量显著高于ASPI,这是由酶的性质所决定的,碱性蛋白酶属于内切酶,可将长的肽链切割成小的肽段,释放的游离氨基酸较少,而三肽酶属于外肽酶,能够切割末端的氨基酸,故TASPI中游离氨基酸含量较高,其中Arg、Glu、Gly、Tyr含量明显提高,这与三肽酶的酶切特性一致。另外,TASPI中含有呈鲜味氨基酸[24](Glu、Asp、Gly、Ala)约5.67 g/100 g,占总游离氨基酸的47.4%,呈苦味氨基酸[24-25](Leu、Ile、Tyr、Phe)约2.77 g/100 g,占总游离氨基酸的23.0%,与ASPI相比,呈鲜味氨基酸含量提高了24.7%,呈苦味氨基酸含量降低了12.2%,由此可以看出,三肽酶水解后可降低大豆肽的苦味。
表1 SPI、ASPI和TASPI中的游离氨基酸含量 单位:g/100 g
Table 1 Free amino acid content in SPI, ASPI and TASPI
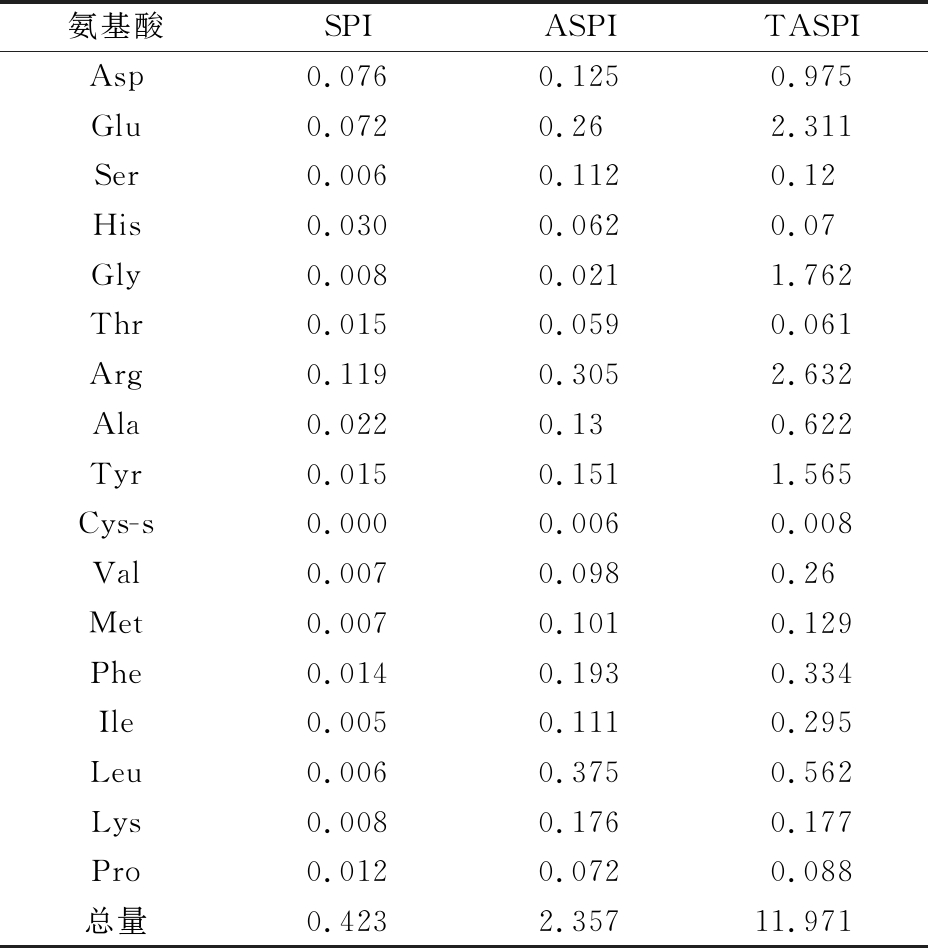
氨基酸SPIASPITASPIAsp0.0760.1250.975Glu0.0720.262.311Ser0.0060.1120.12His0.0300.0620.07Gly0.0080.0211.762Thr0.0150.0590.061Arg0.1190.3052.632Ala0.0220.130.622Tyr0.0150.1511.565Cys-s0.0000.0060.008Val0.0070.0980.26Met0.0070.1010.129Phe0.0140.1930.334Ile0.0050.1110.295Leu0.0060.3750.562Lys0.0080.1760.177Pro0.0120.0720.088总量0.4232.35711.971
2.3 大豆低聚肽苦味、鲜味测定
苦味和鲜味是大豆多肽产品味觉的重要指标,利用电子舌技术将样品的苦味和鲜味数据化,如图3所示。
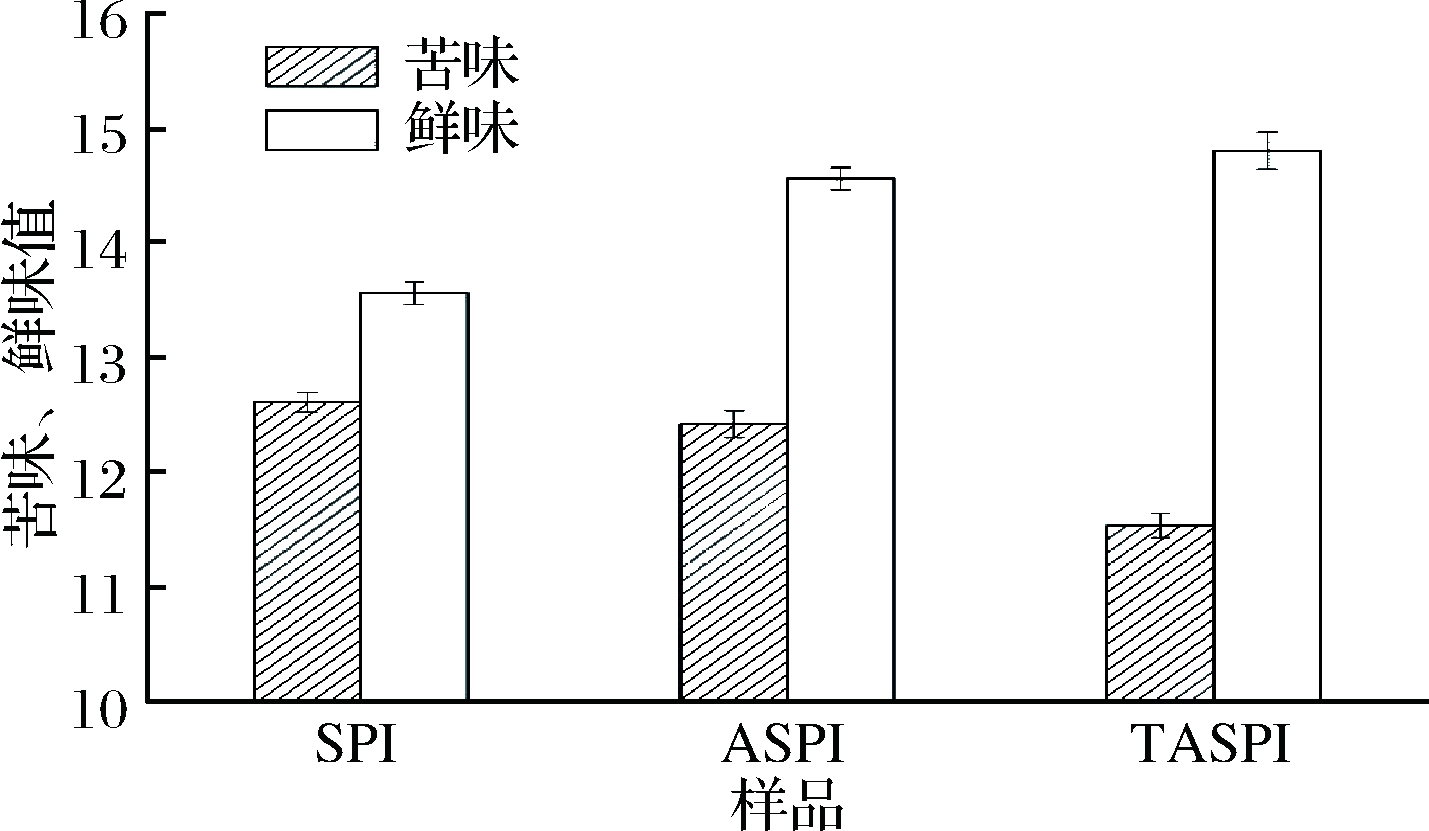
图3 SPI、ASPI和TASPI的苦味、鲜味测定分析
Fig.3 Bitterness and umami analysis of SPI,ASPI and TASPI
ASPI的苦味值和鲜味值分别是12.4和14.6,TASPI苦味值和鲜味值分别是11.5和14.8,苦味值较ASPI降低7.3%,鲜味值提高1.4%,苦味和鲜味均比ASPI有所改善。
通过感官评定对样品的苦味和鲜味进行排序,表2是9位评价人员对3种样品的苦味排序和鲜味排序,然后通过表3的样品苦味的秩和R,使用Friedman检验[21]计算出统计量F=10.1,远大于检验近似临界值8.66(显著性水平α=0.01),说明样品之间存在非常显著差异。用Kramer检定法[21]对3个样品分组,根据评价人数9和样品数3,查阅《食品感官鉴评》[14]书中附表,得到秩和临界值为12~24(α=0.01),SPI的秩和12.5和ASPI的秩和16都在临界值区间内被划分为一组,同组内无显著性差别,TASPI秩和25.5,大于临界最大值24,TASPI单独划分一组,与其他样品存在显著性差异,由此得到结论,在0.01显著水平上,TASPI苦味最低。同样对于鲜味,通过表3鲜味的秩和,计算统计量F=12.3,也远大于检验近似临界值8.66(显著性水平α=0.01),样品之间也存在非常显著差异。分组发现SPI单独一组,ASPI和TASPI一组,2组存在显著性差异。得到结论,在0.01显著水平上,ASPI和TASPI鲜味最强,这与电子舌检测结果一致。
表2 SPI、ASPI和TASPI的排序结果
Table 2 Sorting results of SPI, ASPI and TASPI

注:A代表SPI,B代表ASPI,C代表TASPI
评价员苦味排序和秩次鲜味排序和秩次1 2 31 2 31A > B > CB > C > A2A > B > CC > B > A3A > B > CC > B = A4A = B > CC > B > A5B > A > CB = C > A6A = B > CC = B > A7B = A = CC = B > A8A > B = CB > C > A9B = A > CC > B > A
表3 SPI、ASPI和TASPI苦味、鲜味的秩次和秩和
Table 3 Ranks and rank sums of bitterness and umami of SPI, ASPI, and TASPI

注:排序相同取平均秩次
评价员苦味秩次SPIASPITASPI苦味秩和鲜味秩次SPIASPITASPI鲜味秩和112363126212363216312362.52.51641.51.53632165213631.51.5661.51.53631.51.567222631.51.56812.52.56312691.51.5363216样品秩和R12.51625.55426.51512.554
通过以上电子舌检测和感官评定,结果表明,结合三肽酶的双酶法可以有效降低大豆多肽的苦味,适用于制备低苦味的大豆功能肽。
2.4 大豆低聚肽抗氧化能力分析
分别从DPPH自由基、羟自由基![]() 清除率和还原力4个方面综合评价大豆肽ASPI和TASPI的抗氧化能力。如图4所示,TASPI的DPPH自由基清除率
清除率和还原力4个方面综合评价大豆肽ASPI和TASPI的抗氧化能力。如图4所示,TASPI的DPPH自由基清除率![]() 清除率分别为72.4%、78.4%和89.3%,与ASPI相比,分别提高了48.1%、100%和14.2%。由此可以看出,结合三肽酶双酶法制备的大豆多肽的抗氧化活性明显优于单酶法制备的大豆多肽。抗氧化活性在一定程度上取决于分子质量分布,较小的肽具有较高的反应能力,小分子肽的含量越多,抗氧化性能越强。结合2.2的结果,TASPI中<1 kDa的组分占81.8%,与ASPI相比提高了23.7%,含有更多的十肽以下的小肽,更容易形成良好的抗氧化物质;而且三肽酶可以使ASPI进一步水解,产生更多的小分子肽(例如二肽,三肽等)来作为供体提供更多的电子,与自由基反应将其转化为稳定的产物,终止自由基的链式反应,同时三肽酶水解释放一些疏水性氨基酸也会提高多肽的抗氧化能力。
清除率分别为72.4%、78.4%和89.3%,与ASPI相比,分别提高了48.1%、100%和14.2%。由此可以看出,结合三肽酶双酶法制备的大豆多肽的抗氧化活性明显优于单酶法制备的大豆多肽。抗氧化活性在一定程度上取决于分子质量分布,较小的肽具有较高的反应能力,小分子肽的含量越多,抗氧化性能越强。结合2.2的结果,TASPI中<1 kDa的组分占81.8%,与ASPI相比提高了23.7%,含有更多的十肽以下的小肽,更容易形成良好的抗氧化物质;而且三肽酶可以使ASPI进一步水解,产生更多的小分子肽(例如二肽,三肽等)来作为供体提供更多的电子,与自由基反应将其转化为稳定的产物,终止自由基的链式反应,同时三肽酶水解释放一些疏水性氨基酸也会提高多肽的抗氧化能力。

图4 SPI、ASPI和TASPI的抗氧化活性
Fig.4 Antioxidant activity of SPI、ASPI and TASPI
从图4-d可以看出,TASPI的还原能力最大,OD700值为0.94,比ASPI的OD700值0.77提高了22.1%。三肽酶可以进一步酶解使长肽链断裂成短肽产生H+增加了还原力,因此TASPI的还原能力会高于ASPI。
综上结果表明,结合三肽酶双酶水解制备的大豆低聚肽TASPI在抗氧化性能上明显优于单酶水解的ASPI,抗氧化性能显著提升。
2.5 大豆低聚肽抗ACE能力分析
ACE通过催化血管紧张素 II(ANG II)的产生和抑制血管扩张剂缓激肽活性,起到控制血压的作用。ACE抑制率可以反映多肽的降血压功能的效果[26],如图5所示,TASPI的ACE抑制率达到83.6%,有很强的ACE抑制效果,比ASPI的74.9%提高了11.6%。目前报道利用酶法制备的大豆ACE抑制肽的ACE抑制率在50%~80%,张焱[27]对比不同蛋白酶制备大豆多肽,发现胃蛋白酶制备的小于1 kDa的大豆多肽ACE抑制活性最高可以达到78.5%,于胜男等[28]利用碱性蛋白酶制备的大豆降血压肽的ACE抑制率达到68.6%。
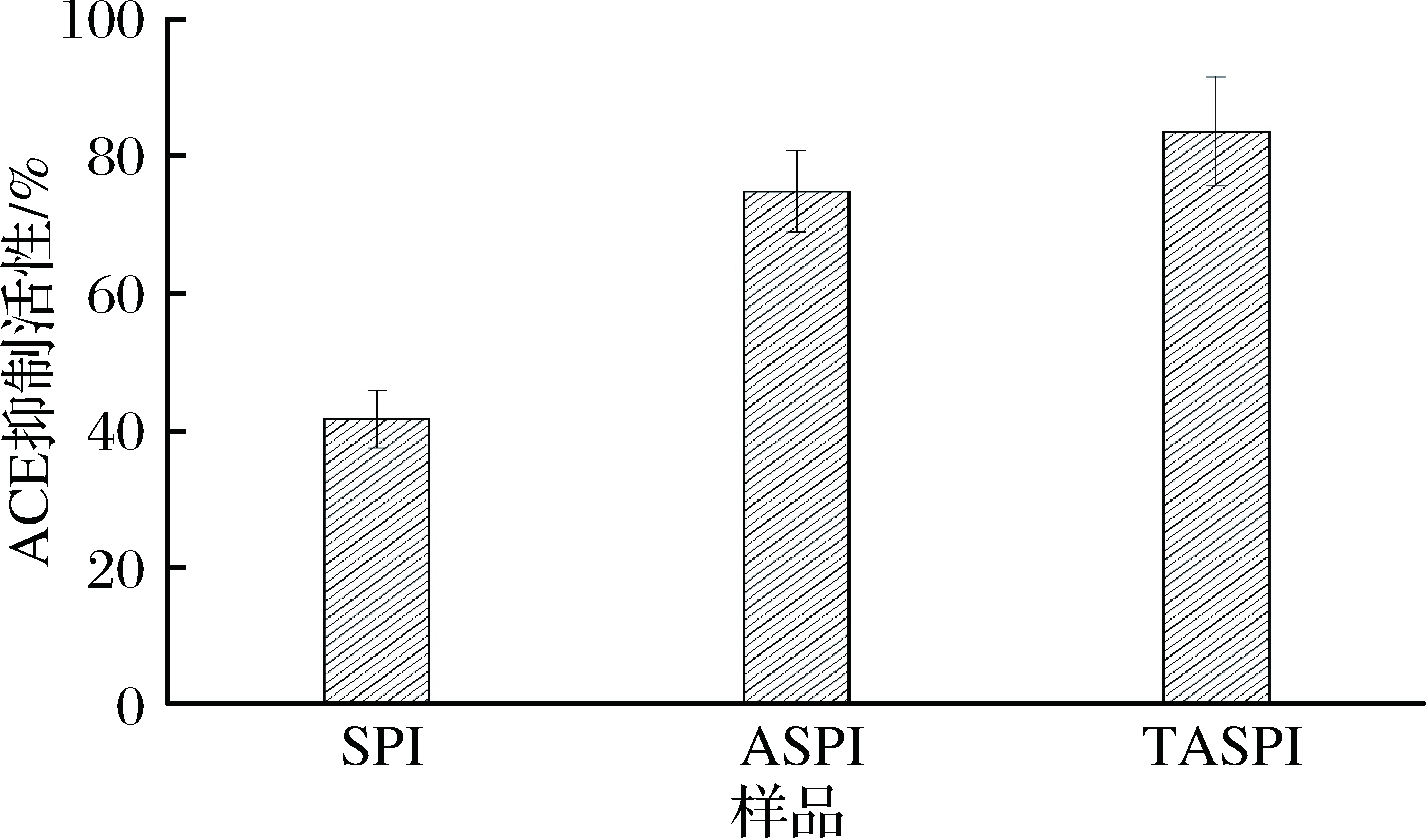
图5 SPI、ASPI和TASPI的ACE抑制率
Fig.5 ACE inhibition rate of SPI,ASPI and TASPI
碱性蛋白酶结合三肽酶双酶水解能够提高大豆多肽的ACE抑制率,主要是和三肽酶的酶切特性有关,能特定地水解一些三肽等小肽产生二肽,而很多二肽均具有较好的ACE抑制率,例如GU等[29]采用RP-HPLC从酱油中分离纯化出多种ACE 抑制肽,经鉴定序列分别为Gly-Tyr、Ser-Tyr、Ala-Tyr、Val-Pro、Val-Gly、Gly-Trp、Ala-Ile、Ala-Phe、Ala-Trp这些二肽。综上所述,碱性蛋白酶结合三肽酶双酶法制备的大豆低聚肽具有良好的抗ACE效果。
3 结论
本研究对结合一种新型三肽酶双酶法制备低苦味的大豆低聚肽进行了功能性质分析,结果表明,双酶水解制备的大豆低聚肽溶解性为80.64%,是单酶水解制备大豆多肽的1.53倍,水解度达到7.9%,提高了30%;<1 kDa的低聚肽占所有多肽的81.8%,提高了23.7%,降低了多肽的分子质量;苦味显著降低,适用于制备低苦味的大豆低聚肽;抗氧化性能提升显著,DPPH自由基、·OH和![]() 清除率分别提高了48.1%、100%和14.2%;同时ACE抑制率达到83.6%,具有较强的降血压功能。因此,结合三肽酶制备的大豆低聚肽不仅苦味降低,而且抗氧化性能及抗ACE功能均有提升,具有良好的应用前景。
清除率分别提高了48.1%、100%和14.2%;同时ACE抑制率达到83.6%,具有较强的降血压功能。因此,结合三肽酶制备的大豆低聚肽不仅苦味降低,而且抗氧化性能及抗ACE功能均有提升,具有良好的应用前景。
[1] 徐天.大豆低聚肽和低聚糖复合物生理功能的研究[D].大连:大连工业大学, 2014.
[2] WANG R, ZHAO H, PAN X, et al. Preparation of bioactive peptides with antidiabetic, antihypertensive, and antioxidant activities and identification of α-glucosidase inhibitory peptides from soy protein[J]. Food Science & Nutrition, 2019,7(5):1 848-1 856.
[3] 徐天,刘艳,郭继强,等.大豆低聚肽和低聚糖复合物对家蚕寿命的影响[J].大豆科学, 2014,33(5):728-730.
[4] 何东平,程雪,马军,等.超声辅助复合酶酶解制备大豆多肽工艺的优化[J].中国油脂, 2018,43(7):72-76.
[5] MEINLSCHMIDT P, SCHWEIGGERT-WEISZ U, BRODE V, et al. Enzyme assisted degradation of potential soy protein allergens with special emphasis on the technofunctionality and the avoidance of a bitter taste formation[J]. LWT-Food Science and Technology, 2016,68:707-716.
[6] 刘伯业. 小麦蛋白低苦味肽的制备及其脱苦机理研究[D].无锡:江南大学, 2017.
[7] ZHU X, ATERHOUSE D S, CHEN J, et al. Bitter-tasting hydrophobic peptides prepared from soy sauce using aqueous ethanol solutions influence taste sensation[J]. International Journal of Food Science & Technology, 2019,55(1):146-156.
[8] 诸葛斌,吴文煜,宗红,等.一种表达三肽酶的重组枯草芽孢杆菌及其构建方法:中国,CN110408583A[P].2019-11-05.
[9] 谷中华,朱旭,杨凌霄,等.小麦面筋蛋白酶解制备合适分子量小肽的研究[J].食品工业科技, 2013,34(24):105-109.
[10] 王利国,刘锐,张民,等.大豆分离蛋白酶解产物的理化性质研究[J].中国食品添加剂, 2018,19(3):73-79.
[11] 宋婷婷,吴珍珍,宗红,等.米曲霉AAP新基因的异源表达及其酶学性质研究[J].食品与发酵工业, 2019,45(5):38-44.
[12] DANG Y, HAO L, ZHOU T, et al. Establishment of new assessment method for the synergistic effect between umami peptides and monosodium glutamate using electronic tongue[J]. Food Research International, 2019,121:20-27.
[13] 魏永义,韩豪敏.排序检验法在食醋感官指标重要性排序中的应用[J].中国调味品, 2018,43(2):118-120.
[14] 张水华,孙君社,薛毅.食品感官鉴评(第二版)[M].广州: 华南理工大学出版社,1999.
[15] 宋春丽,任健,陈佳鹏,等.糖基化及限制性酶解对大豆蛋白结构和抗氧化活性的影响[J].中国油脂, 2017,42(11):65-69.
[16] 张翔,李星星,黄雪松.澳洲坚果糖蛋白的分离纯化及其体外抗氧化能力[J].食品与发酵工业, 2019,45(5):145-150.
[17] 刘丹.大豆抗氧化活性肽的生物制备技术及稳定性研究[D].长春:吉林大学, 2014.
[18] 汪建红,吴维,韩平东.荸荠皮多糖对自由基的清除作用[J].食品研究与开发, 2017,38(20):16-20.
[19] 谯飞.大米蛋白ACE抑制肽制备及其膜高效分离技术的研究[D].哈尔滨:哈尔滨工业大学, 2016.
[20] 夏彦君.大豆蛋白生物加工及功能研究[D].无锡:江南大学, 2019.
[21] 梁慧点,魏永义.排序检验法在火腿肠感官评价中的应用[J].肉类工业, 2019(3):53-55.
[22] 周洋莹,郑红莉,杨文钰,等.大豆分离蛋白-大豆低聚糖糖基化产物溶解性和乳化性分析[J].食品与发酵工业, 2020,46(1):122-128.
[23] 李占方,诸葛斌,宗红,等.生物酶法改性提高植物组织化蛋白的产品特性[J].食品与发酵工业,2017,43(6):66-71.
[24] 胡玲萍,张晓梅,张鸿伟,等.南极磷虾自溶前后氨基酸和胰蛋白酶降解产物的变化[J].食品科学,2019,40(11):1-6.
[25] 刘伯业.小麦蛋白低苦味肽的制备及其脱苦机理研究[D].无锡:江南大学, 2017.
[26] LO W M Y, LI-CHAN E C Y. Angiotensin I converting enzyme inhibitory peptides from in vitro pepsin-pancreatin digestion of soy protein[J]. Journal of Agricultural and Food Chemistry, 2005,53(9):3 369-3 376.
[27] 张焱.大豆蛋白ACE抑制肽的酶法制备及分离纯化[D].合肥:合肥工业大学, 2007.
[28] 于胜男,吴非.制备大豆降血压肽最佳用酶的筛选[J].食品工业科技, 2010,31(5):199-201.
[29] GU Y, WU J. LC-MS/MS coupled with QSAR modeling in characterising of angiotensin I-converting enzyme inhibitory peptides from soybean proteins[J]. Food Chemistry, 2013,141(3):2 682-2 690.