益生菌是活的、对人体健康有益的一类微生物,适量摄入,能够帮助调节肠道的微生态平衡从而有益肠道健康[1-2]。益生菌定植肠道活菌数不低于106 CFU是其发挥益生功效的必要前提,而人体在摄入益生菌后,由于益生菌活性易受人体胃部消化系统的低pH影响,最终能够到达并定植于肠道的益生菌大量减少,不足以发挥相应的益生作用[3-4]。
目前,主要通过对益生菌进行微胶囊化来提高产品的耐酸性。根据不同的包埋材料对益生菌不同的保护原理,包埋材料分为:蛋白质类、多糖类和纤维素类[5-7]。蛋白质类在低于等电点的pH环境下将暴露大量的疏水基团与菌体紧密结合,延缓H+的渗透,目前常通过乳化、复合凝聚和喷雾干燥等工艺对益生菌进行包埋[8-9]。多糖易与金属离子如Ca2+交联形成三维网状结构,将益生菌包埋其中可以阻隔H+的渗透,维持凝胶内部pH环境,常用挤压、乳化等工艺制备微胶囊化益生菌[10-12]。纤维素处于pH 2.0~3.0的环境易析出,呈不溶沉淀,完成对益生菌包埋的同时也可以达到保护益生菌的目的。
尽管现有的包埋方法都能在一定程度上提高益生菌的耐酸性,但产物均为湿微胶囊,含水量较高,不便贮藏,限制了产品的应用。目前常用气流干燥、喷雾干燥和冷冻干燥等方法对产品进行干燥,但气流干燥和喷雾干燥过程温度较高,会较大程度地降低益生菌的活性,而冷冻干燥过程虽然也存在一定的活性损失,但远低于其他干燥工艺[13]。本文选用耐酸性材料并复配相应的冻干保护剂,缓解冷冻干燥和酸性环境对益生菌的损伤,提高益生菌冻干粉的冻干存活率与耐酸性,保持益生菌的生物活性。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
干酪乳杆菌(Lactobacillus casei) CCFM 711,江南大学食品生物技术中心保藏。
1.1.2 试剂
金龙鱼一级大豆油,欧尚超市;酪蛋白酸钠,麦克林生化科技有限公司;胃蛋白酶,生工生物工程上海股份有限公司;羧甲基纤维素钠(DS 0.9),西格玛奥德里奇贸易有限公司;海藻酸钠、CaCO3、NaCl等均为分析纯,国药集团化学试剂有限公司; MRS培养基,青岛海博生物技术有限公司;麦芽糊精、水苏糖、乳清分离蛋白、脱脂乳粉,上海创赛生物科技有限公司。
1.2 仪器设备
GRP-9080型隔水式恒温培养箱,上海森信实验仪器有限公司;FE20型pH计、EL3002型电子天平,梅特勒-托利多仪器(上海)有限公司;MS 3 basic型涡旋振荡器,德国IKA公司; MLS-3750型高温高压灭菌锅,日本SANYO公司;ZHJH-C1115B型超净工作台,上海智诚分析仪器制造有限公司;Lyobeta 5PS冻干机,西班牙Telstar公司。
1.3 实验方法
1.3.1 菌悬液的制备
取保藏于-80 ℃的L.casei CCFM 711甘油保菌管于4 ℃解冻,接种环蘸取保菌液于MRS平板上划线,37 ℃静置培养24 h,挑取平板上的单菌落接种于5 mL MRS 液体培养基中,37 ℃静置培养12 h,活化至第3代,扩大培养,接种量为体积分数4%,37 ℃静置培养12 h,于4 ℃,8 000×g离心20 min,去上清液,收集菌泥,加入适量生理盐水使菌悬液中菌泥质量浓度为500 g/L,混匀,调pH至6.5左右,备用。
1.3.2 冻干保护剂的配制
分别称取糖类冻干保护剂(麦芽糊精、菊粉、抗性糊精、赤藓糖醇、海藻糖、水苏糖)溶于去离子水中,使各保护剂溶液质量浓度为100 g/L,115 ℃高压灭菌20 min,冷却后4 ℃保存备用。
分别称取蛋白质类冻干保护剂(大豆分离蛋白、明胶、脱脂乳粉、豌豆蛋白、鹰嘴豆蛋白、花生蛋白、核桃蛋白)溶于去离子水中,保护剂溶液质量浓度为100 g/L,65 ℃灭菌30 min,冷却后4 ℃保存备用。
将V(冻干保护剂溶液)∶V(菌悬液)=5∶2混合均匀,空白对照组不添加冻干保护剂。
1.3.3 混合保护剂体系的配制
称取适量水苏糖溶于去离子水中,质量浓度达到100 g/L。
称取海藻酸钠10 g/L、羧甲基纤维素钠10 g/L分别溶于2份水苏糖溶液中, 115 ℃高压灭菌20 min,冷却后于4 ℃保存备用,分别记为水苏糖-海藻酸钠,水苏糖-羧甲基纤维素钠。分别称取酪蛋白酸钠5、10、50、100、150 g溶于1 L水苏糖溶液中,65 ℃灭菌30 min,冷却后于4 ℃保存备用,记为水苏糖-酪蛋白酸钠。
1.3.4 保护剂与菌悬液的混合
取上述水苏糖溶液、水苏糖-海藻酸钠溶液、水苏糖-酪蛋白酸钠溶液、水苏糖-羧甲基纤维素钠溶液、糖类冻干保护剂溶液、蛋白质类冻干保护剂溶液与菌悬液以5∶2的体积比混合均匀,空白对照组为生理盐水与菌悬液以5∶2的体积比混合均匀,4 ℃保存备用。
取水苏糖-酪蛋白酸钠溶液与菌悬液以1∶2、3∶2、5∶2、9∶2的体积比混合均匀,4 ℃保存备用。
1.3.5 微胶囊的制备
微胶囊的制备采用张国芳等[14]的方法,略有改动。菌悬液(500 g/L)和混合保护剂(水苏糖-海藻酸钠)分别以体积比2∶1、2∶3、2∶5、2∶7混合,再称取CaCO3加入菌悬液与水苏糖-海藻酸钠溶液中使海藻酸钠与CaCO3的质量比为2∶1、1∶1、1∶2、1∶4、1∶6,混合均匀,并加入到大豆油中,且立即加入Span 80(50、100、200、300、400 μL),磁力搅拌器搅拌15 min,转速为300、400、500、600 r/min。加入含冰醋酸(HAc)的大豆油,使最终水油比为1∶1、1∶3、1∶5、1∶7、1∶9,其中c(HAc)∶c(CaCO3)=2∶1,保持原搅拌速率持续搅拌30 min,使其充分凝胶,待微胶囊形成,加入适量醋酸盐缓冲溶液(pH 5.5),4 ℃静置30 min使水油分离,倾去上层油相。离心(235 r/min)1 min,倾去上清液,洗涤液重悬振荡均匀后,再次离心,除尽油相,收集凝胶颗粒,4 ℃保存备用。
1.3.6 菌悬液与湿微胶囊的真空冷冻干燥
取各保护剂与菌悬液混合液和微胶囊样品各1 mL,分装至西林瓶中,置入冻干机样品腔,预冻至-50 ℃,保持5 h,一次干燥设置为-30 ℃,干燥30 h,二次干燥设置为25 ℃,干燥20 h。
1.3.7 包埋率的计算
参照张国芳等[14]的方法。取0.5 mL湿样品加入到4.5 mL PBS中,旋涡振荡至凝胶颗粒溶解完全释放菌体,取样梯度稀释计数,采用MRS琼脂培养基倾注培养法活菌计数。按公式(1)计算包埋率:
包埋率![]()
(1)
式中:微胶囊悬液中总活菌数量为1 mL微胶囊悬液含菌量与微胶囊悬液体积的乘积,CFU;等量初始菌悬液中总活菌数为1 mL菌悬液含菌量与制备微胶囊加入的菌悬液体积的乘积,CFU。
1.3.8 冻干存活率的计算
冻干存活率的计算如公式(2)所示:
冻干存活率![]()
(2)
式中:湿样品冻干后活菌数为冻干前样品经冷冻干燥后复水的含菌量。
1.3.9 冻干前耐酸性的测定
模拟胃液的配制:用浓HCl将2 g/L NaCl溶液的pH分别调节至2.0、2.5、3.0,115 ℃高压灭菌20 min,冷却后加入3.2 g/L的胃蛋白酶,经0.22 μm滤膜过滤除菌,制得pH值为2.0、2.5、3.0的模拟胃液,现配现用。
称取0.1 mL样品分散于9.9 mL模拟胃液中(pH值为2.0、2.5),37 ℃培养2 h后取样至4.5 mL PBS缓冲液中,梯度稀释计数,其样品耐酸存活率按公式(3)计算:
冻干前耐酸存活率![]()
(3)
式中:W1,0.1 mL样品在10 mL pH 2.0/2.5模拟胃液中处理2 h后的活菌数;W2,0.1 mL样品中的活菌数。
1.3.10 冻干粉耐酸性的测定
参考ASHWAR等[15]的方法,略有改动。取5 mL模拟胃液(pH 2.0、3.0)加入西林瓶中,与冻干粉混合均匀,37 ℃培养2 h后取样至4.5 mL PBS缓冲液中,缓冲液按公式(4)计算耐酸存活率:
冻干粉耐酸存活率![]()
(4)
式中:W2,一瓶冻干粉样品经5 mL模拟胃液处理2 h后活菌数。
称取0.01 g冻干粉分散于10 mL模拟胃液中,37 ℃培养2 h后取样至4.5 mL PBS缓冲液中,梯度稀释计数,缓冲液按公式(5)计算耐酸存活率
耐酸存活率![]()
(5)
式中:W3,0.01 g菌粉在10 mL模拟胃液处理2 h后活菌数。
1.4 数据统计与分析
所有独立实验均重复3次,结果表示为平均数±标准差。试验中不同组(组别>3)之间的显著性差异通过SPSS 16.0软件进行ANOVA判断(Tukey’s检验),P<0.05则认为差异显著。
2 结果与分析
2.1 潜在耐酸性材料对菌体冻干存活率与耐酸性的影响
壁材本身所具有的物理化学性质决定了相应益生菌产品对外界环境的抗性,这对益生菌的保护效果具有重要的影响[16]。实验选取海藻酸钠、酪蛋白酸钠、乳清分离蛋白、羧甲基纤维素钠为代表性保护材料,生理盐水作为对照,直接对各体系进行冷冻干燥,考察各材料本身对于益生菌的保护效果。由表1可知,经pH 3.0模拟胃液处理2 h后,未添加保护剂的对照组存活率仅为19.32%,海藻酸钠、酪蛋白酸钠与羧甲基纤维素钠的添加对干酪乳杆菌的存活率有显著提升,存活率分别为(86.05±3.49)%、(87.32±0.14)%、(87.70±0.40)%。这说明添加保护材料后可以提高干酪乳杆菌在酸性条件下的存活率,对干酪乳杆菌具有保护效果。此外,添加了保护材料的实验组在冷冻干燥的过程中对干酪乳杆菌也具有一定的保护效果,可能是这些保护剂分子质量较大,对菌体形成了包埋,从而在一定程度上提高了冻干存活率。但与WANG等[17]的研究相比,益生菌冷冻干燥后的活性损失较大,仍然有较大的提升空间。目前,通常添加糖类或蛋白类冻干保护剂来提高益生菌在冷冻干燥过程中的冻干存活率,因此需要进一步筛选适用于干酪乳杆菌的冻干保护剂。
表1 潜在耐酸性材料制备干酪乳杆菌CCFM711冻干粉的冻干存活率与耐酸性
Table 1 The freeze-drying survival rate and acid resistance of L. casei CCFM711 lyophilized powder prepared from potential acid-resistant material
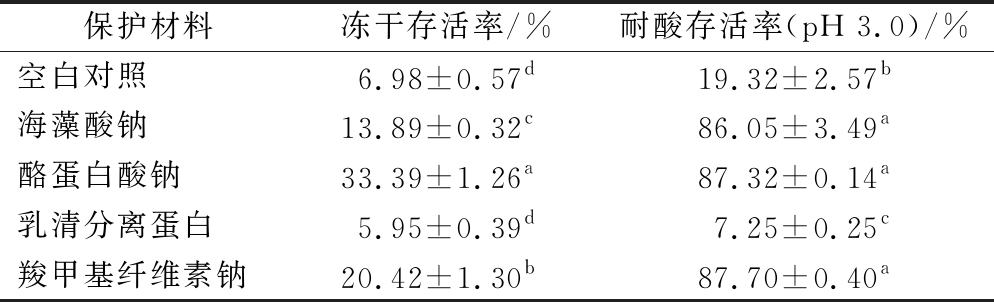
注:同列中不同字母表示数据之间存在显著性差异(P<0.05)(下同);耐酸存活率指每瓶冻干粉样品经5 mL pH 3.0模拟胃液处理2 h的存活率
保护材料冻干存活率/%耐酸存活率(pH 3.0)/%空白对照6.98±0.57d19.32±2.57b海藻酸钠13.89±0.32c86.05±3.49a酪蛋白酸钠33.39±1.26a87.32±0.14a乳清分离蛋白5.95±0.39d7.25±0.25c羧甲基纤维素钠20.42±1.30b87.70±0.40a
2.2 冻干保护剂的筛选
糖类往往含有多个羟基,在冷冻干燥过程中可以取代水分子,与益生菌细胞膜表面的磷酸基团或蛋白质极性基团结合形成氢键,从而避免破坏细胞膜的完整性以及蛋白质的功能性结构[18]。而蛋白质类作为冻干保护剂通常因为它们能够在菌体表面形成蛋白膜,维持益生菌细胞膜的稳定性,避免益生菌因细胞膜的损伤而暴露于外界环境从而影响活性[19]。
基于此,选取6种糖与7种蛋白质,探究它们在冷冻干燥过程中对益生菌活性的影响。由表2可知,未添加冻干保护剂的空白对照组冻干存活率仅为(9.41±0.29)%,冻干保护剂为糖类的实验组冻干存活率均显著高于空白对照组,尤以麦芽糊精、海藻糖与水苏糖的保护效果最好,其冻干存活率分别为(70.00±2.24)%、(78.21±6.65)%、(82.63±1.88)%。以蛋白质作为冻干保护剂,发现各蛋白质之间的保护效果差异较大,其中脱脂乳粉以及花生蛋白对干酪乳杆菌的冻干存活率较好,分别是(52.09±3.8)%、(35.33±6.24)%。由以上结果可知,蛋白质对干酪乳杆菌的保护效果普遍差于糖类,这可能是因为糖类分子质量较小,可以渗透细胞壁与细胞膜外的某些基团结合,形成保护层。综上,选取水苏糖作为干酪乳杆菌的冻干保护剂,与壁材进行复配,同时提高其冻干存活率与耐酸存活率。
表2 不同类冻干保护剂对干酪乳杆菌CCFM711冻干存活率的影响
Table 2 Effect of different freeze-drying protective agents on freeze-drying survival rate of L. casei CCFM711
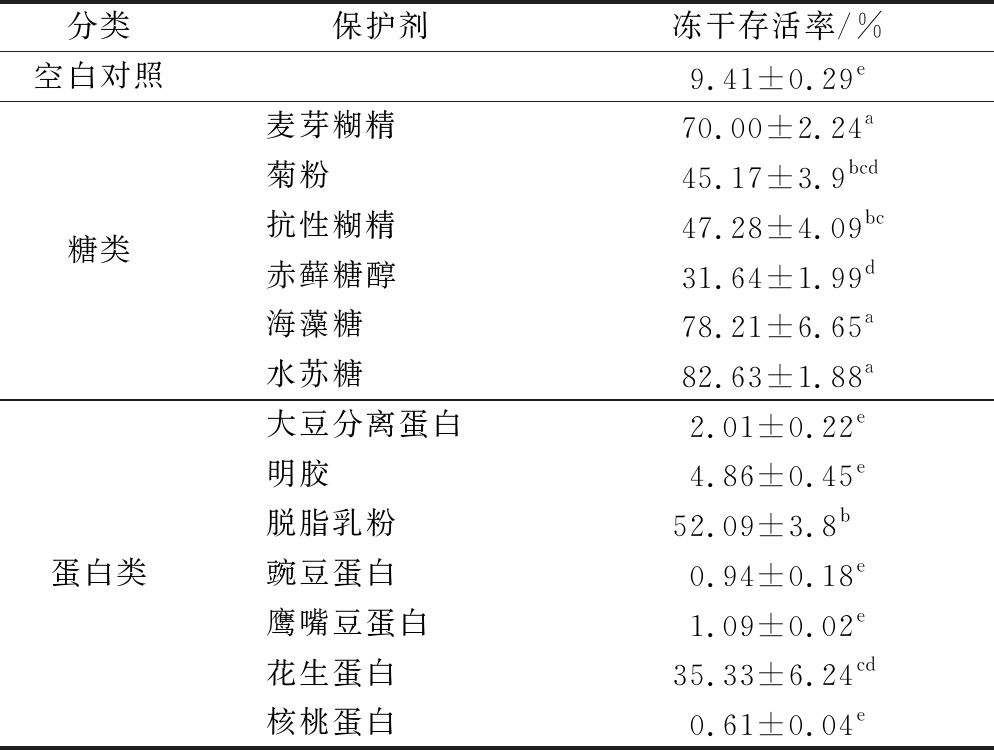
分类保护剂冻干存活率/%空白对照9.41±0.29e糖类麦芽糊精70.00±2.24a菊粉45.17±3.9bcd抗性糊精47.28±4.09bc赤藓糖醇31.64±1.99d海藻糖78.21±6.65a水苏糖82.63±1.88a蛋白类大豆分离蛋白2.01±0.22e明胶4.86±0.45e脱脂乳粉52.09±3.8b豌豆蛋白0.94±0.18e鹰嘴豆蛋白1.09±0.02e花生蛋白35.33±6.24cd核桃蛋白0.61±0.04e
2.3 耐酸壁材与冻干保护剂复配对冻干存活率以及耐酸性的影响
由表3可知,水苏糖作为冻干保护剂能够显著提升干酪乳杆菌在冷冻干燥过程中的存活率,将壁材与冻干保护剂复合,其中海藻酸钠组冻干存活率为(63.78±3.68)%,酪蛋白酸钠组冻干存活率为(59.43±6.28)%,羧甲基纤维素钠组冻干存活率为(78.64±8.65)%。参考ASHWAR等[15]的方法,经pH 2.0/3.0模拟胃液处理后,各实验组处理后pH均远超于原模拟胃液pH,这是因为模拟胃液与溶质比例低(约50∶1),而溶质中所含水苏糖浓度较高,中和了一部分酸性,致使酸处理体系实际pH升高,而人体消化道中pH浮动范围为1.8~3.0,不会出现实验中的pH变化。因此,考虑到该活菌计数结果并非原pH条件下的真实数据,本实验调整了酸处理实验方法,增加了模拟胃液与溶质比例至1 000∶1,以降低酸处理过程中保护剂对pH的缓冲作用。此外,考虑到人体胃环境中pH上限为3.0,将pH 3.0模拟胃液替换为pH 2.5模拟胃液处理,从而防止缓冲作用引起的pH变化突破胃环境的pH上限。
表3 冻干保护剂与壁材复合对干酪乳杆菌CCFM711存活率的影响
Table 3 Effect of freeze-drying protective agent and wall material on the survival rate of L. casei CCFM711
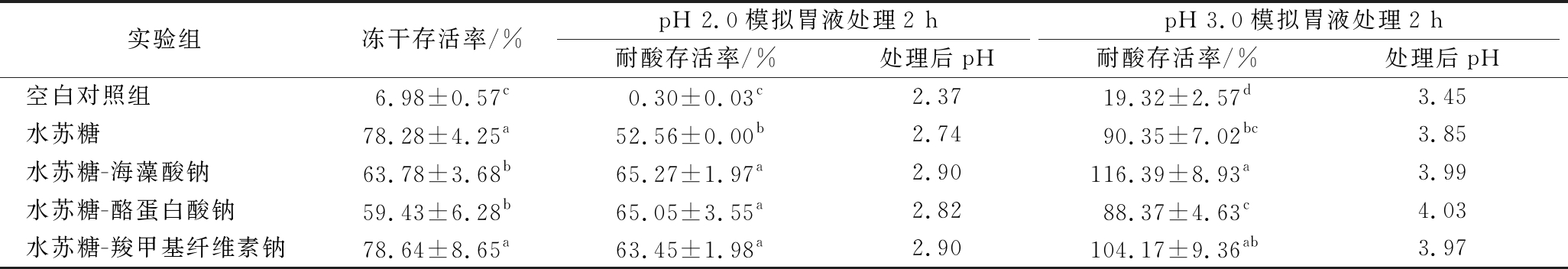
注:耐酸存活率指每瓶冻干粉样品经5 mL模拟胃液(pH 2.0、pH 3.0)处理2 h的存活率
实验组冻干存活率/%pH 2.0模拟胃液处理2 hpH 3.0模拟胃液处理2 h耐酸存活率/%处理后pH耐酸存活率/%处理后pH空白对照组6.98±0.57c0.30±0.03c2.3719.32±2.57d3.45水苏糖78.28±4.25a52.56±0.00b2.7490.35±7.02bc3.85水苏糖-海藻酸钠63.78±3.68b65.27±1.97a2.90116.39±8.93a3.99水苏糖-酪蛋白酸钠59.43±6.28b65.05±3.55a2.8288.37±4.63c4.03水苏糖-羧甲基纤维素钠78.64±8.65a63.45±1.98a2.90104.17±9.36ab3.97
由表4可知,尽管在pH 2.0的极端条件下3种保护剂的添加对菌体存活率无明显提升,但在经过pH 2.5模拟胃液处理后海藻酸钠、酪蛋白酸钠各组存活率分别为(19.56±1.83)%、(34.16±7.18)%,显著高于空白对照组的存活率。但羧甲基纤维素钠组存活率仅为(0.28±0.02)%,低于空白对照组。此外,比较空白对照组与水苏糖组,发现添加水苏糖作为冻干保护剂,pH 2.5模拟胃液处理后其存活率为(4.79±0.00)%,与空白对照组无明显差异。因此,水苏糖作为冻干保护剂,与海藻酸钠、酪蛋白酸钠复合,不仅可以提高菌体冻干存活率,还能降低酸性环境对菌体活性的影响。基于以上耐酸性壁材与冻干保护剂形成的混合保护剂体系,可以对菌体进行包埋固化,从而在菌体与外界环境之间形成物理阻隔,延缓外界环境对菌体的损伤,进一步提升冻干粉的耐酸性。
表4 冻干保护剂与壁材复合对干酪乳杆菌CCFM711存活率的影响
Table 4 Effect of freeze-drying protective agent and wall material on the survival rate of L. casei CCFM711

注:耐酸存活率指0.01 g冻干粉样品经10 mL模拟胃液(pH 2.0、pH 2.5)处理2 h的存活率
实验组冻干存活率/%pH 2.0模拟胃液处理2 hpH 3.0模拟胃液处理2 h耐酸存活率/%处理后pH耐酸存活率/%处理后pH空白对照组6.98±0.57c0±0a2.084.46±4.10c2.82水苏糖78.28±4.25a0±0a2.004.79±0.00c2.61水苏糖-海藻酸钠63.78±3.68b0±0a2.0319.56±1.83b2.64水苏糖-酪蛋白酸钠59.43±6.28b0±0a2.0734.16±7.18a2.66水苏糖-羧甲基纤维素钠78.64±8.65a0±0a2.020.28±0.02c2.61
2.4 乳化法制备干酪乳杆菌海藻酸钠微胶囊
目前,研究中常采用乳化法制备海藻酸钠微胶囊提高菌体的耐酸性。以乳化法制得的益生菌微胶囊包埋率受众多因素的影响,而包埋率是评判微胶囊性能的一个重要指标,因此,优化包埋工艺提高壁材对益生菌的包埋率具有重要意义[11]。由图1可知,在实验设值范围内,Span 80添加量、海藻酸钠与CaCO3质量比对包埋率无显著性影响,而搅拌速率、菌胶比和水油比在一定范围内对包埋率有一定影响。这可能是因为搅拌速率、菌胶比和水油比对形成的微胶囊产量以及粒径产生了影响,从而影响了包埋率[20-22]。综上,制备微胶囊的最优工艺为:搅拌速率500 r/min,Span 80含量200 μL,m(海藻酸钠)∶m(CaCO3)=1∶2,菌胶比1∶5,水油比1∶5。制成微胶囊后,一部分湿微胶囊测定耐酸性,一部分进行冷冻干燥制得干酪乳杆菌CCFM711冻干粉后测定其耐酸性,并与未包埋实验组进行耐酸性比较。

图1 不同工艺参数对微胶囊包埋率的影响
Fig.1 Effect of different process parameters on the encapsulation rate of microcapsules
注:不同字母表示数据之间存在显著性差异(P<0.05)
2.5 海藻酸钠-水苏糖-干酪乳杆菌微胶囊的冻干存活率与耐酸性
由表5可知,海藻酸钠微胶囊冻干存活率为(5.64±1.03)%,冻干微胶囊经pH 2.5的模拟胃液处理后干酪乳杆菌的存活率仅为(0.37±0.28)%,均显著低于未包埋的实验组(即水苏糖-海藻酸钠)的冻干存活率与冻干后耐酸存活率,且包埋组(海藻酸钠微胶囊)与未包埋(水苏糖-海藻酸钠)冻干后耐酸存活率均显著低于冻干前。这可能是因为在制备海藻酸钠-水苏糖-干酪乳杆菌微胶囊过程中,有部分水苏糖残留在水相中,致使微胶囊内水苏糖浓度降低,而在冷冻干燥过程中,冻干保护剂浓度降低将影响冻干微胶囊中菌体的活性,从而降低菌体的冻干存活率与耐酸性。此外,冰晶可能使微胶囊表层破裂,使菌体直接暴露于低pH环境,这也将在一定程度上影响菌体冻干后的耐酸性。水苏糖-海藻酸钠组由于水苏糖浓度无变化,在冷冻干燥过程中,水苏糖作为冻干保护剂可以避免细胞膜结构与功能的完整性受到破坏[18],提高了菌体的活性,其冻干存活率达到了(63.78±3.68)%,经pH 2.5模拟胃液处理2 h后,冻干粉的耐酸存活率为(19.56±1.83)%,虽然显著低于冻干前耐酸存活率为(51.65±3.80)%,但仍然显著高于海藻酸钠微胶囊冻干后耐酸存活率。综上所述,制备海藻酸钠微胶囊过程中,存在冻干保护剂浓度降低且冻干后结构破裂的可能性,从而导致冻干存活率与耐酸性均劣于未包埋实验组。因此,水苏糖复配耐酸性壁材更适用于与菌悬液直接混合并冷冻干燥制备干酪乳杆菌CCFM711耐酸冻干粉,而不适用于包埋后冻干。
表5 海藻酸钠包埋干酪乳杆菌CCFM711对冻干存活率与耐酸性的影响
Table 5 Effect of sodium alginate-embedded L. casei CCFM711 on freeze-drying survival rate and acid resistance

注:pH 2.0与pH 2.5各列不同字母表示数据之间存在显著性差异(P<0.05);冻干前耐酸存活率是指0.1 mL湿样品经9.9 mL模拟胃液(pH 2.0、pH 2.5)处理2 h的存活率,冻干后耐酸存活率指0.01 g冻干粉样品经10 mL模拟胃液(pH 2.0、pH 2.5)处理2 h的存活率
未包埋冻干存活率/%pH 2.0模拟胃液处理2 hpH 2.5模拟胃液处理2 h冻干前耐酸存活率/%冻干后耐酸存活率/%冻干前耐酸存活率/%冻干后耐酸存活率/%海藻酸钠微胶囊5.64±1.030±0a0±0a54.44±10.00a0.37±0.28c水苏糖-海藻酸钠63.78±3.680±0a0±0a51.65±3.80a19.56±1.83b
2.6 真空冷冻干燥制备干酪乳杆菌耐酸冻干粉的工艺优化
2.6.1 酪蛋白酸钠浓度对干酪乳杆菌冻干粉冻干存活率与耐酸性的影响
由表4可知,相同浓度的耐酸性壁材,水苏糖复配酪蛋白酸钠对菌体的保护效果最佳。因此选择酪蛋白酸钠作为耐酸保护材料,水苏糖为冻干保护剂进一步研究其与菌悬液直接混合冻干制备耐酸冻干粉的工艺。由表6可知,当酪蛋白酸钠质量浓度为10 g/L时,干酪乳杆菌CCFM711冻干粉经pH 2.5的模拟胃液处理2 h后达到了(34.16±7.18)%的存活率(表6)。这可能是因为当酪蛋白酸钠浓度较高时,降低了冷冻干燥过程中水苏糖对干酪乳杆菌CCFM711的保护效果,进而致使其耐酸性下降。
表6 酪蛋白酸钠浓度对干酪乳杆菌CCFM711冻干粉冻干存活率与耐酸性的影响(0.01 g/10 mL)
Table 6 Effect of sodium caseinate concentration on freeze-dried survival and acid resistance of lyophilized powder of L. casei CCFM711
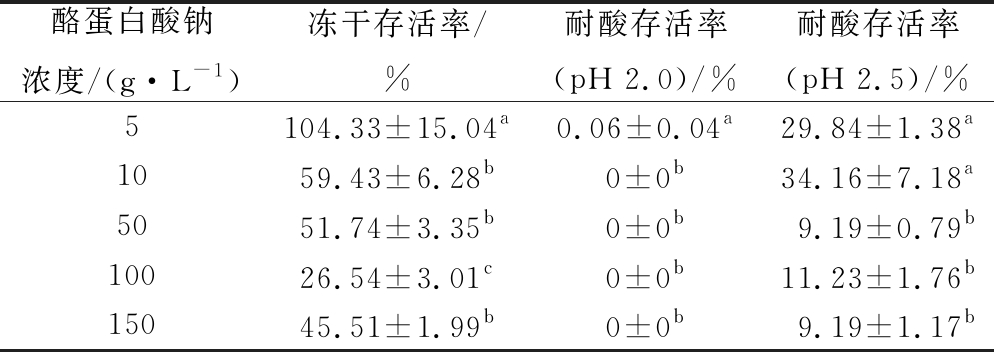
注:同列不同字母表示数据之间存在显著性差异(P<0.05);耐酸存活率指0.01 g冻干粉样品经10 mL模拟胃液(pH 2.0、pH 2.5)处理2 h的存活率(下同)
酪蛋白酸钠浓度/(g·L-1)冻干存活率/%耐酸存活率(pH 2.0)/%耐酸存活率(pH 2.5)/%5104.33±15.04a0.06±0.04a29.84±1.38a1059.43±6.28b0±0b34.16±7.18a5051.74±3.35b0±0b9.19±0.79b10026.54±3.01c0±0b11.23±1.76b15045.51±1.99b0±0b9.19±1.17b
2.6.2 保护剂与菌悬液对干酪乳杆菌冻干粉冻干存活率与耐酸性的影响
基于上述实验结果,确定酪蛋白酸钠质量浓度为10 g/L,水苏糖质量浓度为100 g/L,制备酪蛋白酸钠-水苏糖混合保护剂体系,调整保护剂体系与菌悬液的比例。由表7可知,当混合保护剂与菌悬液的体积比超过3∶2时,冻干存活率无显著差异,但均高于1∶1时的冻干存活率。这说明保护剂浓度过低,不足以完全保护菌体,但是过多的保护剂也不会进一步提高冻干存活率。比较不同的菌胶比制备的冻干粉耐酸存活率,当菌悬液与混合保护剂的体积比为2∶5时,各组无显著性差异,这说明耐酸性最主要的影响因素可能是耐酸性壁材与保护剂的比例,合适的比例下两者形成最适宜的结构保护菌体,降低酸根离子对菌体的侵害。由表7可知,酪蛋白酸钠-水苏糖-干酪乳杆菌CCFM711耐酸冻干粉的最佳制备工艺为:混合保护剂体系中酪蛋白酸钠质量浓度为10 g/L,水苏糖质量浓度为100 g/L,包含500 g/L湿菌泥的菌悬液与混合保护剂体系以体积比2∶5混合,经真空冷冻干燥制备成耐酸冻干粉。
表7 保护剂与菌悬液比例对干酪乳杆菌冻干粉冻干存活率与耐酸性的影响(0.01 g/10 mL)
Table 7 Effect of the ratio of protective agent and bacterial solution on the lyophilized survival rate and acid resistance of lyophilized powder of L. casei CCFM711
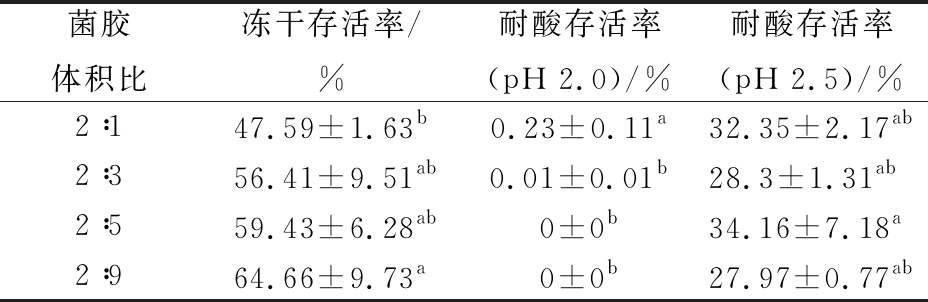
菌胶体积比冻干存活率/%耐酸存活率(pH 2.0)/%耐酸存活率(pH 2.5)/%2∶147.59±1.63b0.23±0.11a32.35±2.17ab2∶356.41±9.51ab0.01±0.01b28.3±1.31ab2∶559.43±6.28ab0±0b34.16±7.18a2∶964.66±9.73a0±0b27.97±0.77ab
3 结论
海藻酸钠、酪蛋白酸钠、羧甲基纤维素钠作为耐酸性包埋材料,均能提高干酪乳杆菌CCFM711冻干粉在酸性条件下的存活率,但对菌体的冻干保护作用较小。水苏糖较其他糖和蛋白类保护剂对菌体具有较好的冻干保护特性,将水苏糖作为保护剂与海藻酸钠、酪蛋白酸钠的复配能够同时提高菌体的冻干存活率和耐酸性。以水苏糖与干酪乳杆菌CCFM711为芯材,海藻酸钠为壁材制备微胶囊虽然能显著提高菌体的耐酸性,但微胶囊冻干后冻干存活率和耐酸性均低于未制备微胶囊组,说明制备微胶囊不适宜耐酸冻干粉的制备。保护剂与耐酸性壁材的直接复配是制备干酪乳杆菌耐酸冻干粉的有效途径。
[1] DA C A G, BURITI F C A, DE S C H B, et al. Probiotic cheese: health benefits, technological and stability aspects[J]. Trends in Food Science & Technology, 2009, 20(8): 344-354.
[2] SARAO L K, ARORA M. Probiotics, prebiotics, and microencapsulation: A review[J]. Critical Reviews in Food Science and Nutrition, 2017, 57(2): 344-371.
[3] KOSARAJU S L, WEERAKKODY R, AUGUSTIN M A. In-vitro evaluation of hydrocolloid-based encapsulated fish oil[J]. Food Hydrocolloids, 2009, 23(5): 1 413-1 419.
[4] PARK J H, SARAVANAKUMAR G, KIM K, et al. Targeted delivery of low molecular drugs using chitosan and its derivatives[J]. Advanced Drug Delivery Reviews, 2010, 62(1): 28-41.
[5] 杨佳, 侯占群, 贺文浩, 等. 微胶囊壁材的分类及其性质比较[J]. 食品与发酵工业, 2009, 35(5): 122-127.
[6] 宋娇娇, 王俊国, 田文静, 等. 微胶囊制备工艺对益生菌活性的影响[J]. 中国乳品工业, 2016, 44(1): 25-30.
[7] LIU H, CUI S W, CHEN M, et al. Protective approaches and mechanisms of microencapsulation to the survival of probiotic bacteria during processing, storage and gastrointestinal digestion: a review[J]. Crit Rev Food Sci Nutr, 2019,59(17): 2 863-2 878.
[8] DOHERTY S, GEE V, ROSS R, et al. Development and characterisation of whey protein micro-beads as potential matrices for probiotic protection[J]. Food Hydrocolloids, 2011, 25(6): 1 604-1 617.
[9] GONZALEZ-FERRERO C, IRACHE J M, GONZALEZ-NAVARRO C J. Soybean protein-based microparticles for oral delivery of probiotics with improved stability during storage and gut resistance[J]. Food Chem, 2018, 239: 879-888.
[10] 田文静. 内源乳化法制备植物乳杆菌LIP-1微胶囊及提高其抗冷冻性能的研究[D].呼和浩特:内蒙古农业大学, 2016.
[11] S NCHEZ M T, RUIZ M A, LASSERROT A, et al. An improved ionic gelation method to encapsulate Lactobacillus spp. bacteria: Protection, survival and stability study[J]. Food Hydrocolloids, 2017, 69: 67-75.
[12] YEUNG T W, ARROYO-MAYA I J, MCCLEMENTS D J, et al. Microencapsulation of probiotics in hydrogel particles: enhancing Lactococcus lactis subsp. cremoris LM0230 viability using calcium alginate beads[J]. Food Funct, 2016, 7(4): 1 797-1 804.
[13] IACONELLI C, LEMETAIS G, KECHAOU N, et al. Drying process strongly affects probiotics viability and functionalities[J]. J Biotechnol, 2015, 214: 17-26.
[14] 张国芳, 王婷婷, 刘丽波, 等. 内源乳化法制备干酪乳杆菌微胶囊[J]. 中国乳品工业, 2017, 45(3): 15-20.
[15] ASHWAR B A, GANI A, GANI A, et al. Production of RS4 from rice starch and its utilization as an encapsulating agent for targeted delivery of probiotics[J]. Food Chem, 2018, 239: 287-294.
[16] 曾凤泽, 陈霞, 邵玉宇, 等. 刍议益生菌微胶囊化壁材的分类及性质[J]. 中国乳品工业, 2013, 41(6): 27-30.
[17] WANG W, CHEN M, WU J, et al. Hypothermia protection effect of antifreeze peptides from pigskin collagen on freeze-dried Streptococcus thermophiles and its possible action mechanism[J]. LWT - Food Science and Technology, 2015, 63(2): 878-885.
[18] ANA S CARVALHO, JOANA SILVA, PETER H O, et al. Effects of various sugars added to growth and drying media upon thermotolerance and survival throughout storage of freeze-dried Lactobacillus delbrueckii ssp. bulgaricus[J].Biotechnology Pregress, 2004, 20(1):248-254.
[19] HONGPATTARAKERE T, URAIPAN S. Bifidogenic characteristic and protective effect of saba starch on survival of Lactobacillus plantarum CIF17AN2 during vacuum-drying and storage[J]. Carbohydr Polym, 2015, 117: 255-261.
[20] 朱莹丹. 植物乳杆菌LIP-1微胶囊制备工艺及其性能的研究[D]. 呼和浩特:内蒙古农业大学, 2015.
[21] 程玉霞. 基于外源乳化法的植物乳杆菌微胶囊制备及性能研究[D]. 杭州:浙江工商大学, 2012.
[22] 朱永明, 杜玲玲, 李晓东, 等. 胶囊化鼠李糖乳杆菌在模拟胃肠道中活性的研究[J]. 中国食品学报, 2016, 16(12): 23-29.