大豆分离蛋白(soy protein isolate, SPI)是一种高营养的植物蛋白,具有无色无味、易于消化、含有丰富的氨基酸等特点。以SPI稳定的水包油乳液,会在油滴表面吸附上一层蛋白,形成相对稳定的界面蛋白保护膜,从而能够降低体系的界面张力,进而使乳液达到相对稳定状态[1]。
Tween 20是一种非离子型多聚乙醚类低分子表面活性剂,具有增溶、乳化和稳定等功能,同时具有价格低廉、化学性稳定和无毒等优点。Tween 20与蛋白质的相互作用研究受到了广泛关注。蛋白-低分子表面活性剂混合物的界面或乳化特性方面通常存在协同或对抗的作用[2]。
水包油(oil in water, O/W)乳液是油脂存在于食品中相对常见的分散体系,在食品应用中蛋白质和小分子表面活性剂一般共存。早期乳液的利用体现在乳制品,如牛奶和酸奶等。在化妆品领域也应用广泛,所有的护肤霜和润肤露等都是乳液。SPI和Tween 20是2种重要类型的乳化剂。Tween 20能形成比SPI大一些的界面压,因而具有更小的界面张力。随着Tween 20浓度的增大,吸附在界面上的SPI会逐渐被Tween 20置换,进入水相,最终形成小分子吸附层,该过程称为界面取代过程[3]。
关于含有Tween 20乳液体系的研究已有一些报道[4-5],小分子表面活性剂在乳液中的应用逐渐成为研究人员关注的热点。ARANCIBIA等[6]研究表明,Tween 80比卵磷脂更有效,可用于开发具有良好物理性能的天然纳米乳剂。KALTSA等[7]研究了Tween 20将乳清分离蛋白置换后,界面上发生的一些特性变化,乳液粒径随Tween 20的增大而减小。CAI等[8]研究表明,小分子表面活性剂形成的界面膜的黏弹性较差,含有蛋白的胶体系统通常更稳定。杨力会等[9]研究了Tween 20添加量为 0.005% 时,可使油脂氧化相对缓慢;当Tween 20含量增加到 0.01%~0.20%时,在一定程度上会起到促进氧化的效果。
本研究旨在对SPI与Tween 20 的乳液体系的物理及氧化稳定性进行探讨,以期为制备含Tween 20的蛋白质乳液提供技术支撑,也为O/W乳液体系的物理及氧化特性研究提供理论参考。
1 材料与方法
1.1 材料与试剂
大豆,市售;低温脱脂豆粕,实验室自制;大豆分离蛋白,实验室自制;核桃油,吉林省姜炳堂商贸有限公司;牛血清白蛋白、Tween 20,美国Sigma 试剂公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH),阿拉丁试剂上海有限公司;2-硫代巴比妥酸(2-thiobarbituric acid, TBA),上海展云化工有限公司;HCl、NaOH等试剂为分析纯级。
1.2 仪器与设备
IKA T18 digital ULTRA TURRAX粗均机,德国艾卡公司; Mastersizer 2 000 Nano-ZS90激光粒度仪,英国马尔文仪器有限公司; FD5-3 型冷冻干燥机,美国 SIM 公司;Tecan Infinite 200 Pro 酶标仪,瑞士帝肯公司;KjelFlex K-360凯氏定氮仪,上海纤检仪器有限公司;高压均质机,巩义市予华仪器有限责任公司;XG-CAM系列接触角测量仪,上海轩铁创析工业设备有限公司;RF-6000荧光分光光度计,日本岛津公司。
1.3 方法
1.3.1 大豆分离蛋白的制备
参考 HUANG等[10]的方法稍作修改,将粉碎后的大豆粉用正己烷脱脂3次(1 g大豆粉用3 mL正己烷脱脂),并将脱脂豆粉放置于通风橱内进行干燥,去除易挥发的正己烷。用蒸馏水将得到的粉末按照1∶15(g∶mL)进行溶解,用2 mol/L NaOH将溶液pH 调节到8.0,并在室温下进行磁力搅拌2 h。将混合液在4 ℃下14 000 r/min离心15 min,收集上清液。用2 mol/L HCl调节上清液pH至4.5,随后进行离心15 min(4 ℃,4 000 r/min)。弃上清液,将沉淀物从离心筒中取出并溶解在装有蒸馏水的烧杯中,用蒸馏水将沉淀物反复洗涤3次,用2 mol/L NaOH将pH值调至中性,倒入玻璃培养皿中放入冰箱冷冻层。之后用冻干机冻干,进行研磨,最后得到大豆分离蛋白粉末。并由凯氏定氮方法测得 SPI 的蛋白质量分数为(91.3±0.60)% (N×5.71)。
1.3.2 大豆分离蛋白乳液的制备
称取一定质量的SPI 粉末并在磷酸盐缓冲液(phosphate bulfer saline, PBS)(5 mmol/L,pH 7)中溶解,在室温下低速搅拌3 h至充分溶解,随后放入冰箱水化过夜,得到质量分数为 1%的蛋白溶液作为水相备用。将50 g/L核桃油与950 g/L水化好的蛋白质溶液通过3次粗均(10 000 r/min,1 min)后制备出粗乳液。然后将粗乳液用高压均质机循环均质3次(8~35 MPa),最终得到乳液样品。整个过程在冰水浴下进行,防止高温引起SPI变性。制备得到4种乳液样品分别为:10 g/L SPI(SPI);10 g/L SPI+5 g/L Tween 20(SPI+T5);10 g/L SPI+10 g/L Tween 20(SPI+T10);10 g/L Tween 20(T10)的乳液样品。在所有乳液样品中加入0.2 g/L叠氮化钠抑制微生物生长[11]。取部分乳液作为新鲜乳液置于冰箱存放,将剩余乳液分装在带盖玻璃瓶中。乳液在50 ℃黑暗中保持6 d,收集样品定期进行氧化实验[12]。
1.3.3 乳液粒度和粒径分布测定
参考YANG等[13]的方法并稍加修改,使用激光粒度仪对所有样品进行平均粒度测定。为避免多个颗粒的相聚和散射产生影响,在分析之前将样品用PBS(5 mmol/L,pH 7) 稀释500倍。水相(PBS)和油相(核桃油)的折射率分别设定为1.330和1.434,每个样品重复3 次。由粒度分布计算体积加权(d4,3)平均粒径。d4,3值用于监测乳液聚集的稳定性。
1.3.4 乳液显微镜形貌观察
将制备好的乳液用pH 7.0的PBS稀释50倍,用漩涡振荡器混匀后,用移液枪取40 μL滴于载玻片中心处,并从一侧缓慢盖上载玻片,采用光学显微镜观察乳滴结构(100倍油镜)。
1.3.5 Zeta电位的测定
参考XU等[14]的方法稍作修改,通过使用激光粒度仪测量所有样品的Zeta电位(mV)。在测量之前用PBS(5 mmol/L,pH 7)稀释乳液样品,稀释倍数为500倍,以避免多个颗粒的相聚。用电位杯量取1 mL左右样品(25 ℃,温度平衡时间为2 min)。每个样品重复3次测量。
1.3.6 界面张力测定
根据LIU等[15]的方法进行改进,使用接触角测量仪(XG-CAM系列)测定油-水界面处的界面张力。核桃油为油相,用PBS(5 mmol/L,pH 7)配制10 g/L SPI溶液作为水相。通过将不同浓度Tween 20分散在PBS(5 mmol/L,pH 7)中来改变水相的组成。将针尖端放置在光源和相机(CCD)之间的光学平板上;将水相倒入样品杯中;将铂片浸入水相中并将其拉至界面;在水相中将核桃油相缓慢加入,直到铂片完全浸没在油中。用数码相机捕获每个油滴的图像,然后通过仪器制造商提供的Young-Laplace方程程序分析油滴的形状来计算界面张力(γ)。
1.3.7 荧光光谱分析
根据ROY等[16]的方法稍作修改,测定内在的色氨酸荧光。将乳液样品(10 μL)在PBS(5 mmol/L,pH 7)中稀释,漩涡振荡并静置后分别加入到石英比色皿中,然后使用荧光分光光度计进行分析。参数设定为:色氨酸的发射光谱200~500 nm,扫描速度1 nm/s,激发波长297 nm。发射光带宽20 nm,激发光带宽10 nm。记录光谱的最大发射强度用于分析。
1.3.8 油脂氧化初级产物的测定
根据DING等[17]的方法稍作修改,用油脂氧化初级产物即脂质氢过氧化物的含量来衡量乳液中油脂氧化的程度。将制备好的4种乳液样品分别放置在10 mL带盖玻璃样品瓶中,每类乳状液各3份放置在 50 ℃恒温避光的烘箱中进行烘箱加速试验,间隔24 h测量1次。
取0.3 mL乳液与1.5 mL提取溶剂[V(异辛烷)∶V(异丙醇)=3∶1]混合,进行涡旋振荡(10 s、3次),在1 000×g下离心2 min,收集有机溶剂相。取200 μL加入到2.8 mL混合溶液[V(甲醇)∶V(丁醇)=2∶1]中,再加入15 μL 3.94 mol/L硫氰酸铵和15 μL亚铁溶液(混合等体积的0.132 mol/L BaCl2和0.144 mol/L FeSO4过0.220 μm滤膜)制备得到。在室温下静置反应20 min后,使用酶标仪96透明孔板,在510 nm下测乳液样品的吸光度。用氢过氧化物标准曲线来计算乳液样品中脂质氢过氧化物值。
1.3.9 硫代巴比妥酸产物值的测定
根据SHEN等[18]的方法稍作修改。对于硫代巴比妥酸产物值(thiobarbituric acid reactive substances, TBARS)进行分析,将1.0 mL乳液样品与2.0 mL含有150 g/L三氯乙酸和3.75 g/L TBA试剂混合,混匀后煮沸30 min。将冷却的上清液用氯仿处理,并在2 200×g下离心20 min。在532 nm处测定上清液的吸光度,并根据由1,1,3,3-四乙氧基丙烷(μmol/L乳液)产生的标准曲线测定TBARS值。TBARS值以丙二醛的含量计,按公式(1)计算:
(1)
式中,A532, 溶液的吸光度;V, 样品液体体积,mL;M,TBA的摩尔质量, 144.15 g/mol;m, 样品质量, g;l, 光程1 cm;ε, 摩尔消光系数, 152 000 L/(mol·cm)。
1.3.10 数据统计及分析
所有实验均设置3次平行实验,利用Excel对数据进行整理,利用Origin 9.1软件作图,采用SPSS 22.0数据处理软件对测定数据进行方差分析(analysis of variance,ANOVA),利用邓肯式多重比较对差异显著性进行分析及相关性分析,P<0.05 表示差异显著。
2 结果与分析
2.1 乳液粒度和粒径分布
乳液粒径是衡量乳液稳定性的重要指标[19]。d4,3表示液滴体积平均直径。乳液在均匀化过程中,Tween 20促进乳滴破裂并抑制乳滴的聚结,从而导致乳滴尺寸变小[20-21]。图1-a表明,乳滴粒径随Tween 20 浓度逐渐增大而减小,表明吸附在油滴上的蛋白被逐渐置换,平均粒径变小,这与袁媛等[22]研究结果相似。KALTSA等[7]研究表明,乳清蛋白乳化橄榄油液滴,在均质过程中其粒径随Tween 20的增大而减小,界面组成也随之发生变化。实验数据显示:SPI+10 g/L Tween 20稳定乳液的平均粒径为(243.07±0.043)nm,显著低于10 g/L Tween 20稳定乳液的平均粒径(286.23±0.031)nm(P<0.05)。该结果与界面张力测量结果一致,表明混合乳化剂(10 g/L SPI+10 g/L Tween 20)比单独使用表面活性剂(10 g/L Tween 20)更能降低界面张力。乳液在储存过程中没有发生相分离,表明所有体系对乳滴的聚集和乳化都是稳定的。因此,Tween 20对SPI的界面置换不影响乳液的物理稳定性。先前的研究表明,当所有系统都包含相对较小的乳滴时,乳滴尺寸不会对乳液中的氧化产生重大影响[23-24]。
界面取代对乳滴粒度分布的影响如图1-b所示,不含Tween 20的乳液粒径较大,随着Tween 20浓度增加,其分布趋于集中,表明乳液的物理稳定性随Tween 20浓度的增大而增强。

图1 Tween 20浓度变化对粒度分布(a)和乳液平均粒径(b)的影响
Fig.1 Effect of Tween 20 concentration on the size distribution and mean particle size of emulsion
2.2 乳液微观形貌观察
由图2可知,乳滴都分布均匀且没有发生聚集,当Tween 20浓度增大时,乳滴出现减小趋势,可能由于与SPI分子相比,Tween 20具有更小的界面张力对油滴分子起到压缩作用,从而出现了乳滴逐渐减小的情况[25]。

a-SPI;b-SPI+T5;c-SPI+T10;d-T10
图2 Tween 20浓度变化对乳滴微观形貌的影响
Fig.2 Effect of Tween 20 concentration on the micro- morphology of droplets
2.3 Zeta电位分析
Zeta电位反映了溶液中粒子间的相互作用力,从而体现出乳液的物理稳定性。由图3可知,在没有Tween 20的情况下,液滴稳定后SPI带负电荷,在pH 7时,电位值为-25.8 mV,这可以归因于吸附蛋白质高于他们的等电点[26]。随 Tween 20 浓度的不断增加,乳滴电位的绝对值都呈现降低趋势,带电蛋白质逐步被 Tween 20 取代进入水相,因而导致乳滴界面电位绝对值减小,这与KALTSA[7]研究结果一致。在添加10 g/L Tween 20后,电位值为-16.7 mV,它的电位绝对值高于单纯含10 g/L的Tween 20(电位值为-15.3 mV),说明仍有少量蛋白质残留在乳滴表面。
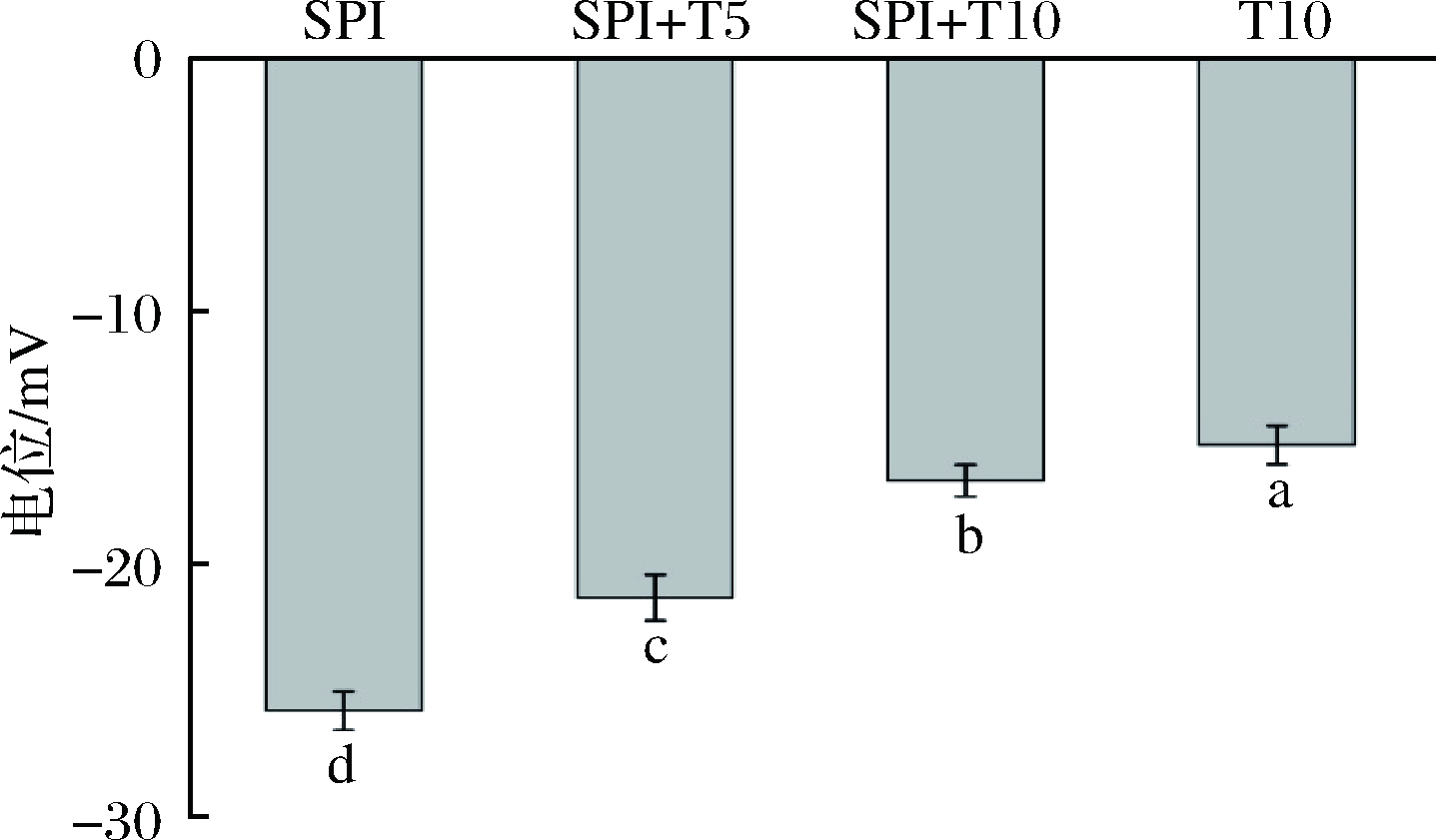
图3 Tween 20浓度变化对乳液粒子电位的影响
Fig.3 Effect of Tween 20 concentration on emulsion particle potential
2.4 Tween 20添加量对界面张力的影响
有研究表明,界面张力的大小可以反映乳液形成的难易程度,评估表面活性剂诱导在乳液中界面发生吸附和置换的行为[27]。由图4可知,只含有10 g/L SPI的乳液界面张力约为(17.2±0.034) mN/m,随着Tween 20从0.0增加到10 g/L,界面张力明显下降(P<0.05)。10 g/L SPI+10 g/L Tween 20混合物的界面张力(10.3±0.026) mN/m低于10 g/L SPI(17.2±0.034)mN/m和10 g/L Tween 20(12.3±0.039)mN/m界面张力,表明蛋白质和Tween 20的混合物能够更有效地降低油相和水相之间的疏水相互作用,与WAN等[2]实验结果一致。在Tween 20质量浓度为10 g/L时,混合体系的界面张力与Tween 20的界面张力接近,说明界面主要被非离子表面活性剂所覆盖,LOPEZ等[28]也得到了相同的结果。
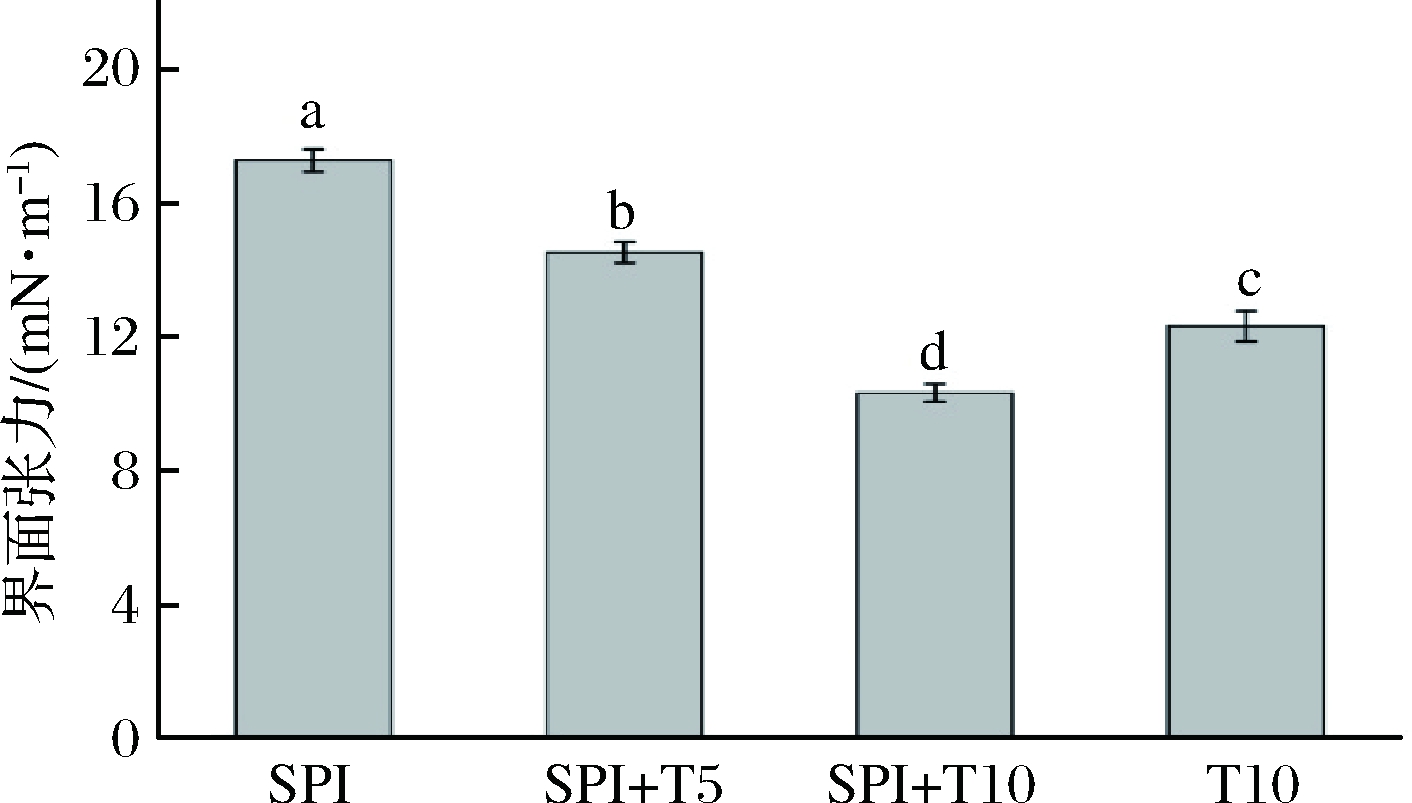
图4 Tween 20浓度变化对乳液界面张力的影响
Fig.4 Effect of Tween 20 concentration on the interfacial tension of emulsion
2.5 荧光光谱分析
乳液中内在色氨酸荧光强度变化可以作为评估蛋白质氧化修饰的指标。由图5可知,随着储存时间的增加,乳液样品中蛋白质荧光强度在50 ℃黑暗环境中呈现出不断减弱的趋势,表明蛋白质逐渐被氧化发生结构修饰[29],这与QIU等[30]研究结果相似。在含SPI的3个样品乳液中,不含Tween 20的SPI乳液荧光损失最大(P<0.05),Tween 20加入导致SPI被置换进入水相,因而导致油脂氧化速率变低,说明吸附的蛋白质可能在乳剂制备过程中抑制了油脂氧化[31]。随着乳状液中Tween 20浓度增加,蛋白质氧化程度再次降低,表现为贮藏过程中荧光损耗降低[32]。NIU等[33]研究了脂质氧化产物丙二醛使乳清分离蛋白荧光猝灭,荧光强度降低,表明蛋白质分子与Tween 20发生置换后,油脂氧化情况也随之改变[34]。相比于含有Tween 20的乳液体系,不含 Tween 20的SPI的乳液氧化稳定性较好, 这与YANG等[1]和BERTON等[35]研究结果一致。

图5 Tween 20浓度变化对乳剂荧光强度的影响
Fig.5 Effect of Tween 20 concentration on the fluorescence intensity of emulsion
2.6 Tween 20 添加量对油脂氧化稳定性的影响
2.6.1 油脂初级氧化产物分析
由图6看出,随着储存时间的增加,4种样品的氢过氧化物含量都在逐渐增加;含有Tween 20的乳剂氢过氧化物含量增加更快,油脂氧化稳定性降低。吸附在界面上的SPI逐渐被Tween 20取代进入水相,表明发生界面取代后,乳液氧化稳定性降低,这与KIOKIAS等[36]的研究结果一致。
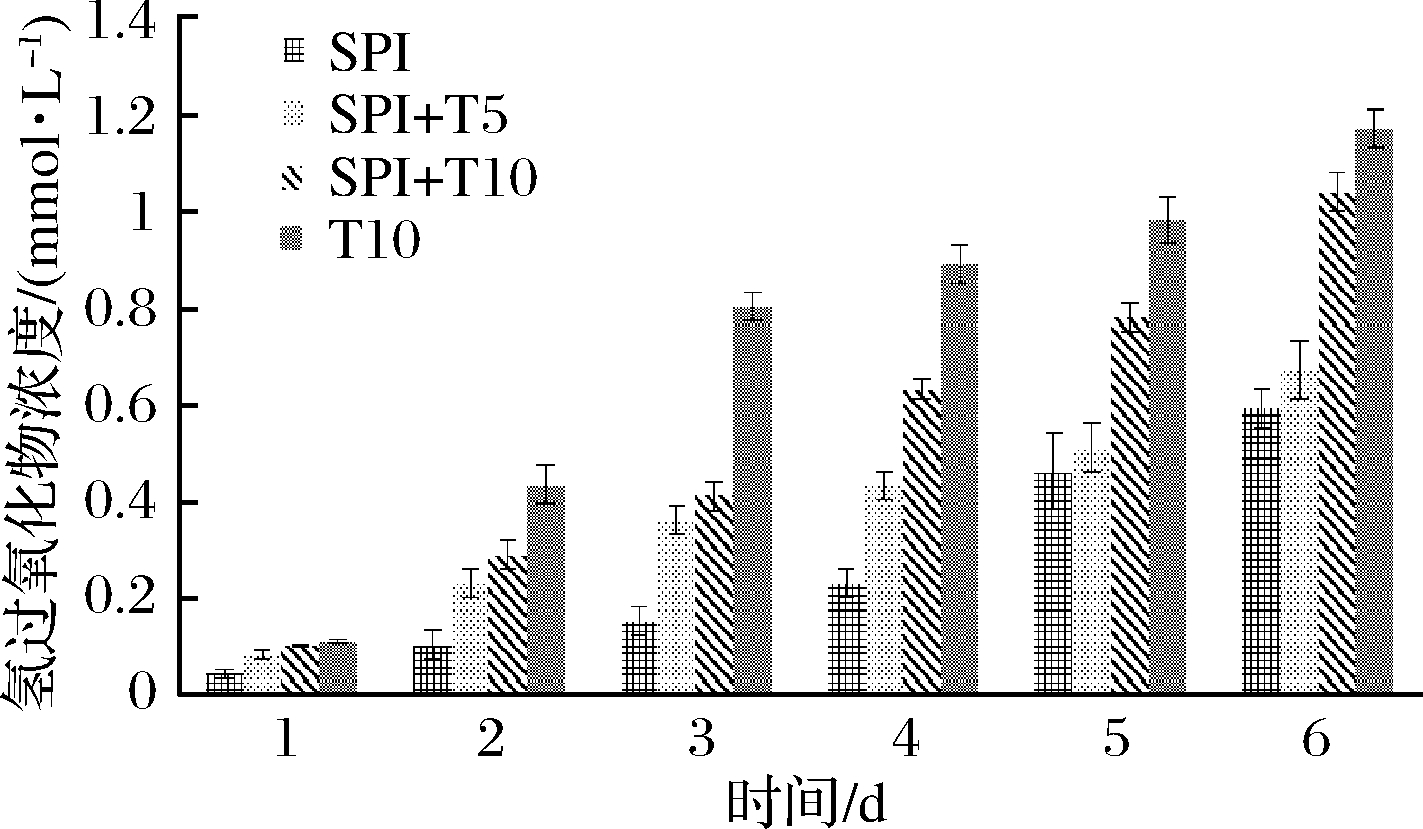
图6 Tween 20浓度变化对乳液中氢过氧化物的影响
Fig.6 Effect of Tween 20 concentration on the concentration of hydrogen peroxide in the emulsion
结果表明,SPI在抑制脂质氧化方面比Tween 20更有效,与KIOKIAS等[36]研究结果一致。Tween 20含量的增加导致O/W乳液的氧化稳定性明显降低,这可以从脂质过氧化氢实验结果得到证明[36]。
2.6.2 TBARS分析
TBARS值可测定乳液中次级氧化产物的含量。由图7可知,在烘箱加速实验中,TBARS的变化趋势和氢过氧化物值的趋势相似,随着储存时间增加,TBARS值逐渐升高,表明油脂的氧化速率增大。
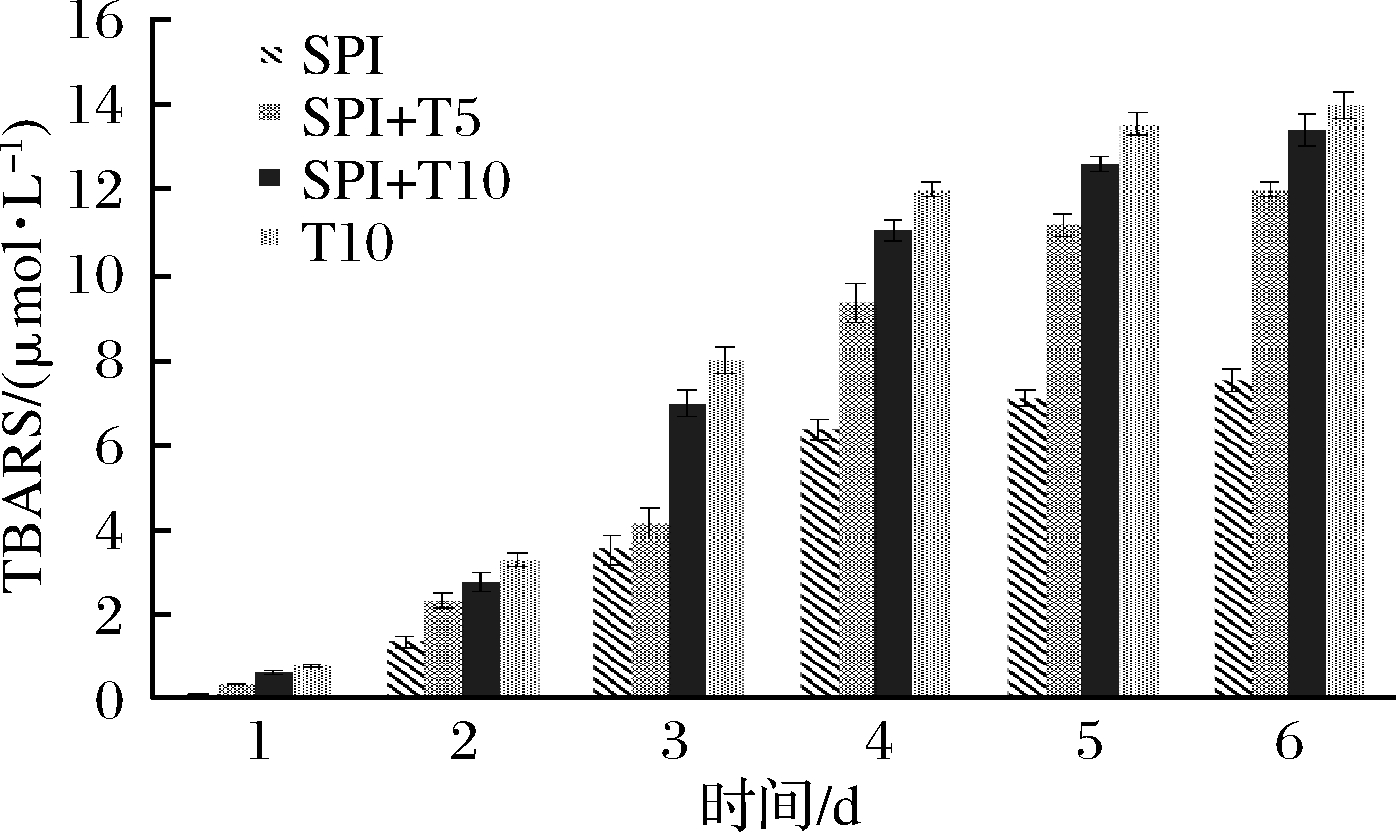
图7 Tween 20浓度变化对TBARS浓度的影响
Fig.7 Effect of Tween 20 concentration on the concentration of TBARS
而Tween 20的加入使TBARS值增加,并且在储存后期曲线变陡,说明乳液氧化情况加剧。以上这些结果表明SPI抑制油脂氧化比Tween 20更有效,这与VIREN[37]、HAAHR[38]等研究结果一致。Tween 20比例的增加导致了乳剂的氧化稳定性明显下降。
3 结论
本实验研究了用Tween 20与SPI制成的乳液体系对乳液的物理和氧化稳定性的影响。结果表明,在O/W乳液中油脂和蛋白发生氧化并且受到蛋白质分子位置的影响。Tween 20存在时,蛋白质分子从油滴表面被部分取代,也改变了它们的氧化敏感性。乳滴粒径和显微镜观察结果表明,随Tween 20浓度逐渐增大,乳滴不断减小,界面中的SPI不断被置换下来。乳滴电位的绝对值和界面张力都呈现降低趋势,表明蛋白质和Tween 20的乳液体系能更有效地降低油相和水相之间的疏水相互作用,表明在添加了Tween 20之后,物理稳定性较好。烘箱加速实验表明,在储存期间蛋白质荧光强度不断变小,表明Tween 20在乳液中界面发生吸附和置换。与含有Tween 20的乳液体系相比,只含SPI的乳液脂质氧化速率最低,说明吸附的蛋白质可能在乳剂制备过程中抑制了脂质氧化。4种样品的氢过氧化物和TBARS值都在增大,但Tween 20的加入,使乳液中的氢过氧化物含量增加更快。这表明在储存过程中,油脂氧化稳定性降低,而Tween 20的加入使其稳定性加速降低。Tween 20与蛋白质共存体系比纯 Tween 20体系的乳液更稳定。以上结果为含小分子表面活性剂的蛋白质乳液在食品加工中的应用提供参考。
[1] YANG J Y, XIONG Y L. Inhibition of lipid oxidation in oil-in-water emulsions by interface-adsorbed myofibrillar protein [J]. Journal of Agricultural and Food Chemistry, 2015, 63(40): 8 896-8 904.
[2] WAN Z L, WANG L Y, WANG J M, et al. Synergistic interfacial properties of soy protein-stevioside mixtures: Relationship to emulsion stability [J]. Food Hydrocolloids, 2014, 39:127-135.
[3] MUNK M B, LARSEN F H, VAN DEN BERG F W J, et al. Competitive displacement of sodium caseinate by low-molecular-weight emulsifiers and the effects on emulsion texture and rheology [J]. Langmuir, 2014, 30(29): 8 687-8 696.
[4] KAUR G, MEHTA S K. Developments of polysorbate (Tween) based microemulsions: Preclinical drug delivery, toxicity and antimicrobial applications [J]. International Journal of Pharmaceutics, 2017, 529(1-2): 134-160.
[5] DONG X, ZHU Q, DAI Y, et al. Encapsulation artocarpanone and ascorbic acid in O/W microemulsions: Preparation, characterization, and antibrowning effects in apple juice [J]. Food Chemistry, 2016, 192:1 033-1 040.
[6] ARANCIBIA C, RIQUELME N, ZUNIGA R, et al. Comparing the effectiveness of natural and synthetic emulsifiers on oxidative and physical stability of avocado oil-based nanoemulsions [J]. Innovative Food Science & Emerging Technologies, 2017, 44:159-166.
[7] KALTSA O, PAXIMADA P, MANDALA I, et al. Physical characteristics of submicron emulsions upon partial displacement of whey protein by a small molecular weight surfactant and pectin addition [J]. Food Research International, 2014, 66:401-408.
[8] CAI B, IKEDA S. Effects of the conjugation of whey proteins with gellan polysaccharides on surfactant-induced competitive displacement from the air-water interface [J]. Journal of Dairy Science, 2016, 99(8): 6 026-6 035.
[9] 杨力会, 杨国龙, 吴莹. Tween对精炼大豆油氧化稳定性的影响[J].粮油加工, 2014(12): 42-45.
[10] HUANG L, DING X, DAI C, et al. Changes in the structure and dissociation of soybean protein isolate induced by ultrasound-assisted acid pretreatment [J]. Food Chemistry, 2017, 232:727-732.
[11] YE J, LU R, SU C, et al. Studies on the microrheology of soybean protein isolate (SPI) solution and emulsion during acid-induced gelation process [J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(3): 23-34.
[12] LI Q, QI B, SUI X, et al. Studies on emulsification and oxidation stability of the soybean isolate protein-phospholipid emulsion system [J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(5): 46-52.
[13] YANG T, ZHENG J, ZHENG B S, et al. High internal phase emulsions stabilized by starch nanocrystals [J]. Food Hydrocolloids, 2018, 82:230-238.
[14] XU D, ZHANG J, CAO Y, et al. Influence of microcrystalline cellulose on the microrheological property and freeze-thaw stability of soybean protein hydrolysate stabilized curcumin emulsion [J]. Lwt-Food Science and Technology, 2016, 66:590-597.
[15] LIU F, ZHU Z, MA C, et al. Fabrication of concentrated fish oil emulsions using dual-channel microfluidization: impact of droplet concentration on physical properties and lipid oxidation [J]. Journal of Agricultural and Food Chemistry, 2016, 64(50): 9 532-9 541.
[16] ROY D, DUTTA S, MALTY S S, et al. Spectroscopic and docking studies of the binding of two stereoisomeric antioxidant catechins to serum albumins [J]. Journal of Luminescence, 2012, 132(6): 1 364-1 375.
[17] DING J, QI B, MAO H, et al. Research on anti - oxidation of ascorbic acid for soy protein emulsion stability [J]. Journal of the Chinese Cereals and Oils Association, 2017, 32(7): 67-73.
[18] SHEN Y, HU R, LI Y. Antioxidant and emulsifying activities of corn gluten meal hydrolysates in oil-in-water emulsions [J]. Journal of the American Oil Chemists Society, 2019,97(2):175-185.
[19] LIU F, TANG C H. Emulsifying properties of soy protein nanoparticles: Influence of the protein concentration and/or emulsification process [J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2 644-2 654.
[20] DICKINSON E. Proteins of emulsions stabilized with milk proteins: Overview of some recent developments. [J]. Journal of Dairy Science, 1997, 80: 2 607-2 619.
[21] MCCLEMENTS D J. Food emulsions: Principles, practice and techniques [M]. 3rd ed. London: CRC Press,2015.
[22] 袁媛,毛立科, 高彦祥. Tween系列乳化剂对β-胡萝卜素纳米乳液粒径及稳定性的影响[J]. 食品科学,2008,29(5):181-186.
[23] IMAI H, MAEDA T, SHIMA M, et al. Oxidation of methyl linoleate in oil-in-water micro- and nanoemulsion systems [J]. Journal of the American Oil Chemists Society, 2008, 85(9): 809-815.
[24] SUN C H, GUNASEKARAN S. Effects of protein concentration and oil-phase volume fraction on the stability and rheology of menhaden oil-in-water emulsions stabilized by whey protein isolate with xanthan gum [J]. Food Hydrocolloids, 2009, 23(1): 165-174.
[25] WAN Z L, WANG L Y, WANG J M, et al. Synergistic interfacial properties of soy protein-stevioside mixtures: Relationship to emulsion stability [J]. Food Hydrocolloids, 2014, 39:127-135.
[26] CHANG C, TU S, GHOSH S, et al. Effect of pH on the inter-relationships between the physicochemical, interfacial and emulsifying properties for pea, soy, lentil and canola protein isolates [J]. Food Research International, 2015, 77:360-367.
[27] ZHANG H. Effect of surfactant chain branch on the formation of O/W microemulsion system by mesoscopic simulation [J]. Chemical Research and Application, 2017, 29(1): 32-36.
[28] LOPEZ C M L, DE LA FUENTE J, RUIZ M, et al. Influence of the presence of monoglyceride on the interfacial properties of soy protein isolate [J]. Journal of the Science of Food and Agriculture, 2012, 92(13): 2 618-2 623.
[29] GURBUZ G, LIU C, JIANG Z Q, et al. Protein-lipid co-oxidation in emulsions stabilized by microwave-treated and conventional thermal-treated faba bean proteins [J]. Food Science & Nutrition, 2018, 6(4): 1 032-1 039.
[30] QIU C, ZHAO M, DECKER E A, et al. Influence of protein type on oxidation and digestibility of fish oil-in-water emulsions: Gliadin, caseinate, and whey protein [J]. Food Chemistry, 2015, 175:249-257.
[31] YI J, NING J, ZHU Z, et al. Impact of interfacial composition on co-oxidation of lipids and proteins in oil-in-water emulsions: Competitive displacement of casein by surfactants [J]. Food Hydrocolloids, 2019, 87:20-28.
[32] SUN W, ZHOU F, SUN D-W, et al. Effect of oxidation on the emulsifying properties of myofibrillar proteins [J]. Food and Bioprocess Technology, 2013, 6(7): 1 703-1 712.
[33] NIU X Y, WANG X Y, HAN Y T, et al. Influence of malondialdehyde-induced modifications on physicochemical and digestibility characteristics of whey protein isolate [J]. Journal of Food Biochemistry,2019,43:1-9.
[34] ZHONG K, HU X S, WU J H, et al. Effects of high pulsed electric field on the secondary and tertiary structure of lipoxygenase [J]. Spectroscopy and Spectral Analysis, 2009, 29(3): 765-768.
[35] BERTON C C C, SAGIS L, SCHROEN K. Formation, structure, and functionality of interfacial layers in food emulsions [J]. Annual Review of Food Science and Technology, 2018, 9(9):551-587.
[36] KIOKIAS S, GORDON M H, OREOPOULOU V. Effects of composition and processing variables on the oxidative stability of protein-based and oil-in-water food emulsions [J]. Critical Reviews in Food Science and Nutrition, 2017, 57(3): 549-558.
[37] VIREN R, DUTHIE G, RANAWANA V. Comparing the efficiency of different food-grade emulsifiers to form and stabilise orange oil-in-water beverage emulsions: influence of emulsifier concentration and storage time [J]. International Journal of Food Science and Technology, 2017, 52(2): 348-358.
[38] HAAHR A M, JACOBSEN C. Emulsifier type, metal chelation and pH affect oxidative stability of n-3-enriched emulsions [J]. European Journal of Lipid Science and Technology, 2008, 110(10): 949-961.