果蔬品质在采后贮藏过程中逐渐下降,因此常选择低温来延长果蔬贮藏寿命,维持果蔬的品质质量[1]。温度极大影响着采后果蔬的贮藏品质[2],若贮藏温度过低,会导致诸如番茄、黄瓜等冷敏型果蔬发生冷害[3]。冷害是指贮藏温度降到果蔬自身所能忍受的极限以下时所受到的伤害[4],冷害症状往往不会在贮藏过程中出现,而是将果蔬转移到常温下才会表现出来。番茄(Solanum lycopersicum L.)是世界上最重要也是应用最广泛的果蔬之一,常作为研究冷害的模型植物[5]。番茄的冷害症状主要有果皮褐变、表面出现凹陷、水渍状斑点、干疤、腐烂加快等[6-7],造成果实严重腐烂和品质劣变,缩短了果实货架期,限制了低温技术在番茄等冷敏性果蔬贮藏中的应用。
赤霉素(gibberellins,GAs)作为一种重要的植物内源性激素,在促进植物细胞分裂、促进植物器官生长、增强植物抗冷性等方面都发挥着十分重要的作用[8-10]。司敏等[11]研究发现,对发育期的李果实进行100 mg/L赤霉素处理,能够有效控制李果实的冷害症状;ZHU等[12]研究发现,0.5 mmol/L赤霉素处理能有效保持番茄果实膜的稳定性,维持细胞壁完整性,降低低温贮藏条件下番茄果实中抗氧化酶的活性,从而提高采后番茄果实的抗冷能力。在活性赤霉素的生物合成途径中,贝壳杉烯合酶是合成前期阶段的重要因素,赤霉素缺失型突变株gib-3正是由于该酶活性丧失,无法合成贝壳杉烯[13];贝壳杉烯作为GA合成的前体物质,它的缺失造成植株内赤霉素合成受阻,从而导致植株内赤霉素缺失,产生植物矮化、节间短、果实小等不良症状[14]。目前对于赤霉素缺失对番茄果实抗冷性影响的研究较少,关于赤霉素增强采后番茄果实抗冷性综合机制的建立仍不全面。本研究采取绿熟期的野生型番茄果实和赤霉素缺失型番茄果实为实验材料,统计番茄果实的冷害指数,观察番茄果实的超微结构,从赤霉素缺失时细胞膜相关酶、细胞壁相关酶、抗氧化相关酶、抗逆相关酶方面入手,探究赤霉素缺失对番茄果实抗冷性的影响,从而明确赤霉素在采后番茄果实抗冷调控中的作用。
1 材料与方法
1.1 材料与试剂
野生型番茄果实及赤霉素缺失型突变体番茄果实,种子由C.M. Rick Tomato Genetics Resource Center提供,种植并采摘于北京市昌平区金六环农业生态园,挑选符合实验要求的番茄果实进行研究。
环氧树脂、十二烯基琥珀酸酐(dodeceny succinicanhydride, DDSA)(优级品),北京金锐林科技发展有限公司;戊二醛(98%),湖北新景新材料有限公司;交联聚乙烯吡咯烷酮(crosslinked polyvinyulpyrrolidone, PVPP)(化学纯)、核黄素(化学纯),美国Sigma公司;氮蓝四唑(分析纯),美国Amresco公司;NaClO、H3PO4、乙醇、丙酮、三氯乙酸、硫代巴比妥酸、乙酸、乙酸钠、多聚半乳糖醛酸、3,5-二硝基水杨酸、乙二胺四乙酸、K3PO4、甲硫氨酸、H2O2均为分析纯,国药集团化学试剂有限公司;植物果胶甲酯酶检测试剂盒,北京凯美特科技有限公司;苯丙氨酸解氨酶活性检测试剂盒、谷胱甘肽S-转移酶活性检测试剂盒,北京索莱宝科技有限公司。
1.2 设备与仪器
ZHWY-200H温型无级调幅振荡器,上海智城分析仪器制造有限公司;QM100(S)型高通量研磨仪,五洲鼎创(北京)科技有限公司;TGL-16k型湖南湘仪台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;HH-4 数显恒温水浴锅,江苏省金坛市荣华仪器有限责任公司;TU-1901 双光束紫外可见分光光度计,北京普析通用有限责任公司;电热恒温培养箱,上海一恒科学仪器有限公司;SPARK型TECAN多功能酶标仪,帝肯(上海)贸易有限公司;YP502N电子天平,上海精密科学仪器有限公司;MX-S型旋涡混匀器,上海京工实业有限公司;日立H-7500型透射电子显微镜,株式会社日立制作所。
1.3 实验方法
1.3.1 实验材料处理
将挑选好的大小、成熟度一致、无机械伤的野生型番茄果实(wild type, WT)和突变株番茄果实(gib-3)分别用水洗净,用体积分数为1%的NaClO溶液浸泡消毒2 min,再以自来水冲洗并沥干表面。将所有番茄果实于4 ℃下贮藏28 d,湿度控制在80%~90%。于贮藏第14、21、28天取样,转移至室温下3 d后测量其冷害指数;于贮藏第21天取样,转移至室温下3 d后观察其超微结构;再于贮藏第0、3、7、14、21、28天对番茄果实的果皮进行取样,分别测量番茄果实的离子渗透率、丙二醛(malondialdehyde,MDA)含量、磷脂酶D(phospholipase, PLD)、脂氧合酶(lipoxygenase,LOX)、多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲酯酶(pectin methylesterase, PME)、超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)、苯丙氨酸解氨酶(phenylalanine ammonia lyase, PAL)和谷胱甘肽转移酶(glutathione transferase, GST)的活性变化。每组试验均进行3次平行操作。
1.3.2 冷害指数测量
参考ZHAO等[15]的方法,略有改动。4 ℃下贮藏第14、21、28 天时,对gib-3和WT型番茄果实取样,每组取样20个,转移至室温下,3 d后统计冷害指数。
1.3.3 超微结构观察
4 ℃下贮藏21 d时,对gib-3和WT型番茄果实取样,每组取样6个,转移至室温下3 d后制作透射电镜样片,观察其超微结构。电镜样片的制作和观察均在中国农业科学院加工研究所电镜室进行。用刀片将番茄果皮组织切成1 mm3的小块, 用体积分数3%戊二醛溶液(pH 7.2)固定2~4 h, 0.1 mol/L磷酸缓冲液(pH 7.4) 清洗2 h,再用10 g/L四氧化锇固定,不同浓度梯度的酒精脱水,无水丙酮置换,35 ℃下用丙酮以2∶1体积比混合液渗透2 h,环氧树脂包埋,500~1 000 üA 超薄切片,醋酸双氧铀-铅双染,在透射电子显微镜下观察表皮下层细胞的变化并拍照。
1.3.4 离子渗透率测定
参考ZHANG等[16]的方法,略有改动。用直径6 cm的打孔器将番茄果实的果皮组织打成圆片,用蒸馏水洗涤后每6片转移至盛有40 mL去离子水的锥形瓶中,测量电导率P0;室温下摇床振荡2 h,测量电导率P1;置于沸水中煮沸10 min,立即冷却至室温,补充蒸发所散失的水分,测量电导率P2。离子渗透率(EI)按公式(1)计算:
(1)
1.3.5 MDA含量测定
采用硫代巴比妥酸(thiobarbituric acid,TBA)法[17]测量番茄果实MDA含量,略有改动。分别取gib-3和WT型番茄果实的果皮组织,在液氮中研磨成粉末,取1.5 g番茄果皮组织粉末,加入7 mL的100 g/L三氯乙酸溶液提取,均质后于4 ℃下8 000×g离心10 min,取2 mL上清液(WT型番茄果实组中加入2 mL三氯乙酸溶液),向其中加入2 mL TBA溶液(6.7 g/L)并混匀,在95 ℃下水浴20 min,冷却至室温,于4 ℃下8 000×g离心10 min,取上清液分别测定450、532和600 nm下的吸光值。MDA含量以鲜重表示,按公式(2)、(3)计算:
cMDA/(μmol·L-1)=6.45×(OD532-OD600)-0.56×OD450
(2)
MDA含量![]()
(3)
式中:cMDA,MDA浓度,μmol/L;V,三氯乙酸(提取用)体积,mL;V1,反应体系体积,mL;V2,三氯乙酸(测定用)提取液体积,mL;m,样品鲜重,g。
1.3.6 PLD、LOX活性测定
参考MAO等[18]的方法,对PLD、LOX活性进行测定。
1.3.7 PG、PME活性测定
PG活性的测定方法参考GAYATHRI等[19]的方法,PME活性使用植物果胶甲酯酶检测试剂盒测定。
1.3.8 SOD、CAT活性测定
SOD和CAT活性均参考DING等[20]的方法测定。
1.3.9 PAL、GST活性测定
PAL和GST活性分别采用苯丙氨酸解氨酶活性检测试剂盒、谷胱甘肽S-转移酶活性检测试剂盒测定。
1.4 数据处理
每个试验至少进行3次平行操作,试验结果以平均值表示。使用SPSS 24软件中的最小显著性差异法和邓肯分析对所有数据进行单因素方差分析,以P<0.05 表示差异显著。
2 结果与分析
2.1 赤霉素缺失对番茄果实冷害指数的影响
番茄果实在4 ℃下贮藏14、21、28 d,转移到室温3 d后开始出现冷害症状。如图1-a所示,与WT型番茄果实相比,gib-3型番茄果实表面凹陷程度、干疤、果肉褐变程度更为严重,甚至出现了微生物侵染现象,且触感比WT软烂。如图1-b所示,4 ℃下贮藏的番茄果实冷害指数呈显著上升趋势(P<0.05),且gib-3型番茄果实的冷害指数显著高于WT(P<0.05)。此外,贮藏第14、21、28天时,gib-3型番茄果实的冷害指数分别是WT的1.25、1.12、1.24倍。这表明,低温贮藏下,赤霉素缺失加重了番茄果实的冷害症状,不利于番茄果实低温下的长期贮藏。

图1 赤霉素缺失对番茄果实冷害症状(a)和冷害指数(b)的影响
Fig.1 Effects of GA synthesis deficiency on chilling injury symptoms (a) and chilling injury index (b) in tomato fruits
注:不同小写字母表示在α=0.05 显著水平下差异显著(P<0.05)
2.2 赤霉素缺失对番茄果实超微结构的影响
由于在4 ℃下贮藏21 d时,gib-3型番茄果实和WT的冷害指数差异最为显著(P<0.05),因此选取4 ℃下贮藏21 d的番茄果实进行超微结构的观察。通过对番茄果实的果皮组织进行超微结构的观察(图2),可以明显看到,与WT相比,gib-3型番茄果实细胞壁破损现象更为严重,且细胞内容物破碎,甚至泄漏至细胞外。另外,gib-3型番茄果实细胞壁较薄,且厚度不均匀,这可能是导致番茄果实果皮出现凹陷和果实软烂的微观原因[21]。在gib-3型番茄果实果皮细胞中,有较为明显的退化的细胞器沉淀,可以清楚地观察到质壁分离等现象。这些微观结构变化增大了细胞内生理生化反应的接触面积,加速了番茄果实的衰老和变质,为病原菌的入侵提供了非常便利的条件[22]。由此可知,赤霉素缺失型番茄果实无法较好地保持低温贮藏下果实细胞壁的完整性,加深了果实遭受冷害的程度。
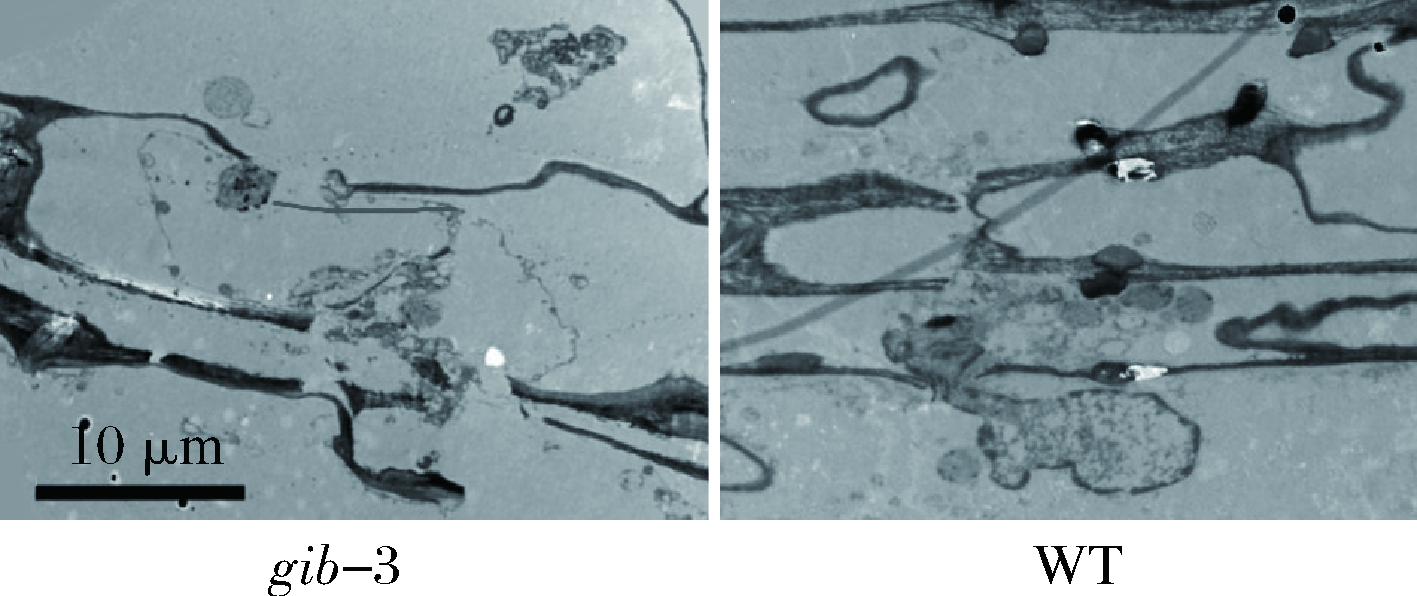
图2 赤霉素缺失对番茄果实超微结构的影响
Fig.2 Effects of GA deficiency on microstructure in tomato fruit
2.3 赤霉素缺失对番茄果实MDA含量和离子渗透率的影响
MDA含量和离子渗透率的大小表明了低温贮藏下番茄果实细胞膜的损伤程度和完整性[15]。MDA是膜脂肪酸过氧化反应的最终产物,MDA含量的增加表明细胞膜完整性受到损害,常作为氧化应激反应的标志[23]。如图3-a所示,在整个贮藏期间,番茄果实的MDA含量逐渐升高,且gib-3型番茄果实的MDA含量显著高于WT型番茄果实(P<0.05);在贮藏第28天,gib-3番茄果实的MDA含量比WT高32.4%。这说明赤霉素缺失加速了膜脂的过氧化进程,无法避免番茄果实细胞膜遭受氧化损伤,无法维持细胞膜完整性,进而降低了其抗冷性。
离子渗透率常用来评价细胞膜透性损失,因此可以作为衡量细胞膜完整性的指标[24]。由图3-b看出,在整个贮藏周期,番茄果实的离子渗透率呈逐渐上升的趋势,且gib-3型番茄果实的离子渗透率显著高于WT(P<0.05)。贮藏第28天时,两者离子渗透率相差最大,达到24.67%。这表明赤霉素缺失提高了番茄果实的离子渗透率,增大了细胞膜透性。
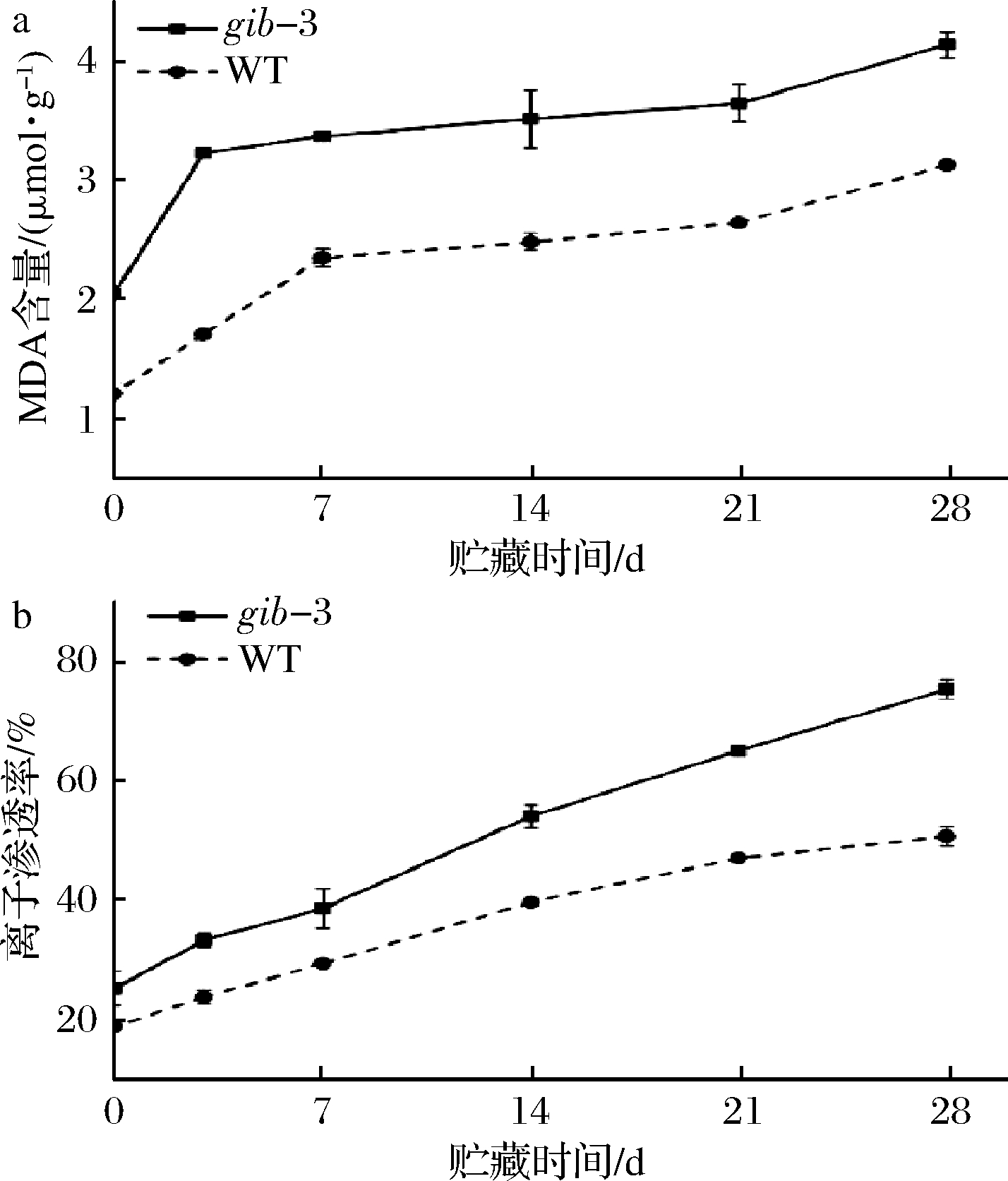
图3 赤霉素缺失对番茄果实MDA含量(a)和离子渗透率(b)的影响
Fig.3 Effects of GA deficiency on MDA content (a) and ion permeability(b) on tomato fruits
2.4 赤霉素缺失对番茄果实细胞膜相关酶活性的影响
前人研究表明[18,24],PLD和LOX等与磷脂代谢有关的酶活性增加会加快膜磷脂的氧化反应,增加脂质不饱和度,增大细胞膜的流动性,破坏细胞膜磷脂双分子层结构,导致细胞膜降解,逐渐失去稳态。由图4-a所示,gib-3型番茄果实的PLD活性显著高于WT(P<0.05),且活性呈现出先升高后降低的趋势。贮藏第14天时2种类型的番茄果实PLD活性迅速升高,可能是因为细胞中液泡破裂导致细胞质变为酸性,激活了PLD[24]。14 d之后,2种番茄果实的PLD活性逐渐下降,MAO等研究发现[18],磷脂降解引起的膜硬化可能是贮藏后期番茄果实PLD活性降低的原因。
如图4-b所示,低温贮藏条件下,gib-3番茄果实的LOX活性显著高于WT(P<0.05),且2种番茄果实的LOX活性均呈现先增长后降低的趋势。贮藏21 d时达到峰值,此时WT的LOX活性为4 454.78 U/g,gib-3的LOX活性为6 486.37 U/g,比WT高45.6%;此后活性逐渐下降。贮藏后期LOX活性逐渐降低可能是由于膜脂过氧化反应的增加,使膜磷脂不饱和度升高,导致LOX的底物减少[18]。研究表明,PLD和LOX有协同作用,PLD可能为LOX的反应位点提供游离脂肪酸,两者的协同作用会加速细胞膜磷脂的过氧化反应进程和降解速度,逐渐破坏细胞膜,引起冷害的发生[18]。

图4 赤霉素缺失对番茄果实PLD活性(a)和LOX活性(b)的影响
Fig.4 Effects of GA deficiency on PLD activity (a) and LOX activity (b) on tomato fruits
2.5 赤霉素缺失对番茄果实细胞壁相关酶活性影响
冷害会影响果蔬的新陈代谢,导致番茄果实表面出现不正常成熟和损伤区域[26],这些变化与细胞壁的完整性有关,其中果胶溶解和解聚作用的改变导致了上述症状的发生[21]。前人研究表明,PME、PG以及果胶裂解酶、半乳糖苷酶和阿拉伯糖苷酶等酶都参与了果胶的降解[21],PG和PME酶活性越高,细胞壁破损程度越严重。KHADEMI等[26]研究发现,PG通过促进果胶的降解来破坏细胞壁。图5-a表明,在整个贮藏周期,gib-3型番茄果实的PG活性显著高于WT(P<0.05),且在0~14 d呈急速上升的趋势,14 d达到峰值,其中WT型番茄果实PG活性为8.07 U/g,gib-3型果实PG活性为16.83 U/g,是WT的2.08倍。由图5-b可知,gib-3型番茄果实的PME活性显著高于WT(P<0.05)。贮藏至21 d时,两者的PME活性均达到最大值,其中gib-3型番茄果实PME活性为354.11 U/L,WT型果实PME活性为312.54 U/L。以上结果表明,GA缺失会增大PG和PME的活性,加快番茄果实细胞壁降解速度,细胞壁破损现象严重,这与观察番茄果实超微结构的结果相符合。
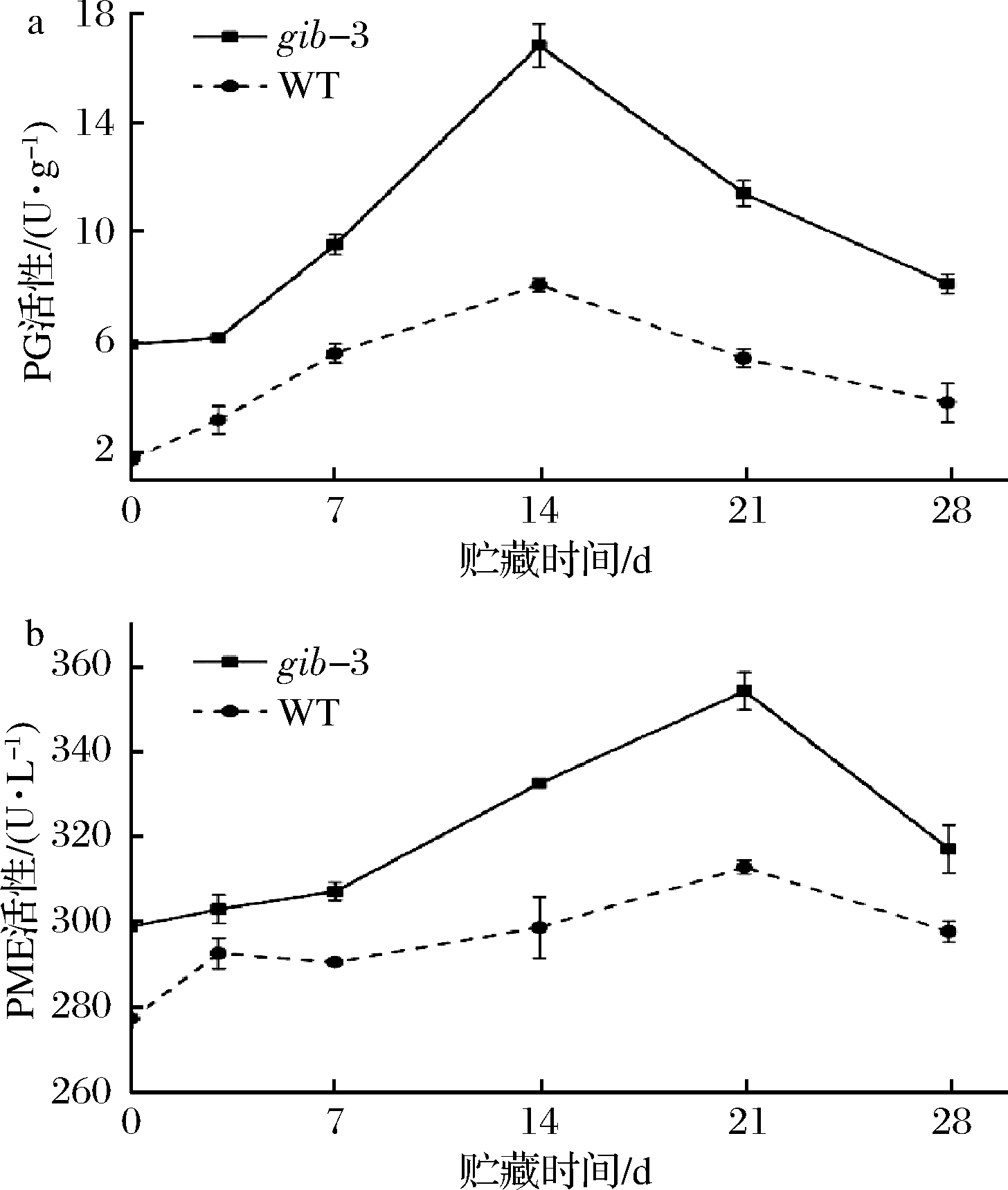
图5 赤霉素缺失对番茄果实PG活性(a)和PME活性(b)的影响
Fig.5 Effects of GA deficiency on PG activity (a) and PME activity (b) on tomato fruits
生吉萍等[27]研究发现,PG和LOX共同影响番茄果实的软化,LOX加速脂质过氧化反应,产生大量自由基促进了乙烯和脱落酸的生成,加速果实衰老;PG则加速果实细胞壁的降解,最终导致细胞膜和细胞壁破损,使果实软烂。在本研究中,gib-3番茄果实的LOX活性在贮藏21 d前持续增加,PG也保持着显著高于WT的活性(P<0.05),导致GA缺失型番茄果实软烂程度严重,抗冷性下降。
2.6 赤霉素缺失对番茄果实抗氧化相关酶活性影响
有研究表明,低温等非生物胁迫会导致植物体内活性氧和自由基的积累[28]。SOD和CAT等抗氧化酶能够减少低温胁迫引起的氧化损伤,对清除活性氧、自由基以保护细胞膜具有十分重要的作用[29]。图6表明,2种类型的番茄果实的SOD和CAT活性均呈现出先升高后降低的趋势,在贮藏第7天时达到峰值,此后活性不断下降。在整个贮藏周期,与WT相比,gib-3型番茄果实的SOD和CAT活性较低。在本研究中,gib-3的LOX活性显著高于WT,加速了膜磷脂过氧化反应的进程,产生了大量自由基;且gib-3的SOD和CAT活性显著低于WT型,使得果实内自由基清除系统无法清除大量累积的活性氧和自由基,导致gib-3番茄果实不断遭受氧化损伤。因此,GA缺失会导致番茄果实SOD和CAT活性的降低,不利于活性氧和自由基的清除,导致其在番茄果实内不断积累,增大了番茄果实遭受氧化损伤的程度,进而使其抗冷性降低。
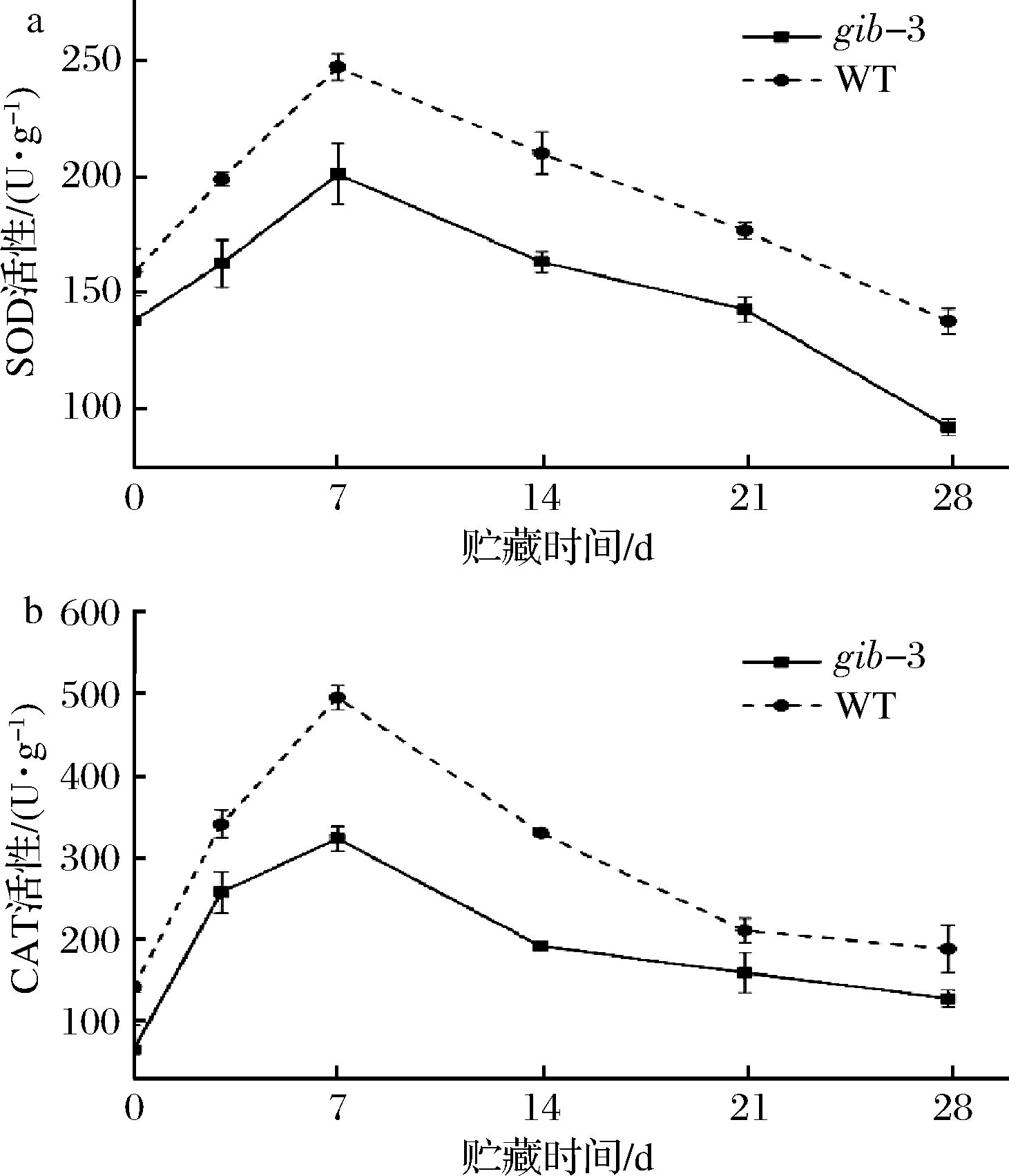
图6 赤霉素缺失对番茄果实SOD活性(a)和CAT活性(b)的影响
Fig.6 Effects of GA deficiency on SOD activity (a) and CAT activity (b) on tomato fruits
2.7 赤霉素缺失对番茄果实抗逆相关酶活性的影响
PAL是苯丙氨酸生物合成途径中十分重要的酶,对苯丙氨酸的生物合成起着重要的调节作用。低温胁迫会刺激PAL活性上升,促进苯丙氨酸的合成,提高植物的抗寒性[30]。前人研究发现,低温胁迫引起的PAL活性增加,可以产生大量苯丙烷代谢物,避免番茄果实遭受光损伤,减轻低温引起的氧化损伤,从而提高果实的抗冷能力[31-32]。本研究中,低温贮藏时,番茄果实的PAL活性受到诱导,故贮藏前期活性不断增加,后期降低。由图7-a可知,gib-3型番茄果实PAL活性显著低于WT(P<0.05),2种番茄果实的PAL活性在贮藏前期呈现出上升趋势,第21天达到峰值,此后活性下降。贮藏21 d,WT型PAL活性为74.97 U/g,gib-3型番茄果实PAL活性为45.29 U/g,比WT低39.59%。另外,本研究中关于番茄果实抗氧化相关酶的生理指标显示,gib-3型番茄果实的SOD和CAT活性较低(图6),不利于清除番茄果实内的活性氧和自由基;而gib-3型番茄果实中较低活性的PAL也无法减轻低温引起的氧化损伤。以上结果表明,GA缺失会引起番茄果实内PAL活性降低,加重番茄果实光损伤和氧化损伤的程度。
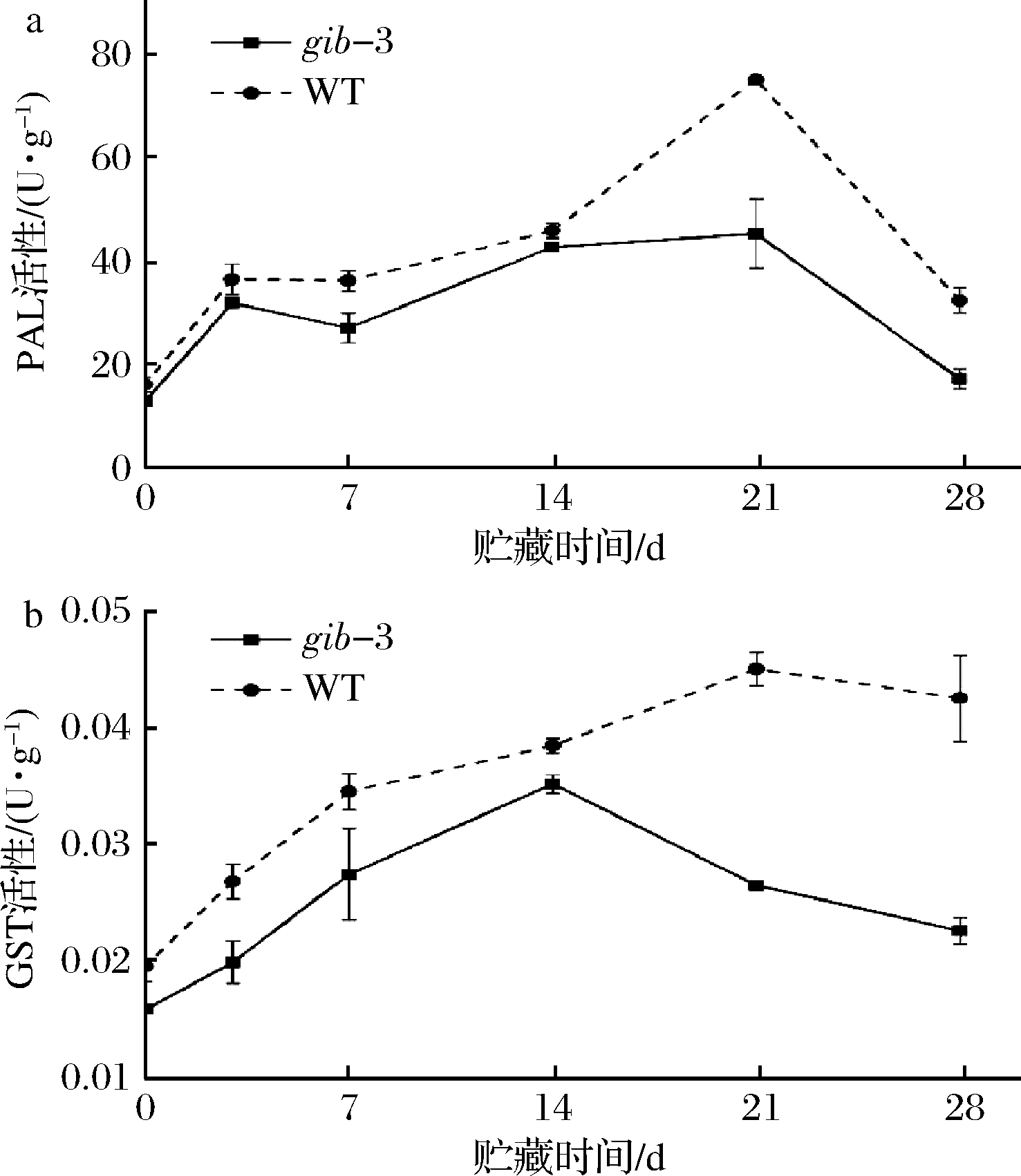
图7 赤霉素缺失对番茄果实PAL活性(a)和GST活性(b)的影响
Fig.7 Effects of GA deficiency on PAL activity (a) and GST activity (b) on tomato fruits
GST是细胞内最重要的抗氧化剂之一,能清除过多的氧化物,保护细胞膜的完整性,增强植物对低温胁迫的抵抗能力[33]。GST作为一种重要的解毒酶,能够减轻活性氧引起的氧化损伤,在生物和非生物应激反应中具有举足轻重的地位[34]。如图7-b所示,gib-3番茄果实的GST活性显著低于WT型(P<0.05)。在整个贮藏周期,2种番茄果实GST活性呈现出先升高后降低的趋势。其中WT型GST的活性在21 d达到峰值,此后缓缓下降;而gib-3型番茄果实GST活性在贮藏14 d就达到峰值,在后续的贮藏时期快速下降,但在14 d时仍比同期WT型的GST活性低8.52%。这表明,GA缺失会导致番茄果实GST活性降低,不利于清除果实内积累的活性氧和自由基,会加重番茄果实的氧化损伤,从而降低番茄果实的抗冷能力。
3 结论
研究表明,GA缺失加重了番茄果实的冷害症状,增大番茄果实冷害指数,且无法维持细胞微观结构的完整性。另外,GA缺失使番茄果实的MDA含量、离子渗透率升高,促进细胞膜磷脂相关酶PLD和LOX、细胞壁降解相关酶PG和PME活性增强,进而破坏细胞膜和细胞壁的完整性;且使细胞抗氧化相关酶SOD和CAT、抗逆相关酶PAL和GST活性减弱,降低清除细胞内积累的活性氧和自由基的能力,使番茄果实不断遭受氧化损伤,降低番茄果实的抗冷性。因此,GA缺失型的番茄果实抗冷能力严重降低,进一步说明赤霉素在采后番茄抗冷调控中发挥了十分重要的作用。
[1] LIU H, SONG L, YOU Y, et al. Cold storage duration affects litchi fruit quality, membrane permeability, enzyme activities and energy charge during shelf time at ambient temperature[J]. Postharvest Biology & Technology, 2011, 60(1):24-30.
[2] SHARMA S, SHARMA R R. Nitric oxide inhibits activities of PAL and PME enzymes and reduces chilling injury in ‘Santa Rosa’ Japanese plum (Prunus salicinalindell) [J]. Journal of Plant Biochemistry and Biotechnology, 2015, 24(3):292-297.
[3] YUN Z, JIN S, DING Y, et al. Comparative transcriptomics and proteomics analysis of citrus fruit, to improve understanding of the effect of low temperature on maintaining fruit quality during lengthy post-harvest storage[J]. Journal of Experimental Botany, 2012, 63(8):2 873-2 893.
[4] STEPONKUS P L. Behavior of the plasma membrane of isolated protoplasts during a freeze-thaw cycle[J]. Cryobiology, 1984, 21(6):690-695.
[5] ZHAO R, SHENG J, LV S, et al. Nitric oxide participates in the regulation of LeCBF1 gene expression and improves cold tolerance in harvested tomato fruit[J]. Postharvest Biology and Technology,2011,62(2):121-126.
[6] BARMAN K, ASREY R, PAL R K, et al. Post-harvest nitric oxide treatment reduces chilling injury and enhances the shelf-life of mango (Mangifera indica L.) fruit during low-temperature storage[J]. Journal of Pomology & Horticultural Science, 2015,89(3):253-260.
[7] DING Y, SHENG J, LI S, et al. The role of gibberellins in the mitigation of chilling injury in cherry tomato (Solanum lycopersicum L.) fruit[J]. Postharvest Biology and Technology, 2015, 101:88-95.
[8] CRAIN B A, CREGG B M. Gibberellic acid inhibitors control height growth and cone production in Abies fraseri[J]. Scandinavian Journal of Forest Research, 2016,32:1-6.
[9] QIU L H, CHEN R F, LUO H M, et al. Effects of exogenous GA3 and DPC treatments on levels of endogenous hormone and expression of key gibberellin biosynthesis pathway genes during stem elongation in sugarcane[J]. Sugar Tech, 2019,21:936-948.
[10] YANG L, YANG D, YAN X, et al. The role of gibberellins in improving the resistance of tebuconazole-coated maize seeds to chilling stress by microencapsulation[J]. Scientific Reports, 2016, 6:35 447.
[11] 司敏,伍利芬,薛华丽,等. 采前赤霉素处理对李果实采后冷害的抑制及部分机理研究[J]. 中国果树, 2018, 192(4):10-15.
[12] ZHU Z, DING Y, ZHAO J, et al. Effects of postharvest gibberellic acid treatment on chilling tolerance in cold-stored tomato (Solanum lycopersicum L.) fruit[J]. Food and Bioprocess Technology, 2016, 9(7):1 202-1 209.
[13] HAYASHI KI, KAWAIDE H, NOTOMI M, et al. Identification and functional analysis of bifunctional ent-kaurene synthase from the moss Physcomitrella patens[J]. FEBS Letters, 2006, 580: 6 175-6 181
[14] BENSEN RJ, ZEEVAART JAD. Comparison of ent-kaurene synthetase A and B activities in cell-free extracts from young tomato fruits of wild-type and gib-1, gib-2, and gib-3 tomato plants[J]. Journal of Plant Growth Regulation, 1990, 9: 237-242.
[15] ZHAO D Y, SHEN L, FAN B, et al. Physiological and genetic properties of tomato fruits from 2 cultivars differing in chilling tolerance at cold storage [J]. Journal of Food Science, 2009, 74(5): 348-352.
[16] ZHANG X, SHEN L, LI F, et al. Arginase induction by heat treatment contributes to amelioration of chilling injury and activation of antioxidant enzymes in tomato fruit[J]. Postharvest Biology and Technology, 2013, 79(Complete):1-8.
[17] AGHDAM M S, ASGHARI M, FARMANI B, et al. Impact of postharvest brassinosteroids treatment on PAL activity in tomato fruit in response to chilling stress[J]. Scientia Horticulturae,2012,144:116-120.
[18] MAO L, PANG H, WANG G, et al. Phospholipase D and lipoxygenase activity of cucumber fruit in response to chilling stress [J]. Postharvest Biology and Technology, 2007, 44(1): 42-47.
[19] GAYATHRI T, NAIR A S. Isolation, purification and characterisation of polygalacturonase from ripened banana (Musa acuminata cv. Kadali) [J]. International Journal of Food Science & Technology, 2014, 49(2):429-434.
[20] DING Y, SHENG J, LI S, et al. The role of gibberellins in the mitigation of chilling injury in cherry tomato (Solanum lycopersicum L.) fruit[J]. Postharvest Biology and Technology, 2015,101: 88-95.
[21] F TIMA C, PALMA F, JAMILENA M, et al. Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J]. Postharvest Biology and Technology, 2015, 108(September):68-77.
TIMA C, PALMA F, JAMILENA M, et al. Cell wall metabolism and chilling injury during postharvest cold storage in zucchini fruit[J]. Postharvest Biology and Technology, 2015, 108(September):68-77.
[22] VICENTE A R, MANGANARIS G A, MINAS I S, et al. Cell wall modifications and ethylene-induced tolerance to non-chilling peel pitting in citrus fruit[J]. Plant Science, 2013, 210C(9):46-52.
[23] AGHDAM M S, MOHAMMADKHANI N. Enhancement of chilling stress tolerance of tomato fruit by postharvest brassinolide treatment[J]. Food and Bioprocess Technology, 2014, 7(3):909-914.
[24] PINHERO R G, ALMQUIST K C, NOVOTNA Z, et al. Developmental regulation of phospholipase D in tomato fruits[J]. Plant Physiology and Biochemistry,2003, 41(3):223-240.
[25] SEVILLANO L, SANCHEZ-BALLESTA M T, ROMOJARO F, et al. Physiological, hormonal and molecular mechanisms regulating chilling injury in horticultural species. Postharvest technologies applied to reduce its impact[J]. Journal of the Science of Food and Agriculture, 2009, 89(4):555-573.
[26] KHADEMI O, BESADA C, MOSTOFI Y, et al. Changes in pectin methylesterase, polygalacturonase, catalase and peroxidase activities associated with alleviation of chilling injury in persimmon by hot water and 1-MCP treatments[J]. Scientia Horticulturae, 2014, 179:191-197.
[27] 生吉萍,罗云波,申琳. PG和LOX对采后番茄果实软化及细胞超微结构的影响[J]. 园艺学报,2000(4):276-281.
[28] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12):909-930.
[29] EGEA I, FLORES F B, MART NEZ-MADRID M C, et al. 1-Methylcyclopropene affects the antioxidant system of apricots (Prunus armeniaca L. cv. Búlida) during storage at low temperature[J]. J Sci Food Agric, 2010, 90(10):1 764-1 764.
NEZ-MADRID M C, et al. 1-Methylcyclopropene affects the antioxidant system of apricots (Prunus armeniaca L. cv. Búlida) during storage at low temperature[J]. J Sci Food Agric, 2010, 90(10):1 764-1 764.
[30] ORTEGA-GARC A, FRANCISCA, PERAG
A, FRANCISCA, PERAG N, et al. The response of phenylalanine ammonia‐lyase, polyphenol oxidase and phenols to cold stress in the olive tree (Olea europaea L. cv. Picual) [J]. Journal of the Science of Food and Agriculture, 2009, 89(9):1 565-1 573.
N, et al. The response of phenylalanine ammonia‐lyase, polyphenol oxidase and phenols to cold stress in the olive tree (Olea europaea L. cv. Picual) [J]. Journal of the Science of Food and Agriculture, 2009, 89(9):1 565-1 573.
[31] OLSEN K M, LEA U S, SLIMESTAD R, et al. Differential expression of four Arabidopsis PAL genes; PAL1 and PAL2 have functional specialization in abiotic environmental-triggered flavonoid synthesis[J]. Journal of Plant Physiology, 2008, 165(14):1 490-1 499.
[32] HEIM K E, TAGLIAFERRO A R, BOBILYA D J. Flavonoid antioxidants: chemistry, metabolism and structure-activity relationships[J]. Journal of Nutritional Biochemistry, 2002, 13(10):572-584.
[33] LE MARTRET B, POAGE M, SHIEL K, et al. Tobacco chloroplast transformants expressing genes encoding dehydroascorbate reductase, glutathione reductase, and glutathione-S-transferase, exhibit altered anti-oxidant metabolism and improved abiotic stress tolerance[J]. Plant Biotechnology Journal, 2011, 9(6):661-673.
[34] MD A K, UJJAL N, JONG-IN P, et al. Genome-wide identification, characterization, and expression profiling of glutathione S-transferase (GST) family in pumpkin reveals likely role in cold-stress tolerance[J]. Genes, 2018, 9(2):84.