酰胺类物质广泛应用于工业各个行业,其中丙烯酰胺及其聚合物主要应用于凝结剂、土壤改良剂及石油回收剂等行业,烟酰胺是VB族中的一员,广泛应用于医药,化妆品及食品等行业,具有重要的经济价值。目前,生物法生产酰胺类化合物正逐渐取代传统的化学合成法,相比较化学合成法,生物法具有经济、高效、绿色及副产物少等优点。
腈水合酶(nitrile hydratase,NHase,EC 4.2.1.84)是一类能够水合腈类物质生成酰胺类化合物的金属酶,根据其活性中心螯合的金属不同,可将腈水合酶分为铁型腈水合酶(Fe-NHase)[1]和钴型腈水合酶(Co-NHase)[2]。腈水合酶主要来源于棒状杆菌属(Corynebacterium)、假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、红球菌(Rhodococcus)及假诺卡氏菌属(Nocardia)等原核生物,在植物病原菌和放线菌中也有发现[3],真核生物邻鞭毛虫(Monosiga brevicollis)中腈水合酶的发现[4-5],对NHase研究具有重要意义。最近,在基因库中很多嗜热菌来源的腈水合酶基因被注释却未被解析,新基因的挖掘对研究腈水合酶具有重要意义。
腈水合酶的热稳定性普遍较差,大部分腈水合酶在50 ℃下就丧失活性[6]。应用于工业生产的红球菌 R. rhodochrous J1来源的腈水合酶有2种:高分子量腈水合酶H-NHase和低分子量腈水合酶L-NHase,在催化丙烯腈过程中起主要作用的H-NHase在50 ℃处理10 min仅剩40%酶活[7],所以在工业催化过程中,需要通过严格的控温来维持腈水合酶酶活,增加了能耗。提高腈水合酶的热稳定性,增加酶或菌体在催化过程中的重复利用率,一直是腈水合酶研究的热点。2015年,房月芹等通过计算机半理性设计,将热稳定性较好的来源于Pseudonocardia thermophila JCM3095的腈水合酶与来源于Psedomonas putida NRRL-18668腈水合酶的β亚基通过同源片段交换,提高了目标蛋白的热稳定性[6]。2015年,XIA等利用一段短肽将P. putida NRRL-18668腈水合酶的β亚基和α亚基进行融合,提高了其酶活和热稳定性[8]。2016年,张晓欢将工业应用菌株 R. rhodochrous J1中H-NHase的β和α融合,提高了其热稳定性[7]。2017年,XIA等根据自由能进行半理性设计对来源于P. putida NRRL-18668的融合型腈水合酶进行点突变,进一步提高腈水合酶的热稳定性[9]。PEI等发现在Aurantimonas manganoxydans ATCC BAA-1229腈水合酶的β亚基表面的一段α螺旋对热稳定性具有重要作用[10]。一方面,研究者们通过蛋白质工程技术,对已有的腈水合酶热稳定性进行了成功的改造;另一方面,在基因库中许多耐热菌及古菌来源的腈水合酶被注释,新型耐热腈水合酶的挖掘对工业应用及科学研究具有重要意义。
在工业生产中,第3代丙烯酰胺生产菌株R. rhodochrous J1发酵周期为100 h[11],效率低下,且菌株中的酰胺酶会进一步将酰胺物质催化生成酸,导致产品纯度不高。目前,腈水合酶的异源表达已被广泛研究[12-13],该酶已成功在毕赤酵母、大肠杆菌、红球菌表达系统中表达[14-17]。工业菌株R. rhodochrous J1的H-NHase和L-NHase,通过优化各亚基之间的SD序列,已成功在大肠杆菌中表达[18-19]。有研究已成功异源表达腈水合酶生产烟酰胺,最终产量为230 g/L[20]。王哲通过优化全细胞催化工艺,在分批添加底物的催化下,烟酰胺最终产量为390 g/L[21]。
本研究针对提高腈水合酶的热稳定性,在Genebank基因库中寻找到一种耐热菌Caldalkalibacillus thermarum TA2.A1来源的腈水合酶基因,成功实现该腈水合酶的异源表达,通过在β亚基的C端添加strep标签成功纯化出该酶,研究其热稳定性,对其全细胞催化工艺优化,探寻其工业应用价值。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
大肠杆菌DH5α感受态、大肠杆菌BL21(DE3)感受态,通用生物系统(安徽)有限公司;质粒pET-24a(+),由本实验室保藏。
1.1.2 主要试剂
3-氰基吡啶和烟酰胺、脱硫生物素,Sigma公司;异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)和卡那霉素,上海生工生物工程有限公司;基因和引物由苏州金唯智合成,本文所用引物和序列如表1所示;胰蛋白胨、酵母膏提取物,Oxoid公司;限制性内切酶NdeⅠ和EcoRⅠ,宝生物公司(大连)有限公司(Takara)。
表1 本文所用引物及其序列
Table 1 Primers used in this study
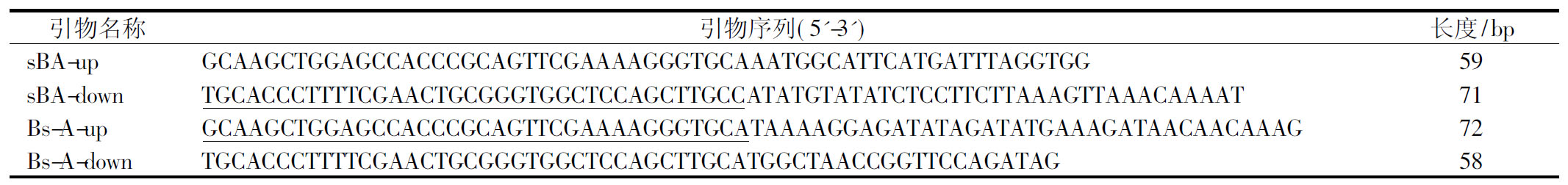
引物名称引物序列(5'-3')长度/bpsBA-upGCAAGCTGGAGCCACCCGCAGTTCGAAAAGGGTGCAAATGGCATTCATGATTTAGGTGG59sBA-downTGCACCCTTTTCGAACTGCGGGTGGCTCCAGCTTGCCATATGTATATCTCCTTCTTAAAGTTAAA-CAAAAT71Bs-A-upGCAAGCTGGAGCCACCCGCAGTTCGAAAAGGGTGCATAAAAGGAGATATAGATATGAAAGATAA-CAACAAAG72Bs-A-downTGCACCCTTTTCGAACTGCGGGTGGCTCCAGCTTGCATGGCTAACCGGTTCCAGATAG58
1.2 实验方法
1.2.1 生物信息分析
利用NCBI-blast工具,将来源于耐热菌株的腈水合酶(NHase)进行初筛,调查研究背景;利用DNAMAN比对酶活中心的氨基酸序列,对所选基因进行复筛;利用SWISS-MODEL对所选酶进行三维结构分析。最终选择来源于温泉热碱芽孢杆菌Caldalkalibacillus thermarum TA2.A1的腈水合酶(Cal.t NHase)进行研究。
1.2.2 表达载体pET-24a(+)-Cal.t NHase 的构建及表达条件优化
将来源于温泉热碱芽孢杆菌的腈水合酶(Cal.t NHase)进行密码子优化,各亚基前面添加一段优化过的RBS序列(AAGGAGATATAGAT)以利于各亚基的表达[22]。将优化过的密码子序列送至苏州金唯智进行基因合成,连接的载体选择pET-24a(+),选择的基因插入位置为NdeⅠ和EcoRⅠ2个酶切位点,保藏菌株选择E. coli DH5α。
将合成好的质粒pET-24a(+)-Cal.t NHase 转化到E. coli BL21(DE 3),涂布在含有50 μg/mL卡那霉素的固体LB平板上,37 ℃倒置培养过夜,挑取单菌落置于含有50 μg/mL卡那霉素的5 mL 2YT液体培养基的试管中,37 ℃,200 r/min培养8~10 h。将培养好的试管种子液以1%的接种量转接到含有50 μg/mL卡那霉素的2YT培养基摇瓶中,37 ℃、200 r/min培养至OD600=0.6~0.8时,添加不同终浓度为0.2、0.4、0.6、0.8 mmol/L IPTG、0.025、0.05、0.1、0.2、0.4 g/L Co2+的诱导剂,30 ℃,200 r/min诱导14 h,破碎上清通过聚丙稀酰胺凝胶电泳(sodium dodecyl sulfate polyaclamide gel electrophoresis,SDS-PAGE)分析蛋白表达情况。
1.2.3 Cal.t NHase的分离纯化及浓度检测
分别在β亚基的N端和C端添加strep标签,构建pET-24a(+)-sBA和pET-24a(+)-BsA表达载体,构建方法为以质粒pET-24a(+)-Cal.t NHase为模板,用表1的引物进行全质粒PCR,DpnⅠ消化质粒模板后,将构建好的质粒转入E. coli DH5α,送测序,将测序结果正确的质粒重新转入E. coli BL21(DE 3),用上述培养方法进行诱导表达。
收集菌体,用缓冲溶液binding buffer(20 mmol/L Na2HPO4、280 mmol/L NaCl、6 mmol/L KCl,pH=7.4)浓缩5倍重悬浮后,置于冰盒中(冰水混合物),用超声破碎仪开3 s停7 s破碎20 min,4 ℃、12 000 r/min、离心1 h,过0.22 μm膜后,strep亲和层析进行纯化。先用抽滤过0.22 μm膜的去离子水将柱子中保存的乙醇溶液至少以5倍体积冲洗干净;再以1 mL/min的流速,用binding buffer溶液平衡柱子;蛋白样品始终放在冰上,10 mL过柱子,流速为1 mL/min,再以binding buffer平衡柱子;待紫外吸收降到0后,用washing buffer (20 mmol/L Na2HPO4、280 mmol/L NaCl、6 mmol/L KCl、2.5 mmol/L脱硫生物素,pH=7.4)洗脱,收集蛋白。将收集到的蛋白用Brandford法测定蛋白质量浓度,SDS-PAGE分析测定,将蛋白稀释到0.5 mg/mL备用。
1.2.4 Cal.t NHase 水合活性的测定
单位酶活力定义为在30 ℃下1 min催化烟腈生成1 μmol烟酰胺所需要的酶量(U);比酶活定义为1 mg 腈水合酶具有的酶活力(U/mg)。反应体系:10 μL质量浓度为0.5 mg/mL蛋白加入490 μL含有200 mmol/L烟腈的10 mmol/L H3PO4缓冲溶液中,30 ℃反应10 min,加入500 μL的乙腈终止反应。过0.22 μm的膜后,C18柱经HPLC测其酶活,流动相为乙腈和水[V(水)∶V(乙腈)=2∶1]的混合液,检测波长为210 nm,检测温度为40 ℃,流动相流速为0.6 mL/min,进样量10 μL,检测10 min,每组数据至少进行3次平行实验。
1.2.5 酶学性质研究
(1)最适温度
分别测定该酶在20、25、30、35、37、40、50 ℃下的酶活,将最高的酶活定义为100%。
(2)最适pH
配含有终浓度为200 mmo/L烟腈的不同pH梯度(pH=5、6、6.5、7、7.5、8、8.5)的10 mmol/L H3PO4缓冲溶液,测定该酶在各pH底物缓冲溶液下的酶活,将最高酶活设定为100%,分析其随pH的变化情况。
(3)热稳定性
将本实验室中研究保存的腈水合酶分离纯化,分别为来源于R. rhodochrous J1的H-NHase(BAG)和L-NHase(BAE)[23-24]、来源于Pseudonocardia thermophila JCM 3095的腈水合酶(Pt-NHase)[25],来源于Pseudomonas putida NRRL 1886的腈水合酶(Pp-NHase)[26]。将酶质量浓度调到0.5 mg/mL,在金属浴65 ℃下处理0、0.5、1、2、3、4、5 h取样,测各腈水合酶的相对酶活,定义各酶处理时间为0 h的酶活为100%,分析其热稳定性情况。
(4)底物及产物耐受性
将诱导培养后的菌液收集菌体,将OD600=8的菌体分别置于烟酰胺浓度为0、1.5、1、1.5、2 mol/L以及烟腈浓度为0、0.2、0.4、0.6、0.8、1 mol/L的缓冲溶液中,30 ℃下孵育30 min,12 000 r/min、1 min离心弃上清缓冲液,用10 mmol/L的H3PO4缓冲溶液洗菌体2次,测其残余酶活,将未经处理的菌体酶活定义为100%。分析不同浓度底物和产物的耐受情况。
1.2.6 全细胞催化生产烟酰胺
将诱导培养后的菌体收集,10 mmol/L、pH=7.4 H3PO4缓冲溶液重悬浮,最终确定反应体系为OD600=8,50 mL,催化期间不断搅拌,控温在30 ℃左右。分批次将烟腈固体添加到菌液中,检测催化过程中烟腈的减少量和烟酰胺的生成量,优化补料间隔时间和补料浓度。
2 结果与分析
2.1 Cal.t NHase基因的异源表达及分离纯化
用限制性内切酶Nde Ⅰ和EcoR Ⅰ对含有目的基因Cal.t NHase的表达载体pET-24a(+)-Cal.t NHase进行双酶切,酶切结果通过琼脂糖核酸凝胶电泳进行验证(图1)。除了诱导剂IPTG影响蛋白表达之外,Co2+对于腈水合酶发挥活性具有重要作用,但过高的Co2+浓度会抑制菌体生长及蛋白表达,故分别对Co2+和IPTG浓度进行优化,结果如图2-a所示,从SDS-PAGE图中确定最佳诱导条件为Co2+0.1 g/L、IPTG 0.2 mmol/L。
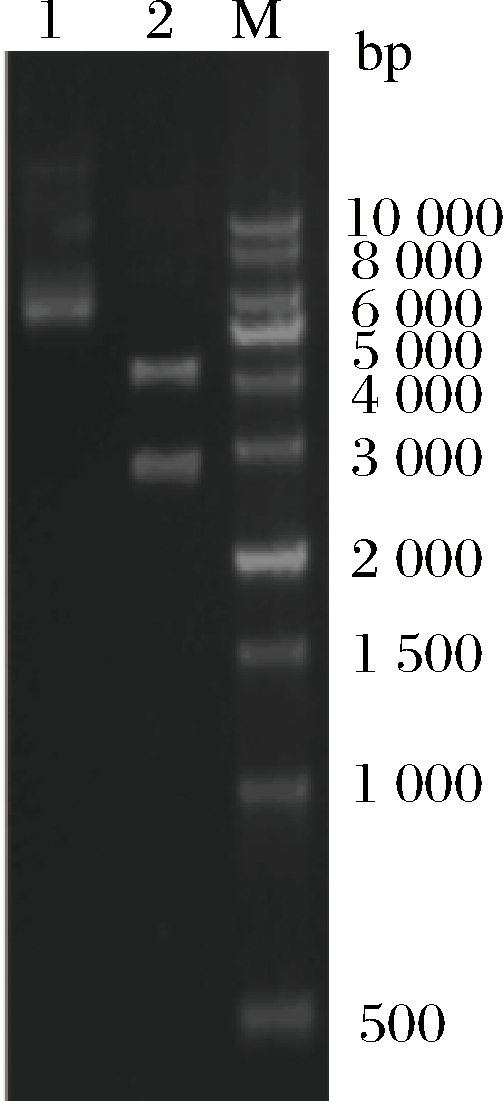
1-pET-24a(+)-Cal.t NHase;2-双酶切质粒pET24a-Cal.t NHase
图1 Cal.t NHase基因电泳图
Fig.1 Electrophoretogramo of Cal.t NHase gene
通过strep亲和层析的方法对目的蛋白进行分离纯化。因为在腈水合酶中,活性中心位于α亚基上,故选择在β亚基的N端和C端融合strep标签,从SDS-PAGE(图2-b)中可以看出将标签加在β亚基的C端可成功纯化该酶,而strep标签融合于腈水合酶β亚基的N端时,影响腈水合酶β亚基的正确折叠,β亚基表达效果不佳,β亚基和α亚基无法正确形成α2β2四聚体,所以strep标签融合于腈水合酶β亚基的N端时无法对目的蛋白Cal.t NHase分离纯化,故在后续的研究中,标签均加在β亚基的C端。
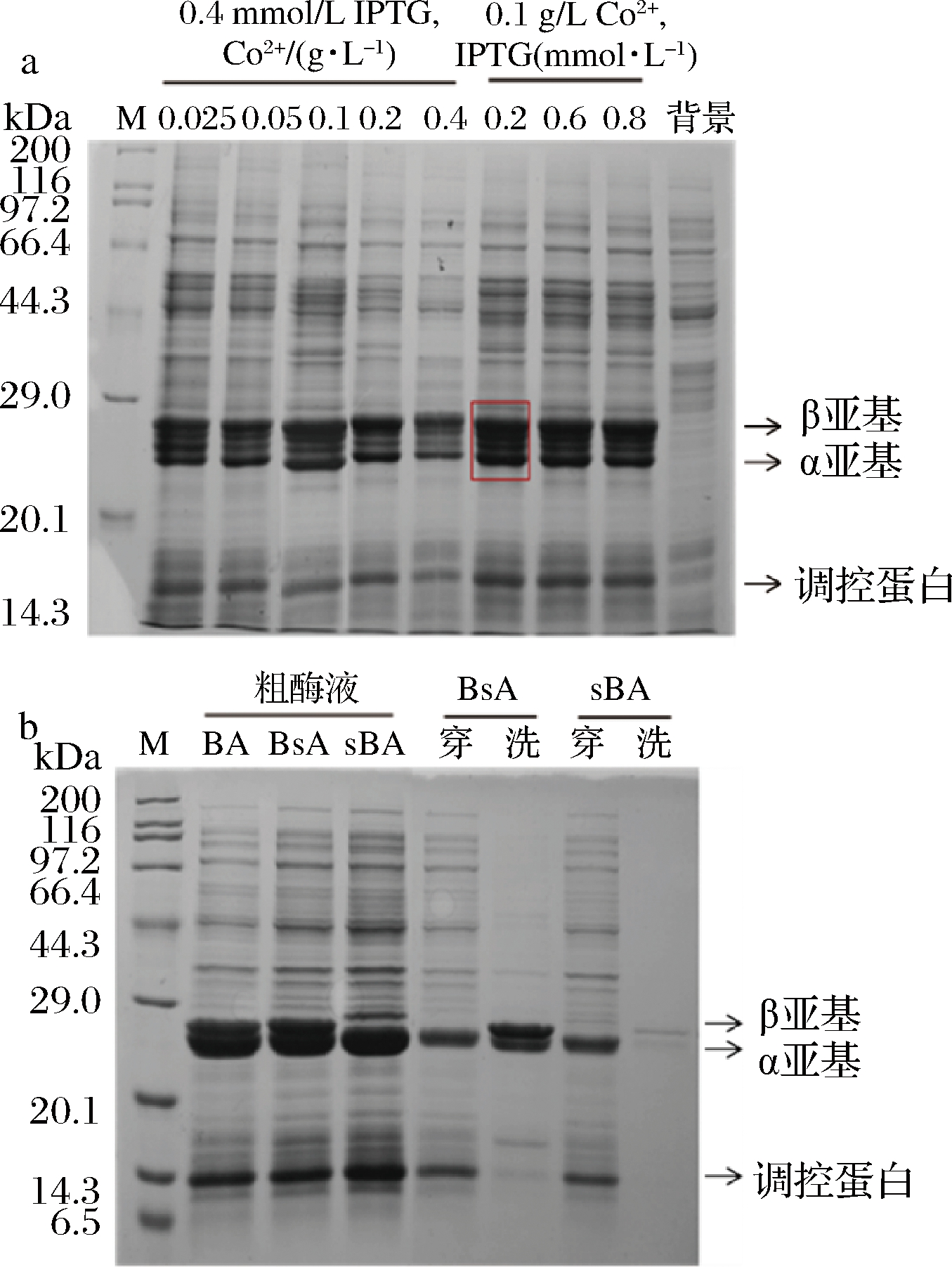
a-优化诱导条件蛋白胶图;b-蛋白纯化蛋白胶图
图2 Cal.t NHase SDS-PAGE图
Fig.2 SDS-PAGE of Cal.t NHase
2.2 酶学性质的分析
不同的反应温度对Cal.t NHase酶活的影响如图3-a所示,该酶最适温度为37 ℃,且在35~40 ℃该蛋白酶活差异不大,在低温下该蛋白酶活较低;不同的pH对Cal.t NHase酶活的影响如图3-b所示,最适pH为7.0且在pH=6.0~7.5其比酶活变化不大。Cal.t NHase的热稳定性如图3-c所示,来源于工业应用菌株红球菌R. rhodochrous J1的腈水合酶(H-NHase)在65 ℃下处理30 min完全丧失活性,来源于嗜热假诺卡氏菌P. thermophila JCM 3095的腈水合酶(Pt-NHase)在65 ℃处理1 h残余酶活仅为10%,Cal.t NHase在65 ℃下处理3 h仍能维持50%的酶活,相较于其他腈水合酶具有较好的热稳定性,对研究腈水合酶热稳定性具有重要参考价值。此外,良好的热稳定性能够节约能耗、降低成本及提高菌体重复利用率,在工业应用中具有重要意义。
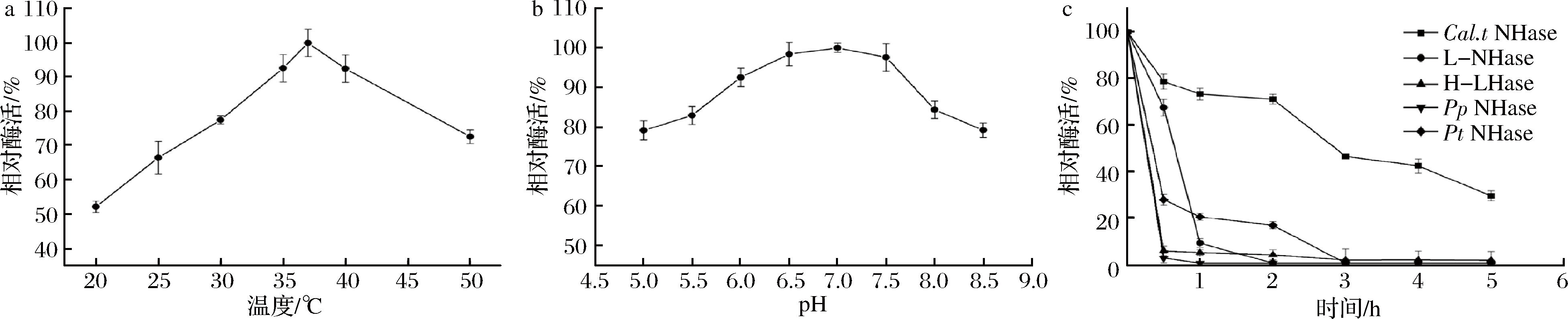
a-最适温度;b-最适pH;c-不同来源的NHase 65 ℃热稳定性
图3 Cal.t NHase的酶学性质
Fig.3 Characterization of Cal.t NHase
PEI等研究发现Pt NHase的β亚基第6个螺旋(Q111-G125)对腈水合酶热稳定性影响较大[10],Cal.t NHase、Pt NHase、Pp NHase、L-NHase、H-NHase相对应的β亚基第六螺旋序列对比如图4所示,从序列对比中可以看到此螺旋序列不保守,但热稳定性相对较好的Cal.t NHase、Pt NHase和L-NHase的L115、Q121和G126相对保守,可能是影响热稳定性的关键位点。

图4 影响NHase热稳定性的关键区域的序列比对
Fig.4 Sequence alignment of heat-sensitive region of NHase from different sources
Cal.t NHase底物(烟腈)和产物(烟酰胺)耐受性如图5所示,用1 mol/L烟腈处理30 min后该酶仍能维持52.87%酶活,用2 mol/L烟酰胺处理30 min仍能维持53.32%酶活。在用底物处理的结果中可以看到,用0.4 mol/L底物处理能维持88.8%的酶活,0.8 mol/L底物处理时仍能维持69%的酶活,在后续的全细胞催化过程中,考虑到底物添加批次及底物浓度过高对酶活影响等因素,选定探索的底物浓度为0.4和0.8 mol/L。
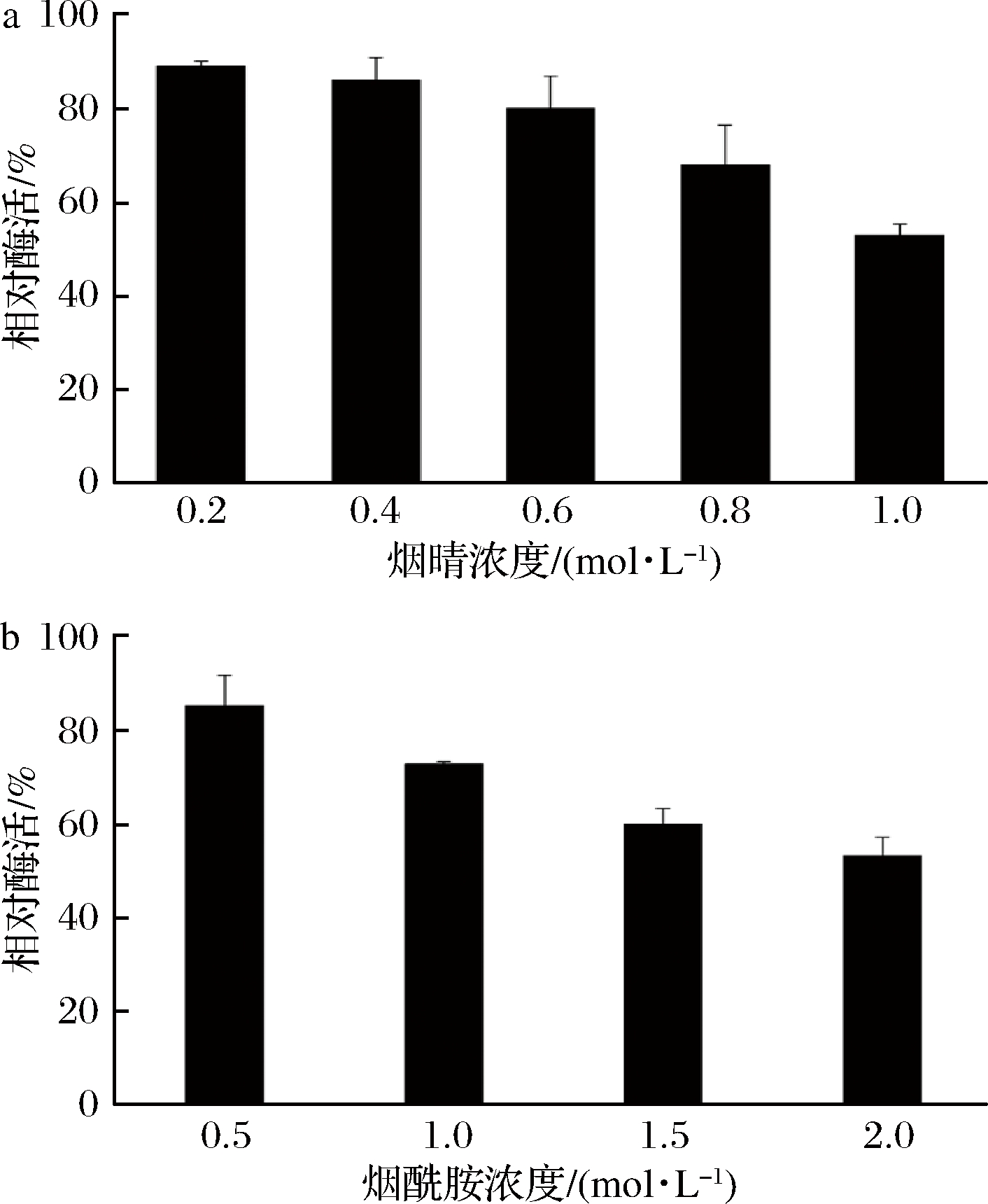
a-底物耐受性;b-产物耐受性
图5 Cal.t NHase底物产物耐受性
Fig.5 Tolerance of Cal.t NHase to 3-cyanopyridine and nicotinamide
2.3 全细胞催化生产烟酰胺
根据王哲[21]的研究,底物分批补料合成烟酰胺工艺,对全细胞催化进行了优化,将底物固体底粉末分批次添加到50 mL,OD600=8的菌液中,不断搅拌,第1批底物反应完后,添加第2批,选择每批底物浓度为0.4 mol/L(图6-a)和0.8 mol/L(图6-c),最终选定的底物添加浓度为0.4 mol/L对底物添加时间进行优化,如图6-a和图6-b所示,最终选定的时间间隔是6 min,后期可适当延长。催化生成烟酰胺的产量比相关文献报道以H-NHase催化提高了26.9%。
3 结论
本文成功实现了温泉热碱芽孢杆菌Caldalkalibacillus thermarum TA2.A1腈水合酶(Cal.t NHase)的异源表达,通过在β亚基的N端添加strep标签,成功实现了Cal.t NHase纯化,其在65 ℃下的半衰期为3 h,较工业应用的来源于R. rhodochrous J1的H-NHase热稳定性高。其比酶活为395 U/mg,比H-NHase提高了60%。在全细胞催化生产烟酰胺过程中,通过对底物添加的优化,最佳方式是前期添加时间间隔为6 min,添加量为0.4 mol/(L·次),最高产量(质量浓度)为495.04 g/L。相比之前全细胞催化研究中,其烟酰胺产量有一定提高,缩短了催化时间,有利于工业生产。
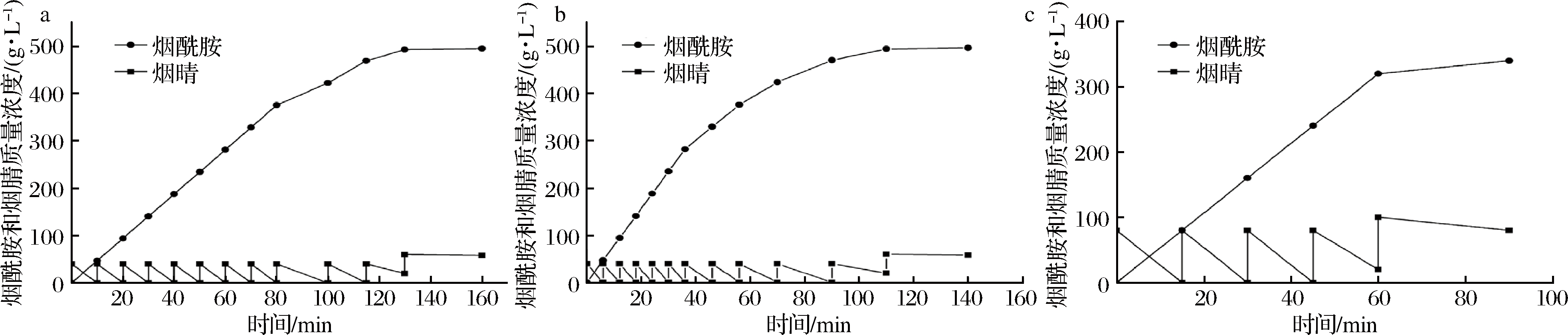
a-0.4 mol/(L·次),最初间隔时间10 min;b-0.4 mol/(L·次),最初间隔时间6 min;c-0.8 mol/(L·次),最初间隔时间15 min
图6 底物分批补料催化工艺的优化
Fig.6 Optimization of substrate fed-batch reaction
[1] WU J, BELL A F, LUO L, et al. Probing hydrogen-bonding interactions in the active site of medium-chain acyl-CoA dehydrogenase using Raman spectroscopy[J]. Biochemistry, 2003, 42(40): 11 846-11 856.
[2] KOBAYASHI M, SHIMIZU S. Cobalt proteins[J]. Eur J Biochem, 1999, 261(1): 1-9.
[3] PRASAD S, BHALLA T C. Nitrile hydratases (NHases): At the interface of academia and industry[J]. Biotechnology Advances, 2010, 28(6): 725-741.
[4] MARTINEZ S, YANG X, BENNETT B, et al. A cobalt-containing eukaryotic nitrile hydratase[J]. BBA-Proteins and Proteomics, 2016, 1 865(1):107-112.
[5] FOERSTNER K U, TOBIAS D, JEAN M, et al. A nitrile hydratase in the eukaryote Monosiga brevicollis[J]. Plos One, 2008, 3(12): e3 976.
[6] 房月芹, 崔文璟, 崔幼恬,等. 利用同源片段交换提高腈水合酶的热稳定性[J]. 中国生物制品学杂志, 2015, 28(3):276-280;284.
[7] 张晓欢. 高分子量腈水合酶的异源表达、全细胞催化及分子改造[D]. 无锡:江南大学, 2016.
[8] XIA Y, CUI W, LIU Z, et al. Construction of a subunit-fusion nitrile hydratase and discovery of an innovative metal ion transfer pattern [J]. Scientific Reports, 2016, 6(1): 19 183.
[9] XIA Y, CUI W, CHENG Z, et al. Improving the thermostability and catalytic efficiency of the subunit-fused nitrile hydratase by semi-rational engineering[J].Chemcatchem, 2017,10(6):1 370-1 375.
[10] PEI X L, WANG G P, WU Y F, et al. Evidence for the participation of an extra α-helix at β-subunit surface in the thermal stability of Co-type nitrile hydratase[J]. Applied Microbiology & Biotechnology, 2018, 102(18): 7 891-7 900.
[11] MAΜGER J, NAGASAWA T, YAMADA H. Nitrile hydratase-catalyzed production of isonicotinamide, picolinamide and pyrazinamide from 4-cyanopyridine, 2-cyanopyridine and cyanopyrazine in Rhodococcus rhodochrous J1[J]. Journal of Biotechnology, 1988, 8(1): 87-95.
[12] NOJIRI M, YOHDA M, ODAKA M, et al. Functional expression of nitrile hydratase in Escherichia coli: Requirement of a nitrile hydratase activator and post-translational modification of a ligand cystein[J]. Journal of Biochemistry, 1999, 125(4): 696-704.
[13] LIU Y, CUI W, XIA Y, et al. Self-subunit swapping occurs in another gene type of cobalt nitrile hydratase[J]. Plos One, 2012, 7(11): e50 829.
[14] ZHOU Z, HASHIMOTO Y, SHIRAKI K, et al. Discovery of posttranslational maturation by self-subunit swapping[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(39): 14 849-14 854.
[15] KIM S H, ORIEL P. Cloning and expression of the nitrile hydratase and amidase genes from Bacillus sp. BR449 into Escherichia coli[J]. Enzyme & Microbial Technology, 2000, 27(7): 492-501.
[16] PRATUSH A, SETH A, BHALLA T C. Expression of nitrile hydratase gene of mutant 4D strain of Rhodococcus rhodochrous PA 34 in Pichia pastoris[J]. Biocatalysis, 2016, 35(1):19-26.
[17] KOMEDA H, KOBAYASHI M, SHIMIZU S. A novel transporter involved in cobalt uptake[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(1): 36-41.
[18] 张晓欢, 崔文璟, 周哲敏. 高分子量腈水合酶在大肠杆菌中的表达策略及重组菌的细胞催化[J]. 微生物学通报, 2016, 43(10): 2 121-2 128.
[19] 余越春, 崔文璟, 刘义, 等. Rhodococcus rhodochrous J1腈水合酶在大肠杆菌中的表达策略[J].工业微生物, 2014,44(2): 14-19.
[20] LI B,SU J,TAO J.Enzyme and process development for production of nicotinamide[J].Organic Process Research & Development,2011,15(1):291-293.
[21] 王哲. 重组大肠杆菌产腈水合酶发酵优化及烟酰胺生产工艺的建立[D].无锡:江南大学, 2017.
[22] LAN Y, ZHANG X, LIU Z, et al. Overexpression and characterization of two types of nitrile hydratases from Rhodococcus rhodochrous J1[J]. Plos One, 2017, 12(6): e0 179 833.
[23] NAGASAWA T, TAKEUCHI K, NARDI-DEI V, et al. Optimum culture conditions for the production of cobalt-containing nitrile hydratase by Rhodococcus rhodochrous J1[J]. Appl Microbiol Biot, 1991, 34(6): 783-788.
[24] NAGASAWA T, TAKEUCHI K, YAMADA H. Characterization of a new cobalt-containing nitrile hydratase purified from urea-induced cells of Rhodococcus rhodochrous J1[J]. Eur J Biochem, 1991, 196(3): 581-589.
[25] YAMAKI T, OIKAWA T, ITO K, et al. Cloning and sequencing of a nitrile hydratase gene from Pseudonocardia thermophila JCM3095[J]. J Ferment Bioeng, 1997, 83(5): 474-477.
[26] PAYNE M S, WU S, FALLON R D, et al. A stereoselective cobalt-containing nitrile hydratase[J]. Biochemistry, 1997, 36(18):5 447-5 454.