大眼金枪鱼(Thunnus obesus) 又称肥壮金枪鱼,属鲈形目鲭科,大洋性洄游鱼类,分布于印度洋、大西洋、太平洋和南海外海等地[1]。其肉质鲜美,营养丰富,不仅富含蛋白质,还含有DHA和EPA等不饱和脂肪酸,食用和商用价值极高[2-4]。据最新国际渔业动态报道,随着金枪鱼市场价格不断走高,捕捞量也在大幅提高[5]。
目前,国内市售大眼金枪鱼占有市场比例较高,由于其属于红肉鱼类,在加工和流通过程当中,如果加工和贮藏不当,容易造成生物胺超标。生物胺是一种低分子量的碱性含氮化合物,广泛存在于蛋白质及氨基酸含量丰富的水产品中,主要通过微生物产生的氨基酸脱羧酶分解游离氨基酸产生[6-8]。食用生物胺超标水产品,易引起人体中毒,近些年来因食用金枪鱼而发生的生物胺中毒事件时有发生。国内对于生食金枪鱼已经有了相关标准,其中组胺不得超过90 mg/kg[9-11]。
国内外对水产品中生物胺产生菌已经有了相关研究,常见的有弧菌属、假单胞菌属、葡萄球菌属、乳酸菌、肠杆菌等[12-13],除此之外一些新的菌群也被证实可产生生物胺,如沙门菌群、巴斯德菌和根瘤菌等不同菌科[14]。目前,大眼金枪鱼中生物胺产生菌的相关研究鲜有报道。本文将大眼金枪鱼的生鱼片作为研究对象,通过微生物分离结合高效液相色谱技术,筛选出了生物胺产生菌,再利用表型特征鉴定和基因型鉴定相结合的方法[15-16],确定了菌株的种类,以期为生食大眼金枪鱼肉中生物胺的控制提供理论参考。
1 材料与方法
1.1 材料与试剂
大眼金枪鱼,购于广州市沛洋食品有限公司(-60 ℃冻藏)。
腐胺、尸胺、精胺、亚精胺、色胺、苯乙胺、组胺、酪胺、丹磺酰氯(纯度≥98%),美国Sigma公司;NaCl、NaOH、NaHCO3、NH3·H2O,广州粤升化学试剂厂;胰蛋白胨、酵母浸粉、琼脂、L-组氨酸、色氨酸、酪氨酸、胰蛋白胨大豆琼脂(tryptose soya agar,TSA)、胰蛋白胨大豆肉汤培养基(tryptic soy broth,TSB),广州市普博仪器有限公司;乙睛(色谱纯),上海安谱实验科技股份有限公司;超纯水,实验室自制。
1.2 仪器与设备
LC-20AD高效液相色谱仪,日本岛津SHINADZU公司;CX41显微镜,日本OLYMPUS公司;MILLI-Q超纯水机,美国Millipore公司;3K30高速冷冻离心机,德国 SIGMA公司;SPX-500智能生化培养箱,宁波江南仪器厂;LDZX-75KBS型立式压力蒸汽灭菌器,上海申安医疗器械厂;TU-1990紫外-可见分光光度计,北京普析通用仪器有限责任公司;VITEK 2 COMPACT细菌鉴定及药敏测试仪,法国梅里埃公司;DYY-7B电泳仪,北京六一仪器厂。
1.3 实验方法
1.3.1 样品制备
将金枪鱼在无菌环境下解冻后置于0 ℃下贮藏备用。
1.3.2 菌落总数和K值的测定
参考GB4789.2—2016的方法[17],测定0 ℃贮藏的大眼金枪鱼中的菌落总数。
参考SC/T 3048—2014[18] 的方法,测定0 ℃贮藏的大眼金枪鱼中K值变化。K值计算如公式(1)所示:
(1)
式中:ATP为腺苷三磷酸浓度、ADP为腺苷二磷酸浓度、AMP为腺苷酸浓度、IMP为肌苷酸浓度、HxR为次黄嘌呤核苷浓度、Hx为次黄嘌呤浓度,单位均为μmol/g。
1.3.3 培养基配制
参考朱晓娟[19]和郝淑贤等[20]的方法配制如下培养基。
生物胺筛选培养基(g/L): 胰蛋白胨5.0、酵母浸粉5.0、NaCl 5.0、CaCO3 1.0、琼脂20、溴甲酚紫0.06、L-组氨酸2、色氨酸2、酪氨酸2,1 mol/L HCl调pH至5.3±0.2。
TSA培养基(g/L):取47 g TSA于1 L蒸馏水中灭菌,制成平板培养基和斜面培养基。
TSB培养基:取TSB 3 g、L-组氨酸0.03 g、色氨酸0.03 g、酪氨酸0.03 g于100 mL蒸馏水中灭菌。
1.3.4 菌株的分离纯化
参考吴燕燕等[21]的方法,无菌条件下取0 ℃贮藏12 d的5 g鱼肉于45 mL无菌生理盐水中,制备为10-1样液,依次梯度稀释到10-2、10-3、10-4和10-5后,各取100 μL菌液涂布到生物胺初筛培养基上,30 ℃培养3 d。
挑取蓝紫色菌落在TSA培养基上划线培养至出现单菌落,30 ℃培养3 d。
将单菌落划线接种于TSA斜面培养基上富集培养,并于菌种保藏箱中临时保藏。
1.3.5 生长曲线的测定
参考AYYASH等[22]的方法,将分离纯化的菌落接种于TSB培养基中活化培养,每间隔相同时间用紫外分光光度计连续测定培养液的OD605nm 值,观察菌株的生长情况。
1.3.6 生物胺质量分数的测定
参考赵庆志等[23]的衍生方法略有改动,将单菌落接种于TSB培养基中活化培养,30 ℃培养3 d,各取1 mL活化菌液离心,取上清液,对上清液进行衍生处理。
色谱条件参考GB5009.208—2016[24] 的方法。色谱柱:WondaCract ODS-2色谱柱(4.6 mm×250 mm,5 μm),柱温40 ℃,流速0.8 mL/min,进样量10 μL,检测波长 254 nm。流动相A为含1%甲酸的0.01 mol/L 乙酸铵溶液,流动相B为乙腈,梯度洗脱程序为:0~22 min,B=58%(体积分数);22~25 min,B=78%(体积分数);25~32.01 min,B=90%(体积分数);32.01~37 min,B=58%(体积分数),外标法定量。标准曲线回归方程如表1所示。
表1 标准曲线回归方程
Table 1 Regression equations of standard curves
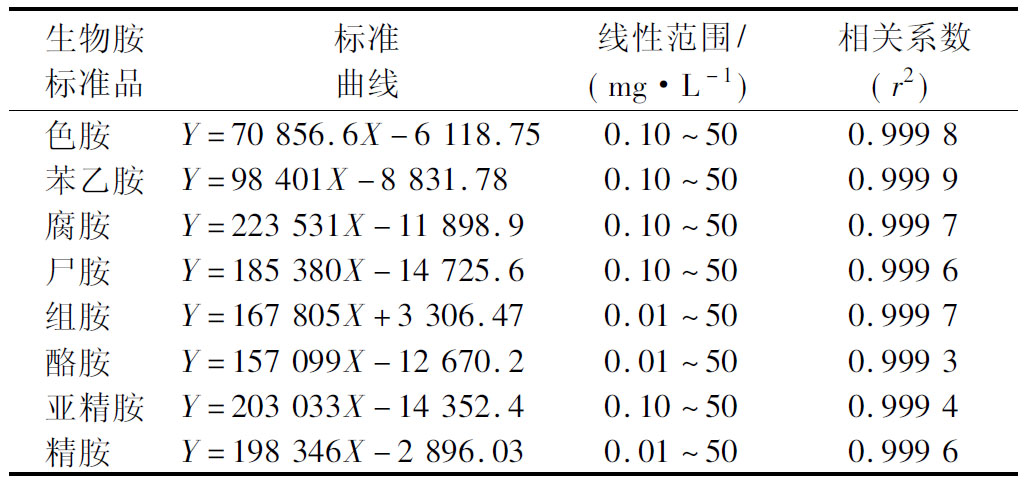
生物胺标准品标准曲线线性范围/(mg·L-1)相关系数(r2)色胺 Y=70 856.6X-6 118.750.10~500.999 8苯乙胺Y=98 401X-8 831.780.10~500.999 9腐胺 Y=223 531X-11 898.90.10~500.999 7尸胺 Y=185 380X-14 725.60.10~500.999 6组胺 Y=167 805X+3 306.470.01~500.999 7酪胺 Y=157 099X-12 670.20.01~500.999 3亚精胺Y=203 033X-14 352.40.10~500.999 4精胺 Y=198 346X-2 896.030.01~500.999 6
1.3.7 形态学指标
观察并记录TSA上单菌落形态特征,挑取单菌落进行涂片、革兰氏染色,于显微镜下观察并记录其大小、颜色、形状、排列等。
1.3.8 菌种鉴定
1.3.8.1 生理生化实验鉴定
吸取适量的菌液分别与3 mL 0.45%(质量分数) NaCl生理盐水混匀,配制相当于0.50~0.63麦氏单位的菌悬液,使用VITEK 2全自动微生物分析系统进行菌种鉴定[25]。
1.3.8.2 产生物胺细菌的16S rDNA 鉴定
筛选出产胺量最高的菌株进行DNA提取,将 PCR 扩增产物进行凝胶电泳分析,送与测序公司进行测序,将返回的序列进行比对。
2 结果与分析
2.1 菌落总数和K值测定结果
将大眼金枪鱼生鱼片置于0 ℃下贮藏,结果如图1所示。鱼肉中菌落总数的变化情况由图1-a可知,大眼金枪鱼初始菌落总数为2.46 lgCFU/g,菌落总数初期生长缓慢,第4天达到4.45 lgCFU/g,超过生食金枪鱼SC/T 3117—2006规定标准[10],第12天时菌落总数为7.13 lgCFU/g,之后菌落长势趋于平缓。K值是反映水产品鲜度的一个重要指标,可以明确表明鱼肉的新鲜程度。一般认为,K值低于20%为一级鲜度,20%~40%为二级鲜度,大于70%已为腐败[26]。由图1-b可知,鱼肉初始K值为12.1%,第4天超过20%,不能用于制作生鱼片[27],K值增长速度为3.30%/d。为更加准确分离出生物胺产生菌,该实验选择菌落总数达到相对稳定阶段12 d的鱼肉作为实验样品。
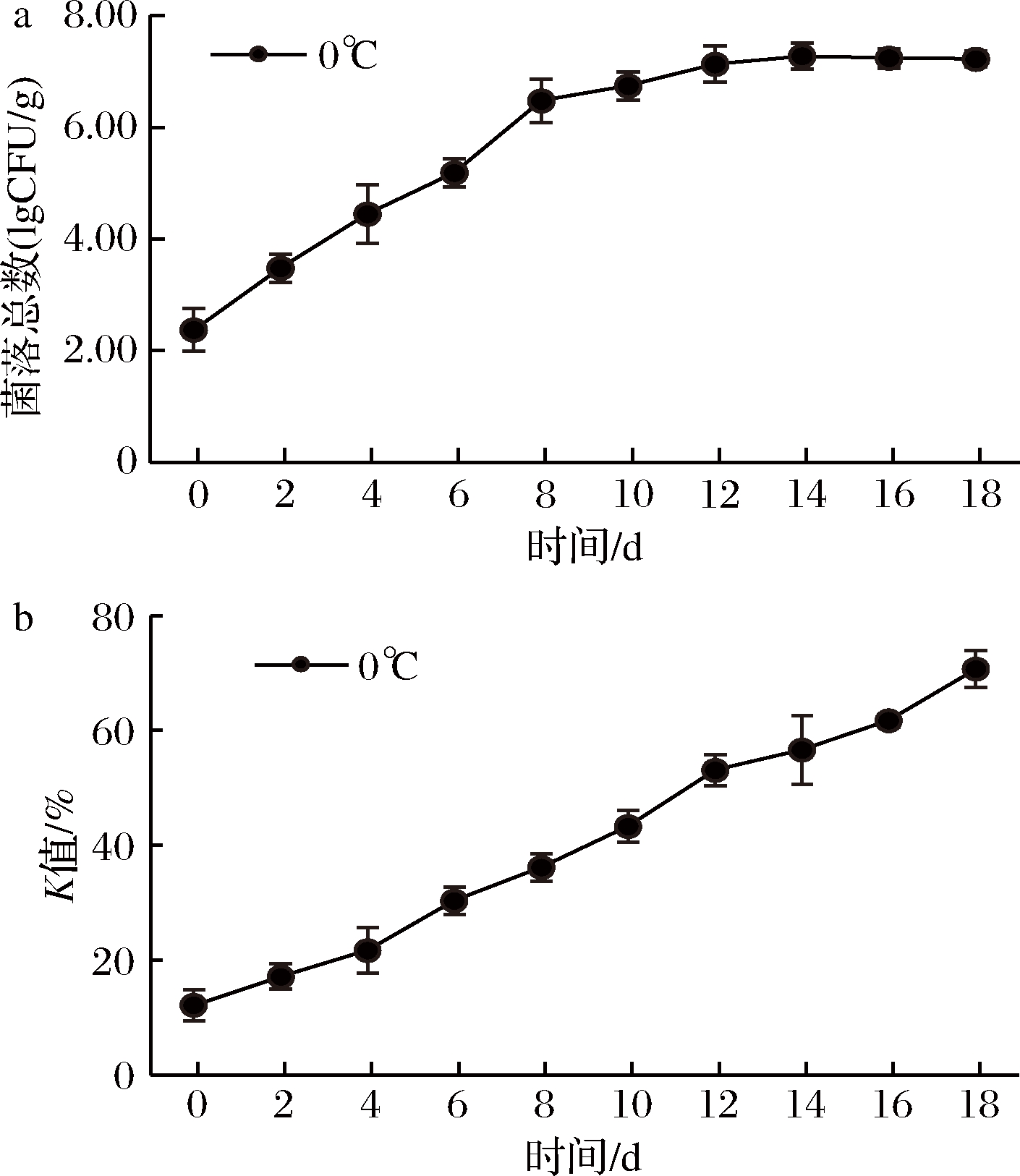
a-0 ℃下菌落总数的变化;b-0 ℃下K值的变化
图1 0 ℃下菌落总数和K值变化
Fig.1 Change of colony count aerobic plate count and Kvalue at 0 ℃
2.2 生物胺产生菌的分离纯化
典型的产胺菌在生物胺筛选培养基中显示蓝紫色,其原理是微生物利用培养基中的游离氨基酸生成了碱性生物胺,从而使菌落周围环境的pH值上升,溴甲酚紫指示剂显示为蓝紫色[28]。挑取蓝紫色菌落划线接种于TSA培养基上纯化培养,最终得到9株单菌落,编号为B-1~B-9。
2.3 生物胺产生菌的生长曲线
将9株生物胺产生菌分别接种于TSB培养基中,确定9株细菌在0和30 ℃条件下的生长曲线,结果如图2所示。9株菌株在0 ℃下生长缓慢,48 h后进入生长稳定期。而在30 ℃下培养9株菌,对数生长期为4~12 h,之后进入生长稳定期。结果表明,从大眼金枪鱼中分离得到的9株菌株适宜在较高温度下生长,初步鉴定为嗜温菌(25~40 ℃)[29]。
2.4 生物胺生成情况分析
为进一步确认这9株菌的产胺能力,将9株菌株分别接种到TSB培养基中,30 ℃培养3 d,分析培养液中生物胺产生质量浓度,结果如表2所示。由表2可知,9株菌均可产生色胺、腐胺和尸胺,菌株B-9生物胺生成能力较其他菌株最弱,总质量浓度为2.78 mg/L。B-1、B-3和B-7的产胺能力较强,总生物胺质量浓度分别为40.4、41.3和50.3 mg/L。其中B-1的色胺产生质量浓度最高,为38.9 mg/L; B-3亚精胺产生质量浓度最高,为31.2 mg/L;B-7酪胺产生质量浓度最高,为38.5 mg/L。
表2 菌株的生物胺生成情况
Table 2 Biogenic amine contents produced by strains
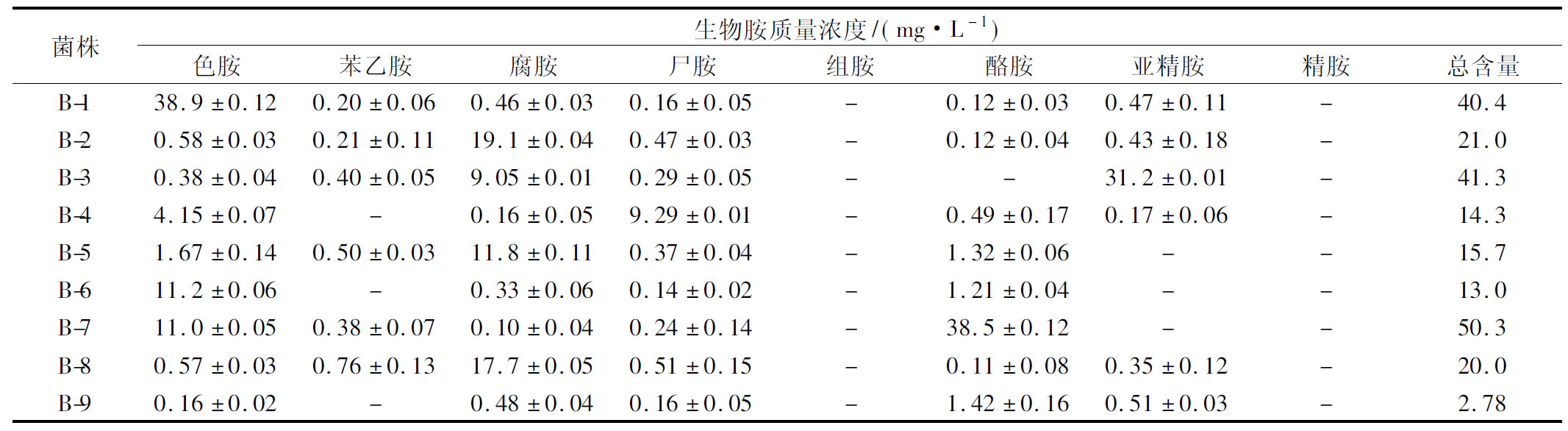
菌株生物胺质量浓度/(mg·L-1)色胺苯乙胺腐胺尸胺组胺酪胺亚精胺精胺总含量B-138.9±0.120.20±0.060.46±0.030.16±0.05-0.12±0.030.47±0.11-40.4B-20.58±0.030.21±0.1119.1±0.040.47±0.03-0.12±0.040.43±0.18-21.0B-30.38±0.040.40±0.059.05±0.010.29±0.05--31.2±0.01-41.3B-44.15±0.07-0.16±0.059.29±0.01-0.49±0.170.17±0.06-14.3B-51.67±0.140.50±0.0311.8±0.110.37±0.04-1.32±0.06--15.7B-611.2±0.06-0.33±0.060.14±0.02-1.21±0.04--13.0B-711.0±0.050.38±0.070.10±0.040.24±0.14-38.5±0.12--50.3B-80.57±0.030.76±0.1317.7±0.050.51±0.15-0.11±0.080.35±0.12-20.0B-90.16±0.02-0.48±0.040.16±0.05-1.42±0.160.51±0.03-2.78
注:-表示未检出
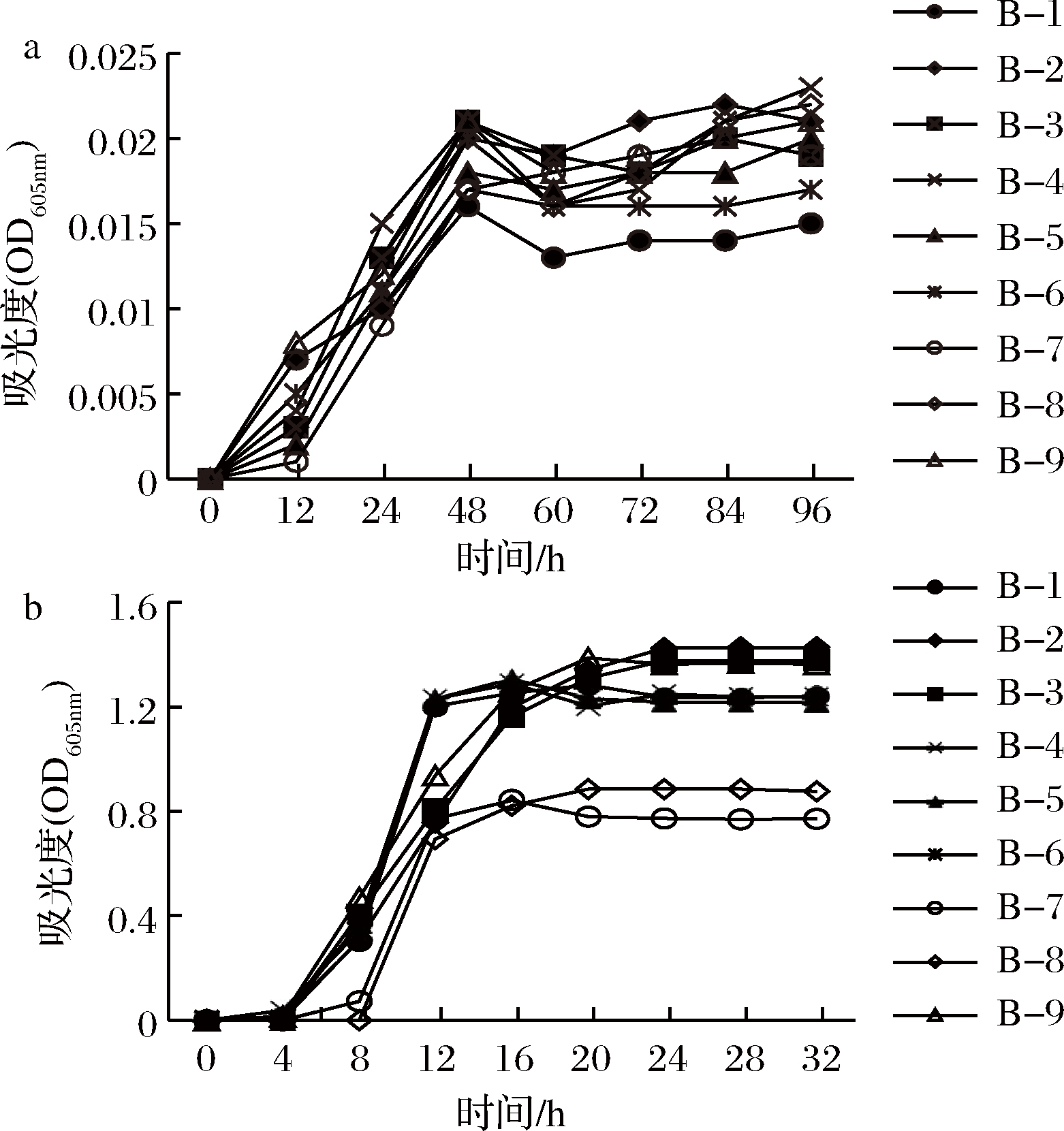
a-9株菌株在0 ℃下的生长曲线;b-9株菌株在30 ℃下的生长曲线
图2 九株菌株在0 ℃和30 ℃下的生长曲线
Fig.2 Growth curves of nine strains at 0 ℃ and 30 ℃
2.5 生物胺产生菌的形态特征
将3株产胺量最高的菌株进行革兰氏染色,显微镜下观察。从显微镜下观察到B-1为革兰氏阴性菌,菌落形态为乳黄色圆形凸起菌落,边缘整齐,菌株为球状菌,无芽孢。B-3为革兰氏阴性菌,菌落形态为圆形,表面光滑不透明,乳黄色,边缘整齐,菌株为杆状菌,无芽孢。B-7为革兰氏阳性菌,菌落形态为白色凸起,边缘整齐,表面光滑圆润,菌株为球状菌,无芽孢。
2.6 生物胺产生菌的鉴定
2.6.1 生理生化实验鉴定
VITEK 2鉴菌仪是通过将检测菌株的各项生理生化实验反应结果与已知的菌株数据库作比较,从而推测菌株的可能性概率,可信概率范围为85.0%~99.0%。经鉴定,3株菌株的生理生化实验结果如表3所示。鉴定B-1菌株为巨型球菌(Macrococcus caseolyticus),可信概率为99.0%;B-3菌株为产碱普罗威登斯菌(Providencia alcalifaciens),可信概率为97.0%;B-7菌株为粪肠球菌(Enterococcus faecalis),可信概率为99.0%。
表3 菌株鉴定结果
Table 3 Identification of strain

项目鉴定鉴定结果B-1B-3B-7项目鉴定鉴定结果B-1B-3B-7丙氨酸-苯丙氨酸-脯氨酸芳胺酶(APPA)---D-塔格糖(dTAG)--+侧金盏花醇(ADO)-+-D-海藻糖(dTRE)+++焦谷氨酸芳胺酶(PyrA)--+柠檬酸盐(钠)(CIT)--+L-阿拉伯醇(IARL)-+-丙二酸盐(MNT)---D-纤维二糖(dCEL)--+5-酮-葡萄糖苷(5KG)---β-半乳糖苷酶(BGAL)---L-乳酸盐产碱(ILATk)+++H2S产生(H2S)--+α-葡萄糖(AGLU)+--β-N-乙酰葡萄糖苷酶(BNAG)--+琥珀酸盐产碱(SUCT)-+-谷氨酰芳胺酶(AGLTp)---N-乙-β-半乳糖胺酶(NAGA)---D-葡萄糖(dGLU)+++α-半乳糖苷酶(AGAL)---γ-谷氨酰转移酶(GGT)-+-磷酸酶(PHOS)-+-葡萄糖发酵(OFF)-+-氨基乙酰芳胺酶(GlyA)-+-β-葡萄糖苷酶(BGLU)--+鸟氨酸脱羧酶(ODC)---D-麦芽糖(dMAL)+-+赖氨酸脱羧酶(LDC)---D-甘露醇(dMAN)--+组氨酸同化(IHISa)-+-D-甘露糖(dMNE)-++COURMARATE (CMT)+-+β-木糖苷酶(BXYL)---β-葡萄糖苷酸酶(BGUR)---β-丙氨酸芳胺(BAlap)---O/129 耐受(O129R)+-+L-脯氨酸芳胺酶(ProA)-+-谷氨酸-甘氨酸-精氨酸芳胺(GGAA)---脂酶(LIP)---L-苹果酸盐同化(IMLTa)-+-古老糖(PLE)---ELLMAN (ELLM)-+-酪氨酸芳胺酶(TyrA)-++L-乳酸盐同化(ILATa)+--尿素酶(URE)++-D-山梨醇(dSOR)--+蔗糖(SAC)+-+
注:+表示阳性反应;-表示阴性反应
2.6.2 16S rDNA 鉴定
琼脂糖凝胶电泳检测PCR产物图片结果如图3所示,电泳可成功扩增出预期的DNA片段,且2 000 bp处扩增条带清晰明亮,所以该PCR片段可同时作为后续PCR反应中的引物和模板,送检测序。
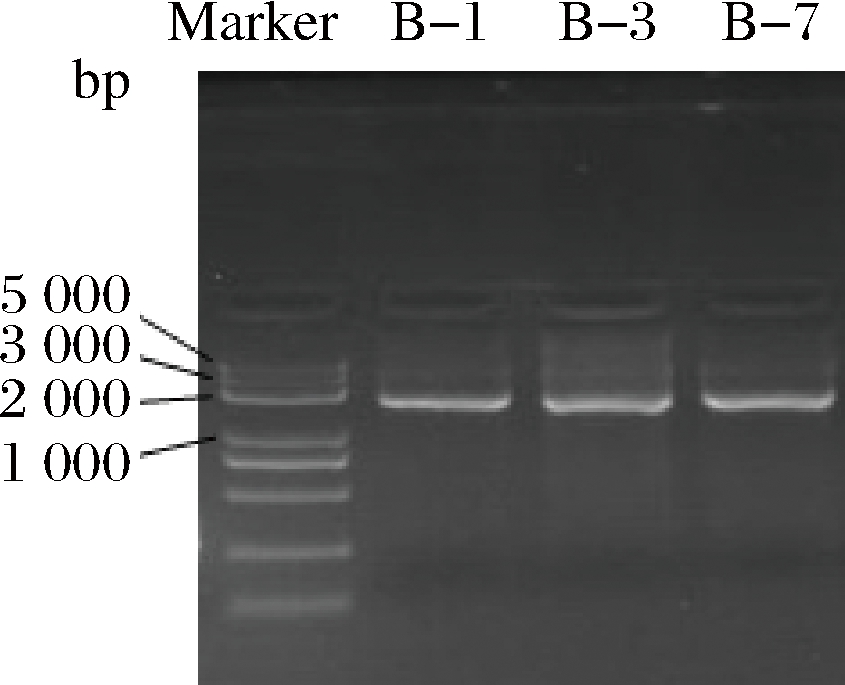
图3 三株菌株的琼脂糖凝胶电泳图
Fig.3 Agarose gel electrophoresis of three strains
将测序结果与NCBI数据库进行比对,并建立系统进化树,结果如图4所示。从比对结果可知,样本B-1与溶酪巨型球菌(Macrococcus caseolyticus)亲源关系最近,样本B-3与产碱普罗威登斯菌(Providencia alcalifaciens)亲源关系最近,样本B-7与粪肠球菌(Enterococcus faecalis)亲源关系最近。由于溶酪巨型球菌(Macrococcus caseolyticus) 为细菌致病菌,可引起一些水产动物大量死亡,推断B-1来自外界环境,并随着贮藏时间的增加,逐渐成为金枪鱼腐败菌中的优势菌种[30]。产碱普罗威登斯菌(Providencia alcalifaciens)和粪肠球菌(Enterococcus faecalis)是人和动物肠道的正常菌群[31-32],但由于金枪鱼体型较大,肠道污染可能性较小,因此推断B-3与B-7同样来自外界环境。
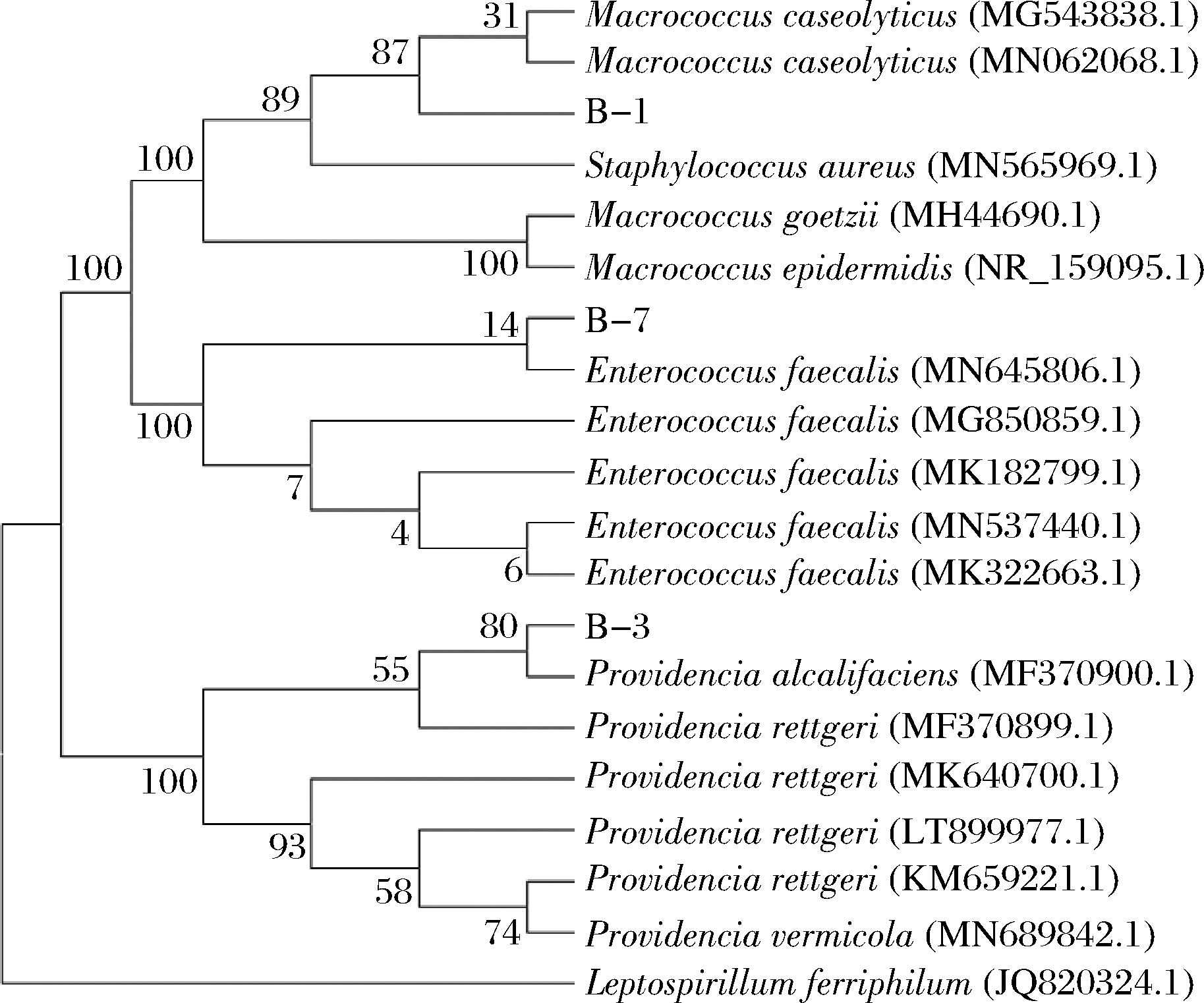
图4 基于16S rDNA 序列构建的进化树
Fig.4 Phylogenetic trees based on the 16S rDNA sequences
3 结论
本研究利用生物胺初筛培养基结合高效液相色谱技术,从大眼金枪鱼生鱼片中筛选出9株生物胺产生菌,其中3株产胺量最高的菌株分别为溶酪巨型球菌 (Macrococcus caseolyticus)、产碱普罗威登斯菌(Providencia alcalifaciens)和粪肠球菌(Enterococcus faecalis)。溶酪巨型球菌(Macrococcus caseolyticus)和产碱普罗威登斯菌(Providencia alcalifaciens)均属于新发现的生物胺产生菌。粪肠球菌(Enterococcus faecalis)曾被LADERO等[33]从乳制品中分离得到。产碱普罗威登斯菌(Providencia alcalifaciens)能够引起人体食物中毒、严重的肠胃炎、腹泻等疾病,对人体健康有潜在的危险性[31]。
研究表明,根据产胺菌的生物学特性,可通过抑制相关菌群和低温贮藏相结合的方法来控制生物胺的生成,保证大眼金枪鱼的品质和食用安全性。
[1] 张俊,邱永松,陈作志,等.南海外海大洋性渔业资源调查评估进展[J].南方水产科学,2018,14(6):118-127.
[2] 邹盈,李彦坡,戴志远,等.三种金枪鱼营养成分分析与评价[J].农产品加工,2018(10): 43-47.
[3] 苏红,李雨欣,钱雪丽,等.鳙鱼、金枪鱼和三文鱼鱼头的营养分析与品质评价[J].食品工业科技,2019,40(17):212-217;224.
[4] J
 SKEL
SKEL INEN E, JAKOBSEN L M A, HULTMAN J, et al. Metabolomics and bacterial diversity of packaged yellowfin tuna (Thunnus albacares) and salmon (Salmo salar) show fish species-specific spoilage development during chilled storage[J].International Journal of Food Microbiology, 2019, 293:44-52.
INEN E, JAKOBSEN L M A, HULTMAN J, et al. Metabolomics and bacterial diversity of packaged yellowfin tuna (Thunnus albacares) and salmon (Salmo salar) show fish species-specific spoilage development during chilled storage[J].International Journal of Food Microbiology, 2019, 293:44-52.
[5] 缪圣赐,国际渔业动态[J].渔业信息与战略,2018,33(1):71-78.
[6] BIJI K B, RAVISHANKAR C N, VENKATESWARLU R, et al. Biogenic amines in seafood: A review[J].Journal of Food Science and Technology, 2016, 53(5):2 210-2 218.
[7] ZHANG Y J, ZHANG Y, ZHOU Y, et al. A review of pretreatment and analytical methods of biogenic amines in food and biological samples since 2010[J]. Journal of Chromatography A,2019,1 605:360 361. https://doi.org/10.1016/j.chroma.2019.07.015.
[8] 刘爱芳,谢晶,钱韻芳.冷藏金枪鱼优势腐败菌致腐败能力[J].食品科学,2018,39(3): 7-14.
[9] 邓建朝,李少丽,杨贤庆,等.金枪鱼中生物胺的防控技术与检测技术的研究发展[J].食品与发酵工业,2019,45(24):262-268.
[10] TITTARELLI F, PERPTUINI G, DI GIANVITO P, et al. Biogenic amines producing and degrading bacteria: A snapshot from raw ewes' cheese[J]. Food Science and Technology, 2019,101:1-9.
[11] 农业部.生食金枪鱼: SC/T 3117—2006[S].北京:中国农业出版社,2006:1-10.
[12] 吴佳佳,王思齐,戴志远. 咸鳓鱼中产组胺菌的分离与鉴定[J]. 食品与发酵工业,2019,45(3):71-76.
[13] 景智波,田建军,杨明阳,等.食品中与生物胺形成相关的微生物菌群及其控制技术研究进展[J].食品科学,2018,39(15):262-268.
[14] 钱茜茜,吴燕燕,魏涯,等.海鲈鱼腌制过程中产胺菌的分离筛选与生物学特性研究[J].食品与发酵工业,2016,42(1):70-75.
[15] 王悦齐,李来好,蔡秋杏,等.分离自腌干鱼的抗氧化发酵菌株的筛选及鉴定[J].南方水产科学,2016,12(3):74-83.
[16] JOSÉ M L, RIVAS B D L, MARCOBAL A, et al. Molecular methods for the detection of biogenic amine-producing bacteria on foods[J]. International Journal of Food Microbiology, 2007, 117(3):258-269.
[17] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB4789.2—2016食品安全国家标准食品微生物学检验菌落总数测定[S].北京:中国标准出版社,2016.
[18] 中华人民共和国农业部. SC/T 3048—2014鱼类鲜度指标K值的测定高效液相色谱法[S].北京:中国标准出版社,2014.
[19] 朱晓娟. 黄酒酒曲中生物胺产生菌的分离鉴定和分子检测[D].天津:天津科技大学,2018:13.
[20] 郝淑贤,魏涯,周婉君,等. 鲭鱼生物胺生成菌的分离与鉴定[J]. 食品科学,2015,36(7):97-100.
[21] 吴燕燕,钱茜茜,陈玉峰,等. 咸鱼中生物胺降解菌的筛选与降解特性研究[J]. 食品工业科技,2016,37(18):173-179.
[22] AYYASH M, JOHNSON S K, LIU S Q, et al. In vitro investigation of bioactivities of solid-state fermented lupin, quinoa and wheat using Lactobacillus spp[J]. Food Chemistry, 2019, 275:50-58.
[23] 赵庆志,邓建朝,杨贤庆,等. 不同贮藏温度下鲐鱼生物胺变化的研究[J]. 食品工业科技,2018,39(4):260-267;279.
[24] 中华人民共和国国家卫生和计划生育委员会,国家食品药品监督管理总局.GB5009.208—2016 食品安全国家标准食品中生物胺的测定[S].北京:中国标准出版社,2016.
[25] WOLFRAM W R, FLORIAN G, MELANIE T, et al. Comparison of VITEK 2, MALDI-TOF MS, 16S rRNA gene sequencing, and whole-genome sequencing for identification of Roseomonas mucosa[J]. Microbial Pathogenesis,2019,139:103 576.
[26] 年益莹,薛鹏,季晓彤,等.减菌处理对金鲳鱼块微冻贮藏品质的影响[J].食品安全质量检测学报,2018,9(8):1 810-1 816.
[27] 汪兰,曾俊杰,吴文锦,等.不同冻藏温度对鲈鱼品质的影响[J].食品工业科技,2018,39(21):287-292.
[28] 宁伟杰,曹传波. 酸碱指示剂在氨氮在线测量中的应用研究[J]. 分析仪器,2017(6):145-148.
[29] MACKIE I M, PIRIE L, RITCHIE A H, et al. The formation of nonvolatile amines in relation to concentrations of free basic amino acids during postmortem storage of muscle of scallop (Pecten maximus), herring (Clupea harengus) and mackerel (Scomber scombrus)[J]. Food Chemistry, 1997, 60(3): 291-295.
[30] 蓝胜华,王利,邓麟杰,等.黄颡鱼溶酪巨型球菌的鉴定与药敏试验[J]. 水产科学,2015,34(12):778-782.
[31] 石磊,梁思思,岛绫香,等.食源性普罗威登斯菌的分离鉴定和耐药性研究[J]. 现代食品科技,2014,30(6):24-29.
[32] 徐亚飞,曾新福,乐敏,等. 粪肠球菌在水产养殖中的应用研究进展[J]. 饲料广角,2018(7):47-49.
[33] LADERO V, CA EDO E, PÉREZ M, et al. Multiplex qPCR for the detection and quantification of putrescine-producing lactic acid bacteria in dairy products[J]. Food Control, 2012, 27(2): 307-313.
EDO E, PÉREZ M, et al. Multiplex qPCR for the detection and quantification of putrescine-producing lactic acid bacteria in dairy products[J]. Food Control, 2012, 27(2): 307-313.